Method Article
A Síntese, Caracterização e Reatividade de uma série de Rutênio
Neste Artigo
Resumo
Complexos de rutênio de fosfina são amplamente utilizados para reações catalíticas homogêneas, como hidrogenação. A síntese de uma série de novos complexos de ruténio tridentado que ostentam o ligando -triphos N N (CH 2 PPh 2) 3 é relatado. Além disso, a reacção estequiométrica de um complexo dihydride Ru- N -triphos com ácido levulínico é descrito.
Resumo
Aqui relatamos a síntese de um ligando tridentado fosfina N (CH 2 PPh 2) 3 (N -triphos Ph) (1) através de uma reacção de Mannich com base de fósforo do precursor hidroxilmetileno fosfina com amónia em metanol, sob uma atmosfera de azoto. A N -triphos Ph ligando precipita a partir da solução após cerca de 1 hora de refluxo e pode ser isolado analiticamente puro através do procedimento de filtração simples cânula sob azoto. A reacção do N -triphos ligando Ph com [Ru 3 (CO) 12], sob refluxo, proporciona uma solução vermelho escuro que mostram evolução de gás de CO em complexação ligando. Cristais cor de laranja do complexo [Ru (CO) 2 {N (CH 2 PPh 2) 3} -κ 3 P] (2) foram isolados por arrefecimento até à temperatura ambiente. A 31 P {1 H} espectro de RMN mostrou um pico única característica com menor frequênciaem comparação com o ligando livre. A reacção de uma solução de tolueno do complexo 2 com oxigénio resultou na precipitação instantânea do carbonato de complexo [Ru (CO 3) (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (3) como um estável ar sólido cor de laranja. A subsequente hidrogenação de 3 sob 15 bar de hidrogénio num reactor de alta pressão deu o complexo dihydride [RuH 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (4), a qual foi totalmente caracterizado por X cristalografia de raios- e espectroscopia de RMN. Complexos de 3 e 4 são potencialmente precursores de catalisadores úteis para uma série de reações de hidrogenação, incluindo produtos derivados da biomassa, como o ácido levulínico (LA). Complexo 4 foi encontrado para reagir de forma limpa com LA na presença do aditivo fonte de protões NH 4 PF 6 para se obter a [Ru (CO) {N (CH 2 PPh 2) 3} 3 P -κ {CH 3 CO (CH 2) 2 CO 2 H} -κ 2O] (PF 6) (6).
Introdução
Complexos de ruténio com base de fosfina são alguns dos catalisadores moleculares mais amplamente estudados e quimicamente versáteis. 1-9 Tipicamente, tais catalisadores de ruténio conter tanto ligandos mono- ou bi-dentadas que ditam a electrónica, sterics, geometria e a solubilidade do complexo, e que impactar profundamente na atividade catalítica. Sistemas de fosfina multidentados foram menos estudados para a catálise, como são conhecidos para conferir maior estabilidade no centro do metal devido ao maior efeito quelato de múltiplos doadores de fósforo no centro de metal. Tal estabilização pode ser indesejável para a catálise, no entanto, sob condições mais severas de reacção (temperaturas e pressões mais elevadas), as propriedades de estabilização de tais ligandos complexos pode ser vantajoso para assegurar a integridade do catalisador. Um tal sistema de ligando fosfina multidentado que 10-12 e 13-18 foram investigadas outras para conferir estabilidade do complexo e coor facialgeometrias coor- é o chamado série ligando N -triphos onde três braços de fosfina estão ligados a um átomo de azoto em ponte apical formando um ligando tridentado potencialmente. Uma das características chave para estes ligandos específicos é o caminho simplista de que eles podem ser sintetizados por meio de uma reacção de Mannich com base de fósforo a partir de fosfinas secundárias prontamente disponíveis (Figura 1), portanto, fosfinas com uma variedade de grupos R pode ser preparado geralmente em rendimentos elevados e com o mínimo de trabalho-up. O objetivo geral desta metodologia é o de apresentar uma rota fácil pelo qual rutênio complexos dihydride caracterizam ligantes N -triphos pode ser acessado por aplicações catalíticas subsequentes. Recentemente, os complexos à base de Ru-triphos têm atraído a atenção como catalisadores para as reacções de hidrogenação de produtos derivados da biomassa, tais como ácido levulínico, 19,20 bio-ésteres de 11,21 e 22 dióxido de carbono para os produtos químicos de alto valor. Seria vantajosopara expandir o escopo de derivados Ru-triphos que ou são tão ou mais ativo do que os sistemas já relatados, especialmente se eles são sinteticamente mais fácil acesso, tais como a N -triphos ligando. O análogo centrado no carbono mais estudado é tipicamente afectada de baixo rendimento e envolve a síntese de reagentes de fosforeto de metal altamente sensíveis ao ar, ao contrário do N -triphos ligando, que é mais flexível e mais fácil de preparar. 10-18
Ligantes N -triphos permanecem relativamente pouco investigado, com apenas molibdênio, tungstênio, rutênio, ródio e ouro complexos tendo sido relatada a partir de nove publicações. Isso está em contraste gritante com os análogos de boro e centrados em carbono, para o qual não estão em torno de 50 e 900 artigos, respectivamente, com um grande número de compostos únicos. Aplicação No entanto, -triphos N contendo complexos de ter encontrado na hidrogenação catalítica assimétrica de olefinas pró-quirais 23 como nósll cyclohydroamination como assimétrica de N-protegido sulfonamidas γ-alenil. 24 Adicionalmente, um complexo de ruténio coordenado por um ligando volumoso N -triphos caracteriza phospholane coordenação porções foi encontrado para activar silanos, um passo chave no desenvolvimento de organo-silício química. 25
Como parte do programa de investigação em curso em catálise, buscou-se preparar uma série de rutênio N -triphos precatalysts Ph e investigar suas reações estequiométricas e potencial catalítico. Apesar de complexos de molibdênio de N -triphos Ph tendo sido relatada pela primeira vez mais de 25 anos atrás, a sua aplicação, ou de outra forma catalítica não foi investigado. Este trabalho demonstra a aplicabilidade da N -triphos andaime, que apesar de ser em geral, subdesenvolvida, possuem muitas características desejáveis, tais como a estabilidade do complexo. Neste artigo descrevemos uma via de síntese e caracterização de auma série de complexos de ruténio N -triphos pH que podem encontrar aplicação em reacções de hidrogenação catalítica.
Protocolo
Nota: Executar todas as sínteses em um exaustor, e só depois de as questões de segurança apropriadas foram identificados e as medidas tomadas para proteger contra eles. Equipamento de proteção individual incluem um jaleco, luvas e óculos de segurança e deve ser usado em todos os momentos.
1. Síntese de N, N, N-tris (diphenylphosphinomethylene) amina, N (CH 2 PPh 2) 3 (N -triphos Ph) (1)
- Para um de 200 ml, seco em estufa balão de Schlenk adicionar cloreto de difenil (hidroximetileno) fosfónio 11 (6,99 g, 24,7 mmol) e coloca-se sob azoto, através de três ciclos de vácuo-azoto sequenciais numa linha de Schlenk dupla colector.
- Adiciona-se metanol desgaseificado (30 ml) e trietilamina (9,5 ml, 68,1 mmol), e agitar temperatura ambiente durante 1 hora para assegurar a conversão do sal de fosfónio com a fosfina hydroxymethene. Em seguida, adicionar uma solução de amoníaco em metanol desgasif içado (2 M, 4,1 ml, 8,2 mmol).
- Aquece-se a mistura de reacção durante 2 horas sob refluxo, Durante o qual o ligando irá precipitar como um sólido branco.
- Embora a N -triphos Ph ligando é estável à oxidação em ar ao longo de curtos períodos de tempo, para um melhor grau de pureza, remover o solvente através de uma cânula de filtração 26 sob azoto, e enxagua-se com metanol desgaseificado (3 x 10 ml) para se obter um produto analiticamente puro , e armazenar sob uma atmosfera de azoto.
2. Síntese de [Ru (CO) 2 {N (CH 2 PPh 2) 3} -κ 3 P] (2)
- A um balão de Schlenk de 200 ml, seco em estufa, adicionar N -Triphos Ph (1,0 g, 1,63 mmol) e [Ru 3 (CO) 12] (347 mg, 0,54 mmol), e coloca-se sob azoto, através de três ciclos de vácuo-azoto sequenciais sobre uma linha dual-colector de Schlenk.
- Adicionar 30 ml de seco, tolueno desgaseificado e levar a mistura ao refluxo durante 12 h.
- Após este 12 h de refluxo, filtrar a solução através de uma cânula para um segundo balão de Schlenk deremover pequenas quantidades de ruténio metálico que se formam durante o decurso da reacção.
- Reduzir o volume de solvente para cerca de 10 ml sob vácuo utilizando um colector de linha dupla de Schlenk equipado com uma armadilha de azoto líquido arrefecido, para induzir a precipitação do complexo.
- Recristaliza-se o precipitado mediante aquecimento suave (80-90 ° C) em um banho de óleo até a redissolução completa ocorre, e subsequente arrefecimento lento até à temperatura ambiente, removendo o calor do banho de óleo, mas permitindo que o frasco de Schlenk a permanecer submerso. Deixar O / N para dar um sólido cristalino cor de laranja.
- Isolar os cristais cor de laranja adequados para difracção de raios-X de uma cânula através de filtração do sobrenadante para outro forno balão de Schlenk seco. Em seguida, lavar os cristais com tolueno seco e desgaseificado (2 x 5 ml) e seco in vácuo O / N. Salve o sobrenadante e as lavagens num balão Schlenk separado.
- Obter um segundo lote de cristais a partir do sobrenadante combinado e solução de enxaguamentos por um processo de recristalização semelhantes aos passos 2.5 e 2.6 para melhorar o rendimento global da reacção.
- Armazenar o complexo sob azoto como a exposição ao ar leva à conversão lenta para o complexo de carbonato oxidado (ver abaixo).
3. Síntese de [Ru (CO 3) (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (3)
- A um balão de Schlenk de 200 ml, adicionar 2 (280 mg, 0,364 mmol) e 5 ml de tolueno para gerar uma suspensão cor de laranja parcialmente dissolvido.
- Inserir uma agulha ligada a um balão de oxigénio na bolha de oxigénio e de suspensão a uma taxa de 2-3 bolhas por segundo através da mistura reaccional durante 10 min.
- Como forma-se um precipitado cor de laranja, recolher por filtração ao ar e lavado com tolueno (2 x 5 ml) e éter dietílico (2 x 5 mL) e seco em vácuo para dar um pó cor de laranja de fluxo livre, que fosse estável em ar.
- Para crescer os cristais adequados para diffr de raios-Xação, dissolver 100 mg de 3 em 3 ml de diclorometano em um frasco e camada 3 ml de tolueno em cima lentamente permitindo que este solvente para correr para o lado do frasco.
- Deixar este S / N para se obter cristais. Isolar os cristais por decantação do sobrenadante e lavar o tolueno (2 x 3 ml) e éter dietílico (2 x 3 ml). Seco no vácuo em uma linha Schlenk dual-manifold.
4. Síntese de [Ru (H) 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (4)
- Prepara-se uma solução de 3 (763 mg, 0,953 mmol) em 20 ml de seco, desgaseificado THF e injectar no reactor de 100 ml de alta pressão do engenheiro autoclave sob uma pressão positiva (0,2 bar) de azoto.
- Mudar o gás do espaço de cabeça do reactor para 100% de hidrogénio e pressurizar a 15 bar à temperatura ambiente, em seguida aquecer a 100 ° C com agitação durante 2 horas.
Atenção! Certifique-se de todos os procedimentos de segurança foram respeitados quando usando altasistemas de pressão! - Após arrefecimento até à TA, vent cuidadosamente o excesso de gás de hidrogénio no espaço de cabeça do reactor e para mudar de azoto.
- Transferir a solução de reacção para um balão de Schlenk de 100 mL sob atmosfera de azoto e, depois de voltar a ligar a uma linha Schlenk dupla colector, filtrar através de uma cânula e dilui-se com 20 ml de seca, desgaseif içada de metanol.
- Remover o solvente sob vácuo utilizando um colector de linha dupla de Schlenk equipado com uma armadilha de azoto líquido arrefecido para dar um pó cor de laranja. Lavar este pó cor de laranja com metanol seco, desgaseificado (3 x 5 ml) e seco, desgaseificado éter dietílico (3 x 5 ml) e seco in vácuo.
- Crescer cristais adequados para análise de difracção de raios-X O / N a partir de uma solução saturada de tolueno seco e desgaseificado de 4 camadas com um volume equivalente de quantidade seca, desgaseif içada de metanol.
- Guarde o complexo em azoto.
5. Reacção de [RuH 2 (CO) {N (CH 2 PPh 2) 3} 3 P -κ] (4) com NH 4 PF 6 e Ácido Levulínicos
- Prepara-se uma solução de 4 (48,4 mg, 65,2 pmol) em 2 mL seco, desgaseif içada de tolueno num balão de Schlenk, seco em estufa, e adicionar através de uma seringa a uma solução agitada de NH 4 PF 6 (10,6 mg, 65,0 nmol) em acetonitrilo (2 ml) em um forno separado balão de Schlenk seco.
- Agita-se a mistura de reacção à temperatura ambiente durante 2 horas. Depois, remover o solvente em vácuo utilizando um colector de linha dupla de Schlenk equipado com uma armadilha de azoto líquido arrefecido para dar o intermediário complexo [RuH (CO) (MeCN) {N (CH 2 PPh 2) 3} -κ 3 P] ( 5).
- Lava-se com a seco, desgaseificado hexano (3 x 3 ml) e seco em vácuo para isolar complexo 5 como um pó castanho.
- A uma solução de 5 em 0,5 ml de acetona desgaseificada-d 6, adiciona-se ácido levulínico (10,8 mg, 93,0 umol, 1,43 equiv.) Em 0,5 ml de acetona desgaseificada-d 6. Agita-se a mistura de reacção durante 2 minutos usandoum agitador de vórtice.
- Ficha de 1 H e 30 P {1 H} espectros de RMN da reacção a cada hora durante 16 horas para observar a reacção. 27
Resultados
A N -triphos Ph ligando (1) e da série de complexo de ruténio: Ru (CO) 2 {N (CH 2 PPh 2) 3} -κ 3 P] (2), [Ru (CO 3) (CO) N { (CH 2 PPh 2) 3} -κ 3 P] (3) e [Ru (H) 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (4) foram caracterizados através de um H, 13 C {1 H}, 30 P {1 H} espectroscopia de RMN, FT-IV, espectrometria de massa ESI e análise elementar. Representante de 1 H e 30 P {1 H} Os dados de RMN são apresentados na Tabela 1. No caso dos complexos 2, 3 e 4 única análise de raios X de cristal confirma inequivocamente as suas estruturas moleculares. 30 P {1 H} é uma espectroscopia de RMN particularmente noseful técnica para estudar estes complexos como desvios característicos a frequência mais elevada em relação aos padrões de ligandos e separação livres podem ser utilizados para identificar ligandos de coordenação bem sucedida e identificar as geometrias específicas dos complexos.
Ph O ligando livre -triphos N (1) exibe uma única ressonância no 30 P {1 H} Espectro de RMN (CDCl3, 162 MHz) a -28,9 ppm. Ocasionalmente, os picos de óxido pode aparecer em freqüências mais altas do 30 P {1 H} espectro de RMN se o devido cuidado não é necessário para excluir o oxigénio durante a reação ou ao fazer uma solução para espectroscopia de RMN. A reacção de N Ph -triphos (1) com [Ru 3 (CO) 12] resulta na dicarbonilo complexo [Ru (CO) 2 {N (CH 2 PPh 2) 3} -κ 3 P] (2), que mostra um característica de mudança de freqüência mais alta de uma camisola a 8.3 ppm no 30 P {1 H} espectro de RMN (C 6 D 6, 162 MHz), indicando que todos os braços de fosfina são coordenados ao centro de Ru e estão no mesmo ambiente químico. A estrutura cristalina de raios-X confirmou que este também (Figura 4A).
A oxidação de 2 a dá a ruténio (II) de carbonato de complexo [Ru (CO 3) (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (3), simplesmente fazendo borbulhar oxigénio molecular através de uma suspensão de 2 em tolueno. Uma alteração significativa na 30 P {1 H} espectro de RMN é visto em relação à 2. Uma característica tripleto e dupleto, 2 AB padrão de acoplamento, visto em 30 na P {1 H} espectro de RMN de 3 com ressonâncias a -23,5 ppm (tripleto) e 15,9 ppm (dupleto) como existem agora dois ambientes diferentes de fósforo, um resultadoda perda de simetria na formação de um carbonato. FT-IR pode ser usado para confirmar a característica κ 2 -carbonato se estende em 1,565 e 1,434 centímetros -1. Cristal único análise de difracção de raios-X confirmou também esta estrutura (Figura 4B).
A hidrogenação de pressão de hidrogénio abaixo de 15 bar 3 dá o complexo de di-hidrogenofosfato de [Ru (H) 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (4) (Figura 2). A 30 P {1 H} espectro de RMN em C 6 D 6 deu um dupleto a 8,5 ppm e 18,8 ppm no tripleto, indicando dois ambientes diferentes de fósforo. O espectro de 1 H RMN mostra ressonâncias de hidreto característicos da região de baixa frequência do espectro como um multipleto centrado em torno -6,50 ppm. Cristal único análise de difracção de raios-X confirmou ainda a estrutura do complexo dihydride (Figura4C).
A reacção de 4 com NH 4 PF 6 em acetonitrilo resultados na perda de um ligando de hidreto de sódio e a formação de H2 molecular, e [RuH (CO) (MeCN) {N (CH 2 PPh 2) 3} -κ 3 P] (PF 6) (5) (Figura 3). A 30 P {1 H} espectro de RMN é ainda mais complicada, pois há agora três ambientes diferentes de fósforo, devido aos três ligantes trans diferentes de coordenação para o centro da rutênio. Um multipleto e dois dupleto-de-dupletos em -12,4, 3,9 ppm e 26,5 ppm são vistos (Figura 5). Na região de baixa frequência do espectro de 1 H RMN de um pseudo-dupleto de tripletos de 5-é visto em -6.3 ppm (Figura 6). A adição de ácido levulínico a 5 dá o complexo [Ru (CO) {N (CH 2 PPh 2) 3} -_4; 3 P {CH 3 CO (CH 2) 2 CO 2 H} -κ 2O] (PF 6) (6) (Figura 3). O espectro de RMN 1 H de 6 após 21 h mostra o completo desaparecimento do sinal de Ru-H (Figura 5) e 30 P {1 H} espectro de RMN mostra um pseudo tripleto a -16,2 ppm e 19,8 ppm dupleto (Figura 6).
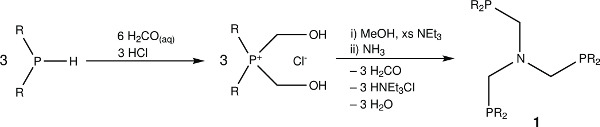
Figura 1. As estruturas químicas do ligando triphosphine N -triphos Ph e o seu esquema sintético geração.

Figura 2. A estrutura química dos complexos de ruténio de N Ph e -triphosum esquema de síntese para a sua preparação sequencial.

Figura 3. A ativação de [RuH 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] com NH 4 PF 6 e posterior coordenação com ácido levulínico.

Figura 4. Os raios X de estruturas de cristal de três Ru- N -triphos complexos de pH, tendo (A) dicarbonilo (complexo 2) (B) carbonil carbonato (complexo 3) e (C) dihydride (4) complexos ligandos auxiliares. Estas estruturas foram obtidos por Andrew JP Branco, do Imperial College London. Note-se, os cristais de [Ru (CO 3) (CO) {N (CH 2 PPh 2) 3} -κ 3 P] foram encontrados para conter dois complexos cristalograficamente independentes, das quais apenas uma é mostrada aqui. Por favor, clique aqui para ver uma versão maior desta figura.

Figura 5. empilhados espectros da região hidreto (-5 a -8 ppm) dos espectros de 1H RMN de [RuH 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (a, d 8 -tolueno, 400 MHz), [RuH (CO) (MeCN) {N (CH 2 PPh 2) 3} -κ 3 P] PF 6 (b, d 6 -acetona, 400 MHz) e [Ru (CO) { N (CH 2PPh 2) 3} P {-κ 3 CH 3 CO (CH 2) 2 CO 2 H} -κ 2O] (PF 6) (c, d 6 -acetona, 400 MHz). Note-se a mudança é como o complexo convertida a partir de uma dihydride (dupleto pseudo-de-dupletos) para um monohydride (dupleto-de-tripletos) e, finalmente, para completar a perda de ligandos de hidreto.

Figura 6. empilhadas 30 P {1 H} espectros de [RuH 2 (CO) {N (CH 2 PPh 2) 3} -κ 3 P] (a, d 8-tolueno, 162 MHz), [RuH (CO) (MeCN) {N (CH 2 PPh 2) 3} 3 -κ P] PF 6 (b, d 6 -acetona, 162 MHz) e [Ru (CO) {N (CH 2 PPh 2) 3} P {-κ 3 CH 3 CO (CH 2) 2 CO 2 H} -κ 2O] (PF 6) (c, d 6 -acetona, 162 MHz). Note-se como o padrão de desdobramento e número de ressonâncias muda com a identidade dos ligandos auxiliares.

Tabela 1. Os 1 H e 30 P {1 H} RMN dados relativos à caracterização do ligando triphosphine e complexos de ruténio subsequentes d = dupleto, t = tripleto, m = multipleto.; padrões pseudo divisão são observados quando dois res separadosonances têm muito semelhante desvios químicos e as constantes de acoplamento.
Discussão
Aqui descrevemos processos de síntese eficiente para a síntese de um ligando tridentado fosfina e uma série de complexos de ruténio. A N -triphos ligando Ph (1) pode ser facilmente preparado, com elevado rendimento com um procedimento de processamento minimalista. Esta reacção de Mannich com base de fósforo usada para sintetizar estes tipos de ligandos é muito geral e pode ser utilizado para outros derivados de ligandos com diferentes grupos R nos átomos de P. 10-12,15-18 Além disso, esta metodologia sintética é receptivo à triphos análogo de ligando, e pode ser utilizado para se obter as mesmas espécies de ruténio dihydride como ligandos com o N -triphos centrada-carbono. Anteriormente, a síntese destes complexos requerem elevadas temperaturas e pressões, bem como os tempos de reacção longos, os quais são negados neste procedimento.
A síntese de uma série de complexos de ruténio 2, 3, 4 , 5 e 6 é realizado de uma forma linear começando com o quelante de N -triphos Ph 1 para [Ru 3 (CO) 12] para gerar o complexo de ruténio 2 dicarbonilo. Este complexo é então dicarbonilo facilmente convertido para o complexo de carbonato de 3 através de um procedimento de oxidação simples e convenientemente isolado na forma de um sólido de ar estável. Um processo de oxidação é de importância crítica para a geração de espécies contendo hidreto de ruténio neste caso. O átomo central no complexo de ruténio 2 está no estado de oxidação zero, e as condições redutoras presentes durante a reacção com H 2 não irá permitir a oxidação necessária de ruténio (0) de ruténio (II) requerido em complexo 4. Por conseguinte, uma oxidação inicial é necessária. Oxidantes químicos, tais como a prata (I) seus sais podem ser usados, e hidrogenação subsequente origina espécies monohydride, 12 no entanto, para as espécies desejadas dihydride, oxigénio molecular deve ser usado como oxidante.
Complexo 3 é convertido no complexo dihydride 4, que tem utilizações potenciais em catálise de hidrogenação, um ponto a notar aqui é que o complexo de 4 é instável em solventes clorados e irá reagir ao longo do tempo para se obter misturas de espécies Ru-Cl, por conseguinte, as amostras de RMN foram normalmente executado em C 6 D 6. Verificou-se que complexos 4 necessita de ser activado com uma fonte de protões, no caso de NH 4 PF 6, para gerar o complexo activo 5 antes que reagirá com LA. 5 encontra-se reagir prontamente com LA durante um período de 21 horas pode ser convenientemente monitorizado utilizando 1 H e 30 P {1 H} espectroscopia de RMN. 1 H e 30 P {1 H} espectroscopia de RMN são técnicas particularmente importantes para caracterizar ocomplexos em cada etapa da síntese, como a mudança de 30 P {1 H} padrões de desdobramento e constantes de acoplamento fornecem informações importantes sobre geometria complexa (Figura 6), enquanto 1H NMR é capaz de detectar o aparecimento e desaparecimento de sinais característicos de hidreto (Figura 5).
É importante que o oxigénio é excluído de reacções durante a síntese de 2, 4, 5 e 6, uma vez que estes complexos vai reagir, normalmente em produtos de decomposição uncharacterizable. Além disso, é necessário acetona-d 6, para observar a conversão do complexo de 5 a 6 por espectroscopia de RMN. Solventes deuterados são necessários, como sinais de protão em solventes não-deuterados irá interferir com as do composto de interesse durante espectroscopia 1 H RMN. A acetona foi escolhido especificamente como clorado resolvernts não pode ser utilizado, e outros solventes, tais como THF irá interferir com a reacção.
Durante a oxidação do complexo de 2 a 3, que não é importante para oxidar o excesso de produto, pois isso irá levar a decomposição. O borbulhar de oxigénio através da suspensão de 2 (passo 3.2), não deve ser feito por mais de cerca de 10 min. Ocasionalmente, um subproduto esverdeada é formado durante a reacção, este acumula-se significativamente, o fluxo de oxigénio deve ser interrompida e a solução foi purgada fazendo borbulhar azoto durante 10 min. Em pequenas quantidades, este subproduto é removido durante a lavagem com éter dietílico (passo 3.3). Em geral, cada complexo (excepto para 6) é estável no ar por períodos curtos quando no estado sólido, que lhe permitam ser pesada sem precauções especiais.
Uma limitação deste processo é a necessidade de um sistema de alta pressão que permite a conversão de complex 3-4. Isto é tipicamente levada a cabo a 15 bar de pressão de H2 (passo 4.2). Este passo foi realizado a pressões mais elevadas (até 50 bar), isto não foi encontrado para aumentar o rendimento ou diminuir o tempo de reacção. Embora a síntese, não foi tentada a pressões mais baixas no laboratório, é possível que condições tão suaves como 1-2 bar seria suficiente. Neste caso, o equipamento não especializada como a TAP selado ampolas de Young poderia ser usado para essa reação. Note-se que qualquer sistema pressurizado é altamente perigoso e deve ser tomado todas as medidas para garantir a segurança do usuário e passantes, e qualquer documentação de saúde e segurança necessária é concluída antes da reação.
Embora uma síntese pressurizado ainda é necessário para sintetizar complexo de 4, continua a ser mais fácil do que o, complexo dihydride anteriormente relatado análoga com o carbono-centradaTriphos (em vez de N -triphos Ph). Estes relatórios necessário, quer condições de reação duras (120 bar H 2, 150 ° C, 20 h) 20 ou várias etapas altamente sensíveis ao ar que requerem o uso de uma caixa de luvas cheia de azoto 28,29. O método relatado permitirá o uso mais amplo de estas espécies como eles se tornam mais acessíveis a grupos não-especializados. Existem vários futuro possível usa para estas espécies, incluindo mas não se limitando a hidrogenação e de hidrogenólise catalisadores, assim como catalisadores para a separação da água e a produção de hidrogénio. Elas serão úteis para o desenvolvimento de um futuro sustentável, no coração dos quais, quase certamente será a inovação quimicamente.
Divulgações
The authors have nothing to disclose.
Agradecimentos
AP is grateful to Imperial College London for a PhD studentship via the Frankland Chair endowment. Johnson Matthey plc are also thanked for the loan of the precious metal salts used in this work.
Materiais
| Name | Company | Catalog Number | Comments |
| Methanol | Obtained from in-house solvent purification system: Innovative Technology, inc "pure solv" drying tower. Stored in ampules over activated molecular sieves under nitrogen. | ||
| Toluene | |||
| Diethyl Ether | |||
| Tetrahydrofuran (THF) | |||
| Acetonitrile | |||
| d6-Acetone | VWR | VWRC87152.0011 | Store in fridge |
| Triethylamine | Sigma-Aldrich | TO886-1L | Distilled and stored over activated molecular sieves under N2 |
| 2 M Ammonia solution in methanol | Sigma-Aldrich | 341428-100ML | Solution comes in a "Sure-Seal" bottle |
| NH4PF6 | Sigma-Aldrich | 216593-5G | Store in desiccator |
| Levulinic Acid | Acros Organics | 125142500 | Solid but melts close to room temperature |
| 3 Å Molecular sieves | Alfa Aesar | LO5359 | Activate by heating over night under vacuum |
| Schlenk flasks | GPE | Custom design | |
| Dual-manifold Schlenk line | GPE | Custom design | Dual-manifold of i) N2 that has been passed through a silica drying column and ii) vacuum. |
| Rotary vacuum pump | Edwards | RV3 A652-01-903 | |
| 100 ml Autoclave Engineer's high pressure reactor | Autoclave Engineer | Custon design | |
| Vortex Stirrer | VWR | 444-1378 |
Referências
- Bruneau, C., Dixneuf, P. H. Ruthenium Catalysis and Fine Chemicals. , Springer. New York. (2004).
- Naota, T., Takaya, H., Murahashi, S. -L. Ruthenium-Catalyzed Reactions for Organic Synthesis. Chem. Rev. 98 (7), 2599-2660 (1998).
- Arockaim, P. B., Bruneau, C., Dixneuf, P. H. Ruthenium(II)-Catalyzed C-H Bond Activation and Functionalization. Chem. Rev. 112 (11), 5879-5918 (2012).
- Trost, B. M., Toste, F. D., Pinkerton, A. B. Non-metathesis ruthenium-catalyzed C-C bond formation. Chem. Rev. 101 (7), 2067-2096 (2001).
- Vougioukalakis, G. C., Grubbs, R. H. Ruthenium-Based Heterocyclic Carbene-Coordinated Olefin Metathesis Catalysis. Chem. Rev. 110 (3), 1746-1787 (2010).
- Lozano-Vila, A. M., Monsaert, S., Bajek, A., Verpoort, F. Ruthenium-based olefin metathesis catalysts derived from alkynes. Chem. Rev. 110 (8), 4865-4909 (2010).
- Samojlowicz, C., Bieniek, M., Grela, K. Ruthenium-based olefin metathesis catalysts bearing N-heterocyclic carbene ligands. Chem. Rev. 109 (8), 3708-3742 (2009).
- Alcaide, B., Almedros, P., Luna, A. G. rubbs’ Ruthenium-Carbenes Beyond the Metathesis Reaction: Less Conventional Non-Metathetic Utility. Chem. Rev. 109 (8), 3817-3858 (2009).
- Conley, B. L., Pennington-Boggio, M. K., Boz, E., Discovery Williams, T. J. Applications, and Catalytic Mechanisms of Shvo’s Catalyst. Chem. Rev. 110 (4), 2294-2312 (2010).
- Miller, P. W., White, A. J. P. The preparation of multimetallic complexes using sterically bulky N-centered tipodal dialkyl phosphine ligands. J. Organomet. Chem. 695 (8), 1138-1145 (2010).
- Hanton, M. J., Tin, S., Boardman, B. J., Miller, P. Ruthenium-catalysed hydrogenation of esters using tripodal phosphine ligands. J. Mol. Catal. A. 346 (1-2), 70-78 (2012).
- Phanopoulos, A., Brown, N. J., White, A. J. P., Long, N. J., Miller, P. W. Synthesis, Characterization, and Reactivity of Ruthenium Hydride Complexes of N-Centered Triphosphine Ligands. Inorg. Chem. 53 (7), 3742-3752 (2014).
- Jin, G. Y. N.N.N-tris(phosphinomethylen)amine N.N.N’-tris(phosphinomethylene)hydrazine N.N.N’.N’-tetra(phosphinomethylene)hydrazine. Tetrahedron Lett. 22 (12), 1105-1108 (1981).
- Walter, O., Huttner, G., Kern, R. Preparation and Characterisation of N(CH2PPh2)3. N(CH2PPh2)3Mo(CO)3 and [HN(CH2PPh2)3Mo(CO)3]BF4. Z. Naturforsch. 51b, 922-928 (1996).
- Fillol, J. L., Kruckenberg, A., Scherl, P., Wadepohl, H., Gade, L. H. Stitching Phospholanes Together Piece by Piece: New Modular Di- and Tridentate Stereodirecting Ligands. Chem. Eur. J. 17 (50), 14047-14062 (2011).
- Rodríguez, L. -I., Roth, T., Fillol, J. L., Wadepohl, H., Gade, L. H. The More Gold–The More Enantioselective: Cyclohydroaminations of γ-Allenyl Sulfonamides with Mono Bis, and Trisphospholane Gold(I) Catalysts. Chem. Eur. J. 18 (12), 3721-3728 (2012).
- Scherl, P., Kruckenberg, A., Mader, S., Wadepohl, H., Gade, L. H. Ruthenium η4-Trimethylenemethane Complexes Containing Tripodal Phosphanomethylamine Ligands. Organometallics. 31 (19), 7024-7027 (2012).
- Scherl, P., Wadepohl, H., Gade, L. H. Hydrogenation and Silylation of a Double-Cyclometalated Ruthenium Complex: Structures and Dynamic Behavior of Hydrido and Hydridosilicate Ruthenium Complexes. Organometallics. 32 (15), 4409-4415 (2013).
- Geilen, F. M. A. Selective and Flexible Transformation of Biomass-Derived Platform Chemicals by a Multifunctional Catalytic System. Angew. Chem. Int. Ed. 49 (32), 5510-5514 (2010).
- Geilen, F. M. A., Engendahl, B., Hölscher, M., Klankermayer, J., Leitner, W. Selective Homogeneous Hydrogenation of Biogenic Carboxylic Acids with [Ru(TriPhos)H]+: A Mechanistic Study. J. Am. Chem. Soc. 133 (36), 14349-14358 (2011).
- Van Engelen, M. C., Teunissen, H. T., de Vries, J. G., Elsevier, C. J. Suitable ligands for homogeneous ruthenium-catalyzed hydrogenolysis of esters. J. Mol. Catal. A. 206 (1-2), 185-192 (2003).
- Wesselbaum, S., vom Stein, T., Klankermayer, J., Leitner, W. Hydrogenation of Carbon Dioxide to Methanol by Using a Homogeneous Ruthenium–Phosphine Catalyst. Angew. Chem. Int. Ed. 51 (30), 7499-7502 (2012).
- Fillol, J. L., Kruckenberg, A., Scherl, P., Wadepohl, H., Gade, L. H. Stitching Phospholanes Together Piece by Piece: New Modular Di- and Tridentate Stereodirecting Ligands. Chem. Eur. J. 17 (50), 14047-14062 (2011).
- Rodríguez, L. -I., Roth, T., Fillol, J. L., Wadepohl, H., Gade, L. H. The More Gold–The More Enantioselective: Cyclohydroaminations of γ-Allenyl Sulfonamides with Mono Bis-, and Trisphospholane Gold(I) Catalysts. Chem. Eur. J. 18 (12), 3721-3728 (2012).
- Scherl, P., Wadepohl, H., Gade, L. H. Hydrogenation and Silylation of a Double-Cyclometalated Ruthenium Complex: Structures and Dynamic Behavior of Hydrido and Hydridosilicate Ruthenium Complexes. Organometallics. 32 (15), 4409-4415 (2013).
- Bennett, B. K., Richmond, T. G. An Inexpensive, Disposable Cannula Filtration Device. J. Chem. Educ. 75 (8), 1034(1998).
- Judd, C. S. Proton NMR Basics. J. Chem. Educ. 72 (8), 706(1995).
- Rhodes, L. F., Venanzi, L. M. Ruthenium(II)-Assisted Borohydride Reduction of Acetonitrile. Inorg. Chem. 26 (16), 2692-2695 (1987).
- Bakhmutov, V. I. In-depth NMR and IR study of the proton transfer equilibrium between [{MeC(CH2PPh2)3}Ru(CO)H2] and hexafluoroisopropanol. Can. J. Chem. 79, 479-489 (2001).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados