Method Article
Detecção e análise de danos no DNA em Rato Músculo Esquelético
Neste Artigo
Resumo
This video describes dissection, tissue processing, sectioning, and fluorescence-based TUNEL labeling of mouse skeletal muscle. It also describes a method for semi-automated analysis of TUNEL labeling.
Resumo
Terminal deoxynucleotidyl transferase (TdT) deoxyuridine triphosphate (dUTP) nick end labeling (TUNEL) is the method of using the TdT enzyme to covalently attach a tagged form of dUTP to 3’ ends of double- and single-stranded DNA breaks in cells. It is a reliable and useful method to detect DNA damage and cell death in situ. This video describes dissection, tissue processing, sectioning, and fluorescence-based TUNEL labeling of mouse skeletal muscle. It also describes a method of semi-automated TUNEL signal quantitation. Inherent normal tissue features and tissue processing conditions affect the ability of the TdT enzyme to efficiently label DNA. Tissue processing may also add undesirable autofluorescence that will interfere with TUNEL signal detection. Therefore, it is important to empirically determine tissue processing and TUNEL labeling methods that will yield the optimal signal-to-noise ratio for subsequent quantitation. The fluorescence-based assay described here provides a way to exclude autofluorescent signal by digital channel subtraction. The TUNEL assay, used with appropriate tissue processing techniques and controls, is a relatively fast, reproducible, quantitative method for detecting apoptosis in tissue. It can be used to confirm DNA damage and apoptosis as pathological mechanisms, to identify affected cell types, and to assess the efficacy of therapeutic treatments in vivo.
Introdução
Terminal desoxinucleotidilo transferase (TdT) dUTP nick marcação terminal (TÚNEL) é o processo de utilizar a enzima TdT para anexar dUTP a 3 'da dupla e ADN de cadeia simples quebra 12,23. O método TUNEL para detecção de apoptose e DNA dano foi relatada pela primeira vez mais de 20 anos atrás por Gavrieli et al. 1,12,24. Desde então, foi avaliado e otimizado em diferentes preparações de tecido 7,23,27,40. TUNEL foi usado para estudar a morte celular induzida por isquemia de neurónios 6,14,29 e cardiomiócitos 43,44, morte celular neuronal excitotóxica 30,31, e como biomarcador no tratamento da artrite 39. Também tem sido utilizada como um factor de prognóstico e marcador de células tumorais em vários cancros humanos 2,3,15,32,37,38,42.
Existem métodos alternativos para a detecção de danos ao DNA e morte celular, mas eles têm desafios técnicos e advertências. Southern blotting pode ser usado para quantifdanos no DNA y em tecido lisados inteiras 7,9-11, mas este método não fornece resolução de nível celular e é difícil de quantificar. O ensaio do cometa é um método baseado em células alternativa que requer a extração de núcleos preservados a partir de células 4,20,28,36. Embora o ensaio do cometa funciona bem em células de cultura isoladas, é muito mais difícil de preparar os núcleos intactos a partir de tecido muscular esquelético 8,21. Tal como acontece com Southern blot, o ensaio do cometa não fornece informações específicas do tipo de células a partir de um homogeneizado de tecido músculo inteiro. Uma outra alternativa para o método de TÚNEL é imuno-histoquímica utilizando anticorpos contra o ADN de cadeia simples 25,33,41 ou contra proteínas que participam em vias de resposta ao dano de ADN e morte celular (por exemplo, p53, H2AX, e caspases) 13,17,22,40. Tais métodos com base em anticorpos requerem caracterização exaustiva de anticorpos e excelente especificidade do anticorpo para se obter uma elevada relação de sinal-para-fundo. Mesmo quando especificaçãoexistem anticorpos ific, podem exigir a desnaturação da proteína-alvo através de procedimentos de recuperação antigênica 34,35. Enquanto discutimos aqui, recuperação antigênica em resultados de tecido muscular em inaceitavelmente elevado autofluorescência. Ao contrário dos métodos alternativos, TUNEL atinge a detecção de danos do ADN com um sinal alto e baixo fundo, excelente especificidade que pode ser testado com os controlos positivos e negativos simples, boa penetração nos tecidos que não necessitam de recuperação de antigénios, e resolução de nível celular. Além disso, o método de TÚNEL demora cerca de 4 horas para se completar, enquanto que os métodos alternativos tipicamente requerem incubações durante a noite.
Estudamos a morte de células do músculo esquelético em um modelo de rato de atrofia muscular espinhal (AME) 10 que foi gerado por Hsieh-Li e seus colegas 16. Para quantificar as células apoptóticas no músculo, temos desenvolvido um método de preparação do tecido, de coloração e quantificação que funciona de forma robusta através skele diferenteTal grupos musculares em diferentes pontos de tempo de desenvolvimento em ratinhos. Nós usamos um kit TUNEL-rotulagem comercialmente disponíveis e software de análise de imagem disponível no mercado. Temos também utilizado com sucesso o ensaio TUNEL em combinação com coloração de imunofluorescência na medula espinal 10.
Os métodos descritos aqui são úteis para investigadores que desejam apreciar a patologia do tecido, os mecanismos de doença, os mecanismos de envelhecimento, e desenvolvimento (pré- e pós-natal) morte celular no músculo esquelético. A técnica de TUNEL é especialmente útil para estudos de lesão e reparação do ADN e morte celular em sistemas-modelo em que apenas um subconjunto de células é afectado e resolução a nível celular é necessária.
Este vídeo descreve a dissecção, processamento de tecidos, corte, e com base em fluorescência TUNEL rotulagem de rato músculo esquelético. Ele também descreve um método de semi-automatizado de TUNEL sinal de quantificação.
Protocolo
NOTA: Todos os procedimentos com animais descritos neste protocolo foram realizadas de acordo com as recomendações do Guia para o Cuidado e Uso de Animais de Laboratório do Instituto Nacional de Saúde 26. O protocolo (MO13M391) foi aprovado pelo Comitê Universidade Animal Care and Use a Johns Hopkins.
1. Neonatal Rato Sacrifício, Dissection, e Fixação
- Sacrifique um rato neonatal por inalação de CO2.
- Cortar imediatamente o hindlimb acima do joelho. Até o dia pós-natal aproximadamente 7, os ossos da perna são suaves o suficiente para cortar com tesoura grande laboratório ou lâmina afiada e posteriormente seção em um criostato.
- Inserir o membro posterior em 10 mL de gelo frio paraformaldeído a 4% em solução salina tamponada com fosfato (PBS) em um tubo de 15 ml.
- Imersão fixar o membro posterior em paraformaldeído durante 4-24 h a 4 ° C. Tecido embrionário requer apenas algumas horass de fixação.
- Evite fixação mais de 24 horas, pois isso pode reduzir a eficiência TUNEL ensaio.
- Cryoprotect o membro posterior por imersão em solução de sacarose.
- Mudar de paraformaldeído a 10% de sacarose em PBS no mesmo tubo de 15 ml, incubar durante a noite a 4 ° C.
- Alterar a 30% de sacarose em PBS, incubar durante a noite a 4 ° C ou até que as pias dos membros posteriores para o fundo do tubo. Tecido podem ser deixadas em sacarose a 30% durante um período mais longo, desde que a sacarose tenha sido esterilizada por filtração.
2. Inclusão do Tecido
- Encher um meio caminho marcado molde a incorporação com a incorporação de média.
- Coloque membro posterior no topo do meio de fixação, com o lado do corte tão perto quanto possível a uma parede do molde. Marque a orientação do membro posterior do lado de fora do molde.
- Incorporar vários membros posteriores e cortar no mesmo bloco. No entanto, é importante para assegurar que todas as hindlimbs do bloco são orientados paralelamente uns aos outros para obter secções em níveis correspondentes ao longo do eixo do membro.
- Cubra hindlimbs com a incorporação de média. Se hindlimbs deslocar ao derramar o meio, re-orientá-los com pinças atraumáticas ou um palito.
- Permitir a incorporação de forma a infiltrar-se o tecido à temperatura ambiente durante pelo menos 15 min.
- Coloque moldes diretamente em gelo seco ou em isopentano em gelo seco para congelar a incorporação médio. Certifique-se de manter o nível de moldes em todos os momentos e evitar o deslocamento do tecido incorporado.
- Mantenha moldes congelados a -80 ° C até que esteja pronto para cortar, por até vários meses.
3. cryosectioning incorporado Limbs
- Ajuste temperatura da câmara de criostato para -20 ° C, temperatura do objecto a -18 ° C; ajustar a temperatura do objeto para baixo, conforme necessário.
- Equilibrar o bloco de tecido no interior da câmara de criostato para, pelo menos, 30 min. Temp bloco corretoratura é crucial para a qualidade do corte.
- Os cortes transversais a uma espessura de 10 pm ou menos. Seções mais espessos não será totalmente penetrado por reagentes TUNEL. Use a placa anti-roll, lâminas, e ângulo de lâmina (geralmente 5 °) recomendado para o criostato.
- Recolhe secções em lâminas de vidro ou gelatin- vectabond-revestidos à temperatura ambiente. Coloque imediatamente em uma caixa de lâminas em gelo seco. Mantenha a caixa de slides em um recipiente separado com gelo seco colocado perto do cryostat ao alcance do braço.
- Os cortes transversais de série através do longo eixo do membro, pulando 100-200 mm. Coletar pelo menos três seções adjacentes em cada nível de série.
4. TUNEL Ensaio sobre Seções hindlimb usando um kit comercialmente disponível (todos os passos à temperatura ambiente, salvo indicação)
- Descongele lâminas com cortes à temperatura ambiente e secar durante a noite ou no fim de semana.
- Reidratar seções por immersing lâminas em PBS para 2 x 10 min em uma jarra de Coplin. Seque com um laboratório de limpar, removendo o máximo de líquido ao redor da seção possível.
- Seções permeabilizar
- Utilizar um não proteolítico, reagente à base de saponina comercial ou 0,5% de Tween 20 e 0,05% de Triton X100 em PBS.
- Coloque o slide em uma câmara de umidade. Uma câmara de humidade é uma simples caixa vazia ponta da pipeta com uma tampa estanque, com água apenas suficiente adicionado para cobrir o fundo da caixa.
- Pipeta reagente suficiente para o slide para cobrir a seção (50 ul é suficiente para membros neonatais do mouse). Não pipete diretamente na seção, como agitação repetida pode causar a seção para retirar a slide.
- Utilizando uma pinça de ponta romba, coloque um pequeno retângulo de parafilm no topo da seção para se espalhar a gota de reagente e cobrir completamente a seção. Se as bolhas de formar sob a parafilm, levante suavemente-lo fora, seca, e reaplicar.
- Incubar as lâminas com permeabilireagente zação durante 1 hora em câmara úmida coberta. Se as secções começam a levantar a partir do slide, tempo de permeabilização pode ser reduzido para 30 min.
- Lavar as lâminas em PBS em uma jarra de Coplin 2 x 5 min. Os rectângulos parafilme deve flutuar para o topo e pode então ser removido e descartados.
- Usando um laboratório de limpeza, seque o máximo de líquido ao redor das seções quanto possível.
- Rotulagem pausa DNA TdT mediada
- Siga as instruções do kit para fazer tampão de marcação 1x TdT, tampão de marcação suficiente pipeta para o slide para cobrir a secção de tecido (50 ul é suficiente para membros neonatais do mouse). Incubar na câmara de humidade durante 5 min. Como alternativa, mergulhe o slide no tampão de marcação TdT em um frasco coplin.
- Siga as instruções do kit para fazer TdT mix rotulagem. O kit inclui cobalto, magnésio, e catiões de manganês; o catião manganês funciona bem em uma variedade de tecidos, incluindo músculo esquelético, sistema nervoso tissues, fígado, pele e osso.
- Para um controlo positivo, adicionar DNase (rotulado "nuclease" no kit) para a mistura de marcação de TdT. Alternativamente, pré-tratamento de uma secção de controlo positivo com ADNase em tampão de nuclease durante 1 hora a 37 ° C, de acordo com as instruções do kit. Mantenha solução DNase e seções tratado com DNase longe de outras seções experimentais para evitar a contaminação cruzada.
- Para um controlo negativo, omitir enzima TdT da mistura de marcação.
- Usar um toalhete de laboratório para remover tanto tampão de marcação a partir do slide TdT quanto possível. Pipeta TdT mistura de marcação sobre a lâmina (50 ul por ponto), cobrir com uma nova rectângulo de parafilme, e incuba-se a câmara de humidade a 37 ° C durante 1 h.
- Siga as instruções do kit para fazer tampão de paragem 1x. Usar um laboratório de limpar para remover TdT mistura de marcação a partir do slide, e adicionar ul de tampão de paragem 200-300 para cobrir a secção de tecido, e incuba-se a câmara de humidade durante 5 min. Al ternatively, mergulhe o slide em tampão de parada em uma jarra de Coplin.
- Lava-se a corrediça 2 x 2 min em PBS. Usar um toalhete de laboratório para remover o máximo de PBS a partir do slide quanto possível.
- Marcação fluorescente
- Siga as instruções do kit para preparar solução de etiquetagem fluoresceína para rotular dNTPs em quebras de DNA. Pipeta solução para o slide (50 ul por seção), cubra com um novo retângulo de parafilm, e incubar na câmara úmida por 20 min.
- Wash slides para 2 min em PBS em uma jarra de Coplin. Usar um toalhete de laboratório para remover tanto quanto possível PBS a partir do slide.
- Diluir a Hoechst 33258 corante nuclear de 1 ug / ml em PBS e pipeta sobre a lâmina (100-200 uL é suficiente para cobrir a secção). Incubar na câmara de humidade durante 5 min.
- Lavar 3x durante 5 min em PBS.
- Lamela com Antifade meios de montagem de fluorescência e selar as bordas com unha polonês.
- Adquirir imagens usando um microscópio de fluorescência convencional com DAPI, FITC, e filtros de Texas Red (ou equivalente). Use um objetivo maior ampliação (20x ou 40x) para verificar se a rotulagem foi bem sucedida e núcleos (inteiros ou fragmentados) foram marcadas. Uma objectiva 10X é suficiente para a quantificação de pontos lacrimais TUNEL positivo.
- Coletar imagens da coloração Hoechst, TUNEL, e sinal autofluorescent como três canais de cores falsas separadas combinadas em uma única imagem. Se a etiqueta de TUNEL fluoróforo é verde, do sinal de imagem autofluorescente no filtro vermelho, e vice-versa.
- Mantenha todas as configurações de imagem equivalente entre os slides para thresholding e quantificação subsequente. Para cada filtro, horários predefinidos e exposição registro, ganho e binning (sem binning é melhor); não usar as configurações de exposição ou de ganho automático.
- Use tentativa e erro para encontrar as configurações de exposição e ganho que melhor capturam a gama de intensidades em todas as lâminas coradas. Certifique-se de que não existem pixels saturadas nas imagens adquiridas, já que esta quantificação viés vontade.
- Tome imagens de todo o grupo muscular de interesse. Isso pode exigir várias imagens para ser "costurado" juntos.
Análise 6. Imagem
- Use programas de análise de imagem disponíveis no mercado para analisar imagens digitais de coloração TUNEL. Análise utilizando software comercial é mostrado aqui. Em alternativa, o software ImageJ livre de NIH pode ser usado para analisar a coloração TUNEL.
- Manchar uma seção ao lado da seção manchada de TUNEL com HE (H & E) e dar uma imagem digital de seção plena com um microscópio de campo claro convencional. Use esta imagem H & E em combinação com um atlas de anatomia 5,18,19 traçar as estruturas anatômicas a serem quantificados.
- Com o canal de TUNEL desligado, rastrear manualmente o contorno da área a ser quantificado, utilizandoHoechst e canais autofluorescência de orientação. Converter a área rastreada em uma máscara (um conjunto de pixels selecionados coordena a ser analisado).
- Ligue o canal de TUNEL. Usando a intensidade função limiarizar no programa de análise de imagem, definir o limite inferior a excluir qualquer sinal autofluorescência.
- Aplicar as mesmas configurações de limite para todas as imagens no set estudo. Converso seleções limiarizadas em máscaras.
- Para cada imagem, combinar a máscara da área do músculo ea máscara TUNEL. A nova máscara combinação irá representar sinal TUNEL dentro apenas a área do músculo rastreado.
- Realizar a quantificação da máscara na máscara de combinação para determinar o número de objectos e da área do sinal de TUNEL dentro da área muscular rastreada objeto. Realize esta usando a função de analisador de partículas em ImageJ.
Resultados
Com coloração bem sucedido, sinal TUNEL-positivo deve ser brilhante o suficiente para isolar a partir de autofluorescência definindo limites de intensidade. Objetos TUNEL-positivos em baixa ampliação pode aparecer fragmentos irregulares como brilhantes no músculo esquelético (Figura 1A). No entanto, a maior ampliação, alguns objetos TUNEL-positivo com a morfologia apoptótica clássico deve ser observado, se o tipo de morte celular envolvido é a apoptose (Figura 1B). O controlo positivo (ADNase adicionada) deve apresentar o sinal de TUNEL positivo abundante, distribuído uniformemente em todos os tecidos na secção (Figura 1C). O controle negativo (enzima TdT omitido da reação) deve render fundo de baixa intensidade e sinal autofluorescent apenas (Figura 1D). Pele, proporciona um controlo positivo interno em secções de perna inteiros, como esse tecido tem uma alta taxa de apoptose normal (Figura 1A).
Sangue vermelhocélulas do osso, células endoteliais, e pode contribuir sinal autofluorescente significativa (Figura 2). Aconselha-se a imagem de cada seção em um canal separado sem marcação fluorescente para garantir que autofluorescência não é confundido com sinalização TUNEL positivo. Sinal de TUNEL positivo verdadeiro deve ter muito maior intensidade do que a autofluorescência, de modo que possa ser isolado por meio de estabelecimento de limiares de intensidade de imagem (Figura 2A, linha média). Alternativamente, o canal pode ser autofluorescente digitalmente subtraído do canal de TUNEL para produzir o sinal de TUNEL positivo (Figura 2A, linha inferior).
O método de marcação TUNEL aqui descrito foi usado para quantificar a morte de células do músculo esquelético, em um modelo de rato de SMA 10. Rotulagem TUNEL mostra um aumento no número de perfis apoptóticos em músculos da perna, de 5 dias de idade os ratos SMA, em comparação com controlos da mesma ninhada (Figura 3A). O aumento em apoptose équantificável pelo método descrito acima, indicando diferenças estatisticamente significativas em vários grupos musculares (Figura 3B).
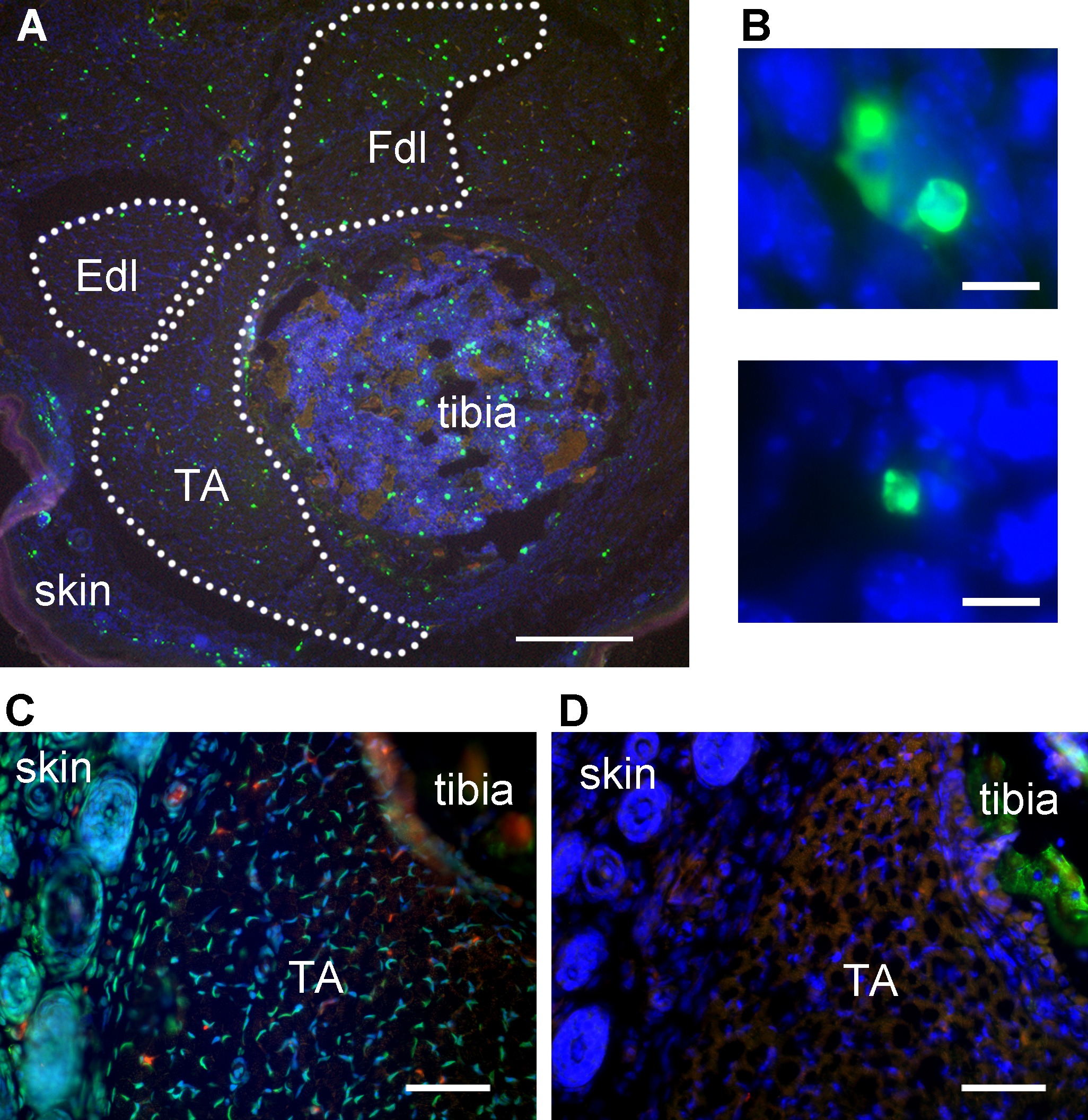
Figura 1: rotulagem TUNEL Representante dos músculos dos membros posteriores do mouse. (A) TUNEL marcado secção transversal do membro posterior do rato mostrando músculo tibial anterior, tíbia, e pele. TA - tibial anterior, Fdl - flexor longo dos dedos, Edl - extensor longo dos dedos. Green - TUNEL, azuis - núcleos, vermelho - sinal autofluorescent. As linhas pontilhadas delinear áreas musculares para quantificação. Pele adjacente músculos dos membros posteriores fornece um controle interno positivo para a rotulagem TUNEL. Barra de escala = 200 mm. (B) representativos imagens de alta ampliação identificando TUNEL-positivo estruturas (verde) em embrionário dia 13 de rato músculo esquelético como núcleos apoptóticos. Escala da barra = 10 m. A e B modificada a partir Fayzullina e Martin 2014 10. (C) de secção transversal do membro posterior do rato TUNEL marcado após o tratamento de DNase para servir como um controlo positivo. A maioria dos núcleos têm rotulagem TUNEL brilhante. Escala da barra = 50 m. (D) Secção transversal do mesmo membro posterior do rato como se mostra em C (semi-adjacente a secção em C) TUNEL marcado com enzima TdT omitido para servir como um controlo negativo. Não há sinal de TUNEL-positivo brilhante; o único sinal verde é autofluorescência como detectado por co-localização com sinal no canal vermelho. Barra de escala = 50 mm. Por favor, clique aqui para ver uma versão maior desta figura.
2 "fo: content-width =" "src =" 6 pol / files / ftp_upload / 52211 / 52211fig2highres.jpg "width =" 600 "/>
Figura 2: A autofluorescência do tecido deve ser considerado e excluídos da quantificação na análise de rotulagem TUNEL. (A) seção transversal hindlimb Rato com rotulagem TUNEL e autofluorescência: imagem original (topo de linha), a mesma imagem com os limites ajustados (linha do meio), e mesma imagem com autofluorescência canal (vermelho) subtraído (linha de fundo). Thresholding elimina celular mais vermelha do sangue e autofluorescência de células endoteliais, mas não o artefato coloração (ponta de seta, linha do meio). Subtração Canal também elimina o artefato coloração (ponta de seta, linha inferior). Green - TUNEL, vermelho - autofluorescência, azuis - núcleos. Barra de escala = 100 pm. Imagem Maior ampliação do painel autofluorescência vermelho retângulo cinza delineia área ampliada em B. (B) em A. Glóbulos vermelhos e algumas células endoteliais (setas), e uma TISSue coloração artefato (seta) autofluoresce em ambos os filtros de fluorescência vermelha e verde. Barra de escala = 50 mm. Por favor, clique aqui para ver uma versão maior desta figura.
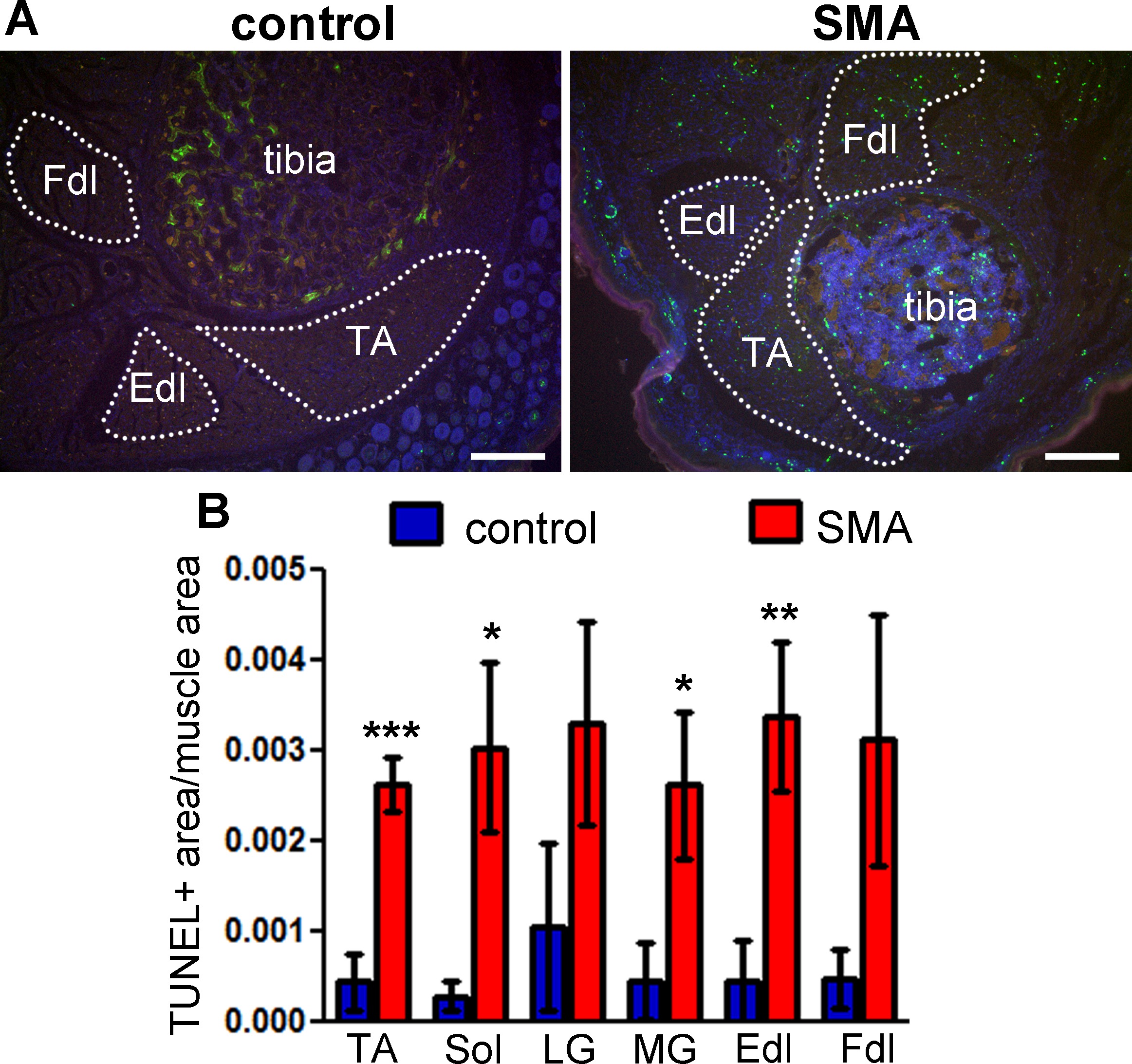
Figura 3: rotulagem TUNEL mostra a morte de células no músculo esquelético de ratos SMA neonatais músculos da parte inferior dos membros posteriores de ratos SMA em dia pós-natal 5 foram marcadas pelo método TUNEL (A) rotulagem TUNEL mostra vários perfis apoptóticos em vários grupos musculares em SMA mouse.. músculo (direito) em comparação com o controlo da mesma ninhada (esquerda). Green - TUNEL, azul - Hoechst (núcleos), vermelho - autofluorescência. As linhas pontilhadas delinear as áreas musculares quantificados. TA - tibial anterior, Fdl - dig flexoritorum longus, Edl - extensor longo dos dedos. Barras de escala = 200 pm rotulagem. (B) TUNEL foi quantificada como a área total de pixels de sinal de TUNEL normalizada para a área total de pixels de músculo. Médias ± erros padrão são ilustrados, n = 4 - 5 ratinhos. A significância estatística entre SMA e de controlo para cada grupo muscular (unicaudal t-teste): * p <0,05, ** p <0,01, *** p <0,001. Este valor foi modificado a partir Fayzullina e Martin 2014 10. Por favor, clique aqui para ver uma versão maior desta figura.
Discussão
Um método para detectar e analisar quantitativamente a apoptose do ADN associada a danos no músculo esquelético de rato está descrito. O procedimento inclui a colheita de tecidos, coloração TUNEL, aquisição de imagem digital e análise de imagens. Fornecimentos histológicos comuns e ferramentas são necessárias, e um kit especial TUNEL comercial é necessária. Os itens de equipamento grandes essenciais necessários são um criostato, microscópio de epifluorescência, com capacidade de imagem digital, e um sistema de computador para análise de imagens.
O pesquisador deve estar ciente dos perigos potenciais. Autofluorescência do tecido é uma grande preocupação em imagens de fluorescência. Em animais não perfundidada, mantendo-se os glóbulos vermelhos contribuirá sinal bastante elevado autofluorescent. As células endoteliais também podem ser significativamente autofluorescente. Portanto, é importante para confirmar que a autofluorescência não é confundido com o sinal de TUNEL positivo. Esta avaliação é realizada facilmente, tendo uma imagem em um canal sem fluorophore, a ser utilizado para comparação e possível subtracção do canal de TUNEL positivo. Desta forma, o método de TÚNEL à base de fluorescência é superior aos métodos de microscopia de campo claro colorimétricos que não proporcionem um controlo interno para a coloração de fundo.
Fixação do tecido terá um impacto significativo no sucesso da rotulagem TUNEL. É melhor para minimizar o tempo de fixação em paraformaldeído, para não exceder 24 horas. Tecido embrionário e neonatal, serão necessários tempos de fixação significativamente menores do que 24 horas.
Quando marcação TUNEL é bem sucedido, o sinal de TUNEL positivo deve ser muito maior do que o fundo da autofluorescência, de modo que o sinal pode ser facilmente isolado por intensidade de limiar de propagação usando software de análise de imagem. Recuperação de antigénios utilizando o protocolo padrão de aquecimento em tampão citrato 27,35 pode melhorar ligeiramente sinal de baixa TUNEL se o tempo de aquecimento é mantido a um mínimo (5 min), mas este pré-tratamento de dezds para reduzir o sinal de TUNEL, se o aquecimento for prolongado por períodos mais longos (por exemplo, 20 minutos a 95 ° C). Recuperação antigênica aumentará autofluorescência de fundo e falsos positivos, e, portanto, pode anular quaisquer ganhos na relação sinal-ruído de sinal aumentado TUNEL.
As medições de sinal TUNEL deve ser normalizada quer para a área total do músculo ou quantificada com o número de núcleos por área quantificada. Porque TUNEL mede núcleos apoptóticos, a normalização ideal seria núcleos totais. No entanto, mesmo em 10 (um) seções musculares relativamente finas, as fibras musculares e núcleos são tão numerosas e embalado tão de perto, que é impossível contar automaticamente núcleos Hoechst-manchadas por thresholding e de separação de partículas algoritmos. Contagem manual também é muito trabalhoso e impreciso. A alternativa viável é a normalizar a área total do músculo.
O ensaio de TUNEL, utilizado com o processamento do tecido apropriadotécnicas e os controlos positivos e negativos, é um método relativamente rápido, reprodutível, quantitativo para a detecção de danos no ADN e morte celular em tecidos. Ele pode ser usado para confirmar a apoptose como um mecanismo patológico, para identificar os tipos de células afectadas, e para avaliar a eficácia dos tratamentos terapêuticos. Este procedimento será de valor para pesquisadores nas áreas de doença do músculo esquelético e lesões, incluindo SMA, ALS, distrofia muscular, miopatia induzida pela toxina, e fisiologia do exercício.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by NIH-NINDS grant RO1-NS065895 and NIH-NINDS grant 5-F31-NS076250-02.
We thank JHU SOM Microscope Facility for the use of the cryostat.
Materiais
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde in phosphate buffered saline | Electron Microscopy Sciences | 19202 | For procedures described here, 4% solution was prepared fresh from powder. Paraformaldehyde from any supplier may be used. Prepared formaldehyde solution should be stored at 4 °C and should not be used after its expiration date (up to several months). Paraformaldehyde is a carcinogen and a toxin by inhalation and skin contact. Please follow precautions specified in the MSDS when handling paraformaldehyde. |
| Sucrose | Sigma | S0389 | Used for cryoprotecting tissue before freezing. Sucrose from any supplier may be used. |
| O.C.T. compound | Tissue-Tek | 4583 | Embedding medium for cryosectioning. |
| Cryostat | Leica | CM 3050S | A Leica CM3050S cryostat was used for the preparations described here. Any cryostat capable of cutting 10 μm sections may be used. |
| Glass slides, 25 x 75 x 1 mm | Fisher | 12-552-3 | Slides from any supplier may be used. |
| Gelatin | Sigma | G-9391 | Gelatin is used to promote tissue section adhesion to glass slides. To coat glass slides with gelatin, dissolve 2.75 g gelatin and 0.275 g chrome alum in 500 ml distilled water, warm to 60 °C, dip slides for several seconds, and let dry. Gelatin from any supplier may be used. Alternatively, gelatin-precoated slides may be purchased. |
| Chromium(III) potassium sulfate dodecahydrate (chrome alum) | Sigma | 243361 | Chrome alum is added to gelatin solution to promote tissue adhesion on glass slides. It is a possible carcinogen and a toxin by inhalation and skin contact. Please follow precautions specified in the MSDS when handling chrome alum. |
| Vectabond tissue adhesion reagent | Vector Labs | SP-1800 | Optional substrate for better tissue adhesion to glass slides; gelatin-coated slides may be used instead. |
| Tween20 | Sigma | P9416 | A detergent used to permeabilize tissue. Tween20 from any supplier may be used. |
| Triton X100 | Sigma | T8787 | A detergent used to permeabilize tissue. Triton X100 from any supplier may be used. |
| TACS 2 TdT fluorescein in situ apoptosis detection kit | Trevigen | 4812-30-K | Commercial kit for fluorescence-based TUNEL labeling. |
| DNase/nuclease | Trevigen | 4812-30-K | (included with kit) |
| DNase/nuclease buffer | Trevigen | 4812-30-K | (included with kit) |
| 10x phosphate buffered saline (PBS), pH 7.4 | Amresco | 780 | Make 1x PBS for washes and dilutions. PBS from any supplier may be used. |
| DNase-free water | Quality Biologicals | 351-029-131 | Water from any supplier may be used. |
| Hoechst 33258 | Sigma | 94403 | Nuclear dye. Any blue fluorescent nuclear dye may be used. As a DNA-binding dye, Hoechst is a suspected carcinogen and should be handled with protective equipment to minimize skin contact. |
| Parafilm M | multiple | 807 | Any other hydrophobic film or cover slip may be used. Available from multiple suppliers. |
| Fluorescent microscope with digital camera | -- | -- | Any fluorescent microscope capable of digitally capturing red, green, and blue fluorescence in separate channels may be used. |
| Vectashield antifade media | Vector Labs | H-1000 | Antifade media from any supplier may be used. |
| glass coverslips, No.1 thickness | Brain Research Labs | 2222-1 | Cover slips from any supplier may be used. The smallest size of 22 x 22 mm is sufficient for neonatal mouse leg sections. |
| Nail polish | Ted Pella | 114-8 | Used to seal coverslips. Nail polish from any supplier (including regular retailers) may be used. Avoid using nail polish with color or additives that may reflect light during fluorescent imaging. |
Referências
- Ansari, B., Coates, P. J., Greenstein, B. D., Hall, P. A. In situ end-labelling detects DNA strand breaks in apoptosis and other physiological and pathological states. 170 (1), 1-8 (1993).
- Ben-Izhak, O., Laster, Z., Akrish, S., Cohen, G., Nagler, R. M. TUNEL as a tumor marker of tongue cancer. Anticancer Res. 28 (5B), 2981-2986 (2008).
- Colecchia, M., et al. Detection of apoptosis by the TUNEL technique in clinically localised prostatic cancer before and after combined endocrine therapy. 50 (5), 384-388 (1997).
- Collins, A. R. The comet assay for DNA damage and repair: principles, applications, and limitations. Mol. Biotechnol. 26 (3), 249-261 (2004).
- Delaurier, A., et al. The Mouse Limb Anatomy Atlas: an interactive 3D tool for studying embryonic limb patterning. 8, 83 (2008).
- Torres, C., Munell, F., Ferrer, I., Reventos, J., Macaya, A. Identification of necrotic cell death by the TUNEL assay in the hypoxic-ischemic neonatal rat brain. Neurosci. Lett. 230 (1), 1-4 (1997).
- Didenko, V. V. . In Situ Detection of DNA Damage : Methods and Protocols. , 978-970 (2002).
- Edelman, J. C., Edelman, P. M., Kniggee, K. M., Schwartz, I. L. Isolation of skeletal muscle nuclei. J. Cell Biol. 27 (2), 365-378 (1965).
- Facchinetti, A., Tessarollo, L., Mazzocchi, M., Kingston, R., Collavo, D., Biasi, G. An improved method for the detection of DNA fragmentation. J. Immunol. Methods. 136 (1), 125-131 (1991).
- Fayzullina, S., Martin, L. J. Skeletal muscle DNA damage precedes spinal motor neuron DNA damage in a mouse model of spinal muscular atrophy (SMA). PLoS.One. 9 (3), e93329 (2014).
- Ferrer, I., et al. Naturally occurring cell death in the developing cerebral cortex of the rat. Evidence of apoptosis-associated internucleosomal DNA fragmentation. Neurosci. Lett. 182 (1), 77-79 (1994).
- Gavrieli, Y., Sherman, Y., Ben-Sasson, S. A. Identification of programmed cell death in situ via specific labeling of nuclear DNA fragmentation. J. Cell Biol. 119 (3), 493-501 (1992).
- Gown, A. M., Willingham, M. C. Improved detection of apoptotic cells in archival paraffin sections: immunohistochemistry using antibodies to cleaved caspase 3. J. Histochem. Cytochem. 50 (4), 449-454 (2002).
- Hara, A., et al. Neuronal apoptosis studied by a sequential TUNEL technique: a method for tract-tracing. Brain Res. Brain Res. Protoc. 4 (2), 140-146 (1999).
- Harn, H. J., et al. Apoptosis occurs more frequently in intraductal carcinoma than in infiltrating duct carcinoma of human breast cancer and correlates with altered p53 expression: detected by terminal-deoxynucleotidyl-transferase-mediated dUTP-FITC nick end labelling (TUNEL). Histopathology. 31 (6), 534-539 (1997).
- Hsieh-Li, H. M., et al. A mouse model for spinal muscular atrophy. Nat. Genet. 24 (1), 66-70 (2000).
- Huerta, S., Goulet, E. J., Huerta-Yepez, S., Livingston, E. H. Screening and detection of apoptosis. J. Surg. Res. 139 (1), 143-156 (2007).
- Iwaki, T., Yamashita, H., Hayakawa, T. A color atlas of sectional anatomy of the mouse. 1, (2001).
- Kaufman, M. H. . The atlas of mouse development. , (1992).
- Koppen, G., Angelis, K. J. Repair of X-ray induced DNA damage measured by the comet assay in roots of Vicia faba. Environ. Mol. Mutagen. 32 (2), 281-285 (1998).
- Kuehl, L. Isolation of skeletal muscle nuclei. Methods Cell Biol. 15, 79-88 (1977).
- Kuo, L. J., Yang, L. X. Gamma-H2AX - a novel biomarker for DNA double-strand breaks. In Vivo. 22 (3), 305-309 (2008).
- Labat-Moleur, F., et al. TUNEL apoptotic cell detection in tissue sections: critical evaluation and improvement. J. Histochem. Cytochem. 46 (3), 327-334 (1998).
- Modak, S. P., Bollum, F. J. Detection and measurement of single-strand breaks in nuclear DNA in fixed lens sections. Exp. Cell Res. 75 (2), 307-313 (1972).
- Naruse, I., Keino, H., Kawarada, Y. Antibody against single-stranded DNA detects both programmed cell death and drug-induced apoptosis. Histochemistry. 101 (1), 73-78 (1994).
- . National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the Care and Use of Laboratory Animals. , (2011).
- Negoescu, A., et al. In situ apoptotic cell labeling by the TUNEL method: improvement and evaluation on cell preparations). J. Histochem. Cytochem. 44 (9), 959-968 (1996).
- Ostling, O., Johanson, K. J. Microelectrophoretic study of radiation-induced DNA damages in individual mammalian cells. Biochem. Biophys. Res. Commun. 123 (1), 291-298 (1984).
- Phanithi, P. B., Yoshida, Y., Santana, A., Su, M., Kawamura, S., Yasui, N. Mild hypothermia mitigates post-ischemic neuronal death following focal cerebral ischemia in rat brain: immunohistochemical study of Fas, caspase-3 and TUNEL. Neuropathology. 20 (4), 273-282 (2000).
- Portera-Cailliau, C., Price, D. L., Martin, L. J. Excitotoxic neuronal death in the immature brain is an apoptosis-necrosis morphological continuum. J. Comp Neurol. 378 (1), 70-87 (1997).
- Portera-Cailliau, C., Price, D. L., Martin, L. J. Non-NMDA and NMDA receptor-mediated excitotoxic neuronal deaths in adult brain are morphologically distinct: further evidence for an apoptosis-necrosis continuum. J. Comp Neurol. 378 (1), 88-104 (1997).
- Ravi, D., Ramadas, K., Mathew, B. S., Nalinakumari, K. R., Nair, M. K., Pillai, M. R. De novo programmed cell death in oral cancer. Histopathology. 34 (3), 241-249 (1999).
- Sakaki, T., Kohmura, E., Kishiguchi, T., Yuguchi, T., Yamashita, T., Hayakawa, T. Loss and apoptosis of smooth muscle cells in intracranial aneurysms. Studies with in situ DNA end labeling and antibody against single-stranded DNA. Acta Neurochir.(Wien). 139 (5), 469-474 (1997).
- Shi, S. R., Cote, R. J., Taylor, C. R. Antigen retrieval immunohistochemistry: past, present, and future. J. Histochem. Cytochem. 45 (3), 327-343 (1997).
- Shi, S. R., Imam, S. A., Young, L., Cote, R. J., Taylor, C. R. Antigen retrieval immunohistochemistry under the influence of pH using monoclonal antibodies. J. Histochem. Cytochem. 43 (2), 193-201 (1995).
- Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L. A simple technique for quantitation of low levels of DNA damage in individual cells. Exp. Cell Res. 175 (1), 184-191 (1988).
- Sirvent, J. J., Aguilar, M. C., Olona, M., Pelegri, A., Blazquez, S., Gutierrez, C. Prognostic value of apoptosis in breast cancer pT1-pT2). A TUNEL, p53, bcl-2, bag-1 and Bax immunohistochemical study. Histol.Histopathol. 19 (3), 759-770 (2004).
- Skyrlas, A., Hantschke, M., Passa, V., Gaitanis, G., Malamou-Mitsi, V., Bassukas, I. D. Expression of apoptosis-inducing factor (AIF) in keratoacanthomas and squamous cell carcinomas of the skin. Exp. Dermatol. 20 (8), 674-676 (2011).
- Smith, M. D., Weedon, H., Papangelis, V., Walker, J., Roberts-Thomson, P. J., Ahern, M. J. Apoptosis in the rheumatoid arthritis synovial membrane: modulation by disease-modifying anti-rheumatic drug treatment. Rheumatology.(Oxford). 49 (5), 862-875 (2010).
- Stadelmann, C., Lassmann, H. Detection of apoptosis in tissue sections). Cell Tissue Res. 301 (1), 19-31 (2000).
- Schans, G. P., van Loon, A. A., Groenendijk, R. H., Baan, R. A. Detection of DNA damage in cells exposed to ionizing radiation by use of anti-single-stranded DNA monoclonal antibody. Int. J. Radiat. Biol. 55 (5), 747-760 (1989).
- Watanabe, I., et al. Detection of apoptotic cells in human colorectal cancer by two different in situ methods: antibody against single-stranded DNA and terminal deoxynucleotidyl transferase-mediated dUTP-biotin nick end-labeling (TUNEL) methods. Jpn. J. Cancer Res. 90 (2), 188-193 (1999).
- Watanabe, T., et al. Apoptosis signal-regulating kinase 1 is involved not only in apoptosis but also in non-apoptotic cardiomyocyte death. Biochem. Biophys. Res. Commun. 333 (2), 562-567 (2005).
- Yaoita, H., Ogawa, K., Maehara, K., Maruyama, Y. Attenuation of ischemia/reperfusion injury in rats by a caspase inhibitor. Circulation. 97 (3), 276-281 (1998).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados
Usamos cookies para melhorar sua experiência em nosso site.
Ao continuar usando nosso site ou clicando em 'continuar', você concorda em aceitar nossos cookies.
