Method Article
Isolamento e Cultura do mouse primárias células pancreáticas acinares
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Nesta publicação, é descrito um procedimento rápido e conveniente para o isolamento e cultura de células acinares pancreáticas primárias do pâncreas murino. Este método constitui uma ferramenta valiosa para o estudo da fisiologia das células primárias normais do pâncreas fresco / não transformada exócrinas.
Resumo
Este protocolo permite o isolamento rápido (em menos de 1 hora) de ácinos pancreáticos de murino, tornando possível mantê-las em cultura durante mais de uma semana. Mais de 20 x 10 6 células acinares podem ser obtidas a partir de um único pâncreas murino. Este protocolo oferece a possibilidade de processar independentemente tantos como 10 pâncreas em paralelo. Porque preserva arquitectura acinar, este modelo é bem adequado para o estudo da fisiologia do pâncreas exócrino, in vitro, em contraste com as linhas de células estabelecidas a partir de tumores pancreáticos, que exibem muitas alterações genéticas, resultando em perda parcial ou total da sua diferenciação acinar.
Introdução
Um problema frequentemente encontrado para laboratórios de investigação úteis em tecido pancreático exócrino é a dificuldade de se cultivar células acinares in vitro durante um período de tempo suficientemente longo para permitir uma experiência de longa duração.
Um factor impedindo o desenvolvimento de tais sistemas de cultura representa a sensibilidade intrínseca do tecido pancreático para manipulação experimental devido ao elevado teor em glicolíticas, proteolítica, lipolítica e de enzimas, que literalmente digerir o tecido pancreático, quando eles são libertados durante o isolamento das células pancreáticas.
Um segundo factor é a notável na plasticidade in vitro de células acinares, que tendem a perder as suas características de secreção e transdiferenciam a outras células maduras, tais como células do ducto pancreático hepatócitos ou células do tipo 1. In vitro, este plasticidade das células varia de acordo com as condições experimentais (tais como composição do meio de cultura) 2 e apresenta um grau de complexidade no design das condições de cultivo apropriadas para células pancreáticas exócrinas 1.
Vários métodos têm sido desenvolvidos para o isolamento e cultura de células acinares, primeiro a partir do pâncreas de porco da guiné 3-5. Inicialmente, esses protocolos envolvidos digestão do tecido pancreático com colagenase, quimotripsina, e um cocktail de protease, com isolamento final por dissociação mecânica vigorosa. As células pancreáticas isoladas desta forma exibido características estruturais e funcionais anormais, nomeadamente uma perda de estruturas apicais e danos significativos aos seus receptores de membrana. Células isoladas permaneceu viável por apenas 1 ou 2 dias.
Preparação de ácinos dispersos mantém a sua arquitectura intra e intercelular, preservando as membranas celulares, limitando os danos para os receptores da superfície e, assim, melhorar a secreção exócrina em resposta a secreção de 6-8. Como result, este método oferece a grande vantagem de prolongar a viabilidade das células acinares de 7-10 dias in vitro. Além disso, este método é actualmente preferido para isolamento de células acinares 9-12, porque a manutenção de contactos intercelulares, incluindo o acoplamento por junções de hiato célula, é um determinante essencial da pancreática exócrina acinar fenótipo celular 13.
À medida que a desdiferenciação de células acinares e do seu transdiferenciação de células ductais é um dos mecanismos propostos para a génese de cancros agressivos pancreáticas exócrinas 14, o modelo ácinos dispersos é também um sistema adequado para estudar a plasticidade do pâncreas e dos seus mecanismos moleculares subsequentes. Além disso, em combinação com a utilização de animais geneticamente modificados 15,16 e o desenvolvimento de técnicas de transferência de genes (adenovirais 2 ou transdução lentiviral, da utilização de nanopartículas, etc), neste modelo in vitro de células acinares primário podeser muito útil na determinação de como diversas disfunções genéticas afectam a regulação da diferenciação de células acinares, ou de desdiferenciação, e deverá proporcionar uma melhor compreensão dos eventos moleculares responsáveis pelo início da pancreatite, lesões pré-cancerosas, e as alterações na plasticidade celular.
Isolamento de ácinos dispersos é a abordagem usamos no nosso laboratório para cultura de células acinares pancreáticas. Nós aqui descrever e discutir o método utilizado. Ele envolve a dissociação enzimática de tecido pancreático (com uma colagenase bacteriana), acoplado ao rompimento mecânico, sem dissociação de células acinares. Enquanto a maioria dos protocolos envolvem a cultura do ácinos, em suspensão ou em substratos de plástico com tratamento especial, nós cultivá-las em suspensão apenas brevemente (por 24 horas), semeando-los depois para andaimes matriz se cultura de células prolongada é necessária.
Este protocolo permite o isolamento rápido (em menos de 1 hora) de corrente alternada dispersos de pâncreasini, sustentável durante mais de uma semana de cultura. Ele permite o isolamento de mais de 20 x 10 6 por células acinares do pâncreas do rato. A sua simplicidade permite processar independentemente tantos como 10 pâncreas em paralelo. Ao manter a arquitectura intra e intercelular de ácinos e assim o fenótipo das células acinares primárias isoladas, este modelo constitui um sistema de escolha para o estudo de mecanismos de transdiferenciação, como todos os outros modelos pancreáticas exócrinas actualmente disponíveis são derivadas de tumores pancreáticos exibindo muitos genética alterações que levam a transformação celular.
Protocolo
Todos os procedimentos foram aprovados por um comitê de ética sob regulamentação da autoridade governamental ("Comité d'Evaluation Commun au Centre Léon Bérard, à l'Animalerie de trânsito de l'ENS, au PBES et au Laboratoire P4" (CECCAPP)). Camundongos foram mantidos em um biotério livre de patógenos específicos no "Plateforme AniCan, Centro Léon Bérard" (Lyon, França) e tratados de acordo com as diretrizes institucionais.
Uma representação esquemática do procedimento é mostrado na Figura 1.
1. Dissecção pâncreas e dilaceração (Dia 0)
A dissecção muito rápida é crítico para um rendimento óptimo de extracção e para garantir uma boa viabilidade das células em cultura. A fim de reduzir o tempo necessário para o isolamento de pâncreas, de todos os instrumentos e equipamentos devem estar pronto antes da eutanásia do rato.
- Eutanásia rato por asfixia CO 2 ou luxação cervical.
A partir deste passo, todos os procedimentos devem ser realizados em um ambiente estéril (gabinete de segurança microbiológica, o nível II) com equipamentos de dissecção estéril.
- Corrigir o mouse e pulverizar o abdômen do rato com etanol 70%. Com qualquer uma tesoura de dissecção e uma pinça, faça uma incisão em forma de V na área genital e continuá-la até o diafragma para abrir completamente a cavidade abdominal.
- Posicionar os lóbulos do fígado contra o diafragma, que devem permanecer ali, se a cavidade do corpo é aberta suficientemente longe. Puxe o intestino eo cólon fora da cavidade abdominal, à sua esquerda, e encontrar o reto. Com um par de fórceps curvos e dissecando tesoura, garra e seção do reto.
- Com o mesmo par de pinças, cuidadosamente desenrole totalmente o intestino do reto para o estômago, puxando o intestino à sua esquerda.
- Usando Noyes tesoura e um par de fórceps, cuidadosamente cortadas ao longo do pâncreas e do intestino libertá-la com o baço a partir do resto do tracto digestivo.
- Pega o baço e o pâncreas secção ligado a ele (Figura 2).
Nesta etapa, certifique-se de que nenhuma gordura mesentérica e / ou outro tecido adjacente (baço, intestino, etc) podem ser coletadas com o pâncreas, para evitar a contaminação celular.
Para o resto do processo, todos os tampões devem ser preparada sem ião de cálcio Ca 2 + agentes quelantes para evitar a dissociação completa do tecido pancreático exócrino em células acinares individuais.
- Enxaguar o pâncreas duas vezes em solução salina equilibrada de Hank (HBSS) 1x.
Neste passo, como tecido adiposo irá flutuar ao contrário do pâncreas que se afundará, é facilmente possível visualizar e remover rapidamente o tecido adiposo branco contaminante ainda ligado ao pâncreas.
Se o pâncreas precisa ser transportado para a instalação de cultura de células, deve ser mantido em gelo em HBSS 1x.
- Transferir o pâncreas em uma placa de Petri estéril contendo 5 ml de HBSS 1x. Usando Noyes tesouras e um bisturi, cortar o pâncreas em pequenos pedaços de 1-3 mm 3 (Figura 3A).
2. Dissociations enzimática e mecânica de pâncreas (Dia 0)
- Transferi-los para um tubo de polipropileno ml estéril 50.
- Centrifugar durante 2 minutos a 450 xg e 4 ° C. Aspirar e desprezar o sobrenadante para remover fragmentos de células e células do sangue.
- Adicionar 10 ml de solução de colagenase IA (1x HBSS contendo 10 mM de HEPES, 200 U / ml de collagenaSE IA, e de 0,25 mg / ml de inibidor de tripsina) de secções de pâncreas. Usando uma pipeta serológica de 25 ml, transferi-los para um balão de 25 cm2. Incubar para 20-30 min a 37 ° C. Durante este tempo (5 minutos cada), executar uma dissociação mecânica por energeticamente movimento de vai-e-vem os fragmentos pâncreas cerca de dez vezes, em pipetas estéreis de tamanho decrescente (25, 10, e 5 ml pipetas serológicas).
Neste passo, é frequentemente essencial para controlar a extensão da dissociação enzimática de secções pancreáticas.
- Quando o tecido pancreático parece ser bem dissociado (de acordo com o desaparecimento de fragmentos pancreáticas e ao aumento da turbidez da solução) (Figura 3B), parar a reacção enzimática por adição de 10 ml de solução de lavagem tamponada fria (HBSS 1x contendo 5 % Soro Fetal Bovino (FBS) e 10 mM de HEPES).
- Transferi-lo para um tubo de 50 ml de polipropileno estéril e centrifuge durante 2 min a 450 xg e 4 ° C. Aspirar cuidadosamente e descartar o sobrenadante para remover a solução de colagenase IA.
- Ressuspender o sedimento e lava-se com 10 ml de solução de lavagem tamponada. Centrifugar durante 3 min a 450 xg e 4 ° C. Aspirar cuidadosamente e descartar o sobrenadante. Repita este passo mais duas vezes.
3. Filtração e semeadura de Dispersos Acini (Dia 0)
- Ressuspender o sedimento celular em 7 ml de meio de Waymouth contendo 2,5% de FBS, 1% de Penicilina-Estreptomicina mistura (PS), 0,25 mg / ml de inibidor de tripsina, e 25 ng / mL de Factor de Crescimento Epidérmico recombinante humana (EGF).
- Filtra-se a mistura de células, permitindo-lhe passar através de um filtro de 100 um para reter os fragmentos não digeridos (dutos, vasos sanguíneos, e as ilhotas de Langerhans). Estruturas acinares pancreáticas (acinus de 10-15 células) passar.
- Lavar o filtro com 6 ml de meio contendo FBS de Waymouth, PS, tripsina inhibitor e EGF.
Após este passo, as células têm de ser tratadas com muito cuidado, para evitar qualquer ácinos dissociação.
- Semente ácinos isolado em uma placa de cultura de 6 poços (2 ml por poço) (Figura 3C). Cultura los a 37 ° C sob 5% (v / v) de atmosfera de CO 2.
Após este passo, as células acinares são cultivadas em suspensão.
4. Acinar Cultura de Células (dia 1 a 10)
- Vinte e quatro horas depois, transferir os ácinos (em suspensão) para uma nova placa de cultura de 6 poços, para eliminar as células contaminantes e restos celulares que tenham aderido durante a noite (Figura 4).
Se a cultura de células tem de ser alargado durante vários dias, ou se as condições experimentais requerem células cultivadas em monocamada, recomenda-se a transferência e sementes em ácinos matriz andaimes.
- Um dia antes de verding em apoio matricial (dia 0), casaco de uma placa de cultura de 6 poços com colágeno tipo I (5 mg / cm 2). Adicionar 1 ml de solução de colagénio do tipo I (50 ug / ml em ácido acético 0,02 M, 0,2 um por filtração) a cada poço e permitir que adsorva passivamente em plástico, durante 1 hora a 37 ° C (ou durante a noite a 4 ° C, ).
- Aspirar a solução de colágeno tipo I e lavar a poço revestido duas vezes com tampão fosfato 1x.
- Permitir que o poço revestido para secar (em um gabinete de segurança microbiológica) pelo menos 12 horas antes do uso.
- Transferir a ácinos primário isolado (obtido no Passo 4.1) para o prato de colagénio tipo I revestido de 6 poços de cultura e da cultura deles em condições idênticas às descritas anteriormente (a 37 ° C sob 5% (v / v) de atmosfera de CO2) . As células aderem ao substrato de colagénio de tipo I durante 2 dias.
- No Dia 3, mudar o meio de cultura para eliminar as células não viáveis, que não aderiram. Com o tempo na cultura, as células vão progressivamente spler com o apoio contendo colágeno. Alterar o meio de cultura a cada 3 dias (Figura 5).
As células acinares isolados obtidos podem ser contadas, depois de uma completa dissociação mecânica, usando uma câmara de contagem Thoma célula. Note-se que as células acinares isoladas não podem ser mantidas em cultura em seguida.
A qualidade da cultura acinar obtido pode ser controlado por controlo da expressão de marcadores específicos tais como Tripsinogênio acinares, Pâncreas transcription factor 1 subunidade alfa, ou A1 carboxipeptidase (por imunocitoquímica ou experiências de imunofluorescência).
Resultados
A Figura 1 esquematiza o "dispersa" ácinos método para isolamento de células acinares Primária. Os passos críticos, que têm de ser estritamente respeitadas ao longo do protocolo, são descritas na discussão da peça.
Para facilitar a sua remoção, o pâncreas tem que ser coletadas a partir do abdômen, juntamente com o baço em anexo (Figura 2). Ambos os órgãos precisam de ser cortados em pedaços, e os tecidos de gordura residual, que pode ainda ser ligada ao pâncreas deve ser removido (Passo 1.6).
A macro-e imagens microscópicas, que são mostrados na Figura 3, representa o resultado depois de cada passo de dissociação enzimática e mecânica do pâncreas. Após o corte, o pâncreas é dividido em pequenas peças (Figura 3A; Passo 1.8). A Figura 3B mostra o aspecto do pâncreas após uma dissociação enzimática sucesso depender de uma cuidadosa tempormonitorização ai da digestão em curso (Passo 2.4). Este passo é um passo crucial para determinar o momento exato em que for necessário. A Figura 3C mostra o material obtido após a filtração da mistura de pâncreas (Passo 3.4). Apenas os ácinos bem separados são mantidos após este passo.
A Figura 4 é uma ilustração um dia típico de ácinos pancreáticos isolados utilizando o nosso protocolo. A transferência de células acinares numa nova placa de cultura permite eliminar os fragmentos celulares e as células aderentes contaminantes (Passo 4.1).
Como mostrado na Figura 5, quando cultivadas em colagénio do tipo I, as células acinares espalhar e perdem a sua diferenciação acinares (morfologia e organização 3D), dando origem a uma monocamada de células em forma de fuso (Passo 4.6).
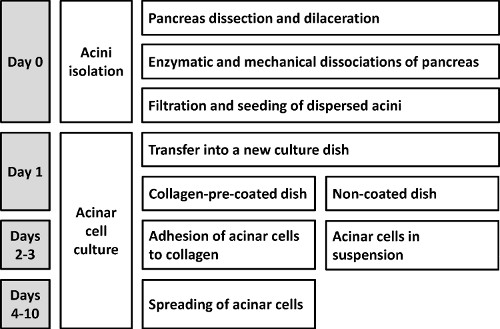
Figura 1. Representação esquemática do protocolo que permite o isolamento de rato primária ácinos dispersos.
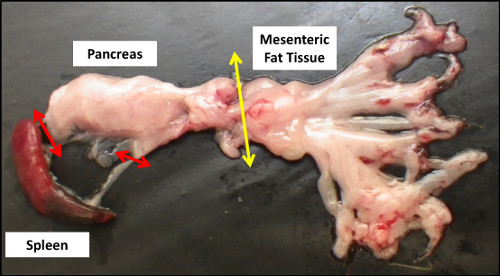
Figura 2. Anatomia bruta do pâncreas após a dissecção. Setas vermelhas e amarelas indicam, respectivamente, as conexões anatômicas restantes com o baço e gordura mesentérica que precisam ser cortadas para a coleta de pâncreas.
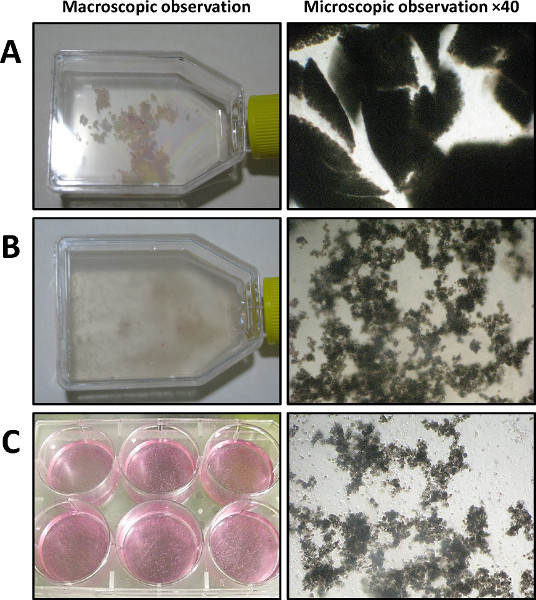
Figura 3. Disperso ácinos isolamento (dia 0), visualizados por observação macroscópica (painel da esquerda) e por microscopia de contraste de fase (painel da direita, a ampliação de 40X). D) Após dilaceração (mostrada num balão de 25 cm 2). B) Após a digestão de colagenase IA e vigoroso mecânica dissociatidiante. C) Após a filtração e transfere-se uma placa de cultura de 6 poços.
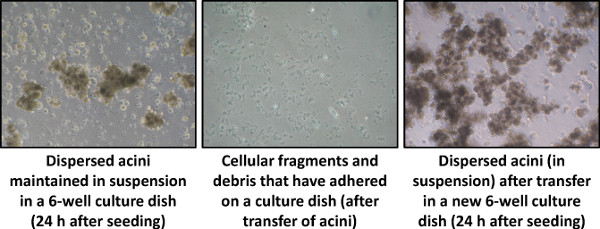
Figura 4. Disperso ácinos cultura, 24 horas após a sementeira (Dia 1), visualizada por microscopia de contraste de fase (aumento de 40 vezes).
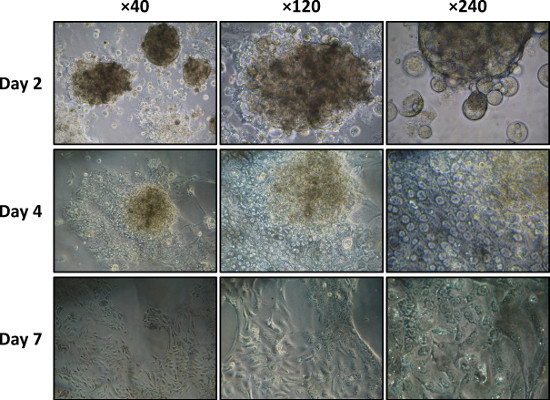
Figura 5. Disperso cultura ácinos num prato de colagénio tipo I revestido nos dias 2, 4, 7 e visualizadas por microscopia de contraste de fase (40X, 120X, e ampliações de 240X).
Discussão
Neste protocolo, descrevemos um procedimento para isolar células acinares pancreáticas. Este método torna possível isolar mais do que 20 x 10 6 células acinares por animal, em menos de 1 hora. Graças à sua implementação rápida e simples (até 10 pâncreas podem ser processados de forma independente por cada experiência em paralelo), este protocolo surge como um bom compromisso entre métodos de isolamento existentes 3-5,9-12,17.
Etapas críticas / resolução de problemas
A eficiência deste método baseia-se precauções tomadas em alguns pontos críticos. O primeiro passo de dilaceração pâncreas (Passo 1.8) é essencial para a digestão enzimática subsequente pâncreas. Insuficiente corte plano irá diminuir o rendimento de dissociação enzimática e o número de células acinares obtidos. Isso torna necessário prolongar a incubação com colagenase IA, inevitavelmente, causando uma dissociação excessiva de células acinares e conseaumentando vamente a morte celular.
Como advertido acima, a segunda etapa crítica é a digestão por colagenase IA (Passo 2.3). Demasiada dissociação enzimática conduz a uma elevada taxa de morte celular. A extensão da digestão pâncreas devem ser frequentemente monitorizada durante este passo crítico (Figura 3B). Depois de dissociações mecânicos e enzimáticos, atenção especial deve ser dada a fim de lidar com muito cuidado os ácinos dispersos, a fim de preservar suas estruturas intercelulares.
Limitações
Mesmo se a adição do Factor de Crescimento Epidérmico (EGF) para a cultura da Waymouth pode precipitar a progressiva transdiferenciação acinar para ductal, é essencial para manter as células vivas.
Tal como descrito no protocolo e, se necessário, o período de cultura in vitro das células acinares pode ser aumentado para até 10 dias por inoculação de células na matriz scaffidade, como colágeno tipo I. No entanto, importante, e como mostrado por outros, células de uma cultura em colagénio do tipo I irá induzir a transdiferenciação progressiva de células acinares a células ductais. Este processo inicia-se depois de 4 dias de cultura em colagénio e pode estar completa após 7 dias. Portanto, pode ser necessário verificar a presença de um marcador ductal específico, como a fibrose cística reguladora da condutância transmembrana ou Cytokeratin-19 (por imunocitoquímica ou experimentos de imunofluorescência) se a cultura de células acinar precisa ser estendido para uma semana. O uso alternativo de Matrigel como uma matriz de andaime, reduzindo a adesão de ácinos dispersos, faz com que seja possível aumentar a manutenção do fenótipo acinar durante 2 dias.
Possíveis modificações
Seccionamento do recto durante a etapa de esvaziamento aumenta o risco de contaminação bacteriana. Nós nunca experiente, uma situração. No entanto, se necessário, existe um outro procedimento possível para contornar este problema. Ele consiste em encontrar o estômago, o baço e a primeira parte do duodeno, pâncreas e seccionamento em anexo. Note-se que este procedimento alternativo deve ser perfeitamente dominada. Caso contrário, a duração da dissecção será mais longo, prejudicando a qualidade do, em seguida, o material biológico retirado.
A cultura em monocamada a longo prazo das células acinares podem ser optimizadas, nomeadamente modificando a matriz de suporte. Caso seja necessário, as condições experimentais, colagénio do tipo I pode ser substituído por outro andaime, tais como Matrigel. Neste caso, Matrigel deve ser preparada em 400 ug / ml de concentração no frio tamponado com fosfato 1x. Posteriormente, os poços são incubados com Matrigel (40 mg / cm 2) durante a noite a 4 ° C. Este ponto deve ser rigorosamente respeitado. O processo de cultura continua a ser o mesmo que o descrito no Passo 4.
O método can ser optimizadas empiricamente. Por exemplo, a quantidade de aminoácidos no meio de cultura de células pancreáticas exócrinas podem regular a síntese de proteínas por estas células 18. Sphyris et ai. Blauer 2 e et ai. 19 elaboraram um meio de cultura completo, contendo uma quantidade mais elevada de aminoácidos (essenciais e não-essenciais), promovendo a manutenção das células acinares no estado diferenciado. Tal meio pode ser muito útil quando se deseja a células acinares cultura isolados por este método por mais de 10 dias.
Outro parâmetro que pode ser modificado se a cultura de longo prazo é necessário, é que o pH do meio de cultura. Fisiologicamente, o pólo apical das células acinares está em permanente contacto com um líquido rico em bicarbonato, ligeiramente alcalinas dando origem ao suco pancreático. É tentador especular que o pH do ambiente das células acinares pode ser importante na manutenção da acinar differentiatioEstado n. Alguns protocolos previamente relatado o uso de um meio de cultura com um pH ajustado para 7,8 para imitar a fisiologia "inicial" de células acinares 19.
Importância da técnica
É importante mencionar que existem outros protocolos para a cultura de células acinares, utilizando explantes e culturas organotípicas do pâncreas 19. A sua aplicação, com base na migração das células do pâncreas do explante para a membrana sobre a qual elas são cultivadas, é mais difícil. O isolamento destas células pancreáticas requer nomeadamente uma primeira semana de cultura de explantes de pâncreas. A principal vantagem deste método é que não é necessária qualquer dissociação enzimática, de modo que tanto a integridade da membrana celular e as interacções célula-célula são preservados. Sob estas condições, as células acinares podem ser mantidas in vitro durante 14 dias. No entanto, a cultura de células acinares obtido não é puro, e fibroblastos de contaminantes, ductal cells, e células endoteliais são inevitavelmente presentes, que podem ser incompatíveis com alguns tipos de experiências. Em contraste, o nosso procedimento produz rapidamente uma população pura de células acinares, conservando sua arquitetura inicial de ácinos.
Dorrell et ai. Descrito um outro método para isolar os diferentes tipos de células pancreáticas de rato (incluindo acinar, adesiva, e células endócrinas), utilizando separação de células activada por fluorescência (FACS) 17. Este método é muito eficiente para obter uma população pura (ou específica) das células acinares. No entanto, isso requer uma marcação fluorescente com anticorpos específicos, triagem prévia. Além disso, esse procedimento também exige uma especialização em FACS e um citômetro de fluxo. Além disso, esta técnica não permite que uma cultura prolongada de células acinares, devido à perda da sua arquitectura inicial de ácinos. O método permite uma rápida prolongada em cultura in vitro de células acinares dispersas com uma qualidade e uma pureza que umre compatível com a maioria das outras aplicações de rotina.
As aplicações futuras
Uma vez dominado, esta técnica para o isolamento de células acinares / cultura deve ser muito útil no tratamento de uma série de perguntas e, nomeadamente, para investigar os mecanismos envolvidos na plasticidade do pâncreas e transdiferenciação, que são bem conhecidas, mas mal compreendido. Ao preservar algumas comunicações inter e intracelular, este modelo disperso ácinos permanece fisiologicamente mais relevante do que as linhas de células imortalizadas.
No campo da tumorigénese pancreático, este modelo celular primário proporciona um sistema adequado para estudar a transdiferenciação de células acinares, um dos mecanismos propostos para gerar cancros pancreáticos agressivos. Embora as linhas celulares humanas imortalizadas ou murino (tal como Colo357, Panc-1, ou BxPC3) podem ser mais flexíveis do que as células acinares primárias, tanto a sua origem e a sua amostralex estado genético (linhas de células transformadas como inicialmente isolado a partir de tumores pancreáticos nem metástases pancreáticas) constituem as principais desvantagens em estudar estes mecanismos.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Agradecemos ao pessoal da AniCan (CRCL, Lyon) para a sua assistência técnica com cuidado animal. Este trabalho foi apoiado pelo Institut National de la Santé et de la Recherche Médicale (Programa Avenir INSERM), o Ligue Nationale Contre le Câncer, pela Associação pour la Recherche sur le Cancer, pelo Institut National du Cancer, e por bolsas de o Ligue Nationale Contre le Cancer (JG), a partir do Institut National du Cancer (JG), a partir do Ministère de l'Enseignement Supérieur et de la Recherche de França (PGR e DFV) e da Associação pour la Recherche sur le Cancer ( DFV).
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 μm filter | Dutscher | 146560 | |
| 10 ml serological pipettes | Beckton Dickinson | 357551 | |
| 100 μm filter | Beckton Dickinson | 352360 | |
| 100 mm Petri dish | Beckton Dickinson | 353003 | |
| 1000 μl filter tips | Starlab | S1122-1830 | |
| 20 μl filter tips | Starlab | S1120-1810 | |
| 200 μl filter tips | Starlab | S1120-8810 | |
| 25 ml serological pipettes | Beckton Dickinson | 357535 | |
| 5 ml serological pipettes | Beckton Dickinson | 357543 | |
| 50 ml polypropylene tube | Beckton Dickinson | 352070 | |
| 6-well plate | Beckton Dickinson | 353046 | |
| Acetic acid 100% | VWR BDH Prolabo | 20104.298 | |
| Collagenase IA | Sigma-Aldrich | C2676 | |
| Curved forceps, Dumont #7 | World Precision Instruments | 14188 | To sterilize before use |
| Dissecting scissors, straight | World Precision Instruments | 14393 | To sterilize before use |
| Epidermal Growth Factor, human | Promokine | C-60180 | |
| Ethanol absolute (AnalaR Normapur) | VWR BDH Prolabo | 20821.310 | |
| Fetal Bovine Serum | Lonza | 14-801F | |
| Forceps, Dumont #5 | World Precision Instruments | 14098 | To sterilize before use |
| Hank’s Balanced Salt Solution 1x | Gibco | 14025050 | |
| HEPES 1 M (pH 6.98-7.30) | Lonza | 17-737F | |
| Incubator O2/CO2 | Sanyo | MCO-19M | |
| Inverted microscope | Nikon | Eclipse TS100 | |
| Matrigel | Beckton Dickinson | 356234 | |
| Microbiological Safety Cabinet, level II | Faster | SafeFast Elite 212 S | |
| Noyes scissors, sharp/sharp tips, German | World Precision Instruments | 500228-G | To sterilize before use |
| Penicillin-Streptomycin mixture | Gibco | 15140122 | |
| Phosphate Buffer Saline 10x | Gibco | 14200067 | |
| Pipet-Aid | Drummond Scientific Company | Pipet-Aid XP | |
| Pipetman P1000 | Gilson | F123602 | |
| Pipetman P20 | Gilson | F123600 | |
| Pipetman P200 | Gilson | F123601 | |
| Refrigerated centrifuge | Eppendorf | 5810R | |
| Scalpel | Paramount Surgimed Ltd. | Disposable Scalpel Size 23 | |
| T25 flask, 25 cm2 | Sigma-Aldrich | Z707481 | |
| Trypsin inhibitor, from Glycine Max | Sigma-Aldrich | T6522 | |
| Type I collagen | Beckton Dickinson | 354236 | |
| Waymouth’s medium | Gibco | 31220-023 |
Referências
- Lardon, J., Bouwens, L. Metaplasia in the pancreas. Differentiation. 73, 278-286 (2005).
- Sphyris, N., Logsdon, C. D., Harrison, D. J. Improved retention of zymogen granules in cultured murine pancreatic acinar cells and induction of acinar-ductal transdifferentiation in vitro. Pancreas. 30, 148-157 (2005).
- Amsterdam, A., Jamieson, J. D. Structural and functional characterization of isolated pancreatic exocrine cells. Proc. Natl. Acad. Sci. U.S.A. 69, 3028-3032 (1972).
- Amsterdam, A., Jamieson, J. D. Studies on dispersed pancreatic exocrine cells. I. Dissociation technique and morphologic characteristics of separated cells. J. Cell. Biol. 63, 1037-1056 (1974).
- Amsterdam, A., Jamieson, J. D. Studies on dispersed pancreatic exocrine cells. II. Functional characteristics of separated cells. J. Cell. Biol. 63, 1057-1073 (1974).
- Schultz, G. S., et al. Guinea pig pancreatic acini prepared with purified collagenase. Exp. Cell Res. 130, 49-62 (1980).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. Am. J. Physiol. 235, 517-524 (1978).
- Logsdon, C. D., Williams, J. A. Epidermal growth factor binding and biologic effects on mouse pancreatic acini. Gastroenterology. 85, 339-345 (1983).
- Han, B., Logsdon, C. D. Cholecystokinin induction of mob-1 chemokine expression in pancreatic acinar cells requires NF-kappaB activation. Am. J. Physiol. 277, 74-82 (1999).
- Ji, B., Kopin, A. S., Logsdon, C. D. Species differences between rat and mouse CCKA receptors determine the divergent acinar cell response to the cholecystokinin analog JMV-180. J. Biol. Chem. 275, 19115-19120 (2000).
- Ji, K. A., Yang, M. S., Jou, I., Shong, M. H., Joe, E. H. Thrombin induces expression of cytokine-induced SH2 protein (CIS) in rat brain astrocytes: involvement of phospholipase A2, cyclooxygenase, and lipoxygenase. Glia. 48, 102-111 (2004).
- Gaiser, S., et al. Intracellular activation of trypsinogen in transgenic mice induces acute but not chronic pancreatitis. Gut. 60, 1379-1388 (2011).
- Logsdon, C. D., Williams, J. A. Pancreatic acinar cells in monolayer culture: direct trophic effects of caerulein in vitro. Am. J. Physiol. 250, 440-447 (1986).
- Stanger, B. Z., Dor, Y. Dissecting the cellular origins of pancreatic cancer. Cell Cycle. 5, 43-46 (2006).
- Vincent, D. F., et al. Tif1gamma suppresses murine pancreatic tumoral transformation by a smad4-independent pathway. Am. J. Pathol. 180, 2214-2221 (2012).
- Vincent, D. F., et al. Inactivation of TIF1gamma cooperates with Kras to induce cystic tumors of the pancreas. PLoS Genet. 5, e1000575 (2009).
- Dorrell, C., et al. Isolation of mouse pancreatic alpha, beta, duct and acinar populations with cell surface markers. Mol. Cell Endocrinol. 339, 144-150 (2011).
- Case, R. M. Synthesis, intracellular transport and discharge of exportable proteins in the pancreatic acinar cell and other cells. Biol. Rev. Camb. Philos. Soc. 53, 211-354 (1978).
- Blauer, M., Nordback, I., Sand, J., Laukkarinen, J. A novel explant outgrowth culture model for mouse pancreatic acinar cells with long-term maintenance of secretory phenotype. Eur. J. Cell. Biol. 90, 1052-1060 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados