Method Article
Aislamiento y cultivo de ratón primarias células acinares pancreáticas
* Estos autores han contribuido por igual
En este artículo
Resumen
En esta publicación, se describe un procedimiento rápido y conveniente para el aislamiento y cultivo de las células acinares pancreáticas primarias del páncreas murino. Este método constituye un enfoque valioso para el estudio de la fisiología de las células pancreáticas exocrinas normales / no transformada primarios frescos.
Resumen
Este protocolo permite el aislamiento rápido (en menos de 1 hora) de acinos pancreáticos murino, por lo que es posible mantener en cultivo durante más de una semana. 10 6 células acinares Más de 20 x puede obtenerse a partir de un único páncreas murino. Este protocolo ofrece la posibilidad de procesar de forma independiente hasta 10 páncreas en paralelo. Debido a que preserva la arquitectura acinar, este modelo es muy adecuado para el estudio de la fisiología del páncreas exocrino in vitro en contraste con las líneas celulares establecidas a partir de tumores de páncreas, que muestran muchas alteraciones genéticas que resultan en la pérdida parcial o total de su diferenciación acinar.
Introducción
Un problema frecuente para los laboratorios de investigación que trabajan en tejido pancreático exocrino es la dificultad de cultivar las células acinares in vitro durante un periodo de tiempo suficientemente largo para permitir que un experimento a largo plazo.
Un factor que impide el desarrollo de estos sistemas de cultivo es la sensibilidad intrínseca del tejido pancreático a la manipulación experimental, debido al alto contenido de enzimas glucolíticas, proteolítica y lipolítica, que literalmente digerir el tejido pancreático cuando se liberan durante el aislamiento de las células pancreáticas.
Un segundo factor es la notable en la plasticidad in vitro de las células acinares, que tienden a perder sus características de secreción y transdifferentiate a otras células maduras, tales como células ductales pancreáticas o células de hepatocitos como 1. In vitro, esta plasticidad de las células varía con las condiciones experimentales (tales como composición del medio de cultivo) 2 e introduce un grado de complejidad en el diseño de las condiciones de cultivo apropiados para las células pancreáticas exocrinas 1.
Varios métodos han sido desarrollados para el aislamiento y cultivo de células acinares, primero desde el páncreas conejillo de indias 3-5. Inicialmente, los protocolos involucrados digestión de tejido pancreático con colagenasa, quimotripsina, y un cóctel de proteasa, con el aislamiento final por disociación mecánica vigorosa. Las células pancreáticas aisladas de esta manera muestran características estructurales y funcionales anormales, en particular una pérdida de estructuras apicales y daños significativos a sus receptores de membrana. Las células aisladas se mantuvieron viables sólo 1 ó 2 días.
Preparación de acinos dispersa mantiene su arquitectura intra-e intercelular, la preservación de las membranas celulares, lo que limita el daño a receptores de la superficie, y por lo tanto la mejora de la secreción exocrina en respuesta a secretagogos de 6-8. Como resuLT, este método ofrece la importante ventaja de extender la viabilidad celular acinar a 7-10 días in vitro. Por otra parte, actualmente se prefiere este método de aislamiento de células acinares 9-12 porque el mantenimiento de los contactos intercelulares, incluyendo acoplamiento celular por uniones, es un determinante esencial de la exocrina pancreática acinar fenotipo celular 13.
A medida que la desdiferenciación de las células acinares y su transdiferenciación de células ductales es uno de los mecanismos propuestos para la génesis de los cánceres de páncreas exocrino agresivos 14, el modelo de acinos dispersa es también un sistema adecuado para estudiar la plasticidad pancreática y sus mecanismos moleculares subsiguientes. Además, en combinación con el uso de animales modificados genéticamente 15,16 y el desarrollo de técnicas de transferencia de genes (adenoviral 2 o transducción lentiviral, el uso de las nanopartículas, etc), en este modelo de células acinares primaria in vitro puedeser muy útil en la determinación de cómo diversas disfunciones genéticas afectan la regulación de la diferenciación de células acinares o desdiferenciación y deberían proporcionar una mejor comprensión de los eventos moleculares responsables de la aparición de la pancreatitis, lesiones precancerosas, y los cambios en la plasticidad de las células.
El aislamiento de los acinos dispersa es el enfoque que usamos en nuestro laboratorio con las células acinares pancreáticas cultura. Se describen y discuten el método utilizado. Se trata de la disociación enzimática de tejido pancreático (con una colagenasa bacteriana) acoplado a la disrupción mecánica sin la disociación de las células acinares. Aunque la mayoría de protocolos implican el cultivo de la acinos, en suspensión o en sustratos de plástico especialmente tratadas, les crecen en suspensión sólo brevemente (durante 24 horas), sembrando en ellos después andamios matriz si se requiere cultivo celular prolongado.
Este protocolo permite el aislamiento rápido (en menos de 1 hora) de la dispersión de páncreas de corriente alternaini, sostenible desde hace más de una semana en la cultura. Se permite el aislamiento de más de 20 x 10 6 células acinares por páncreas de ratón. Su simplicidad hace que sea posible procesar de forma independiente un máximo de 10 páncreas en paralelo. Mediante el mantenimiento de la arquitectura intra e intercelular de los acinos y por lo tanto el fenotipo de las células acinares primarias aisladas, este modelo constituye un sistema de elección para el estudio de los mecanismos de transdiferenciación, como todos los otros modelos pancreáticas exocrinas actualmente disponibles se derivan de los tumores pancreáticos se presentan muchos genética alteraciones que conduce a la transformación celular.
Protocolo
Todos los procedimientos fueron aprobados por un comité de ética bajo reglamentación de la autoridad gubernamental ("Comité d'Evaluación Commun au Centre Léon Bérard, à l'Animalerie de tránsito de l'ENS, au PBES et au laboratoire P4" (CECCAPP)). Los ratones fueron mantenidos en una instalación específica de animales libres de patógenos en el "Plateforme Anican, Centro Léon Bérard" (Lyon, Francia) y manipulen de conformidad con las directrices institucionales.
Una representación esquemática del procedimiento se muestra en la Figura 1.
1. La disección del páncreas y dilaceración (día 0)
Una disección muy rápido es crítico para un rendimiento óptimo de la extracción y para asegurar una buena viabilidad de las células en cultivo. Con el fin de reducir el tiempo necesario para el aislamiento del páncreas, todos los instrumentos y equipos deben estar preparados antes de la eutanasia del ratón.
- La eutanasia ratón por asfixia con CO2 o dislocación cervical.
A partir de este paso, todos los procedimientos tienen que ser realizadas bajo una atmósfera estéril (cabina de seguridad microbiológica, el nivel II) con el equipo de disección estéril.
- Fijar el ratón y rociar el abdomen del ratón con etanol al 70%. Con las tijeras de disección y pinzas, hacer una incisión en forma de V en el área genital y continuarla hasta el diafragma para abrir completamente la cavidad abdominal.
- Coloque los lóbulos del hígado contra el diafragma, sino que deben permanecer allí si la cavidad corporal está abierta lo suficiente. Tire del intestino y el colon fuera de la cavidad abdominal a su izquierda, y encontrar el recto. Con un par de pinzas curvas y tijeras de disección, agarre y la sección del recto.
- Con el mismo par de pinzas, cuidadosamente desenrollar por completo el intestino desde el recto hasta el estómago tirando del intestino a la izquierda.
- Uso de Noyes tijeras y un par de fórceps, cortar cuidadosamente el páncreas a lo largo del intestino y liberar con el bazo del resto del tracto digestivo.
- Coge el bazo y el páncreas sección unido a él (Figura 2).
En este paso, asegúrese de que no hay tejido grasa mesentérica y / u otro tejido adyacente (bazo, intestino, etc) pueden ser recogidos con el páncreas, para evitar la contaminación celular.
Para el resto del procedimiento, todos los tampones deben estar preparados sin calcio de iones Ca 2 + quelantes para evitar la disociación completa del tejido pancreático exocrino en las células acinares individuales.
- Enjuague el páncreas dos veces en solución salina equilibrada de Hank (HBSS) 1x.
En este paso, como el tejido de grasa flotará en contra de páncreas que se hundirá, es fácilmente posible para visualizar y eliminar rápidamente el contaminante tejido adiposo blanco todavía unido a páncreas.
Si necesita el páncreas para ser transportado a las instalaciones de cultivo celular, se debe tener en hielo en HBSS 1x.
- Transferir el páncreas en una placa de Petri estéril que contiene 5 ml de HBSS 1x. Uso de Noyes tijeras y un bisturí, cortar el páncreas en pequeños trozos de 1 a 3 mm 3 (Figura 3A).
2. Disociaciones enzimáticas y mecánicos de Páncreas (día 0)
- Transferirlos a un tubo de polipropileno estéril de 50 ml.
- Se centrifuga durante 2 minutos a 450 xg y 4 ° C. Aspirar y descartar el sobrenadante para eliminar los fragmentos celulares y las células sanguíneas.
- Añadir 10 ml de solución de colagenasa IA (1x HBSS que contiene HEPES 10 mM, 200 U / ml de collagenaSE IA, y 0,25 mg / ml de inhibidor de tripsina) a las secciones de páncreas. Usando una pipeta de 25 serológica, transferirlos a un matraz de 25 cm 2. Incubar durante 20-30 min a 37 ° C. Durante este tiempo (cada 5 min), lleve a cabo una disociación mecánica por enérgicamente en movimiento hacia atrás y hacia adelante los fragmentos de páncreas alrededor de diez veces, en pipetas estériles de tamaño decreciente (25, 10, y 5 pipetas serológicas ml).
En este paso, es esencial controlar con frecuencia la medida de la disociación enzimática de secciones pancreáticas.
- Cuando el tejido pancreático parece ser bien disociado (de acuerdo con la desaparición de los fragmentos pancreáticas y para el aumento de la turbidez de la solución) (Figura 3B), detener la reacción enzimática mediante la adición de 10 ml de solución de lavado fría tamponada (HBSS que contiene 1x 5 % de suero fetal bovino (FBS) y 10 mM de HEPES).
- Traslado en un tubo de polipropileno estéril de 50 ml y centrifuge durante 2 minutos a 450 xg y 4 ° C. Con cuidado aspirar y descartar el sobrenadante para eliminar la solución de colagenasa IA.
- Resuspender y lavar el precipitado con 10 ml de solución de lavado tamponada. Centrifugar durante 3 min a 450 xg y 4 º C. Con cuidado aspirar y descartar el sobrenadante. Repita este paso dos veces más.
3. La filtración y la siembra de Dispersed acinos (día 0)
- Resuspender el sedimento celular en 7 ml de medio de Waymouth que contiene 2,5% de FBS, 1% de penicilina-estreptomicina mezcla (PS), 0,25 mg / ml de inhibidor de tripsina, y 25 ng / ml de factor de crecimiento epidérmico recombinante humano (EGF).
- El filtrado de la mezcla de células por permitiendo que pase a través de un filtro de 100 micras para retener los fragmentos no digeridos (conductos, vasos sanguíneos, y los islotes de Langerhans). Estructuras acinares pancreáticas (acinus de 10-15 células) pasar a través.
- Enjuague el filtro con 6 ml de medio que contiene FBS al Waymouth, PS, tripsina inhibitor y EGF.
Después de este paso, las células tienen que ser tratado con mucho cuidado, para evitar cualquier acinos disociación.
- Semilla los acinos aislado en una placa de cultivo de 6 pocillos (2 ml por pocillo) (Figura 3C). Cultura ellas a 37 ° C bajo 5% (v / v) de atmósfera de CO 2.
Después de este paso, las células acinares se cultivan en suspensión.
4. Cultivo de células acinares (Día 1 a 10)
- Veinticuatro horas después, transferir los acinos (en suspensión) en una nueva placa de cultivo de 6 pocillos, para eliminar las células contaminantes y los restos celulares que se han adherido durante la noche (figura 4).
Si necesita extenderse durante varios días o si las condiciones experimentales requieren células cultivadas en monocapa, se recomienda para la transferencia y la semilla de acinos en andamios de matriz del cultivo celular.
- El día antes de verding el soporte de la matriz (día 0), recubrir una placa de cultivo de 6 pocillos con colágeno tipo I (5 mg / cm 2). Añadir 1 ml de solución de colágeno tipo I (50 mg / ml en ácido acético 0,02 M, 0,2 m-filtrada) a cada pocillo y permitir que se adsorba pasivamente sobre plástico, durante 1 hora a 37 ° C (o durante la noche a 4 ° C ).
- Aspirar la solución de colágeno tipo I y enjuagar el pozo cubierto dos veces con buffer fosfato salino-1x.
- Deje que el pozo cubierto para secar (en una cabina de seguridad microbiológica) por lo menos 12 horas antes de su uso.
- Transferir los acinos primaria aislado (obtenida en la etapa 4.1) en el colágeno de tipo I-recubierto placa de cultivo de 6 pocillos y la cultura en las mismas condiciones que las descritas anteriormente (a 37 ° C bajo 5% (v / v) de atmósfera de CO 2) . Las células se adhieren al sustrato de colágeno tipo I durante 2 días.
- En el Día 3, cambiar el medio de cultivo para eliminar las células no viables que no se han adherido. Con el tiempo en cultivo, las células se progresivamente spleer en el soporte que contiene colágeno. Cambiar el medio de cultivo cada 3 días (Figura 5).
Las células acinares aislados obtenidos se pueden contar, después de una disociación mecánica completa mediante el uso de una cámara de recuento de células Thoma. Tenga en cuenta que las células acinares aislados no pueden mantenerse en cultivo después.
La calidad de la cultura acinares obtenido puede ser controlado por el control de la expresión de marcadores específicos acinares tales como tripsinógeno, Páncreas Factor de Transcripción 1 subunidad alfa, o carboxipeptidasa A1 (por inmunocitoquímica o experimentos de inmunofluorescencia).
Resultados
La figura 1 esquematiza el método acinos "dispersado" para las células acinares aislamiento primario. Los pasos críticos, que tienen que ser estrictamente respetado durante el protocolo, se describen en la parte de discusión.
Para facilitar su retirada, el páncreas tiene que ser recogida desde el abdomen junto con el bazo adjunto (Figura 2). Ambos órganos tienen que ser cortados a pedazos, y el tejido graso residual que podría ser aún en el páncreas se deben quitar (Paso 1.6).
La macro-y las imágenes microscópicas, que se muestran en la Figura 3, representan el resultado después de cada paso de las disociaciones enzimáticas y mecánicas del páncreas. Después de cortar, el páncreas se divide en piezas pequeñas (Figura 3A; Paso 1.8). La Figura 3B muestra el aspecto del páncreas después de una disociación enzimática con éxito basándose en una tempor cuidadoal seguimiento de la digestión en curso (Paso 2.4). Este paso es un paso crucial para determinar el tiempo exacto que se necesita. La Figura 3C muestra el material obtenido después de la filtración de la mezcla de páncreas (Paso 3.4). Sólo los acinos bien separadas se mantienen después de este paso.
La Figura 4 es un día típico 1 ejemplo de acinos pancreáticos aislados utilizando nuestro protocolo. La transferencia de las células acinares en una nueva placa de cultivo permite eliminar los fragmentos celulares y las células contaminantes adherentes (Paso 4.1).
Como se muestra en la Figura 5, cuando se cultiva en colágeno de tipo I, las células acinares se extienden y pierden su diferenciación acinar (morfología y organización 3D), dando lugar a una monocapa de células en forma de huso (Paso 4.6).
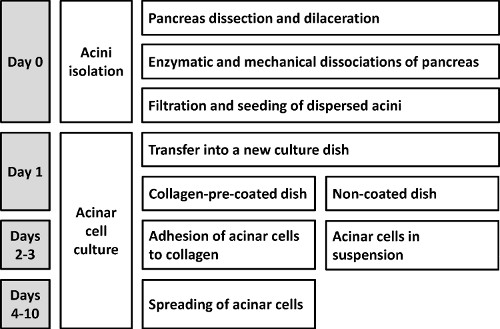
Figura 1. Representación esquemática del protocolo que permite el aislamiento de ratón primaria dispersa acinos.
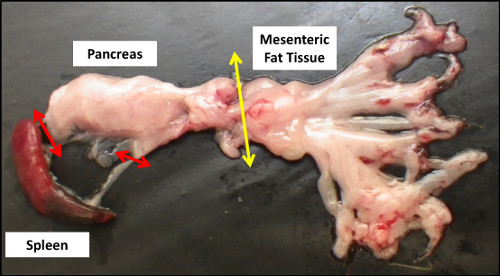
Figura 2. Anatomía macroscópica del páncreas después de la disección. Flechas rojas y amarillas indican, respectivamente, las conexiones anatómicas restantes con el bazo y el tejido de grasa mesentérica que hay que cortar para la recolección de páncreas.
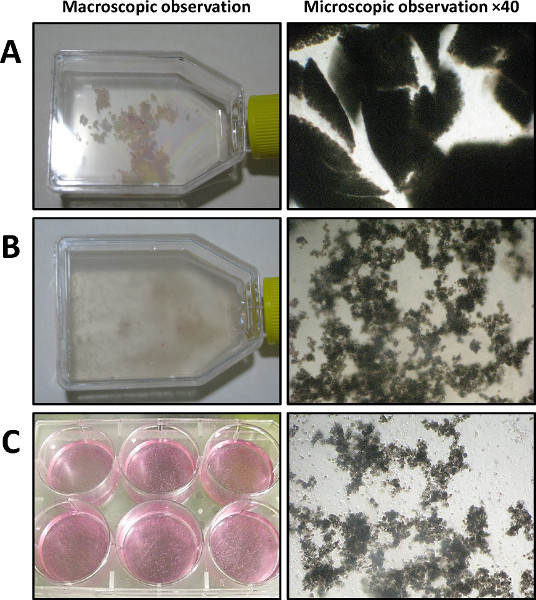
Figura 3. Dispersos acinos aislamiento (día 0) se visualizó por observación macroscópica (panel izquierdo) y microscopía de contraste de fase (panel de la derecha, 40 aumentos). A) Después dilaceración (que se muestra en un matraz de 25 cm 2). B) Después de la digestión colagenasa IA y vigoroso mecánica dissociatien. C) Después de la filtración y la transferencia en una placa de cultivo de 6 pocillos.
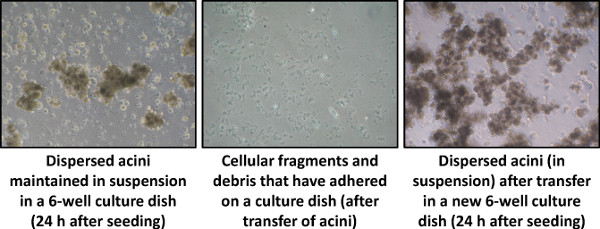
La Figura 4. Dispersos acinos cultura, 24 horas después de la siembra (día 1), visualizado por microscopía de contraste de fase (40 aumentos).
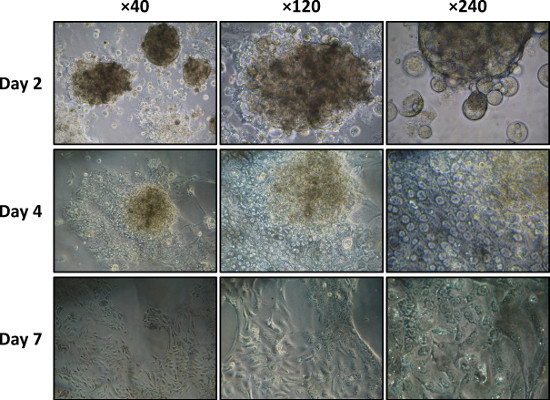
Figura 5. Dispersos cultura acinos tipo I en un plato revestido con colágeno en los días 2, 4, y 7 visualizaron por microscopía de contraste de fase (40X, 120X, 240X y aumentos).
Discusión
En este protocolo, se describe un procedimiento para el aislamiento de células acinares pancreáticas. Este método hace posible aislar más de 20 x 10 6 células acinares por animal en menos de 1 hora. Gracias a su rápida y fácil aplicación (hasta 10 páncreas se pueden procesar de forma independiente por experimento en paralelo), este protocolo aparece como un buen compromiso entre los métodos de aislamiento existentes 3-5,9-12,17.
Los pasos críticos / Localización de Averías
La eficiencia de este método se basa en las precauciones tomadas en unos pocos puntos críticos. El primer paso de dilaceración páncreas (Paso 1.8) es esencial para la posterior digestión enzimática del páncreas. Insuficiente de corte-arriba para disminuir el rendimiento de la disociación enzimática y el número de células acinares obtenidos. Esto hace que sea necesario prolongar la incubación con colagenasa IA, provocando inevitablemente una disociación excesiva de las células acinares y consecutivosaumentar relativamente la muerte celular.
Como se advirtió anteriormente, el segundo paso crítico es la digestión por colagenasa IA (Paso 2.3). El exceso de disociación enzimática conduce a una alta tasa de muerte celular. El grado de digestión páncreas debe ser supervisada con frecuencia durante este paso crítico (Figura 3B). Después de disociaciones mecánicos y enzimáticos, especial atención debe prestarse a fin de manejar con mucho cuidado los acinos dispersos con el fin de preservar sus estructuras intercelulares.
Limitaciones
Incluso si la adición de Factor de Crecimiento Epidérmico (EGF) para la cultura de la Waymouth puede precipitar la transdiferenciación acinar-a-ductal progresiva, es esencial para mantener vivas las células.
Como se describe en el protocolo y, si es necesario, el período de cultivo in vitro de las células acinares se puede extender a un máximo de 10 días por la siembra de las células de la matriz scaffedad como el colágeno tipo I. Sin embargo, importante, y como se muestra por otros 1, el cultivo de células en colágeno de tipo I se inducir la transdiferenciación progresiva de las células acinares en células ductales. Este proceso se inicia después de 4 días de cultivo sobre el colágeno y puede ser completa después de 7 días. Por lo tanto, puede ser necesario comprobar la presencia de un marcador ductal específica tal como la fibrosis quística regulador de conductancia transmembrana o citoqueratina-19 (por inmunocitoquímica o experimentos de inmunofluorescencia) si necesita el cultivo de células acinares que se extienda a 1 semana. El uso alternativo de Matrigel como un andamio matriz, mediante la reducción de la adherencia de los acinos dispersa, hace que sea posible extender el mantenimiento de su fenotipo acinar durante 2 días.
Las modificaciones posibles
Seccionamiento el recto durante la etapa de disección aumenta el riesgo de contaminación bacteriana. Nunca hemos tenido tal situación. Sin embargo, si es necesario, existe otro procedimiento para evitar este posible problema. Consiste en encontrar el estómago, el bazo y la primera parte del duodeno, páncreas y seccionar adjunto. Tenga en cuenta que este procedimiento alternativo necesita ser perfectamente dominado. De lo contrario, la duración de la disección se hacen más largos, a continuación, poner en peligro la calidad de la materia biológica eliminado.
El cultivo en monocapa a largo plazo de las células acinares se puede optimizar, en particular mediante la modificación de la matriz de soporte. Si es requerido por las condiciones experimentales, el colágeno tipo I puede ser sustituido por otro andamio, como Matrigel. En este caso Matrigel debe estar recién preparado a 400 mg / ml de concentración en frío Phosphate-Buffered Saline 1x. A partir de entonces, los pocillos se incuban con Matrigel (40 g / cm 2) durante la noche a 4 ° C. Este punto debe ser estrictamente respetado. El procedimiento de cultivo sigue siendo el mismo que el descrito en el paso 4.
El método de can ser optimizado empíricamente. Por ejemplo, la cantidad de aminoácidos en el medio de cultivo de las células pancreáticas exocrinas puede regular la síntesis de proteínas por estas células 18. Sphyris et. Al 2 y Blauer y col. 19 han elaborado un medio de cultivo completo que contiene una mayor cantidad de aminoácidos (esenciales y no esenciales), la promoción de mantenimiento de las células acinares en el estado diferenciado. Tal medio puede ser muy útil si se desea a las células acinares de cultivo aislados mediante este método durante más de 10 días.
Otro parámetro que puede ser modificado, si se requiere, el cultivo a largo plazo, es el pH del medio de cultivo. Fisiológicamente, el polo apical de las células acinares está en contacto permanente con un líquido rico en bicarbonato, ligeramente alcalino dando lugar a que el jugo pancreático. Es tentador especular que el pH del medio de células acinares podría ser importante en el mantenimiento de la acinares differentiatioEstado n. Algunos protocolos informó anteriormente el uso de un medio de cultivo con un pH ajustado a 7.8 para imitar la fisiología "inicial" de las células acinares 19.
Importancia de la técnica
Es importante mencionar que existen otros protocolos para el cultivo de células acinares, utilizando explantes de páncreas y culturas organotípicos 19. Su aplicación, sobre la base de la migración de células de páncreas del explante a la membrana en los que se cultivaron, es más difícil. El aislamiento de estas células pancreáticas requiere en particular una primera semana de cultivo de explantes de páncreas. La principal ventaja de este método es que no se necesita la disociación enzimática, de modo que se conservan tanto en la integridad de la membrana celular y de las interacciones de célula a célula. Bajo estas condiciones, las células acinares pueden ser mantenidos in vitro durante hasta 14 días. Sin embargo, el cultivo de células acinares obtenido no es pura, y fibroblastos contaminantes, ductal cells, y las células endoteliales son inevitablemente presente, que podría ser incompatible con algunos tipos de experimentos. En contraste, nuestro procedimiento produce rápidamente una población pura de células acinares, la conservación de su arquitectura inicial de acinos.
Dorrell et al. Describe otro método con el fin de aislar los diferentes tipos de células pancreáticas de ratón (incluyendo acinares, conducto, y las células endocrinas), mediante clasificación de células activadas por fluorescencia (FACS) 17. Este método es muy eficiente para obtener una población pura (o específica) de las células acinares. Sin embargo, se requiere un marcaje fluorescente con anticuerpos específicos, la clasificación previa. Por otra parte, este procedimiento también requiere una experiencia en FACS y un citómetro de flujo. Además, esta técnica no permite un cultivo prolongado de células acinares, debido a la pérdida de su arquitectura inicial de acinos. Nuestro método rápido permite un prolongado cultivo in vitro de células acinares dispersas con una calidad y una pureza que unavolver compatible con la mayoría de las otras aplicaciones de rutina.
Las aplicaciones futuras
Una vez dominado, esta técnica para el aislamiento de células acinares / cultivo debe resultar muy útil en el tratamiento de una serie de preguntas y en particular para la investigación de los mecanismos implicados en la plasticidad pancreática y transdiferenciación, que son bien conocidos pero poco conocidos. Al preservar algunas de las comunicaciones inter e intracelular, este modelo sigue siendo dispersa acinos fisiológicamente más relevantes que las líneas celulares inmortalizadas.
En el campo de la tumorigénesis pancreática, este modelo celular primario proporciona un sistema adecuado para el estudio de la transdiferenciación de células acinares, uno de los mecanismos propuestos para generar los cánceres de páncreas agresivos. Aunque las líneas celulares inmortalizadas humanos o murino (por ejemplo, Colo357, Panc-1, o BxPC3) podrían ser más flexible de usar que las células acinares primarias, tanto en su origen y su borradorestado genético lex (líneas celulares transformadas como inicialmente aislados de tumores pancreáticos o incluso metástasis pancreáticas) constituyen los principales inconvenientes en el estudio de estos mecanismos.
Divulgaciones
Los autores declaran que no tienen intereses financieros en competencia.
Agradecimientos
Damos las gracias al personal de Anican (CRCL, Lyon) por su asistencia técnica con el cuidado animal. Este trabajo fue apoyado por el Institut National de la Santé et de la Recherche Médicale (Programa Avenir INSERM), la Ligue Nationale Contre le Cancer, por la Association pour la Recherche sur le Cancer, por el Instituto Nacional del Cáncer, y por becas de la Ligue Nationale Contre le Cancer (JG), del Instituto Nacional del Cáncer (JG), del Ministère de l'Enseignement Supérieur et de la Recherche de Francia (RMP y DFV) y de la Association pour la Recherche sur le Cancer ( DFV).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.2 μm filter | Dutscher | 146560 | |
| 10 ml serological pipettes | Beckton Dickinson | 357551 | |
| 100 μm filter | Beckton Dickinson | 352360 | |
| 100 mm Petri dish | Beckton Dickinson | 353003 | |
| 1000 μl filter tips | Starlab | S1122-1830 | |
| 20 μl filter tips | Starlab | S1120-1810 | |
| 200 μl filter tips | Starlab | S1120-8810 | |
| 25 ml serological pipettes | Beckton Dickinson | 357535 | |
| 5 ml serological pipettes | Beckton Dickinson | 357543 | |
| 50 ml polypropylene tube | Beckton Dickinson | 352070 | |
| 6-well plate | Beckton Dickinson | 353046 | |
| Acetic acid 100% | VWR BDH Prolabo | 20104.298 | |
| Collagenase IA | Sigma-Aldrich | C2676 | |
| Curved forceps, Dumont #7 | World Precision Instruments | 14188 | To sterilize before use |
| Dissecting scissors, straight | World Precision Instruments | 14393 | To sterilize before use |
| Epidermal Growth Factor, human | Promokine | C-60180 | |
| Ethanol absolute (AnalaR Normapur) | VWR BDH Prolabo | 20821.310 | |
| Fetal Bovine Serum | Lonza | 14-801F | |
| Forceps, Dumont #5 | World Precision Instruments | 14098 | To sterilize before use |
| Hank’s Balanced Salt Solution 1x | Gibco | 14025050 | |
| HEPES 1 M (pH 6.98-7.30) | Lonza | 17-737F | |
| Incubator O2/CO2 | Sanyo | MCO-19M | |
| Inverted microscope | Nikon | Eclipse TS100 | |
| Matrigel | Beckton Dickinson | 356234 | |
| Microbiological Safety Cabinet, level II | Faster | SafeFast Elite 212 S | |
| Noyes scissors, sharp/sharp tips, German | World Precision Instruments | 500228-G | To sterilize before use |
| Penicillin-Streptomycin mixture | Gibco | 15140122 | |
| Phosphate Buffer Saline 10x | Gibco | 14200067 | |
| Pipet-Aid | Drummond Scientific Company | Pipet-Aid XP | |
| Pipetman P1000 | Gilson | F123602 | |
| Pipetman P20 | Gilson | F123600 | |
| Pipetman P200 | Gilson | F123601 | |
| Refrigerated centrifuge | Eppendorf | 5810R | |
| Scalpel | Paramount Surgimed Ltd. | Disposable Scalpel Size 23 | |
| T25 flask, 25 cm2 | Sigma-Aldrich | Z707481 | |
| Trypsin inhibitor, from Glycine Max | Sigma-Aldrich | T6522 | |
| Type I collagen | Beckton Dickinson | 354236 | |
| Waymouth’s medium | Gibco | 31220-023 |
Referencias
- Lardon, J., Bouwens, L. Metaplasia in the pancreas. Differentiation. 73, 278-286 (2005).
- Sphyris, N., Logsdon, C. D., Harrison, D. J. Improved retention of zymogen granules in cultured murine pancreatic acinar cells and induction of acinar-ductal transdifferentiation in vitro. Pancreas. 30, 148-157 (2005).
- Amsterdam, A., Jamieson, J. D. Structural and functional characterization of isolated pancreatic exocrine cells. Proc. Natl. Acad. Sci. U.S.A. 69, 3028-3032 (1972).
- Amsterdam, A., Jamieson, J. D. Studies on dispersed pancreatic exocrine cells. I. Dissociation technique and morphologic characteristics of separated cells. J. Cell. Biol. 63, 1037-1056 (1974).
- Amsterdam, A., Jamieson, J. D. Studies on dispersed pancreatic exocrine cells. II. Functional characteristics of separated cells. J. Cell. Biol. 63, 1057-1073 (1974).
- Schultz, G. S., et al. Guinea pig pancreatic acini prepared with purified collagenase. Exp. Cell Res. 130, 49-62 (1980).
- Williams, J. A., Korc, M., Dormer, R. L. Action of secretagogues on a new preparation of functionally intact, isolated pancreatic acini. Am. J. Physiol. 235, 517-524 (1978).
- Logsdon, C. D., Williams, J. A. Epidermal growth factor binding and biologic effects on mouse pancreatic acini. Gastroenterology. 85, 339-345 (1983).
- Han, B., Logsdon, C. D. Cholecystokinin induction of mob-1 chemokine expression in pancreatic acinar cells requires NF-kappaB activation. Am. J. Physiol. 277, 74-82 (1999).
- Ji, B., Kopin, A. S., Logsdon, C. D. Species differences between rat and mouse CCKA receptors determine the divergent acinar cell response to the cholecystokinin analog JMV-180. J. Biol. Chem. 275, 19115-19120 (2000).
- Ji, K. A., Yang, M. S., Jou, I., Shong, M. H., Joe, E. H. Thrombin induces expression of cytokine-induced SH2 protein (CIS) in rat brain astrocytes: involvement of phospholipase A2, cyclooxygenase, and lipoxygenase. Glia. 48, 102-111 (2004).
- Gaiser, S., et al. Intracellular activation of trypsinogen in transgenic mice induces acute but not chronic pancreatitis. Gut. 60, 1379-1388 (2011).
- Logsdon, C. D., Williams, J. A. Pancreatic acinar cells in monolayer culture: direct trophic effects of caerulein in vitro. Am. J. Physiol. 250, 440-447 (1986).
- Stanger, B. Z., Dor, Y. Dissecting the cellular origins of pancreatic cancer. Cell Cycle. 5, 43-46 (2006).
- Vincent, D. F., et al. Tif1gamma suppresses murine pancreatic tumoral transformation by a smad4-independent pathway. Am. J. Pathol. 180, 2214-2221 (2012).
- Vincent, D. F., et al. Inactivation of TIF1gamma cooperates with Kras to induce cystic tumors of the pancreas. PLoS Genet. 5, e1000575 (2009).
- Dorrell, C., et al. Isolation of mouse pancreatic alpha, beta, duct and acinar populations with cell surface markers. Mol. Cell Endocrinol. 339, 144-150 (2011).
- Case, R. M. Synthesis, intracellular transport and discharge of exportable proteins in the pancreatic acinar cell and other cells. Biol. Rev. Camb. Philos. Soc. 53, 211-354 (1978).
- Blauer, M., Nordback, I., Sand, J., Laukkarinen, J. A novel explant outgrowth culture model for mouse pancreatic acinar cells with long-term maintenance of secretory phenotype. Eur. J. Cell. Biol. 90, 1052-1060 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados