Method Article
Optogenética ativação de neurônios Zebrafish somatossensoriais usando chef-tdTomato
Neste Artigo
Resumo
Optogenética técnicas tornaram possível estudar a contribuição dos neurónios específicos para o comportamento. Nós descrevemos um método em zebrafish larval para ativar neurônios individuais somatossensoriais expressando uma variante channelrodopsina (chef) com um diodo-bombeado do laser de estado sólido (DPSS) e registrando os comportamentos eliciados com uma câmera de vídeo de alta velocidade.
Resumo
Zebrafish larvais estão a emergir como um modelo para descrever o desenvolvimento ea função de simples circuitos neurais. Devido à sua fertilização externa, o rápido desenvolvimento, e translucidez, peixe-zebra são particularmente bem adequados para as abordagens optogenética para investigar a função do circuito neural. Nesta abordagem, os canais de iões sensíveis à luz são expressos em neurónios específicos, permitindo que o experimentador para activar ou inibir-los à vontade e, assim, avaliar a sua contribuição para comportamentos específicos. A aplicação destes métodos em zebrafish larval é conceitualmente simples, mas exige a otimização de detalhes técnicos. Aqui demonstramos um procedimento para expressar uma variante channelrodopsina nos neurônios de larvas de zebrafish somatossensoriais, foto-ativação de células individuais, e registrando os comportamentos resultantes. Com a introdução de algumas modificações de métodos previamente estabelecidos, esta abordagem pode ser utilizada para eliciar respostas comportamentais de neurónios individuais activados atépara pelo menos 4 dias pós-fertilização (DPF). Especificamente, nós criamos um transgene usando um neurônio somatossensorial enhancer, CREST3, para dirigir a expressão do marcado channelrodopsina variante, chef-tdTomato. Injectar este transgene em células de embriões de uma-etapa resulta na expressão de mosaico em neurónios sensoriais, que podem ser visualizados por microscopia confocal. Illuminating identificaram células desses animais com a luz de um laser de 473 nm DPSS, guiado através de um cabo de fibra óptica, provoca comportamentos que podem ser gravados com uma câmera de vídeo de alta velocidade e analisados quantitativamente. Esta técnica pode ser adaptada para comportamentos de estudo induzidas pela activação de qualquer neurónio de peixe zebra. Combinando esta abordagem com perturbações genéticas ou farmacológicas será uma forma poderosa para investigar a formação de circuito e função.
Introdução
O desenvolvimento de métodos optogenética para promover ou inibir a excitabilidade neuronal com comprimentos de onda de luz definidos, tornou possível estudar a função de populações distintas de neurônios nos circuitos neurais que controlam o comportamento 1, 19, 21. Esta técnica é frequentemente usada para activar grupos de neurónios, mas também pode ser usado para activar os neurónios individuais. Larvas de peixe-zebra são particularmente sensíveis a estes métodos, uma vez que são translúcidos, o sistema nervoso se desenvolve rapidamente, e a criação de animais transgénicos é rápida e de rotina. No entanto, importantes barreiras técnicas devem ser superados para conseguir a ativação confiável único neurônio.
Para otimizar um processo de ativação dos neurônios optogenética zebrafish individuais, nós nos concentramos em neurônios somatossensoriais. Larvas do peixe detectar uma variedade de estímulos somatossensorial, utilizando duas populações de neurônios: os neurônios trigeminais, que inervam a cabeça, e Rohon Barba-(RB), que inervam neurónios do resto do corpo. Cada neurônio trigêmeo e RB projeta um axônio periférico que ramos extensivamente na pele para detectar estímulos e um axônio central que conecta a jusante circuitos neurais. Os animais respondem ao toque tão cedo quanto 21 horas pós-fertilização (hpf), indicando que os circuitos somatossensoriais coerentes formaram 5, 18. Durante o desenvolvimento das larvas, pelo menos, algum do trigémeo e RB sinapse neurônios na célula Mauthner para activar respostas de fuga clássicos, mas a acumular evidência sugere que há múltiplas classes de neurónios somatossensoriais com diferentes padrões de conectividade que podem suscitar variações sobre o comportamento de fuga 2, 4, 10, 12, 14, 15, 16, 17. A motivação para o desenvolvimento deste método foi caracterizar a função comportamental de diferentes classes de neurónios sensoriais, mas esta abordagem poderia, em princípio, ser utilizado para estudar a função do neurónio ou quase qualquer população de neurónios no larval zebrafish.
Douglass et ai. Anteriormente descrito um método para a activação channelrodopsina-2-expressando neurônios somatossensoriais com luz azul, provocando o comportamento de escape 3. A sua abordagem utilizado um elemento potenciador do gene ISL1 para conduzir a expressão de CHR2-EYFP em neurónios somatossensorial. Este transgene, no entanto, foi relatado para exibir fluorescência relativamente fraco, o que requer a co-injecção de um segundo repórter, UAS :: GFP, para permitir a visualização das células que expressam CHR2-EYFP. Esta abordagem foi utilizada para obter respostas de comportamento entre 24-48 hpf, mas nunca poderia provocar uma resposta passado 72 hpf. Assim, embora este método funciona para estudar circuitos neurais em muito primeiros estágios larvais (24-48 hpf), é insuficiente para a caracterização de circuitos neurais e respostas comportamentais em larvas mais velhas, quando mais diversas respostas comportamentais são aparentes e os circuitos neurais são mais maduros.
Procuramosmelhorar a sensibilidade desta técnica, a fim de caracterizar a função de sub-populações de neurónios RB larvais. Para melhorar a expressão utilizou-se um intensificador somatossensorial específico (CREST3) 20 para conduzir a expressão de LexA-VP16 e um alongamento de sequências do operador LexA (4xLexAop) 11 para amplificar a expressão de um canal de fluorescência marcado activado pela luz. Esta configuração amplificado expressão do canal, eliminando a necessidade de co-expressão de um segundo repórter e que nos permite determinar directamente a abundância relativa do canal em cada neurónio. Usando a sequência de LexA / LexAOp tinha a vantagem adicional de permitir-nos introduzir o transgene em peixes-zebra linhas repórter que utilizam o sistema Gal4/UAS. A expressão transitória do transgene resultou em níveis variáveis de expressão, mas era geralmente suficientemente robusto para visualizar o corpo da célula e as projecções axonais dos neurônios individuais ao longo de vários dias. Para otimizar a sensibilidadedade de luz que usamos a luz ativado canal chef, uma variante channelrodopsina consistindo de uma quimera de channelopsin-1 (Chop1) e channelopsin-2 (Chop2) com um site de cruzamento na hélice laço EF 13. Este canal é ativado no mesmo comprimento de onda chr2, mas requer menor intensidade de luz para ativação, tornando-a mais sensível do que outros canais comumente usados, incluindo chr2. A proteína chef foi fundida com a proteína fluorescente vermelha, tdTomato, permitindo-nos para a tela para a expressão da proteína sem ativar o canal. Como uma fonte de luz, foi utilizado um diodo bombeado laser de estado sólido (DPSS) acoplado a um cabo de fibra óptica para proporcionar uma precisa, pulso de alta potência de luz azul, para uma região específica da larva. Isto permitiu-nos concentrar a luz laser sobre neurónios individuais, eliminando a necessidade de encontrar raros animais transgénicos que expressam o canal num único neurónio. Usando essa abordagem, fomos capazes de ativar neurônios individuais RB, gravar resposta comportamentals com uma câmera de vídeo de alta velocidade, e os neurônios ativados imagem em alta resolução com microscopia confocal.
Protocolo
Preparar o seguinte antes do tempo.
1. Prepare cabo ótico
- Criar uma unidade de armazenamento para o cabo de fibra óptica por fusão do gargalo cónica de uma pipeta de Pasteur de vidro ao longo de um bico de Bunsen para criar um ângulo de ~ 150 °.
- Utilizando um cortador de fio ou uma lâmina de barbear, corte cuidadosamente o cabo de fibra óptica em duas partes. Cada peça deve ter uma extremidade com um FC / PC adaptador e uma extremidade exposta. Armazenar uma peça como um cabo de reserva.
- Descascar o cabo de fibra óptica para baixo para o revestimento através da remoção do revestimento de fibras e as fibras de reforço (Figura 1A), de 5,0 cm de corte de extremidade do cabo.
- Insira o cabo óptico no preparado Pasteur pipeta. Certifique-se de cabo pode facilmente entrar e sair da ponta da pipeta.
- Com cabo óptico saindo da ponta da pipeta Pasteur, corte cuidadosamente e retire revestimento de fibra de cerca de fibra de vidro, ~ 2 mm de corte final.
- Usando um cortador de diamante caneta / vidro, entalhe a fibra de vidro e quebrar off a fim de criar um corte limpo / superfície na extremidade da fibra (Figura 1B).
- Retrair cabo ótico em pipeta Pasteur para armazenamento. Repita o passo (1,6) se a ponta de fibra óptica fica lascado ou quebra de forma desigual.
- Cabo óptico de posição usando uma pipeta de Pasteur micromanipulador (Figura 1C).
Procedimentos 2-8 descrevem um método para a injecção em embriões de transgenes geralmente aplicáveis a muitos experimentos zebrafish. Variações sobre este método, como as descritas em outros vídeos Jove 6, 7, 8, 9, 22 são igualmente eficazes.
2. Puxe agulhas de injeção
- Usando um extrator de agulha, puxar um tubo de vidro de borosilicato em duas agulhas de injeção com uma ponta gradualmente reduzida. Puller configurações irão variar. (Em um extrator agulha Sutter Instruments usamos configurações: P = 500 Calor, = 720, Pull = 50 Velocity, = 70 e Tempo = 150). Cada extrator agulha é diferente, assim otimizar as configurações do extrator lospirically. Para mais agulhas cónicas, aumentar o calor e / ou recepção. Para agulhas menos cônico, aumentar o tempo e / ou Pull diminuição.
- Agulhas guarde em um recipiente seguro (ou seja, uma placa de Petri com fita enrolada, para fora do lado adesivo).
3. Despeje moldes de injeção
- Derreta 0,5 g de agarose em 30 embrião ml / água azul, até agarose se dissolva completamente.
- Despeje a metade inferior de uma placa de Petri.
- Coloque o molde rectangular com poços de montagem (Figura 2) em agarose, tendo o cuidado de limitar a formação de bolhas em torno dos poços.
- Permitir agarose solidificar.
- Retire do molde eo placa de Petri com o azul / água embrião.
- Armazenar em posição vertical, enchido com água limpa, à temperatura ambiente para utilização no mesmo dia ou a 4 ° C para uso futuro.
4. Mix fazer DNA plasmídico para Injectáveis
- Diluir o ADN plasmídico até uma concentração de 50 ng / ul com vermelho de fenol a 1:10 em DDH 2 O. Paraexemplo:
1,0 ml DNA plasmídeo (250 ng / ml) 0,5 ml vermelho de fenol 3,5 ml DDH 2 O - Mistura de ADN podem ser mantidas à temperatura ambiente, se usar imediatamente ou armazenadas a 4 ° C durante vários dias.
5. Configure pares acasalados
Isto deve ser feito a noite antes que você pretende fazer injeções.
- Preencha tanques de criação com sistema de água e coloque peixes machos e fêmeas juntos. Se as injecções não pode ser realizada logo que as luzes mudam na instalação, peixe macho e fêmea com um divisor separado.
6. Prepare-se para Injeções (pode ser feito enquanto espera para embriões)
- Ligue pressão injetor plataforma. Verifique se o sistema está configurado para pulsar. Comece com o conjunto de duração de pulso a 1.
- Ligue a válvula de ar eAjuste a pressão injetor para ~ 20 psi.
- Usando um escopo de dissecação com a maior ampliação, quebrar a ponta da agulha com uma pinça ou uma póquer para criar uma abertura uM ~ 2 (Figura 3, Movie 1).
- Preencha agulhas com uma mistura de DNA por: 1. Colocação da agulha do lado da ponta, para cima, para a mistura de ADN e permitindo que a agulha preencher por acção capilar ou 2. Utilizando uma ponta de longo alcance para pipetar 1-2 ul do DNA misturar directamente para dentro da agulha.
- Lugar cheio de agulhas em um lugar seguro até que esteja pronto para injetar.
7. Coletar embriões
- Depois de luzes facilidade de ter ligado, remova divisores (se aplicável). Coletar embriões com um coador / peneira pequena e transferi-los para uma placa de Petri com o azul fresco / água embrião.
8. Injectar embriões no estágio de célula 1-2
- Transferir os embriões colhidos para moldes de injecção, utilizando uma pipeta de plástico.
- Usando um microscópio de dissecação, empurre embriões empoços com uma pinça ou um pôquer sem corte (Figura 4, filme 2).
- Coloque agulha carregada em um micromanipulador e posição sobre embriões.
- Calibrar o volume de injecção, ajustando a duração do pulso em um passo incrementos de até alcançar o volume desejado (~ 1 nl). Isto poderia ser calibrado com um micrómetro, como descrito em um vídeos anteriores Jove 8, 22, mas para esta precisão experiência não é necessária, uma vez que uma ampla gama de volumes de injecção irá resultar em expressão adequada.
- Injectar ~ 1 nl DNA misturar diretamente na célula e repita para todos os embriões. O ADN pode também ser injectado na gema de ovo, mas esta tende a ser menos eficientes (Figura 5, Movie 3).
- Remover embriões injetados de molde utilizando um fluxo suave de azul / água embrião.
- Loja injectado em embriões de 28,5 ° C no escuro.
- Remover não fertilizados, embriões danificados ou mortos periodicamente.
- Trate embriões wiª PTU entre 18-24 hpf para evitar a pigmentação.
9. Tela para a expressão do transgene
- Manualmente dechorionate 24-48 embriões HPF usando uma pinça.
- Anestesiar larvas usando 0,02% tricaina.
- Usando um microscópio de fluorescência de dissecação, identificar larvas com RB ou expressão neurônio trigêmeo e transferir para um novo prato com água fresca PTU azul / embrião. Embriões com expressão em células esparso facilmente identificáveis são óptimas, mas neurónios individuais serão orientadas para a activação com um cabo de fibra óptica para uma ampla gama de densidade de expressão é aceitável.
- Embriões Armazenar a 28,5 ° C no escuro até desejada fase experimental.
10. Monte larvas para Experimentos Comportamento
- Faça 1,5% baixo derretimento de agarose em DDH 2 O e armazenar em um bloco de aquecimento 42 ° C para evitar que ele se solidifique.
- Utilizando uma pipeta de Pasteur de vidro, a transferência de uma das larvas pré-rastreada para uma banheirae de 1,5% de agarose de fusão baixo, com água como azul / embrião pouco quanto possível.
- Transferir as larvas numa gota de agarose sobre uma placa de Petri pequenas.
- Sob um microscópio de dissecação, a posição se dorsal larva.
- Quando agarose solidificou, cortar a agarose com uma lâmina fina (# 11 bisturi), deixando uma cunha de agar em torno da larva inteira.
- Faça dois cortes diagonais em cada lado da gema, tomar cuidado para não nick da larva.
- Preencha a área em torno da agarose com embrião / água azul.
- Puxar agarose longe do tronco e cauda da larva (Figura 6).
11. Prepare alta velocidade da câmera e software de imagem
- Monte de alta velocidade da câmera para dissecar escopo.
- Conectar a câmera ao computador.
- Ligue o computador.
- Ligue de alta velocidade da câmera.
- Software de vídeo / imagem aberta (Usamos AOS software de imagem e descrever os procedimentos para usá-lo aqui, mas outra imagemsoftware é igualmente aceitável).
- Ajustar as configurações da câmera de acordo (ou seja, 1.000 quadros por segundo (fps), tampão de gatilho de 50% ou outras configurações preferenciais).
- Iniciar a gravação.
12. Ativar neurônios individuais usando um laser de 473 nm
- Anexar a laser estimulador e cabo óptico.
- Ligue estimulador.
- Definir estimulador a um máximo de 5 volts e com uma duração de pulso de 5 mseg.
- Ligar a laser de acordo com as instruções do fabricante.
- Usar um microscópio de dissecação para posicionar a ponta do cabo óptico próximo do corpo celular de um neurónio com Chef-tdTomato expressão (Figura 6).
- Entregar pulso de luz azul para ativar neurônio sensorial.
- Comportamento registro usando uma câmera de alta velocidade fixado em 500 ou 1.000 quadros por segundo.
- Repita experimento como desejado, espera 1 min entre cada activação para evitar a habituação. (Nós registramos um mínimo de três respostas para cada neurônio).
- Paralarvas lançamento, erguer além de agarose com uma pinça, tomando cuidado para não ferir o animal. Este animal pode ser permitido o desenvolvimento adicional e o processo pode ser repetido em uma fase mais antiga para caracterizar o desenvolvimento do comportamento. O embrião pode ser remontado de alta resolução de imagem confocal de células activadas para correlacionar o comportamento com a estrutura celular, tal como descrito abaixo.
- Transfira a larva placa de cultura com o azul fresco / água embrião. Nós usamos uma placa de 24 cavidades para controlar larvas individual.
13. Neuron imagem (s) com um microscópio Confocal
- Anestesiar larvas com tricaina 0,02%.
- Mount larvas, com o lado dorsal para cima, em 1,2% de agarose de fusão baixo ou de um molde dorsal.
- Imagem chef-tdTomato neurônios com um laser nm 543 e filtro adequado e objetivo. Usamos uma objetiva de 20x.
- Remover larvas de agarose e voltar ao indivíduo bem com o azul / água embrião.
- Armazenar a 28,5 ° C no escuro, para fuanálise rther.
Resultados

Figura 1. Cabo de fibra óptica configurar. (A) Camadas de um cabo de fibra óptica. (B) do cabo de fibra óptica descascado em uma pipeta Pasteur. (C) Cabo de fibra óptica em pipeta Pasteur posicionado usando um micromanipulador.

Figura 2. Modelo de molde de injeção.

Figura 3. (Filme 1). Quebrando a agulha.

Figura 4. (Filme 2). Colocando os embriões para dentro do molde de injecção.
ther.within-page = "always"> 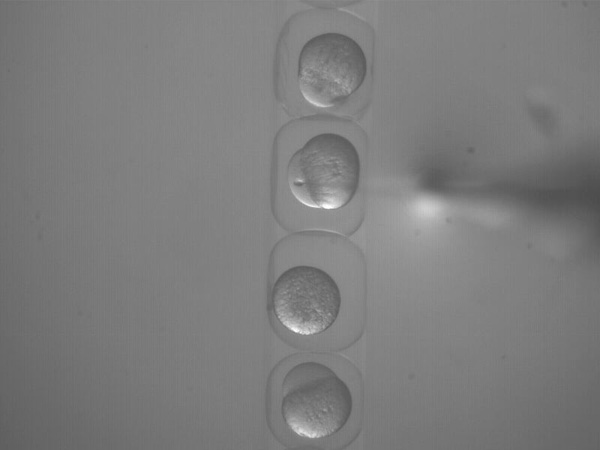
Figura 5. (Filme 3). Injetando um nl mistura de DNA em uma célula do embrião palco.
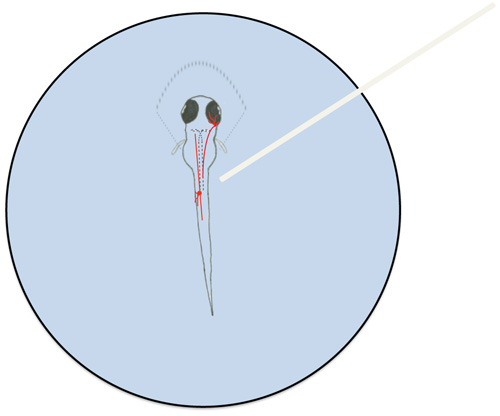
Figura 6. Diagrama de uma larva zebrafish montado e neurónios representativos envolvidos na resposta ao toque larval. Zebrafish larvas foram parcialmente montado em 1,5% de agarose de fusão baixo (representado por linhas tracejadas em torno da porção rostral do larva). Um neurônio trigêmeo (na cabeça) e um neurônio Rohon Beard (no tronco) são representadas em vermelho. Células Mauthner são delineadas por linhas tracejadas na larva. O cabo de fibra óptica (branco) é mostrado posicionado sobre o corpo da célula RB neurônio.
oad/50184/50184fig7.jpg "alt =" Figura 7 "fo: conteúdo largura =" 5in "fo: src =" files/ftp_upload/50184/50184fig7highres.jpg / "/>
Figura 7. (Filme 4). Ativação de um único neurônio RB expressingChEF provoca uma resposta comportamental. (A) Ainda quadros retratando a ativação de um neurônio único RB expressar-chef tdTomato. Neurónios individuais foram activadas por um impulso de 5 ms a partir de um laser de 473 nm, por meio de azul de um cabo de fibra óptica de 200 um. Tensão de condução do laser azul foi fixado em um máximo de 5 volts. O comportamento resultante foi gravado em 1000 frames por segundo por uma câmera de alta velocidade. (B) A microscopia confocal foi utilizado para a imagem do neurônio RB ativado. Seta mostra região estimulada em alambiques de comportamento. (C) a imagem ampliada de RB neurónio indicado em (B). Barra de escala, 100 mm. (Filme 5 e 6) mesmo peixe, (Filme 5) a ativação do trigêmeo, (Filme 6) RB neurônio sobre a extensão gema.p_upload/50184/50184fig7large.jpg "target =" _blank "> Clique aqui para ver maior figura.

Figura 8. Latência de comportamento, em condições variáveis. Para a maioria das experiências que activado um único neurónio, em ~ 35 larvas hpf expressando Chef-tdTomato com 5 ms de pulso a partir de um laser de 473 nm azul impulsionado por uma fonte de alimentação de 5 V (Figura 6). Para entender melhor a dinâmica de ativação chef, que variou parâmetros para determinar o seu efeito sobre o comportamento. (A) A duração do estímulo de luz (5 mseg versus 10 mseg) não afectou a latência quando quantificados a partir de início do impulso de luz. (B) Na ~ 35 hpf, tensão inversamente afeta a latência. Tensões mais baixas resultaram em um aumento na latência do movimento. Para os nossos ensaios, utilizou-se o valor máximo de tensão (5 V) permissible para o nosso aparelho de laser, o que provocou comportamentos estereotipados confiável da maioria dos neurônios brilhantemente expressam RB.

Figura 9. (Filme 7). Ativação de chef-tdTomato expressando neurônios RB em 60 larvas hpf. (A) ainda quadros retratando ativação de neurônios RB expressando-chef tdTomato por 10 ms de pulso de um laser azul 473 nm através de um cabo de fibra óptica de 200 um. O comportamento resultante foi gravado em 1000 frames por segundo por uma câmera de alta velocidade. (B) A microscopia confocal foi utilizada para a imagem activadas RB neurónio (s). Seta mostra região estimulada em alambiques de comportamento. Barra de escala, 100 mm.
 o: src = "files/ftp_upload/50184/50184fig10highres.jpg /" />
o: src = "files/ftp_upload/50184/50184fig10highres.jpg /" />
Figura 10. (Filme 8). Ativação de chef-tdTomato expressando neurônios RB em 4 larvas dpf. Ainda quadros retratando ativação de neurônios RB expressando-chef tdTomato por 20 ms de pulso de um laser azul 473 nm através de um cabo de fibra óptica de 200 um. O comportamento resultante foi gravado em 1000 frames por segundo com uma câmera de alta velocidade.
Filme 1. Clique aqui para ver filme .
Filme 2. Clique aqui para ver filme .
Filme 3. Clique aqui para ver filme .
Filme 4.ttp :/ / www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50184/50184movie4.mpg "target =" _blank "> Clique aqui para ver filme.
Filme 5. Clique aqui para ver filme .
Filme 6. Clique aqui para ver filme .
Filme 7. Clique aqui para ver filme .
Filme 8. Clique aqui para ver filme .
Discussão
Nós descrevemos uma abordagem para optogenética ativação de neurônios individuais em zebrafish RB ao vivo. Nosso método emprega transgenia transitória para expressar uma fluorescente etiquetado variante channelrodopsina, chef-tdTomato 13, em determinados neurônios somatossensoriais. Esta abordagem poderia ser facilmente adaptado para o uso em outras populações de células larvais zebrafish.
Usando essa abordagem, consistentemente induziu respostas comportamentais 34-48 larvas hpf expressar-chef tdTomato. Usando a 5 msec de pulso de luz azul, a 5 V, fomos capazes de activar os neurónios do RB simples (Figura 7). Ao posicionar a fibra óptica, em diferentes pontos ao longo do animal, verificou-se que era necessário para apontar a luz azul directamente a um corpo da célula para provocar uma resposta comportamental. Pulsos de luz não provocou uma resposta de larvas que não expressou chef. Além disso, nunca pulsos de luz ao longo do axónio central ou periférica do axónio eliciou uma resposta, even em larvas jovens (dados não mostrados). Esta propriedade foi vantajoso, uma vez que poderia confiantemente ativar neurônios individuais em animais em que os neurônios múltiplas foram rotulados, mesmo que os axônios centrais de outros neurônios passou perto do corpo do neurônio alvo da célula (Filme 4-6).
Para testar a fiabilidade do método de avaliação de parâmetros cinemáticos, determinou-se a latência da resposta de fuga (o tempo de activação de luz de resposta comportamental) entre 40 e 48 hpf, um parâmetro que se sabe ser altamente estereotipado. Para determinar se a duração do estímulo luminoso influencia a activação neuronal, nos neurónios alvo iluminado por 5 ou 10 ms (Figura 8A). Uma vez que o comportamento de latência em ambas as condições eram as mesmas quando calculado a partir do início do impulso de luz, concluiu-se que a duração do pulso de luz não influenciou a latência de comportamento. No entanto, achou que a redução da tensão aumentou ªlatência e de um comportamento (Figura 8B). Em 5 V, no entanto, muitas respostas (9 de 16 peixes) foram de 20 ± 5 ms, semelhante ao relatado para a latência de respostas de fuga naturais. Assim, a activação de neurónios com 5 V aproxima-se activação máxima.
Parâmetros para efetivamente obter respostas comportamentais de ativar neurônios individuais RB variou em larvas mais velhas. Nós sucesso obteve respostas comportamentais de animais tão antiga quanto 4 dpf, substancialmente mais tarde do que foi relatado anteriormente. No entanto, enquanto que a activação dos neurónios RB individuais com um pulso de luz 5 ms, 5 V consistentemente resultou em uma resposta comportamental antes de 48 hpf, a activação de larvas mais velhas (> 60 hpf) não foi tão consistente. Pulsos mais longos (10-100 ms) de luz eram muitas vezes necessário para ativar os neurônios em larvas mais velhas (Figura 9 e 10, Filme 7 e 8, respectivamente). Portanto, os parâmetros de activação podem precisarser optimizada / calibrado com base na fase experimental.
A abordagem aqui descrita pode ser utilizada para muitas aplicações potenciais. Estamos a utilizar este método para definir as respostas comportamentais eliciadas por diferentes subtipos de neurónios, mas também pode ser utilizado para caracterizar o desenvolvimento de respostas comportamentais como o animal amadurece, os efeitos das drogas ou mutantes, ou no comportamento, em combinação com a fisiologia ou imagem, para caracterizar circuitos a jusante activados por um neurônio identificado. Por outro lado, os canais de inibidores, tais como halorhodopsin, poderiam ser utilizados para inibir neurónios específicos dentro de uma rede neural.
Divulgações
Os autores declaram que não têm qualquer interesse financeiro que faça concorrência.
Agradecimentos
Agradecemos Fumi Kubo, Tod Thiele e HerwigBaier (UCSF / Max Planck Institute) para o conselho em experimentos de comportamento e de laser DPSS estabelecidos; Heesoo Kim e Chiara Cerri do Curso de Neurobiologia MBL para auxiliar na Chef-tdTomato experimentos; PetronellaKettunen (Universidade de Gotemburgo ) para colaboração inicial em experimentos optogenética; BaljitKhakh, Eric Hudson, Mike Baca e John Milligan (UCLA) para assessoria técnica, e Roger Tsien (UCSD) para o chef-tdTomato construir. Este trabalho foi financiado por uma concessão NRSA (5F31NS064817) para AMSP e uma bolsa da NSF (RIG: 0819010) para AS.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente / Material | Companhia | Número de catálogo | Comentários |
| Materiais | |||
| Pipeta de Pasteur de vidro | Pescador | 1367820B | ou equivalente (10-15 mm de diâmetro) |
| 200 fibra óptica mM | Thorlabs | AFS200/220Y-CUSTOM | Patch Cord, Comprimento: 3 m, Acabar A: FC / PC End, B: FC / PC, Jacket: FT030 |
| 50 fibra óptica mM | Thorlabs | AFS50/125Y-CUSTOM | Patch Cord, Comprimento: 3 m, Acabar A: FC / PC End, B: FC / PC, Jacket: FT030 |
| Ferramenta de descascamento ajustável | Thorlabs | AFS900 | Ferramenta ou três furos Stripping (FTS4) |
| Diamante escriba Wedge | Thorlabs | S90W | |
| Flaming / Brown Micropipeta Puller | Sutter Instruments | P-97 | ou equivalente |
| Tubo de vidro de borosilicato com filamento | Sutter Instruments | BF-100-78-10 | |
| Molde de injeção | n / a | n / a | Figura 5 |
| 1,5 ml tubos de centrífuga | Qualquer | Qualquer | |
| Placa de petri (100x15 mm) | Qualquer | Qualquer | |
| Petri (60x15 mm) | Qualquer | Qualquer | |
| Pressão injetor | ASI | MPPI-3 | ou equivalente |
| Micromanipulador e metal estande | Narashige | M152 | ou equivalente |
| Pipetas descartáveis de plástico | Fisherbrand | 13-711-7 | ou equivalente |
| Poker (titular Pin e pino Inseto) | Multa Ciência Tools, Inc. | 26018-17 e 26000-70 | ou equivalente |
| Fórceps | Multa Ciência Tools, Inc. | 11255-20 | ou equivalente |
| Microloader ponteiras | Eppendorf | 9300001007 | |
| 28.5 ° C incubadora | qualquer | qualquer | |
| 42 ° C de calor bloco | Qualquer | Qualquer | |
| Não-estéreis lâminas de bisturi # 11 | Belas ferramentas científicas, Inc. | 10011-00 | ou equivalente |
| Dissecando slidar | Zeiss | Stemi | ou equivalente |
| Fluorescente escopo de dissecação com filtro padrão | Qualquer | qualquer | ou equivalente |
| Microscópio confocal | Zeiss | LSM 510 ou 710 | ou objetivos equivalentes com lasers para GFP e RFP, e 10x, 20x e 40x |
| Câmera de alta velocidade | AOS Technologies, Inc. | X-PRI (130025-10) | ou equivalente |
| 473 nm laser portátil | Lasers de cristal | CL-473-050 | ou poder superior, com opção TTL |
| S48 Estimulador | Astro-Med, Inc. divisão Instrumento Grama | S48K | ou equivalente |
| FC PC / para FC / PC manga de acoplamento | Thorlabs | ADAFC1 | Maio need para conexão de cabo óptico |
| Segurança Laser óculos | Thorlabs | LG10 | ou equivalente |
| 24 placas de cultura | Genesee | 25-102 | ou equivalente |
| Solteiro lâminas depressão | Pescador | S175201 | Ou equivalente |
| Reagente | |||
| Instant Ocean | Ecossistemas Aquáticos | IS50 | |
| Azul de metileno | Pescador | S71325 | |
| Vermelho de fenol | Sigma | P4758 | |
| Agarose | EMD | 2125 | ou equivalente |
| Baixa Melt agarose | Sigma | A9045 | ou equivalente |
| PTU | Sigma | P7629 | |
| Tricaina | Sigma | A5040 | |
| água / embrião azul | 10 L DDH 2 O 0,6 g instantânea Oceano 6 gotas de metileno azul | ||
| vermelho de fenol | (5 mg / ml em 0,2 M KCl) | ||
| 100x PTU | 0,150 g PTU 50 ml DDH 2 O dissolver em 70 ° C, agitar frequentemente alíquota e armazenar a -20 ° C | ||
| 1x PTU | 1 ml 100x PTU 99 ml de água azul / peixe | ||
| Tricaina solução estoque | 400 mg tricaina 97,9 DDH 2 O | ||
| ~ 2,1 ml de Tris 1M, pH9.0 | ajustar o pH para 7,0 ~ armazenar em 4 ° C ou -20 ° C para armazenamento a longo prazo |
Referências
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17968-17973 (2009).
- Burgess, H. A., Johnson, S. L., Granato, M. Unidirectional startle responses and disrupted left-right co-ordination of motor behaviors in robo3 mutant zebrafish. Genes Brain Behav. 8 (5), 500-511 (2009).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr. Biol. 18 (15), 1133-1137 (2008).
- Downes, G. B., Granato, M. Supraspinal input is dispensable to generate glycine-mediated locomotive behaviors in the zebrafish embryo. J. Neurobiol. 66 (5), 437-451 (2006).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog. Neurobiol. 68 (2), 85-111 (2002).
- Eisenhoffer, G. T., Rosenblatt, J. Live Imaging of Cell Extrusion from the Epidermis of Developing Zebrafish. J. Vis. Exp. (52), e2689(2011).
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J. Vis. Exp. (26), e1217(2009).
- Kague, E., Weber, C., Fisher, S. Mosaic Zebrafish Transgenesis for Evaluating Enhancer Sequences. J. Vis. Exp. (41), e1722(2010).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating Chimeric Zebrafish Embryos by Transplantation. J. Vis. Exp. (29), e1394(2009).
- Kohashi, T., Oda, Y. Initiation of Mauthner- or non-Mauthner-mediated fast escape evoked by different modes of sensory input. J. Neurosci. 28 (42), 10641-10653 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9 (5), 703-709 (2006).
- Liao, J. C., Haehnel, M. Physiology of afferent neurons in larval zebrafish provides a functional framework for lateral line somatotopy. J. Neurophysiol. 107 (10), 2615-2623 (2012).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Liu, K. S., Fetcho, J. R. Laser ablations reveal functional relationships of segmental hindbrain neurons in zebrafish. Neuron. 23 (2), 325-335 (1999).
- Liu, Y. C., Bailey, I., Hale, M. E. Alternative startle motor patterns and behaviors in the larval zebrafish (Danio rerio). J. Comp. Physiol. A. Neuroethol. Sens Neural. Behav. Physiol. 198 (1), 11-24 (2012).
- Palanca, A. M., Lee, S. L., Yee, L. E., Joe-Wong, C., Trinh, L. A., Hiroyasu, E., Husain, M., Fraser, S. E., Pellegrini, M., Sagasti, A. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev. Neurobiol. , (2012).
- Pujol-Martí, J., Zecca, A., Baudoin, J. P., Faucherre, A., Asakawa, K., Kawakami, K., López-Schier, H. Neuronal birth order identifies a dimorphic sensorineural map. J. Neurosci. 32 (9), 2976-2987 (2012).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
- Szobota, S., et al. Remote control of neuronal activity with a light-gated glutamate receptor. Neuron. 54 (4), 535-545 (2007).
- Uemura, O., et al. Comparative functional genomics revealed conservation and diversification of three enhancers of the isl1 gene for motor and sensory neuron-specific expression. Dev. Biol. 278 (2), 587-606 (2005).
- Wyart, C., Del Bene, F., Warp, E., Scott, E. K., Trauner, D., Baier, H., Isacoff, E. Y. Optogenetic dissection of a behavioural module in the vertebrate spinal cord. Nature. 461 (7262), 407-410 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113(2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados