Method Article
Optogenetische Aktivierung der Zebrafisch Somatosensory Neuronen mit Chef-tdTomato
In diesem Artikel
Zusammenfassung
Optogenetische Techniken haben es ermöglicht, den Beitrag der spezifischen Neuronen zu studieren. Wir beschreiben ein Verfahren in larvalen Zebrafisch zur Aktivierung einzelner somatosensorischen Neuronen Ausdruck einer Channelrhodopsin Variante (Chef) mit einem diodengepumpten Festkörperlaser (DPSS-Laser) und Aufzeichnung der ausgelöste Verhalten mit einem High-Speed-Video-Kamera.
Zusammenfassung
Larven Zebrafisch als Modell für die Beschreibung der Entwicklung und Funktion von einfachen neuronalen Schaltungen entstehen. Aufgrund ihrer äußeren Befruchtung rasante Entwicklung, und Transluzenz werden Zebrafisch besonders gut für optogenetische Ansätze geeignet neuronalen Schaltkreis Funktion zu untersuchen. In diesem Ansatz werden lichtempfindlichen Ionenkanäle in bestimmten Neuronen exprimiert, so dass die Versuchsleiter zu aktivieren oder hemmen sie an Willen und somit beurteilen, ihren Beitrag zur spezifischen Verhaltensweisen. Die Anwendung dieser Methoden in der larvalen Zebrafisch ist konzeptionell einfach, erfordert aber die Optimierung der technischen Details. Hier zeigen wir, ein Verfahren zur Expression eines Channelrhodopsin Variante im Larvenstadium Zebrafisch somatosensorischen Neuronen, photo-aktivierenden Einzelzellen, und Aufzeichnen der resultierenden Verhaltensweisen. Durch die Einführung von ein paar Änderungen an bereits etablierten Methoden, könnte dieser Ansatz verwendet werden, um Verhaltensreaktionen von einzelnen Neuronen aktiviert bis hervorzurufenmindestens 4 Tagen nach der Befruchtung (dpf). Konkret haben wir ein Transgen mit einem somatosensorischen Neuronen Enhancer, CREST3, um den Ausdruck des markierten Channelrhodopsin Variante Chef-tdTomato fahren. Injektion dieses Transgen in 1-Zellen-Stadium Embryonen führt Mosaik Expression in somatosensorischen Neuronen, die mit Konfokalmikroskopie abgebildet werden können. Beleuchten identifizierten Zellen in diesen Tieren mit Licht von einer 473 nm Laser DPSS, geführt durch ein Glasfaserkabel, hervorruft Verhaltensweisen, die mit einer Hochgeschwindigkeits-Videokamera aufgezeichnet und analysiert werden können quantitativ. Diese Technik könnte zur Studie Verhaltensweisen hervorgerufen durch Aktivierung keine Zebrafisch Neuron angepasst werden. Kombiniert mit genetischen oder pharmakologischen Störungen wird eine leistungsfähige Methode zur Schaltung Bildung und Funktion zu untersuchen.
Einleitung
Die Entwicklung optogenetische Verfahren zur Förderung oder Hemmung neuronaler Erregbarkeit mit definierten Wellenlängen von Licht hat es möglich gemacht, um die Funktion der unterschiedlichen Populationen von Neuronen in der neuronalen Schaltkreise Regelung des Verhaltens 1, 19, 21 zu studieren. Diese Technik wird oft verwendet, um Gruppen von Neuronen zu aktivieren, aber es kann auch verwendet werden, um einzelne Neuronen aktiviert werden. Zebrafisch-Larven sind besonders empfänglich zu diesen Methoden, da sie durchsichtig sind, entwickelt ihr Nervensystem schnell, und die Schaffung von transgenen Tieren ist schnell und Routine. Allerdings müssen erhebliche technische Hürden zu überwinden, um sicher zu erreichen einzelnes Neuron aktiviert werden.
Um ein Verfahren zur optogenetische Aktivierung der einzelnen Zebrafisch Neuronen zu optimieren, haben wir uns auf somatosensorischen Neuronen. Zebrafischlarven erkennen eine Vielzahl von somatosensorischen Reize mit zwei Populationen von Neuronen: Trigeminus Neuronen, die den Kopf innervieren und Rohon-Beard (RB) Neuronen, die den Rest des Körpers innervieren. Jedes Neuron trigeminaler und RB projiziert einen peripheren Axon dass Zweige extensiv in der Haut auf Reize und eine zentrale, die Axon stromabwärts neuronalen Schaltkreise verbindet detektieren. Tiere reagieren, so früh wie 21 Stunden nach der Befruchtung (hpf) berühren, was darauf hinweist, dass eine kohärente somatosensorischen Schaltungen 5 gebildet, 18. Während Larvalentwicklung zumindest einige trigeminaler und RB Neuronen Synapse auf die Zelle zu aktivieren Mauthner klassischen Escape Reaktionen, aber vermehrt Hinweise darauf deutet, dass es mehrere Klassen von somatosensorischen Neuronen mit unterschiedlichen Mustern auf die Anbindung, die Variationen des Fluchtverhalten 2, 4 hervorrufen kann, 10, 12, 14, 15, 16, 17. Unsere Motivation zur Entwicklung dieser Verfahren war, die Verhaltens-Funktion von verschiedenen Klassen von Neuronen somatosensorischen charakterisieren, aber dieser Ansatz könnte im Prinzip verwendet werden, um die Funktion von nahezu jedem Neuron oder Population von Neuronen in lar studierenval Zebrafisch.
Douglass et al. Zuvor beschrieben ein Verfahren zur Aktivierung Channelrhodopsin-2-Expression somatosensorischen Neuronen mit blauem Licht, entlocken Fluchtverhalten 3. Ihr Ansatz verwendet ein Enhancer-Element aus dem ISL1 Gen zur Expression von ChR2-EYFP in somatosensorischen Neuronen fahren. Dieses Transgen wurde jedoch berichtet, dass relativ schwache Fluoreszenz anzuzeigen, erfordern Coinjektion eines zweiten Reporters, um UAS :: GFP erlauben Visualisierung der Zellen, die EYFP-ChR2. Dieser Ansatz wurde verwendet, um das Verhalten Antworten zwischen 24-48 hpf entlocken, konnte aber nie eine Reaktion hervor letzten 72 hpf. Während also diese Methode funktioniert für das Studium neuronalen Schaltkreisen in einem sehr frühen Larvenstadien (24-48 hpf), ist es nicht ausreichend für die Charakterisierung von neuronalen Schaltkreisen und Verhaltensreaktionen bei älteren Larven, wenn mehr diverse Verhaltensreaktionen offensichtlich sind und neuronale Schaltkreise sind reifer.
Wir versuchten,Verbesserung der Empfindlichkeit dieser Technik, um die Funktion von Subpopulationen von Larven RB Neuronen zu charakterisieren. Verbesserung der Expression verwendeten wir eine somatosensorischen-spezifischen Enhancer (CREST3) 20, um die Expression von LexA-VP16 und eine Strecke von LexA Operatorsequenzen (4xLexAop) 11 anzutreiben, um die Expression eines fluoreszierend markierten lichtaktivierten Kanal amplifizieren. Diese Konfiguration verstärkten Expression des Kanals, wodurch die Notwendigkeit für Co-Expression eines zweiten Reportergens und es uns ermöglicht, direkt die relative Häufigkeit des Kanals in jedem Neuron. Verwendung des LexA / LexAop Sequenz hatte den zusätzlichen Vorteil, dass es uns, die das Transgen in Zebrafische Linien, die die Reporter-System verwenden Gal4/UAS einzuführen. Transiente Expression dieses Transgen führte in verschiedenen Ebenen des Ausdrucks, sondern war in der Regel robust genug, um sowohl den Zellkörper und axonale Projektionen einzelner Neuronen über mehrere Tage zu visualisieren. Um sensitiv zu optimierenkeit zu beleuchten haben wir das Licht aktiviert Kanal Koch, ein Channelrhodopsin Variante, bestehend aus einer Chimäre channelopsin-1 (Chop1) und channelopsin-2 (CHOP2) mit einem Crossover-Website unter Helix-Schleife EF 13. Dieser Kanal wird bei der gleichen Wellenlänge wie ChR2 aktiviert, sondern erfordert geringere Lichtintensität für die Aktivierung, wodurch es empfindlicher als andere üblicherweise verwendete Kanäle, einschließlich ChR2. Der Küchenchef Protein wurde das rot fluoreszierende Protein, tdTomato verschmolzen, so dass wir für die Proteinexpression ohne Aktivierung des Kanals zu screenen. Als Lichtquelle verwendeten wir einen diodengepumpten Festkörperlaser (DPSS)-Laser, der mit einem faseroptischen Kabel, um eine präzise, High-Power Pulses von blauem Licht auf eine bestimmte Region der Larven zu liefern. Dies erlaubte uns, Laserlicht auf einzelnen Neuronen zu konzentrieren, wodurch die Notwendigkeit für die Suche nach seltenen transgenen Tieren Ausdruck der Kanal in einem einzelnen Neuron. Mit diesem Ansatz konnten wir einzelne RB Neuronen zu aktivieren, notieren Verhaltensreaktions mit einem High-Speed-Video-Kamera und Bild die aktivierten Neuronen bei hoher Auflösung mit der konfokalen Mikroskopie.
Protokoll
Bereiten Sie die folgenden vor der Zeit.
Ein. Bereiten Sie Optic Cable
- Erstellen einer Speichereinheit für die Lichtwellenleiter durch Schmelzen des verjüngten Hals einer Pasteurpipette aus Glas über einem Bunsenbrenner ein ~ 150 °-Winkel zu erzeugen.
- Mit einem Seitenschneider oder einer Rasierklinge schneiden Sie vorsichtig die Glasfaserkabel in zwei Stücke. Jedes Stück sollte einen Ende mit einem FC / PC-Adapter und ein freiliegendes Ende aufweisen. Bewahren Sie ein Stück als Reserve-Kabel.
- Streifen der Lichtwellenleiter auf der Verkleidung durch Entfernen der Fasermantel und Verstärkung Fasern (1A) von 5,0 cm von geschnittenen Ende des Kabels.
- Legen Glasfaserkabel in die vorbereitete Pasteurpipette. Achten Sie darauf, Kabel können leicht bewegen und aus der Pipettenspitze.
- Mit LWL vorstehende von der Spitze des Pasteur Pipette vorsichtig schneiden und entfernen Fasermantel aus der ganzen Glasfaser, ~ 2 mm vom abgeschnittenen Ende.
- Mit einem Diamant-pen / Glasschneider, die Glasfaser nick und brechen off das Ende um einen sauberen Schnitt / Fläche am Ende der Faser (1B) zu schaffen.
- Einfahren Glasfaserkabel in Pasteurpipette für die Lagerung. Wiederholen Sie Schritt (1,6), wenn Spitze des LWL wird gesäumt oder Brüche ungleichmäßig.
- Position Glasfaserkabel in Pasteurpipette mit einem Mikromanipulator (1C).
Verfahren 2-8 beschreiben ein Verfahren zum Einspritzen von Transgenen in Embryonen die allgemein in vielen Experimenten Zebrafisch. Variationen dieses Verfahrens, wie sie in anderen JoVE Videos 6, 7, 8, 9, 22 sind gleich wirksam.
2. Ziehen Sie Injektionsnadeln
- Mit einer Nadel Abzieher, ziehen Borosilicatglasröhren in zwei Injektionsnadeln mit einer allmählich sich verjüngende Spitze. Puller Einstellungen variieren. (Auf einem Sutter Instruments Nadel Abzieher verwenden wir Einstellungen: P = 500, Heat = 720, Pull = 50, Velocity = 70 und Time = 150). Jede Nadel Abzieher ist anders, so zu optimieren, Abzieher-Einstellungen emrisch. Für weitere konischen Nadeln, erhöhen die Wärme-und / oder Pull. Für weniger konischen Nadeln, erhöhen Zeit und / oder Abnahme Pull.
- Laden Nadeln in einer sicheren Containers (dh eine Petrischale mit gewalzten Band, Klebeseite out).
3. Gießen Spritzgussformen
- Melt 0,5 g Agarose in 30 ml Embryo / blauen Wasser, bis Agarose vollständig gelöst hat.
- Gießen Sie in der unteren Hälfte einer Petrischale.
- Zeigen rechteckige Form mit Montage-Bohrungen (Abbildung 2) in Agarose, wobei darauf zu Blasenbildung um den Brunnen zu begrenzen.
- Lassen Agarose zu verfestigen.
- Entfernen Schimmel und füllen Petrischale mit blau / Embryo Wasser.
- Aufrecht lagern, gefüllt mit klarem Wasser, bei Raumtemperatur für den selben Tag Nutzung oder bei 4 ° C für die zukünftige Verwendung.
4. Machen Plasmid DNA Mix für Injektionszwecke
- Plasmid-DNA zu verdünnen zu einer Konzentration von 50 ng / ul mit 1:10 Phenolrot in ddH 2 O. FürBeispiel:
1,0 ml Plasmid-DNA (250 ng / ml) 0,5 ml Phenolrot 3,5 ml ddH 2 O - DNA-Mischung kann bei Raumtemperatur gehalten werden, wenn unter Verwendung sofort oder bei 4 ° C über mehrere Tage.
5. Richten Sie Fügepaaren
Dies sollte den Abend getan werden, bevor Sie zu Injektionen planen.
- Füllen Zuchtbecken mit System Wasser und Ort Männchen und Weibchen zusammen. Wenn Injektionen können nicht so schnell durchgeführt werden, wie Anzeigen leuchten in der Anlage, separate Männchen und Weibchen mit einem Teiler.
6. Bereiten Sie sich für Injektionen (Kann getan während der Wartezeit für Embryonen werden)
- Schalten Sie Injektor rig. Achten Sie darauf, das System so eingestellt ist, pulsieren. Beginnen Sie mit der Impulsdauer auf 1 gesetzt.
- Schalten Sie den AIR Ventil undStellen Sie den Druck Injektor ~ 20 psi.
- Mit einem Binokular bei maximaler Vergrößerung, brechen Spitze der Nadel mit einer Pinzette oder einem Poker um eine ~ 2 um Öffnung (Abbildung 3, Movie 1) zu schaffen.
- Füllen Sie Nadeln mit DNA Mix: 1. Platzieren Sie die Nadel, Spitze nach oben in der DNA-Mix und lassen die Nadel durch Kapillarwirkung oder 2 zu füllen. Mit einem Long-Reach-Spitze 1-2 ul der DNA pipettieren gemischt direkt in die Nadel.
- Platz gefüllt Nadel an einem sicheren Ort, bis die Injektion bereit.
7. Sammle Embryonen
- Nach Anlage leuchtet eingeschaltet haben, entfernen Teiler (falls zutreffend). Sammle Embryonen mit einem Sieb / small Sieb und übertragen Sie sie auf einer Petrischale mit frischem Blau / Embryo Wasser.
8. Inject Embryonen im 1-2 Zell-Stadium
- Übertragen geerntet Embryonen Spritzgussformen mit einem Kunststoff-Pipette.
- Mit einem Binokular, schieben Embryonen inBrunnen mit einer Pinzette oder einem stumpfen Poker (Abbildung 4, Movie 2).
- Zeigen geladenen Nadel in einem Mikromanipulator und Position über Embryonen.
- Kalibrieren Injektionsvolumen durch Einstellen der Impulsdauer in 1-Schritt-Schritten, bis Sie die gewünschte Lautstärke (~ 1 nl) zu erreichen. Dies könnte mit einem Mikrometer Folie kalibriert werden, wie es in einer früheren JoVE Videos 8, 22 beschrieben, aber für dieses Experiment Genauigkeit ist nicht erforderlich, da eine große Anzahl Injektionsvolumina in ausreichender Expression führt.
- Inject ~ 1 nl DNA mischen direkt in die Zelle, und wiederholen Sie für alle Embryonen. DNA kann auch in den Dotter injiziert werden, aber dies neigt dazu, weniger effizient sein (Abbildung 5, Kinofilm 3).
- Entfernen Sie injizierten Embryonen aus der Form mit einem sanften Strom von blau / Embryo Wasser.
- Shop injizierten Embryonen bei 28,5 ° C in der Dunkelheit.
- Entfernen unbefruchteten, beschädigte oder abgestorbene Embryonen periodisch.
- Gönnen Embryonen with PTU zwischen 18-24 hpf zur Pigmentierung verhindern.
9. Screen für Transgene Expression
- Manuelles dechorionate 24-48 hpf Embryonen mit einer Pinzette.
- Anesthetize Larven mit 0,02% Tricain.
- Mit einem fluoreszierenden Seziermikroskop identifizieren Larven mit RB oder Trigeminus Neuron Ausdruck und übertragen Sie diese auf einen neuen Teller mit frischen PTU blau / Embryo Wasser. Embryonen mit spärlichen Ausdruck in leicht identifizierbaren Zellen sind optimal, aber einzelne Neuronen zur Aktivierung mit einem Glasfaserkabel ausgerichtet sein, so ein breites Spektrum des Ausdrucks Dichte ist akzeptabel.
- Laden Embryonen bei 28,5 ° C im Dunkeln bis zur gewünschten Versuchsstadium.
10. Montieren Larven für Behavior Experiments
- Machen 1,5% niedrig schmelzende Agarose in ddH 2 O und Speicher in einem 42 ° C Heizblock es ein Erstarren zu verhindern.
- Verwendung eines Glases Pasteurpipette Übertragung eines der vorbedruckte Larven in eine Wannee von 1,5% niedrig schmelzende Agarose mit so wenig blau / Embryo Wasser wie möglich.
- Übertragen Larven in einem Tropfen Agarose auf eine kleine Petrischale.
- Unter einem Binokular, Position Larve dorsalen up.
- Wenn Agarose erstarrt ist, schneiden Sie das Agarose mit einer dünnen Rasierklinge (# 11 Skalpell), so dass ein Keil aus Agar um den gesamten Larve.
- Machen Sie zwei diagonale Schnitte auf beiden Seiten der Dotter; darauf achten, nicht nick die Larve.
- Füllen Sie den Bereich rund um die Agarose mit Embryo / blauen Wasser.
- Ziehen Agarose vom Rumpf und Schwanz der Larve (Abbildung 6).
11. Bereiten Sie High-Speed Camera and Imaging Software
- Montieren Sie High-Speed-Kamera auf Binokular.
- Schließen Sie die Kamera an den Computer.
- Schalten Sie den Computer ein.
- Schalten Sie High-Speed-Kamera.
- Open video / Imaging-Software (Wir verwenden AOS Imaging-Software und Verfahren für den Einsatz hier zu beschreiben, aber andere bildgebendeSoftware ist gleichermaßen akzeptabel).
- Passen Sie die Kameraeinstellungen entsprechend (dh 1.000 Frames pro Sekunde (fps), 50% Triggerpuffer oder andere Einstellungen).
- Starten Sie die Aufnahme.
12. Aktivieren einzelner Neurone mit einem 473 nm Laser
- Bringen Stimulator, Laser und Lichtwellenleiter.
- Schalten Sie Stimulator.
- Stimulator eingestellt auf maximal 5 Volt und einer Pulsdauer von 5 msec.
- Schalten Sie Laser nach den Anweisungen des Herstellers.
- Verwenden Sie ein Binokular, um die Spitze des optischen Kabels in der Nähe Zellkörper eines Neurons mit Chef-tdTomato Ausdruck (Abbildung 6) zu positionieren.
- Deliver Puls von blauem Licht auf sensorische Neuronen zu aktivieren.
- Rekord Verhalten mit einem High-Speed-Kamera mit 500 oder 1.000 Bildern pro Sekunde.
- Wiederholen Experiment wie gewünscht, wartet 1 Minute zwischen jeder Betätigung zur Gewöhnung zu vermeiden. (Wir nehmen ein Minimum von drei Antworten für jedes Neuron).
- AufRelease Larven, hebeln auseinander Agarose mit einer Pinzette, kümmert sich nicht um das Tier zu verletzen. Dieses Tier erlaubt werden kann, weiter zu entwickeln, und das Verfahren kann in einem höheren Stufe wiederholt werden, um die Entwicklung des Verhaltens zu charakterisieren. Der Embryo kann auch für hochauflösende konfokale Abbildung der aktivierten Zelle Verhalten mit Zellstruktur korrelieren, wie unten beschrieben, wieder montiert werden.
- Übertragen Larve Kultur Teller mit frischem blau / Embryo Wasser. Wir verwenden eine 24-Well-Platte zu verfolgen einzelnen Larven halten.
13. Bild Neuron (en) mit einem Konfokalmikroskop
- Anesthetize Larven mit 0,02% Tricain.
- Berg Larven, dorsalen Seite nach oben in 1,2% niedrig schmelzende Agarose oder in einer dorsalen Form.
- Bild Chef-tdTomato Neuronen mit einem 543-nm-Laser und geeignete Filter und Ziel. Wir verwenden ein 20x-Objektiv.
- Entfernen Larven aus Agarose und zur individuellen Wohlbefindens mit blau / Embryo Wasser.
- Lagerung bei 28,5 ° C im Dunkeln further Analyse.
Ergebnisse

Abbildung 1. Optic-Kabel eingerichtet. (A) Ebenen eines faseroptischen Kabels. (B) Stripped Glasfaserkabels in einer Pasteurpipette. (C) LWL-Kabel in Pasteurpipette positioniert mit einem Mikromanipulator.

Abbildung 2. Spritzgießwerkzeug Vorlage.

Abbildung 3. (Movie 1). Brechen Sie die Nadel.

Abbildung 4. (Movie 2). Anordnen Embryonen in die Spritzgußform.
ther.within-page = "always"> 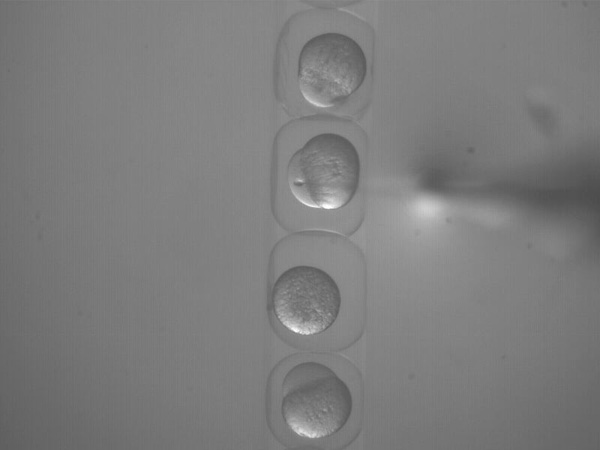
Abbildung 5. (Film 3). Injektion von 1 nl DNA-Mischung in 1-Zell-Stadium Embryos.
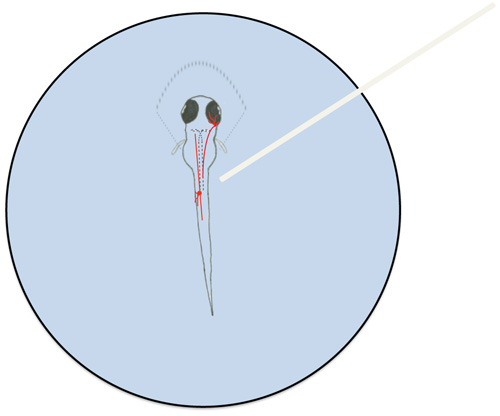
Abbildung 6. Schematische Darstellung einer montierten Zebrafischlarve und repräsentative Neuronen im Larvenstadium Touch Response beteiligt. Zebrafisch-Larven wurden teilweise bei 1,5% niedrig schmelzende Agarose (dargestellt durch gestrichelte Linien rund um den rostralen Teil der Larve) montiert. Eine Trigeminus-Neuron (im Kopf) und ein Rohon-Beard Neuron (im Kofferraum) sind rot dargestellt. Mauthner Zellen werden durch gestrichelte Linien in der Larve skizziert. Die Optik-Kabel (weiß) ist gezeigt, über die RB Neuron Zellkörper.
oad/50184/50184fig7.jpg "alt =" Abbildung 7 "fo: content-width =" 5in "fo: src =" / files/ftp_upload/50184/50184fig7highres.jpg "/>
Abbildung 7. (Movie 4). Aktivierung eines einzelnen RB Neuron expressingChEF löst eine Verhaltensreaktion. (A) Standbilder darstellen Aktivierung eines einzelnen Neurons RB Ausdruck Chef-tdTomato. Einzelne Neurone wurden von einem 5 ms Impuls von einem 473 nm blauen Laser über ein 200 um Glasfaserkabel aktiviert. Speisespannung der blauen Laser wurde bei einer maximal 5 Volt eingestellt. Die daraus resultierende Verhalten wurde bei 1.000 Frames pro Sekunde von einem High-Speed-Kamera aufgenommen. (B) Die konfokale Mikroskopie wurde verwendet, um Bild die aktivierten RB Neurons. Der Pfeil zeigt Region im Verhalten Stills stimuliert. (C) vergrößertes Bild der RB Neuron angegeben in (B). Maßstab, 100 um. (Movie 5 und 6) gleiche Fisch, (Film 5) Trigeminus Aktivierung (Movie 6) RB Neuron über yolk Erweiterung.p_upload/50184/50184fig7large.jpg "target =" _blank "> Klicken Sie hier für eine größere Abbildung zu sehen.

Abbildung 8. Latency des Verhaltens unter verschiedenen Bedingungen. Für die meisten Experimente, die wir ein einzelnes Neuron in ~ 35 hpf Larven Ausdruck Chef-tdTomato mit einem 5 ms Impuls von einem 473 nm blauen Laser mit einer 5-V-Quelle (Abbildung 6) angetrieben aktiviert. Zum besseren Verständnis der Dynamik der Chef Aktivierung, variierten wir Parameter auf ihre Wirkung auf das Verhalten bestimmen. (A) Die Dauer der Licht-Stimulation (5 msec versus 10 ms) nicht beeinflusst Latenz, wenn ab Beginn der Lichtimpuls quantifiziert. (B) bei ~ 35 hpf, Spannung umgekehrt beeinflusst Latenz. Niedrigeren Spannungen in Folge einer Erhöhung der Latenz von Bewegung. Für unsere Experimente verwendeten wir die maximale Spannung (5 V) permissible für unsere Laservorrichtung, die zuverlässig stereotype Verhaltensweisen, die von den meisten hell-exprimierenden RB Neuronen hervorgerufen.

Abbildung 9. (Movie 7). Aktivierung der Chef-tdTomato Ausdruck RB Neuronen in 60 hpf Larven. (A) Standbilder darstellen Aktivierung von RB Neuronen, Chef-tdTomato von einem 10 ms-Impuls von einem 473 nm blauen Laser über ein 200 um Glasfaserkabel. Die daraus resultierende Verhalten wurde bei 1.000 Frames pro Sekunde von einem High-Speed-Kamera aufgenommen. (B) Konfokale Mikroskopie wurde verwendet, um das Bild aktivierten RB Neuron (en). Der Pfeil zeigt Region im Verhalten Stills stimuliert. Maßstab, 100 um.
 o: src = "/ files/ftp_upload/50184/50184fig10highres.jpg" />
o: src = "/ files/ftp_upload/50184/50184fig10highres.jpg" />
Abbildung 10. (Movie 8). Aktivierung der Chef-tdTomato Ausdruck RB Neuronen in 4 dpf Larven. Standbilder darstellen Aktivierung von RB Neuronen, Chef-tdTomato von einem 20 ms-Impuls von einem 473 nm blauen Laser über ein 200 um Glasfaserkabel. Die resultierende Verhalten wurde bei 1000 Frames pro Sekunde mit einer Hochgeschwindigkeits-Kamera aufgenommen.
Movie 1. Klicken Sie hier, um Film anzusehen .
Movie 2. Klicken Sie hier, um Film anzusehen .
Movie 3. Klicken Sie hier, um Film anzusehen .
Movie 4.ttp :/ / www-jove-com.remotexs.ntu.edu.sg/files/ftp_upload/50184/50184movie4.mpg "target =" _blank "> Klicken Sie hier, um Film zu sehen.
Movie 5. Klicken Sie hier, um Film anzusehen .
Movie 6. Klicken Sie hier, um Film anzusehen .
Movie 7. Klicken Sie hier, um Film anzusehen .
Movie 8. Klicken Sie hier, um Film anzusehen .
Diskussion
Wir haben einen Ansatz für optogenetische Aktivierung der einzelnen RB Neuronen im Live Zebrafisch beschrieben. Unsere Methode beschäftigt transiente Transgenese einen fluoreszenzmarkierten Channelrhodopsin Variante Chef-tdTomato 13, in bestimmten somatosensorischen Neuronen auszudrücken. Dieser Ansatz könnte leicht zur Verwendung in anderen larvalen Zebrafisch Zellpopulationen angepasst werden.
Mit diesem Ansatz konsequent ausgelöst Verhaltensreaktionen 34 bis 48 hpf Larven Ausdruck Chef-tdTomato. Mit einem 5 ms Impuls von blauem Licht bei 5 V, konnten wir einzelne RB Neuronen (Abbildung 7) zu aktivieren. Durch Positionieren der optischen Faser an verschiedenen Stellen entlang des Tieres, fanden wir, dass es notwendig war, die blaues Licht direkt zielen auf einen Zellkörper eine Behavioral Antwort hervorzurufen. Lichtpulse nicht zu entlocken eine Reaktion von Larven, die nicht ausdrücken wollte Koch. Darüber hinaus Lichtpulse entlang der zentralen Axon oder dem peripheren Axonen nie löste eine Reaktion even im Junglarven (Daten nicht gezeigt). Diese Eigenschaft war vorteilhaft, da wir zuversichtlich könnte aktivieren einzelner Neuronen bei Tieren, in denen mehrere Neuronen markiert wurden, auch wenn die zentralen Axone anderer Neuronen weitergegeben in der Nähe der gezielten Neurons Zellkörper (Movie 4-6).
Um die Zuverlässigkeit des Ansatzes zur Beurteilung kinematischen Parametern zu testen, haben wir die Latenz der Flucht Reaktion (die Zeit vom Lichtaktivierung an Verhaltensreaktion) zwischen 40 und 48 hpf, ein Parameter, der bekanntlich sehr stereotype wird. Um festzustellen, ob die Dauer der Lichtreiz beeinflusst Neuron Aktivierung beleuchtet wir Zielneuronen für 5 oder 10 ms (8A). Da das Verhalten Latenz in beiden Bedingungen waren die gleichen, wenn vom Beginn des Lichtimpulses berechnet schlossen wir, dass die Dauer des Lichtimpulses nicht beeinflusste Latenzzeit des Verhaltens. Allerdings haben wir feststellen, dass die Verringerung der Spannung erhöht the Latenz eines Verhaltens (Abbildung 8B). Bei 5 V jedoch viele Reaktionen (9 von 16 Fischen) betrugen 20 ± 5 ms, ähnlich der Latenz für natürliche Fluchtreaktionen gemeldet. So aktivieren Neuronen mit 5 V nähert maximale Aktivierung.
Parameter für die effektive Auslösung Verhaltensreaktionen von der Aktivierung einzelner RB Neuronen in älteren Larven variiert. Wir haben erfolgreich ausgelöst Verhaltensreaktionen von Tieren so alt wie die 4 dpf, wesentlich später als bisher gemeldet. Allerdings, während die Aktivierung der einzelnen RB Neuronen mit einem 5 ms Lichtpuls bei 5 V konsequent zu einer Verhaltensreaktion vor 48 hpf, Aktivierung der älteren Larven (> 60 hpf) war nicht so konsequent. Längeren Pulsen (10-100 msec) des Lichts waren oft notwendig, Neuronen in älteren Larven (Abbildung 9 und 10, Film 7 bzw. 8) zu aktivieren. Daher kann Aktivierungsparameter müssenoptimiert / kalibriert werden basierend auf experimentellen Stadium.
Der Ansatz beschreiben wir hier könnte für viele potentielle Anwendungen verwendet werden. Wir benutzen dieses Verfahren die Verhaltensreaktionen ausgelöst durch verschiedene Subtypen von Neuronen definieren, aber es könnte auch verwendet werden, um die Entwicklung von Verhaltensreaktionen charakterisieren das Tier reift, die Wirkungen von Arzneimitteln oder Mutanten auf Verhalten, oder, in Kombination mit der Physiologie oder Bildgebung, nach stromabwärts Schaltungen durch einen identifizierten Neuron aktiviert charakterisieren. Umgekehrt könnte inhibitorische Kanäle wie Halorhodopsin, verwendet, um spezifische Neuronen innerhalb eines neuronalen Netzwerks zu hemmen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanzielles Interesse haben.
Danksagungen
Wir danken Fumi Kubo, Tod Thiele und HerwigBaier (UCSF / Max-Planck-Institut) zur Beratung über das Verhalten Experimente und DPSS-Laser eingerichtet; Heesoo Kim und Chiara Cerri aus der MBL Neurobiologie Kurs für die Unterstützung in der Chef-tdTomato Experimente; PetronellaKettunen (University of Gothenburg ) für die erste Zusammenarbeit auf optogenetische Experimente; BaljitKhakh, Eric Hudson, Mike Baca und John Milligan (UCLA) für technische Beratung und Roger Tsien (UCSD) für den Chef-tdTomato konstruieren. AS: Diese Arbeit wurde durch ein NRSA (5F31NS064817) Auszeichnung AMSP und einem Zuschuss von der NSF (0.819.010 RIG) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenz / Material | Firma | Catalog Number | Kommentare |
| Materialien | |||
| Glas Pasteurpipette | Fischer | 1367820B | o. dgl. (10-15 mm Durchmesser) |
| 200 &mgr; Glasfaser | Thorlabs | AFS200/220Y-CUSTOM | Patchkabel, Länge: 3 m, A: FC / PC, B: FC / PC, Jacket: FT030 |
| 50 um Glasfaser | Thorlabs | AFS50/125Y-CUSTOM | Patchkabel, Länge: 3 m, A: FC / PC, B: FC / PC, Jacket: FT030 |
| Einstellbare Stripping Tool | Thorlabs | AFS900 | oder Drei-Loch Stripping Tool (FTS4) |
| Diamant Wedge Schreiber | Thorlabs | S90W | |
| Flaming / Brown Feinpipettenziehvorrichtung | Sutter Instruments | P-97 | oder gleichwertige |
| Borosilicatglasröhren mit Filament | Sutter Instruments | BF-100-78-10 | |
| Spritzgießwerkzeug | n / a | n / a | Abbildung 5 |
| 1,5 ml Zentrifugenröhrchen | Jeder | Jeder | |
| Petrischale (100x15 mm) | Jeder | Jeder | |
| Petrischale (60x15 mm) | Jeder | Jeder | |
| Injektor | ASI | MPPI-3 | oder gleichwertige |
| Mikromanipulator und Metallständer | Narashige | M152 | oder gleichwertige |
| Einweg-Pipetten | Fisherbrand | 13-711-7 | oder gleichwertige |
| Poker (Pin Halter und Insekten pin) | Fine Science Tools, Inc. | 26018-17 und 26000-70 | oder gleichwertige |
| Zange | Fine Science Tools, Inc. | 11255-20 | oder gleichwertige |
| Microloader Pipettenspitzen | Eppendorf | 9300001007 | |
| 28,5 ° C Inkubator | jeder | jeder | |
| 42 ° C Heizblock | Jeder | Jeder | |
| Non-Sterile Skalpellklingen Nr. 11 | Feine Scientific Tools, Inc. | 10011-00 | oder gleichwertige |
| Sezieren szurechtkommen | Zeiss | Stemi | oder gleichwertige |
| Fluorescent Binokular mit Standard-Filter | Jeder | jeder | oder gleichwertige |
| Konfokalmikroskop | Zeiss | LSM 510 oder 710 | oder gleichwertig mit Lasern für GFP und RFP und 10x, 20x und 40x |
| High-Speed-Kamera | AOS Technologies, Inc. | X-PRI (130025-10) | oder gleichwertige |
| 473 nm tragbare Laser | Kristall-Laser | CL-473 bis 050 | oder höhere Macht, mit TTL-Option |
| S48 Stimulator | Astro-Med, Inc. Grass Instrument Division | S48K | oder gleichwertige |
| FC / PC auf FC / PC Verbindungshülse | Thorlabs | ADAFC1 | May need für LWL-Verbindung |
| Laserschutzbrillen | Thorlabs | LG10 | oder gleichwertige |
| 24 Petrischalen | Genesee | 25-102 | oder gleichwertige |
| Einzel Depressionen Dias | Fischer | S175201 | Oder gleichwertig |
| Reagens | |||
| Instant Ocean | Aquatic Ecosystems | IS50 | |
| Methylenblau | Fischer | S71325 | |
| Phenolrot | Sigma | P4758 | |
| Agarose | EMD | 2125 | oder gleichwertige |
| Low Melt Agarose | Sigma | A9045 | oder gleichwertig |
| PTU | Sigma | P7629 | |
| Tricaine | Sigma | A5040 | |
| blau / Embryo Wasser | 10 L ddH 2 O 0,6 g Instant Ocean 6 Tropfen Methylenblau | ||
| Phenolrot | (5 mg / ml in 0,2 M KCl) | ||
| 100x PTU | 0,150 g PTU 50 ml ddH 2 O lösen sich bei 70 ° C, oft schütteln aliquotieren und bei -20 ° C | ||
| 1x PTU | 1 ml 100x PTU 99 ml blau / Fisch Wasser | ||
| Tricaine Stammlösung | 400 mg Tricain 97,9 ddH 2 O | ||
| ~ 2,1 ml 1M Tris, pH 9,0, | pH-Wert auf ~ 7,0 store in 4 ° C oder -20 ° C für die langfristige Lagerung |
Referenzen
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17968-17973 (2009).
- Burgess, H. A., Johnson, S. L., Granato, M. Unidirectional startle responses and disrupted left-right co-ordination of motor behaviors in robo3 mutant zebrafish. Genes Brain Behav. 8 (5), 500-511 (2009).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr. Biol. 18 (15), 1133-1137 (2008).
- Downes, G. B., Granato, M. Supraspinal input is dispensable to generate glycine-mediated locomotive behaviors in the zebrafish embryo. J. Neurobiol. 66 (5), 437-451 (2006).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog. Neurobiol. 68 (2), 85-111 (2002).
- Eisenhoffer, G. T., Rosenblatt, J. Live Imaging of Cell Extrusion from the Epidermis of Developing Zebrafish. J. Vis. Exp. (52), e2689(2011).
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J. Vis. Exp. (26), e1217(2009).
- Kague, E., Weber, C., Fisher, S. Mosaic Zebrafish Transgenesis for Evaluating Enhancer Sequences. J. Vis. Exp. (41), e1722(2010).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating Chimeric Zebrafish Embryos by Transplantation. J. Vis. Exp. (29), e1394(2009).
- Kohashi, T., Oda, Y. Initiation of Mauthner- or non-Mauthner-mediated fast escape evoked by different modes of sensory input. J. Neurosci. 28 (42), 10641-10653 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9 (5), 703-709 (2006).
- Liao, J. C., Haehnel, M. Physiology of afferent neurons in larval zebrafish provides a functional framework for lateral line somatotopy. J. Neurophysiol. 107 (10), 2615-2623 (2012).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Liu, K. S., Fetcho, J. R. Laser ablations reveal functional relationships of segmental hindbrain neurons in zebrafish. Neuron. 23 (2), 325-335 (1999).
- Liu, Y. C., Bailey, I., Hale, M. E. Alternative startle motor patterns and behaviors in the larval zebrafish (Danio rerio). J. Comp. Physiol. A. Neuroethol. Sens Neural. Behav. Physiol. 198 (1), 11-24 (2012).
- Palanca, A. M., Lee, S. L., Yee, L. E., Joe-Wong, C., Trinh, L. A., Hiroyasu, E., Husain, M., Fraser, S. E., Pellegrini, M., Sagasti, A. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev. Neurobiol. , (2012).
- Pujol-Martí, J., Zecca, A., Baudoin, J. P., Faucherre, A., Asakawa, K., Kawakami, K., López-Schier, H. Neuronal birth order identifies a dimorphic sensorineural map. J. Neurosci. 32 (9), 2976-2987 (2012).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
- Szobota, S., et al. Remote control of neuronal activity with a light-gated glutamate receptor. Neuron. 54 (4), 535-545 (2007).
- Uemura, O., et al. Comparative functional genomics revealed conservation and diversification of three enhancers of the isl1 gene for motor and sensory neuron-specific expression. Dev. Biol. 278 (2), 587-606 (2005).
- Wyart, C., Del Bene, F., Warp, E., Scott, E. K., Trauner, D., Baier, H., Isacoff, E. Y. Optogenetic dissection of a behavioural module in the vertebrate spinal cord. Nature. 461 (7262), 407-410 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113(2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten