Method Article
Um modelo murino de treinamento muscular por eletroestimulação neuromuscular
Neste Artigo
Resumo
Um modelo murino de estimulação eléctrica neuromuscular (EENM), uma modalidade segura e barata clínica, para os músculos do compartimento anterior é descrito. Este modelo tem a vantagem de a modificação de um dispositivo facilmente disponível clínica para a finalidade de obter contracções musculares segmentados e específicos em ratos.
Resumo
Estimulação elétrica neuromuscular (EENM) é uma modalidade clínica comum, que é amplamente usado para restaurar 1, manter 2 ou melhorar a capacidade muscular funcional 3-5. Estimulação da superfície transcutânea do músculo esquelético envolve um fluxo de corrente entre um cátodo e um ânodo, provocando assim a excitação da unidade de motor e as fibras musculares circundantes.
EENM é uma modalidade atraente para avaliar as respostas do músculo esquelético adaptativos por várias razões. Primeiro, ele fornece um modelo reprodutível experimental, no qual adaptações fisiológicas, tais como fibra muscular hipertrofia muscular e fortalecimento 6, a angiogénese 7-9, a secreção do factor de crescimento 9-11, e activação de células de músculo precursor 12 estão bem documentados. Tais respostas fisiológicas podem ser cuidadosamente titulada utilizando diferentes parâmetros de estimulação (para revisão Cochrane, ver 13). Além disso, a EENM recrutasunidades motoras não-selectivamente, e de uma forma espacialmente fixada e temporalmente síncrono 14, oferecendo a vantagem de exercer um efeito do tratamento sobre todas as fibras, independentemente do tipo de fibra. Apesar de existirem contra-indicações específicas para EENM em populações clínicas, incluindo doenças venosas periféricas ou neoplasias, por exemplo, a EENM é seguro e viável, mesmo para aqueles que estão doentes e / ou acamados e para as populações em que o exercício rigoroso pode ser um desafio.
Aqui, nós demonstrar o protocolo para a adaptação eléctrodos comercialmente disponíveis e realizando um protocolo de EENM utilizando um modelo de murino. Este modelo animal tem a vantagem de utilizar um dispositivo clinicamente disponível e fornecendo feedback instantâneo sobre o posicionamento do eléctrodo para eliciar o efeito desejado músculo contráctil. Para o propósito deste manuscrito, vamos descrever o protocolo para a estimulação do músculo dos músculos compartimento anterior de um membro posterior do rato.
Protocolo
1. Preparação do eletrodo
- Corte de 1 cm x 1 cm de seção da placa de circuito vetor.
- Estabilize 2 pinos WIREWRAP usando uma pegada vice, com pinos espaçados cerca de 3,5 mm. As extremidades bifurcadas dos pinos deve ser voltada para cima.
- Dobre WIREWRAP pinos em um ângulo de 90 °, aproximadamente a meio caminho ao longo de seu comprimento, usando alicates needlenose.
- Expor os fios de cobre de conectores, de aproximadamente 7 cm de conexão chumbo, por retirar o isolamento do fio.
- Solda um dos fios de cobre para a extremidade bifurcada de um dos pinos WIREWRAP. Repita o passo de solda para o pino WIREWRAP outro.
- Puxe encolher tubulação na conexão soldada entre fios de cobre e alfinetes de ouro, a fim de isolar e estabilizar. Aquecer a tubagem usando a ponta de solda.
- Coloque as pontas dos pinos unsoldered WIREWRAP nas aberturas adjacentes da placa de circuito breadboard.
- Assegurar que os pinos WIREWRAP são paralelos um ao outro, e stick através da breadboard de modo que as pontas estão localizados à mesma distância quando colocado através da placa.
- Encaixe as extremidades soldadas dos pinos em epóxi claro. Permitir que o epoxi para curar durante aproximadamente 10 minutos, ou até completamente seca.
- Repetir a aplicação de epóxi até que os pinos e placa de circuito vector são completamente imersos no fim de proporcionar uma integridade estrutural e de alívio de tensão para os cabos.
- Areia para baixo o epoxi utilizando uma lima de metal para expor as pontas dos pinos de ouro.
- Use um multímetro para garantir que os dois protagonistas não são eletricamente curto-circuito e que os cabos tenham continuidade adequada
- Fixe o eletrodo conduz a partir do dispositivo EENM para conector de fios fêmea de 2 vias (Pomona patch cord).
2. Preparação dos animais
- Os animais são anestesiados por inalação usando isofluorano 2% (Abbott Laboratories, North Chicago, IL) em 100% de O2 de gás. O animal deve permanecer anestesiado durante tele NMES sessão.
- Antes de iniciar o protocolo de EENM executar uma pitada dedo do pé para assegurar que o animal é totalmente anestesiado.
- Animal deve ser regularmente verificados para a resposta à estimulação de modo a assegurar o nível de anestésico é suficiente. A anestesia deve ser ajustada conforme necessário. Outro movimento do que a da perna estimulada, alterações na profundidade respiratória, e cor das membranas mucosas devem todos ser avaliada regularmente para monitorizar a profundidade da anestesia.
- Coloque o animal em decúbito lateral.
- Aplicar lubrificante oftálmica para os olhos, a fim de evitar a secagem da córnea durante o procedimento.
- Raspar a área membro posterior a ser tratada, e limpar com álcool.
- Limpe o eletrodo com água sanitária 3%, em seguida, enxaguar com água.
- Aplicar uma camada de gel condutor sobre o local onde o eléctrodo será aplicado. Reaplique quando necessário durante todo o protocolo de EENM para garantir o fluxo de corrente entre o eletrodo ea pele.
- Um calor da lâmpada or cobertor de água circulante deve ser usado para manter gamas normais do corpo do núcleo.
- Nota: Todos os procedimentos foram revistos e aprovados pelo Animal Care Universidade de Pittsburgh e do Comitê Institucional de Uso e realizado em PHS segurados ea AAALAC Int. programa credenciado e instalações.
3. Estimulação
- A colocação do eletrodo:
- Para a estimulação dos músculos compartimento anterior, incluindo o músculo tibial anterior e do músculo longus extensor digitorum, colocar o eléctrodo de superfície directamente sobre o nervo profunda do animal fibular, que é uma sucursal distai fora do nervo fibular comum, e está localizado apenas anterior à do cabeça da fíbula.
- Para a estimulação dos músculos do compartimento anterior, a colocação do eletrodo é confirmada quando a estimulação provoca dorsiflexão do tornozelo plena e completa extensão dos dígitos. Por outro lado, dorsiflexão, na ausência de extensão dígito sugere que apenas ante o tibialrior do músculo está sendo estimulada. Tal resposta contráctil alvo pode ser desejável, dependendo desenho do estudo.
- A contracção muscular é dividido em 2 fases de estimulação: um movimento livre, fase concêntrica, que ocorre durante o processo inicial ~ 0,5 segundos. Durante esta primeira fase, a pata se move de uma posição de descanso para dorsiflexão máxima e extensão dígito. A segunda fase de estimulação é uma contração isométrica sustentada no fim-range dorsiflexão e extensão dígito.
- Os parâmetros de estimulação:
- Este modelo utiliza a EENM 300 PV Empi dispositivo eletroterapia multifuncional, que oferece 2 canais de EENM convencionais (ver tabela). Para os fins do presente modelo, apenas o canal 1 é usado.
- Parâmetros utilizados incluem simétrica forma de onda, uma duração de pulso de 150 ms e uma frequência de 50Hz. Tempo de estimulação é definido como 5 segundos, com uma rampa de 0,5 segundo e 0,5 segundo de uma rampa para baixo. Isto irá permitir que o músculo se mais gradualmente acclicompanheiro à estimulação. No protocolo de corrente, tempo de pausa entre as contrações foi ajustado para 10 segundos, mas este pode ser ajustado em função do efeito desejado. Diminuiu off vezes irá resultar em uma iniciação mais rápida da fadiga muscular. Estes parâmetros de estimulação foram baseados em protocolos clínicos concebidos para melhorar a força muscular usando estimulação eléctrica neuromuscular, sem induzir danos músculo esquelético significativo 1, 15, 16.
- Ratos concluir duas séries de 10 contrações, com um descanso de 5 minutos entre as séries.
- Para animais adultos, a intensidade da EENM é geralmente iniciada às 9 mA. Pela nossa experiência, este é aproximado com a intensidade máxima de partida que não induz uma alteração da marcha perceptível imediatamente após a estimulação. Para as sessões subsequentes NMES, a intensidade é aumentada de 1 mA cada vez que os animais são capazes de completar 20 dorsiflexions completos.
- Após a conclusão da estimulação protocolo e recomuito da anestesia, os animais normalmente demonstram uma marcha normal e postura. Gait deve permanecer intacta durante toda a duração do programa EENM.
4. Os resultados representativos
O protocolo de EENM descrito neste artigo foi implementada em várias linhagens de camundongos, incluindo: tipo selvagem (B6/10), B6.SCID e mdx / mice SCID. Os resultados representativos da EENM realizadas durante 4 semanas (20 sessões) em 3-5 meses de idade mdx / SCID são apresentados.
Os animais foram sacrificados humanamente por deslocamento cervical e sob anestesia. O músculo tibial anterior foi colhido e imediatamente congelados em C. 2-metil-butano pré-arrefecidos em azoto líquido e armazenado a -80 ° Serial secções transversais (10 mm) foram obtidos e montado em lâminas. As análises estatísticas foram realizadas utilizando padrão de pacotes de software de estatística (SPSS, v19.0 software). Primeiro, teste de Levene foi utilizado para avaliar se há was igualdade de variâncias. Amostras independentes t-teste foi então realizada para investigar as diferenças entre EENM e grupos de controle.
Hematoxilina e eosina (H & E) as manchas foram realizados para investigar se o protocolo de EENM poderia resultar em lesões aumentou no músculo distrófico. Uma seção foi selecionada e imagens foram obtidas utilizando um microscópio de luz (Nikon Eclipse E800, Nikon, Japão). O número total de fibras e do número de fibras com núcleos localizado centralmente foram manualmente contadas utilizando o National Institutes of Health (NIH) - software de análise de imagem desenvolvido, Imagem J. Não houve aumento significativo do índice de regeneração (número de fibras centralmente nucleadas / número total de fibras) nos animais submetidos à EENM, em comparação com os controlos (p = 0,802; Figura 1). Isto sugere que a aplicação de EENM não aumenta a cascata degeneração-regeneração observada em animais distróficos, e é, portanto, não é provávela ser induzir uma lesão do músculo aumentada.
A coloração de imunofluorescência para CD31 foi realizada para investigar o efeito do protocolo de EENM de 4 semanas em vascularização do músculo. Resumidamente, as secções do músculo foram fixadas em formalina a 4% e bloqueadas com 5% de soro de cavalo (HS). As secções foram incubadas com um anticorpo de rato anti-rato primária (1:300 de diluição em HS 5%) e tratado com um 555-cabra marcado com anticorpo secundário anti-rato (1:300 de diluição em HS 5%). Para quantificar o número total de células positivas CD31, uma secção foi seleccionado, e fotografados usando microscopia de fluorescência (Nikon Eclipse E800, Japão). O número total de capilares foi manualmente contadas utilizando Northern Eclipse Software (Empix Imaging Inc.). Houve um aumento significativo no número de células positivas CD31 nos animais submetidos à EENM quando comparado com os controlos (p <0,01; Figura 2), indicando que o protocolo de EENM como descrito promove a angiogénese do músculo esquelético.
Em testes in situ contrátil: Quatro semanas após a conclusão de um protocolo de EENM, testes contrátil dos músculos do compartimento anterior foi realizada, utilizando um aparelho de ensaios in situ (Modelo 809B, Aurora Scientific Inc, Canadá), estimulador (modelo 701C, Aurora Scientific Inc , Canadá), ea força de transdutor (Aurora Scientific Inc., Canadá). Resumidamente, o nervo peroneal de animais anestesiados foi isolado através de uma pequena incisão lateral para o joelho. Os ratinhos foram então colocado em decúbito dorsal em uma plataforma e do pé a ser testado foi posicionada sobre a platina. O membro posterior utilizado para testes foi estabilizado com fita de tecido no joelho e do pé. Músculos foram estimulados através de um gancho de eletrodos inseridos sob a pele. A contração muscular tetânica foi testado em uma freqüência de 150Hz 350ms para investigar se a 4 semanas de protocolo de EENM seria induzir melhorias na força muscular. Os resultados foram normalizados para peso do músculo molhado. Houve um aumento de aproximadamente 30% na tetanIC contração de animais submetidos à EENM, quando comparados aos controles (p = 0,005) (Figura 3), sugerindo que o protocolo descrito melhora a força muscular esquelética em mdx / SCID animais.

. Figura 1 Hematoxilina & Eosina músculo esquelético de distrófica (mdx) / camundongos imunodeficientes (4-5 meses) (10x): A) controles não tratados, B) após 4 semanas de EENM.
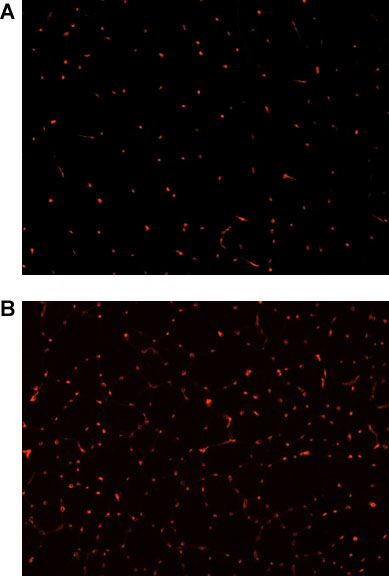
Figura 2. CD31 imunofluorescência (vermelho), como um marcador de vascularização do músculo esquelético, no músculo esquelético de distrófica (MDX) / ratinhos imunodeficientes (4-5 meses) (ampliação de 20x) A) controlos não tratados, B) após 4 semanas de EENM.
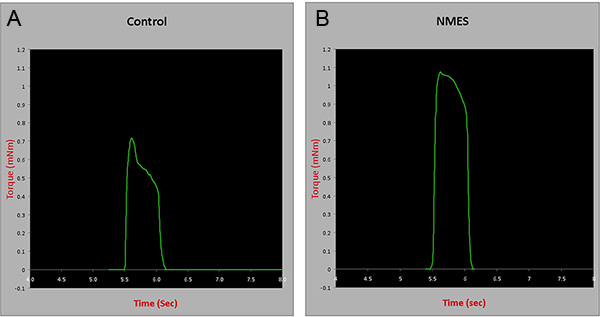
Figura 3. Testes Contrátildos músculos compartimento anterior no controlo e animais tratados com EENM durante 4 semanas. mNm = metros mili Newton. Clique aqui para ver maior figura .
Discussão
Estes resultados sugerem que o nosso modelo desenvolvido murino de EENM promove a angiogénese no músculo esquelético (Figura 2) e reforço (Figura 3), mas não induz danos no músculo esquelético (Figura 1).
Deve notar-se que os parâmetros de estimulação aqui descritos foram concebidos para induzir um músculo sobrecarga para os músculos do compartimento anterior. Tal como é o caso para cenários clínicos, a colocação do eléctrodo pode ser ajustada para estimular a outros grupos musculares, embora a resposta do músculo à EENM pode ser diferente, dependendo da composição do tipo de fibra. EENM duração, o número total de sessões de tratamento, eo número total de repetições pode ser modificada de acordo com a concepção do estudo.
Como acontece com qualquer protocolo, este método apresenta limitações que devem ser observadas. No presente estudo, a estimulação foi realizada ao longo do nervo fibular profundo. No entanto, na prática clínica, a estimulação is tipicamente administrado na unidade de motor. No modelo animal, a estimulação do nervo exigiria uma menor intensidade, a fim de provocar a contração do músculo inteiro. Outra limitação do modelo, como é a de que somos incapazes de obter informações sobre nível de conforto durante a aplicação da EENM, dado que os animais são anestesiados. Portanto, a tolerabilidade de intensidades comparáveis em uma população clínica é difícil de avaliar. No entanto, os nossos resultados sugerem histológicos nosso modelo EENM, como descrito, não induz lesões musculares.
O desenvolvimento de modelos animais que imitam modalidades comumente implementadas na clínica nos fornecer ferramentas úteis de laboratório que permite uma melhor compreensão das respostas celulares e moleculares para intervenções terapêuticas. Além disso, tais modelos são úteis para conduzir estudos pré-clínicos tanto para refinar protocolos de reabilitação existentes e desenvolver novos indicações.
Divulgações
Não temos nada a divulgar.
Agradecimentos
Este trabalho foi financiado pelo National Institutes of Health (NIH) K12 para físicos e terapeutas ocupacionais abrangente Oportunidades de Capacitação em Pesquisa em Reabilitação (K12 HD055931), a Fundação de Fisioterapia e do Pittsburgh Claude D. Pimenta americanos mais velhos Independência Centro (P30 AG024827 ).
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Vector mensagens wire wrap com terminal de solda bifurcada | Newark | T68 | |
| Vector placa de circuito | Newark | 3662-2 | |
| Pomona patch cord | Newark | P-36-0 | |
| 5 minutos epóxi | VO Baker Co. | 4001 | |
| Spectra Gel Eletrodo 360 | Milliken Medical | MR41217 | |
| Dispositivo de estimulação portátil neuromuscular | EMPI | 300PV |
Referências
- Snyder-Mackler, L., Delitto, A., Bailey, S. L., Stralka, S. W. Strength of the quadriceps femoris muscle and functional recovery after reconstruction of the anterior cruciate ligament. A prospective, randomized clinical trial of electrical stimulation. Journal of Bone & Joint Surgery - American. 77, 1166-1173 (1995).
- Gibson, J. N., Smith, K., Rennie, M. J. Prevention of disuse muscle atrophy by means of electrical stimulation: maintenance of protein synthesis. Lancet. 2, 767-770 (1988).
- Malatesta, D., Cattaneo, F., Dugnani, S., Maffiuletti, N. A. Effects of electromyostimulation training and volleyball practice on jumping ability. Journal of Strength & Conditioning Research. 17, 573-579 (2003).
- Maffiuletti, N. A., Dugnani, S., Folz, M., Di Pierno, E., Mauro, F. Effect of combined electrostimulation and plyometric training on vertical jump height. Med. Sci. Sports Exerc. 34, 1638-1644 (2002).
- Pichon, F., Chatard, J. C., Martin, A., Cometti, G. Electrical stimulation and swimming performance. Med. Sci. Sports Exerc. 27, 1671-1676 (1995).
- Gondin, J., Guette, M., Ballay, Y., Martin, A. Electromyostimulation training effects on neural drive and muscle architecture. Med. Sci. Sports Exerc. 37, 1291-1299 (2005).
- Mathieu-Costello, O., Agey, P. J., Wu, L., Hang, J., Adair, T. H. Capillary-to-fiber surface ratio in rat fast-twitch hindlimb muscles after chronic electrical stimulation. Journal of Applied Physiology. 80, 904-909 (1996).
- Ebina, T., Hoshi, N., Kobayashi, M. Physiological angiogenesis in electrically stimulated skeletal muscle in rabbits: characterization of capillary sprouting by ultrastructural 3-D reconstruction study. Pathology International. 52, 702-712 (2002).
- Zhao, M., Huai, B., Wang, E., Forrester, J. V., McCaig, C. D. Electrical stimulation directly induces pre-angiogenic responses in vascular endothelial cells by signaling through VEGF receptors. Journal of Cell Science. 117, 397-405 (2004).
- Nagasaka, M., Kohzuki, M., Fujii, T. Effect of low-voltage electrical stimulation on angiogenic growth factors in ischaemic rat skeletal muscle. Clinical & Experimental Pharmacology & Physiology. 33, 623-627 (2006).
- Brutsaert, T. D., Gavin, T. P., Fu, Z. Regional differences in expression of VEGF mRNA in rat gastrocnemius following 1 hr exercise or electrical stimulation. BMC Physiology. 2, 8 (2002).
- Putman, C. T., Dusterhoft, S., Pette, D. Changes in satellite cell content and myosin isoforms in low-frequency-stimulated fast muscle of hypothyroid rat. Journal of Applied Physiology. 86, 40-51 (1999).
- Monaghan, B., Caulfield, B., O'Mathuna, D. P. Surface neuromuscular electrical stimulation for quadriceps strengthening pre and post total knee replacement. Cochrane Database Syst. Rev. CD007177, (2010).
- Jubeau, M., Gondin, J., Martin, A., Sartorio, A., Maffiuletti, N. A. Random motor unit activation by electrostimulation. Int. J. Sports Med. 28, 901-904 (2007).
- Piva, S. R., Goodnite, E. A., Azuma, K. Neuromuscular electrical stimulation and volitional exercise for individuals with rheumatoid arthritis: a multiple-patient case report. Physical Therapy. 87, 1064-1077 (2007).
- Delitto, A., Rose, S. J., McKowen, J. M., Lehman, R. C., Thomas, J. A., Shively, R. A. Electrical stimulation versus voluntary exercise in strengthening thigh musculature after anterior cruciate ligament surgery.[erratum appears in Phys Ther 1988 Jul;68(7):1145]. Physical Therapy. 68, 660-663 (1988).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados