Method Article
Un modelo murino de entrenamiento de los músculos mediante la estimulación eléctrica neuromuscular
En este artículo
Resumen
Un modelo murino de la estimulación eléctrica neuromuscular (EENM), una modalidad clínica segura y de bajo costo, a los músculos del compartimento anterior se describe. Este modelo tiene la ventaja de modificar un dispositivo clínico fácilmente disponibles para el propósito de provocar contracciones musculares específicas y específica en ratones.
Resumen
La estimulación eléctrica neuromuscular (EENM) es una modalidad clínica común que se utiliza ampliamente para restaurar una, mantener dos o mejorar la capacidad funcional del músculo 3.5. Estimulación transcutánea superficie del músculo esquelético implica un flujo de corriente entre un cátodo y un ánodo, induciendo con ello la excitación de la unidad de motor y las fibras musculares circundantes.
EENM es una modalidad atractiva para evaluar las respuestas del músculo esquelético de adaptación por varias razones. En primer lugar, proporciona un modelo experimental reproducible en los que las adaptaciones fisiológicas, como la hipertrofia miofibrilar y el fortalecimiento de los músculos 6, 7-9 angiogénesis, la secreción del factor de crecimiento 9.11, y el precursor de activación de las células del músculo 12 están bien documentados. Estas respuestas fisiológicas pueden ajustarse con precisión utilizando diferentes parámetros de estimulación (para una revisión Cochrane, ver 13). Además, NMES reclutasunidades de motor no selectiva, y de manera síncrona y espacialmente fijado temporalmente 14, ofreciendo la ventaja de ejercer un efecto del tratamiento sobre todas las fibras, independientemente del tipo de fibra. A pesar de que existan contraindicaciones específicas a la EENM en poblaciones clínicas, incluyendo los trastornos venosos periféricos o tumores malignos, por ejemplo, la EENM es segura y factible, incluso para aquellos que están enfermos y / o en la cama y para las poblaciones en las que el ejercicio riguroso puede ser un reto.
Este sentido, demuestran el protocolo para la adaptación de electrodos disponibles en el mercado y la realización de un protocolo de EENM utilizando un modelo murino. Este modelo animal tiene la ventaja de utilizar un dispositivo clínicamente disponibles y proporcionando información instantánea sobre el posicionamiento del electrodo para obtener el efecto deseado muscular contráctil. A los efectos de este manuscrito, se describe el protocolo para la estimulación muscular de los músculos del compartimento anterior de una extremidad posterior del ratón.
Protocolo
1. Preparación de electrodos
- Un corte de 1 cm x 1 cm de sección de la placa de circuito del vector.
- Estabilizar 2 pines wirewrap con un férreo control, con alfileres espaciadas aproximadamente 3,5 mm. Los extremos bifurcados de los pasadores debe quedar hacia arriba.
- Doble wirewrap clavijas en un ángulo de 90 °, aproximadamente a medio camino a lo largo de su longitud, con unos alicates de punta fina.
- Exponer los cables de cobre de conectores, de aproximadamente 7 cm de la conexión del conductor, al despojar el aislamiento del cable.
- Soldadura uno de los hilos de cobre al extremo bifurcado de uno de los pasadores wirewrap. Repita el paso de soldadura para el pasador de wirewrap otro.
- Tire de tubería de encogimiento en la conexión entre los cables de cobre con soldadura y alfileres de oro con el fin de aislar y estabilizar. Calentar el tubo con la punta del soldador.
- Inserte las puntas de los pasadores sin soldar wirewrap en las aberturas adyacentes de la placa de circuito protoboard.
- Asegurarse de que los pasadores wirewrap son paralelas entre sí y ptick a través de la protoboard de tal manera que las puntas se encuentran a la misma distancia cuando se coloca a través del tablero.
- Insertar los extremos de los pernos de soldadura en epoxi transparente. Deje que el epoxi cure durante aproximadamente 10 minutos, o hasta que esté completamente seco.
- Repetir la aplicación de epoxi hasta que los pasadores y el tablero de circuito vectores están completamente embebido con el fin de proporcionar la integridad estructural y alivio de tensión para los hilos conductores.
- La arena de la resina epoxi utilizando una lima de metal para exponer las puntas de los pasadores de oro.
- Utilice un multímetro para asegurarse de que los dos cables no son eléctricamente cortocircuito y que los cables tienen la continuidad adecuada
- Conecte el electrodo lleva desde el dispositivo a la EENM conector hembra de alambre de 2 vías (cable de Pomona parche).
2. Preparación de Animales
- Los animales son anestesiados mediante inhalación usando 2% isofluorano (Abbott Laboratories, North Chicago, IL) en 100% de O 2 de gas. El animal debe permanecer anestesiado todo tque la EENM sesión.
- Antes de iniciar el protocolo de EENM realizar un pellizco dedo para asegurar que el animal está totalmente anestesiado.
- Animal, debe comprobarse periódicamente la respuesta a la estimulación con el fin de garantizar el nivel de anestesia es suficiente. La anestesia se debe ajustar según sea necesario. Movimiento distinto del de la pierna estimulada, cambios en la profundidad respiratoria, y el color de las membranas mucosas todos deben ser evaluados periódicamente para controlar la profundidad de la anestesia.
- Coloque el animal en decúbito lateral.
- Aplicar lubricante oftálmica a los ojos con el fin de impedir el secado de córnea durante el procedimiento.
- Afeitar el área de las extremidades traseras a tratar, y limpie con alcohol.
- Limpie el electrodo con un 3% de lejía, luego enjuague con agua.
- Aplique una capa de gel conductor sobre el lugar donde se aplica el electrodo. Vuelva a aplicar cuando sea necesario a través del protocolo de EENM para garantizar el flujo de corriente entre el electrodo y la piel.
- Una lámpara de calor or capa de agua circulante se debe utilizar para mantener los rangos normales corporal.
- Nota: Todos los procedimientos han sido revisados y aprobados por el Cuidado de Animales de la Universidad de Pittsburgh y el Comité Institucional de Uso y actuó en PHS a los asegurados ya AAALAC Int. programa acreditado e instalaciones.
3. Estímulo
- Posicionamiento del electrodo:
- Para la estimulación de los músculos del compartimento anterior, incluyendo el músculo tibial anterior y el músculo extensor largo de los dedos, colocar el electrodo de superficie directamente sobre el nervio profundo peroneo del animal, que es una rama distal fuera del nervio peroneo común, y está situado justo anterior a la del cabeza del peroné.
- Para la estimulación de los músculos del compartimento anterior, la colocación del electrodo se confirma cuando la estimulación provoca la flexión dorsal del tobillo completo y la extensión completa de los dígitos. Por otro lado, la flexión dorsal, en la ausencia de extensión dígito indica que sólo el tibial previarior del músculo está siendo estimulado. Tal respuesta contráctil específica puede ser deseable, dependiendo del diseño del estudio.
- La contracción muscular se divide en 2 fases de estimulación: una libre de la fase móvil, concéntrico, que se produce durante el período inicial ~ 0,5 segundos. Durante esta primera fase, la pata se mueve desde una posición de descanso a la dorsiflexión y la extensión máxima de dígitos. La segunda fase de estimulación es una contracción isométrica sostenida en dorsiflexión final alcance y extensión de dígitos.
- Los parámetros de estimulación:
- Este modelo utiliza la EENM Empi 300 PV dispositivo de electroterapia multifunción, que ofrece 2 canales de EENM convencionales (véase el cuadro). Para los fines de este modelo, sólo se utiliza un canal.
- Los parámetros utilizados incluyen simétrica forma de onda, una duración de impulso de 150 mS y una frecuencia de 50Hz. Tiempo de estimulación se establece en 5 segundos, con una rampa de hasta 0,5 segundos y una rampa de 0,5 segundos hacia abajo. Esto permitirá que el músculo más gradual aclimataciónsu compañero a la estimulación. En el protocolo actual, fuera de tiempo entre las contracciones se establece en 10 segundos, pero esto puede ser ajustado en función del efecto deseado. Disminución de tiempos se traducirá en una iniciación más rápida de la fatiga muscular. Estos parámetros de estimulación se basa en protocolos clínicos diseñados para mejorar la fuerza muscular mediante estimulación eléctrica neuromuscular, sin inducir un daño significativo del músculo esquelético 1, 15, 16.
- Los ratones que completar dos series de 10 contracciones, con un descanso de 5 minutos entre series.
- Para los animales adultos, la intensidad de EENM se suele iniciar a las 9 mA. Desde nuestra experiencia, esto es aproximado a la máxima intensidad de partida que no induce una notable alteración de la marcha inmediatamente después de la estimulación. Para las sesiones posteriores NMES, la intensidad se incrementa en 1 mA cada vez que los animales son capaces de completar 20 dorsiflexions completos.
- Tras la finalización de la estimulación de protocolo y el recomuy de la anestesia, los animales suelen demostrar una marcha normal y la postura. La marcha debe permanecer intacta durante toda la duración del programa de EENM.
4. Los resultados representativos
El protocolo de EENM se describe en este artículo se ha implementado en varias cepas de ratón, a saber: de tipo salvaje (B6/10), B6.SCID y mdx / ratones SCID. Los resultados representativos de la EENM llevadas a cabo durante 4 semanas (20 sesiones) en 3-5 meses de edad mdx / SCID se presentan.
Los animales fueron sacrificados humanitariamente por dislocación cervical, mientras que bajo anestesia. El músculo tibial anterior se cosechó y se congelaron inmediatamente en 2-metil-butano pre-enfriado en nitrógeno líquido, y se almacenó a -80 ° C. Serial secciones transversales (10 micras) se obtuvieron y se montaron en portaobjetos. Los análisis estadísticos se realizaron utilizando el estándar de paquetes de software estadísticos (SPSS, v19.0 software). En primer lugar, la prueba de Levene se utilizó para evaluar si existe was la igualdad de las varianzas. Muestras independientes t-test se realiza para investigar las diferencias entre EENM y los grupos de control.
Hematoxilina y eosina (H & E) Las manchas se realizaron para investigar si el protocolo de EENM se traduciría en una lesión mayor en el músculo distrófico. Una sección se ha seleccionado, y las imágenes fueron obtenidas con un microscopio óptico (Nikon Eclipse E800, Nikon, Japón). El número total de fibras y el número de fibras con núcleos centralmente localizado se contaron manualmente utilizando los Institutos Nacionales de Salud (NIH) - software desarrollado análisis de imagen, imagen J. No hubo un incremento significativo en el índice de regeneración (número de fibras centralmente nucleadas / número total de fibras) en los animales sometidos a EENM, en comparación con los controles (p = 0,802; Figura 1). Esto sugiere que la aplicación de EENM no aumenta la cascada de degeneración-regeneración observado en animales distróficos, y es por lo tanto no es probableque se induce un daño muscular.
Inmunofluorescencia tinción para CD31 se realizó para investigar el efecto del protocolo de 4 semanas EENM sobre la vascularización del músculo. En pocas palabras, las secciones musculares fueron fijadas en formol al 4% y se bloquearon con 5% suero de caballo (HS). Las secciones se incubaron con una rata anti-ratón anticuerpo primario (1:300 dilución en 5% SA) y se trató con una cabra 555-etiquetados anti-rata anticuerpo secundario (1:300 dilución en 5% HS). Para cuantificar el número total de células positivas a CD31, una sección se ha seleccionado, y se fotografiaron mediante microscopía de fluorescencia (Nikon Eclipse E800, Japón). El número total de los capilares se contó manualmente con el norte de Eclipse Software (Empix Imaging Inc.). Hubo un aumento significativo en el número de células positivas CD31 en los animales sometidos a EENM cuando se compara con los controles (p <0,01; Figura 2), lo que indica que el protocolo de EENM como se describe promueve la angiogénesis músculo esquelético.
En ensayos in situ contráctil: Cuatro semanas después de la finalización de un protocolo de EENM, las pruebas de contracción de los músculos del compartimento anterior se realizó con un aparato de ensayos in situ (Modelo 809B, Aurora Scientific Inc, Canadá), estimulador (Modelo 701C, Aurora Scientific Inc , Canadá), y la fuerza del transductor (Aurora Scientific Inc, Canadá). Brevemente, el nervio peroneo de animales anestesiados se aisló a través de una pequeña incisión lateral a la rodilla. Los ratones fueron colocados en posición supina sobre una plataforma y el pie está probando fue colocado sobre la placa base. El miembro posterior utilizado para la prueba se estabilizó con cinta de tela sobre la rodilla y el pie. Los músculos se estimularon con unos electrodos gancho insertados bajo la piel. La contracción muscular tetánica se puso a prueba a una frecuencia de 150 Hz para 350 ms para investigar si el protocolo de 4 semanas NMES podría inducir mejoras en la fuerza muscular. Los resultados se normalizan a peso húmedo del músculo. Hubo un aumento de aproximadamente 30% en el tetanIC contracción de los animales sometidos a la EENM, en comparación con los controles (p = 0,005) (Figura 3), lo que sugiere el protocolo descrito mejora la fuerza muscular esquelético en mdx / SCID animales.

. Figura 1 hematoxilina y eosina músculo esquelético de la distrófica (MDX) / ratones inmunodeficientes (4-5 meses) (10 aumentos): A los controles no tratados), B) después de 4 semanas de la EENM.
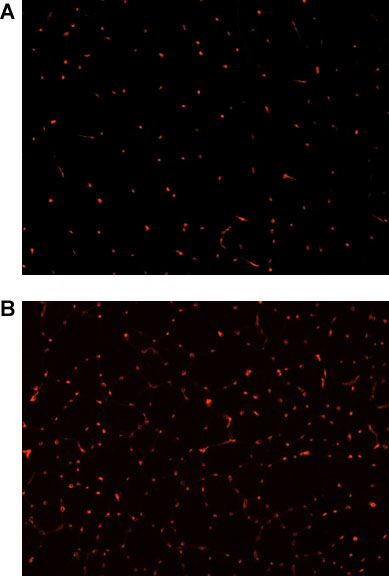
Figura 2. CD31 inmunofluorescencia (rojo), como marcador de la vascularización del músculo esquelético, en el músculo esquelético de la distrófica (MDX) / ratones inmunodeficientes (4-5 meses) (20 aumentos) a) los controles no tratados, B) después de 4 semanas de EENM.
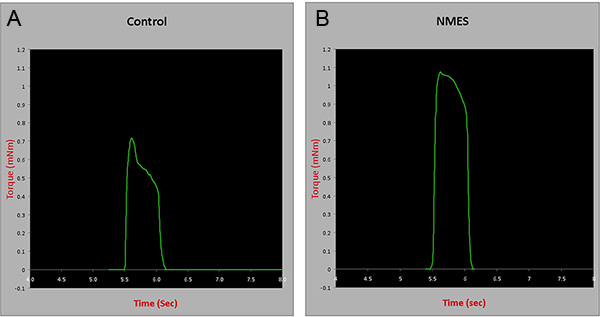
Figura 3. Pruebas contráctilde los músculos del compartimento anterior en el control y animales tratados con EENM durante 4 semanas. mNm = mili Nm. Haga clic aquí para ver más grande la figura .
Discusión
Estos resultados sugieren que nuestro modelo murino de EENM desarrollada promueve la angiogénesis músculo esquelético (Figura 2) y el refuerzo (Figura 3), pero no induce daños músculo esquelético (Figura 1).
Cabe señalar que los parámetros de estimulación descritos aquí han sido diseñadas para inducir una sobrecarga muscular a los músculos del compartimento anterior. Así como es el caso de situaciones clínicas, colocación de los electrodos puede ser ajustado para estimular otros grupos musculares, aunque la respuesta del músculo a EENM puede ser diferente, dependiendo de la composición de fibra tipo. EENM duración, el número total de sesiones de tratamiento, y el número total de repeticiones puede ser modificado de acuerdo al diseño del estudio.
Al igual que con cualquier protocolo, este método tiene limitaciones que deben tenerse en cuenta. En el presente estudio, la estimulación se realiza sobre el nervio peroneo profundo. Sin embargo, en la clínica, la estimulación is general se administra en la unidad de motor. En el modelo animal, la estimulación del nervio requeriría una intensidad menor a fin de provocar la contracción del músculo completo. Otra limitación del modelo que se presenta es que no somos capaces de obtener información sobre el nivel de comodidad durante la aplicación de la EENM, dado que los animales son anestesiados. Por lo tanto, la tolerabilidad de intensidad comparable en una población clínica es difícil de evaluar. Sin embargo, nuestros resultados histológicos indican nuestro modelo de EENM, como se ha descrito, no induce una lesión muscular.
El desarrollo de modelos animales que imitan a las modalidades aplicadas comúnmente en la clínica nos proporciona herramientas de laboratorio útiles que permite una mejor comprensión de las respuestas celulares y moleculares a las intervenciones terapéuticas. Además, estos modelos son útiles para llevar a cabo estudios pre-clínicos tanto al perfeccionamiento de los protocolos existentes de rehabilitación y desarrollo de nuevas indicaciones.
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este trabajo fue financiado por los Institutos Nacionales de Salud (NIH) de K12 Físicos y Terapeutas Ocupacionales-Oportunidades en Formación Integral de Rehabilitación de Investigación (K12 HD055931), la Fundación de Terapia Física y el Pittsburgh Claude D. Pepper estadounidenses mayores de la Independencia Centro (P30 AG024827 ).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
| Vector mensajes en el hilo envolver con terminal de soldadura bifurcado | Newark | T68 | |
| Vector de circuito | Newark | 3662-2 | |
| Pomona cable de conexión | Newark | P-36-0 | |
| 5 minutos de epoxy | VO Baker, Co. | 4001 | |
| Spectra 360 gel para electrodos | Milliken Medical | MR41217 | |
| El dispositivo portátil de estimulación neuromuscular | EMPI | 300PV |
Referencias
- Snyder-Mackler, L., Delitto, A., Bailey, S. L., Stralka, S. W. Strength of the quadriceps femoris muscle and functional recovery after reconstruction of the anterior cruciate ligament. A prospective, randomized clinical trial of electrical stimulation. Journal of Bone & Joint Surgery - American. 77, 1166-1173 (1995).
- Gibson, J. N., Smith, K., Rennie, M. J. Prevention of disuse muscle atrophy by means of electrical stimulation: maintenance of protein synthesis. Lancet. 2, 767-770 (1988).
- Malatesta, D., Cattaneo, F., Dugnani, S., Maffiuletti, N. A. Effects of electromyostimulation training and volleyball practice on jumping ability. Journal of Strength & Conditioning Research. 17, 573-579 (2003).
- Maffiuletti, N. A., Dugnani, S., Folz, M., Di Pierno, E., Mauro, F. Effect of combined electrostimulation and plyometric training on vertical jump height. Med. Sci. Sports Exerc. 34, 1638-1644 (2002).
- Pichon, F., Chatard, J. C., Martin, A., Cometti, G. Electrical stimulation and swimming performance. Med. Sci. Sports Exerc. 27, 1671-1676 (1995).
- Gondin, J., Guette, M., Ballay, Y., Martin, A. Electromyostimulation training effects on neural drive and muscle architecture. Med. Sci. Sports Exerc. 37, 1291-1299 (2005).
- Mathieu-Costello, O., Agey, P. J., Wu, L., Hang, J., Adair, T. H. Capillary-to-fiber surface ratio in rat fast-twitch hindlimb muscles after chronic electrical stimulation. Journal of Applied Physiology. 80, 904-909 (1996).
- Ebina, T., Hoshi, N., Kobayashi, M. Physiological angiogenesis in electrically stimulated skeletal muscle in rabbits: characterization of capillary sprouting by ultrastructural 3-D reconstruction study. Pathology International. 52, 702-712 (2002).
- Zhao, M., Huai, B., Wang, E., Forrester, J. V., McCaig, C. D. Electrical stimulation directly induces pre-angiogenic responses in vascular endothelial cells by signaling through VEGF receptors. Journal of Cell Science. 117, 397-405 (2004).
- Nagasaka, M., Kohzuki, M., Fujii, T. Effect of low-voltage electrical stimulation on angiogenic growth factors in ischaemic rat skeletal muscle. Clinical & Experimental Pharmacology & Physiology. 33, 623-627 (2006).
- Brutsaert, T. D., Gavin, T. P., Fu, Z. Regional differences in expression of VEGF mRNA in rat gastrocnemius following 1 hr exercise or electrical stimulation. BMC Physiology. 2, 8(2002).
- Putman, C. T., Dusterhoft, S., Pette, D. Changes in satellite cell content and myosin isoforms in low-frequency-stimulated fast muscle of hypothyroid rat. Journal of Applied Physiology. 86, 40-51 (1999).
- Monaghan, B., Caulfield, B., O'Mathuna, D. P. Surface neuromuscular electrical stimulation for quadriceps strengthening pre and post total knee replacement. Cochrane Database Syst. Rev. CD007177, (2010).
- Jubeau, M., Gondin, J., Martin, A., Sartorio, A., Maffiuletti, N. A. Random motor unit activation by electrostimulation. Int. J. Sports Med. 28, 901-904 (2007).
- Piva, S. R., Goodnite, E. A., Azuma, K. Neuromuscular electrical stimulation and volitional exercise for individuals with rheumatoid arthritis: a multiple-patient case report. Physical Therapy. 87, 1064-1077 (2007).
- Delitto, A., Rose, S. J., McKowen, J. M., Lehman, R. C., Thomas, J. A., Shively, R. A. Electrical stimulation versus voluntary exercise in strengthening thigh musculature after anterior cruciate ligament surgery.[erratum appears in Phys Ther 1988 Jul;68(7):1145]. Physical Therapy. 68, 660-663 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados