Method Article
Modelo Experimental de Endocardite resistente à meticilina
Neste Artigo
Resumo
Endocardite modelo experimental de ratos devido à meticilina-resistente S. aureus.
Resumo
Infecções endovasculares, incluindo endocardite, são fatais síndromes infecciosas 1-3. Staphylococcus aureus é a causa mais comum em todo o mundo dessas síndromes com morbidade e mortalidade inaceitavelmente elevada, mesmo com tratamentos adequados agente antimicrobiano 4-6. O aumento em infecções devidas a resistente à meticilina S. aureus (MRSA), as altas taxas de falhas vancomicina clínicas de tratamento e os problemas crescentes de linezolida e resistência à daptomicina tem tudo ainda mais complicada a gestão de pacientes com essas infecções, e levou a custos de saúde de elevada 7, 8. Além disso, deve salientar-se que os estudos mais recentes com os resultados do tratamento com antibióticos têm sido baseados em cenários clínicos e, portanto, pode muito bem ser influenciada por factores do hospedeiro variando de paciente para paciente. Portanto, um modelo animal de infecção relevante endovascular em que factores do hospedeiro são semelhantes a partir de animal para animal é maiscrucial para investigar patogénese microbiana, bem como a eficácia de novos agentes antimicrobianos. Endocardite em rato é um bem estabelecida modelo experimental animal que se aproxima endocardite humana nativa. Este modelo tem sido utilizado para examinar o papel de determinados factores de virulência de estafilococos e da eficácia dos regimes de tratamento com antibióticos para endocardite estafilocócica. Neste relatório, nós descrevemos o modelo de endocardite experimental devido à MRSA que poderia ser usado para investigar patogênese bacteriana e da resposta ao tratamento com antibióticos.
Protocolo
1. Preparando o MRSA de Infecção
- Inocule uma ansa cheia de cultura MRSA de um tubo de estoque a -80 ° C a uma sangue de ovelha Trypticase Soy placa de agar (TSA) (ver Tabela de reagentes específicos e equipamentos), e incubar a 37 ° C durante a noite.
- Verifique a pureza da cultura sobre a placa de ágar sangue (fenótipos semelhantes colônia) para ter certeza não há contaminação.
- Escolha uma colónia da placa de sangue de ovelha TSA e inocular a colónia em 5 ml Trypticase Soy Broth (TSB) em um tubo de 15 ml snap-tapado.
- Incubar a 37 ° C durante a noite com agitação a 200 rpm.
2. Preparando Cateteres Cirurgia
Corte o tubo de polietileno (PI10,. Becton Dickinson, nenhuma ordem 427401) a 10 cm comprimento, e derreter uma extremidade pressionando a ponta com uma pinça estéreis. O objectivo da selagem uma extremidade do cateter é evitar hemorragia durante a cateterização.
3. Pré-sPreparação urgery e Anestesia
- Rato lugar Sprague-Dawley (Harlan, Indianapolis, Ind. fêmea, 250-300 gramas) em uma câmara contendo isofluorano em oxigénio da mistura de gases (50%: 50%) até que o anestésico tem efeito (por exemplo, os músculos estão relaxados e reflexos de pedais estão ausentes ), e manter os animais em um estado de anestesia durante a cirurgia com a mistura de gás.
- Limpe a área do pescoço do queixo até um pouco abaixo do esterno com Betadine e etanol 70%.
4. Procedimento Cirúrgico
- Use uma técnica asséptica durante toda a cirurgia. Fazer uma incisão (1-1,5 cm) verticalmente através da pele só camada do pescoço acima do esterno.
- Usando dissecção romba, separar a fáscia para expor a artéria carótida direita com 2 pares de pinças curvas dentadas.
- Puxe delicadamente a artéria para fora da cavidade do pescoço, e coloque dois comprimentos de 10 cm de fio de seda sob a artéria e amarrar a artéria na extremidade exposta cefálica, coloque um clipe sobre a artery para evitar sangramento.
- Fazer um pequeno furo no topo da artéria utilizando um introdutor de cateter (Becton Dickinson, ordem n. 406.999), inserir um cateter com um fórceps através do orifício na artéria, remover o grampo e empurrar para baixo do cateter para o coração até que a resistência seja cumprido.
- Amarrá a sutura solto em torno da extremidade caudal da artéria e fixar o cateter no lugar com a sutura de seda quando o cateter está no lugar, tal como determinado por: i) o comprimento do cateter inserido (4-5 cm); resistência ii) um maior avanço e iii) pulsação do cateter com o batimento cardíaco. Deixar o cateter no lugar durante o resto da experiência.
- Cortar sutura em excesso e as extremidades do cateter, e se certificar de que não há sangramento a partir do cateter. Dobre as pontas soltas sob a pele do pescoço e feche a pele com grampos de pele.
- Coloque o rato na gaiola em um lugar morno até que recuperou da anestesia, e fornecer comida e água. Verifique o rato freqüentemente durante eapós a recuperação da anestesia.
- Esta cirurgia é um "Categoria E" procedimento. Os procedimentos produzidos a dor é sem alívio com analgésicos desde infecções por MRSA que acompanham angústia para os animais.
5. Infecção por MRSA
- A infecção pode ser realizada entre 1 e 7 dias pós-cirurgia, mas manter consistente dentro experimentos.
- Limpeza da cauda de rato com etanol a 70%, e injectar 0,5 ml MRSA com uma contagem de célula desejado (10 abril-10 junho ufc / animal para a maioria das cepas de S. aureus). Com 27 G agulha 1/2 polegada por via intravenosa a partir da veia da cauda Cuidado : cultura MRSA pertence ao nível de biossegurança 2 (BSL2) e tem potencial perigo moderado para o pessoal e do ambiente.
- Manter a pressão no local até que a hemostase ocorre antes de retornar o rato para o compartimento.
6. Ratos sacrifício e tecidos-alvo Cultura
- Sacrificar ratos por injecção ip de pentobarbital de sódio (200 mg/ Kg) após 1 a 6 dias após a infecção.
- Coloque o rato sobre as costas e limpe o peito com etanol 70%.
- Fazer uma incisão em forma de V no peito abaixo esterno, e cortado a cartilagem de nervuras de cada lado do esterno para expor o coração.
- Puxe o coração se suavemente, e clipe através do tecido do coração perto da aorta e dissecar até libertar o coração.
- Coloque o coração em uma placa de Petri esterilizada com 4x4 polegadas dentro de gaze, faça um corte através da parede do ventrículo esquerdo interior e abrir a câmara do lado esquerdo.
- Verifique visualmente para a colocação do cateter. Examinar e remover vegetações da válvula com uma tesoura e pinças.
- Pesar e homogeneizar as vegetações, e fazer diluições seriadas com PBS para a cultura quantitativa.
7. Os resultados representativos
Imediatamente após a inserção do cateter na artéria e empurrando para baixo a cerca de 4-5 cm do cateter para o coração, uma resistência será experienCED. Se nenhuma resistência é detectado, o cateter pode não ter sucesso, foi inserido no lado esquerdo da câmara do coração, que podem afectar a colocação do cateter. Um correcto posicionamento do cateter publicado anteriormente 9 é mostrada na Figura 1.
Parte das amostras de infecção por MRSA precisam de ser cultivadas quantitativa a certificar-se a contagem viável exacta bacteriana para a infecção e pureza da amostra infecção. Além disso, os organismos recuperados a partir de vegetações deve ser os mesmos que os utilizados no inoculo.
A Tabela 1 apresenta um exemplo de virulência de um S. aureus estirpe no modelo de rato endocardite, que foi publicado anteriormente 9. Todos os animais desafiados com inóculos de 10 5 e 10 6 ufc e sacrificados entre 3 a 6 dias após infecção endocardite desenvolveram com S. alta densidades aureus em vegetações cardíacas, bem como os rins e do baço ( Tabela 1). Ratos com culturas de válvulas estéreis são considerados não infectados.
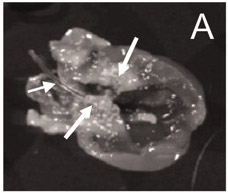
Figura 1. O cateter está em um lugar correto (lado esquerdo da câmara do coração), e vegetações diversas são visíveis em torno da válvula aórtica 9.
| Inóculo (n º de animas) | A média de log 10 CFU / g de tecido ± DP um em: | ||
| Vegetação | Rim | Baço | |
| 10 6 UFC / animal (9) | 10,36 ± 0,85 | 7,30 ± 0,64 | 6,70 ± 0,57 |
| 10 5 UFC / animal (8) | 9,93 ± 0,53 | 7,14 ± 0,53 | 6,44 ± 0,63 |
| 10 4 UFC / animal (7) | 3,46 ± 0,50 * | 1,81 ± 0,74 * | 1,58 ± 0,59 * |
um desvio, SD padrão. P <0,001 em relação ao 10 5 ou 10 6 CFU-desafiados animais.
Tabela 1. S. densidade aureus em vegetações cardíacas com diferentes inóculos na endocardite ratos 9.
Discussão
A endocardite rato é um modelo animal importante e bem caracterizado para estudos in vivo na patogénese e agentes antimicrobianos para o tratamento de infecções bacterianas 9-11. Além disso, o modelo de rato endocardite representa um composto de infecções agudas e sub-aguda, e imita homólogo humano e endocardite válvula humana nativa. Além disso, acompanhados por um cateter na habitação, que representa uma infecção clássica associada ao biofilme, um problema comum e difícil na prática clínica 12. Mais importante ainda, os resultados gerados com o modelo de rato endocardite são altamente reprodutível.
A patogenicidade do S. aureus no modelo de rato endocardite, como outros modelos animais, podem variar dependendo de um número de parâmetros, incluindo a dose de inóculo, fase de crescimento bacteriano (log versus estacionário), idade dos animais, e de fundo genético animal 9, 13. Taxas de sucesso cirúrgico são highly dependente do conhecimento técnico e habilidades cirúrgicas do pesquisador. Sucesso na cirurgia pode ser medido por: 1) o número de animais que recuperar da cirurgia; cateter 2) num local correcto no momento do sacrifício, e 3) vegetações presentes nas válvulas cardíacas.
Em resumo, a endocardite rato é um modelo, praticável reprodutível e importante que imita a situação clínica de perto. Portanto, é apropriado para todas as áreas de investigação sépsis, incluindo patogénese microbiana e eficácia de agentes antimicrobianos para o tratamento das síndromes endocardite experimentais.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Este trabalho foi financiado pelo National Institutes of Health EUA [concessão R01AI-39108 para ASB] ea American Heart Association [subsídios SDG 0630219N e AID 09GRNT2180065 para YQX].
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Placa de ágar sangue, sangue de carneiro 5% em Trypticase Soy ágar (TSA) | Diagnóstico Hardy | A10BX | |
| Trypticase Soy Broth (TSB) | Becton Dickinson | 211825 | |
| Agitando incubadora | Labnet | I5311-DS | |
| Tubagem de polietileno | Becton Dickinson | 427401 | |
| Introdutor de cateter | Becton Dickinson | 6999 | |
| Isofluorance | Western Medical Suppy, Inc | 2147 | Siga as informações de segurança e manuseio |
| Instrumentos Cirúrgicos | Belas Ferramentas e Instrumentos de Pesquisa de Ciências Biomédicas, Inc. | Encontre os instrumentos das duas empresas para as suas necessidades |
Referências
- Petti, C. A., Fowler, V. G. Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin. 21, 219-233 (2003).
- Bashore, T. M., Cabell, C., Fowler, V. Update on infective endocarditis. Curr. Probl. Cardiol. 31, 274-352 (2006).
- Fowler, V. G. Jr, Justice, A., Moore, C. Risk factors for hematogenous complications of intravascular catheter-associated Staphylococcus aureus bacteremia. Clin. Infect. Dis. 17, 313-320 (1993).
- Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis. 39, 309-317 (2004).
- Hoen, B. Special issues in the management of infective endocarditis caused by gram-positive cocci. Infect Dis. Clin. North Am. 16, 437-452 (2002).
- Moise, P. A., Hershberger, E., Amodio-Groton, M. I., Lamp, K. C. Safety and clinical outcomes when utilizing high-dose (> or =8 mg/kg) daptomycin therapy. Ann. Pharmacother. 43, 1211-1219 (2009).
- Sakoulas, G., Brown, J., Lamp, K. C., Friedrich, L. V., Lindfield, K. C. Clinical outcomes of patients receiving daptomycin for the treatment of Staphylococcus aureus infections and assessment of clinical factors for daptomycin failure: a retrospective cohort study utilizing the Cubicin Outcomes Registry and Experience. Clin. Ther. 31, 1936-1945 (2009).
- Xiong, Y. Q., Willard, J., Kadurugamuwa, J. L., Yu, J., Francis, K. P., Bayer, A. S. Real-time in vivo bioluminescent imaging for evaluating the efficacy of antibiotics in a rat Staphylococcus aureus endocarditis model. Antimicrob. Agents Chemother. 49, 380-387 (2005).
- Peerschke, E. I., Bayer, A. S., Ghebrehiwet, B., Xiong, Y. Q. gC1qR/p33 blockade reduces Staphylococcus aureus colonization of target tissues in an animal model of infective endocarditis. Infect. Immun. 74, 4418-4423 (2006).
- Ganesh, V. K., Rivera, J. J., Smeds, E. A structural model of the Staphylococcus aureus ClfA-fibrinogen interaction opens new avenues for the design of anti-staphylococcal therapeutics. PLoS Pathog. 4, e1000226(2008).
- Boles, B. R., Horswill, A. R. Staphylococcal biofilm disassembly. Trends Microbiol. , (2011).
- Tseng, C. W., Sanchez-Martinez, M., Arruda, A., Liu, G. Y. Subcutaneous Infection of Methicillin Resistant Staphylococcus Aureus (MRSA). J. Vis. Exp. (48), e2528(2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados