Method Article
Modelo experimental de endocarditis Resistente a la Meticilina
En este artículo
Resumen
Modelo experimental de rata endocarditis por estafilococos resistentes a S. Staphylococcus.
Resumen
Infecciones endovasculares, incluyendo la endocarditis, son peligrosas para la vida síndromes infecciosos 1-3. Staphylococcus aureus es el más común en todo el mundo la causa de los síndromes de ese tipo con la morbilidad y la mortalidad inaceptablemente alta, incluso con los tratamientos adecuados de agentes antimicrobianos 4-6. El aumento de las infecciones por S. aureus resistente a meticilina Staphylococcus aureus (MRSA), las altas tasas de fracasos de tratamiento clínico a la vancomicina y crecientes problemas de linezolid y la resistencia a la daptomicina tiene todo se complica aún más el manejo de pacientes con este tipo de infecciones, y dio lugar a altos costos de atención médica 7, 8. Además, cabe destacar que los estudios más recientes con los resultados del tratamiento con antibióticos se han basado en la práctica clínica, y por lo tanto podría estar influido por factores del huésped que varían de paciente a paciente. Por lo tanto, un modelo animal adecuado de la infección endovascular en la que los factores del huésped son similares a partir de animal a animal es máscrucial para investigar patogénesis microbiana, así como la eficacia de nuevos agentes antimicrobianos. La endocarditis en la rata es un modelo bien establecido animal de experimentación que se aproxima la endocarditis de válvula nativa humana. Este modelo ha sido utilizado para examinar el papel de determinados factores de virulencia estafilococos y la eficacia de los regímenes de tratamiento antibiótico para la endocarditis por estafilococos. En este reporte se describe el modelo de endocarditis experimental por MRSA que podrían ser utilizados para investigar la patogénesis bacteriana y la respuesta al tratamiento con antibióticos.
Protocolo
1. Preparación de las cepas de SARM para la infección
- Inocular un asa de la cultura MRSA de un tubo de valores a -80 ° C a una sangre de oveja agar tripticasa soya (TSA) placa (ver Tabla de reactivos y equipos específicos), y se incuba a 37 ° C durante la noche.
- Comprobar la pureza de la cultura en la placa de agar sangre (fenotipos similares colonia) para asegurarse de que no hay contaminación.
- Elige una colonia de la placa de la sangre de oveja TSA e inocular la colonia en 5 ml de caldo de soja tripticasa (TSB) en un 15 ml con tapa complemento tubo.
- Incubar a 37 ° C durante la noche con agitación a 200 rpm.
2. Preparación de catéteres Cirugía
Corte el tubo de polietileno (PE10;. Becton Dickinson, n º de pedido 427 401) a 10 cm de longitud, y se funden uno de los extremos al presionar la punta con unas pinzas esterilizadas. El propósito de sellar un extremo del catéter es para evitar el sangrado durante la cateterización.
3. Pre-sPreparación ratamientos quirúrgicos y anestesia
- Lugar rata Sprague-Dawley (Harlan, Indianapolis, IN femenino, 250-300 gramos) en una cámara que contiene oxígeno isofluorano-mezcla de gas (50%: 50%), hasta que la anestesia haga efecto (por ejemplo, los músculos se relajan y los reflejos están ausentes del pedal ), y mantener los animales en un estado de anestesia durante la cirugía con la mezcla de gases.
- Limpie la zona del cuello desde la barbilla hasta justo debajo del esternón con Betadine y el 70% de etanol.
4. Procedimiento Quirúrgico
- Utilice una técnica estéril durante toda la cirugía. Hacer una incisión (1-1.5 cm) verticalmente a través de sólo la capa de piel del cuello por encima del esternón.
- Con disección roma, separar la fascia para exponer la arteria carótida derecha con 2 pares de pinzas de dientes curvos.
- Tire suavemente de la arteria hasta fuera de la cavidad del cuello, y coloque dos de 10 cm de longitud de la sutura de seda debajo de la arteria y atar la arteria en el extremo expuesto cefálica, colocar un clip en el arteria para prevenir el sangrado.
- Hacer un pequeño agujero en la parte superior de la arteria mediante un catéter introductor (Becton Dickinson, no. 406.999), insertar un catéter con una pinza a través del agujero en la arteria, retire el clip y empuje hacia abajo el catéter hacia el corazón hasta que la resistencia se cumple.
- Ate la sutura suelta alrededor del extremo caudal de la arteria y asegurar el catéter en su lugar con la sutura de seda cuando el catéter está en su lugar según lo determinado por: i) la longitud de catéter (4-5 cm), ii) la resistencia a un mayor avance , y iii) la pulsación de la sonda con el latido del corazón. Dejar el catéter en su lugar durante el resto del experimento.
- Corte el exceso de sutura y termina con catéter, y asegurarse de que no hay sangrado por el catéter. Meta los extremos sueltos bajo la piel del cuello y cerrar la piel por medio de grapas.
- Coloque la rata en la jaula en un lugar cálido hasta que se recupere de la anestesia, y proporcionar alimentos y agua. Ver la rata y con frecuencia durantedespués de la recuperación de la anestesia.
- Esta cirugía es una "Categoría E" procedimiento. Los procedimientos producen el dolor no se alivia con analgésicos ya que las infecciones por SARM que acompañan a la angustia de los animales.
5. La infección por SARM
- La infección se puede realizar entre 1 y 7 días después de la cirugía, pero mantenga coherente dentro de los experimentos.
- Limpieza cola de rata con 70% de etanol, e inyectar 0,5 ml de MRSA en un recuento de células deseada (abril 10-06 10 ufc / animal para la mayoría de las cepas de S. aureus). Con 27 aguja T 1/2 pulgada por vía intravenosa de la vena de la cola Precaución : la cultura MRSA pertenece al nivel de bioseguridad 2 (BSL2) y tiene peligro potencial moderado para el personal y el medio ambiente.
- Mantenga la presión en el sitio hasta la hemostasia se produce antes de regresar a la rata de la jaula.
6. Las ratas de sacrificio y de tejidos cultura de destino
- Sacrificar las ratas por inyección ip de pentobarbital sódico (200 mg/ Kg) después de 1 a 6 días después de la infección.
- Coloque el ratón sobre la espalda y limpie el pecho con el 70% de etanol.
- Hacer una incisión en forma de V en el pecho debajo del esternón, y cortar el cartílago de las costillas a cada lado del esternón para exponer el corazón.
- Tire el corazón con suavidad, y el clip a través del tejido del corazón cerca de la aorta y la disección hasta liberar el corazón.
- Ponga el corazón en una placa de Petri estéril con el interior de gasa de 4x4 pulgadas, hacer un corte a través de la pared del ventrículo izquierdo interno y abrir la cámara del lado izquierdo.
- Compruebe visualmente para la colocación del catéter. Examinar y eliminar las vegetaciones de la válvula con las tijeras y pinzas.
- Pesar y homogeneizar las vegetaciones, y hacer diluciones seriadas con PBS para el cultivo cuantitativo.
7. Los resultados representativos
Inmediatamente después de insertar el catéter en la arteria y empujando hacia abajo sobre el catéter 4-5 cm hacia el corazón, una resistencia será expeced. Si no se detecta la resistencia, el catéter no puede haber sido insertada con éxito en el lado izquierdo de la cámara del corazón, lo que puede afectar a la colocación del catéter. Una correcta colocación del catéter publicado previamente 9 se muestra en la Figura 1.
Parte de las muestras de la infección por SARM tienen que ser cultivadas cuantitativa del asegúrese de que el exacto número de viables para la infección bacteriana y la pureza de la muestra de la infección. Además, los organismos recuperados de vegetaciones deben ser los mismos que los utilizados en el inóculo.
La Tabla 1 presenta un ejemplo de la virulencia de una S. aureus cepa en el modelo de endocarditis rata que fue publicado previamente 9. Todos los animales desafiados con inóculos de 10 5 y 10 6 ufc y se sacrificaron entre 3 a 6 días después de las infecciones por endocarditis desarrollados con alta S. densidades de S. aureus en las vegetaciones cardíacas, así como los riñones y el bazo ( Tabla 1). Las ratas con las culturas de las válvulas estériles se consideran no infectados.
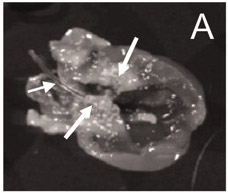
Figura 1. El catéter está en un lugar correcto (del lado izquierdo de la cámara del corazón), y numerosas vegetaciones son visibles alrededor de la válvula aórtica 9.
| Inóculo (número de ánimas) | El promedio diario de 10 UFC / g de tejido ± desviación estándar de una: | ||
| Vegetación | Riñón | Bazo | |
| 10 6 UFC / animal (9) | 10,36 ± 0,85 | 7,30 ± 0,64 | 6,70 ± 0,57 |
| 10 5 UFC / animal (8) | 9,93 ± 0,53 | 7,14 ± 0,53 | 6,44 ± 0,63 |
| 10 4 UFC / animal (7) | 3,46 ± 0,50 * | 1,81 ± 0,74 * | 1,58 ± 0,59 * |
una desviación SD estándar. P <0,001 con respecto a 5 o 10 10 6 UFC-desafió animales.
Tabla 1. S. Staphylococcus densidad en vegetaciones cardíacas con inóculos diferente en el modelo de rata endocarditis 9.
Discusión
La endocarditis rata es un modelo animal importante y bien caracterizado-para estudios in vivo en la patogénesis y los agentes antimicrobianos en el tratamiento de infecciones bacterianas 9-11. Además, el modelo de rata endocarditis representa una combinación de las infecciones agudas y sub-aguda, y se asemeja mucho a la humana y la endocarditis de válvula nativa humana. Por otra parte, acompañado de un catéter en la vivienda, que representa una infección clásica asociada a la biopelícula, un problema común y difícil en la práctica clínica 12. Lo más importante, los resultados generados con el modelo de endocarditis ratas son altamente reproducibles.
La patogenicidad de S. aureus en el modelo de rata endocarditis, como otros modelos animales, puede variar dependiendo de un número de parámetros, incluyendo dosis inóculo, fase de crecimiento bacteriano (log o fijas), la edad de los animales, y el fondo genético animal 9, 13. Las tasas de éxito quirúrgico son highly depende de los conocimientos técnicos y habilidades quirúrgicas del investigador. El éxito en la cirugía se puede medir por: 1) el número de animales que se recuperan de la cirugía, 2) del catéter en un lugar correcto en el momento del sacrificio, y 3) vegetaciones presentes en las válvulas cardíacas.
En resumen, la endocarditis rata es un modelo factible, reproducible y importante que imita la situación clínica de cerca. Por lo tanto, es apropiado para todos los campos de la investigación, incluyendo la sepsis patogénesis microbiana y la eficacia de los agentes antimicrobianos en el tratamiento de síndromes endocarditis experimental.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por los EE.UU. Institutos Nacionales de Salud [de subvención R01AI-39108 de ASB] y la American Heart Association [SDG subvenciones 0630219N y la AID 09GRNT2180065 de YQX].
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
| Placa de agar sangre, de carnero al 5% de sangre en agar tripticasa soya (TSA) | Diagnóstico Hardy | A10BX | |
| Caldo de soja tripticasa (TSB) | Becton Dickinson | 211825 | |
| Incubadora de agitación | Labnet | I5311-DS | |
| Polietileno tubo | Becton Dickinson | 427401 | |
| Catéter introductor | Becton Dickinson | 6999 | |
| Isofluorance | Médico Nacional de Occidente SuppY, Inc | 2147 | Siga las instrucciones de seguridad y manejo |
| Los instrumentos quirúrgicos | Herramientas de Bellas Ciencia e Instrumentos de Investigación Biomédica, Inc. | Encuentra los instrumentos de las dos empresas para sus necesidades |
Referencias
- Petti, C. A., Fowler, V. G. Staphylococcus aureus bacteremia and endocarditis. Cardiol. Clin. 21, 219-233 (2003).
- Bashore, T. M., Cabell, C., Fowler, V. Update on infective endocarditis. Curr. Probl. Cardiol. 31, 274-352 (2006).
- Fowler, V. G., Justice, A., Moore, C. Risk factors for hematogenous complications of intravascular catheter-associated Staphylococcus aureus bacteremia. Clin. Infect. Dis. 17, 313-320 (1993).
- Wisplinghoff, H., Bischoff, T., Tallent, S. M., Seifert, H., Wenzel, R. P., Edmond, M. B. Nosocomial bloodstream infections in US hospitals: analysis of 24,179 cases from a prospective nationwide surveillance study. Clin. Infect. Dis. 39, 309-317 (2004).
- Hoen, B. Special issues in the management of infective endocarditis caused by gram-positive cocci. Infect Dis. Clin. North Am. 16, 437-452 (2002).
- Moise, P. A., Hershberger, E., Amodio-Groton, M. I., Lamp, K. C. Safety and clinical outcomes when utilizing high-dose (> or =8 mg/kg) daptomycin therapy. Ann. Pharmacother. 43, 1211-1219 (2009).
- Sakoulas, G., Brown, J., Lamp, K. C., Friedrich, L. V., Lindfield, K. C. Clinical outcomes of patients receiving daptomycin for the treatment of Staphylococcus aureus infections and assessment of clinical factors for daptomycin failure: a retrospective cohort study utilizing the Cubicin Outcomes Registry and Experience. Clin. Ther. 31, 1936-1945 (2009).
- Xiong, Y. Q., Willard, J., Kadurugamuwa, J. L., Yu, J., Francis, K. P., Bayer, A. S. Real-time in vivo bioluminescent imaging for evaluating the efficacy of antibiotics in a rat Staphylococcus aureus endocarditis model. Antimicrob. Agents Chemother. 49, 380-387 (2005).
- Peerschke, E. I., Bayer, A. S., Ghebrehiwet, B., Xiong, Y. Q. gC1qR/p33 blockade reduces Staphylococcus aureus colonization of target tissues in an animal model of infective endocarditis. Infect. Immun. 74, 4418-4423 (2006).
- Ganesh, V. K., Rivera, J. J., Smeds, E. A structural model of the Staphylococcus aureus ClfA-fibrinogen interaction opens new avenues for the design of anti-staphylococcal therapeutics. PLoS Pathog. 4, e1000226 (2008).
- Boles, B. R., Horswill, A. R. Staphylococcal biofilm disassembly. Trends Microbiol. , (2011).
- Tseng, C. W., Sanchez-Martinez, M., Arruda, A., Liu, G. Y. Subcutaneous Infection of Methicillin Resistant Staphylococcus Aureus (MRSA). J. Vis. Exp. (48), e2528 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados