Method Article
네트워크 약리학 및 실험용 쥐 모델을 사용하여 혈관 석회화를 위한 치료제로서의 Salidroside 평가
* 이 저자들은 동등하게 기여했습니다
요약
이 연구는 비타민 D3(VD3)와 결합된 고지방 식단(HFD)에 의해 유도된 혈관 석회화의 쥐 모델을 확립합니다. 이 모델은 혈관 석회화를 예방하고 치료하는 살리드사이드의 치료 효능을 평가하는 데 사용되었으며, 네트워크 약리학 및 생체 내 실험을 통해 잠재적인 작용 메커니즘에 대한 통찰력을 제공했습니다.
초록
혈관 석회화(VC)는 상당한 이환율 및 사망률과 관련된 중요한 병리학적 상태입니다. 이 연구는 네트워크 약리학과 분자 생물학의 하이브리드 접근 방식을 사용하여 VC에 대한 Rhodiola crenulata의 활성 화합물인 살리드로사이드(SAL)의 치료 메커니즘을 설명합니다. 데이터베이스 마이닝 및 네트워크 분석을 통해 2871개의 VC 관련 대상과 교차하는 388개의 SAL 대상을 식별하여 208개의 공통 대상을 도출했습니다. String 데이터베이스와 Cytoscape 3.9.1의 토폴로지 분석을 통해 구축된 단백질-단백질 상호 작용(PPI) 네트워크는 IL6, TNF, TP53, IL1B, HIF1A, CASP3 및 STAT3를 포함한 10개의 주요 표적을 정확히 찾아냈습니다. 확인된 유전자는 지질 및 죽상동맥경화 경로에 집중되어 있으며, 이는 SAL에 의한 VC의 개선이 지질 및 염증 인자의 비정상적인 발현 조절을 통해 이루어질 수 있음을 나타냅니다. 또한 SAL은 염증 인자의 비정상적인 발현을 억제하여 JAK2/STAT3 경로를 활성화하여 VC의 진행에 개입하는 것으로 밝혀졌습니다. JAK2/STAT3 경로는 SAL이 VC의 추가 악화를 방지하는 핵심 분자 메커니즘입니다. 기능적 농축 분석은 VC의 중추적 경로인 염증 반응 및 지질 대사에 이러한 표적이 관여하는 것을 밝혔습니다. 쥐를 대상으로 한 생체 내 연구에서는 이상지질혈증과 혈관 염증을 완화하는 SAL의 효능이 입증되었으며, 혈청 지질 프로필이 개선되고 혈관 칼슘 침착이 감소했습니다. 웨스턴 블롯 분석에 기반을 둔 기계론적 탐사는 JAK2/STAT3 신호 경로를 조절하는 살리드사이드의 능력을 입증했으며, 이 중요한 분자 메커니즘에서 조절제로서의 잠재력을 강조하고 VC에 대한 잠재적인 치료 표적을 제공했습니다. 이 연구의 강점은 컴퓨터 예측과 생체 내 검증을 통합하는 방법론적 엄격함에 있습니다. 이 포괄적인 접근 방식은 VC와 싸우는 데 있어 천연 화합물의 치료 메커니즘을 탐구하기 위한 강력한 프레임워크를 구축합니다.
서문
혈관 석회화(VC)는 혈관 벽 내에 칼슘이 비정상적으로 침착되어 동맥이 굳어지고 탄력성이 감소하여 궁극적으로 혈관 기능을 손상시키는 것을 말합니다. 전통적으로 VC는 지질 축적과 관련된 내막 석회화(intimal calcification)와 내측 석회화(medial calcification)의 두 가지 유형으로 나뉩니다. 전자는 염증성 침윤과 밀접한 관련이 있으며, 혈관 평활근 세포(VSMC)가 조골세포와 같은 세포로 이동, 증식 및 분화되는 것을 특징으로 하는 혈관 벽의 골형성 변형을 유발합니다1.
VSMC가 노화, 유전적 요인, 당뇨병 및 만성 신장 질환과 같은 환경 조건의 영향을 받는 골형성 분화를 겪는 능력은 노화 관련 VC의 주요 원인입니다. 이러한 조골세포와 같은 변형은 동맥 석회화와 퇴행을 악화시킵니다1.
VC는 퇴행성 변화, 대사 불균형 및 다양한 전신 상태에 의해 유발되는 다면적인 상태입니다. 혈관 손상의 약 80%와 관상 동맥 질환 사례의 90%가 VC를 나타내며, 이는 심각한 심혈관 질환의 위험을 현저히 증가시킵니다 1,2. 따라서 이 상태를 효과적으로 완화하거나 되돌릴 수 있는 약물 치료법을 발견해야 할 긴급한 필요성이 있습니다.
현재 VC의 치료 전략에는 다양한 약물 개입이 포함되지만 이러한 목적을 위해 특별히 고안된 약물은 없습니다. 경미한 석회화가 있는 환자의 경우, 플라크를 안정화하기 위해 스타틴이 처방되는 경우가 많습니다. 그러나 지질 수치를 낮춤으로써 관상동맥 협착증을 줄일 수 있지만, 석회화에 미치는 영향은 제한적이다2.
죽상동맥경화증의 복잡성을 감안할 때, 많은 환자들이 향상된 혈소판 활성화를 보이며, 혈소판 응집을 억제하고 혈전증의 위험을 줄이기 위해 아스피린이나 클로피도그렐과 같은 항혈소판제를 사용해야 합니다. 그러나 아스피린 요법은 관상동맥 칼슘 수치가 높고 출혈 위험이 낮은 사람에게만 효과적이다3.
또한 비타민 K와 같은 보충제에 대한 연구는 VC 진행을 예방할 수 있는 잠재력을 시사합니다4. 심한 경우 침습적 개입이 고려될 수 있지만 널리 퍼진 VC5에는 적합하지 않은 경우가 많습니다. 기존 VC가 없는 개인의 경우 혈압, 지질 프로필, 생활 방식 선택과 같은 위험 요인을 관리하는 것이 여전히 중요합니다6.
홍경천(Rhodiola crenulata)은 Crassulaceae과의 다년생 허브로, 전통적으로 중국 의학에서 사용되어 왔습니다. 주요 생리 활성 성분인 살리드로사이드(salidroside)는 주목할만한 생물학적 활성으로 인해 상당한 관심을 받고 있습니다. Salidroside는 세포사멸을 억제하고, 강력한 항산화 특성을 나타내며, 항염증 특성을 소유하는 능력으로 유명합니다 7,8. 이러한 특성은 혈관 기능을 향상시키고 혈관 노화를 지연시키며 혈관 내피를 보호할 수 있는 잠재력에 기여합니다. VC의 잠재적인 치료제로서 살리드로사이드는 연구에 상당한 가치를 지닙니다. 그러나, 살리드로사이드가 VC를 개선하는 정확한 메커니즘은 완전히 밝혀지지 않았으며, VC 치료에서 그 치료 잠재력을 활용하기 위한 추가 조사가 필요합니다.
이러한 메커니즘을 탐구하기 위해 본 연구는 약리학, 생물정보학 및 컴퓨터 과학을 결합하여 생물학적 시스템을 분석하고 약물 메커니즘을 밝히는 혁신적인 방법론인 네트워크 약리학을 활용합니다. 기존의 단일 표적 약물 연구와 비교했을 때, 네트워크 약리학은 여러 생물학적 표적 및 신호 경로에 대한 약물의 효과를 분석하여 보다 포괄적인 접근 방식을 제공합니다. 현대 약물 개발의 핵심 도구로서 약물, 표적 및 경로의 네트워크를 구축하여 약물 작용의 기본 메커니즘을 밝힙니다 9,10. 치료 메커니즘을 탐구하는 데 광범위하게 사용되었음에도 불구하고 생물정보학 및 네트워크 약리학의 관점에서 살리드로사이드와 VC 간의 상호 작용 메커니즘에 대한 연구는 제한적이었습니다.
이 연구는 광범위한 데이터베이스 마이닝을 통해 주요 표적을 식별하고 분석하여 VC에 대한 살리드로사이드의 잠재적 영향에 대한 분자 네트워크 맵을 구성합니다. 단백질-단백질 상호작용(PPI) 네트워크가 생성되고 토폴로지 분석이 적용되어 석회화 공정에서 중요한 노드를 강조 표시합니다.
컴퓨터 예측을 확인하기 위해 VC의 쥐 모델은 비타민 D3(VD3)가 함유된 고지방 식단을 투여하여 개발되었습니다. 이 모델은 인간 VC의 병리학적 특징을 복제합니다. 조직학적 기법을 통해 혈관 손상을 평가하고, 혈청 지질 프로필 및 염증 마커를 평가하여 살리드사이드의 전신 효과를 조사하고, SAL 항-VC 관련 단백질의 발현을 웨스턴 블로팅을 사용하여 측정하여 실험적으로 유도된 VC에 대한 살리드로사이드의 영향을 탐구하며, 이 연구는 VC와 싸우기 위한 치료 전략으로서 이 화합물의 잠재력에 대한 귀중한 통찰력을 제공하는 것을 목표로 합니다.
프로토콜
이 프로토콜은 장춘중의과대학 실험동물위원회(Experimental Animals Committee)의 승인을 받았습니다(승인 번호 2023091). 이 연구는 유럽 공동체 지침(European Community Guidelines)과 1986년 EEC 지침(EEC Directive of 1986)을 포함한 국제 지침을 준수하여 연구 전반에 걸쳐 동물에 대한 윤리적 대우를 보장합니다. 수컷 Wistar 쥐(8-10주, 체중 200-220g)를 연구에 사용했습니다. 사용된 시약 및 장비에 대한 자세한 내용은 재료 표에 나열되어 있습니다.
1. 잠재적인 살리드로사이드-VC 표적의 네트워크 약리학 예측
참고: 네트워크 약리학은 계산 방법과 대규모 데이터 분석을 활용하여 유기체 내 경로, 유전자 및 단백질과 같은 약물 분자와 생물학적 표적 간의 복잡한 상호 작용을 조사합니다11,12. 이 접근 방식은 연구된 개체의 생물학적 기능과 관계를 해독하는 데 도움이 됩니다. 이 방법론은 데이터베이스 활용, 화학 정보 처리, 생체 활성 데이터 수집, 단백질 데이터 검색, 유전자 발현 프로파일 분석, 상호 작용 네트워크 구축 및 경로11의 농축 분석을 포함합니다. 그림 1은 살리드로사이드와 혈관 석회화 사이의 핵심 표적의 상호 작용 네트워크를 보여줍니다.
- "Ingredient" 타겟 데이터베이스 구축
- HERB, TCMSP, PubChem, SwissTargetPrediction, CTD, PharmMapper, SEA 및 STITCH와 같은 데이터베이스13 ( 보충 표 1 참조)를 검색하기 위한 성분의 키워드로 "Salidroside"를 사용한다.
- 관련 문헌을 검토하여 호모 사피엔스(Homo sapiens)로 설정된 종과 함께 살리드사이드와 관련된 표적을 식별합니다. 중복을 제거한 후 UniProt( 보충 표 1 참조)을 사용하여 표적 단백질을 표준화하고 포괄적인 Salidroside 표적 데이터베이스를 구축합니다14.
- "질병" 대상 데이터베이스 구축
- "혈관 석회화(Vascular calcification)"를 키워드로 사용하여 GeneCards, OMIM, PharmGkb, DrugBank를 포함한 데이터베이스15 ( 보충 표 1 참조)를 검색하고, 종은 호모 사피엔스(Homo sapiens)로 설정된다. 중복 제거 후 혈관 석회화 대상 데이터베이스를 만듭니다.
- 잠재적 치료 표적 예측
- 살리드로이드(salidroside) 및 혈관 석회화(vascular calcification)에 대한 표적을 입력하여( 보충 표 1 참조) 공통 표적을 식별합니다. 벤 다이어그램을 생성하여 혈관 석회화 치료에서 살리드로사이드의 잠재적인 치료 표적을 시각화합니다.
- "Salidroside-Vascular Calcification" 단백질-단백질 상호 작용(PPI) 네트워크 구축
- 잠재적 표적을 Multiple Proteins List로 컴파일하고 유기체를 Homo sapiens로 설정하고 상호 작용 점수를 중간 신뢰도(>0.4)16로 설정하여 STRING(보충 표 1 참조)을 사용하여 분석합니다. 추가 분석을 위해 PPI 데이터를 TSV 형식으로 추출합니다.
참고: 쥐 유전자의 85%가 인간 유전자와 상동하고 유사한 생물학적 기능을 수행한다는 점을 감안할 때, 쥐는 혈관 석회화에 대한 살리드로사이드의 효과를 검증하기 위한 실험 대상으로 선택되었습니다17.
- 잠재적 표적을 Multiple Proteins List로 컴파일하고 유기체를 Homo sapiens로 설정하고 상호 작용 점수를 중간 신뢰도(>0.4)16로 설정하여 STRING(보충 표 1 참조)을 사용하여 분석합니다. 추가 분석을 위해 PPI 데이터를 TSV 형식으로 추출합니다.
- 핵심 대상의 선택 및 네트워크 구축
- CytoNCA 플러그인을 사용하여 BC(Betweenness), CC(Closeness), DC(Degree), EC(Eigenvector), LAC(Local Average Connectivity) 및 NC(Network Centrality)와 같은 매개변수를 평가하기 위해 분석을 위해 PPI 네트워크 데이터를 Cytoscape 3.9.1( 보충 표 1 참조)로 가져옵니다. CC=1 로 키 대상을 선택하여 'SAL-VC'에 대한 핵심 대상 동작 스펙트럼 맵을 구성합니다.
- CytoHubba 플러그인을 사용하여 MCC(Maximal Clique Centrality), MNC(Maximum Neighborhood Component) 및 Degree 계산을 기반으로 상위 10개 허브 유전자를 식별하여 허브 유전자 스펙트럼 맵을 생성합니다.
- GO 및 KEGG 경로 농축 분석
- DAVID( 보충 표 1 참조)를 사용하여 유전자 ID 변환을 수행하고, 종 정보를 위해 유전자 유형-9606에 대한 ENSEMBL_GENE_ID 선택합니다. GO 기능 및 KEGG 경로 농축에 대한 Omicshare( 보충 표 1 참조)를 사용하여 변환된 유전자 목록을 분석하며, 유의성은 P 값 < 0.0518로 설정되었습니다.
참고: GO 기능 분석에는 분자 기능(MF), 생물학적 과정(BP) 및 세포 구성 요소(CC)가 포함됩니다. KEGG 경로 분석에는 경로 강화(pathway enrichment)와 경로 분류 강화(pathway classification enrichment)가 포함된다19. 농축 분석 결과는 그림 2에 나와 있습니다.
- DAVID( 보충 표 1 참조)를 사용하여 유전자 ID 변환을 수행하고, 종 정보를 위해 유전자 유형-9606에 대한 ENSEMBL_GENE_ID 선택합니다. GO 기능 및 KEGG 경로 농축에 대한 Omicshare( 보충 표 1 참조)를 사용하여 변환된 유전자 목록을 분석하며, 유의성은 P 값 < 0.0518로 설정되었습니다.
2. 동물 실험
- 순응
- Wistar 쥐는 12시간의 라이트/다크 사이클을 가진 특정 병원체가 없는(SPF) 조건에서 적응합니다. 실험을 시작하기 전에 건강을 유지하기 위해 음식과 물에 대한 자유가 있는지 확인하십시오. 1주일 동안 적응형 수유를 수행합니다.
- 모델 수립
- 쥐를 환경 조건에 적응시키고 대조군(Ctrl, ND + Vehicle), 모델 그룹(Model, HFD + Vehicle), SAL 저용량 그룹(SAL-L, HFD + SAL 5mg/kg), SAL 고용량 그룹(SAL-H, HFD + SAL 10mg/kg) 및 Simvastatin(SIM) 그룹(HFD + SIM 5mg/kg)의 5개 그룹으로 무작위로 할당합니다.
- 전체 실험 기간 동안 Ctrl 그룹에게는 일반 식단(ND)을, 나머지 그룹에는 고지방 식단(HFD)을 투여합니다. HFD 투여 첫날, Ctrl 그룹20,21을 제외한 모든 그룹에 600,000 IU/kg VD3의 단일 피하 용량을 주입합니다. 이후 8주 동안 매주 100,000IU/kg VD3의 피하 주사를 합니다(그림 3).
- 동물의 건강 상태와 생존을 매일 모니터링하십시오. 9주차에 실험적 개입을 시작한다.
- 연구가 끝나면 동물을 안락사시킵니다(제도적으로 승인된 프로토콜에 따라). 혈청 샘플을 수집하여 30분 동안 그대로 두었다가 원심분리하여 혈청을 분리합니다(이전에 발표된 보고서20,21에 따름). 혈관 조직(복부 대동맥)을 절개하고 인산염 완충 식염수(PBS)로 헹구어 혈액을 제거합니다.
- 조직학적 검사를 위해 조직의 한 부분을 4% 파라포름알데히드에 고정하고 분자 분석을 위해 다른 부분을 액체 질소에 저장합니다.
알림: 사용하기 전에 살리드로사이드를 따뜻한 물로 희석하십시오.
3. HE, VK, EVG 염색을 이용한 혈관 조직 손상 평가
참고: 혈관 조직(복부 대동맥)을 4% 파라포름알데히드로 고정하고 48시간 후에 에탄올에서 탈수하고 파라핀에 묻습니다. Hematoxylin-Eosin(HE), Elastica van Gieson(EVG) 및 Von Kossa(VK) 염색을 위해 포함된 파라핀 블록을 5μm 슬라이스로 절단하고 광학 현미경으로 조직학적 형태를 관찰합니다. HE 염색은 조직 형태의 변화를 평가하는 데 사용됩니다. 혈관 조직에서는 평활근 세포 증식, 무질서한 세포 배열 및 염증을 포함한 혈관 벽의 구조적 변화를 강조합니다. EVG 염색은 탄성 섬유 손상 또는 혈관 조직의 리모델링을 평가하는 데 필수적이며 석회화가 혈관 탄성에 미치는 영향을 이해하는 데 도움이 되는 탄성 섬유와 콜라겐 섬유를 시각화합니다. VK 염색은 VC의 핵심 기능인 칼슘 침전물을 검출하여 혈관 조직에서 석회화의 정도와 분포를 평가하는 데 중요합니다22,23.
- 혈관 조직 손상 감지를 위한 HE 염색
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
- 자일렌을 두 번 갈아주어 각각 8분 동안 절편을 파라핀화하고 단계당 3분 동안 등급이 매겨진 에탄올 계열(100%, 95%, 85%, 75%)을 통해 재수화합니다. 흐르는 수돗물로 2분 동안 헹굽니다.
- 헤마톡실린 염색
- 헤마톡실린으로 섹션을 5-10분 동안 염색하고 세척하여 과도한 얼룩을 제거한 다음 흐르는 수돗물로 헹굽니다.
참고: 세포질 색에 영향을 줄 수 있는 지나치게 어두운 염색을 피하기 위해 5분의 밝은 염색을 권장합니다.
- 헤마톡실린으로 섹션을 5-10분 동안 염색하고 세척하여 과도한 얼룩을 제거한 다음 흐르는 수돗물로 헹굽니다.
- 분화
- 분화 용액에서 30초 동안 섹션을 구별한 다음 수돗물로 각각 3분 동안 두 번 헹굽니다.
- Eosin counterstaining
- 섹션을 에오신 염색에 1분 동안 놓습니다. 과도한 얼룩을 제거한 후 빠른 탈수를 수행하십시오.
- 탈수, 정화 및 장착
- 빠른 탈수를 위해 섹션을 75%, 85%, 95% 및 100% 에탄올에 각각 3초 동안 담근 다음 100% 에탄올을 1분 동안 담그십시오.
참고: eosin은 물과 에탄올 구배에서 색을 잃을 수 있으므로 빠른 탈수가 권장됩니다.
- 빠른 탈수를 위해 섹션을 75%, 85%, 95% 및 100% 에탄올에 각각 3초 동안 담근 다음 100% 에탄올을 1분 동안 담그십시오.
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
- 칼슘 검출을 위한 VK 염색
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
- 3.1.1단계에 따라 이 단계를 수행합니다.
- 질산은 반응
- 섹션을 닦아내고 미세한 브러시로 윤곽을 그린 다음 Von Kossa로 염색합니다( 재료 표 참조). 자외선에 4시간 동안 노출시킨 다음 흐르는 수돗물로 철저히 헹굽니다.
- 헤마톡실린(hematoxylin)을 이용한 대조염색
- 헤마톡실린으로 섹션을 5분 동안 염색하고 흐르는 수돗물로 헹구고 구별하고 다시 헹군 다음 흐르는 수돗물로 헹굽니다.
- Eosin counterstaining
- 등급이 매겨진 에탄올(각각 5분 동안 85% 및 95%)을 통해 섹션을 탈수한 다음 5분 동안 에오신으로 염색합니다.
- 탈수 및 장착
- 에탄올 수조(100% 에탄올 I, II, III 각각 5분)에서 섹션을 탈수하고 크실렌 수조(크실렌 I 및 II 각각 5분)에서 정화합니다. 그런 다음 중성 발삼으로 섹션을 장착합니다.
- 현미경 검사 및 이미지 캡처
- 광학 현미경으로 염색된 부분을 검사하고 분석을 위해 이미지를 캡처합니다.
참고: 칼슘 침전물이 갈색-검은색에서 짙은 검은색으로 나타나고, 핵이 파란색이며, 배경이 빨간색인지 확인합니다. 사용 직전에 신선한 VK 염색을 위해 질산은 용액을 준비하십시오.
- 광학 현미경으로 염색된 부분을 검사하고 분석을 위해 이미지를 캡처합니다.
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
- 탄성 및 콜라겐 섬유를 위한 EVG 염색
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
- 파라핀 부분을 50분 동안 열로 처리한 다음 자일렌에 20분 동안 담가 파라핀을 제거합니다. 각 섹션을 등급이 매겨진 에탄올 시리즈(100%, 95%, 85%, 75%)에 각각 5분 동안 노출시키고 흐르는 수돗물에 5분 동안 헹구는 것으로 마무리합니다.
- EVG 염색
- EVG 염색 용액( 재료 표 참조)을 10분 동안 바른 다음 흐르는 수돗물에 5초 동안 짧게 헹구어 과도한 얼룩을 제거합니다.
- 다음으로, Verhoeff 작업 용액( 재료 표 참조)을 5분 동안 바른 다음 흐르는 수돗물에서 5초 동안 다시 간단히 헹굽니다. 엘라스틴 섬유가 명확하게 보일 때까지 Verhoeff의 차별화 솔루션을 5초 동안 바른 다음 흐르는 수돗물로 5초 동안 헹굽니다.
알림: 구성 요소 A, B 및 C(시판되는 키트에 제공됨)를 5:2:2 비율로 혼합하여 사용하기 전에 Verhoeff 작업 솔루션을 준비합니다. 2시간 이내에 용액을 사용하고 염색 과정에서 필요에 따라 보충하여 섹션이 건조되는 것을 방지합니다.
- 탈수 및 장착
- 등급이 매겨진 에탄올 시리즈(75%, 85%, 95%, 100%)를 통해 각 5초 동안 섹션을 탈수한 다음 각각 1분 동안 자일렌을 두 번 변경하여 설명합니다. 짧은 공기 건조 기간이 지나면 중성 발삼으로 섹션을 장착합니다.
- 현미경 검사 및 이미지 분석
- 광학 현미경으로 염색된 부분을 검사하여 탄성 섬유와 콜라겐 섬유를 시각화하고 후속 분석을 위해 이미지를 캡처합니다.
- 탈파라핀화(Deparaffinization) 및 재수화(rehydration)
4. 알칼리성 인산가수분해효소(ALP) 분석
참고: ALP를 석회화 방지 치료의 효과를 평가하기 위한 핵심 지표로 사용하십시오.
- 시약 준비
- 발색 기질을 얼음처럼 차가운 0.05M pH 9.6 탄산염 완충액에 최종 부피 2.5mL로 용해시킵니다.
참고: 1.59g의 탄산나트륨과 2.93g의 중탄산나트륨을 1,000mL의 이중 증류수에 용해하여 완충액을 준비합니다.
- 발색 기질을 얼음처럼 차가운 0.05M pH 9.6 탄산염 완충액에 최종 부피 2.5mL로 용해시킵니다.
- 기질 희석
- 10μL의 p-니트로페놀 용액(10mM)을 0.05M pH 9.6 탄산염 완충액으로 0.2mL의 최종 부피로 희석하여 0.5mM의 최종 농도를 달성합니다.
- 시료 전처리
- lysis buffer에서 복부 대동맥을 균질화합니다. 균질액(4°C에서 10분 동안 ~12,000 x g)을 원심분리하고 ALP 활성 검출을 위해 상층액을 수집합니다.
참고: 용해 완충액에 인산가수분해효소 억제제가 없는지 확인하십시오. 보류 중인 테스트 샘플을 -80°C에서 보관하여 반복적인 동결-해동 주기를 피하십시오.
- lysis buffer에서 복부 대동맥을 균질화합니다. 균질액(4°C에서 10분 동안 ~12,000 x g)을 원심분리하고 ALP 활성 검출을 위해 상층액을 수집합니다.
- 분석을 위한 마이크로플레이트 준비
- 블랭크 웰, 표준 웰 및 샘플 웰이 있는 96웰 플레이트를 준비합니다. 50 μL의 표준 용액을 표준 웰에 추가하고 50 μL의 보류 중인 테스트 샘플을 샘플 웰에 추가합니다. 플레이트를 37°C에서 10분 동안 배양합니다.
- 반응 종결 및 흡광도 측정
- 각 웰에 100μL의 정지 용액을 추가하여 반응을 종료합니다. 405nm에서 흡광도를 측정하고 흡광도 값을 기반으로 ALP 활성을 계산합니다(제조업체의 지침에 따라 재료 표 참조).
알림: ALP 활성이 있는 표준 또는 샘플을 포함하는 웰은 다양한 노란색 음영을 나타냅니다. 색상은 최대 2시간 동안 안정적입니다.
- 각 웰에 100μL의 정지 용액을 추가하여 반응을 종료합니다. 405nm에서 흡광도를 측정하고 흡광도 값을 기반으로 ALP 활성을 계산합니다(제조업체의 지침에 따라 재료 표 참조).
5. 칼슘 함량 측정
참고: 칼슘 함량 측정은 생물학적 조직의 광물화 정도를 평가하는 데 중요합니다.
- 조직 준비
- 조직을 작은 조각으로 다지고 용해 완충액에서 균질화합니다.
- 시료 희석 및 원심분리
- 용해 완충액에서 조직을 1:10의 비율로 희석합니다. 혼합물을 균질화하고 4°C, 12,000 x g 에서 5분 동안 원심분리합니다. 분석을 위해 상층액을 수집합니다.
알림: 0mM 칼슘 표준 용액을 사용하여 칼슘 표준 희석액(1.0-5mM)을 준비합니다( 재료 표 참조).
- 용해 완충액에서 조직을 1:10의 비율로 희석합니다. 혼합물을 균질화하고 4°C, 12,000 x g 에서 5분 동안 원심분리합니다. 분석을 위해 상층액을 수집합니다.
- 플레이트 설정 및 배양
- 50μL의 표준 또는 테스트 샘플을 96웰 플레이트의 각 웰에 추가합니다. 150μL의 분석 작업 용액을 추가하고 완전히 혼합한 후 10분 동안 실온의 암흑 속에서 플레이트를 배양합니다. 575nm에서 흡광도를 측정하고 표준 곡선을 구성합니다.
- 칼슘 함량 계산
- 표준 곡선을 사용하여 희석 계수, 시료 부피 및 칼슘의 원자량을 통합하여 칼슘 함량을 계산합니다.
6. 염증성 사이토카인(IL-6, TNF-α, IL-1β)에 대한 효소 결합 면역흡착 분석법(ELISA)
참고: IL-6, IL-1β 및 TNF-α는 염증 반응의 존재 및 중증도를 나타내는 주요 전염증성 사이토카인입니다. 이러한 사이토카인을 측정하는 것은 염증 과정을 이해하고 항염증 치료의 효과를 평가하는 데 필수적입니다.
- 시료 채취
- 쥐의 복부 대동맥에서 혈청을 수집합니다. 실온에서 2시간 동안 응고시킵니다. 3,000 x g에서 4°C에서 10분 동안 시료를 원심분리하고 상층액을 수집합니다.
- 분석을 위한 마이크로플레이트 준비
- 표준물질 및 테스트 샘플용으로 지정된 웰이 있는 96웰 플레이트를 준비합니다. 다양한 농도의 50μL의 표준물질( 재료 표 참조)을 적절한 웰에 추가합니다.
- 시료 전처리
- 테스트 샘플용으로 지정된 각 웰에 40μL의 샘플 희석액을 추가합니다. 10μL의 시료를 동일한 웰에 첨가하여 5배 희석합니다.
- 효소 표지 시약을 사용한 배양
- IL-6, TNF-α 또는 IL-1β에 특이적인 효소 표지 시약 100μL를 블랭크를 제외한 모든 웰에 추가합니다. 플레이트를 37°C에서 60분 동안 배양합니다.
- 세탁
- 블랭크를 제외한 모든 웰에서 액체를 버리십시오. 1x 세척 용액(증류수에 20배 희석으로 준비)으로 우물을 씻습니다. 이 세척 단계를 5회 반복하고 우물을 말리십시오.
- 색상 개발 및 종료
- 50μL의 기질 용액 A 및 B(시판되는 키트에서 제공, 재료 표 참조)를 각 웰에 추가합니다. 부드럽게 섞고 37°C의 어두운 곳에서 15분 동안 플레이트를 배양합니다. 각 웰에 50μL의 정지 용액을 추가하여 반응을 종료합니다.
- 흡광도 측정 및 데이터 분석
- 블랭크 웰을 0으로 설정합니다. 마이크로플레이트 리더를 사용하여 450nm에서 흡광도를 측정합니다. OD 값과 표준 농도를 기반으로 표준 곡선을 생성합니다. 보간법을 사용하여 시료 농도를 계산하고 희석 계수를 조정합니다.
7. 지질 프로필 분석
참고: 지질 프로필 분석은 비정상적인 지질 수치를 감지하며, 지질 수치가 상승하거나 불균형하면 혈관 석회화의 위험을 가속화할 수 있습니다.
- 총 콜레스테롤 및 트리글리세리드(TC 및 TG)
- 혈청을 수집하고 블랭크, 보정 및 보류 중인 테스트 샘플을 위해 지정된 웰이 있는 96웰 플레이트를 준비합니다. 각 웰에 2.5μL의 혈청, 검량 표준물질 또는 블랭크 용액을 추가합니다.
- 각 웰에 250μL의 작업 용액을 추가합니다. 부드럽게 섞고 플레이트를 37°C에서 10분 동안 배양합니다. 마이크로플레이트 리더를 사용하여 500nm에서 흡광도를 측정합니다.
- 저밀도 지단백질 및 고밀도 지단백질(LDL-C 및 HDL-C)
- 혈청을 수집하고 블랭크, 보정 및 보류 중인 테스트 샘플용으로 지정된 웰이 있는 96웰 플레이트를 준비합니다. 2.5μL의 혈청, 검량 표준물질 또는 블랭크 용액을 각 웰에 추가합니다.
- 분석 키트 지침에 명시된 대로 각 웰에 적절한 시약(180 μL의 경우 1번 시약 또는 60 μL의 경우 2번 시약, 재료 표 참조)을 추가합니다. 온도(37°C)에서 각 시약에 권장되는 시간(시약 1은 5분 또는 시약 2는 10분) 동안 배양합니다.
- 마이크로플레이트 리더를 사용하여 LDL-C 또는 HDL-C에 대해 표시된 특정 파장(600nm)에서 흡광도를 측정합니다.
8. 웨스턴 블로팅
참고: 웨스턴 블롯(WB)은 주요 단백질의 발현 수준을 평가하는 데 중요한 역할을 하며, 총 형태와 인산화 형태를 모두 검출할 수 있습니다.
- 조직 준비
- 조직 0.05g의 무게를 측정하고 PBS로 철저히 헹구어 과도한 이물질을 제거합니다. 1x phosphatase 및 protease 억제제를 함유한 500μL의 lysis buffer를 추가합니다. 조직을 4°C에서 10분 동안 배양하고 조직 분쇄기를 사용하여 균질화합니다.
- 단백질 추출
- 균질화된 샘플을 1분 동안 그대로 둔 다음 4°C 및 12,000 x g 에서 15분 동안 원심분리합니다. 단백질 분석을 위해 상층액을 수집합니다. 제조업체의 지침에 따라 BCA 방법을 사용하여 단백질 농도를 측정합니다( 재료 표 참조). 표준 곡선을 사용하여 농도를 계산합니다.
알림: 사용하기 전에 원심분리기를 4°C로 예냉각하십시오. 562nm에서 단백질 농도를 측정합니다.
- 균질화된 샘플을 1분 동안 그대로 둔 다음 4°C 및 12,000 x g 에서 15분 동안 원심분리합니다. 단백질 분석을 위해 상층액을 수집합니다. 제조업체의 지침에 따라 BCA 방법을 사용하여 단백질 농도를 측정합니다( 재료 표 참조). 표준 곡선을 사용하여 농도를 계산합니다.
- 시료 전처리
- 단백질 샘플을 β-메르캅토에탄올과 SDS가 4:1 비율로 함유된 5x loading buffer와 혼합합니다. 혼합물을 100°C에서 5분 동안 가열하여 단백질을 변성시킵니다.
참고: 1x 로딩 버퍼가 필요한 경우 5x 버퍼를 용해 버퍼로 희석합니다.
- 단백질 샘플을 β-메르캅토에탄올과 SDS가 4:1 비율로 함유된 5x loading buffer와 혼합합니다. 혼합물을 100°C에서 5분 동안 가열하여 단백질을 변성시킵니다.
- SDS-PAGE 젤 준비
- 12% SDS-PAGE 겔을 준비하여 전기영동 장치에 넣습니다. 지침에 따라 중간 표시까지 1x 전기영동 버퍼를 추가합니다( 보충 표 2 참조).
- 전기영동
- -20 °C에서 단백질 샘플을 검색합니다. 웰당 60μg의 단백질을 로드하고 겔을 실행합니다.
- 스태킹 겔에 대해 전류를 20분 동안 50mA로 설정한 다음 염료 전면이 바닥에 도달할 때까지 분리 젤에 대해 60분 동안 100mA로 높입니다.
- 멤브레인 전달
- 메탄올의 PVDF 멤브레인을 5분 동안 활성화합니다.
- 전사 샌드위치를 여과지 → SDS-PAGE 젤 → PVDF 멤브레인 → 여과지 순서로 조립합니다. 300mA에서 60분 동안 단백질을 전달합니다.
알림: SDS-PAGE 젤과 PVDF 멤브레인 사이에 기포가 끼지 않도록 하십시오.
- 블로킹
- PVDF 멤브레인을 실온에서 5% BSA(1x TBST로 준비)에 넣고 60분 동안 부드럽게 흔들어 배양합니다. 1x TBST로 멤브레인을 각각 5분 동안 3회 세척합니다.
- 1차 항체 배양
- 차단 완충액에 희석한 적절한 1차 항체(예: p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB p65, NF-κB p65, IκBα) 5mL에 멤브레인을 실온에서 2.5시간 동안 배양합니다.
- 2차 항체 배양
- 1차 항체 배양 후 각각 5분 동안 1x TBST로 멤브레인을 3회 세척합니다. 적절한 2차 항체를 실온에서 1시간 동안 배양합니다. 1x TBST로 멤브레인을 각각 5분씩 3회 다시 세척합니다.
- 탐지
- ECL 화학발광 검출24 를 사용하여 단백질 띠를 시각화합니다( Table of Materials(재료표 참조).
- 밀도 측정 분석
- ImageJ 소프트웨어를 사용하여 단백질 밴드를 정량화합니다. ImageJ: Image → 8-bit → Process → Subtract Background(배경 빼기)에서 이 워크플로우를 따릅니다. 분석 → 측정값 설정 → 분석 → 척도 설정. → 결과를 편집→ 반전→ 분석 → 측정합니다. 파일 → IntDen→ 다른 이름으로 저장합니다.
- 그래프 작성 및 통계 분석 소프트웨어를 사용하여 통계 그래프를 생성합니다.
참고: 결과를 검증하기 위해 반복 실험 전반에 걸쳐 결과가 일관되는지 확인합니다.
9. 통계 분석
- GraphPad Prism 9.0을 사용하여 데이터를 수집하고 구성합니다.
- 원시 데이터의 평균 ± SD를 사용하여 오차 막대를 계산하고 플로팅합니다.
- 일원분산분석(One-Way ANOVA)을 사용하여 통계 분석을 수행한 후 다중 비교를 위한 Tukey의 사후 검정을 수행합니다.
- P < 0.05에서 통계적 유의성을 확인하며, P-값이 작을수록 결과의 차이가 더 크다는 것을 나타냅니다.
결과
네트워크 약리학 분석
HERB, TCMSP, Pubmed, SwissTargetPrediction, CTD, PharmMapper, SEA 및 STITCH와 같은 데이터베이스를 사용하여 살리드로사이드에 대한 388개의 잠재적 표적 유전자를 확인했습니다. 또한 VC와 관련된 2871개의 잠재적 표적 유전자를 GeneCards, OMIM, PharmGkb 및 DrugBank와 같은 데이터베이스에서 검색했습니다. VENN 다이어그램을 통한 교차 분석은 VC에 대한 살리드로사이드의 개입을 위한 주요 타겟으로 간주되는 208개의 중첩 타겟을 보여주었습니다(그림 1A).
PPI 네트워크 분석
STRING 플랫폼을 사용하여 상위 100개의 노드를 선택한 208개의 주요 대상 간의 상호 작용을 분석했습니다. 그런 다음 이러한 노드를 Cytoscape 3.9.1로 가져와 자세한 PPI 네트워크를 구축했습니다. EC, BC, NC, LAC, CC 및 DC와 같은 매개변수를 사용한 네트워크 토폴로지 분석은 37개의 핵심 대상을 식별했습니다. 학위, MCC 및 MNC에 초점을 맞춘 추가 개선을 통해 IL6, TNF, TP53, IL1B, HIF1A, CASP3 및 STAT3을 포함한 상위 10개 핵심 대상을 정확히 찾아냈습니다(그림 1B).
GO 기능 및 KEGG 경로 분석
208개의 주요 표적에 대한 GO 기능 분석을 통해 4808개의 생물학적 과정, 294개의 세포 구성 요소 및 515개의 분자 기능을 식별했습니다. KEGG 경로 분석은 주로 신진대사, 유전 및 환경 정보 처리, 유기체 시스템, 세포 과정 및 인간 질병과 관련된 281개의 신호 전달 경로를 보고했습니다. 확인된 유전자의 대부분은 지질 및 죽상동맥경화증 경로에서 풍부하게 분포되어 있는 것으로 밝혀졌으며, 이는 SAL이 VC를 개선하는 핵심 메커니즘이 지질 및 염증 인자의 비정상적인 변화를 조절하는 것과 관련이 있을 수 있음을 나타냅니다(그림 2).
In vivo 실험 검증
Ctrl 그룹과 비교했을 때, 모델 그룹의 쥐들은 비만, 무기력증, 칙칙한 털을 보였다. 혈청 지질 프로파일은 모델 그룹에서 TC, TG 및 LDL-C 수치가 유의하게 증가하고 HDL-C가 감소한 것으로 나타났습니다(p < 0.05). 반대로, SAL-L, SAL-H 및 SIM 그룹은 이러한 매개변수에서 상당한 개선을 보였으며, SAL 그룹에서는 용량 의존적 효과(p < 0.05)가 나타났습니다(그림 4).
HE 염색은 쥐 복부 대동맥의 구조적 변화를 확인하는 데 사용되었으며, EVG 염색은 탄성 섬유의 상태를 평가하고, VK 염색은 칼슘 침전물을 확인하는 데 사용되었습니다. 대조군에서 HE 염색은 복부 대동맥 조직의 뚜렷한 층을 묘사했고, EVG 염색은 파괴를 최소화하면서 탄성 섬유의 깔끔한 배열을 보여주었습니다. 칼슘 침전물은 VK 염색에 따라 현저하게 나타나지 않았습니다. 반대로, 모델 그룹은 내막 증식증과 염증성 세포 침투를 동반한 혈관 조직을 보였으며, 배지 층의 광범위한 구조적 혼란을 보였습니다. 탄력 있는 섬유와 평활근 세포의 구분은 불분명했고, 섬유는 눈에 띄는 괴사성 석회화와 함께 불규칙하게 배열되어 있었습니다. 외래 림프구 침투도 관찰되었다. 이 그룹의 EVG 염색은 광범위한 파손과 함께 탄성 섬유의 무질서한 패턴을 나타냈으며 VK 염색은 상당한 칼슘 침전물을 확인했습니다.
SAL 중재 후, VC는 혈관 손상의 눈에 띄는 개선을 관찰했습니다. HE 염색은 SAL-L 및 SAL-H 그룹이 배지에서 최소한의 평활근 세포 퇴행과 함께 잘 정의된 혈관층 구조를 가지고 있음을 나타냅니다. EVG 염색 후, 두 그룹의 탄성 섬유는 SAL-H 그룹이 SAL-L 그룹보다 성능이 뛰어나 중단이 거의 없이 깔끔하게 정렬되었습니다. VK 염색 결과 두 그룹 모두에서 유의미한 칼슘 침전물이 나타나지 않았으며, 이는 SAL이 VC에 의해 유도된 혈관 구조 변화를 완화했음을 시사합니다.
SIM 개입 후, 혈관 구조적 변화는 SAL-H 그룹의 변화를 반영했습니다. HE 염색은 배지에서 최소한의 평활근 세포 퇴행과 함께 명확한 복부 대동맥 구조를 보여주었습니다. EVG 염색은 파쇄가 거의 없는 탄성 섬유의 질서 정연한 배열을 확인했으며, Von Kossa 염색은 상당한 칼슘 침전물을 감지하지 못했습니다. 이러한 결과는 SAL 그룹이 VC와 관련된 부작용을 유의하게 개선했음을 시사합니다(그림 5).
칼슘 이온(Ca2+)과 ALP 수치는 모두 Ctrl 그룹(p < 0.05)에 비해 모델 그룹에서 유의하게 높았습니다. 그러나 이러한 수치는 SAL-L 및 SAL-H 그룹에서 현저히 감소했으며, SAL의 더 높은 용량이 우수한 효능을 입증했습니다(그림 6A, B). 또한, 모델 그룹에서는 Bone Morphogenetic Protein-2(BMP2)의 발현이 눈에 띄게 향상된 반면(p < 0.001), SAL 그룹은 BMP2 발현이 다양한 범위(p < 0.01)로 감소한 것으로 나타났습니다(그림 6C). 염증 인자 분석은 모델 그룹에서 TNF-α 및 IL-6의 유의한 상향 조절을 보여주었으며(p < 0.05), 이는 VC로 인한 염증 반응을 나타냅니다(그림 6D-F). SAL 치료 후, 이러한 염증 마커는 유의하게 감소했으며(p < 0.05), SAL-H 그룹에서 더 나은 결과를 보였다.
혈관 조직의 단백질 발현 분석에서 모델 그룹에서 JAK2, STAT3 및 NF-κB p65의 인산화 수준이 증가하고 IκBα의 발현이 감소한 것으로 나타났습니다(p < 0.05). SAL-L 및 SAL-H 처리는 모두 JAK2, STAT3 및 NF-κB p65의 인산화 수준을 유의하게 감소시키는 동시에 IκBα 발현을 증가시켜 살리드로사이드가 JAK2/STAT3 신호 전달 경로를 통한 VC 진행을 완화하는 것을 시사합니다(그림 7).
이러한 결과는 네트워크 약리학 및 생체 내 검증에 의해 뒷받침되는 VC에 대한 SAL의 잠재적인 치료 효과를 강조하는 동시에 가능한 작용 메커니즘에 대한 통찰력을 제공합니다.

그림 1: 살리드로사이드와 혈관 석회화 사이의 핵심 표적의 상호 작용 네트워크. (A) 살리드로사이드와 혈관 석회화 사이의 핵심 표적의 상호 작용 네트워크의 흐름도. (B) 살리드로사이드 타겟(보라색)과 혈관 석회화 타겟(녹색) 사이의 중복을 보여주는 벤 다이어그램. 교차하는 대상은 검은색 텍스트로 표시됩니다. (C) VC에 대한 살리드로사이드의 효과와 관련된 잠재적인 핵심 표적 상호 작용 네트워크. (1) PPI 네트워크의 상위 100개 인접 노드. 각 노드는 대상을 나타내고 각 가장자리는 대상 간의 상호 작용을 나타냅니다. (2) 허브 유전자 네트워크(CytoNCA 플러그인을 사용하여 식별된 37개의 노드). (3) PPI 네트워크의 상위 20개 인접 노드. (4-6) CytoHubba 플러그인을 사용하여 Degree, MCC 및 MNC 기준에 따라 식별된 주요 대상(각각 10개 노드). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
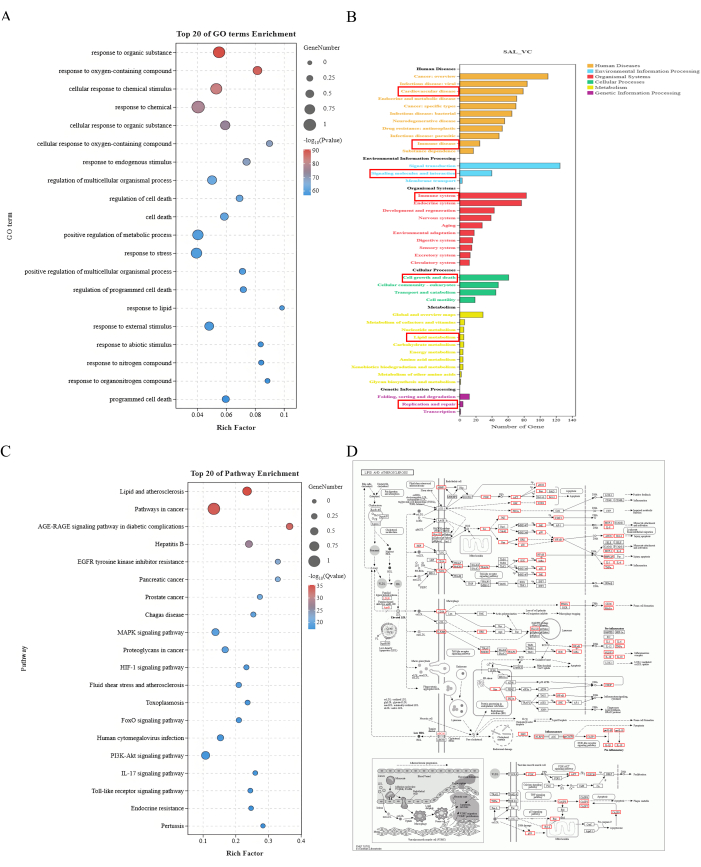
그림 2: 농축 분석 결과. (A) 상위 20개 GO 용어 농축. X축은 Rich Factor를 나타내고 Y축은 GO 용어를 나타냅니다. 점의 크기는 유전자의 수를 나타내고 색상은 -log10(P 값)을 나타내고 빨간색은 더 작은 P 값을 나타냅니다. (B) KEGG 경로 강화 주석. X축은 유전자의 수를 나타내고 Y축은 다양한 수준의 주석 정보를 나타냅니다. 서로 다른 색상은 첫 번째 수준 주석의 다양한 범주를 나타냅니다. (C) 상위 20개 경로 강화. X축은 Rich Factor를 나타내고 Y축은 GO 용어를 나타냅니다. 점의 크기는 유전자의 수를 나타내고 색상은 -log10(P 값)을 나타내고 빨간색은 더 작은 P 값을 나타냅니다. (D) 지질 및 죽상동맥경화증 경로 지도. 빨간색 상자는 지질 및 죽상동맥경화증 경로에서 농축된 VC에서 살리드로이드 중재의 잠재적 표적을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 생체 내 실험을 통해 쥐의 혈관 석회화에 대한 살리드로사이드의 효과 조사. 실험 설계의 순서도. Wistar 쥐는 11w 실험에 사용되었습니다. 첫 주 동안 쥐는 적응한 다음 후속 실험을 위해 Ctrl, Model, SAL-L, SAL-H 및 SIM의 5개 그룹으로 무작위로 나뉘었습니다. 1-9주차에는 Ctrl 그룹에게 일반 다이어트(ND)를 먹이는 것이 포함되었고, 다른 그룹은 600,000 IU/kg VD3를 한 번 주사한 후 8w부터 시작하여 매주 100,000 IU/kg VD3를 주사하는 고지방 다이어트(HFD)를 받았습니다. 9주차부터 10주차까지 모든 그룹이 HFD로 전환했으며(Ctrl 그룹 제외), SAL-L 및 SAL-H 그룹은 각각 5mg/kg 및 10mg/kg의 살리드로시드 복강내 주사를 받은 반면, SIM 그룹은 5mg/kg(n = 8)으로 심바스타틴을 투여받았습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
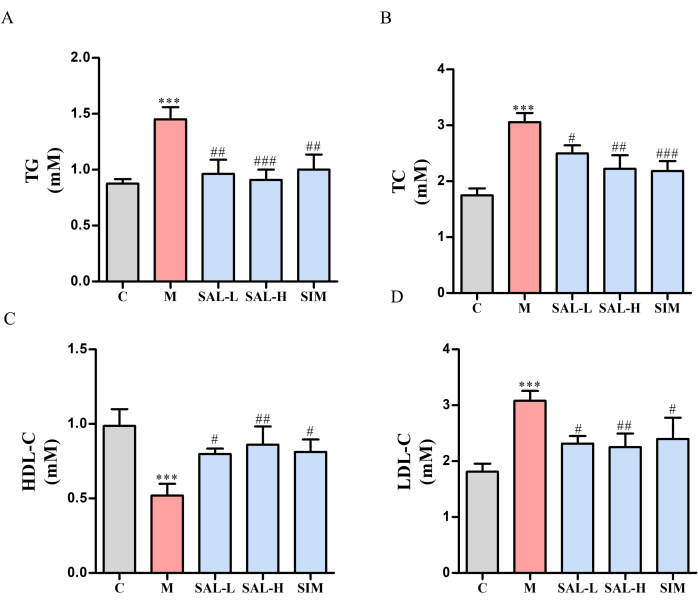
그림 4: 살리드로사이드로 처리된 VC 쥐의 혈청 지질 수치. VC 랫드의 혈청-지질 수치는 단일 시약 GPO-PAP 및 이중 시약 직접 방법을 사용하여 측정되었습니다. (A) TG 수준(단일 시약 GPO-PAP 방법). (B) TC 수준(단일 시약 GPO-PAP 방법). (C) HDL-C 수준(이중 시약 직접 방법). (D) LDL-C 수치(이중 시약 직접 방법). 각 열은 평균 ± SD(n = 8)를 나타냅니다. Ctrl 그룹에 비해 P 는 0.001<. 모델 그룹에 비해 ###P < 0.001, ##P <0.01, #P < 0.05입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
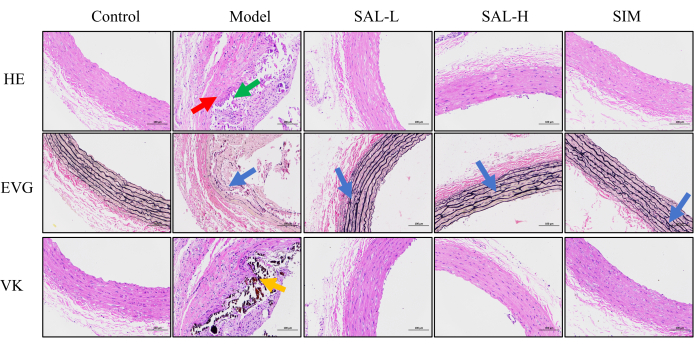
그림 5: VC 쥐의 혈관 조직 손상에 대한 조직학적 평가. HE 염색은 조직 손상을 평가하는 데 사용되었으며, 빨간색 화살표는 내측 석회화를 나타내고 녹색 화살표는 외막의 림프구 침투를 나타냅니다. 핵은 파란색으로 염색되고 세포질은 빨간색으로 염색됩니다. EVG 염색은 복부 대동맥의 탄성 섬유 손상을 관찰하는 데 사용되었으며, 파란색 화살표는 탄성 섬유 파열 및 무질서 영역을 나타냅니다. 탄력 있는 섬유는 붉은색으로 나타나고 근육은 옅은 빨간색으로 보입니다. 복부 대동맥의 칼슘 침착을 관찰하기 위해 VK 염색을 사용했으며, 주황색 영역은 칼슘 침전물을 나타내며 검은색으로 나타납니다(스케일 바: 100μm, n = 8). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
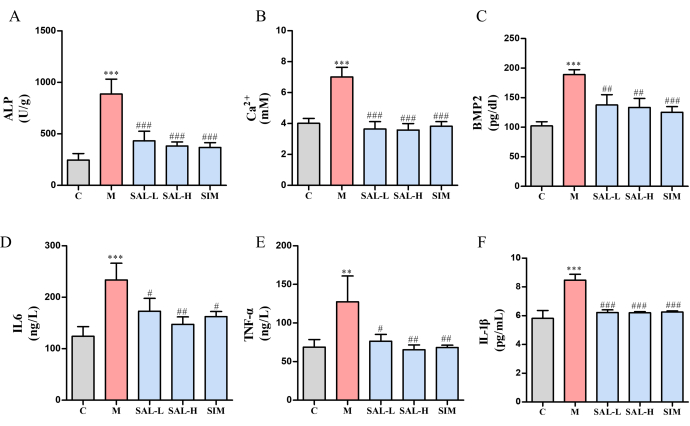
그림 6: 살리드로시드로 처리된 VC 쥐에서 뼈 석회화 마커 및 염증성 사이토카인의 발현.(A) ALP 활성(혈관 석회화 마커). (B) 칼슘 이온 함량. (C) BMP2 발현(뼈 형태 유전 단백질). (D) IL-6 발현(전염증성 사이토카인). (E) TNF-α 발현(전염증성 사이토카인). (F) IL-1β 발현(전염증성 사이토카인). 각 열은 평균 ± SD(n = 8)를 나타냅니다. Ctrl 그룹에 비해 P < 0.001, **P < 0.01; 모델 그룹과 비교했을 때, ###P < 0.001, ##P < 0.01, #P < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
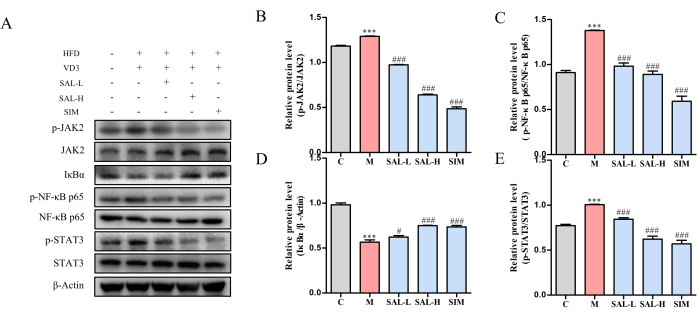
그림 7: 살리드로사이드를 투여한 VC 쥐의 주요 단백질 발현에 대한 웨스턴 블롯 분석.(A) p-JAK2, JAK2, p-STAT3, STAT3, p-NF-κB p65, NF-κB p65 및 IκBα 단백질 발현 수준의 웨스턴 블롯 분석. (B) 다른 그룹에서 P-JAK2/JAK2의 상대적 단백질 발현. (C) 다른 그룹에서 p-NF-κB p65, NF-κB p65의 상대 단백질 발현. (D) 다른 그룹에서 IκBα의 상대 단백질 발현. (E) 다른 그룹에서 P-STAT3/STAT3의 상대 단백질 발현. 각 열은 평균 ± SD(n = 8)를 나타냅니다. Ctrl 그룹과 비교했을 때, P는 0.001<; 모델 그룹과 비교했을 때, ###P < 0.001, ##P < 0.01, #P < 0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 8: VC 쥐에서 살리드로이드 개입의 제안된 분자 메커니즘. 살리드로시드가 VC에 개입하는 제안된 분자 메커니즘은 지질 관련 인자 및 전염증성 사이토카인(IL-1β, IL-6, TNF-α)의 억제를 포함합니다. Salidroside는 IκBα의 활성화와 JAK2의 인산화를 억제하여 NF-κB/STAT3 염증-면역 경로를 억제합니다. 이는 궁극적으로 VC 진행과 관련된 혈관 조직 손상을 감소시킵니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 표 1: 네트워크 약리학 데이터베이스 정보. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: SDS-PAGE의 구성 요소(1개 샘플용). 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
VC는 혈관 세포와 조직의 퇴행성 변화를 특징으로 하며, 혈관 내 병리학적 미네랄 침전물이 혈관 벽을 굳게 하거나 죽상경화성 플라크를 형성하여 폐쇄성 혈관 질환을 유발할 수 있습니다25. 연구에 따르면 VC 플라크의 약 85%가 급성 심혈관 발작을 유발할 수 있는 혈전증으로 발전할 수 있습니다. 또한, VC는 잠재적인 급성 심혈관 질환, 뇌졸중 및 말초 혈관 질환의 중요한 지표이다26. 현재의 치료법은 주로 항응고제, 지질 저하제, 혈관 긴장 조절에 초점을 맞추고 있지만, 이러한 치료법은 특히 석회화가 진행된 단계에서 효과가 제한적이고 부작용이 있는 경우가 많습니다.
p-하이드록시페네틸-베타-D-글루코피라노사이드로 확인된 화합물인 살리드로사이드(SAL)는 신경계, 심혈관 및 면역 체계에 영향을 미치는 다양한 혈관 상태뿐만 아니라 만성 신장 질환27,28에 영향을 미치는 상당한 치료 가능성을 보여주었습니다. 현대 연구에 따르면 항산화, 노화 방지, 면역 조절 및 항염증 효과가 확인되었습니다 29,30,31. Salidroside는 혈관 수축 작용을 억제하고 혈관 확장제를 촉진하여 내피 기능을 개선하고 혈관 탄력성을 향상시키는 효과가 현저하다32. 혈관의 탄력성은 석회화 이후의 변화를 직접적으로 반영하며, 탄력 있는 단백질의 분해를 동반하는 탄력성 손실은 종종 혈관의 내층과 중간층을 손상시킵니다. 이러한 손상은 종종 염증 세포의 활성화로 나타납니다. 수많은 연구에서 VC와 염증 사이의 밀접한 연관성을 강조하고 있습니다. 만성 염증은 이소성 석회화(ectopic calcification)의 핵심 원인으로 여겨지는데, 이때 전염증성 세포(pro-inflammatory cell)가 증식하고 여러 경로를 통해 VC에 기여하는 인자를 방출한다 33,34,35,36. 다중 표적 치료제로서 Salidroside의 잠재력은 혈관 석회화가 염증, 지질 대사 및 산화 스트레스를 포함하는 복잡한 병리학적 과정이라는 점을 감안할 때 특히 관련이 있습니다. 지질 축적 및 산화 스트레스를 조절하면서 염증 경로를 억제하는 Salidroside의 다중 표적 접근법은 현재 사용 중인 단일 표적 약물에 비해 뚜렷한 이점을 제공합니다. 따라서 본 연구에서는 염증인자 발현을 조사하여 살리드로사이드가 염증을 감소시켜 VC에 영향을 미치는지 여부를 추가로 조사할 것입니다.
2007년 Hopkins에 의해 도입된 네트워크 약리학의 개념은 네트워크 기반 접근법을 사용하여 약물, 질병 및 표적이 여러 구성 요소, 표적 및 경로 간에 어떻게 상호 작용하는지 조사하는 것을 포함합니다37. 이 연구에서는 네트워크 약리학을 사용하여 SAL이 VC와 어떻게 상호 작용하는지 예측하고 IL6, STAT3, TNF, TP53 및 ALB와 같은 중요한 표적을 정확히 찾아냈습니다. 그 결과 지질 대사 및 죽상동맥경화증 경로에 이러한 유전자가 집중되어 있음을 나타내었으며, 이는 VC가 동맥의 지질 축적 및 염증과 관련이 있을 수 있음을 시사합니다. 이러한 예측을 검증하기 위해 VD3와 결합된 고지방 식단에 의해 유도된 VC의 랫트 모델을 사용했습니다. 이 모델을 통해 SAL이 VC에 미치는 영향을 추가로 탐색할 수 있었습니다. 그 결과, VC는 HDL-콜레스테롤을 낮추면서 TC, TG 및 LDL-콜레스테롤의 수치를 증가시키는 것으로 밝혀졌습니다. 더욱이, 다른 용량의 SAL은 이러한 비정상 지표를 조절하는 데 다양한 효과를 보여주었습니다. 추가 연구 결과에 따르면 SAL은 복부 대동맥의 칼슘 침착을 효과적으로 감소시키고, 비정상적인 칼슘 이온 수치를 교정하며, 염증 세포 침투를 감소시키는 동시에 ALP 및 BMP2와 같은 석회화 관련 마커의 발현을 감소시키는 것으로 나타났습니다.
JAK/STAT 경로는 다양한 성장 및 신호 전달 과정에서 중요한 역할을 하며, 면역 반응과 세포 분화를 조절하여 염증 반응에 필수적입니다38. IL-6에 의해 활성화되는 STAT3는 급성기 반응의 일부로, IL-6는 JAK 인산화를 유도하고, 이는 다시 STAT3를 인산화합니다. 이 활성화는 세포 성장, 분화 및 생존과 관련된 유전자 발현을 제어합니다. STAT3의 지속적인 인산화는 혈관 질환과 관련이 있으며 접착 분자의 비정상적인 발현으로 이어질 수 있으며, 이는 초기 VC 단계에서 혈관 내막에 대한 단핵구의 접착을 촉진하여 혈관 구조를 더욱 손상시킵니다39,40. 실험 결과는 SAL이 인산화된 JAK2, STAT3 및 NF-κB p65의 발현을 억제하는 동시에 IκBα의 발현을 촉진하는 것으로 나타나 VC 진행을 억제하는 SAL의 역할이 IL-6/JAK2/STAT3 신호 전달 경로를 통해 매개됨을 시사합니다(그림 8).
이 연구에서 네트워크 약리학은 VC 진행과 관련된 주요 메커니즘을 성공적으로 예측하여 SAL이 개입하는 표적과 경로를 식별했습니다. 쥐와 인간 시스템 사이의 생리학적, 병리학적 유사성으로 인해 쥐 모델은 미래의 임상 연구에 특히 가치가 있습니다. 또한 쥐는 비용 효율적이고 다루기 쉬워 질병 연구 및 약물 발견에 적합합니다. 동물 모델의 장점에도 불구하고 한계가 있습니다. 쥐 모델은 도움이 되기는 하지만 인간의 VC 개발의 복잡성을 완전히 포착할 수는 없습니다. 향후 연구에서는 보다 다양한 모델을 포함하고 동반질환 및 다양한 환자 배경과 같은 요인을 고려해야 한다.
그러나 이 연구에는 몇 가지 제한 사항이 있습니다. 실험 기간은 10주였으며, 이 기간 동안 쥐에게 초기 고용량의 고지방 식단(HFD)을 먹인 후 VC를 유도하기 위해 VD3를 여러 번 저용량으로 투여했습니다. 쥐 모델에서 관찰된 높은 사망률은 예비 실험에서 처음 주목되었는데, VD3를 고용량으로 장기간 투여하면 쥐의 생존율이 현저히 감소하여 궁극적으로 실험의 질과 일정에 영향을 미친다는 사실이 밝혀졌습니다. 이는 생존율을 높이고 보다 강력한 데이터를 얻기 위해 모델을 최적화해야 할 필요성을 강조합니다. 이 연구는 쥐의 VC에 대한 SAL의 효과를 확인했지만, VC의 복잡성과 장기간의 개발 과정은 단일 동물 연구가 병태 생리학을 완전히 포착하지 못할 수 있음을 의미합니다. 향후 연구는 쥐의 생존율을 높이기 위해 모델을 개선하는 데 초점을 맞춰야 합니다. 또한, 생체 내 실험에서 SAL이 JAK2/STAT3 경로를 통해 염증 인자를 조절하여 VC를 감소시키는 것으로 입증되었지만, 추가 연구에서는 in vitro에서 업스트림 및 다운스트림 타겟을 탐색해야 합니다. 마지막으로, SAL에 대한 임상 연구는 제한적이며, 인간에 대한 SAL의 효능과 안전성을 평가하기 위해서는 더 많은 연구가 필요합니다. VC는 만성 신장 질환, 뇌혈관 질환 및 관상 동맥 동맥 경화증을 포함한 여러 상태와 관련이 있습니다. 이 연구는 혈관 관련 질환에 대한 치료법을 탐색하는 데 추가로 활용할 수 있는 VC 모델을 성공적으로 확립했습니다. 여기에 사용된 실험 설계 및 기술은 VC와 관련된 약물 발견을 위한 귀중한 기반을 제공합니다.
요약하면, 본 연구는 네트워크 약리학과 분자 생물학을 활용하여 살리드로사이드가 혈관 석회화에 미치는 영향을 조사했습니다. 연구 결과는 SAL이 JAK2/STAT3 경로를 통해 염증을 감소시키고, 지질 인자 발현을 낮추고, VC 마커를 감소시켜 VC를 억제한다는 것을 보여주며, VC 치료를 위한 유망한 치료법을 제시합니다.
공개
모든 저자가 모든 이해 상충을 공개했는지 확인합니다.
감사의 말
이 작업은 길림성 과학기술부 프로젝트(YDZJ202301ZYTS460)와 길림성 교육부 프로젝트(JJKH20230991KJ)의 재정 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 30% (29:1) Acrylamide/Bis Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | A1010 | |
| 4% Paraformaldehyde Fix Solution | Beyotime Biotech Inc (Beyotime) , China | P0099 | |
| 5*loading buffer | Beijing Solarbio Science & Technology Co., Ltd ,China | P1040 | |
| Alkaline Phosphatase Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0321S | |
| AlphaView Software | Proteinsimple Inc.USA | AlphaView SA | |
| BCA Protein Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0012 | |
| Bluing Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | G1866 | |
| Calcium Colorimetric Assay Kit | Beyotime Biotech Inc (Beyotime) , China | S1063S | |
| Collagen Fiber And Elastic Fiber Staining Kit(EVG-Verh eff Method) | Beijing Solarbio Science & Technology Co., Ltd ,China | G1597 | |
| Dewatering machine | Diapath Biosciences Ltd, Italy | Donatello | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd,China | JB-P5 | |
| Enzyme-labeled instrument | Biotek Co., Ltd,USA | Epoch | |
| Ethanol absolute | GHTECH Co., Ltd, China | 64-17-5 | |
| Goat Anti-Mouse IgG (H+L) HRP | Bioworld technology, co, Ltd.,China | BS20242-Y | |
| GraphPad Prism Software | GraphPad Software.,USA | GraphPad Prism 9.0 | |
| Hematoxylin-Eosin Stain Kit | Beijing Solarbio Science & Technology Co., Ltd ,China | G1120 | |
| High-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A112 | |
| HRP-labeled Goat Anti-Rabbit IgG(H+L) | Guangzhou saiguo biotech Co.,LTD | A0208 | |
| Image J Software | National Institutes of Health(NIH),USA | Image J | |
| IκB Alpha Polyclonal antibody | Proteintech Group, Inc.A,USA | 10268-1-AP | |
| JAK2 Antibody | Affinity Biosciences Co., Ltd,China | AF6022 | |
| Low-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A113 | |
| NF-κB p65 Antibody | Proteintech Group, Inc.A,USA | 10745-1-AP | |
| Pathological microtome | Leica Biosystems,USA | RM2016 | |
| Phosphatase Inhibitor Cocktail Tables | F. Hoffmann-La Roche, Ltd,Switzerland | 04906845001 | |
| Phospho-JAK2 (Tyr931) Antibody | Affinity Biosciences Co., Ltd,China | AF3024 | |
| Phospho-NF-κB p65(Ser276) Antibody | Affinity Biosciences Co., Ltd,China | AF2006 | |
| Phospho-STAT3(S727) Antibody | Abways Science & Technology Co., Ltd ,China | CY5291 | |
| Protease Inhibitor Cocktail | F. Hoffmann-La Roche, Ltd,Switzerland | 11873580001 | |
| PVDF membrane | F. Hoffmann-La Roche, Ltd,Switzerland | 3010040001 | |
| Rat IL-1β ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI303 | |
| Rat IL-6 ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI328 | |
| Rat TNF-α ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PT516 | |
| RIPA Lysis Buffer | Beyotime Biotech Inc (Beyotime) , China | P0013B | |
| Salisoroside | Shanghai yuanye Bio-Technology Co., Ltd,China | S25475 | |
| SDS | Guangzhou saiguo biotech Co.,LTD,China | 3250KG001 | |
| Sodium carbonate | China National Pharmaceutical Group Co., Ltd. , China | 1001921933 | |
| Sodium hydrogen carbonate | China National Pharmaceutical Group Co., Ltd. , China | 10018960 | |
| Sodium thiosulfate | China National Pharmaceutical Group Co., Ltd. , China | 20042518 | |
| STAT3 Antibody | Proteintech Group, Inc.A,USA | 10253-2-AP | |
| TBST (10×) | Beyotime Biotech Inc (Beyotime) , China | ST673 | |
| Total cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A111 | |
| Triglyceride assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A110 | |
| Tris Base | Guangzhou saiguo biotech Co.,LTD | 1115GR500 | |
| Upright optical microscope | Nikon Corporation,Japan | Eclipse E100 | |
| Von Kossa Solution | Wuhan servicebio technology CO.,LTD,China | G1043 | |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology, Inc. ,USA | SC-2048 | |
| β-Actin antibody | Cell Signaling Technology, Inc.,USA | E4967 |
참고문헌
- Sutton, N. R., et al. Molecular mechanisms of vascular health: Insights from vascular aging and calcification. Arterioscler Thromb Vasc Biol. 43 (1), 15-29 (2023).
- Henein, M. Y., Owen, A. Statins moderate coronary stenoses but not coronary calcification: Results from meta-analyses. Int J Cardiol. 153 (1), 31-35 (2011).
- Ajufo, E., et al. Value of coronary artery calcium scanning in association with the net benefit of aspirin in primary prevention of atherosclerotic cardiovascular disease. JAMA Cardiol. 6 (2), 179-187 (2021).
- Vossen, L. M., Kroon, A. A., Schurgers, L. J., De Leeuw, P. W. Pharmacological and nutritional modulation of vascular calcification. Nutrients. 12 (1), 100 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC Cardiovasc Interv. 14 (12), 1275-1292 (2021).
- Demer, L. L., Watson, K. E., Boström, K. Mechanism of calcification in atherosclerosis. Trends Cardiovasc Med. 4 (1), 45-49 (1994).
- Chen, F., et al. Network pharmacology analysis combined with experimental validation to explore the therapeutic mechanism of salidroside on intestine ischemia-reperfusion. Biosci Rep. 43 (8), BSR20230539 (2023).
- Rong, L., et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer ags cells through the pi3k/akt/MTOR pathway. Biomed Pharmacother. 122, 109726 (2020).
- Zhang, P., et al. Network pharmacology: Towards the artificial intelligence-based precision traditional Chinese medicine. Brief Bioinform. 25 (1), bbad518 (2023).
- Jiao, X., et al. A comprehensive application: Molecular docking and network pharmacology for the prediction of bioactive constituents and elucidation of mechanisms of action in component-based Chinese medicine. Comput Biol Chem. 90, 107402 (2021).
- Li, S., Zhang, B. Traditional Chinese medicine network pharmacology: Theory, methodology and application. Chin J Nat Med. 11 (2), 110-120 (2013).
- Wang, X., Hu, Y., Zhou, X., Li, S. Editorial: Network pharmacology and traditional medicine: Setting the new standards by combining in silico and experimental work. Front Pharmacol. 13, 1002537 (2022).
- Huang, Z., Yang, Y., Fan, X., Ma, W. Network pharmacology-based investigation and experimental validation of the mechanism of scutellarin in the treatment of acute myeloid leukemia. Front Pharmacol. 13, 952677 (2022).
- Zhang, R., Zhu, X., Bai, H., Ning, K. Network pharmacology databases for traditional Chinese medicine: Review and assessment. Front Pharmacol. 10, 123 (2019).
- Wang, C., Liu, X., Guo, S. Network pharmacology-based strategy to investigate the effect and mechanism of alpha-solanine against glioma. BMC Complement Med Ther. 23 (1), 371 (2023).
- Li, X., et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huang Lian jiedu decoction against sepsis. Comput Biol Med. 144, 105389 (2022).
- Holmes, R. S., et al. Recommended nomenclature for five mammalian carboxylesterase gene families: Human, mouse, and rat genes and proteins. Mamm Genome. 21 (9-10), 427-441 (2010).
- Geng, J., Zhou, G., Guo, S., Ma, C., Ma, J. Underlying mechanism of traditional herbal formula Chuang-ling-ye in the treatment of diabetic foot ulcer through network pharmacology and molecular docking. Curr Pharm Des. 30 (6), 448-467 (2024).
- Chen, X., et al. Puerarin inhibits emt induced by oxaliplatin via targeting carbonic anhydrase xii. Front Pharmacol. 13, 969422 (2022).
- Herrmann, J., Babic, M., Tolle, M., Van Der Giet, M., Schuchardt, M. Research models for studying vascular calcification. Int J Mol Sci. 21 (6), 2204 (2020).
- Zhou, H., X, W., Yuan, Y., Qi, X. Comparison of methods for establishing a rat model of atherosclerosis using three doses of vitamin D3 and atherogenic diet. Chin J Arterioscler. 20 (11), 995-998 (2012).
- Zhang, Y., et al. Il-18 mediates vascular calcification induced by high-fat diet in rats with chronic renal failure. Front Cardiovasc Med. 8, 724233 (2021).
- Kazlouskaya, V., et al. The utility of elastic verhoeff-van gieson staining in dermatopathology. J Cutan Pathol. 40 (2), 211-225 (2013).
- Tang, X., et al. Underlying mechanism and active ingredients of tianma gouteng acting on cerebral infarction as determined via network pharmacology analysis combined with experimental validation. Front Pharmacol. 12, 760503 (2021).
- Lee, S. J., Lee, I. K., Jeon, J. H. Vascular calcification-new insights into its mechanism. Int J Mol Sci. 21 (8), 2685 (2020).
- Magdic, J., et al. Intracranial vertebrobasilar calcification in patients with ischemic stroke is a predictor of recurrent stroke, vascular disease, and death: A case-control study. Int J Environ Res Public Health. 17 (6), 2013 (2013).
- Zhou, L., et al. Salidroside-pretreated mesenchymal stem cells contribute to neuroprotection in cerebral ischemic injury in vitro and in vivo. J Mol Histol. 52 (6), 1145-1154 (2021).
- Hutcheson, J. D., Goettsch, C. Cardiovascular calcification heterogeneity in chronic kidney disease. Circ Res. 132 (8), 993-1012 (2023).
- Zhang, X., et al. Salidroside: A review of its recent advances in synthetic pathways and pharmacological properties. Chem Biol Interact. 339, 109268 (2021).
- Zhang, P., Li, Y., Guo, R., Zang, W. Salidroside protects against advanced glycation end products-induced vascular endothelial dysfunction. Med Sci Monit. 24, 2420-2428 (2018).
- Li, Y., et al. Salidroside promotes angiogenesis after cerebral ischemia in mice through shh signaling pathway. Biomed Pharmacother. 174, 116625 (2024).
- Gao, X. F., Shi, H. M., Sun, T., Ao, H. Effects of radix et rhizoma Rhodiolae kirilowii on expressions of von Willebrand factor, hypoxia-inducible factor 1 and vascular endothelial growth factor in myocardium of rats with acute myocardial infarction. Zhong Xi Yi Jie He Xue Bao. 7 (5), 434-440 (2009).
- Li, X., Liu, C., Li, Y., Xiong, W., Zuo, D. Inflammation promotes erythropoietin induced vascular calcification by activating p38 pathway. Bioengineered. 13 (3), 5277-5291 (2022).
- Bessueille, L., Magne, D. Inflammation: A culprit for vascular calcification in atherosclerosis and diabetes. Cell Mol Life Sci. 72 (13), 2475-2489 (2015).
- Li, R., et al. Salidroside prevents tumor necrosis factor-alpha-induced vascular inflammation by blocking mitogen-activated protein kinase and nf-kappa B signaling activation. Exp Ther Med. 18 (5), 4137-4143 (2019).
- Xing, S. S., et al. Salidroside attenuates endothelial cellular senescence via decreasing the expression of inflammatory cytokines and increasing the expression of sirt3. Mech Ageing Dev. 175, 1-6 (2018).
- Hopkins, A. L. Network pharmacology. Nat Biotechnol. 25 (10), 1110-1111 (2007).
- Xin, P., et al. The role of jak/stat signaling pathway and its inhibitors in diseases. Int Immunopharmacol. 80, 106210 (2020).
- Fu, X., et al. Glycosides from buyang huanwu decoction inhibit atherosclerotic inflammation via jak/stat signaling pathway. Phytomedicine. 105, 154385 (2022).
- Macri, F., et al. High phosphate-induced jak-stat signalling sustains vascular smooth muscle cell inflammation and limits calcification. Biomolecules. 14 (1), 107328 (2023).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유