Method Article
ネットワーク薬理学および実験ラットモデルを用いた血管石灰化治療薬としてのサリドロシドの評価
* これらの著者は同等に貢献しました
要約
この研究は、高脂肪食(HFD)とビタミンD3(VD3)の組み合わせによって誘発される血管石灰化のラットモデルを確立します。このモデルは、血管石灰化の予防と治療におけるサリドロシドの治療効果を評価するために使用され、ネットワーク薬理学と in vivo 実験を通じてその潜在的な作用機序に関する洞察を提供しました。
要約
血管石灰化 (VC) は、重大な罹患率と死亡率に関連する重大な病理学的状態です。この研究では、ネットワーク薬理学と分子生物学のハイブリッドアプローチを採用して、 Rhodiola crenulata由来の活性化合物であるサリドロシド(SAL)のVCに対する治療メカニズムを明らかにします。データベースマイニングとネットワーク分析により、2871のVC関連ターゲットと交差する388のSALターゲットが特定され、208の共通のターゲットが得られました。StringデータベースとCytoscape 3.9.1のトポロジカル解析 によって 構築されたタンパク質間相互作用(PPI)ネットワークは、IL6、TNF、TP53、IL1B、HIF1A、CASP3、STAT3など、10の主要なターゲットを特定しました。同定された遺伝子は脂質経路とアテローム性動脈硬化経路に集中しており、SALによるVCの改善は、脂質および炎症因子の異常な発現の制御を通じて起こる可能性があることを示しています。また、SALは炎症性因子の異常な発現を阻害し、それによってJAK2/STAT3経路を活性化してVCの進行に介入することもわかりました。JAK2/STAT3経路は、SALがVCのさらなる劣化を防ぐための重要な分子メカニズムです。機能強化分析により、これらの標的がVCの重要な経路である炎症反応と脂質代謝に関与していることが明らかになりました。ラットを用いた in vivo 試験では、脂質異常症と血管の炎症の緩和におけるSALの有効性が示され、血清脂質プロファイルの改善と血管のカルシウム沈着の減少が示されました。ウェスタンブロット解析に基づくメカニズムの探索により、サリドロシドがJAK2/STAT3シグナル伝達経路を調節する能力が実証され、この重要な分子メカニズムのモジュレーターとしての可能性が浮き彫りになり、VCの治療標的となる可能性が示されました。この研究の強みは、計算予測と in vivo 検証を統合した方法論の厳密さにあります。この包括的なアプローチは、VCに対抗する天然化合物の治療メカニズムを探求するための強固なフレームワークを確立します。
概要
血管石灰化(VC)とは、血管壁内にカルシウムが異常に沈着し、動脈硬化や弾力性の低下を引き起こし、最終的には血管機能を損なうことを指します。伝統的に、VCは2つのタイプに分けられてきました:脂質の蓄積に関連する内膜石灰化と内側石灰化。前者は炎症性浸潤と密接に関連しており、血管平滑筋細胞(VSMC)の骨芽細胞様細胞への移動、増殖、および分化を特徴とする血管壁の骨形成形質転換を引き起こします1。
VSMCが、加齢、遺伝学、糖尿病や慢性腎臓病などの環境条件などの要因に影響されて骨形成分化を受ける能力は、加齢に伴うVCの主な要因です。この骨芽細胞様の形質転換は、動脈の石灰化と変性を悪化させます1。
VCは、変性変化、代謝の不均衡、およびさまざまな全身状態によって引き起こされる多面的な状態です。血管損傷の約80%、冠動脈疾患の症例の90%がVCを示し、重篤な心血管イベントのリスクを大幅に増加させます1,2。したがって、この状態を効果的に緩和または逆転させる薬理学的治療法を発見することが急務です。
現在、VCの治療戦略にはさまざまな薬理学的介入が含まれますが、この目的のために特別に設計された薬剤はありません。軽度の石灰化の患者には、プラークを安定させるためにスタチンが処方されることがよくあります。ただし、脂質レベルを下げることで冠状動脈の狭窄を軽減する可能性がありますが、石灰化への影響は限られています2。
アテローム性動脈硬化症の複雑さを考えると、多くの患者は血小板の活性化が促進され、血小板凝集を阻害し、血栓症のリスクを減らすためにアスピリンやクロピドグレルなどの抗血小板薬を使用する必要があります。ただし、アスピリン療法は、冠状動脈カルシウムスコアが高く、出血のリスクが低い個人にのみ有益です3。
さらに、ビタミンKなどのサプリメントに関する研究では、VCの進行を防ぐ可能性が示唆されています4。重症の場合、侵襲的な介入が検討される場合がありますが、広範なVCには適さないことがよくあります5。既存のVCを持たない個人にとって、血圧、脂質プロファイル、ライフスタイルの選択などのリスク要因を管理することは依然として重要です6。
Rhodiola crenulataは、シソウ科の多年生草本で、伝統的に漢方薬で利用されてきました。その主要な生物活性成分であるサリドロシドは、その顕著な生物学的活性のために大きな注目を集めています。サリドロシドは、アポトーシスを阻害し、強力な抗酸化特性を示し、抗炎症特性を有する能力で有名です7,8。これらの特性は、血管機能を強化し、血管の老化を遅らせ、血管内皮を保護する可能性に貢献しています。VCの潜在的な治療薬として、サリドロシドは研究にとって大きな価値を持っています。しかし、サリドロシドがVCを改善する正確なメカニズムはまだ完全に解明されておらず、VCの治療におけるその治療可能性を活用するためのさらなる研究が必要です。
これらのメカニズムを探るために、本研究では、薬理学、バイオインフォマティクス、計算機科学を組み合わせた革新的な方法論であるネットワーク薬理学を活用し、生体システムの解析と薬物メカニズムの解明を行います。従来の単一標的薬物研究と比較して、ネットワーク薬理学は、複数の生物学的標的およびシグナル伝達経路に対する薬物の影響を分析することにより、より包括的なアプローチを提供します。現代の医薬品開発における重要なツールとして、薬物、標的、および経路のネットワークを構築して、薬物作用の根底にあるメカニズムを明らかにします9,10。治療メカニズムの探索に広く使用されているにもかかわらず、バイオインフォマティクスとネットワーク薬理学の観点から、サリドロシドとVCの間の相互作用メカニズムに関する研究は限られています。
この研究では、広範なデータベースマイニングを通じて主要なターゲットを特定および分析することにより、サリドロシドがVCに与える潜在的な影響の分子ネットワークマップを構築します。タンパク質間相互作用(PPI)ネットワークが生成され、トポロジカル解析を適用して、石灰化プロセスの重要なノードが強調表示されます。
計算予測を確認するために、ビタミンD3(VD3)を含む高脂肪食を投与することにより、VCのラットモデルが開発されます。このモデルは、ヒトVCの病理学的特徴を再現しています。血管損傷は組織学的技術を通じて評価され、血清脂質プロファイルと炎症マーカーはサリドロシドの全身効果を調査するために評価され、SAL抗VC関連タンパク質の発現はウェスタンブロッティングを使用して測定され、実験的に誘導されたVCに対するサリドロシドの影響を調査するために、この研究はVCと戦うための治療戦略としてこの化合物の可能性に貴重な洞察を提供することを目指しています。
プロトコル
このプロトコールは、長春中医薬大学の実験動物委員会によって承認されました(承認番号2023091)。この研究は、欧州共同体ガイドラインや1986年のEEC指令などの国際的なガイドラインに準拠しており、研究全体を通じて動物の倫理的扱いを確保しています。この研究には、雄のWistarラット(8-10週、体重200-220g)を使用しました。使用した試薬や機器の詳細は 、資料表に記載されています。
1. サリドロシド-VC標的候補のネットワーク薬理学的予測
注:ネットワーク薬理学は、計算方法と大規模なデータ分析を利用して、薬物分子と生物内の経路、遺伝子、タンパク質などの生物学的標的との間の複雑な相互作用を調査します11,12。このアプローチは、研究対象のエンティティの生物学的機能と関係を解読するのに役立ちます。この方法論は、データベースの利用、化学情報の処理、生理活性データの取得、タンパク質データの検索、遺伝子発現プロファイルの解析、相互作用ネットワークの構築、および経路の濃縮解析を網羅しています11。図1は、サリドロシドと血管石灰化との間のコアターゲットの相互作用ネットワークを示しています。
- 「Ingredient」ターゲットデータベースの構築
- HERB、TCMSP、PubChem、SwissTargetPrediction、CTD、PharmMapper、SEA、STITCHなどのデータベース13 ( 補足表1を参照)を検索するための成分のキーワードとして「サリドロシド」を使用します。
- 関連文献をレビューして、サリドロシドに関連する標的を特定し、種を ホモ・サピエンスに設定します。重複を削除した後、UniProtを用いて標的タンパク質を標準化し( 補足表1参照)、包括的なサリドロシド標的データベース14を確立する。
- 「疾患」対象データベースの構築
- 「血管石灰化」をキーワードとして、GeneCards、OMIM、PharmGkb、DrugBankなどのデータベース15 ( 補足表1参照)を検索し、種を ホモ・サピエンスに設定する。重複排除後、血管石灰化ターゲット データベースを作成します。
- 潜在的な治療標的の予測
- サリドロシドと血管石灰化のターゲット( 補足表1を参照)を入力して、一般的なターゲットを特定します。ベン図を生成して、血管石灰化の治療におけるサリドロシドの潜在的な治療標的を視覚化します。
- 「サリドロシド-血管石灰化」タンパク質間相互作用(PPI)ネットワークの構築
- 潜在的なターゲットをMultiple Proteins Listにコンパイルし、STRINGを使用してそれらを分析します( 補足表1を参照)、生物を Homo sapiens に設定し、相互作用スコアを中程度の信頼度(>0.4)に設定します16。PPIデータをTSV形式で抽出して、さらに分析します。
注:ラット遺伝子の85%がヒト遺伝子と相同であり、同様の生物学的機能を果たしていることを考慮して、ラットは、血管石灰化17に対するサリドロシドの効果を検証するための実験対象として選択されました。
- 潜在的なターゲットをMultiple Proteins Listにコンパイルし、STRINGを使用してそれらを分析します( 補足表1を参照)、生物を Homo sapiens に設定し、相互作用スコアを中程度の信頼度(>0.4)に設定します16。PPIデータをTSV形式で抽出して、さらに分析します。
- キーターゲットの選定とネットワーク構築
- PPIネットワークデータをCytoscape 3.9.1( 補足表1を参照)にインポートし、CytoNCAプラグインを使用して解析し、Betweenness(BC)、Closeness(CC)、Degree(DC)、Eigenvector(EC)、Local Average Connectivity(LAC)、Network Centrality(NC)などのパラメータを評価します。 CC=1 のキーターゲットを選択して、'SAL-VC' のコアターゲットアクションスペクトルマップを構築します。
- CytoHubbaプラグインを使用して、Maximal Clique Centrality(MCC)、Maximum Neighborhood Component(MNC)、およびDegreeの計算に基づいて上位10のハブ遺伝子を同定し、Hub-genesスペクトルマップを生成します。
- GOおよびKEGG経路エンリッチメント解析
- DAVIDを使用して遺伝子ID変換を実行し( 補足表1を参照)、種情報の遺伝子タイプ-9606の ENSEMBL_GENE_ID を選択します。Omicshare( 補足表1を参照)を使用して、GO機能およびKEGG経路の濃縮について、有意性を P 値0.0518に設定して、変換された遺伝子リスト<解析します。
注:GO機能解析には、分子機能(MF)、生物学的プロセス(BP)、および細胞成分(CC)が含まれます。KEGG経路解析には、経路濃縮と経路分類濃縮が含まれます19。濃縮分析の結果を 図 2 に示します。
- DAVIDを使用して遺伝子ID変換を実行し( 補足表1を参照)、種情報の遺伝子タイプ-9606の ENSEMBL_GENE_ID を選択します。Omicshare( 補足表1を参照)を使用して、GO機能およびKEGG経路の濃縮について、有意性を P 値0.0518に設定して、変換された遺伝子リスト<解析します。
2. 動物実験
- 順化
- 特定の病原体を含まない(SPF)条件下で、12時間の明暗サイクルでWistarラットを順応させます。実験開始前に、健康を維持するために食料と水 を自由に入手できる ことを確認してください。適応給餌を1週間行います。
- モデル設立
- ラットを環境条件に順応させ、ランダムに5つのグループに割り当てます:対照群(Ctrl、ND + Vehicle)、モデル群(Model、HFD + Vehicle)、SAL低用量群(SAL-L、HFD + SAL 5mg / kg)、SAL高用量群(SAL-H、HFD + SAL 10mg / kg)、およびシンバスタチン(SIM)群(HFD + SIM 5mg / kg)。
- 実験の全期間にわたって、通常の食事 (ND) を Ctrl グループに、残りのグループに高脂肪食 (HFD) を投与します。HFD 投与の初日に、Ctrl グループ20,21 を除くすべてのグループに 600,000 IU/kg VD3 の単回皮下用量を注射します。その後、次の8週間、100,000 IU / kg VD3の毎週の皮下注射を行います(図3)。
- 動物の健康状態と生存状況を毎日監視します。9週目に実験的介入を開始します。
- 研究の終了時に動物を安楽死させます(施設で承認されたプロトコルに従います)。血清サンプルを採取し、30分間放置し、遠心分離して血清を単離します(以前に発表されたレポート20,21に続いて)。血管組織(腹部大動脈)を解剖し、リン酸緩衝生理食塩水(PBS)ですすいで血液を取り除きます。
- 組織学的検査のために組織の一部を4%パラホルムアルデヒドに固定し、分子分析のために別の部分を液体窒素に保存します。
注:使用前にサリドロシドを温水で希釈してください。
3. HE、VK、EVG染色による血管組織損傷の評価
注:血管組織(腹部大動脈)を4%パラホルムアルデヒドに固定し、48時間後にエタノールで脱水し、パラフィンに包埋します。ヘマトキシリン-エオシン(HE)、エラスティカ・ファン・ギーソン(EVG)、およびフォン・コッサ(VK)染色のために、包埋したパラフィンブロックを5 μmに切断し、光学顕微鏡で組織学的形態を観察します。HE染色は、組織形態の変化を評価するために使用されます。血管組織では、平滑筋細胞の増殖、無秩序な細胞配置、炎症など、血管壁の構造変化が浮き彫りになります。EVG染色は、弾性線維の損傷や血管組織のリモデリングを評価するために不可欠であり、石灰化が血管弾性に与える影響を理解するのに役立つ弾性線維とコラーゲン線維を視覚化します。VK染色は、VCの重要な特徴であるカルシウム沈着物を検出し、血管組織22,23の石灰化の程度と分布を評価するために重要である。
- 血管組織の損傷検出のためのHE染色
- 脱パラフィンと水分補給
- キシレンの2つの交換で切片をそれぞれ8分間脱パラフィンし、段階的なエタノールシリーズ(100%、95%、85%、75%)でステップごとに3分間再水和します。その後、水道水で2分間すすぎます。
- ヘマトキシリン染色
- 切片をヘマトキシリンで5〜10分間染色し、洗浄して余分な汚れを取り除き、続いて水道水ですすいでください。
注:細胞質の色に影響を与える可能性のある過度に暗い染色を避けるために、5分間の薄い染色をお勧めします。
- 切片をヘマトキシリンで5〜10分間染色し、洗浄して余分な汚れを取り除き、続いて水道水ですすいでください。
- 区別
- 分化溶液で切片を分化し、30秒間、続いて水道水で2回、それぞれ3分間すすぎます。
- エオシン対比染色
- 切片をエオシンステインに1分間置きます。余分な汚れを取り除いた後、急速な脱水を行います。
- 脱水、清澄化、および取り付け
- 急速な脱水のために、切片を75%、85%、95%、および100%エタノールにそれぞれ3秒間浸し、続いて100%エタノールを1分間浸します。
注:エオシンは水やエタノールの勾配で色を失う可能性があるため、急速な脱水をお勧めします。
- 急速な脱水のために、切片を75%、85%、95%、および100%エタノールにそれぞれ3秒間浸し、続いて100%エタノールを1分間浸します。
- 脱パラフィンと水分補給
- カルシウム検出のためのVK染色
- 脱パラフィンと水分補給
- この手順は、手順 3.1.1 に続いて実行します。
- 硝酸銀反応
- 切片を拭いて乾かし、細いブラシで輪郭を描き、フォン・コッサで染色します( 材料の表を参照)。紫外線に4時間さらした後、水道水で十分にすすいでください。
- ヘマトキシリンによる対比染色
- 切片をヘマトキシリンで5分間染色し、流水ですすぎ、区別して再度すすぎ、続いて水道水すすぎます。
- エオシン対比染色
- 切片を等級付けエタノール(85%と95%でそれぞれ5分間)で脱水し、エオシンで5分間染色します。
- 脱水と取り付け
- エタノール浴(100%エタノールI、II、III)で切片を脱水し(100%エタノールI、II、III、各5分間)、キシレン浴(キシレンIおよびII各5分間)で清澄化します。次に、中性バルサムでセクションを取り付けます。
- 顕微鏡検査と画像キャプチャ
- 光学顕微鏡で染色切片を検査し、分析のために画像をキャプチャします。
注:カルシウム沈着物が茶褐色から暗黒色に見え、核が青く、背景が赤であることを確認してください。使用直前に、新鮮なVK染色用の硝酸銀溶液を調製します。
- 光学顕微鏡で染色切片を検査し、分析のために画像をキャプチャします。
- 脱パラフィンと水分補給
- 弾性繊維およびコラーゲン繊維のEVG染色
- 脱パラフィンと水分補給
- パラフィン切片を50分間熱で処理し、次にキシレンに20分間浸してパラフィンを除去します。切片を等級分けされたエタノールシリーズ(100%、95%、85%、75%)にそれぞれ5分間さらし、最後に水道水で5分間すすぎます。
- EVG染色
- EVG染色液( 材料表を参照)を10分間塗布した後、水道水で5秒間短時間すすぎ、余分な汚れを取り除きます。
- 次に、Verhoeffワーキングソリューション( 材料の表を参照)を5分間適用し、続いて流水で5秒間別の短時間のすすぎを行います。
注:コンポーネントA、B、およびC(市販のキットに付属)を5:2:2の比率で混合して、使用前にVerhoeff作業溶液を調製します。2時間以内に溶液を使用し、染色プロセス中に必要に応じて補充して、切片が乾燥するのを防ぎます。
- 脱水と取り付け
- 等級付けされたエタノールシリーズ(75%、85%、95%、および100%)で切片をそれぞれ5秒間脱水し、続いてキシレンを2回交換して各1分間清澄化します。短時間の風乾期間の後、中性バルサムでセクションを取り付けます。
- 顕微鏡検査と画像解析
- 光学顕微鏡で染色された切片を検査して、弾性繊維とコラーゲン繊維を視覚化し、その後の分析のために画像をキャプチャします。
- 脱パラフィンと水分補給
4. アルカリホスファターゼ(ALP)アッセイ
注:抗石灰化治療の有効性を評価するための主要な指標としてALPを使用してください。
- 試薬調製
- 発色基質を氷冷した0.05 M pH 9.6炭酸塩緩衝液に溶解し、最終容量2.5 mLにします。
注:1.59 gの炭酸ナトリウムと2.93 gの重炭酸ナトリウムを1,000 mLの再蒸留水に溶解して緩衝液を調製します。
- 発色基質を氷冷した0.05 M pH 9.6炭酸塩緩衝液に溶解し、最終容量2.5 mLにします。
- 基質希釈
- 10 μL の p-ニトロフェノール溶液 (10 mM) を 0.05 M pH 9.6 炭酸バッファーで最終容量 0.2 mL に希釈し、最終濃度 0.5 mM になるようにします。
- サンプル調製
- 腹部大動脈を溶解緩衝液中でホモジナイズします。ホモジネート(~12,000 x g を 4 °C で 10 分間)を遠心分離し、上清を回収して ALP 活性を検出します。
注:溶解バッファーにホスファターゼ阻害剤が含まれていないことを確認してください。保留中のテストサンプルは-80°Cで保存し、凍結融解サイクルを繰り返さないようにします。
- 腹部大動脈を溶解緩衝液中でホモジナイズします。ホモジネート(~12,000 x g を 4 °C で 10 分間)を遠心分離し、上清を回収して ALP 活性を検出します。
- アッセイのためのマイクロプレート調製
- ブランクウェル、スタンダードウェル、サンプルウェルを含む96ウェルプレートを調製します。標準溶液50μLを標準ウェルに加え、50μLの保留テストサンプルをサンプルウェルに加えます。プレートを37°Cで10分間インキュベートします。
- 反応終了と吸光度測定
- 各ウェルに100μLの停止溶液を加えて、反応を終了します。405 nmでの吸光度を測定し、吸光度の値に基づいてALP活性を計算します(製造元の指示に従って、 材料の表を参照)。
注:標準物質またはALP活性のあるサンプルを含むウェルは、さまざまな色合いの黄色を示します。色は最大2時間安定しています。
- 各ウェルに100μLの停止溶液を加えて、反応を終了します。405 nmでの吸光度を測定し、吸光度の値に基づいてALP活性を計算します(製造元の指示に従って、 材料の表を参照)。
5. カルシウム含有量の測定
注:カルシウム含有量の測定は、生体組織の石灰化の程度を評価するために重要です。
- ティッシュの準備
- 組織を細かく刻み、溶解バッファーでホモジナイズします。
- サンプル希釈と遠心分離
- 組織を溶解バッファーで1:10の比率で希釈します。混合物を均質化し、4°C、12,000 x g で5分間遠心分離します。分析のために上清を収集します。
注:5 mMカルシウム標準溶液を使用して、カルシウム標準希釈液(0〜1.0 mM)を調製します( 材料の表を参照)。
- 組織を溶解バッファーで1:10の比率で希釈します。混合物を均質化し、4°C、12,000 x g で5分間遠心分離します。分析のために上清を収集します。
- プレートのセットアップとインキュベーション
- 50 μLの標準サンプルまたは試験サンプルを96ウェルプレートの各ウェルに加えます。アッセイ用作業溶液150 μLを加え、十分に混合し、プレートを暗所で室温で10分間インキュベートします。575 nm での吸光度を測定し、標準曲線を作成します。
- カルシウム含有量の計算
- カルシウムの希釈係数、サンプル量、原子量を組み込んだ標準曲線を使用して、カルシウム含有量を計算します。
6. 炎症性サイトカイン(IL-6、TNF-α、IL-1β)の酵素結合免疫吸着アッセイ(ELISA)
注:IL-6、IL-1β、およびTNF-αは、炎症反応の存在と重症度を示す主要な炎症誘発性サイトカインです。これらのサイトカインを測定することは、炎症過程を理解し、抗炎症治療の有効性を評価するために不可欠です。
- サンプルコレクション
- ラットの腹部大動脈から血清を採取します。室温で2時間凝固させます。サンプルを3,000 x gで4°Cで10分間遠心分離し、上清を回収します。
- アッセイのためのマイクロプレート調製
- 標準および試験サンプル用に指定されたウェルを備えた96ウェルプレートを準備します。50 μLの標準試料( 材料表を参照)をさまざまな濃度で適切なウェルに加えます。
- サンプル調製
- 40 μLのサンプル希釈液を、テストサンプル用に指定された各ウェルに加えます。同じウェルに10 μLのサンプルを加え、5倍希釈します。
- 酵素標識試薬とのインキュベーション
- IL-6、TNF-α、またはIL-1βに特異的な酵素標識試薬100 μLをブランクを除くすべてのウェルに加えます。プレートを37°Cで60分間インキュベートします。
- 洗浄
- ブランクを除くすべてのウェルから液体を捨てます。ウェルを1倍洗浄液(蒸留水で20倍希釈して調製)で洗浄します。この洗浄手順を5回繰り返し、ウェルを乾燥させます。
- カラーの現像と終了
- 50 μLの基質溶液AおよびB(市販のキットから、 材料表を参照)を各ウェルに加えます。穏やかに混合し、プレートを37°Cの暗所で15分間インキュベートします。各ウェルに50μLの停止溶液を加えて、反応を終了します。
- 吸光度測定とデータ解析
- ブランク・ウェルをゼロに設定します。マイクロプレートリーダーを使用して450nmでの吸光度を測定します。OD値と標準濃度に基づいて標準曲線を生成します。補間を使用してサンプル濃度を計算し、希釈係数を調整します。
7. 脂質プロファイルアッセイ
注:脂質プロファイルアッセイは、脂質レベルの上昇または不均衡が血管石灰化のリスクを加速させる可能性のある異常な脂質レベルを検出します。
- 総コレステロールとトリグリセリド(TCおよびTG)
- 血清を採取し、ブランクサンプル、キャリブレーションサンプル、および保留中のテストサンプル用に指定されたウェルを備えた96ウェルプレートを調製します。2.5 μLの血清、キャリブレーションスタンダード、またはブランク溶液を各ウェルに加えます。
- 各ウェルに250μLの作業溶液を加えます。穏やかに混合し、プレートを37°Cで10分間インキュベートします。マイクロプレートリーダーを使用して500nmでの吸光度を測定します。
- 低密度リポタンパク質と高密度リポタンパク質(LDL-CおよびHDL-C)
- 血清を採取し、ブランク、キャリブレーション、および保留中のテストサンプル用に指定されたウェルを備えた96ウェルプレートを調製します。2.5 μLの血清、キャリブレーションスタンダード、またはブランク溶液をそれぞれのウェルに加えます。
- アッセイキットの説明書に指定されているように、適切な試薬(180 μL用の試薬1または60 μL用の試薬2、 材料表を参照)を各ウェルに加えます。各試薬に推奨される温度(37°C)および時間(試薬1で5分間、または試薬2で10分間)でインキュベートします。
- LDL-CまたはHDL-Cで示される特定の波長(600nm)での吸光度をマイクロプレートリーダーで測定します。
8. ウェスタンブロッティング
注:ウェスタンブロット(WB)は、主要なタンパク質の発現レベルの評価に役立ち、全型とリン酸化型の両方の検出を可能にします。
- ティッシュの準備
- ティッシュペーパー0.05gの重さを量り、PBSで十分にすすいで余分な破片を取り除きます。1xホスファターゼおよびプロテアーゼ阻害剤を含む溶解バッファー500 μLを添加します。組織を4°Cで10分間インキュベートし、ティッシュグラインダーを使用してホモジナイズします。
- タンパク質抽出
- 均質化したサンプルを1分間放置した後、4°C、12,000 x g で15分間遠心分離します。タンパク質分析のために上清を収集します。製造元の指示に従って、BCA法を使用してタンパク質濃度を測定します( 材料の表を参照)。標準曲線を使用して濃度を計算します。
注:使用前に遠心分離機を4°Cに予冷してください。562 nmでタンパク質濃度を測定します。
- 均質化したサンプルを1分間放置した後、4°C、12,000 x g で15分間遠心分離します。タンパク質分析のために上清を収集します。製造元の指示に従って、BCA法を使用してタンパク質濃度を測定します( 材料の表を参照)。標準曲線を使用して濃度を計算します。
- サンプル調製
- タンパク質サンプルを、β-メルカプトエタノールとSDSを含む5倍ローディングバッファーと4:1の比率で混合します。混合物を100°Cで5分間加熱して、タンパク質を変性させます。
注:1xローディングバッファーが必要な場合は、5xバッファーを溶解バッファーで希釈してください。
- タンパク質サンプルを、β-メルカプトエタノールとSDSを含む5倍ローディングバッファーと4:1の比率で混合します。混合物を100°Cで5分間加熱して、タンパク質を変性させます。
- SDS-PAGEゲル調製
- 12% SDS-PAGEゲルを調製し、電気泳動装置に入れます。指示に従って、1x電気泳動バッファーを中間点まで追加します( 補足表2を参照)。
- 電気泳動
- -20°Cからタンパク質サンプルを回収します。 ウェルあたり60μgのタンパク質をロードし、ゲルを泳動します。
- スタッキングゲルの電流を50mAに20分間設定し、次に分離ゲルの電流を100mAに60分間増やし、染料の前面が底に達するまでします。
- メンブレントランスファー
- PVDF膜をメタノール中で5分間活性化します。
- トランスファーサンドイッチを次の順序で組み立てます:濾紙→SDS-PAGEゲル→PVDFメンブレン→濾紙。タンパク質を300mAで60分間移動させます。
注意: SDS-PAGEゲルとPVDFメンブレンの間に気泡が挟まっていないことを確認してください。
- ブロッキング
- PVDFメンブレンを5% BSA(1x TBSTで調製)に室温でインキュベートし、60分間穏やかに振とうします。メンブレンを1x TBSTで5分間ずつ3回洗浄します。
- 一次抗体のインキュベーション
- 適切な一次抗体(p-JAK2、JAK2、p-STAT3、STAT3、p-NF-κB p65、NF-κB p65、IκBαなど)にメンブレンをインキュベートし、室温で2.5時間ブロッキングバッファーで希釈します。
- 二次抗体インキュベーション
- 一次抗体のインキュベーション後、メンブレンを1x TBSTで5分間ずつ3回洗浄します。適切な二次抗体と室温で1時間インキュベートします。メンブレンを1x TBSTで再度5分間、3回ずつ洗浄します。
- 検出
- ECL化学発光検出24 を使用してタンパク質バンドを可視化します( 材料の表を参照)。
- デンシトメトリー解析
- ImageJソフトウェアを使用してタンパク質バンドを定量化します。ImageJ のワークフロー「 Image の → 8 ビット→プロセス→背景の減算」に従います。「測定値の設定→解析」→「スケールの設定→解析」。→「インバート」→「インバート」「解析」を編集→→結果を測定します。ファイル→ IntDen→として保存します。
- グラフ作成および統計分析ソフトウェアを使用して統計グラフを生成します。
注: 結果を検証するには、反復間で結果が一貫していることを確認してください。
9. 統計分析
- GraphPad Prism 9.0を使用してデータを収集し、整理します。
- 生データから平均±SDを使用してエラーバーを計算し、プロットします。
- 一元配置分散分析を使用して統計分析を実行し、その後に多重比較のためのテューキーの事後検定を実行します。
- P < 0.05 での統計的有意性を求め、P 値が小さいほど結果の差が大きいことを示します。
結果
ネットワーク薬理学分析
HERB、TCMSP、Pubmed、SwissTargetPrediction、CTD、PharmMapper、SEA、STITCHなどのデータベースを使用して、サリドロシドの388の潜在的な標的遺伝子が特定されました。さらに、VCに関連する2871の潜在的な標的遺伝子が、GeneCards、OMIM、PharmGkb、DrugBankなどのデータベースから取得されました。VENNダイアグラム による 交差分析により、VCにおけるサリドロシドの介入の主要なターゲットと考えられている208の重複するターゲットが明らかになりました(図1A)。
PPIネットワーク分析
STRINGプラットフォームを使用して、上位100ノードを選択した208の主要ターゲット間の相互作用を分析しました。次に、これらのノードをCytoscape 3.9.1にインポートして、詳細なPPIネットワークを構築しました。EC、BC、NC、LAC、CC、DCなどのパラメータを使用したネットワークトポロジー解析により、37のコアターゲットが特定されました。さらに、学位、MCC、MNC に着目してさらに改良した結果、IL6、TNF、TP53、IL1B、HIF1A、CASP3、STAT3 など、上位 10 のコアターゲットが特定されました(図 1B)。
GO機能解析とKEGGパスウェイ解析
208の主要ターゲットのGO機能解析により、4808の生物学的プロセス、294の細胞成分、515の分子機能が特定されました。KEGGの経路解析では、主に代謝、遺伝情報処理、環境情報処理、生物システム、細胞プロセス、ヒト疾患など、281のシグナル伝達経路が報告されました。同定された遺伝子のほとんどが脂質およびアテローム性動脈硬化症経路に富んでいることがわかり、SALがVCを改善する主要なメカニズムには、脂質および炎症因子の異常な変化の調節が含まれている可能性があることが示されています(図2)。
in vivo 実験の検証
Ctrl群と比較して、モデル群のラットは肥満、無気力、および鈍い毛皮を示しました。血清脂質プロファイルは、モデル群でTC、TG、およびLDL-Cレベルの有意な増加とHDL-Cの減少を示しました(p < 0.05)。 逆に、SAL-L、SAL-H、およびSIMグループでは、これらのパラメータに有意な改善が見られ、SALグループでは用量依存的な効果が見られました(p < 0.05)(図4)。
HE染色はラット腹部大動脈の構造変化を特定するために利用され、EVG染色は弾性線維の状態を評価し、VK染色はカルシウム沈着物を特定するために採用されました。対照群では、HE染色により腹部大動脈組織の明確な層が描かれ、EVG染色では、最小限の中断で弾性線維がきれいに配置されていることが明らかになりました。カルシウム沈着物は、VK染色による顕著な存在ではありませんでした。逆に、モデルグループは、内膜過形成と炎症性細胞浸潤を伴う血管組織と、培地層の広範な構造的混乱を示しました。弾性線維と平滑筋細胞の区別は不明瞭で、線維は不規則に配列されており、壊死性石灰化が見られました。外来リンパ球の浸潤も認められました。このグループのEVG染色では、弾性繊維の無秩序なパターンが示され、広範な切れ目があり、VK染色ではかなりのカルシウム沈着が確認されました。
SAL介入後、VCによって血管損傷の顕著な改善が観察されました。HE染色は、SAL-LおよびSAL-Hグループが明確に定義された血管層構造を持ち、培地中の平滑筋細胞の変性が最小限であることを示しました。EVG染色後、両群の弾性繊維は、ほとんど中断することなくきれいに整列し、SAL-H群はSAL-L群を上回りました。VK染色では、どちらのグループでも有意なカルシウム沈着物は見られず、SALがVCによって誘発される血管構造の変化を緩和したことが示唆されています。
SIM介入後、血管構造の変化はSAL-H群のものを反映していました。HE染色は、培地中の平滑筋細胞の変性を最小限に抑えた明確な腹部大動脈構造を示しました。EVG染色では、弾性繊維の整然とした配置がほとんど中断されず、フォンコッサ染色では大きなカルシウム沈着物は検出されませんでした。これらの知見は、SALグループがVCに関連する有害症状を有意に改善したことを示唆しています(図5)。
カルシウムイオン(Ca2+)とALPのレベルは、モデルグループではCtrlグループ(p < 0.05)と比較して有意に上昇しました。しかし、これらのレベルはSAL-L群とSAL-H群で著しく低下し、SALの高用量は優れた有効性を示しました(図6A、B)。さらに、骨形態形成タンパク質-2(BMP2)の発現はモデル群で顕著に増強されました(p < 0.001)、SALグループはBMP2発現の減少をさまざまな程度で示しました(p < 0.01)(図6C)。炎症因子分析により、モデル群ではTNF-αとIL-6の有意なアップレギュレーションが明らかになり(p < 0.05)、VCによる炎症反応が示されました(図6D-F)。SAL治療後、これらの炎症マーカーは有意に減少し(p < 0.05)、SAL-H群でより良い結果が得られました。
血管組織におけるタンパク質発現解析では、モデル群においてJAK2、STAT3、およびNF-κB p65のリン酸化レベルが上昇し、IκBαの発現が減少したことが示されました(p < 0.05)。 SAL-LおよびSAL-H処理はいずれも、JAK2、STAT3、およびNF-κB p65のリン酸化レベルを有意に低下させ、IκBαの発現を増加させたことから、サリドロシドがJAK2/STAT3シグナル伝達経路を介したVCの進行を緩和することが示唆されています(図7)。
これらの結果は、ネットワーク薬理学と in vivo 検証によって裏付けられたSALのVCに対する潜在的な治療効果を強調し、その可能な作用機序についての洞察を提供します。

図1:サリドロシドと血管石灰化の間のコアターゲットの相互作用ネットワーク。 (A)サリドロシドと血管石灰化との間のコアターゲットの相互作用ネットワークのフローチャート。(B)サリドロシド標的(紫)と血管石灰化標的(緑)の重なりを示すベン図。交差するターゲットは黒のテキストで示されます。(C)VCに対するサリドロシドの影響に関与する潜在的なコアターゲット相互作用ネットワーク。(1)PPIネットワークの上位100の隣接ノード。各ノードはターゲットを表し、各エッジはターゲット間の相互作用を表します。(2)ハブ遺伝子ネットワーク(CytoNCAプラグインを使用して37ノードを同定)。(3)PPIネットワークの上位20の隣接ノード。(4-6) CytoHubbaプラグインを用いてDegree、MCC、MNCの基準に基づいて同定した主要なターゲット(各10ノード)。 この図の拡大版を表示するには、ここをクリックしてください。
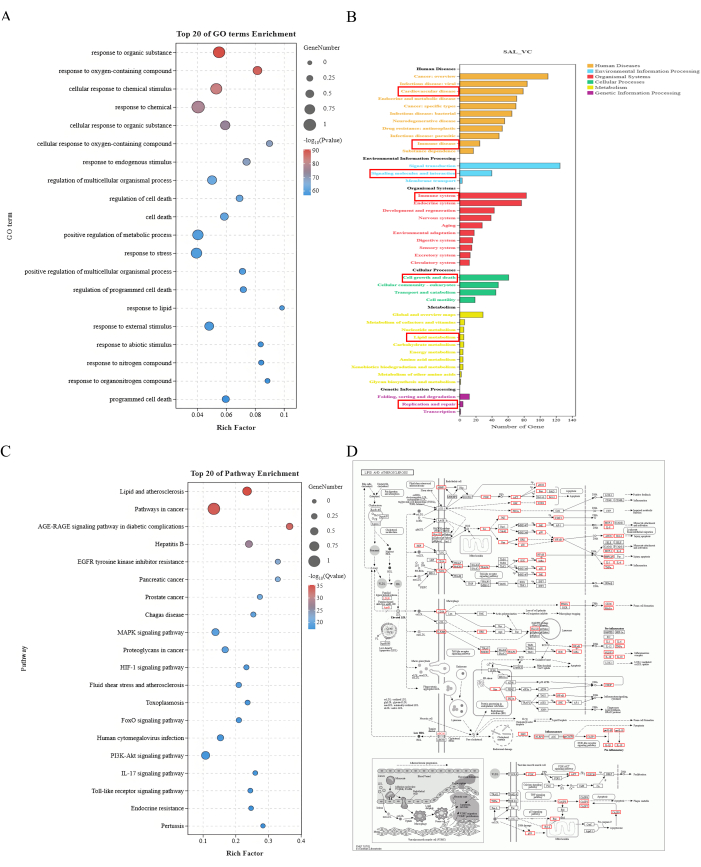
図2:エンリッチメント分析結果 (A) 上位20のGO用語エンリッチメント。X 軸はリッチ係数を表し、Y 軸は GO 項を表します。ドットの大きさは遺伝子の数を示し、色は-log10(P 値)、赤は P 値が小さいことを示します。(B)KEGG経路濃縮アノテーション。X 軸は遺伝子の数を表し、Y 軸はさまざまなレベルのアノテーション情報を表します。異なる色は、第 1 レベルの注釈のさまざまなカテゴリを表します。(C)トップ20の経路エンリッチメント。X 軸はリッチ係数を表し、Y 軸は GO 項を表します。ドットの大きさは遺伝子の数を示し、色は-log10(P 値)、赤は P 値が小さいことを示します。(D)脂質およびアテローム性動脈硬化症経路マップ。赤いボックスは、脂質およびアテローム性動脈硬化症経路に富むVCにおけるサリドロシド介入の潜在的な標的を示しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3: in vivo 実験によるラットの血管石灰化に対するサリドロシドの効果の調査。 実験計画のフローチャート。Wistarラットを11w実験に使用しました。最初の1週間で、ラットは順応し、その後の実験のために、Ctrl、Model、SAL-L、SAL-H、SIMの5つのグループにランダムに分けられました。1〜9週目には、Ctrlグループに通常の食事(ND)を給餌しましたが、他のグループは600,000 IU / kg VD3の単回注射後8wから高脂肪食(HFD)を受け取り、その後100,000 IU / kg VD3を毎週注射しました。9週目から10週目まで、すべての群がHFDに切り替え(対照群を除く)、SAL-L群とSAL-H群はそれぞれ5mg/kgと10mg/kgのサリドロシドの腹腔内注射を受け、SIM群は5mg/kgのシンバスタチンを投与された(n = 8)。 この図の拡大版を表示するには、ここをクリックしてください。
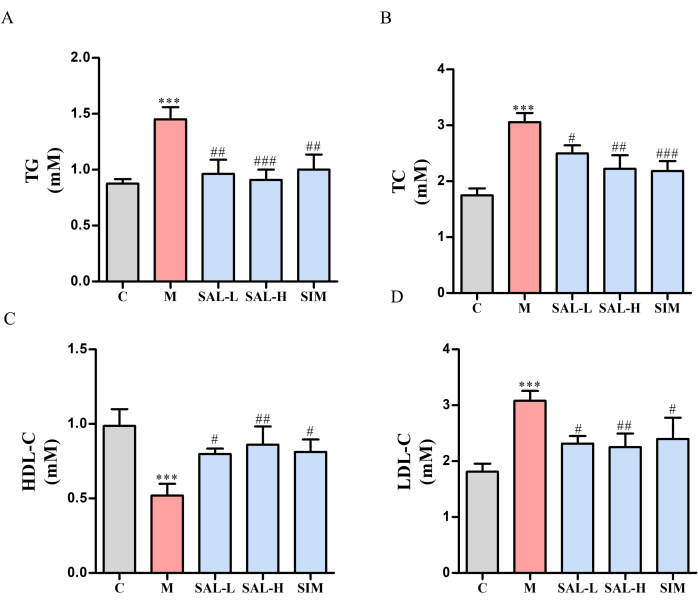
図4:サリドロシドで治療したVCラットの血清脂質レベル。 VCラットの血清脂質レベルは、単一試薬GPO-PAPおよび二重試薬直接法を使用して測定されました。(A)TGレベル(単一試薬GPO-PAP法)。(B)TCレベル(単一試薬GPO-PAP法)。(C)HDL-Cレベル(デュアル試薬直接法)。(D)LDL-Cレベル(デュアル試薬直接法)。各列は平均± SD を表します (n = 8)。Ctrl グループと比較すると、 P < 0.001;モデルグループと比較すると、 ###P < 0.001、 ##P <0.01、 #P < 0.05です。 この図の拡大版を表示するには、ここをクリックしてください。
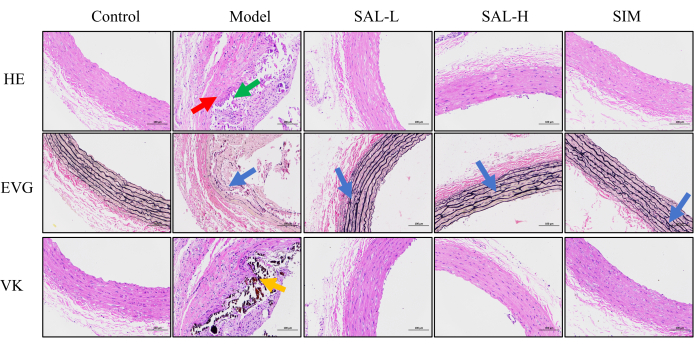
図5:VCラットにおける血管組織損傷の組織学的評価。 HE染色は組織損傷の評価に使用され、赤い矢印は内側の石灰化を示し、緑の矢印は外膜へのリンパ球浸潤を示します。核は青く染色され、細胞質は赤く染色されます。EVG染色は、腹部大動脈の弾性線維の損傷を観察するために使用され、青い矢印は弾性線維の破裂と混乱の領域を示しています。弾性繊維は赤く見え、筋肉は淡い赤に見えます。VK染色は、腹部大動脈におけるカルシウム沈着の観察に使用され、オレンジ色の領域はカルシウム沈着物を示し、黒く見えます(スケールバー:100μm、n=8)。 この図の拡大版を表示するには、ここをクリックしてください。
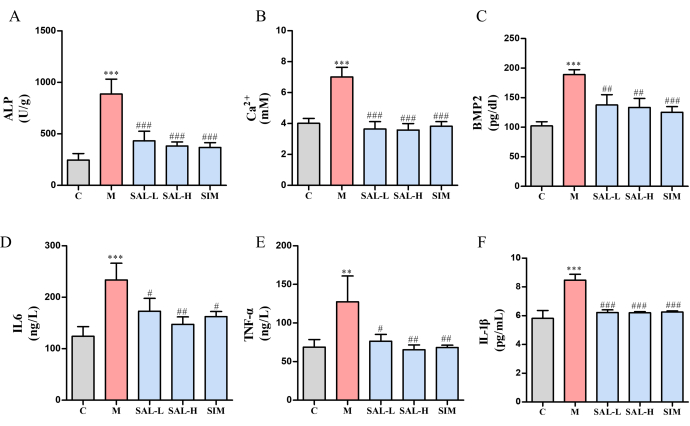
図6:サリドロシドで治療したVCラットにおける骨石灰化マーカーおよび炎症性サイトカインの発現(A)ALP活性(血管石灰化のマーカー)。(B)カルシウムイオン含有量。(C)BMP2発現(骨形態形成タンパク質)。(D)IL-6の発現(炎症誘発性サイトカイン)。(E)TNF-α発現(炎症誘発性サイトカイン)。(F)IL-1βの発現(炎症誘発性サイトカイン)。各列は平均± SD を表します (n = 8)。Ctrl グループと比較すると、P < 0.001、**P < 0.01;モデル グループと比較すると、###P < 0.001、##P < 0.01、#P < 0.05 です。この図の拡大版を表示するには、ここをクリックしてください。
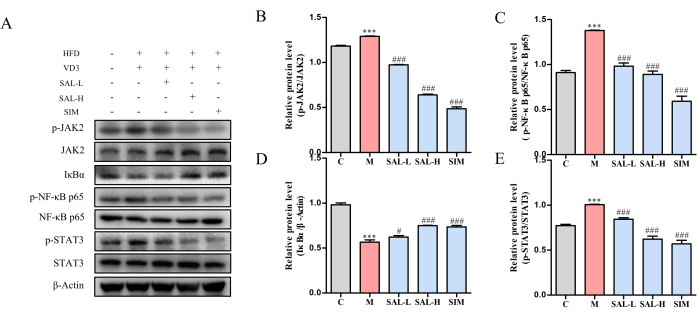
図7:サリドロシドで処理したVCラットにおける主要なタンパク質発現のウェスタンブロット解析。(A)p-JAK2、JAK2、p-STAT3、STAT3、p-NF-κB p65、NF-κB p65、およびIκBαタンパク質発現レベルのウェスタンブロット解析。(B)異なるグループにおけるP-JAK2/JAK2の相対的タンパク質発現。(C)p-NF-κB p65、NF-κB p65の異なるグループにおける相対的タンパク質発現。(D)異なるグループにおけるIκBαの相対的タンパク質発現。 (E)異なるグループにおけるP-STAT3/STAT3の相対的タンパク質発現。各列は平均± SD を表します (n = 8)。Ctrl グループと比較すると、P < 0.001;モデル・グループと比較すると、###P < 0.001、##P < 0.01、#P < 0.05です。この図の拡大版を表示するには、ここをクリックしてください。

図8:VCラットにおけるサリドロシド介入の提案された分子メカニズム。 サリドロシドがVCに介入する提案された分子メカニズムには、脂質関連因子および炎症誘発性サイトカイン(IL-1β、IL-6、TNF-α)の阻害が含まれます。サリドロシドは、IκBαの活性化とJAK2のリン酸化を抑制し、それによりNF-κB/STAT3炎症免疫経路を阻害します。これにより、最終的にVCの進行に伴う血管組織の損傷が軽減されます。 この図の拡大版を表示するには、ここをクリックしてください。
補足表1:ネットワーク薬理学データベース情報。このファイルをダウンロードするには、ここをクリックしてください。
補足表2:SDS-PAGEのコンポーネント(1サンプル分)このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
VCは、血管細胞および組織の変性変化を特徴とし、血管内の病理学的ミネラル沈着物が血管壁の硬化またはアテローム性動脈硬化性プラークの形成を引き起こし、閉塞性血管疾患を引き起こす可能性があります25。研究によると、VCプラークの約85%が血栓症に進化する可能性があり、これが急性心血管エピソードを引き起こす可能性があります。さらに、VCは、潜在的な急性心血管イベント、脳卒中、および末梢血管疾患の重要な指標です26。現在の治療法は、主に抗凝固薬、脂質低下薬、血管張力の調節に焦点を当てていますが、これらのアプローチは、特に石灰化の進行した段階では、有効性と副作用が限られていることがよくあります。
サリドロシド(SAL)は、p-ヒドロキシフェネチル-β-D-グルコピラノシドとして同定された化合物であり、神経系、心血管系、免疫系に影響を与えるさまざまな血管状態、および慢性腎臓病において有意な治療可能性を示しています27,28。現代の研究では、その抗酸化作用、アンチエイジング作用、免疫調節作用、および抗炎症作用が確認されています29,30,31。サリドロシドは、血管収縮薬を阻害し、血管拡張薬を促進することにより、内皮機能を著しく改善し、血管の弾力性を高めます32。血管の弾力性は、石灰化後の変化を直接反映しており、弾力性の喪失はしばしば弾性タンパク質の分解を伴い、血管の内層と中層を損傷します。この損傷は、多くの場合、炎症細胞の活性化として現れます。多くの研究が、VCと炎症との密接な関連を強調しています。慢性炎症は異所性石灰化の主要な推進力と見なされており、炎症誘発性細胞が増殖し、複数の経路33,34,35,36を通じてVCに寄与する因子を放出します。血管石灰化が炎症、脂質代謝、および酸化ストレスを含む複雑な病理学的プロセスであることを考えると、マルチターゲット治療薬としてのサリドロシドの可能性は特に重要です。サリドロシドのマルチターゲットアプローチは、脂質の蓄積と酸化ストレスを調節しながら炎症経路を阻害し、現在使用されている単一標的薬に比べて明確な利点を示します。したがって、この研究では、炎症性因子の発現を調べて、サリドロシドが炎症を軽減することによってVCに影響を与えるかどうかをさらに調査します。
2007年にホプキンス大学によって導入されたネットワーク薬理学の概念は、ネットワークベースのアプローチを用いて、薬物、疾患、および標的が複数の構成要素、標的、および経路間でどのように相互作用するかを調べることを含む37。この研究では、ネットワーク薬理学を用いて、SALがVCとどのように相互作用するかを予測し、IL6、STAT3、TNF、TP53、ALBなどの重要な標的を特定しました。その結果、これらの遺伝子が脂質代謝経路とアテローム性動脈硬化経路に集中していることが示され、VCが動脈内の脂質蓄積と炎症に関連している可能性が示唆されました。これらの予測を検証するために、VD3と組み合わせた高脂肪食によって誘発されたVCのラットモデルを使用しました。このモデルにより、SALがVCに与える影響をさらに調査することができました。その結果、VCはTC、TG、LDL-Cのレベルが上昇し、HDL-Cが低下することが明らかになりました。さらに、異なる用量のSALは、これらの異常な指標を調節する上でさまざまな効果を示しました。さらなる研究結果から、SALは腹部大動脈におけるカルシウム沈着を効果的に減少させ、異常なカルシウムイオンレベルを是正し、炎症性細胞浸潤を減少させると同時に、ALPやBMP2などの石灰化関連マーカーの発現を減少させることが示されました。
JAK/STAT経路は、さまざまな増殖およびシグナル伝達プロセスにおいて重要な役割を果たし、免疫応答および細胞分化を調節し、炎症応答に不可欠である38。IL-6によって活性化されるSTAT3は急性期応答の一部であり、IL-6はJAKリン酸化を誘導し、JAKリン酸化がSTAT3をリン酸化します。この活性化は、細胞の増殖、分化、生存に関連する遺伝子発現を制御します。STAT3の持続的なリン酸化は血管疾患と関連しており、接着分子の異常な発現につながる可能性があり、初期のVC段階では単球の血管内膜への接着を促進し、血管構造をさらに損傷する39,40。実験結果は、SALがリン酸化JAK2、STAT3、およびNF-κB p65の発現を阻害する一方で、IκBαの発現を促進することを示しており、VC進行の抑制におけるSALの役割は、IL-6/JAK2/STAT3シグナル伝達経路を介して媒介されていることを示唆しています(図8)。
この研究では、ネットワーク薬理学はVCの進行に関与する主要なメカニズムを成功裏に予測し、SALが介入する標的と経路を特定しました。ラットとヒトのシステムには生理学的および病理学的な類似性があるため、ラットモデルは将来の臨床研究にとって特に価値があります。さらに、ラットは費用対効果が高く、取り扱いが容易であるため、病気の研究や創薬に適しています。動物モデルの利点にもかかわらず、制限があります。ラットモデルは有用ですが、ヒトのVC発生の複雑さを完全に捉えることはできません。今後の研究では、より多様なモデルを取り上げ、併存疾患やさまざまな患者の背景などの要因を考慮する必要があります。
ただし、この研究にはいくつかの制限があります。実験期間は10週間で、その間にラットに高脂肪食(HFD)を与え、最初の高用量とそれに続く複数の低用量のVD3を与えてVCを誘導しました。ラットモデルで観察された高い死亡率は、予備実験で最初に注目され、VD3の高用量および長期投与がラットの生存率を大幅に低下させ、最終的に実験の質とタイムラインに影響を与えることがわかりました。このことは、生存率を向上させ、より堅牢なデータを得るために、モデルを最適化する必要性を強調しています。この研究では、ラットのVCに対するSALの効果が確認されましたが、VCの複雑さとその長期にわたる開発プロセスは、単一の動物研究がその病態生理学を完全に捉えていない可能性があることを意味します。今後の研究では、ラットの生存率を高めるためにモデルを改良することに焦点を当てるべきである。さらに、 in vivo 実験では、SALがJAK2/STAT3経路を介して炎症性因子を調節することによりVCを減少させることが示されましたが、さらなる研究では、in vitroで上流および下流の標的を調査する必要があります。最後に、SALに関する臨床研究は限られており、その有効性と安全性をヒトで評価するには、さらなる研究が必要です。VCは、慢性腎臓病、脳血管疾患、冠動脈アテローム性動脈硬化症など、複数の疾患と関連しています。この研究は、血管関連疾患の治療法を探求するためにさらに活用できるVCモデルを確立することに成功しました。ここで使用されている実験デザインと技術は、VCに関連する創薬の貴重な基盤にもなります。
要約すると、この研究では、ネットワーク薬理学と分子生物学を利用して、血管石灰化に対するサリドロシドの影響を調査しました。結果は、SALが炎症を抑制し、脂質因子発現を低下させ、JAK2/STAT3経路を介してVCマーカーを減少させることによりVCを阻害することを示しており、VC治療の有望な治療アプローチを示唆しています。
開示事項
すべての著者が利益相反を開示していることを確認します。
謝辞
この研究は、吉林省科学技術局プロジェクト(YDZJ202301ZYTS460)と吉林省教育局プロジェクト(JJKH20230991KJ)によって財政的に支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 30% (29:1) Acrylamide/Bis Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | A1010 | |
| 4% Paraformaldehyde Fix Solution | Beyotime Biotech Inc (Beyotime) , China | P0099 | |
| 5*loading buffer | Beijing Solarbio Science & Technology Co., Ltd ,China | P1040 | |
| Alkaline Phosphatase Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0321S | |
| AlphaView Software | Proteinsimple Inc.USA | AlphaView SA | |
| BCA Protein Assay Kit | Beyotime Biotech Inc (Beyotime) , China | P0012 | |
| Bluing Solution | Beijing Solarbio Science & Technology Co., Ltd ,China | G1866 | |
| Calcium Colorimetric Assay Kit | Beyotime Biotech Inc (Beyotime) , China | S1063S | |
| Collagen Fiber And Elastic Fiber Staining Kit(EVG-Verh eff Method) | Beijing Solarbio Science & Technology Co., Ltd ,China | G1597 | |
| Dewatering machine | Diapath Biosciences Ltd, Italy | Donatello | |
| Embedding machine | Wuhan Junjie Electronics Co., Ltd,China | JB-P5 | |
| Enzyme-labeled instrument | Biotek Co., Ltd,USA | Epoch | |
| Ethanol absolute | GHTECH Co., Ltd, China | 64-17-5 | |
| Goat Anti-Mouse IgG (H+L) HRP | Bioworld technology, co, Ltd.,China | BS20242-Y | |
| GraphPad Prism Software | GraphPad Software.,USA | GraphPad Prism 9.0 | |
| Hematoxylin-Eosin Stain Kit | Beijing Solarbio Science & Technology Co., Ltd ,China | G1120 | |
| High-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A112 | |
| HRP-labeled Goat Anti-Rabbit IgG(H+L) | Guangzhou saiguo biotech Co.,LTD | A0208 | |
| Image J Software | National Institutes of Health(NIH),USA | Image J | |
| IκB Alpha Polyclonal antibody | Proteintech Group, Inc.A,USA | 10268-1-AP | |
| JAK2 Antibody | Affinity Biosciences Co., Ltd,China | AF6022 | |
| Low-density lipoprotein cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A113 | |
| NF-κB p65 Antibody | Proteintech Group, Inc.A,USA | 10745-1-AP | |
| Pathological microtome | Leica Biosystems,USA | RM2016 | |
| Phosphatase Inhibitor Cocktail Tables | F. Hoffmann-La Roche, Ltd,Switzerland | 04906845001 | |
| Phospho-JAK2 (Tyr931) Antibody | Affinity Biosciences Co., Ltd,China | AF3024 | |
| Phospho-NF-κB p65(Ser276) Antibody | Affinity Biosciences Co., Ltd,China | AF2006 | |
| Phospho-STAT3(S727) Antibody | Abways Science & Technology Co., Ltd ,China | CY5291 | |
| Protease Inhibitor Cocktail | F. Hoffmann-La Roche, Ltd,Switzerland | 11873580001 | |
| PVDF membrane | F. Hoffmann-La Roche, Ltd,Switzerland | 3010040001 | |
| Rat IL-1β ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI303 | |
| Rat IL-6 ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PI328 | |
| Rat TNF-α ELISA Kit | Beyotime Biotech Inc (Beyotime) , China | PT516 | |
| RIPA Lysis Buffer | Beyotime Biotech Inc (Beyotime) , China | P0013B | |
| Salisoroside | Shanghai yuanye Bio-Technology Co., Ltd,China | S25475 | |
| SDS | Guangzhou saiguo biotech Co.,LTD,China | 3250KG001 | |
| Sodium carbonate | China National Pharmaceutical Group Co., Ltd. , China | 1001921933 | |
| Sodium hydrogen carbonate | China National Pharmaceutical Group Co., Ltd. , China | 10018960 | |
| Sodium thiosulfate | China National Pharmaceutical Group Co., Ltd. , China | 20042518 | |
| STAT3 Antibody | Proteintech Group, Inc.A,USA | 10253-2-AP | |
| TBST (10×) | Beyotime Biotech Inc (Beyotime) , China | ST673 | |
| Total cholesterol assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A111 | |
| Triglyceride assay kit | Nanjing Jiancheng Bioengineering Research Institute Co., Ltd,China | A110 | |
| Tris Base | Guangzhou saiguo biotech Co.,LTD | 1115GR500 | |
| Upright optical microscope | Nikon Corporation,Japan | Eclipse E100 | |
| Von Kossa Solution | Wuhan servicebio technology CO.,LTD,China | G1043 | |
| Western Blotting Luminol Reagent | Santa Cruz Biotechnology, Inc. ,USA | SC-2048 | |
| β-Actin antibody | Cell Signaling Technology, Inc.,USA | E4967 |
参考文献
- Sutton, N. R., et al. Molecular mechanisms of vascular health: Insights from vascular aging and calcification. Arterioscler Thromb Vasc Biol. 43 (1), 15-29 (2023).
- Henein, M. Y., Owen, A. Statins moderate coronary stenoses but not coronary calcification: Results from meta-analyses. Int J Cardiol. 153 (1), 31-35 (2011).
- Ajufo, E., et al. Value of coronary artery calcium scanning in association with the net benefit of aspirin in primary prevention of atherosclerotic cardiovascular disease. JAMA Cardiol. 6 (2), 179-187 (2021).
- Vossen, L. M., Kroon, A. A., Schurgers, L. J., De Leeuw, P. W. Pharmacological and nutritional modulation of vascular calcification. Nutrients. 12 (1), 100 (2019).
- Kereiakes, D. J., et al. Principles of intravascular lithotripsy for calcific plaque modification. JACC Cardiovasc Interv. 14 (12), 1275-1292 (2021).
- Demer, L. L., Watson, K. E., Boström, K. Mechanism of calcification in atherosclerosis. Trends Cardiovasc Med. 4 (1), 45-49 (1994).
- Chen, F., et al. Network pharmacology analysis combined with experimental validation to explore the therapeutic mechanism of salidroside on intestine ischemia-reperfusion. Biosci Rep. 43 (8), BSR20230539 (2023).
- Rong, L., et al. Salidroside induces apoptosis and protective autophagy in human gastric cancer ags cells through the pi3k/akt/MTOR pathway. Biomed Pharmacother. 122, 109726 (2020).
- Zhang, P., et al. Network pharmacology: Towards the artificial intelligence-based precision traditional Chinese medicine. Brief Bioinform. 25 (1), bbad518 (2023).
- Jiao, X., et al. A comprehensive application: Molecular docking and network pharmacology for the prediction of bioactive constituents and elucidation of mechanisms of action in component-based Chinese medicine. Comput Biol Chem. 90, 107402 (2021).
- Li, S., Zhang, B. Traditional Chinese medicine network pharmacology: Theory, methodology and application. Chin J Nat Med. 11 (2), 110-120 (2013).
- Wang, X., Hu, Y., Zhou, X., Li, S. Editorial: Network pharmacology and traditional medicine: Setting the new standards by combining in silico and experimental work. Front Pharmacol. 13, 1002537 (2022).
- Huang, Z., Yang, Y., Fan, X., Ma, W. Network pharmacology-based investigation and experimental validation of the mechanism of scutellarin in the treatment of acute myeloid leukemia. Front Pharmacol. 13, 952677 (2022).
- Zhang, R., Zhu, X., Bai, H., Ning, K. Network pharmacology databases for traditional Chinese medicine: Review and assessment. Front Pharmacol. 10, 123 (2019).
- Wang, C., Liu, X., Guo, S. Network pharmacology-based strategy to investigate the effect and mechanism of alpha-solanine against glioma. BMC Complement Med Ther. 23 (1), 371 (2023).
- Li, X., et al. Network pharmacology prediction and molecular docking-based strategy to explore the potential mechanism of Huang Lian jiedu decoction against sepsis. Comput Biol Med. 144, 105389 (2022).
- Holmes, R. S., et al. Recommended nomenclature for five mammalian carboxylesterase gene families: Human, mouse, and rat genes and proteins. Mamm Genome. 21 (9-10), 427-441 (2010).
- Geng, J., Zhou, G., Guo, S., Ma, C., Ma, J. Underlying mechanism of traditional herbal formula Chuang-ling-ye in the treatment of diabetic foot ulcer through network pharmacology and molecular docking. Curr Pharm Des. 30 (6), 448-467 (2024).
- Chen, X., et al. Puerarin inhibits emt induced by oxaliplatin via targeting carbonic anhydrase xii. Front Pharmacol. 13, 969422 (2022).
- Herrmann, J., Babic, M., Tolle, M., Van Der Giet, M., Schuchardt, M. Research models for studying vascular calcification. Int J Mol Sci. 21 (6), 2204 (2020).
- Zhou, H., X, W., Yuan, Y., Qi, X. Comparison of methods for establishing a rat model of atherosclerosis using three doses of vitamin D3 and atherogenic diet. Chin J Arterioscler. 20 (11), 995-998 (2012).
- Zhang, Y., et al. Il-18 mediates vascular calcification induced by high-fat diet in rats with chronic renal failure. Front Cardiovasc Med. 8, 724233 (2021).
- Kazlouskaya, V., et al. The utility of elastic verhoeff-van gieson staining in dermatopathology. J Cutan Pathol. 40 (2), 211-225 (2013).
- Tang, X., et al. Underlying mechanism and active ingredients of tianma gouteng acting on cerebral infarction as determined via network pharmacology analysis combined with experimental validation. Front Pharmacol. 12, 760503 (2021).
- Lee, S. J., Lee, I. K., Jeon, J. H. Vascular calcification-new insights into its mechanism. Int J Mol Sci. 21 (8), 2685 (2020).
- Magdic, J., et al. Intracranial vertebrobasilar calcification in patients with ischemic stroke is a predictor of recurrent stroke, vascular disease, and death: A case-control study. Int J Environ Res Public Health. 17 (6), 2013 (2013).
- Zhou, L., et al. Salidroside-pretreated mesenchymal stem cells contribute to neuroprotection in cerebral ischemic injury in vitro and in vivo. J Mol Histol. 52 (6), 1145-1154 (2021).
- Hutcheson, J. D., Goettsch, C. Cardiovascular calcification heterogeneity in chronic kidney disease. Circ Res. 132 (8), 993-1012 (2023).
- Zhang, X., et al. Salidroside: A review of its recent advances in synthetic pathways and pharmacological properties. Chem Biol Interact. 339, 109268 (2021).
- Zhang, P., Li, Y., Guo, R., Zang, W. Salidroside protects against advanced glycation end products-induced vascular endothelial dysfunction. Med Sci Monit. 24, 2420-2428 (2018).
- Li, Y., et al. Salidroside promotes angiogenesis after cerebral ischemia in mice through shh signaling pathway. Biomed Pharmacother. 174, 116625 (2024).
- Gao, X. F., Shi, H. M., Sun, T., Ao, H. Effects of radix et rhizoma Rhodiolae kirilowii on expressions of von Willebrand factor, hypoxia-inducible factor 1 and vascular endothelial growth factor in myocardium of rats with acute myocardial infarction. Zhong Xi Yi Jie He Xue Bao. 7 (5), 434-440 (2009).
- Li, X., Liu, C., Li, Y., Xiong, W., Zuo, D. Inflammation promotes erythropoietin induced vascular calcification by activating p38 pathway. Bioengineered. 13 (3), 5277-5291 (2022).
- Bessueille, L., Magne, D. Inflammation: A culprit for vascular calcification in atherosclerosis and diabetes. Cell Mol Life Sci. 72 (13), 2475-2489 (2015).
- Li, R., et al. Salidroside prevents tumor necrosis factor-alpha-induced vascular inflammation by blocking mitogen-activated protein kinase and nf-kappa B signaling activation. Exp Ther Med. 18 (5), 4137-4143 (2019).
- Xing, S. S., et al. Salidroside attenuates endothelial cellular senescence via decreasing the expression of inflammatory cytokines and increasing the expression of sirt3. Mech Ageing Dev. 175, 1-6 (2018).
- Hopkins, A. L. Network pharmacology. Nat Biotechnol. 25 (10), 1110-1111 (2007).
- Xin, P., et al. The role of jak/stat signaling pathway and its inhibitors in diseases. Int Immunopharmacol. 80, 106210 (2020).
- Fu, X., et al. Glycosides from buyang huanwu decoction inhibit atherosclerotic inflammation via jak/stat signaling pathway. Phytomedicine. 105, 154385 (2022).
- Macri, F., et al. High phosphate-induced jak-stat signalling sustains vascular smooth muscle cell inflammation and limits calcification. Biomolecules. 14 (1), 107328 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved