Method Article
16α-[18F]-Fluoro-17β-Estradiol PET를 사용하여 암컷 난소 절제술 마우스의 인간 유방암 이종이식편에서 에스트로겐 수용체 α 발현 시각화
요약
여기에서는 ERα-양성 유방 이종이식편에서 ERα 발현을 시각화하기 위한 도구로 16α-[18F]-fluoro-17β-estradiol(18F-FES) 양전자 방출 단층촬영(PET)을 사용하는 프로토콜을 보여줍니다.
초록
16α-[18F]-플루오로-17β-에스트라디올(18F-FES) 양전자 방출 단층촬영(PET)을 사용하여 BALB/c 누드 마우스에서 에스트로겐 수용체 알파(ERα) 양성 유방암 이종이식을 시각화하는 방법을 보여주기 위해 난소 절제술된 BALB/c 누드 마우스에 ERα 양성 유방암 세포(MCF-7, 3 × 106 세포, 어깨[n = 10] 또는4th 서혜부 유방 지방 패드[n = 10]) 또는 ERα 음성 유방암 세포(MDA-MB-231, 1 × 106 셀; 유방 지방 패드 [n = 5]). MCF-7 세포를 보유한 마우스는 세포 주입 2일 전에 목 목덜미에 20μg의 17β-에스트라디올(20μg/20μL; 옥수수유:에탄올, 9:1)을 피하 주사한 후 5주 동안 일주일에 5회 매일 주사했습니다. 종양 부피는 (L*W2)/2 (L; 길이, W; 너비) 공식에 따라 측정되었습니다. 종양 부피가 약 100mm에 도달하면3, 17β-에스트라디올 주사를 마우스가 PET 이미징을 위해 18F-FES를 투여하기 2일 전에 중단하여 ERα와의 경쟁적 결합을 피했습니다. 측면 꼬리 정맥을 통한 18회의 F-FES 투여 시, 주입 후 1시간에서 1.5시간에 15분 동안 PET/MRI를 수행했습니다. 18분F-FES 흡수는 ERα 음성, MDA-MB-231 종양 보유 마우스에서 관찰되지 않았습니다. 18분F-FES 흡수는 어깨에 MCF-7 종양이 있는 마우스에서 가장 두드러졌습니다. 서혜부 유방 지방 패드에서 자란 MCF-7 종양에서는 18F-FES의 장 배설 패턴이 이러한 종양에서 검출할 수 있는 방사능을 가렸기 때문에 18F-FES 흡수가 덜 눈에 띄었습니다. ERα 양성 유방 이종이식편에서 ERα 발현을 시각화하기 위한 도구로 18F-FES PET를 사용하기 위해 어깨와 같이 마우스의 복부에서 멀리 떨어진 종양에서 18F-FES 흡수의 가시성이 명확함을 입증합니다.
서문
유방암(BC)은 다양한 분자 하위 유형으로 계층화할 수 있습니다1. 내강 아형으로 분류되는 유방 종양은 에스트로겐 수용체 알파(ERα)를 과발현합니다. 따라서 BC의 이러한 하위 유형은 ERα 양성(ERα+)이라고도 합니다. 다행히도 ERα+ BC 진단을 받은 환자는 10년 생존율이 가장 높고 원격 전이율이 낮습니다 2,3. ERα 발현으로 인해 이러한 환자는 선택적 에스트로겐 수용체 조절제(SERM), 항에스트로겐 약물, 아로마타제 억제제를 포함한 다양한 호르몬 요법 옵션을 이용할 수 있다4.
유방암 환자가 호르몬 요법을 받을 수 있는지 여부를 평가하기 위해서는 유방 종양 내 ERα의 발현 수준을 결정해야 합니다 5,6,7. 검사의 황금 표준은 면역조직화학(IHC) 방법을 사용하여 수행되지만, 많은 보고서에서 얻은 결과의 재현성과 신뢰성 모두에 대한 문제를 강조합니다 6,8,9. IHC는 본질적으로 반정량적(semi-quantitative) 기법이기 때문에 결과 불일치를 유발할 수 있으며, 조직 처리 및 후속 해석의 차이로 인해 변동성이 발생할 수 있습니다6. 이 반복되는 문제를 바로잡기 위해 2010년에 가이드라인이 설정되었고 2020년에 미국임상종양학회(American Society of Clinical Oncology)가 관찰자 간 변동10을 줄이기 위해 지침을 업데이트했습니다. 현재 임상적으로 검증된 컷오프는 ≥1%이며, 매우 작은 발현 수준에서도 ERα 발현은 내분비 요법을 사용하여 임상적으로 유의미한 이점을 입증했습니다11.
진행성 BC에서 ERα 발현은 전이와 원발성 종양 간에 다를 수 있습니다. 일부 관찰에서는 전이성 병변과 원발성 종양 사이의 ERα 발현 수준이 18%-55% 차이가 있다고 보고했는데, 이는 BC 전이의 ERα 상태를 결정하는 것이 중요하다는 점을 지적한다12. 이 문제를 해결하기 위해 지침은 전이성 병변에서 호르몬 수용체 상태를 확인하여 정보에 입각한 치료 계획을 세우는 것이 중요하다고 강조합니다13,14. 그러나 특히 IHC 방법을 통한 이것의 타당성은 생검을 하기 어려운 곳에 전이가 존재할 수 있다는 점을 고려할 때 의심스럽습니다.
분자 이미징 방법은 암 환자 내의 종양 병변을 감지하고 시각화하는 데 필수적인 도구가 되기 위해 등장했습니다. 특히, 양전자 방출 단층촬영(PET) 이미징에는 추적자, 더 구체적으로 말하자면 이러한 병변을 비침습적으로 시각화하기 위해 종양의 특정 특징을 활용하도록 설계된 방사성 의약품의 사용이 필요합니다. 종양학에서 사용되는 가장 일반적인 PET 추적자는 18F-플루오로데옥시글루코스(18F-FDG)15입니다. 이 연구에서는 방사성 표지된 형태의 에스트라디올, 18F-플루오로에스트라디올(18F-FES)의 사용을 탐구합니다. 에스트라디올(ERα의 리간드)은 여성의 난소에서 주로 생성되는 호르몬이다16. 18분F-FES는 최근 미국 식품의약국(FDA)의 승인을 받았으며 CeriannaTM으로 판매되고 있습니다. 이 이미징 에이전트는 재발성 또는 전이성 BC17 환자의 생검의 보조제로 사용하도록 설계되었습니다. 18F-FES를 사용한 전신 PET 영상은 원발성 종양과 생검이 어려운 부위의 원격 전이 모두에서 ERα 수치를 검출하기 위한 비침습적 방법으로 사용할 수 있습니다18. 18개의 F-FES PET 영상을 사용한 ERα 수치 예측은 IHC 결과와 상관관계가 있으며, 18개의 F-FES PET 영상을 사용한 ERα의 검출이 거의 또는 전혀 없는 것은 호르몬 요법에 반응할 가능성이 없는 종양의 신뢰할 수 있는 예측 변수입니다18. 임상에서 18F-FES의 적절한 사용을 보장하기 위해, 가이드라인은 해당 분야의 전문가들의 합의를 통해 공식화되었다19. 이 연구에서는 마우스의 유방암 전임상 모델에서 18개의 F-FES PET의 사용을 평가합니다.
프로토콜
모든 동물 연구는 오스틴 병원 동물 윤리 위원회(A2023/05812)의 승인을 받았으며 과학적 목적을 위한 동물 관리 및 사용에 대한 호주 규약에 따라 수행되었습니다.
1. 세포 준비
- 일상적인 세포 배양 절차를 사용하여 T175 조직 배양 플라스크에서 페니실린/스트렙토마이신 및 10% 소 태아 혈청(FBS)이 보충된 DMEM/F-12의 MDA-MB-231 및 MCF-7 세포를 유지합니다. 주입을 위해 세포를 준비하기 전에, 액체 질소 저장소에서 부활한 후 세포를 최소 3배 계대 세포로 만듭니다. 37°C의 가습 인큐베이터에서 5% CO2로 세포를 성장시킵니다.
- 주사를 위해 세포를 준비하는 날에 15 마우스(즉, 최소 45 ×10 6 MCF-7 세포)에 대해 마우스당 주입당 3 × 106 MCF-7 세포가 있고 5 마우스(즉, 최소 5 ×10 6 MDA-MB-231 세포)에 대해 마우스당 주입당 1 × 106 MDA-MB-231 세포가 있도록 세포를 증식시킵니다.
참고: 각 마우스에 동일한 수의 세포를 허용하려면 5번의 추가 주입을 위해 충분한 세포를 준비합니다(예: 5개의 마우스를 주입하기 위해 10번의 주입을 위한 충분한 세포를 준비합니다). - 세포 주입 당일, 모든 플라스크에서 배지를 제거하고 약 5mL의 트립신-EDTA(0.25% 트립신 및 0.05% EDTA)를 1x 인산염 완충 식염수(PBS)(pH 7.4)에 넣어 세포 분리를 용이하게 합니다.
- 세포가 분리되면 약 10mL의 완전한 배지를 플라스크에 넣어 트립신 활성을 억제합니다. 세포를 재현탁하고 단일 세포 현탁액을 50mL 튜브로 옮깁니다. ~300 × g 에서 2분 동안 펠릿 세포에 원심분리기를 투여합니다.
- 세포 펠릿을 적절한 부피의 배지에 재현탁하고 세포 수를 계산하여 수확된 총 세포 수를 결정합니다.
참고: mL당 약 1 × 106 개 셀(계수 챔버를 사용하는 경우 16제곱미터당 50-100개 세포)의 용액을 계수하는 것을 목표로 합니다. 전체 플라스크당 5 × 106 으로 성장하는 세포의 경우 5mL의 배지에서 세포를 수확합니다. 밀도가 더 높은 세포주의 경우 플라스크당 10mL의 배지를 사용합니다. - 멸균 층류 캐비닛의 얼음 위에서 이 단계를 수행합니다. 이 수치에 도달하면 세포 현탁액을 300 × g 에서 2분 동안 다시 원심분리하여 펠릿 세포로 만듭니다. 3 × 106 MCF-7 셀당 40 μL의 PBS와 10 μL의 기저막 매트릭스 용액이 있도록 펠릿을 차가운 PBS 및 얼음처럼 차가운 기저막 매트릭스 용액에 재현탁시킵니다.
- MDA-MB-231 세포 펠릿을 1 × 106 세포당 40 μL의 PBS와 10 μL의 기저막 매트릭스 용액이 있도록 동일한 성분으로 재현탁합니다. 차가운 피펫 팁을 사용하여 50mL 튜브의 cell-PBS-basement membrane matrix mixture를 더 작은 1.5mL tube로 옮기고 cell을 마우스에 주입하기 직전에 cell mixture를 얼음 위에 보관합니다.
참고: 이 연구에 사용된 기저막 매트릭스는 -20°C에서 보관됩니다. 기저막 매트릭스 용액이 필요하기 전날, 용액의 분취액을 4°C에 놓고 밤새 해동합니다. 다음날, 차가운 온도(얼음 위)에서 사용할 준비가 됩니다. 용액을 피펫팅할 때 사용된 피펫 팁이 차가워져 기저막 매트릭스 용액이 응고되는 것을 방지하십시오. 주입을 위한 세포 준비일 전에 멸균 피펫 팁 상자를 냉장고에 보관하는 것이 좋습니다. 얼음처럼 차가운 PBS 및 기저막 매트릭스 용액에 세포 펠릿을 재현탁할 때 PBS를 먼저 첨가한 다음 필요한 양의 기저막 매트릭스 용액을 첨가합니다.
2. 난소 절제술을 받은 마우스에 세포 주입
- 생후 6-8주 된 암컷 난소 절제술을 받은 BALB/c 누드 마우스가 세포 주입 전 최소 1주일 동안 동물 사육 시설에 순응하도록 합니다.
참고: 이 연구는 12-14주 된 더 오래된 쥐에 접근했습니다. 난소 절제술은 낮은 수준의 내인성 에스트라디올을 보장하고 18F-FES 리간드와의 경쟁을 줄입니다. 연구되는 모델에 따라, 어린 마우스(예: 4-8주)는 내인성 에스트라디올 수치가 낮기 때문에 난소 절제술을 받을 필요가 없을 수도 있습니다20,21. - 마취 유도 챔버를 사용하여 4% 이소플루란과 4L/분의 속도로 산소를 공급한 마우스에서 마취를 유도합니다. 마우스를 관찰하고 오른쪽 반사 상실을 확인하십시오. 쥐가 더 이상 움직이지 않으면 마우스를 멸균 층류 캐비닛으로 옮기고 주둥이를 코 마스크에 넣은 다음 이소플루란을 2%로, 산소를 2L/min의 속도로 조정하여 마취를 유지합니다.
알림: 최적의 관리를 위해 한 번에 한 마리의 마우스를 마취하십시오. - 유방내 지방 패드(IMF) 주사의 경우 알코올로 4번째 서혜부 유선의 피부를 면봉으로 닦습니다. 사전 냉각된(얼음 위) 27G 주사기를 사용하여 콜드 셀 현탁액을 끌어올리고 주사기를 얼음 위에 두어 주입 전에 기저막 매트릭스 용액이 가열/응고되는 것을 방지합니다.
- 주로 사용하지 않는 손의 엄지와 검지를 사용하여 4번째 유선을 부드럽게 들어 올리고 주로 사용하는 손으로 27G 주사기 바늘을 삽입하여 바늘의 경사가 위쪽을 향하도록 합니다. 세포-PBS-기저 막 매트릭스 용액 혼합물을 포함하는 세포 현탁액 50μL를 유방 지방 패드에 천천히 주입합니다.
참고: 세포가 주입될 때 손가락 사이에서 기포가 느껴져야 합니다. 주입 부위에 누출이 있는지 확인하십시오. - 주사가 완료되면 이소플루란을 끄고 마우스의 주둥이를 콧방울 안에 넣어 산소를 들이마시고 의식을 되찾습니다(약 1분 정도 소요). 최적의 복구를 위해 마우스를 열 패드의 케이지에 다시 놓습니다.
- 어깨 주사의 경우, IMF 주사에 대해 설명된 위의 절차를 사용하며, 유일한 차이점은 세포 주사의 위치입니다.
참고: 또는 마취 없이 어깨 주사를 완료할 수 있습니다(아래 2.7단계 참조). - 마취 없이 어깨 주사를 하려면 엄지와 검지 사이에 주로 사용하지 않는 손을 사용하여 마우스의 어깨 너머로 피부를 잡고 들어 올려 피부에 '텐트'를 형성합니다. 27G 주사기 바늘을 사용하여 cell-PBS-basement membrane matrix 용액을 포함하는 50μL의 세포 현탁액을 천천히 주입합니다. 바늘을 부드럽게 빼내고 누출 여부를 확인하십시오.
참고: 대안으로, Hamilton 주사기를 소량 주입에 사용하여 대량 전달의 정확성을 보장할 수 있습니다. 주사 사이에 80% v/v 에탄올은 다른 세포주를 사용할 때 주사기를 헹구는 데 사용되며 PBS는 주사기에서 잔류 에탄올을 헹구고 제거하는 데 사용됩니다.
3. 에스트라디올 용액의 준비
- 물질의 밀리그램을 정확하게 측정할 수 있는 저울을 사용하여 7mg의 에스트라디올 분말을 1.5mL 튜브에 넣습니다.
- 700 μL의 100% 에탄올을 7 mg의 에스트라디올 분말에 첨가합니다. 1.5mL 튜브를 부드러운 셰이커에 실온(RT)에서 약 1시간 동안 또는 에스트라디올 분말이 완전히 용해될 때까지 놓습니다.
- 각각 70μL 에탄올-에스트라디올 용액이 포함된 10개의 1.5mL 튜브에 용액을 분주합니다. 나중에 사용할 수 있도록 튜브를 -20°C에 놓습니다.
참고 : Estradiol-ethanol 재고는 약 2 주 동안 -20 ° C에서 보관할 수 있습니다.
4. 에스트라디올 용액의 피하 주사
- 에스트라디올 주사가 필요한 날에는 다음 혼합물을 신선하게 만드십시오. 630μL의 옥수수 기름을 70μL의 에탄올-에스트라디올 용액이 들어 있는 1.5mL 튜브에 비히클로 결합합니다. 용액을 균질해질 때까지 소용돌이치게 하여 에탄올이 분리되지 않고 차량 오일 상단에 층을 형성하도록 합니다.
참고 : 이것은 20 μg / 20 μL 옥수수 기름 : 에탄올, 9 : 1 용액의 700 μL를 산출합니다. 각 마우스는 이 용액을 20μL씩 받습니다. 혼합물의 오일은 점도로 인해 주사기 외부와 1.5mL 튜브의 측면에 달라붙는 경향이 있으므로 항상 추가 용액을 만드십시오(예: 20마리의 마우스의 경우 400μL로 충분하지만 거의 두 배(700μL)를 만들면 충분한 오류 공간이 제공됨). - 인슐린 주사기에 부착된 29G 바늘을 사용하여 20μL의 에스트라디올 용액을 천천히 추출합니다.
참고: 용액에는 오일 9부와 에스트라디올-에탄올 1부가 포함되어 있기 때문에 혼합물이 주사기로 들어가는 데 시간이 걸립니다. - 에스트라디올 용액을 주입할 마우스는 ERα를 발현하는 종양을 보유하고 있어 성장을 위해 에스트로겐에 의존하는 마우스입니다(이 연구에서는 MCF-7). ERα(본 연구에서 MDA-MB-231)를 발현하지 않는 종양이 있는 마우스는 에스트라디올 용액을 투여받지 않습니다. 주사할 마우스를 앞에, 가급적이면 수건 위에 부드럽게 배치하여 제지하는 동안 팔다리가 다치는 것을 방지합니다.
- 주로 사용하지 않는 손을 사용하여 약지와 새끼 손가락 사이에 꼬리 윗부분을 잡고 마우스를 제지합니다. 엄지와 검지를 사용하여 마우스 목 근처의 느슨한 피부를 들어 올려 에스트라디올 용액의 피하 주사를 위해 피부에 '텐트'를 형성합니다.
- 마우스를 이 구속 상태로 유지하면서 주로 사용하는 손을 사용하여 마우스에 에스트라디올 용액을 주입합니다. 바늘의 경사가 위쪽을 향하게 하여 바늘의 절반 미만이 보일 때까지 바늘을 피부의 '텐트' 아래로 밀어 넣습니다.
참고: 용액을 주입하면 피부가 눈에 띄게 부풀어 올라야 합니다. - 용액의 역류를 방지하려면 몇 초 동안 바늘을 피부 아래에 두십시오. 역류가 발생하면 티슈로 해당 부위를 부드럽게 두드려 건조시켜 잔류 용액을 제거합니다.
참고: 일부 실험에서는 참기름과 결합된 에스트라디올을 사용하여 호르몬을 투여했습니다. 참기름을 매개체로 사용하면 에스트라디올 주사 부위의 피부 아래에 국소 염증이 발생합니다. 이와 같이, 옥수수 기름은 에스트라디올 주사 부위의 염증 징후가 없거나 최소한인 후속 실험의 매개체로 선택되었다22. 자세한 내용은 토론을 참조하십시오. - 바늘을 제거한 후 면봉을 사용하여 국소 소독제로 주사 부위를 부드럽게 닦습니다. 이는 마우스의 피부를 통해 바늘을 삽입/제거함으로써 주입 부위 표면의 염증을 방지하기 위함이다.
- ERα(MCF-7)를 발현하는 종양이 있는 마우스에게 세포 주입 3일 전에 에스트라디올 주사를 피하 주사한 다음 5주 동안 일주일에 5회 주사합니다(그림 1). 18 F-FES 프로브가 표적인 ERα에 대한 경쟁적 결합을 피하기 위해 이미징 데이 2일 전에 에스트라디올 주입을 중단합니다.
참고: 이 연구에서는 MCF-7 종양이 있는 마우스에게 월요일부터 금요일까지 매일 에스트라디올을 주사했습니다. 그 다음 주에 수요일에 이미지를 촬영해야 한다면, 토요일과 일요일에도 에스트라디올 주사를 계속했습니다. 에스트라디올은 월요일과 화요일에 투여되지 않았고 수요일에 생쥐를 이미지화했습니다.
5. 난소 절제술을 받은 마우스의 18F-FES PET 및 MRI 이미징
주의: 방사능을 다룰 때는 보호 장비를 사용하십시오. 방사능을 취급할 때 적용 가능한 모든 규제 절차를 따르십시오.
- 마우스의 무게를 측정하고 무게를 기록합니다.
- 이 연구를 위해 18F-FES를 동물 모델에 사용하기 위해 임상 등급23(Austin Health의 분자 이미징 및 치료부에서 획득)에서 합성 및 공식화했습니다. 약 150-300 μCi/100 μL의 조정된 감쇠 보정 주입 농도에서 10% w/v 에탄올 식염수 용액에 18F-FES(109분 방사성 반감기)를 희석합니다.
참고: 1000 Ci/mmol의 특정 활성은 ERα24의 생체 내 PET 이미징에 충분하며, 수신된 18F-FES는 이 기준선 값보다 높은 특정 활성을 가졌습니다. - 29G 바늘이 있는 인슐린 주사기로 100μL를 뽑습니다. 선량 교정기를 사용하여 방사능 선량과 시간을 측정하고 기록합니다. 주입 할 때까지 주사기를 납 방패 뒤에 놓습니다.
참고: 선량 검사기를 사용하여 각 선량에서 18F-FES 방사능의 양을 측정합니다. 용량 보정기는 제조업체의 프로토콜에 따라 세슘-137과 같은 표준 표준 물질에 대해 보정해야 합니다. 판독 시간은 감쇠 보정을 결정하기 위해 기록하는 것이 중요합니다. 교정기에 표시된 시간이 PET 획득에 사용되는 컴퓨터의 시간과 일치하는지 확인합니다. - 정맥 주사를 위해 꼬리 정맥을 확장하려면 마우스를 30cm 거리의 발열체 아래에 2분 동안 놓습니다. 주사 전에 해당 부위를 소독하기 위해 70% w/v 에탄올로 꼬리를 닦습니다.
- 18 F-FES 100μL(주사기의 전체 부피)를 측면 꼬리 정맥을 통해 볼루스 주사로 투여하고 주사 시간을 기록합니다. 주사 부위를 티슈로 눌러 꼬리 정맥의 출혈을 멈춥니다.
- 용량 교정기를 사용하여 주사기와 조직의 잔량을 측정하고 측정 및 시간을 기록합니다. 다중 챔버를 사용하여 이미징할 수 있도록 2개씩 엇갈리게 배치된 마우스를 주입합니다.
알림: 일부 프로브는 주사기에 남아 있습니다. 인슐린 주사기의 사용은 주사 투여 후 주사기/바늘에 갇히는 투여량이 감소하기 때문에 Luer 잠금 장치를 통해 바늘에 연결된 주사기보다 선호됩니다. 또한, 프로브의 정맥 주사 후 발생할 수 있는 출혈을 멈추는 데 사용되는 조직의 방사능을 측정합니다. 이는 조직에 흡수된 혈액의 역류에 18F-FES의 방사능이 일부 포함되어 있을 수 있기 때문입니다. 또한 측면 꼬리 정맥을 데우는 데 걸리는 시간은 열원의 강도 및 생쥐와 얼마나 가까운지와 같은 변수에 따라 달라집니다. 표준 열 램프의 경우 정맥이 확장되는 데 최대 15분이 소요될 수 있습니다. 생쥐는 과열 징후가 있는지 면밀히 모니터링해야 하며 필요한 경우 주사 사이에 열원에서 제거해야 합니다. - 주입 후 수면에 할당된 마우스의 경우, 주입된 마우스를 이소플루란(2%-2.5%) 및 산소(2L/분)의 유지 수준으로 유지되는 마취실에 가열 패드에서 1시간 동안 배치하여 프로브가 PET 스캔 전에 마우스의 전신 순환을 통해 분배될 수 있도록 합니다. 그룹의 다른 쥐가 PET 스캔까지 1-1.5시간 동안 케이지 안을 자유롭게 걸을 수 있도록 합니다.
- 1-1.5시간 후, 마우스를 노즈-콘 이소플루란 마취 하에 이미징 챔버에 놓습니다. 침대 히터를 32°C로 켜고 다중 챔버 설정을 선택한 다음 호흡기 모니터링 시스템을 켭니다. 이미지를 촬영할 두 마리의 마우스를 엎드린 자세로 놓습니다. 이미징 챔버를 PET/MRI 기계에 놓습니다.
- 이미지 획득 전반에 걸쳐 마우스의 호흡을 모니터링합니다. 호흡 차트를 사용하여 스캔하는 동안 주어진 시간에 분당 60-80회 호흡을 보장합니다. 호흡수가 원하는 범위보다 낮거나 높게 떨어지면 필요에 따라 이소플루란 용량을 조절합니다.
참고: 이미징 챔버에 센서가 있기 때문에 동물의 호흡을 모니터링할 수 있습니다. - 정적 15분 PET 획득을 GRE(Gradient Echo) 3D 축 MRI 스캔과 페어링합니다. 획득 매개변수에 대해서는 아래를 참조하십시오.
- PET 프로토콜을 설정하려면 관련 소프트웨어에서 Radiopharmaceutical Editor 창을 엽니다. 사용 중인 동위원소, 주사기 활성(MBq), 주입 시간 및 적용 활성(MBq), 체중을 지정합니다. 이러한 모든 매개변수는 관심 조직에서 프로브의 흡수를 계산하고 정량화하는 데 필수적입니다.
- 이미징을 위해 마우스가 올바른 위치에 있는지 확인하려면 2D Scout(전면 및 후면) 시퀀스를 사용하여 PET 시야를 결정합니다. 400-600keV의 에너지 창, 1-5, 5ns의 일치 모드를 사용하여 15분 정적 PET 획득을 진행합니다. 그 후 약 27분 동안 GRE3D 축 MRI 스캔을 수행합니다.
- 관련 소프트웨어를 사용하여 획득한 이미지를 재구성합니다.
- PET/MRI 이미지의 정적 재구성을 수행하고 기하학적 플래너를 사용하여 재구성 영역을 수정하여 마우스 전체를 덮도록 함으로써 최적의 재구성 시간을 보장합니다.
- 결과 식별 창에서 임의 보정, 감쇠 보정(AC) + 분산, 위치 범위를 켜기로 전환합니다. 감쇠 참조 시간을 ADMIN으로 설정합니다. 몸체-공기 임계값을 30%로 설정하고 재질 맵에서 감쇠 보정을 기반으로 합니다.
- 다중 챔버 이미지 분리, 공동 정합 및 관심 영역(ROI)을 그리기 위해 관련 소프트웨어를 사용합니다. 공동 정합을 위해 PET에 맞게 MRI를 재정렬하고 PET 이미지를 재구성합니다.
- 다중 챔버 이미지를 분리하려면 Image Processing > Segmentation > Hotel Separator를 클릭합니다. 과학 모드를 켜고 2개의 개체가 발견될 때까지 필요에 따라 임계값 및 부피 매개변수를 조정합니다.
- 주사기에 남아 있는 잔여 용량을 고려하여 주입 시점의 투여량을 입력하여 PET 데이터를 그램당 주입 투여량 퍼센트 단위(%ID/g)로 변환하거나 피험자의 체중을 추가로 입력하여 PET 데이터를 표준화 흡수 값(SUV) 단위로 변환합니다. PET 데이터 세트를 마우스 오른쪽 버튼으로 클릭하고 Basic Info(기본 정보 ) 탭에서 %ID/g 필드를 찾아 이 변환을 수행합니다. 이전에 기록된 %ID/g를 입력합니다.
- 종양 단면에 ROI를 그리려면 프로그램 창의 왼쪽에 있는 Measurements(측정 ) 탭을 클릭합니다. 폴리곤 또는 자유형 도구를 사용하여 ROI를 그립니다. 종양 둘레를 조심스럽게 그려서 PET 이미지가 활성 창에 있는 동안 작업이 수행되도록 합니다( Fn-A를 사용하여 확인). 결과는 ROI 값을 %ID/g로 제공합니다.
참고: ROI 분석은 %ID/g의 좋은 추정치를 제공합니다. 잘 보정된 카메라는 생체 외 생체 분포 데이터와 비교하여 ±5%의 정확도를 제공해야 합니다.
6. 면역조직화학을 위한 종양 조직 채취 및 고정
- 실험 종말점에서 4%-5%에서 이소플루란의 치사적 흡입 또는 CO2 과다 흡입을 사용하여 마우스를 안락사시킵니다.
- 수술용 가위와 핀셋을 사용하여 종양 표면 근처에 조심스럽게 작은 절개를 만들고 종양 조직을 절제합니다. 피부가 종양 조직에 붙어 있는 경우 메스 칼날을 사용하여 피부와 종양을 부드럽게 분리합니다.
- 약 3mL의 10% 중성 완충 포르말린이 들어 있는 5mL 바이알에 종양 조직을 넣습니다. 조직 고정을 용이하게 하기 위해 조직 전체가 용액으로 덮여 있는지 확인하십시오. 조직을 포르말린에 24시간 동안 담그십시오.
- 다음 날, 고정된 종양 조직을 70% 에탄올이 함유된 5mL 바이알에 옮깁니다. 파라핀 포매를 준비하기 위해 종양 조직에 특이적인 조직 카세트에 라벨을 붙입니다.
- 종양 조직을 조직 카세트에 넣고 파라핀이 매립될 때까지 70% 에탄올 용액에 보관합니다.
참고: 이 연구에서 파라핀 임베딩은 Austin Health의 해부병리학자가 수행했습니다.
7. 에스트로겐 수용체 알파 (ERα)의 탐지를 위한 면역조직화학
- 마이크로톰을 사용하여 표준 절차에 따라 염색에 필요한 종양 조직의 4μm 두께의 절편을 절단합니다.
- 절단된 종양 절편이 있는 유리 현미경 슬라이드를 슬라이드 랙에 놓고 랙을 37°C 오븐에 넣어 밤새 건조시키고 염색하기 전에 조직이 슬라이드에 부착되도록 합니다.
- 다음 날 아침, 절단된 종양 절편이 포함된 슬라이드가 있는 랙을 60°C 오븐에 30분 동안 넣어 탈랍 과정을 용이하게 합니다.
알림: 굽는 동안 유리 슬라이드가 위를 향해야 합니다. 이것은 조직 부착을 보장하고 녹는 왁스는 인접한 슬라이드가 아닌 자체 슬라이드로 녹습니다. - 섹션을 다시 수화하려면 구운 부분을 자일렌에 두 번, 각 5분(2x 5분) 100% 에탄올을 2x 5분 동안 담근 다음 70% 에탄올을 1x 5분 동안 담그십시오. 슬라이드를 증류수로 5분 동안 세척합니다.
- 항원 회수를 위해 100°C 수조에서 25-30분 동안 1x EDTA 버퍼, pH 8 용기에 슬라이드를 담그십시오. 수조에서 슬라이드를 제거하고 슬라이드를 최소 1시간 동안 RT에 놓으십시오. 슬라이드가 냉각되면 흐르는 수돗물로 2분 동안 세척한 다음 TBST(0.01% Tween20의 TBS)를 2x 5분 동안 세척합니다.
- 소수성 장벽 펜을 사용하여 슬라이드의 섹션 주위에 원을 그립니다.
- 약 100μL의 3% H2O2 용액(증류수에 희석됨)을 RT에서 10분 동안 섹션에 배치하여 내인성 과산화효소를 담금질합니다. 흐르는 수돗물로 슬라이드를 2분 동안 세척한 다음 TBST를 2x 5분 동안 세척합니다.
- RT에서 30분 동안 약 100μL/섹션의 차단 완충액(TBST의 5% 소 혈청 알부민(BSA))으로 절편을 차단합니다.
- 여분의 용액을 배양 트레이에 부드럽게 튕겨 차단 버퍼를 배출합니다. 약 100μL의 1차 항체(토끼에서 사육된 인간 항-ERα)를 1:300 희석(또는 사용된 항체에 특이적으로 미리 결정된 최적의 희석)으로 절편에 추가합니다. 1% BSA TBST로 항체 희석액을 구성하고 슬라이드를 배치하여 4°C에서 하룻밤 동안 항체와 함께 배양합니다.
알림: 배양 트레이 바닥에는 물을 채워 섹션이 밤새 건조되지 않도록 해야 합니다. - 다음 날 아침, TBST로 슬라이드를 3x 5분 동안 세척합니다. 약 100μL의 항토끼 2차 항체를 절편에 추가하고 RT에서 45분 동안 그대로 둡니다. TBST로 슬라이드를 3x 5분 동안 세척합니다.
- 흄 후드에서 약 100μL의 3,3'-디아미노벤지딘(DAB) 시약을 절편에 추가하고 절편당 약 3분 동안 용액을 그대로 유지합니다. 흐르는 수돗물로 슬라이드를 10분 동안 세척하여 DAB 반응을 억제합니다.
- 카운터 스테인은 헤마톡실린으로 1분 동안 미끄러지고, 흐르는 수돗물에 2분 동안 헹굽니다. 슬라이드를 Scott의 물에 1분 동안 담근 다음 흐르는 수돗물에 2분 더 헹굽니다.
- 단면을 탈수하려면 단면을 70% 에탄올에 2분 동안, 100% 에탄올에 2x 2분 동안 담근 다음 자일렌에 2x 2분 동안 담그십시오.
- 흄 후드에서 디부틸 프탈레이트 폴리스티렌 크실렌(DPX)으로 섹션을 조심스럽게 장착하고 섹션 위에 커버슬립을 놓아 기포가 관심 조직 위에 갇히지 않도록 합니다. 슬라이드를 흄 후드에서 밤새 말리십시오.
- 다음 날, 슬라이드 스캐너를 사용하여 이미지를 캡처하고 염색을 시각화합니다.
결과
18개의 F-FES PET를 사용하여 ERα 양성 종양을 명확하게 시각화할 수 있는 위치를 결정하기 위해 이 연구에는 난소 절제술을 받은 마우스의 3개 코호트가 사용되었습니다(그림 1). 두 그룹의 마우스에 MCF-7 세포(ERα 양성 유방암 세포주)를 IMF 또는 어깨에 주입했습니다. 음성 대조군으로, 다른 생쥐 코호트에 ERα를 발현하지 않는 일반적으로 사용되는 삼중 음성 유방암 세포주인 MDA-MB-231 세포를 주입했습니다(그림 1). 이 연구의 작업 흐름을 요약한 다이어그램은 에스트로겐 의존성 종양의 성장을 촉진하기 위해 피하 에스트라디올 주사의 사용을 강조합니다. 모든 모델에서 세포 주입 후 4-5주 내에 종양 부피가 약 100mm3에 도달했습니다(그림 1 및 그림 2). 난소 절제술을 받은 마우스의 어깨에서 자란 MCF-7 종양은 정소적으로 성장한 종양(20일)에 비해 확립하는 데 더 오래 걸렸습니다(30일). MDA-MB-231 종양을 IMF가 확립하는 데 평균 30일이 걸렸습니다.
모든 그룹의 종양이 평균 부피가 74.59mm3 (SEM ± 6.80 mm3, n = 20)에 도달했을 때 이미징을 위해 대표적인 마우스를 선택했습니다 (그림 1; 그림 2). 생쥐에서 invivo 18F-FES 분포가 어떻게 가장 잘 시각화되는지 평가하기 위해 생쥐에게 측면 꼬리 정맥을 통해 18F-FES를 주입한 후 잠자기 상태로 전환하거나 케이지에 다시 넣고 주입 후 1시간 동안 활성 상태를 유지하도록 했습니다(그림 3). 1시간 후, 18개의 F-FES 분포를 시각화하기 위해 15분의 스캔 시간으로 마우스의 PET 이미지를 획득했습니다. 분석 결과, 18F-FES 주입 후 1시간 동안 깨어 있는 마우스에서는 18F-FES 주입 후 1시간 동안 잠을 자고 있는 마우스와 달리 배경이 감소된 더 선명한 PET 이미지가 생성되는 것으로 관찰되었습니다(그림 3). 이 관찰에 따라, 이미징할 나머지 마우스는 18F-FES 주입 후 1-1.5시간 동안 깨어 있었습니다.
다음으로, 3개 코호트 모두의 마우스에 평균 10.5MBq의 18F-FES를 주입했습니다(그림 4). 대표적인 코로나 및 최대 강도 투영(MIP) 이미지는 이러한 코호트에서 18개의 F-FES의 흡수 및 분포를 보여줍니다. MCF-7 종양에 의한 18개의 F-FES 흡수는 어깨뿐만 아니라 유방 지방 패드에서도 볼 수 있었다(그림 4A-D). 중요한 것은 어깨에 MCF-7 종양이 있는 마우스에서 18개의 F-FES 흡수가 가장 뚜렷했다는 것입니다(1.7-3.9 %ID/g, n = 9). 어깨 종양이 다른 장기에서 멀리 떨어져 있기 때문에 다른 장기에 18개의 F-FES가 축적되어도 이 신호가 가려지지 않았습니다(그림 4A, B). 4번째 서혜부 유방 지방 패드에서 자란 MCF-7 종양에서 18개의 F-FES 흡수가 보였으나 18개의 F-FES의 장 배설 패턴과 겹쳐서 이러한 종양에서 검출할 수 있는 방사능(0.83-1.88 %ID/g, n = 4)을 부분적으로 가렸습니다(그림 4C,D). 18분ERα 음성, MDA-MB-231 종양 보유 마우스(0.18 - 0.22 %ID/g, n = 2)에서는 F-FES 흡수가 관찰되지 않았습니다(그림 4E,F).
종점에서 종양을 절제하고 면역조직화학을 수행하여 18개의 F-FES 표적인 ERα의 발현 수준을 평가했습니다. ERα의 발현은 유방 지방 패드 또는 어깨에서 자란 MCF-7 종양 조직에서 유사했습니다(그림 5). ERα 발현은 삼중 음성 MDA-MB-231 종양 조직에서 예상대로 무효였습니다(그림 5).

그림 1: 18F-FES PET/MRI 이미징 전에 여성 난소 절제술을 받은 BALB/c 누드 마우스에서 종양을 확립하기 위한 워크플로우. 이 연구에서는 3개의 생쥐 코호트가 사용되었습니다. 주입된 세포주, 세포주의 ERα 상태, 주입 부위 및 투여된 에스트라디올(E2) 주입 횟수의 다이어그램이 표시됩니다. 성장을 위해 에스트로겐에 의존하는 종양을 가지고 있는 마우스에서, 세포 주입 3일 전인 0일째에 E2 (파란색 화살표)의 피하 주사가 시작되었습니다. 4일째에는 IMF 또는 마우스의 어깨에 세포를 주입했습니다. 종양이 자리를 잡는 데 약 4-5주가 걸립니다. 이 기간 동안 E2 주사를 7일 간격으로 5회 투여했습니다(주당 5회 주사). 이미징 전 주에 해당 주에 총 7회 E2 주사를 맞았습니다. E2 주사는 PET 이미징 2일 전에 중단되었습니다. 약어: E2 = 에스트라디올; IMF = 유방내 지방 패드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
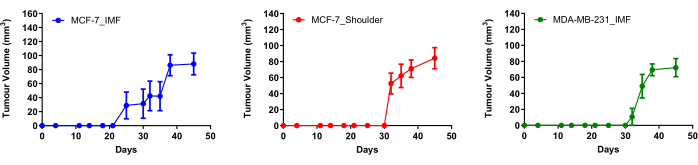
그림 2: 암컷 난소 절제술된 BALB/c 누드 마우스에 주입된 MCF-7 및 MDA-MB-231 세포의 종양 성장 곡선. MCF-7 세포(300만개)를 4번째 서혜부 유방 지방 패드(n=10) 또는 마우스의 어깨(n=5)에 주입하고, 100만 개의 MDA-MB-231 세포를 IMF(n=5)에 주입했습니다. MCF-7 세포를 보유한 마우스는 5주 동안 매주 5회 피하 E2 주사를 받았습니다. 영상화된 마우스의 평균 종양 부피는 101.03mm3 (SEM ± 11.77 mm3, n = 6)이었다. 데이터는 평균이고 오차 막대는 ± SEM을 나타냅니다. 약어 : E2 = estradiol; IMF = 유방내 지방 패드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3. In vivo 18F-FES 분포는 18F-FES 투여 후 1시간 동안 활성화된 마우스에서 더 잘 시각화됩니다. 이미징 당일, 약 100mm3의 종양을 가진 마우스에 측면 꼬리 정맥을 통해 18F-FES 프로브를 주입했습니다. 선택된 마우스는 잠을 자게 하거나 프로브 투여 후 1시간 동안 깨어 있었습니다. 생쥐의 PET 이미지는 15분의 스캔 시간으로 획득했습니다. 대표 이미지는 서로 다른 두 그룹에서 생체 내 18F-FES 분포를 보여줍니다. 약어: h p.i. = 주사 후 시간. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
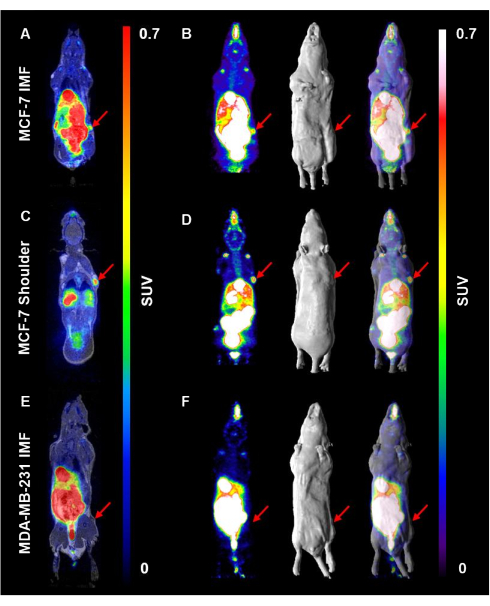
그림 4. 18분F-FES 흡수는 ERα 양성 종양에서 서혜부 유방 지방 패드에 비해 어깨에서 더 잘 시각화됩니다. ERα 양성 종양의 성장을 지원하기 위해 마우스에 E2를 피하 주사했습니다. E2 주입은 평균 10.5MBq 18F-FES 프로브/마우스를 주입하기 전에 48시간 동안 중단되었습니다. PET 이미지는 주입 후 1시간 후 15분의 스캔 시간으로 획득했습니다. (A) MCF-7 종양 IMF를 보유한 마우스의 대표적인 관상 단면과 (B) 18개의 F-FES 흡수를 시각화하기 위한 최대 강도 투영 이미지, 표면 렌더링 MRI 및 PET/MRI 오버레이가 표시됩니다. 어깨에 (C,D) MCF-7 종양이 있는 마우스와 MDA-MB-231 종양 보유 마우스에 (E,F)가 있는 마우스에 대해 동일한 일련의 이미지가 표시됩니다. 빨간색 화살표는 종양의 위치를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 난소 절제술된 BALB/c 누드 마우스에서 절제된 MCF-7 종양은 18F-FES 표적, ERα를 발현합니다. 18번의 F-FES 이미징 후 종점에서 MCF-7 또는 MDA-MB-231 종양을 보유한 마우스에서 종양을 절제했습니다. 종양 조직은 면역조직화학을 사용하여 ERα에 대해 염색했습니다. ERα 발현은 핵에서 시각화됩니다. 눈금 막대는 50μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에서는 ERα 발현을 특징으로 하는 유방 종양 검출에서 18F-FES PET/MRI의 유용성을 설명합니다. 예를 들어, ERα 양성 종양을 시각화할 수 있는 한 위치는 마우스의 어깨이며, 이러한 종양은 4번째 서혜부 유방 지방 패드 내에 위치한 종양과 비교하여 18개의 F-FES 흡수로 명확하게 식별할 수 있음을 보여줍니다(그림 4). 18분F-FES 흡수는 MDA-MB-231 종양에서 보이지 않았으며, 이는 면역조직화학을 사용하여 관찰된 ERα 발현의 결핍을 확인했습니다(그림 4 및 그림 5).
18F-FES의 배설 패턴이 간담도계와 장관을 통해 발생함에 따라 마우스25의 서혜부 유방 지방 패드에 위치한 18개의 F-FES 유방 종양의 흡수를 정확하게 감지하기가 어려워집니다. 이는 생쥐에서 이러한 땀샘의 해부학적 위치가 간과 소화관에 매우 가깝기 때문입니다. 18F-FES 흡수를 통해 4번째 유방 지방 패드에서 종양을 볼 수 있지만, 이는 종양이 마우스의 장관에서 자라나 바깥쪽으로 돌출되는 것에 의존합니다. 실용적인 관점에서 볼 때, 생쥐에 세포를 주입한 후 종양이 자라는 방향은 예측할 수 없습니다. 이와는 대조적으로, 유방 종양이 생쥐의 어깨에 자리 잡는 데 시간이 더 오래 걸린다는 것을 발견했지만(그림 2), 종양의 위치는 18F-FES가 배설되는 해부학적 영역에서 편리하게 멀리 떨어져 있습니다. 따라서 어깨에 위치한 ERα 양성 종양에서 18개의 F-FES 흡수를 검출하는 성공률이 증가합니다(그림 4). 이 연구에서는 어깨에 ERα 양성 종양을 확립하는 것이 이소성 유방암 모델에서 18개의 F-FES 흡수를 명확하게 시각화할 수 있는 위치 중 하나임을 보여줍니다. 또한, 4번째 서혜부 유방 지방 패드에 종양을 확립하는 것은 18F-FES의 배설 패턴으로 인해 이상적이지 않다는 것을 보여줍니다. 유방암에 대한 많은 생체 내 연구는 유방 조직을 지지하는 부근의 유방 지방 패드 내에서 유방 종양의 성장을 보장하는 정형소 유방암 모델을 사용하는 것을 선호할 수 있다26. 이러한 경우, 유방암과 관련하여 ERα 발현을 시각화하는 데 관심이 있는 연구 그룹은 2차 및 3차 흉부 유방 지방 패드(27)를 사용하려고 시도할 수 있습니다. 해부학적 관점에서 볼 때, 흉부 유방 지방 패드는 간담도계와 장관에서 더 멀리 떨어져 있습니다. 그러므로, 이 부위의 종양에 의한 18F-FES 흡수는 마우스27의 서혜부 유방 지방 패드에서 성장한 종양에 비해 더 명확할 것으로 예상된다. 본 연구에서는 흉부 유방 지방 패드에 종양을 확립하는 이점을 입증하지 못했지만, 다른 그룹에서는 18개의 F-FES PET 이미징과 결합할 수 있는 정립성 유방암 모델로서 이 위치의 유용성을 입증했습니다20,27. 부인할 수 없는 사실은, 정소성 마우스 모델에서 암을 연구하는 것이 인간에서 암이 어떻게 발생하고 존재하는지를 가장 잘 나타낸다는 것이다28.
여기에 설명된 방법론의 중요한 단계는 난소 절제술을 받은 마우스와 정기적인 에스트라디올 보충제를 사용하여 발달을 위해 호르몬에 의존하는 유방 종양의 성장을 촉진하는 것입니다. 이 연구에서는 높은 수준의 ERα29를 발현하는 루미널 유방암 세포주인 MCF-7을 선택했습니다. ERα 종양의 검출은 수용체 점유에 의존하기 때문에 이 연구에서 난소 절제술을 받은 마우스를 사용하는 것은 매우 중요했다30. 이는 에스트로겐이 주로 난소에서 생성되기 때문이며, 존재하는 경우 내인성 에스트로겐이 주입된 프로브와 경쟁하여 18F-FES의 ERα16에 대한 결합 기회를 제한할 수 있기 때문입니다. 에스트로겐 보충에 사용할 수 있는 다양한 방법이 있으며, 여기에는 실라스틱 캡슐, 서방성 펠릿, 삼투압 펌프 및 오일 차량을 사용한 피하 주사의 사용이 포함됩니다31. 우리의 실험적 요구를 위해 옥수수 기름을 사용한 일일 피하 주사가 사용되었는데, 이는 이미징 시 에스트라디올을 쉽게 회수하여 표적 수용체(ERα) 포화 문제를 완화할 수 있었기 때문입니다. 흥미롭게도, 여러 연구 그룹은 에스트라디올의 피하 주사 후 피부 아래에 형성되는 오일-에스트라디올 용액의 '거품' 또는 '주머니'를 보고하고 있으며, 이러한 '거품' 또는 '주머니'가 사라지는 데 종종 몇 주가 걸린다는 것을 관찰했습니다 - 우리는 참기름을 매개체로 사용할 때 우리의 연구에서도 이것을 관찰했지만 옥수수 기름에서는 덜 분명합니다 22,32. 따라서 에스트라디올 주사 부위의 피부 아래 염증 징후를 최소화하기 위해 참기름보다는 옥수수 기름을 호르몬 투여 매개체로 사용하는 것이 좋습니다. 또한 이 방법론에서는 에스트라디올을 피하로 투여한 직후 주사 부위에 국소 소독제를 사용하는 방법에 대해서도 자세히 설명합니다. 여기에서 연구에서 수행된 실험에서 이것은 주사 후 쥐의 피부 표면에 대한 자극을 완화하여 전반적인 웰빙을 향상시키는 것으로 나타났습니다. 에스트로겐 의존성 종양의 성장을 촉진하기 위해 서방형 에스트로겐 펠릿 이식을 사용하는 것은 일부 그룹에서 보고되었습니다20,33. 수용체 결합에 대한 순환 에스트라디올과 18F-FES 간의 경쟁을 제한하기 위해 이미징 3일 전에 펠릿을 제거합니다. 그러나, 에스트로겐에 대한 장기간의 생체 내 노출은 ERα를 차지할 수 있으며, 이는 18F-FES 프로브(34)의 결합 기회를 감소시킬 수 있다는 점을 고려해야 한다. peroral route는 estradiol35의 간헐적 전달에 사용될 수 있는 또 다른 방법입니다. 이 방법은 너트 버터 혼합물을 통해 에스트라디올을 성공적으로 전달할 수 있으며, 이 기술은 비침습적이지만, 이 방법의 실용성은 힘든 과정이 될 수 있고 특히 큰 생쥐 코호트를 사용하는 경우 어려울 수 있기 때문에 의심스럽습니다35.
면역조직화학(Immunohistochemistry)은 PET 이미징을 위해 선택된 마우스의 대표적인 종양에서 표적 발현을 확인하기 위한 도구로 사용되었습니다. ERα의 발현은 어깨 또는 서혜부 유방 지방 패드에서 자란 MCF-7 종양에서 유사했습니다(그림 5). 이 관찰은 어깨 종양(1.7-3.9 %ID/g, n = 9)에 비해 IMF 종양(0.83-1.88 %ID/g, n = 4)에 의한 18F-FES의 낮은 흡수가 두 부위에서 ERα의 차등 발현 때문이 아님을 시사합니다. 이는 18개의 F-FES의 장 배설이 ROI 분석을 사용하여 IMF 종양에 의한 프로브 흡수를 정확하게 정량화하는 데 방해가 된다는 생각을 되풀이합니다.
여러 요인이 ERα 양성 종양에 의한 18F-FES의 흡수에 영향을 미칠 수 있으며, 그 중 하나는 방사성 추적자36,37의 특정 활성(감기 및 방사성 의약품 질량당 방사성 측정)입니다. 18F-FES 제제의 특정 활성이 낮으면 더 많은 양의 '라벨링되지 않은' 또는 차가운 FES가 수용체 점유에 영향을 미칠 수 있으며, '라벨링된' FES에 사용할 수 있는 ERα 결합 부위의 양이 제한될 수 있습니다. 이 연구에서 사용된 18개의 F-FES는 전임상 적용 전에 합성되고 임상 등급으로 재공식화되었습니다23. 또한, 이 연구에서 종양의 크기가 상대적으로 작았다는 점을 인정하는 것이 중요합니다. 자란 종양 중 일부는 서로 다른 혈관 발달 단계에 있었을 가능성이 있습니다. 이는 종양 성장 곡선의 표준 오차(SEM)에 의해 강조되며(그림 2), 각 코호트의 모든 종양이 100mm3에 도달하지 않았음을 보여줍니다. 이 문제를 피하기 위해 향후 실험에서 더 많은 수의 세포를 주입하여 종양 확립 성공률을 높일 계획입니다.
18분F-FES PET 영상은 의심할 여지 없이 환자, 특히 ERα 양성인 유방 종양이 있는 환자에게 적절한 치료 옵션을 알려주는 데 도움이 될 수 있는 강력한 도구입니다38. 유방 전이의 생검이 불가능한 경우, 18F-FES PET를 사용하여 이러한 병변에서 ERα 발현을 비침습적으로 검출할 수 있습니다. 18분F-FES PET는 ERα 발현의 손실/이득을 감지하는 데에도 사용할 수 있습니다. 예를 들어, ERα 분해제인 fulvestrant에 대한 반응으로 ERα 발현이 소실된 것은 이전에 18F-FES 흡수의 감소 정도와 일치하는 것으로 나타났습니다39. 또한, 우리는 현재 이전에 수용체40이 없었던 유방암 모델에서 ERα 발현의 가능한 이득을 이미징하는 과정에 있습니다. 우리의 연구 결과로부터, 우리는 18개의 F-FES 흡수에 의해 ERα 발현 종양이 검출될 수 있는 한 위치가 난소 절제술된 마우스의 어깨 내에 확립된 위치임을 입증했습니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
이 연구는 미국 국립유방암재단(National Breast Cancer Foundation, IIRS-22-071)의 지원을 받았다. 우리는 빅토리아 주 정부의 운영 인프라 지원 프로그램을 인정합니다. 이 연구는 또한 국립 이미징 시설(National Imaging Facility)과 빅토리아 주 정부의 지원을 받는 ANSTO-Austin-LICR 파트너십인 Solid Target Laboratory를 사용하여 수행되었습니다. 저자는 La Trobe-ONJCRI 노드인 Olivia Newton-John Cancer Research Institute(ONJCRI)에서 NCRIS(National Collaborative Research Infrastructure Strategy) 기능인 National Imaging Facility의 과학적, 기술적 지원을 인정합니다. 그림 1과 3은 BioRender로 만든 것입니다.
자료
| Name | Company | Catalog Number | Comments |
| 2.5% Trypsin (10x) | Gibco | 15090-046 | |
| 27 G x 13 mm 0.5 mL insulin syringe | Terumo | SS*05M2713KA | For cell injections |
| 29 G x 13 mm 0.5 mL insulin syringe | Terumo | SS*05M2913KA | For estradiol injections |
| 30% H2O2 | Chem-Supply | HA154 | Diluted to a 3% working solution with distilled water |
| Corn oil | Sigma | C8267 | |
| DAB Substrate Kit | Abcam | ab64238 | |
| Dako anti-rabbit-HRP, 110 mL | Aligent-Dako | K4003 | Secondary antibody used for IHC |
| DMEM/F-12 Medium | Gibco | 11320033 | |
| Dose calibrator | Capintec | 5130-3216 | |
| Estradiol | Sigma | E2758 | |
| Estrogen Receptor α (D8H8) Rabbit mAb | Cell Signalling Technology | #8644 | Primary antibody used for IHC |
| FBS | Bovogen | SFBS | |
| Heat element (Infra Red Lamp) | Amcal | 12400 | For tail vein dilation |
| Matrigel | Corning | 356225 | |
| MultiCell 4 Channel Monitoring kit for triple- or quadruple-mouse imaging chamber | Mediso | PR-MC900200 | For monitoring of mouse respiration |
| NanoScan PET/MRI 3T System | Mediso | PR-RD000000 | For PET/MRI acquistion |
| PBS (1x) | Gibco | 14190-144 | |
| TBST | ThermoFisher | #28360 | Wash buffer for IHC |
| Three mice imaging chamber | Mediso | PR-MC407300 | For PET/MRI acquistion |
참고문헌
- Perou, C. M., et al. Molecular portraits of human breast tumours. Nature. 406 (6797), 747-752 (2000).
- Ignatov, A., Eggemann, H., Burger, E., Ignatov, T. Patterns of breast cancer relapse in accordance to biological subtype. J Cancer Res Clin Oncol. 144 (7), 1347-1355 (2018).
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Gnant, M., Turner, N. C., Hernando, C. Managing a long and winding road: Estrogen receptor-positive breast cancer. Am Soc Clin Oncol Educ Book. 43, e390922 (2023).
- Thomsen, C., Nielsen, S., Nielsen, B. S., Pedersen, S. H., Vyberg, M. Estrogen receptor-α quantification in breast cancer: Concordance between immunohistochemical assays and mRNA-in situ hybridization for ESR1 gene. Appl Immunohistochem Mol Morphol. 28 (5), 347-353 (2020).
- Shafi, S., et al. Integrating and validating automated digital imaging analysis of estrogen receptor immunohistochemistry in a fully digital workflow for clinical use. J Pathol Inform. 13, 100122 (2022).
- Harvey, J. M., Clark, G. M., Osborne, C. K., Allred, D. C. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. J Clin Oncol. 17 (5), 1474-1474 (1999).
- Caruana, D., Wei, W., Martinez-Morilla, S., Rimm, D. L., Reisenbichler, E. S. Association between low estrogen receptor positive breast cancer and staining performance. NPJ Breast Cancer. 6 (1), 5 (2020).
- Goldstein, N. S., Ferkowicz, M., Odish, E., Mani, A., Hastah, F. Minimum formalin fixation time for consistent estrogen receptor immunohistochemical staining of invasive breast carcinoma. Am J Clin Pathol. 120 (1), 86-92 (2003).
- Hammond, M. E. H., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med. 134 (6), 907-922 (2010).
- Allison, K. H., et al. Estrogen and progesterone receptor testing in breast cancer: ASCO/CAP guideline update. J Clin Oncol. 38 (12), 1346-1366 (2020).
- Amir, E., et al. Tissue confirmation of disease recurrence in breast cancer patients: Pooled analysis of multi-centre, multi-disciplinary prospective studies. Cancer Treat Rev. 38 (6), 708-714 (2012).
- Cardoso, F., Senkus-Konefka, E., Fallowfield, L., Costa, A., Castiglione, M. Locally recurrent or metastatic breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 21 (Suppl 5), v15-v19 (2010).
- Cardoso, F., et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Ann Oncol. 31 (12), 1623-1649 (2020).
- James, W. F., et al. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 49 (3), 480-508 (2008).
- Pedersen, M. A., et al. Dynamic whole-body [18F]FES PET/CT increases lesion visibility in patients with metastatic breast cancer. EJNMMI Res. 14 (1), 24 (2024).
- Grabher, B. J. 18F-FES whole-body imaging protocol for evaluating tumor estrogen receptor status in patients with recurrent or metastatic breast cancer. J Nucl Med Technol. 51 (3), 188-193 (2023).
- Van Kruchten, M., et al. PET imaging of estrogen receptors as a diagnostic tool for breast cancer patients presenting with a clinical dilemma. J Nucl Med. 53 (2), 182-190 (2012).
- Ulaner, G. A., et al. Summary: Appropriate use criteria for estrogen receptor-targeted pet imaging with 16α-18F-fluoro-17β-fluoroestradiol. J Nucl Med. 64 (3), 351-354 (2023).
- He, S., Wang, M., Zhang, Y., Luo, J., Zhang, Y. Monitoring the early response of fulvestrant plus tanshinone IIA combination therapy to estrogen receptor-positive breast cancer by longitudinal 18F-FES PET/CT. Contrast Media Mol Imaging. 2019 (1), 2374565 (2019).
- Joseph, J. D., et al. The selective estrogen receptor downregulator GDC-0810 is efficacious in diverse models of ER+ breast cancer. eLife. 5, e15828 (2016).
- Alsina-Sanchis, E., et al. Intraperitoneal oil application causes local inflammation with depletion of resident peritoneal macrophages. Mol Cancer Res. 19 (2), 288-300 (2021).
- Sluka, P., et al. Characterization of an estrogen receptor α-selective 18F-estradiol PET tracer. World J Nucl Med. 23 (03), 153-160 (2024).
- Katzenellenbogen, J. A. The quest for improving the management of breast cancer by functional imaging: The discovery and development of 16α-[18f]fluoroestradiol (fes), a pet radiotracer for the estrogen receptor, a historical review. Nucl Med Biol. 92, 24-37 (2021).
- Boers, J., et al. Image quality and interpretation of [18F]-FES-PET: Is there any effect of food intake. Diagnostics (Basel). 10 (10), 756 (2020).
- Caceres, S., et al. Tumor growth progression in ectopic and orthotopic xenografts from inflammatory breast cancer cell lines. Vet Sci. 8 (9), 194 (2021).
- Kumar, M., Salem, K., Jeffery, J. J., Fowler, A. M. PET Imaging of Estrogen Receptors Using 18F-Based Radioligands. Estrogen Receptors. , (2022).
- Zhang, W., et al. Comparative study of subcutaneous and orthotopic mouse models of prostate cancer: Vascular perfusion, vasculature density, hypoxic burden and BB2r-targeting efficacy. Sci Rep. 9 (1), 11117 (2019).
- Lee, A. V., Oesterreich, S., Davidson, N. E. MCF-7 cells-changing the course of breast cancer research and care for 45 years. J Natl Cancer Inst. 107 (7), djv073 (2015).
- Pedram, H., et al. 18F-fluoroestradiol PET guides dosing of selective estrogen receptor degraders. J Nucl Med. 55 (supplement 1), 11 (2014).
- Ingberg, E., Theodorsson, A., Theodorsson, E., Strom, J. O. Methods for long-term 17β-estradiol administration to mice. Gen Comp Endocrinol. 175 (1), 188-193 (2012).
- Luengo-Mateos, M., et al. Protocol for ovariectomy and estradiol replacement in mice. STAR Protoc. 5 (1), 102910 (2024).
- Yang, Z., et al. High specific activity is not optimal: 18F-fluoroestradio positron emission tomography-computed tomography results in a breast cancer xenograft. J Labelled Comp Radiopharm. 59 (13), 576-581 (2016).
- Aliaga, A., et al. Breast cancer models to study the expression of estrogen receptors with small animal PET imaging. Nucl Med Biol. 31 (6), 761-770 (2004).
- Ström, J. O., Theodorsson, A., Ingberg, E., Isaksson, I. -. M., Theodorsson, E. Ovariectomy and 17β-estradiol replacement in rats and mice: A visual demonstration. J Vis Exp. 64, e4013 (2012).
- Pisaneschi, F., et al. Automated, resin-based method to enhance the specific activity of fluorine-18 clicked PET radiotracers. Bioconjug Chem. 28 (2), 583-589 (2017).
- Johannes, N., et al. Variation of specific activities of 68Ga-aquibeprin and 68Ga-avebetrin enables selective PET imaging of different expression levels of integrins α5β1 and αvβ3. J Nucl Med. 57 (10), 1618-1624 (2016).
- Liu, C., Ma, G., Xu, X., Song, S., Yang, Z. Can 18F-FES PET improve the evaluation of 18F-FDG PET in patients with metastatic invasive lobular carcinoma. Clin Nucl Med. 49 (4), 301-307 (2024).
- Heidari, P., et al. Pharmacodynamic imaging guides dosing of a selective estrogen receptor degrader. Clin Cancer Res. 21 (6), 1340-1347 (2015).
- Roswall, P., et al. Microenvironmental control of breast cancer subtype elicited through paracrine platelet-derived growth factor-CC signaling. Nat Med. 24 (4), 463-473 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유