Method Article
16α-[18F]-フルオロ-17β-エストラジオールPETを使用して、雌卵巣摘出マウスのヒト乳がん異種移植片におけるエストロゲン受容体α発現を可視化
要約
ここでは、16α-[18F]-フルオロ-17β-エストラジオール(18F-FES)陽電子放出断層撮影法(PET)を、ERα陽性乳房異種移植片におけるERα発現を視覚化するためのツールとして使用するプロトコルを示します。
要約
16α-[18F]-フルオロ-17β-エストラジオール(18F-FES)陽電子放出断層撮影法(PET)を使用してBALB/cヌードマウスでエストロゲン受容体α(ERα)陽性乳がん異種移植片を視覚化する方法を実証するために、卵巣摘出されたBALB/cヌードマウスにERα陽性乳がん細胞(MCF-7、3×106細胞;肩[n=10]または4番目の鼠径乳腺脂肪パッド[n=10])またはERα陰性乳がん細胞(MDA-MB-231、 1 × 106セル;乳腺脂肪パッド[n = 5])。MCF-7細胞を保有したマウスは、細胞注入の2日前に首筋に17β-エストラジオール20μg(20μg/20μL、コーン油:エタノール、9:1)を皮下注射し、その後、毎日週5回、5週間にわたって注射しました。腫瘍体積は、式:(L * W2)/2(L;長さ、W;幅)に従って測定されました。腫瘍の体積が約100 mm3に達すると、マウスがPETイメージングのために18F-FESを投与される2日前に17β-エストラジオール注射を中止し、ERαとの競合的結合を回避しました。側尾静脈を介した18F-FES投与後、PET/MRIを注射後1時間から1.5時間で15分間実施しました。18名F-FESの取り込みは、ERα陰性のMDA-MB-231担がんマウスでは観察されませんでした。18名F-FESの取り込みは、肩にMCF-7腫瘍を有するマウスで最も顕著でした。鼠径乳腺脂肪パッドで増殖したMCF-7腫瘍では、18F-FESの腸内排泄パターンがこれらの腫瘍で検出可能な放射能を覆い隠していたため、18F-FESの取り込みはあまり目立たなかった。18F-FES PETをERα陽性乳房異種移植片におけるERα発現を可視化するツールとして使用するために、マウスの腹部から離れた場所、例えば肩部に位置する腫瘍において、18F-FESの取り込みの可視性が明確であることを示しています。
概要
乳がん(BC)は、さまざまな分子サブタイプに層別化できます1。管腔サブタイプに分類される乳房腫瘍は、エストロゲン受容体α(ERα)を過剰発現します。そのため、このBCのサブタイプはERα陽性(ERα+)とも呼ばれます。幸いなことに、ERα+ BCと診断された患者は、遠隔転移の発生率が低く、10年生存率が最も高くなります2,3。ERαの発現により、このような患者は、選択的エストロゲン受容体モジュレーター(SERM)、抗エストロゲン薬、アロマターゼ阻害剤4などのホルモン療法の選択肢を利用することができます。
乳がん患者がホルモン療法に適格であるかどうかを評価するには、乳房腫瘍内のERαの発現レベルを決定する必要があります5,6,7。検査のゴールドスタンダードは免疫組織化学(IHC)法を用いて行われるが、多くの報告では、得られた結果の再現性と信頼性の両方の問題が強調されている6,8,9。IHCは、この手法が本質的に半定量的であるため、結果の不一致を生じさせる可能性があり、組織処理とその後の解釈の違いがばらつきにつながる可能性があります6。この繰り返し発生する問題を修正するために、ガイドラインは 2010 年に設定され、2020 年に米国臨床腫瘍学会によって更新され、観察者間の変動を減らすことを目的としています 10。現在、臨床的に検証されたカットオフは≥1%であり、非常に小さな発現レベルでもERαの発現は、内分泌療法を用いて臨床的に意義のある利益を示しています11。
進行BCでは、ERαの発現は転移と原発腫瘍とで異なる場合がある。いくつかの観察では、転移性病変と原発腫瘍との間のERα発現レベルの18%〜55%の不一致が報告されており、BC転移のERα状態を決定することの重要性を示しています12。これに対処するために、ガイドラインは、情報に基づいた治療計画を立てるために、転移性病変におけるホルモン受容体の状態を確認することの重要性を強調しています13,14。しかし、特にIHC法では、生検が困難な場所に転移が存在する可能性があることを考えると、その実現可能性には疑問があります。
分子イメージング法は、がん患者の腫瘍病変の検出と可視化に不可欠なツールとして登場しています。特に、陽電子放出断層撮影法(PET)イメージングでは、トレーサー、より具体的には放射性医薬品の使用が必要であり、これらの病変を非侵襲的に視覚化する目的で腫瘍の特定の特徴を利用するように設計されています。腫瘍学で使用される最も一般的なPETトレーサーは、18F-フルオロデオキシグルコース(18F-FDG)15です。この研究では、放射性標識されたエストラジオール、18F-フルオロエストラジオール(18F-FES)の使用を検討します。エストラジオール(ERαのリガンド)は、主に女性の卵巣で産生されるホルモンです16。18名F-FESは最近、食品医薬品局(FDA)から承認を受け、CeriannaTMとして販売されています。この造影剤は、再発性または転移性のBC17患者の生検の補助として使用するように設計されています。18F-FESによる全身PETイメージングは、原発腫瘍と生検が困難な領域の遠隔転移の両方でERαレベルを検出するための非侵襲的方法として使用できます18。18F-FES PETイメージングを用いたERαレベルの予測はIHC結果と相関しており、さらに、18F-FES PETイメージングを用いたERαの検出はほとんどまたはまったくないというのは、ホルモン療法に反応しにくい腫瘍の信頼性の高い予測因子である18。18 F-FESを臨床で適切に使用するために、ガイドラインは、この分野の専門家によるコンセンサスを通じて策定されています19。本研究では、マウスの乳がん前臨床モデルにおける18F-FES PETの使用を評価します。
プロトコル
すべての動物実験は、オースティン病院動物倫理委員会(A2023/05812)によって承認され、科学目的での動物の世話と使用に関するオーストラリア法に準拠して実施されました。
1. 細胞調製
- 通常の細胞培養手順を使用して、ペニシリン/ストレプトマイシンおよび10%ウシ胎児血清(FBS)を添加したDMEM/F-12中のMDA-MB-231およびMCF-7細胞をT175組織培養フラスコに保持します。注射用の細胞を調製する前に、液体窒素貯蔵庫からの復活後、少なくとも3回細胞を継代します。加湿インキュベーターで37°C、5%CO2で細胞を増殖させます。
- 注射用の細胞を調製する日に、15匹のマウスに対して1マウスあたり注入あたり3個×106 個のMCF-7細胞(すなわち、少なくとも45個×10個の6 個のMCF-7細胞)および5匹のマウスに対して1回の注入につき10個×10個の6 個のMDA-MB-231細胞(すなわち、少なくとも5個×10個の6 個のMDA-MB-231細胞)が存在するように細胞を増殖させる。
注:各マウスに同数の細胞を許容するには、5回の追加注射に十分な細胞を準備します(たとえば、5匹のマウスを注射するために10回の注射に十分な細胞を準備します)。 - 細胞注入の日に、すべてのフラスコから培地を取り出し、約5 mLのトリプシン-EDTA(0.25%トリプシンおよび0.05%EDTA)を1xリン酸緩衝生理食塩水(PBS)(pH 7.4)に細胞上に置いて、細胞の剥離を促進します。
- 細胞が分離したら、約10 mLの完全培地をフラスコに入れて、トリプシン活性を阻害します。細胞を再懸濁し、単一細胞懸濁液を50 mLチューブに移します。~300 × g で 2 分間遠心分離し、細胞をペレット化します。
- 細胞ペレットを適切な量の培地に再懸濁し、細胞をカウントして、回収された細胞の総数を決定します。
注:mLあたり約1×10個の6 細胞の溶液をカウントすることを目指します(計数チャンバーを使用する場合は16マスあたり50〜100個の細胞)。フルフラスコあたり5 × 106 で増殖する細胞の場合は、5 mLの培地で細胞を回収します。密度の高い細胞株の場合は、フラスコあたり10 mLの培地を使用します。 - この手順は、滅菌された層流キャビネット内の氷上で実行します。この数に達したら、細胞懸濁液を再び300 × g で2分間遠心分離し、細胞をペレット化します。ペレットを冷PBSおよび氷冷基底膜マトリックス溶液に再懸濁し、3×10個の6 MCF-7細胞あたり40 μLのPBSと10 μLの基底膜マトリックス溶液が存在するようにします。
- MDA-MB-231細胞ペレットを同じ成分で再懸濁し、1個×10個の6 個の細胞あたり、40μLのPBSと10μLの基底膜マトリックス溶液が存在するようにします。細胞-PBS基底膜マトリックスミックスを50 mLチューブからコールドピペットチップで小さな1.5 mLチューブに移し、マウスに細胞を注入する直前に細胞混合物を氷上に保ちます。
注:この研究で使用した基底膜マトリックスは、-20°Cで保存します。 基底膜マトリックス溶液が必要になる前日、溶液のアリコートを4°Cで一晩解凍します。翌日、低温(氷上)で使用できるようになります。溶液をピペッティングするときは、基底膜マトリックス溶液が固まらないように、使用するピペットチップが冷えていることを確認してください。滅菌ピペットチップの箱を、注射用の細胞調製の日の前に冷蔵庫に保管しておくことをお勧めします。細胞ペレットを氷冷PBSと基底膜マトリックス溶液に再懸濁する場合、最初にPBSを添加し、次に必要量の基底膜マトリックス溶液を添加します。
2. 卵巣摘出マウスへの細胞注入
- 6〜8週齢の女性卵巣摘出BALB / cヌードマウスが、細胞注射の少なくとも1週間前に動物飼育施設で順応できるようにします。
注:この研究では、12〜14週齢の古いマウスにアクセスできました。卵巣摘出術は、低レベルの内因性エストラジオールを確保し、18F-FESリガンドとの競争を減らします。研究されているモデルによっては、若いマウス(例えば、4〜8週間)は、内因性エストラジオール20,21のレベルが低いため、卵巣摘出術を受ける必要がない場合があります。 - 麻酔導入チャンバーを使用して、4%イソフルランと酸素を4 L / minの速度でマウスに麻酔を誘発します。マウスを観察し、直立反射の喪失を確認します。マウスが動かなくなったら、マウスを滅菌層流キャビネットに移し、鼻を鼻マスクに入れ、イソフルランを2%に、酸素を2 L / minの速度に調整して麻酔を維持します。
注:最適なケアを確保するために、一度に1匹のマウスに麻酔をかけます。 - 乳房内脂肪パッド(IMF)注射の場合は、アルコールで4番目の 鼠径乳腺の皮膚を綿棒で拭きます。予冷した(氷上)27Gシリンジを使用してコールドセル懸濁液を吸い上げ、シリンジを氷上に置いて、注入前に基底膜マトリックス溶液が温まったり固まったりするのを防ぎます。
- 利き手でない方の親指と人差し指を使って、第4乳腺をそっと持ち上げ、利き手で27Gの注射針を挿入し、針の斜角が上を向くようにします。細胞-PBS基底膜マトリックス溶液混合物を含む細胞懸濁液50μLを乳腺脂肪パッドにゆっくりと注入します。
注:細胞が注入されるとき、指の間に泡が感じられるはずです。注入部位に漏れがないか確認してください。 - 注射が完了したら、イソフルランをオフにし、マウスの鼻を鼻円錐形に保ち、酸素を吸い込んで意識を取り戻します(これには約1分かかります)。マウスをヒートパッドのケージに戻して、最適な回復を実現します。
- 肩の注射については、IMF注射で概説した上記の手順を使用しますが、唯一の違いは細胞注射の位置です。
注:あるいは、麻酔なしで肩の注射を完了することもできます(以下のステップ2.7を参照)。 - 麻酔なしで肩を注射する場合は、親指と人差し指の間の利き手ではない手を使用して、マウスの肩の上に皮膚を保持して持ち上げ、皮膚に「テント」を形成します。27 Gシリンジ針を使用して、細胞-PBS基底膜マトリックス溶液を含む細胞懸濁液50 μLをゆっくりと注入します。針をそっと引き抜き、漏れがないか確認します。
注:別の方法として、ハミルトンシリンジを少量注入に使用して、容量送達の精度を確保することができます。注入の合間には、異なる細胞株を使用する場合は80% v/vエタノールを使用してシリンジをすすぎ、PBSはシリンジからの残留エタノールをすすぎて除去するために使用されます。
3.エストラジオール溶液の調製
- ミリグラムの物質を正確に測定できるスケールを使用して、7 mgのエストラジオール粉末を1.5 mLのチューブに秤量します。
- 700 μLの100%エタノールを7 mgのエストラジオール粉末に加えます。1.5mLチューブを穏やかなシェーカーに室温(RT)で約1時間、またはエストラジオール粉末が完全に溶解するまで置きます。.
- 1.5 mLチューブ10本に溶液を分注し、それぞれに70 μLのエタノール-エストラジオール溶液を入れます。将来の使用のためにチューブを-20°Cに置きます。
注:エストラジオール - エタノールストックは、約2週間-20°Cで保持することができます。
4. エストラジオール溶液の皮下注射
- エストラジオール注射が必要な日には、次の混合物を新鮮に作ります。630μLのコーン油をビヒクルとして、70μLのエタノールエストラジオール溶液を含む1.5mLチューブに混ぜ合わせます。均一になるまで溶液を渦巻き、エタノールが分離して車両オイルの上部に層を形成しないようにします。
注:これにより、20μg/20μLのコーン油:エタノール、9:1溶液のうち700μLが得られます。各マウスは、この溶液を20μL受け取ります。混合物中のオイルは、その粘度のためにシリンジの外側と1.5mLチューブの側面に付着する傾向があるため、常に追加の溶液を調製してください(たとえば、20匹のマウスの場合、400μLで十分ですが、ほぼ2倍の量(700μL)にすると、エラーに対して十分なスペースが得られます)。 - インスリン注射器に取り付けられた29Gの針を使用して、20μLのエストラジオール溶液をゆっくりと引き上げます。
注:溶液には9部の油と1部のエストラジオール-エタノールが含まれているため、混合物がシリンジに引き込まれるのに時間がかかります。 - エストラジオール溶液を注射するマウスは、ERαを発現する腫瘍を抱えているため、エストロゲンに依存して増殖するマウスです(この研究ではMCF-7)。ERαを発現しない腫瘍を有するマウス(この研究ではMDA-MB-231)は、エストラジオール溶液を投与されません。注射するマウスを前方、できればタオルの上にそっと置き、拘束中に手足を傷つけないようにします。
- 利き手ではない方の手を使って、薬指と小指の間にマウスの尻尾の上部を持ってマウスを拘束します。親指と人差し指を使用して、マウスの首の近くの緩い皮膚を持ち上げ、エストラジオール溶液の皮下注射のための皮膚に「テント」を形成します。
- マウスをこの拘束状態に保ちながら、利き手を使用してマウスにエストラジオール溶液を注入します。針の斜角を上に向けて、針の半分未満が見えるまで、針を皮膚の「テント」の下に押し込みます。
注:溶液が注入されると、皮膚が目に見えて膨らむはずです。 - 溶液の逆流を防ぐために、針を数秒間皮下に置いてください。逆流が発生した場合は、ティッシュでその部分を軽くたたいて乾かし、残留溶液を取り除きます。
注:いくつかの実験では、エストラジオールとゴマ油を組み合わせてホルモンを投与するために使用されました。ゴマ油を媒体として使用すると、エストラジオール注射部位の皮膚下に局所的な炎症が起こります。そのため、その後の実験の手段としてコーン油が選ばれ、エストラジオール注射部位での炎症の徴候が存在しないか、または最小限であった22。詳細については、ディスカッションを参照してください。 - 針を抜いた後、綿棒を使用して局所消毒剤で注射部位を優しく綿棒で拭きます。これは、マウスの皮膚から針が挿入/抜去されることによる注射部位の表面の炎症を防ぐためです。
- ERα(MCF-7)を発現する腫瘍を有するマウスに、細胞注射の3日前にエストラジオール注射をし、その後、週5回、5週間注射します(図1)。イメージング日の2日前にエストラジオール注射を停止して、 18F-FESプローブとの競合的結合を標的であるERαに回避します。
注:この研究では、MCF-7腫瘍を保有するマウスに、月曜日から金曜日まで毎日エストラジオールを注射しました。彼らが翌週の水曜日に撮影されることになった場合、エストラジオール注射は土曜日と日曜日に続けられました。エストラジオールは、水曜日にマウスが画像化される前に、月曜日と火曜日に投与されませんでした。
5. 卵巣摘出マウスのF-FES PETおよびMRIイメージング 18件
注意:放射能を取り扱うときは、保護具を使用してください。放射能を取り扱う際には、適用されるすべての規制手順に従ってください。
- マウスの重量を量り、その重量を記録します。
- 本研究では、 18F-FESを合成し、臨床グレード23(Department of Molecular Imaging and Therapy, Austin Healthから取得)で製剤化し、動物モデルに使用しました。 18F-FES(放射性半減期109分)を10% w / vエタノール生理食塩水で希釈し、調整崩壊補正注入濃度を約150〜300 μCi / 100 μLにします。.
注:1000 Ci/mmolの比活性は、ERα24のin vivo PETイメージングには十分であり、受け取った18F-FESは、このベースライン値を超える比活性を持っていました。 - 29G針付きのインスリン注射器で100μLを吸引します。線量キャリブレーターを使用して、放射能の線量と時間を測定および記録します。注射器を注入時まで鉛シールドの後ろに置きます。
注:線量キャリブレーターを使用して、各線量で 18のF-FES放射能の量を測定します。線量キャリブレーターは、メーカーのプロトコルに従って、セシウム137などの標準標準物質に対して較正する必要があります。読み取りの時間は、減衰補正を決定するために記録することが重要です。キャリブレーターに表示される時刻が、PET取得に使用されるコンピューターの時刻と一致していることを確認します。 - 静脈内注射のために尾静脈を拡張するには、マウスを発熱体の下に30cmの距離で2分間置きます。70% w / vエタノールで尾を拭き、注射前にその領域を消毒します。
- 100μL の 18 F-FES (シリンジ内の全容量) を外側尾静脈を介してボーラス注射で投与し、注射時間を記録します。注入部位をティッシュで押して、尾静脈の出血を止めます。
- 線量キャリブレーターを使用して、シリンジと組織の残りの線量を測定し、測定値と時間を記録します。マウスを2個ずつずらして注入し、マルチチャンバーを使用したイメージングを可能にします。
注意: 一部のプローブはシリンジに残ります。インスリン注射器の使用は、注射投与後に注射器/針に閉じ込められる用量量が減少するため、ルアーロックを介して針に接続された注射器よりも好まれます。さらに、プローブの静脈内注射後に発生する可能性のある出血を止めるために使用される組織内の放射能が測定されます。これは、組織に吸収された血液の逆流に、 18F-FESからの放射能が含まれている可能性があるためです。さらに、側尾静脈を温めるのにかかる時間は、熱源の強度やマウスにどれだけ近いかなどの変数によって異なります。標準的なヒートランプの場合、静脈が拡張するのに最大15分かかる場合があります。マウスは過熱の兆候がないか注意深く監視し、必要に応じて注入の合間に加熱源から取り除く必要があります。 - 注射後に睡眠に割り当てられたマウスの場合、注射したマウスをイソフルラン(2%-2.5%)と酸素(2L / min)の維持レベルに保たれた麻酔室に1時間置き、PETスキャンの前にマウスの全身循環を介してプローブを分散させます。グループ内の他のマウスがPETスキャンまで1〜1.5時間ケージ内を自由に歩くのを待ちます。
- 1〜1.5時間後、マウスをノーズコーンイソフルラン麻酔下のイメージングチャンバーに入れます。ベッドヒーターを32°Cにオンにし、マルチチャンバーセットアップを選択して、呼吸モニタリングシステムをオンにします。撮像する2匹のマウスを腹臥位に置きます。イメージングチャンバーをPET / MRI装置に配置します。
- 画像取得中はマウスの呼吸を監視します。呼吸チャートを使用して、スキャン中の任意の時間に毎分60〜80回の呼吸を確保します。呼吸数が希望の範囲を下回るか上回っている場合は、必要に応じてイソフルランの用量を調整します。.
注:動物の呼吸は、イメージングチャンバー内のセンサーの存在により監視することができます。 - 静的な15分間のPET取得とグラジエントエコー(GRE)3D軸方向MRIスキャンを組み合わせます。取得パラメータについては、以下を参照してください。
- PETプロトコルを設定するには、関連するソフトウェアで Radiopharmaceutical Editor ウィンドウを開きます。使用する同位体、シリンジ活性(MBq)、注入時間と適用活性(MBq)、および体重を指定します。これらのパラメータはすべて、対象組織におけるプローブの取り込みを計算および定量化するために不可欠です。
- マウスがイメージング用に正しく配置されていることを確認するには、2D Scout(前面と背面)シーケンスを使用してPETの視野を決定します。400-600 keVのエネルギーウィンドウ、1-5、5 nsの一致モードを使用して、15分間の静的PET取得に進みます。その後、約27分間GRE3D軸方向MRIスキャンを行います。
- 取得した画像を関連するソフトウェアを使用して再構築します。
- PET/MRI画像の静的再構成を行い、ジオメトリックプランナーを使用して再構成領域を変更し、マウス全体を覆うようにして、最適な再構成時間を確保します。
- [Results Identification] ウィンドウで、ランダム補正、減衰補正 (AC) + 散乱、位置範囲を [On] に切り替えます。ディケイ参照時間を ADMIN に設定します。ボディ エアしきい値を 30% に設定し、マテリアル マップに基づいて減衰補正を行います。
- マルチチャンバー画像の分離、共レジストレーション、関心領域(ROI)の描画には、関連するソフトウェアを使用します。共レジストレーションの場合は、PETに合うようにMRIを再調整し、PET画像を再構築します。
- マルチチャンバー画像を分離するには、[ 画像処理] > [セグメンテーション] > [ホテル セパレーター] をクリックします。 科学モード をオンにし、2つのオブジェクトが見つかるまで、必要に応じてしきい値とボリュームのパラメータを調整します。
- 注射器に残った残留線量を考慮して注射時の線量を入力すると、PET データをグラム当たりの注射量の割合の単位 (%ID/g) に変換するか、さらに被験者の体重を入力して PET データを標準化された取り込み値の単位 (SUV) に変換します。この変換を行うには、PET データ セットを右クリックし、[ 基本情報 ] タブの [%ID/g] フィールドを見つけます。以前に記録した %ID/g を入力します。
- 腫瘍切片のROIを描画するには、プログラムウィンドウの左側にある [測定 ]タブをクリックします。 ポリゴン または フリーハンド ツールでROIを描画します。腫瘍の周囲を慎重に描き、PET画像がアクティブウィンドウにある間にアクションが実行されることを確認します( Fn-Aを使用して確認します)。この結果、ROI の値は %ID/g として得られます。
注:ROI分析では、%ID/gの適切な推定値が得られます。適切にキャリブレーションされたカメラは、 ex vivo 生体内分布データと比較して±5%の精度を提供するはずです。
6. 免疫組織化学のための腫瘍組織の採取と固定
- 実験エンドポイントでは、イソフルランの致死吸入を4%〜5%で行うか、CO2を過剰に吸入してマウスを安楽死させます。
- 手術用ハサミとピンセットを使用して、腫瘍の表面近くに小さな切開を慎重に作成し、腫瘍組織を切除します。腫瘍組織に皮膚が付着している場合は、メスの刃を使って腫瘍から皮膚をやさしく分離します。
- 腫瘍組織を、約3 mLの10%中性緩衝ホルマリンを含む5 mLバイアルに入れます。組織の固定を容易にするために、組織全体が溶液で覆われていることを確認してください。組織をホルマリンに24時間沈めたままにします。
- 翌日、固定腫瘍組織を70%エタノールを含む5mLバイアルに移します。.パラフィン包埋の準備として、腫瘍組織に特異的な組織カセットを標識します。
- 腫瘍組織を組織カセットに入れ、パラフィンが包埋するまで70%エタノール溶液で保存します。
注:この研究では、パラフィン包埋はAustin Healthの解剖病理学者によって行われました。
7. エストロゲン受容体α(ERα)の検出のための免疫組織化学
- ミクロトームを使用して、標準的な手順に従って、染色に必要な腫瘍組織の厚さ4 μmの切片を切断します。
- 腫瘍切片を切開したガラス顕微鏡スライドをスライドラックに入れ、ラックを37°Cオーブンに入れて一晩乾燥させ、組織がスライドに付着していることを確認する前に染色します。
- 翌朝、切断された腫瘍切片を含むスライドを載せたラックを60°Cのオーブンに30分間入れ、脱ロウプロセスを促進します。
注意: 焼くときは、スライドガラスが上を向く必要があります。これにより、組織の付着が確保され、溶けたワックスは隣接するスライドではなく、それ自体のスライドに溶けます。 - 切片を再水和するには、焼き切片をキシレンに2回、各5分(2x 5分)100%エタノールを2回5分間、次に70%エタノールを1x5分間沈めます。スライドを蒸留水で5分間洗浄します。
- 抗原賦活化のために、スライドを1x EDTAバッファー(pH 8)の容器に100°Cの水浴中で25〜30分間浸漬します。ウォーターバスからスライドを取り外し、スライドをRTに少なくとも1時間置くようにします。スライドが冷めたら、流水で2分間洗い、次にTBST(0.01%Tween20を含むTBS)で5分間2回洗います。
- 疎水性バリアペンを使用して、スライドのセクションの周りに円を描きます。
- 約100μLの3%H2O2溶液(蒸留水で希釈)を切片に室温で10分間置いて、内因性ペルオキシダーゼをクエンチします。
- ブロッキングバッファー(TBST中の5%ウシ血清アルブミン(BSA))の約100μL/切片で切片をRTで30分間ブロックします。
- 余分な溶液をインキュベーショントレイに静かにフリックして、ブロッキングバッファーを排出します。約100 μLの一次抗体 (ウサギで産生したヒト抗ERα) を切片に1:300 希釈 (または使用する抗体に対して事前に決定された最適な希釈倍率) で添加します。抗体希釈液を1% BSA TBSTで調製し、スライドを配置して抗体と4°Cで一晩インキュベートします。
注:インキュベーショントレイは、切片が一晩乾燥しないように、底に水を入れる必要があります。 - 翌朝、スライドをTBSTで5分間3回洗います。約100 μLの抗ウサギ二次抗体を切片に添加し、室温で45分間放置し、スライドをTBSTで5分間3回洗浄します。
- ドラフト内で、約100 μLの3,3'-ジアミノベンジジン(DAB)試薬を切片に加え、溶液を切片あたり約3分間保持します。スライドを水道水で10分間洗浄することにより、DAB反応を抑制します。
- スライドをヘマトキシリンで1分間カウンターステインし、水道水で2分間すすぎます。スライドをスコットの水に1分間浸し、次に水道水でさらに2分間すすぎます。
- 切片を脱水するには、切片を70%エタノールに2分間、100%エタノールに2×2分間、次にキシレンに2×2分間浸します。
- ドラフトでは、切片をフタル酸ジブチルポリスチレンキシレン(DPX)に慎重に取り付け、切片にカバースリップを貼って、気泡が目的の組織に引っかからないようにします。スライドをヒュームフードで一晩乾かします。
- 翌日、スライドスキャナーを使用して画像をキャプチャし、染色を視覚化します。
結果
18F-FES PETを使用してERα陽性腫瘍をはっきりと視覚化できる場所を決定するために、この研究では卵巣摘出マウスの3つのコホートを使用しました(図1)。2つのグループのマウスに、MCF-7細胞(ERα陽性乳がん細胞株)をIMFまたは肩部に注射しました。ネガティブコントロールとして、マウスの別のコホートに、ERαを発現しない一般的に使用されるトリプルネガティブ乳がん細胞株であるMDA-MB-231細胞を注射しました(図1)。この研究のワークフローを概説する図は、エストロゲン依存性腫瘍の成長を促進するための皮下エストラジオール注射の使用を強調しています。すべてのモデルにおいて、腫瘍体積は細胞注入後4〜5週間で約100 mm3に達しました(図1および図2)。卵巣摘出マウスの肩部に増殖したMCF-7腫瘍は、同所性に増殖した腫瘍(20日)と比較して、確立に時間がかかりました(30日)(図2)。MDA-MB-231腫瘍IMFが確立するのに平均30日かかりました。
代表的なマウスをイメージング用に選択しました(図1)すべてのグループの腫瘍が平均体積74.59 mm3 (SEM ± 6.80 mm3、n = 20; 図 2)。 in vivo18F-FESの分布をマウスでどのように可視化するのが最適かを評価するために、マウスに側尾静脈を介して 18F-FESを注射し、眠らせるか、ケージに戻して注射後1時間活動的にさせました(図3)。1時間後、マウスのPET画像を15分のスキャン時間で取得し、 18個のF-FES分布を可視化しました。解析の結果、 18F-FES注射の1時間後に覚醒したマウスでは、 18F-FES注射の1時間後に眠っていたマウスとは対照的に、背景を縮小してより鮮明なPET画像が生成されることが観察されました(図3)。この観察結果から、撮影対象の残りのマウスは、 18F-FES注入後1〜1.5時間起きていた。
次に、3つのコホートすべてのマウスに、平均10.5MBqの18個のF-FESを注射しました(図4)。代表的な冠状および最大強度投影(MIP)画像は、これらのコホートにおける18のF-FESの取り込みと分布を示しています。MCF-7腫瘍による18個のF-FESの取り込みは、乳腺脂肪パッドと肩の両方で見られました(図4A-D)。重要なことに、18F-FESの取り込みは、肩にMCF-7腫瘍を有するマウスで最も明白でした(1.7-3.9%ID / g、n = 9)。他の臓器に18個のF-FESが蓄積しても、肩の腫瘍はそのような臓器から離れていたため、このシグナルは不明瞭ではありませんでした(図4A、B)。4番目の鼠径乳腺脂肪パッドで増殖したMCF-7腫瘍では、18F-FESの取り込みが見られましたが、18F-FESの腸排泄パターンと重なり、これらの腫瘍で検出可能な放射能(0.83-1.88 %ID / g、n = 4)が部分的に不明瞭になりました(図4C、D)。18名ERα陰性のMDA-MB-231担体マウス(0.18 - 0.22 %ID/g、n = 2)では、F-FESの取り込みは観察されませんでした(図4E、F)。
エンドポイントでは、腫瘍を切除し、免疫組織化学検査を実施して、 18のF-FESターゲットであるERαの発現レベルを評価しました。ERαの発現は、乳腺脂肪パッドまたは肩のいずれかで増殖したMCF-7腫瘍組織で同等でした(図5)。ERαの発現は、トリプルネガティブMDA-MB-231腫瘍組織ではボイドであると予想されました(図5)。

図1: 18F-FES PET/MRIイメージングの前に、女性の卵巣摘出術BALB/cヌードマウスで腫瘍を確立するためのワークフロー。 この研究では、マウスの3つのコホートが使用されました。注入された細胞株、細胞株のERα状態、注入部位、および受けたエストラジオール(E2)注入回数の図が示されている。成長のためにエストロゲンに依存する腫瘍を保有するマウスでは、細胞注射の3日前の0日目にE2 (青矢印)の皮下注射が開始されました。4日目に、細胞をIMFまたはマウスの肩に注入しました。腫瘍の確立には約4〜5週間かかります。この期間中、E2 注射を 7 日間隔で 5 回 (週 5 回) 投与しました。イメージングの前の週に、その週に合計7回E2 注射が行われました。E2 注射は、PET イメージングの 2 日前に中止しました。略語:E2 =エストラジオール。IMF = 乳房内脂肪パッド。 この図の拡大版を表示するには、ここをクリックしてください。
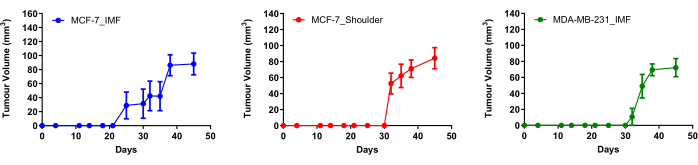
図2:雌の卵巣摘出BALB/cヌードマウスに注入したMCF-7およびMDA-MB-231細胞の腫瘍増殖曲線。MCF-7細胞(300万個)をマウスの4番目の鼠径部乳腺脂肪パッド(n=10)または肩部(n=5)のいずれかに注入し、100万個のMDA-MB-231細胞をIMF(n=5)に注入した。MCF-7細胞を保有するマウスに、E2を週5回、5週間にわたって皮下注射しました。画像化されたマウスの平均腫瘍体積は101.03mm3(SEM±11.77mm3、n=6)でした。データは平均値であり、エラーバーは±SEMを表します。略語:E2 = エストラジオール;IMF = 乳房内脂肪パッド。この図の拡大版を表示するには、ここをクリックしてください。

図 3. In vivo 18F-FESの分布は、 18F-FES投与後1時間活性を持つマウスでよりよく視覚化されます。 イメージングの日には、約100 mm3 の腫瘍を有するマウスに、側尾静脈を介して 18F-FESプローブを注入しました。選択されたマウスは、プローブ投与後1時間眠らされるか、または起きていました。マウスのPET画像は、15分のスキャン時間で取得しました。代表的な画像は、2つの異なるグループにおける in vivo 18F-FESの分布を示しています。略語:h p.i. = 注射後数時間。 この図の拡大版を表示するには、ここをクリックしてください。
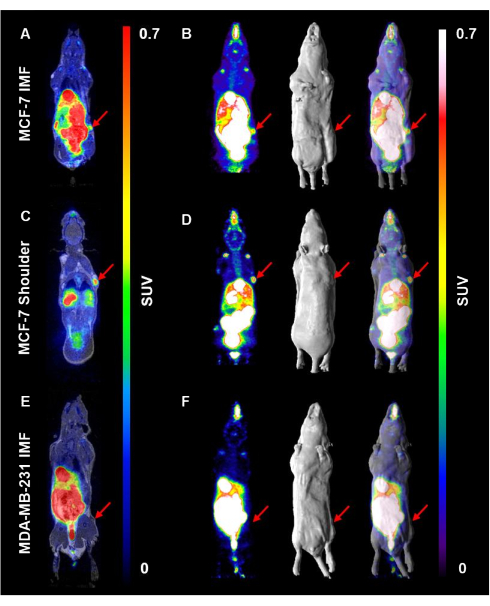
図 4.18名F-FESの取り込みは、ERα陽性腫瘍の鼠径部乳腺脂肪パッドと比較して、肩でよりよく視覚化されます。マウスにE2を皮下注射し、ERα陽性腫瘍の増殖をサポートしました。E2 注入は、平均 10.5 MBq 18F-FES プローブ/マウスの注入前に 48 時間停止しました。PET画像は、注入後1時間で15分のスキャン時間で取得しました。(A)MCF-7腫瘍IMFを有するマウスの代表的な冠状切片が示され、(B)最大強度投影画像、表面レンダリングMRI、および18F-FES取り込みを視覚化するためのPET/MRIオーバーレイが示されています。肩部に(C,D)MCF-7腫瘍を有するマウスとMDA-MB-231担体マウス(E,F)について、同様の画像シリーズを表示する。赤い矢印は腫瘍の位置を表しています。この図の拡大版を表示するには、ここをクリックしてください。

図 5.卵巣摘出術BALB/cヌードマウスから切除されたMCF-7腫瘍は、18個のF-FES標的ERαを発現します。18回のF-FESイメージング後、エンドポイントでMCF-7またはMDA-MB-231腫瘍のいずれかを有するマウスから腫瘍を切除しました。腫瘍組織を免疫組織化学を用いてERαについて染色した。ERαの発現は核内で可視化されます。スケールバーは50μmを表しています。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ここでは、ERα発現を特徴とする乳房腫瘍の検出における18F-FES PET/MRIの有用性について説明します。一例として、ERα陽性腫瘍を視覚化できる場所の1つはマウスの肩にあることを示し、これらの腫瘍は、4番目の鼠径乳腺脂肪パッド内にある腫瘍と比較して、18F-FESの取り込みによって明確に識別できます(図4)。18名F-FESの取り込みはMDA-MB-231腫瘍では見られず、免疫組織化学を用いて観察されるERα発現の欠如が確認された(図4および図5)。
18F-FESの排泄パターンは肝胆道系と腸管を通じて起こるため、マウス25の鼠径乳腺脂肪パッドに位置する18F-FES乳房腫瘍の取り込みを正確に検出することが困難になる。これは、マウスのこれらの腺の解剖学的位置が肝臓と消化管に近接しているためです。18F-FESの取り込みを介して4番目の乳腺脂肪パッドに腫瘍が見える可能性がありますが、これは腫瘍がマウスの腸管から離れて成長し、外側に突き出ることに依存しています。実用上の観点からは、マウスへの細胞注入後に腫瘍が増殖する方向は予測できません。対照的に、乳房腫瘍はマウスの肩に形成されるのにより長い時間がかかることがわかりましたが(図2)、腫瘍の位置は18F-FESが排泄される解剖学的領域から離れた場所に都合よく位置しています。そのため、肩部に位置するERα陽性腫瘍における18のF-FES取り込みの検出成功率が向上します(図4)。この研究では、肩にERα陽性腫瘍を確立することが、子宮外乳がんモデルにおける18のF-FES取り込みを明確に視覚化できる1つの場所であることを示します。さらに、4番目の鼠径乳腺脂肪パッドに腫瘍を確立することは、18F-FESの排泄パターンのために理想的ではないことを示しています。乳がんに関する多くのin vivo研究では、同所性乳がんモデルを利用することを好む場合があり、これにより、乳房組織を支える近くの乳腺脂肪パッド内での乳房腫瘍の成長が確保される26。このような場合、乳がんの文脈でERαの発現を視覚化することに関心のある研究グループは、第2および第3の胸部乳房脂肪パッド27を使用しようとするかもしれない。解剖学的観点から見ると、胸部乳房脂肪パッドは肝胆道系と腸管からさらに離れた場所にあります。したがって、この領域の腫瘍による18F-FESの取り込みは、マウスの鼠径部乳腺脂肪パッドで増殖した腫瘍と比較して、より鮮明であると予想される27。この研究では、胸部乳腺脂肪パッドに腫瘍を確立する利点を実証していませんが、他のグループは、18F-FES PETイメージング20,27と組み合わせることもできる同所性乳がんモデルとして、この場所の有用性を実証しています。否定できないほど、同所性マウスモデルでがんを研究することは、ヒトにおいてがんがどのように発生し、存在するかを最もよく表している28。
ここで説明する方法論の重要なステップには、卵巣摘出マウスの使用と定期的なエストラジオール補給が含まれ、発生のためにホルモンに依存する乳房腫瘍の成長を促進します。この研究では、ERα29を高レベルで発現する管腔乳がん細胞株であるMCF-7を選択しました。ERα腫瘍の検出は受容体占有率に依存しているため、この研究では卵巣摘出マウスを使用することが重要でした30。これは、エストロゲンが主に卵巣によって産生され、存在する場合、内因性エストロゲンが注入されたプローブと競合する可能性があり、18F-FESのERα16への結合機会が制限されるためです。エストロゲン補給には、シラスティックカプセル、徐放性ペレット、浸透圧ポンプ、およびオイルビヒクル31を使用した皮下注射の使用を含む、さまざまな方法があります。私たちの実験ニーズでは、イメージング時にエストラジオールを簡単に回収できるため、コーン油を使用した毎日の皮下注射を使用し、標的受容体(ERα)飽和の問題を軽減しました。興味深いことに、複数の研究グループが、エストラジオールの皮下注射後に皮膚の下に形成される油エストラジオール溶液の「泡」または「ポケット」を報告しており、これらの「泡」または「ポケット」が消えるまでに数週間かかることが多いことを観察しています-ゴマ油を媒体として使用した場合の私たちの研究でもこれを観察しましたが、コーン油22,32ではあまり目立ちません.したがって、エストラジオール注射部位の皮膚下の炎症の兆候を最小限に抑えるために、ゴマ油ではなくコーン油をホルモンの投与手段として使用することを好みます。また、この方法論では、エストラジオールが皮下投与された直後の注射部位での局所消毒剤の使用についても詳しく説明します。ここでの研究で行われた実験では、これにより、注射後のマウスの皮膚表面への刺激が軽減され、マウスの全体的な健康状態が改善されたようです。エストロゲン依存性腫瘍の成長を促進するための徐放性エストロゲンペレット移植の使用は、一部のグループによって報告されています20,33。循環エストラジオールと18F-FESとの間の受容体結合の競合を制限するために、ペレットはイメージングの3日前に除去されます。しかし、エストロゲンへの長期のin vivo曝露はERαを占有する可能性があり、これにより18F-FESプローブ34の結合機会が減少する可能性があることを考慮する必要があります。peroral routeは、エストラジオール35の断続的な送達に採用できた別の方法です。この方法は、ナットバター混合物を通じてエストラジオールを成功裏に送達することができ、この技術は非侵襲的であるが、この方法の実用性は、骨の折れるプロセスであり、マウスの大規模なコホートが使用される場合特に困難であるため、疑わしい。
免疫組織化学は、PETイメージング用に選択されたマウスの代表的な腫瘍における標的発現を確認するためのツールとして使用されました。ERαの発現は、肩または鼠径部の乳脂肪パッドのいずれかで増殖したMCF-7腫瘍で同等でした(図5)。この観察結果は、肩の腫瘍(1.7-3.9%ID / g、n = 9)と比較して、IMF腫瘍(0.83-1.88%ID / g、n = 4)による 18のF-FESの取り込みが低いのは、2つの部位でのERαの差次的発現によるものではないことを示唆しています。これは、 18F-FESの腸内排泄が、ROI分析を使用したIMF腫瘍によるプローブの取り込みの正確な定量化を妨げるという考えを繰り返し示しています。
複数の要因がERα陽性腫瘍による18F-FESの取り込みに影響を与える可能性があり、そのような1つは、放射性トレーサー36,37の比活性(冷たく放射性医薬品の質量あたりの放射能の測定)である。18F-FES調製物の比活性が低い場合、「標識なし」または低温のFESの量が多いと、受容体の占有率に影響が及び、「標識された」FESに利用可能なERα結合部位の量が制限される可能性があります。この研究では、使用された18のF-FESが合成され、前臨床適用に先立って臨床グレードに再処方されました23。さらに、この研究の腫瘍のサイズが比較的小さかったことを認識することが重要です。増殖した腫瘍の一部は、血管発達の異なる段階にあった可能性があります。これは、腫瘍成長曲線の平均(SEM)の標準誤差によって強調され(図2)、各コホートのすべての腫瘍が100mm3に達するまで成長したわけではないことを例示しています。この問題を回避するために、今後の実験ではより多くの細胞を注入し、腫瘍の樹立成功率を高めていきたいと考えています。
18名F-FES PETイメージングは、患者、特にERα陽性の乳房腫瘍を抱える患者に適切な治療オプションを提供するのに役立つ強力なツールであることは間違いありません38。乳房転移の生検が不可能な場合、 18F-FES PETを使用して、そのような病変におけるERα発現を非侵襲的に検出することができます。 18名F-FES PETは、ERα発現の損失/利得を検出するためにも使用できます。例えば、ERα分解剤であるフルベストラントに応答したERα発現の喪失は、 18F-FES取り込みの減少の大きさと一致することが以前に示されている39。さらに、我々は現在、以前は受容体40が欠落していた乳癌モデルにおけるERα発現の可能な増加をイメージングする過程にある。私たちの調査結果から、ERαを発現する腫瘍が 18F-FESの取り込みによって検出される可能性のある場所の1つは、卵巣摘出マウスの肩内に確立された場所であることを示しています。
開示事項
著者は何も開示していません。
謝辞
この研究は、National Breast Cancer Foundation(IIRS-22-071)の支援を受けました。私たちは、ビクトリア州政府の運用インフラストラクチャサポートプログラムを認めています。この研究は、ANSTO-Austin-LICRパートナーシップであるSolid Target Laboratoryを使用して行われ、National Imaging Facilityとビクトリア州政府の支援も受けています。著者らは、La Trobe-ONJCRIノード、Olivia Newton-John Cancer Research Institute(ONJCRI)におけるNational Collaborative Research Infrastructure Strategy(NCRIS)機能であるNational Imaging Facilityの科学的および技術的支援を認めています。図1と図3はBioRenderで作成されています。
資料
| Name | Company | Catalog Number | Comments |
| 2.5% Trypsin (10x) | Gibco | 15090-046 | |
| 27 G x 13 mm 0.5 mL insulin syringe | Terumo | SS*05M2713KA | For cell injections |
| 29 G x 13 mm 0.5 mL insulin syringe | Terumo | SS*05M2913KA | For estradiol injections |
| 30% H2O2 | Chem-Supply | HA154 | Diluted to a 3% working solution with distilled water |
| Corn oil | Sigma | C8267 | |
| DAB Substrate Kit | Abcam | ab64238 | |
| Dako anti-rabbit-HRP, 110 mL | Aligent-Dako | K4003 | Secondary antibody used for IHC |
| DMEM/F-12 Medium | Gibco | 11320033 | |
| Dose calibrator | Capintec | 5130-3216 | |
| Estradiol | Sigma | E2758 | |
| Estrogen Receptor α (D8H8) Rabbit mAb | Cell Signalling Technology | #8644 | Primary antibody used for IHC |
| FBS | Bovogen | SFBS | |
| Heat element (Infra Red Lamp) | Amcal | 12400 | For tail vein dilation |
| Matrigel | Corning | 356225 | |
| MultiCell 4 Channel Monitoring kit for triple- or quadruple-mouse imaging chamber | Mediso | PR-MC900200 | For monitoring of mouse respiration |
| NanoScan PET/MRI 3T System | Mediso | PR-RD000000 | For PET/MRI acquistion |
| PBS (1x) | Gibco | 14190-144 | |
| TBST | ThermoFisher | #28360 | Wash buffer for IHC |
| Three mice imaging chamber | Mediso | PR-MC407300 | For PET/MRI acquistion |
参考文献
- Perou, C. M., et al. Molecular portraits of human breast tumours. Nature. 406 (6797), 747-752 (2000).
- Ignatov, A., Eggemann, H., Burger, E., Ignatov, T. Patterns of breast cancer relapse in accordance to biological subtype. J Cancer Res Clin Oncol. 144 (7), 1347-1355 (2018).
- Siegel, R. L., Giaquinto, A. N., Jemal, A. Cancer statistics. CA Cancer J Clin. 74 (1), 12-49 (2024).
- Gnant, M., Turner, N. C., Hernando, C. Managing a long and winding road: Estrogen receptor-positive breast cancer. Am Soc Clin Oncol Educ Book. 43, e390922 (2023).
- Thomsen, C., Nielsen, S., Nielsen, B. S., Pedersen, S. H., Vyberg, M. Estrogen receptor-α quantification in breast cancer: Concordance between immunohistochemical assays and mRNA-in situ hybridization for ESR1 gene. Appl Immunohistochem Mol Morphol. 28 (5), 347-353 (2020).
- Shafi, S., et al. Integrating and validating automated digital imaging analysis of estrogen receptor immunohistochemistry in a fully digital workflow for clinical use. J Pathol Inform. 13, 100122 (2022).
- Harvey, J. M., Clark, G. M., Osborne, C. K., Allred, D. C. Estrogen receptor status by immunohistochemistry is superior to the ligand-binding assay for predicting response to adjuvant endocrine therapy in breast cancer. J Clin Oncol. 17 (5), 1474-1474 (1999).
- Caruana, D., Wei, W., Martinez-Morilla, S., Rimm, D. L., Reisenbichler, E. S. Association between low estrogen receptor positive breast cancer and staining performance. NPJ Breast Cancer. 6 (1), 5 (2020).
- Goldstein, N. S., Ferkowicz, M., Odish, E., Mani, A., Hastah, F. Minimum formalin fixation time for consistent estrogen receptor immunohistochemical staining of invasive breast carcinoma. Am J Clin Pathol. 120 (1), 86-92 (2003).
- Hammond, M. E. H., et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for immunohistochemical testing of estrogen and progesterone receptors in breast cancer. Arch Pathol Lab Med. 134 (6), 907-922 (2010).
- Allison, K. H., et al. Estrogen and progesterone receptor testing in breast cancer: ASCO/CAP guideline update. J Clin Oncol. 38 (12), 1346-1366 (2020).
- Amir, E., et al. Tissue confirmation of disease recurrence in breast cancer patients: Pooled analysis of multi-centre, multi-disciplinary prospective studies. Cancer Treat Rev. 38 (6), 708-714 (2012).
- Cardoso, F., Senkus-Konefka, E., Fallowfield, L., Costa, A., Castiglione, M. Locally recurrent or metastatic breast cancer: ESMO clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 21 (Suppl 5), v15-v19 (2010).
- Cardoso, F., et al. 5th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 5). Ann Oncol. 31 (12), 1623-1649 (2020).
- James, W. F., et al. Recommendations on the use of 18F-FDG PET in oncology. J Nucl Med. 49 (3), 480-508 (2008).
- Pedersen, M. A., et al. Dynamic whole-body [18F]FES PET/CT increases lesion visibility in patients with metastatic breast cancer. EJNMMI Res. 14 (1), 24 (2024).
- Grabher, B. J. 18F-FES whole-body imaging protocol for evaluating tumor estrogen receptor status in patients with recurrent or metastatic breast cancer. J Nucl Med Technol. 51 (3), 188-193 (2023).
- Van Kruchten, M., et al. PET imaging of estrogen receptors as a diagnostic tool for breast cancer patients presenting with a clinical dilemma. J Nucl Med. 53 (2), 182-190 (2012).
- Ulaner, G. A., et al. Summary: Appropriate use criteria for estrogen receptor-targeted pet imaging with 16α-18F-fluoro-17β-fluoroestradiol. J Nucl Med. 64 (3), 351-354 (2023).
- He, S., Wang, M., Zhang, Y., Luo, J., Zhang, Y. Monitoring the early response of fulvestrant plus tanshinone IIA combination therapy to estrogen receptor-positive breast cancer by longitudinal 18F-FES PET/CT. Contrast Media Mol Imaging. 2019 (1), 2374565 (2019).
- Joseph, J. D., et al. The selective estrogen receptor downregulator GDC-0810 is efficacious in diverse models of ER+ breast cancer. eLife. 5, e15828 (2016).
- Alsina-Sanchis, E., et al. Intraperitoneal oil application causes local inflammation with depletion of resident peritoneal macrophages. Mol Cancer Res. 19 (2), 288-300 (2021).
- Sluka, P., et al. Characterization of an estrogen receptor α-selective 18F-estradiol PET tracer. World J Nucl Med. 23 (03), 153-160 (2024).
- Katzenellenbogen, J. A. The quest for improving the management of breast cancer by functional imaging: The discovery and development of 16α-[18f]fluoroestradiol (fes), a pet radiotracer for the estrogen receptor, a historical review. Nucl Med Biol. 92, 24-37 (2021).
- Boers, J., et al. Image quality and interpretation of [18F]-FES-PET: Is there any effect of food intake. Diagnostics (Basel). 10 (10), 756 (2020).
- Caceres, S., et al. Tumor growth progression in ectopic and orthotopic xenografts from inflammatory breast cancer cell lines. Vet Sci. 8 (9), 194 (2021).
- Kumar, M., Salem, K., Jeffery, J. J., Fowler, A. M. PET Imaging of Estrogen Receptors Using 18F-Based Radioligands. Estrogen Receptors. , (2022).
- Zhang, W., et al. Comparative study of subcutaneous and orthotopic mouse models of prostate cancer: Vascular perfusion, vasculature density, hypoxic burden and BB2r-targeting efficacy. Sci Rep. 9 (1), 11117 (2019).
- Lee, A. V., Oesterreich, S., Davidson, N. E. MCF-7 cells-changing the course of breast cancer research and care for 45 years. J Natl Cancer Inst. 107 (7), djv073 (2015).
- Pedram, H., et al. 18F-fluoroestradiol PET guides dosing of selective estrogen receptor degraders. J Nucl Med. 55 (supplement 1), 11 (2014).
- Ingberg, E., Theodorsson, A., Theodorsson, E., Strom, J. O. Methods for long-term 17β-estradiol administration to mice. Gen Comp Endocrinol. 175 (1), 188-193 (2012).
- Luengo-Mateos, M., et al. Protocol for ovariectomy and estradiol replacement in mice. STAR Protoc. 5 (1), 102910 (2024).
- Yang, Z., et al. High specific activity is not optimal: 18F-fluoroestradio positron emission tomography-computed tomography results in a breast cancer xenograft. J Labelled Comp Radiopharm. 59 (13), 576-581 (2016).
- Aliaga, A., et al. Breast cancer models to study the expression of estrogen receptors with small animal PET imaging. Nucl Med Biol. 31 (6), 761-770 (2004).
- Ström, J. O., Theodorsson, A., Ingberg, E., Isaksson, I. -. M., Theodorsson, E. Ovariectomy and 17β-estradiol replacement in rats and mice: A visual demonstration. J Vis Exp. 64, e4013 (2012).
- Pisaneschi, F., et al. Automated, resin-based method to enhance the specific activity of fluorine-18 clicked PET radiotracers. Bioconjug Chem. 28 (2), 583-589 (2017).
- Johannes, N., et al. Variation of specific activities of 68Ga-aquibeprin and 68Ga-avebetrin enables selective PET imaging of different expression levels of integrins α5β1 and αvβ3. J Nucl Med. 57 (10), 1618-1624 (2016).
- Liu, C., Ma, G., Xu, X., Song, S., Yang, Z. Can 18F-FES PET improve the evaluation of 18F-FDG PET in patients with metastatic invasive lobular carcinoma. Clin Nucl Med. 49 (4), 301-307 (2024).
- Heidari, P., et al. Pharmacodynamic imaging guides dosing of a selective estrogen receptor degrader. Clin Cancer Res. 21 (6), 1340-1347 (2015).
- Roswall, P., et al. Microenvironmental control of breast cancer subtype elicited through paracrine platelet-derived growth factor-CC signaling. Nat Med. 24 (4), 463-473 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved