Method Article
Isolation of Mitochondria for Mitochondrial Supercomplex Analysis from Small Tissue and Cell Culture Samples(소조직 및 세포 배양 샘플에서 미토콘드리아 초복합체 분석을 위한 미토콘드리아 분리)
요약
이 프로토콜은 소량의 샘플만 사용할 수 있는 경우 호흡기 초복합체를 분석하는 기술을 설명합니다.
초록
지난 수십 년 동안 호흡기 초복합체(SC)의 존재에 대해 축적된 증거는 미토콘드리아 전자 수송 사슬 조직에 대한 우리의 이해를 변화시켰고, 이는 "가소성 모델"의 제안을 낳았습니다. 이 모델은 조직 또는 세포 대사 상태에 따라 서로 다른 비율의 SC와 복합체가 공존한다고 가정합니다. SC에서 조립의 동적 특성으로 인해 셀은 사용 가능한 연료의 사용과 전자 전달의 효율성을 최적화하여 활성 산소 종 생성을 최소화하고 셀이 환경 변화에 적응할 수 있는 능력을 선호할 수 있습니다.
최근에는 신경퇴행성 질환(알츠하이머병, 파킨슨병), 바스 증후군(Barth Syndrome), 리 증후군(Leigh syndrome), 암(cancer) 등 다양한 질환에서 SC 조립의 이상이 보고되고 있다. 질병 진행에서 SC 어셈블리 변경의 역할은 아직 확인되지 않았습니다. 그럼에도 불구하고 SC 어셈블리 상태를 결정하기에 충분한 양의 샘플을 사용할 수 있는지는 종종 어려운 과제입니다. 이는 크기가 작거나 여러 분석을 위해 나누어야 하는 생검 또는 조직 샘플, 성장이 느리거나 미세유체 장치에서 추출한 세포 배양, 일부 1차 배양 또는 희귀 세포 또는 특정 고가의 처리(나노 입자, 매우 비싼 화합물 등)의 효과를 분석해야 하는 경우에 발생합니다. 이러한 경우 효율적이고 적용하기 쉬운 방법이 필요합니다. 이 논문은 소량의 세포 또는 조직에서 농축된 미토콘드리아 분획을 얻는 데 적합한 방법을 제시하여 기본 전기영동으로 미토콘드리아 SC의 구조와 기능을 분석한 후 겔 내 활성 분석 또는 웨스턴 블롯을 수행합니다.
서문
초복합체(SC)는 개별 호흡 사슬 복합체 1,2 사이의 초분자 결합입니다. SC의 초기 식별과 Schägger 2,3 그룹에 의한 그 구성에 대한 설명 이후, 나중에 다른 그룹에 의해 확인된 이래, SC는 서로 다른 화학량론에서 호흡기 복합체 I, III 및 IV(CI, CIII 및 CIV)를 포함하고 있음이 확인되었습니다. SC의 두 가지 주요 집단을 정의할 수 있는데, CI(및 CIII 단독 또는 CIII 및 CIV)를 포함하고 분자량이 매우 높은(MW, 더 작은 SC의 경우 ~1.5MDa부터 시작: CI + CIII2) 및 CIII 및 CIV를 포함하지만 CI는 포함하지 않고 훨씬 더 작은 크기(예: ~680kDa의 CIII2 + CIV). 이러한 SC는 내부 미토콘드리아 막에 유리 복합체와 공존하며 비율도 다릅니다. 따라서, CI는 대부분 관련 형태에서 발견되지만(즉, SCs에서: 소의 심장에서 ~80%, 많은 인간 세포 유형에서 90% 이상)3, CIV는 자유 형태(소의 심장에서 80% 이상)에서 매우 풍부하며, CIII는 보다 균형 잡힌 분포를 보여줍니다(더 풍부한 자유 형태의 경우 ~40%, Dimer로, in bovine heart).
그들의 존재는 현재 일반적으로 받아들여지고 있지만, 그들의 정확한 역할은 여전히 논쟁 중이다 4,5,6,7,8,9,10. 가소성 모델에 따르면, 세포 유형 또는 대사 상태에 따라 SC와 개별 복합체의 비율이 상이하게 존재할 수 있다 1,7,11. 조립체의 이러한 역동적 인 특성으로 인해 셀은 사용 가능한 연료의 사용과 환경 변화에 대응하여 산화 인산화 (OXPHOS) 시스템의 효율성을 조절 할 수 있습니다 4,5,7. SC는 또한 활성 산소 종 생성 속도를 제어하고 개별 복합체 4,12,13,14의 안정화 및 회전율에 참여할 수 있습니다. SC 조립 상태의 수정은 다양한 생리학적 및 병리학적 상황(15,16) 및 노화 과정(17)과 관련하여 설명되었다.
따라서, SC 패턴의변화는 성장에 사용되는 탄소원에 따라 효모에서 설명되었으며2, 포도당이 갈락토스4로 치환될 때 배양된 포유류 세포에서 설명되었습니다. 또한 공복 후 생쥐의 간에서변화가 보고되었으며8 미토콘드리아 지방산 산화가 차단된 성상세포(astrocyte)에서도 변화가 보고되었다18. 또한, 바스 증후군(Barth syndrome)19, 심부전(heart failure)20, 여러 대사 장애(multiple metabolic21) 및 신경학적장애(neurological 22,23,24), 그리고 다른 종양(25,26,27,28)에서 SC와 OXPHOS의 감소 또는 변화가 발견되었다. SC 조립 및 수준의 이러한 변화가 이러한 병리학적 상황에서 주요 원인인지 또는 2차 효과를 나타내는지 여부는 아직 조사 중입니다15,16. 다양한 방법론이 SC의 조립 및 기능에 대한 정보를 제공할 수 있습니다. 여기에는 활성 측정 8,29, 초구조 분석(30,31) 및 단백질체학(32,33)이 포함됩니다. 점점 더 많이 채택되고 있으며 앞서 언급한 방법론 중 일부의 시작점이 되는 유용한 대안은 Schägger의 그룹34,35에서 이 목적을 위해 개발한 블루 네이티브(BN) 전기영동에 의한 SC 조립 상태의 직접 측정입니다.
이 접근법은 미토콘드리아 막을 얻고 용해시키기 위해 재현 가능하고 효율적인 절차가 필요하며 겔 내 활성 분석(IGA), 2차원 전기영동 및 웨스턴 블롯(WB)과 같은 다른 기술로 보완할 수 있습니다. BN 전기영동에 의한 SC 동역학 연구의 한계는 시작 세포 또는 조직 샘플의 양일 수 있습니다. SC 조립 및 기능 분석을 위한 일련의 프로토콜은 Schägger의 그룹 분석법에서 채택되었으며, 20mg의 조직부터 시작하여 신선 또는 냉동 세포 또는 조직 샘플에 적용할 수 있습니다.
프로토콜
참고: 모든 배양 배지 및 완충액의 조성은 표 1 에 명시되어 있으며 이 프로토콜에 사용된 모든 재료 및 시약과 관련된 세부 정보는 재료 표에 나열되어 있습니다.
1. 세포 배양에서 미토콘드리아 분리
참고: 분석된 세포의 최소 부피는 ~30-50μL의 충전된 세포입니다(1.4단계). 이는 세포 유형(L929 유래 세포에서 5 × 106 및 107 세포 사이 또는 MDA-MB-468)에 따라 적어도 2개 또는 3개의 100mm 세포 배양 플레이트 또는 80-90%의 합류점에서 150mm 플레이트 1개에 해당할 수 있습니다. 효율적인 세포 파괴는 중요한 단계입니다.
- 부착 세포를 약 80% 합류 또는 부유 세포를 적절한 밀도로 성장시킵니다.
- 500 × g 에서 5분 동안 원심분리하여 세포를 수확합니다(비부착 세포의 경우 세포 현탁액에서 직접 또는 부착 세포의 경우 1x PBS에서 0.05% 트립신 및 0.02% EDTA의 트립신-EDTA 용액을 사용한 표준 트립신화 후).
- 차가운 1x PBS로 세포를 2배 세척하고 5분 동안 500× g 에서 원심분리하여 침전시킵니다.
알림: 이 시점부터 모든 단계는 4°C에서 수행해야 합니다. 따라서 모든 시약은 차가워야 하며 세포나 미토콘드리아가 들어 있는 튜브는 얼음 위에 보관해야 합니다. - 두 번째 원심분리 후 상층액을 버리고 세포 펠릿 부피(cpv)를 추정하고 세포를 -80°C에서 최소 15분 동안 동결하여 1.8단계에서 멤브레인 파괴를 용이하게 합니다.
알림: 이 시점에서 프로토콜을 중지할 수 있으며 셀은 -80°C에서 몇 주 동안 보관할 수 있습니다. 일반적으로 바닥이 원뿔형 인 10 또는 15 mL 눈금이 매겨진 튜브가 적합합니다. - 세포를 얼음 위에서 천천히 해동시킵니다.
- 충진된 세포 펠릿을 cpv(10mM MOPS, 83mM 자당, pH 7.2)의 7배에 해당하는 저긴장성 완충액(예: 700μL의 완충액에 100μL의 충진된 세포)에 재현탁시킵니다.
알림: 볼륨은 효율적인 팝을 얻기에 충분해야 합니다(1.8단계의 참고 참조). - 세포 현탁액을 적절한 크기의 Potter-Dounce 균질화기로 옮기고 세포를 얼음에서 2분 동안 배양하여 세포가 부풀어 오르도록 합니다. 예를 들어, 700-800 μL의 세포 현탁액 부피의 경우 1 mL 용량의 균질화가 적합합니다.
- 600rpm으로 회전하는 모터 구동 테프론 유봉에 연결된 균질기에서 8-10번의 스트로크를 수행하여 세포막을 파괴합니다.
알림: 스트로크를 만들 때 막을 각각 팽창 및 파괴하기 위한 저긴장 및 동결 작용과 함께 세포 파괴 효율을 높일 수 있는 진공을 만드는 것이 중요합니다. 잘 수행되면 각 스트로크에서 빠른 움직임으로 균질기를 아래로 당길 때 "팝" 소리가 들립니다. - 세포 현탁액(cpv의 7배)에 동일한 부피의 고긴장성 완충액(30mM MOPS, 250mM 자당, pH 7.2)을 추가하여 등장성 환경을 생성합니다.
- 균질액을 10-15mL 튜브로 옮기고 1,000 × g 의 고정 로터에서 4 °C에서 5분 동안 원심분리합니다.
알림: 깨지지 않은 세포가 들어 있는 원래 튜브를 이 용도로 사용할 수 있습니다. - 미토콘드리아 분획을 포함하는 상층액을 1.5mL 폴리프로필렌 튜브에 옮깁니다.
- 선택 사항: 미토콘드리아의 수율을 높이려면 1.10단계에서 얻은 펠릿을 완충액 A의 세포 펠릿 부피의 7배(10mM Tris, 1mM EDTA, 0.32M 자당, pH 7.4)에 재현탁시키고 4°C에서 5분 동안 1,000× g 으로 원심분리합니다. 1.13단계를 진행하기 전에 새 상층액을 이전 상층액과 결합합니다.
- 16,000 × g 의 미세 분리기에서 4 ° C에서 2 분 동안 원심 분리하여 미토콘드리아 조분율을 수집합니다.
- 상층액을 버리고 각 미토콘드리아 농축 펠릿에 0.5mL의 완충액 A를 혼합하여 두 튜브의 내용물을 하나로 결합하고 1.13단계에서 설명한 것과 동일한 조건에서 원심분리합니다. 모든 재료가 하나의 튜브에만 들어갈 때까지 동일한 과정을 반복합니다.
- 상층액을 버리고, 최종 펠릿에 300μL의 완충액 A를 재현탁하고, Bradford assay를 사용하여 미토콘드리아 단백질 농도를 정량화합니다. 이전과 같이 다시 원심분리기를 하고 섹션 3으로 진행합니다.
2. 소량의 동물 조직으로부터 미토콘드리아의 분리
참고: 이 프로토콜을 특정 신뢰도로 적용하기 위한 최소 조직의 양은 세포 유형과 미토콘드리아 풍부도에 따라 다르지만 대부분의 경우 ~20-30mg의 조직이 될 수 있습니다. 조직 샘플은 신선한 재료 또는 냉동 샘플일 수 있습니다. 후자의 경우 절차를 시작하기 전에 얼음 위에 놓인 균질화 완충액에서 샘플을 해동시킵니다.
- 조직의 양(mg)을 가능한 한 가깝게 무게를 측정하거나 추정합니다.
- 가위로 조직을 자르고 작은 조각을 잃지 않도록 주의하면서 여과기를 사용하여 균질화 완충액에서 3-4회 세척합니다.
참고: 이 단계는 균질화 단계를 통해 세포를 직접 쉽게 분해할 수 있는 뇌나 연조직보다 골격근이나 심장과 같은 조직에서 더 중요합니다. - 신선한 균질화 배지(간 1g당 4mL, 심장, 갈색 지방 조직(BAT) 또는 근육 1g당 10mL, 뇌 또는 신장 g당 5mL, 표 1의 각 사례에 대한 특정 완충액 조성 참조)을 추가합니다.
- 완충액이 있는 조직 조각을 균질화기로 옮기고 선택한 조직에 따라 최적의 균질화 및 미토콘드리아 분리 프로토콜을 따릅니다.
- 간, 비장, 신장에서 미토콘드리아의 분리
- 600rpm에서 모터 구동 테프론 유봉을 사용하여 Elvehjem-Potter에서 4-6개의 위아래 스트로크로 균질화합니다.
- 균질화된 조직을 멸균 원심분리 튜브로 옮깁니다. 1,000 × g 의 스윙 로터에서 4 °C에서 5 분 동안 원심 분리기.
- 1.5mL 폴리프로필렌 튜브에 이전 단계에서 얻은 상층액을 채웁니다. 4°C의 미세분리기에서 16,000× g 으로 2분 동안 원심분리하고 이후에 설명된 대로 진행합니다(단계 1.13 - 1.15).
- 심장 및 근육 샘플에서 미토콘드리아의 분리
- 600rpm에서 모터 구동 테프론 유봉을 사용하여 Elvehjem-Potter에서 6-8 스트로크로 균질화합니다. 균질화된 조직을 멸균 원심분리 튜브로 옮깁니다.
- 1,000 × g 의 스윙 로터에서 4 °C에서 5 분 동안 원심 분리기. 상층액을 깨끗한 1.5mL 폴리프로필렌 튜브에 붓습니다.
참고: 2.6.2단계에서 얻은 펠릿의 두 번째 균질화는 미토콘드리아 수율을 높이기 위해 4-5개의 추가 스트로크와 1/2 부피의 균질화 완충액으로 수행할 수 있습니다. 새로운 상층액(4°C에서 5분 동안 1,000×g에서 다시 원심분리 후)은 2.6.3단계로 진행하기 전에 이전 상층액과 결합할 수 있습니다. 미토콘드리아 수율을 증가시키는 대안은 균질화 전에 트립신 용액에서 심장 및 근육 조직 샘플을 해리하는 것입니다36,37. 이 경우, 미토콘드리아 막이 디지토닌으로 용해되기 전에 트립신을 효율적으로 비활성화/제거해야 합니다(단계 3.2). - 미세 분리기에서 16,000 × g 으로 원심 분리하여 4 ° C에서 2 분 동안 원심 분리하여 미정제 미토콘드리아 분획을 얻습니다.
- 상층액을 버리고 각 미토콘드리아 농축 펠릿에 0.5mL의 완충액 AT를 재현탁시켜 두 튜브의 내용물을 하나로 결합하고 2.6.3단계에서 설명한 것과 동일한 조건에서 원심분리합니다. 모든 재료가 하나의 튜브에만 들어갈 때까지 동일한 과정을 반복합니다.
- 상층액을 버리고, 최종 펠릿에 300μL의 완충액 A(BSA 없음)를 재현탁하고, Bradford assay를 사용하여 미토콘드리아 단백질 농도를 정량화합니다. 이전과 같이 다시 원심분리기를 하고 섹션 3으로 진행합니다.
- 뇌에서 미토콘드리아의 분리
- 수동으로 구동되는 유리 유봉이 있는 Dounce 유형 유리 균질화기를 사용하여 10-15번의 스트로크로 뇌 조각을 균질화합니다. 균질화된 조직을 멸균 원심분리 튜브로 옮깁니다.
- 1,000 × g 의 스윙 로터에서 4 °C에서 5 분 동안 원심 분리기.
- 상층액을 깨끗한 원심분리기 튜브에 모읍니다.
- 이전 원심분리 단계에서 얻은 펠릿을 첫 번째 균질화에 사용된 동일한 부피의 매체 AT에 재현탁시킵니다. 5-10 패스를 사용하여 2.7.1 단계에서 설명 된 과정을 반복하여 펠릿을 다시 균질화하고 1,000 × g 의 스윙 로터에서 4 ° C에서 5 분 동안 현탁액을 원심 분리합니다.
- 상층액을 제거하고 2.7.3단계에서 준비한 튜브에 추가합니다. 10,000× g 의 고정각 로터에서 4°C에서 10분 동안 원심분리하여 미토콘드리아 분획을 얻습니다.
- 상층액을 버리고 펠릿을 매체 AT의 초기 균질화 부피(단계 2.7.1)의 1/2로 재현탁시킵니다. 미토콘드리아 현탁액을 깨끗한 1.5mL 폴리프로필렌 튜브에 분배하고 16,000× g 의 원심분리기를 4°C에서 2분 동안 미세분리기에 넣습니다.
- 상층액을 버리고 각 미토콘드리아 농축 펠릿에 0.5mL의 완충액 AT를 재현탁시켜 두 튜브의 내용물을 하나로 결합하고 2.7.6단계에서 설명한 것과 동일한 조건에서 원심분리합니다. 모든 재료가 하나의 튜브에만 들어갈 때까지 동일한 과정을 반복합니다.
- 상층액을 버리고, 최종 펠릿에 300μL의 완충액 A(BSA 없음)를 재현탁하고, Bradford assay를 사용하여 미토콘드리아 단백질 농도를 정량화합니다. 이전과 같이 다시 원심분리기를 하고 섹션 3으로 진행합니다.
- BAT에서 미토콘드리아의 분리
- 600rpm에서 모터 구동 테프론 유봉을 사용하여 Elvehjem-Potter에서 8-10번의 위아래 스트로크로 균질화합니다. 균질화된 조직을 멸균 원심분리 튜브로 옮깁니다.
- 1,000 × g 의 스윙 로터에서 4 °C에서 5 분 동안 원심 분리기.
- 1.5mL 폴리프로필렌 튜브에 상부 지방층을 피하면서 이전 단계에서 얻은 상층액을 채웁니다.
참고: 2.8.2단계에서 얻은 펠릿의 두 번째 균질화를 수행하여 미토콘드리아 수율을 높일 수 있습니다. 새로운 상층액(4°C에서 5분 동안 1,000× g 에서 다시 원심분리 후)은 2.8.4단계로 진행하기 전에 이전 상층액과 결합할 수 있습니다. - 16,000 × g 에서 2분 동안 원심분리기, 4 °C의 미세분리기에서 2분 동안 원심분리.
- 상층액을 버리고 각 미토콘드리아 농축 펠릿에 0.5mL의 완충액 AT2를 재현탁시켜 두 튜브의 내용물을 하나로 결합하고 2.8.4단계에서 설명한 것과 동일한 조건에서 원심분리합니다. 모든 재료가 하나의 튜브에만 들어갈 때까지 동일한 과정을 반복합니다.
- 상층액을 버리고, 최종 펠릿에 300μL의 완충액 A(BSA 없음)를 재현탁하고, Bradford assay를 사용하여 미토콘드리아 단백질 농도를 정량화합니다. 이전과 같이 다시 원심분리기를 하고 섹션 3으로 진행합니다.
3. 블루 네이티브 분석을 위한 시료 준비
- BN 샘플 완충액(50mM NaCl, 50mM 이미다졸, 5mM 아미노카프로산, 4mM PMSF)에 미토콘드리아 분획(포유류 세포 배양 또는 조직에서 얻음)을 재현탁시켜 약 10mg/mL의 단백질 농도를 얻습니다. 다양한 유형의 샘플에 대한 예상 수율에 대해서는 표 2 를 참조하십시오.
- 디지토닌(10% 원액)을 첨가하여 디지토닌 4g/미토콘드리아 단백질 g의 비율(단계 3.1에서 제조한 미토콘드리아 현탁액 10μL에 디지토닌 10% 원액 4μL)을 얻어 미토콘드리아 막을 가용화시킵니다.
참고: 세제 대 단백질 비율(g/g)은 재현 가능한 결과를 얻기 위해 각 유형의 샘플에 대해 최적화되어야 합니다. 2-8g의 디지토닌/g의 미토콘드리아 단백질은 대부분의 조직에 최적인 것으로 밝혀졌습니다34,35. - 위아래로 부드럽게 피펫팅하여 혼합합니다. 샘플을 얼음 위에서 5분 동안 배양합니다.
참고: 이 단계가 끝나면 미토콘드리아 현탁액이 더 선명해져야 합니다(불투명에서 반투명으로 이동). 그렇지 않으면 세제의 양이 올바른 멤브레인 용해에 충분하지 않음을 나타낼 수 있습니다. - 미세분리기(약 20,000× g )에서 4°C에서 25분 동안 최고 속도로 원심분리하여 불용성 물질을 제거합니다.
- 새 튜브에 상층액을 수집합니다. 상청액에 초기 재현탁 부피의 1/3에 해당하는 5% G-250(Coomassie Blue G-250 5% in 0.75M aminocaproic acid)을 첨가하고(단계 3.1, 이는 Coomassie 1.6g/단백질 g의 최종 비율에 해당) 피펫팅으로 혼합합니다.
- 겔에 로딩하기 전에 얼음에 보관하거나 -80 °C에서 부분 표본을 동결하십시오.
4. 블루 네이티브 겔 전기영동
알림: 전기 영동은 냉장실(4-8 °C)에서 수행됩니다. 냉장실 시설이 없는 경우 전기영동 탱크에 냉각 블록을 도입할 수 있습니다. 상업적인 3-13% 본래 polyacrylamide 젤29는 이용되고, 그러나 원하는 구배 농도의 집에서 만드는 젤은 또한 이용될 수 있다38,39.
- 상부 챔버와 하부 챔버에 각각 cold cathode A와 anode buffers를 로드합니다. 또는 상부 챔버를 음극 완충액 A로 조심스럽게 채우기 전에 샘플을 웰에 로드합니다.
참고: 상업용 전기영동 버퍼는 당사 실험실에서 사용되지만 표 1에 표시된 대로 준비할 수 있습니다. - 30에서 100 μg 사이의 미토콘드리아 단백질을 로드합니다.
참고: 일반적으로 30-50μg의 단백질(WB의 경우) 또는 40-100μg의 단백질(IGA의 경우)이 10레인 겔(0.5 x 0.15cm 웰)에 웰당 로드됩니다. 음극 A 완충액은 Coomassie Blue G-250을 함유하고 있으며 강렬한 파란색을 띠고 있어 시료 로딩을 위한 겔 웰을 보기 어렵습니다. 예를 들어, 이 단계에서 피펫 팁을 배치하는 데 도움이 되도록 각 웰의 중앙을 빨간색 마커로 표시하는 것이 편리합니다. 네이티브 분자량 마커는 그래디언트 겔이 적절하게 형성되었고 복합체 및 SC 패턴이 올바른 패턴인지 확인하기 위해 BN-PAGE 기법을 설정할 때 유용할 수 있습니다. - 80-100V에서 25-30분 동안 실행한 다음 160-180V에서 실행하여 염료가 겔 바닥에 도달할 때까지(총 ~125-165분) 전류를 12mA/겔로 제한합니다.
- 겔 내 활성 분석(IGA)을 수행해야 하는 경우 염료 전면이 겔 중앙에 있을 때(실행 시작 후 ~1시간) 음극 완충액 A를 음극 완충액 B로 대체합니다.
참고 : G-250 염료에 대한 결합으로 인해 일부 밴드 (주로 복합체 V, ~ 600kDa의 MW를 가진 "내부"제조업체로 간주 될 수있는 복합체 V)가 보이기 때문에 겔을 실행 직후에 염색없이 문서화 할 수 있지만 일반적으로 SC 및 개별 복합체는 염색 또는 IGA 분석 없이는 보이지 않습니다. IGA 분석 또는 WB에 사용되는 겔은 염색되거나 고정되어서는 안 됩니다. - 카세트에서 겔을 분해하고 Coomassie blue 염색(섹션 5), IGA 분석(섹션 6) 또는 WB 면역 검출(섹션 7)을 계속합니다.
5. 겔 염색
- Coomassie 파란색 염료 용액을 사용하여 실온(RT)에서 10-15분 동안 겔을 염색합니다(40% 메탄올, 10% 아세트산에 0.25%의 Coomassie 염료 R-15, 10-15분 동안 염색).
- RT에서 40% 메탄올과 10% 아세트산으로 여러 번 세척(일반적으로 4-5 x 15분)하여 탈색합니다.
- 겔을 문서화합니다.
6. 겔 활성(IGA) 분석
- 전기영동이 끝나기 전에 다양한 호흡기 복합체의 분석을 위한 IGA 용액을 준비하고 어두운 곳에서 유지합니다(예: 어두운 색상의 플라스틱 상자를 사용하거나 알루미늄 호일로 덮음). 각 버퍼의 구성은 표 1에 자세히 설명되어 있습니다.
- 사용할 젤이나 레인을 수용할 수 있도록 가능한 한 작은 플라스틱 상자에 넣으십시오.
- 겔을 덮을 수 있을 만큼 충분한 양의 적절한 용액을 추가하고(보통 5 또는 10 겔 레인의 경우 각각 5 또는 10mL) 빛에서 멀리 떨어진 곳에서 부드럽게 흔들며(60-80rpm) 배양합니다.
참고: 배양 시간은 분석할 복합체와 로드된 샘플의 특성 및 양에 따라 다릅니다. CI와 CIV는 가장 쉽고 빠르게 결과를 제공합니다. 따라서 CI 활동은 일반적으로 몇 분 후에 보이기 시작하는 반면 CII 및 CIV는 관찰하는 데 ~ 30 분이 필요하고 CV는 ~ 1.5-2 시간이 필요합니다. 반응은 모든 경우에 몇 시간 동안 계속될 수 있으며 예를 들어 야간(ON) 배양을 위해 배양을 차가운 방(4-6°C)으로 이동하여 신호 강화 속도를 줄일 수 있습니다. CIII 활성은 BN34가 아닌 투명한 천연 전기영동(CN)에 대해서만 작동합니다. - 적절한 밴드가 생기면 분석 용액을 제거하고 증류수로 2 배 세척 한 다음 40 % 메탄올과 10 % 아세트산 (메탄올로만 고정 된 CV 제외)으로 겔을 30 분 동안 고정하여 반응을 중지합니다.
- IGA에 의한 CI 검출 후 CIV 활성을 분석하려면 겔을 증류수로 2번 세척하고, CI 활성을 문서화하고, 겔을 50mM 인산칼륨 완충액(pH 7.2)으로 30분 동안 2회 배양한 다음, 복합 IV 띠가 나타날 때까지(일반적으로 RT 또는 4°C에서 배양하여) 완전한 CIV 반응 완충액으로 배양합니다.
- 겔을 문서화합니다.
참고: ATPase 활동의 경우, 현상된 띠가 흰색이므로 겔을 문서화할 때 투명 띠가 보이도록 어두운 배경에 놓으십시오.
7. 웨스턴 블롯 분석
- 표 1에 따라 전사 버퍼를 준비하고 전기영동이 끝날 때까지 4°C에서 유지한다.
- 겔을 트레이에 넣고 전사 버퍼를 추가합니다. 상온에서 10-15분 동안 배양합니다.
- 겔과 같은 크기의 PVDF 멤브레인 조각을 자르고 교반 하에 10초 동안 메탄올에서 활성화시킵니다. 증류수로 여러 번 세척하고 전사 완충액을 추가합니다. RT에서 10-15분 동안 부드럽게 흔들어 배양합니다.
- 젤과 멤브레인 사이에 기포가 생기지 않도록 전사 샌드위치를 카세트의 검은색 면-스폰지-블로팅 페이퍼-젤-멤브레인 블로팅 페이퍼-스폰지-카세트의 투명한 면 순서로 준비합니다.
- 카세트를 닫고 잠근 다음 샌드위치를 이송을 위한 올바른 방향(검은색 면이 음극을 향함)으로 이송 탱크에 넣습니다.
- 이송 탱크에 이송 버퍼를 채우고, 자기 교반기를 추가하여 버퍼를 교반하고, 전원 공급 장치를 80시간 동안 2V 또는 100V에서 1시간 동안 연결합니다. 4에서 8 °C 사이 (예 : 냉장실) 및 이송 시스템의 냉각 블록을 사용하여 이송을 수행하십시오.
- 멤브레인을 회수하고 검출할 다양한 호흡기 복합체에 대한 특정 항체를 사용하여 표준 웨스턴 블롯 프로토콜을 계속합니다29.
결과
위에서 설명한 프로토콜에 따라 얻어진 미토콘드리아의 수율은 세포주 또는 조직 유형, 샘플의 특성(즉, 신선 또는 냉동 조직이 사용되는 경우) 또는 균질화 공정의 효율성과 같은 여러 요인에 따라 달라집니다. 다른 세포주와 조직에서 얻은 미토콘드리아의 예상 수율은 표 2에 수집되어 있습니다. 미토콘드리아 분획이 얻어지면 다음 단계는 호흡기 SC 패턴 분석으로, BN-PAGE에 의한 미토콘드리아 샘플 용해화 및 전기영동 분리 후 IGA 분석 또는 WB 면역검출 후 수행됩니다. 그림 1 은 실행 직후 염색되지 않은 겔 레인의 양상과 배양된 세포주와 마우스 간 미토콘드리아 샘플의 표준 Coomassie 염색 후 띠 패턴을 보여줍니다.
그림 2A,B에서는 IGA 분석을 사용한 후 인간 세포와 마우스 세포의 SC 조립 패턴 간의 명확한 차이를 관찰할 수 있습니다. 따라서 유리 복합체 I은 마우스 세포에서 관찰되는 반면 인간 미토콘드리아에서는 검출되지 않습니다. 복합 IV-IGA 패턴은 두 인간 세포주에서 매우 유사하며(그림 2B) 그림 2A에서 분석된 두 마우스 세포주 간의 차이를 나타냅니다. 이러한 차이는 BL6 세포가 SCAF18의 돌연변이 변이체를 발현한다는 사실에 기인합니다.
작은 샘플에 대해 작업하기 위해 여기에 설명된 미토콘드리아 분리를 위한 프로토콜로 수득된 SC 패턴은 더 큰 샘플에 사용되는 "종래의" 프로토콜과 관련하여 유지됩니다. 이는 그림 2C에서 볼 수 있으며, 레인 1 및 6(간 3g과 BAT 1.1g에서 기존 프로토콜을 사용하여 미토콘드리아 분리 후 획득)과 각각 레인 2 및 5(여기에 제시된 프로토콜을 사용하여 두 조직의 약 0.1g에서 얻음)를 비교함으로써 볼 수 있습니다. 가소성 모델에서 제안된 바와 같이, 호흡기 복합체와 SC의 상대적 비율은 세포 유형과 대사 상태에 따라 달라집니다. 그림 2C,D에서 보인 바와 같이, 다른 조직은 다른 SC 집합 유형을 보여줍니다. 따라서 뇌 미토콘드리아는 다른 조직과 비교할 때 유리 복합체 I 수준이 매우 낮고 SC의 비율이 높으며, BAT는 CV 수치가 낮고(그림 2A) SC III + IV(그림 2D)가 높은 것이 특징입니다. 심장 미토콘드리아는 높은 수준의 SC와 CV를 나타내며, CV 조립 패턴은 배양된 세포주와 마우스 간 미토콘드리아 샘플 간에 매우 유사합니다(그림 2E).
SC 어셈블리는 또한 비장 제어 및 종양 세포에서 얻은 두 개의 샘플에 대해 그림 3 과 같이 WB로 분석할 수 있습니다. 이 경우 30-50μg의 미토콘드리아 단백질은 일반적으로 특정 항체를 가진 다양한 복합체 및 SC를 검출하기에 충분합니다. 그림 4 는 이러한 프로토콜을 적용하는 동안 발생할 수 있는 몇 가지 주요 위험을 보여줍니다. 잘못된 겔 그래디언트는 그림 4A, 레인 1에서와 같이 비정상적이고 원치 않는 이동 패턴을 생성할 수 있으며, 여기서 SC는 겔의 아크릴아마이드 농도가 정상보다 높기 때문에 레인 상부의 웰 가까이에 남아 있습니다. 고온(여기서는 37°C 및 40°C에서 10분 동안)에서 비교적 짧은 시간 동안이라도 시료를 배양하면 SC와 CI가 분해됩니다(그림 4A 레인 2-4). 마찬가지로, 세제 대 단백질 비율은 좋은 결과와 적절한 겔 분리능에 매우 중요합니다. 디지토닌 2g/단백질 g의 비율 이하에서는 띠 분리능이 점진적으로 감소하고 더 낮은 농도(0.5g/g)에서는 SC에 해당하는 영역의 도말만 볼 수 있습니다(그림 4B).

그림 1: 배양 세포주(L929Balbc)와 마우스 간에서 디지토닌 투과화된 미토콘드리아를 BNGE로 분리한 후 미토콘드리아 복합체 및 초복합체의 패턴. 왼쪽의 레인(1과 2)은 CV만 검출할 수 있는 런 직후의 염색되지 않은 겔의 측면을 나타내고, 오른쪽의 레인(3과 4)은 Coomassie 염색 후 밴드의 패턴을 보여줍니다. 약어: BNGE = 블루 네이티브 겔 전기영동; CV = 복소수 V; SCs = 초복합체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
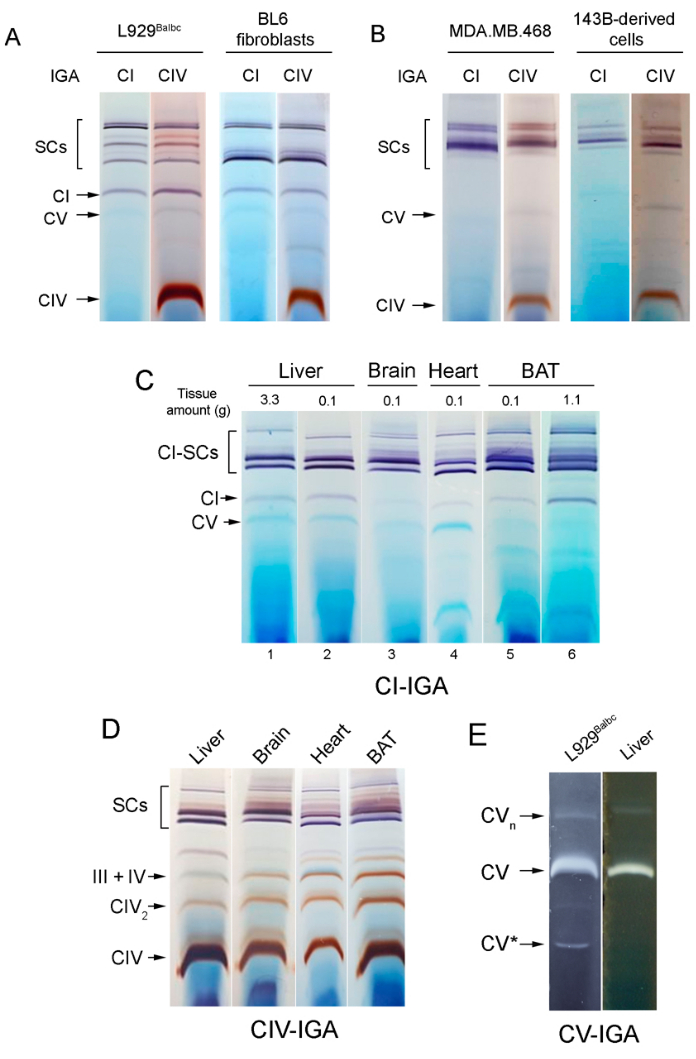
그림 2: 다양한 세포주와 마우스 조직에서 분리한 미토콘드리아의 IGA 분석. (A,B) (A) 마우스 또는 (B) 인간 세포주에서 분리된 미토콘드리아에서 표시된 복합체의 겔 내 활성. L929Balbc는 앞서 설명한 바와 같이 Balb/cJ 마우스 혈소판의 미토콘드리아를 ρ°L929neo 세포로 전달하여 당사 실험실에서 생성된 투과연골 세포주입니다40,41. BL6 섬유아세포는 BL6 마우스의 귀 생검을 통해 우리 실험실에서 생성된 불멸화된 세포주입니다. (C) 3g의 간(1번 레인)과 1.1g의 BAT(6번 레인)로 시작하는 기존 방법 또는 여기에 제시된 프로토콜을 사용하여 분리한 마우스 미토콘드리아의 CI-IGA 패턴은 모든 경우(2번 레인, 간, 3번 레인, 심장, 4번 레인, 뇌 및 5번 BAT)로 시작합니다. (D) 마우스 간, 심장, 뇌 및 BAT 미토콘드리아의 CIV-IGA 패턴(패널 2C, 레인 2-5에 표시된 CI-IGA 후 수행). (E) 마우스 배양 세포 및 간에서 분석된 CV-IGA 활성. 레인당 약 60-75μg의 미토콘드리아 단백질이 로드되었습니다. 약어 : IGA = in-gel activity; SC = 초복합체; CI = 복합체 I; BAT = 갈색 지방 조직. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
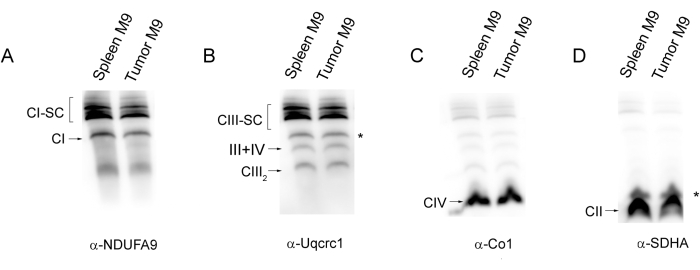
그림 3: 비장 샘플에서 다양한 미토콘드리아 복합체 및 초복합체의 WB 면역검출. 비장 대조군(Spleen M9) 및 종양(Tumor M9) 샘플에서 얻은 미토콘드리아 복합체 및 SC의 Blue Native PAGE 분리 후, 이를 PVDF 멤브레인으로 옮기고 표시된 CI, CIII, CIV 및 CII 소단위(각각 패널 A-D)를 인식하는 항체와 순차적으로 혼성화했습니다. 레인당 약 50μg의 미토콘드리아 단백질이 로드되었습니다. 별표는 이전 웨스턴 블롯에서 남아 있는 신호를 나타냅니다. 약어: SC = 초복합체; CI = 복합체 I; CIII = 복합체 III; CIV = 복합체 IV; CII = 복합 II. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: Blue-Native PAGE에 의한 SC 분석의 함정. 서로 다른 가용화 조건에서 (A) 신선한 쥐 간과 (B) 냉동 쥐 간에서 분리한 미토콘드리아의 CI IGA 분석. (A) 레인 1, 잘못된 겔 구배 농도(정상 8-3% 대신 13-13%). 레인 2-4, 로딩 전에 각각 얼음 위에서 또는 37°C 및 40°C에서 10분 동안 배양된 샘플. (B) 용해화를 위해 다른 디지토닌/단백질 비율을 사용하여 냉동된 쥐 간에서 얻은 미토콘드리아의 CI에 대한 IGA 후 패턴. 약어: SC = 초복합체; PAGE = 폴리아크릴아미드 겔 전기영동; CI = 복합체 I; IGA = 겔 내 활성. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 보통 | 구성 | ||
| 하이포토닉 버퍼(Hypotonic buffer) | 10 mM 걸레, 83 mM 자당, pH 7.2 | ||
| 하이퍼토닉 완충액 | 30mM 걸레, 250mM 자당, pH 7.2 | ||
| 균질화 완충액 A | 10 mM 트리스, 1 mM EDTA, 0.32 M 자당, pH 7.4 | ||
| 균질화 완충액 AT | 225 mM 만니톨, 1 mM EGTA, 75 mM 자당, 0.01% BSA pH 7.4 | ||
| 균질화 완충액 AT2 | 225 mM 만니톨, 1 mM EGTA, 75 mM 자당, 0.02% BSA pH 7.4 | ||
| BN 시료 완충액 | 50mM NaCl, 50mM 이미다졸, 2mM 아미노카프로산, 1mM EDTA pH 7.0 | ||
| Digitonin 솔루션 | 50mM NaCl, 50mM 이미다졸, 5mM 아미노카프로산, 4mM PMSF에서 10% 디지토닌 | ||
| BN 로딩 버퍼 | 0.75M 아미노카프로산에 함유된 5% Coomassie Blue G | ||
| BN 음극 버퍼 A | 50mM 트리신, 15mM 비스-트리스 pH = 7.0 (4 °C), 0.02 % G-250 (쿠마시 브릴리언트 블루 G-250) | ||
| BN 음극 버퍼 B | 50 mM 트리신, 15 mM 비스-트리스 pH = 7.0 (4 ° C), 0.002 % G-250 | ||
| BN 양극 버퍼 | 50mM 비스-트리스, pH=7.0 | ||
| 복합체 I IGA 기판 | 5mM Tris-HCl pH 7.4, 0.1mg/mL NADH, 2.5mg/mL 니트로블루 테트라졸륨(NBT) | ||
| 복합체 II IGA 기판 | 50mM 인산칼륨 완충액 pH 7.4, 20mM 숙신산나트륨, 0.2mM 페나진 메토설페이트(PMS), 2.5mg/mL NBT | ||
| 복합체 III IGA 기판 | 50mM 인산칼륨 완충액 pH 7.2, 0.05% 디아미노벤지딘(DAB) | ||
| 복합체 IV IGA 기질 | CIII 및 50μM 사이토크롬 c와 동일한 솔루션 | ||
| 복합체 V IGA 기판 | 35 mM 트리스, 270 mM 글리신 pH 8.3, 14 mM MgSO4, 0.2 % Pb (NO3) 2, 8 mM ATP | ||
| 염색 용액 | Coomassie 염료 R-250은 40 % 메탄올 및 10 % 아세트산에서 0.25 % | ||
| 탈색/정착 용액 | 40% 메탄올, 10% 아세트산 | ||
| 전송 버퍼 | 48 mM 트리스, 39 mM 글리신, 20 % 메탄올 | ||
표 1: 버퍼 및 미디어 구성.
| 세포 유형/조직 | 시작 금액 | 예상 수율(μg 미토콘드리아 단백질) | 레인 수(50-60 μg/lane) |
| 배양된 세포 | |||
| MDA-MB-468 (영어) | 100μL vpc | 300-400 마이크로그램 | 6-9 |
| 143B 파생 | 100μL vpc | 200-350 마이크로그램 | 4-7 |
| 마우스 섬유아세포(Mouse Fibroblasts) | 100μL vpc | 150-200 마이크로그램 | 3-5 |
| 심장 | 100의 mg의 | 400-500 마이크로그램 | 10-12* |
| 골격근 | 100의 mg의 | 300-400 마이크로그램 | 8-10* |
| 간 | 100의 mg의 | 400-500 마이크로그램 | 8-10 |
| 지라 | 50의 mg의 | 150-250 마이크로그램 | 3-5 |
| 박쥐 | 100의 mg의 | 200-300 마이크로그램 | 4-6 |
| 뇌 | 100의 mg의 | 250-300 마이크로그램 | 5-8 |
표 2: 다양한 세포 유형 및 마우스 조직에서 얻은 미토콘드리아의 예상 수율. 심장이나 골격근에서 얻은 미토콘드리아 분획은 다른 조직에서 얻은 것보다 더 순수합니다. 따라서, 더 적은 양이 겔(*)에 적재될 수 있다.
토론
여기에 설명된 프로토콜에 도입된 방법론적 조정은 미토콘드리아 복합 활성(충분한 양의 샘플의 가용성이 저하될 때 중요함)을 유지하고 조직 또는 세포주의 예상되는 SC 패턴을 재현하면서 손실을 피하고 수율을 높이기 위한 것입니다( 그림 2C 참조).). 이러한 목적으로 SC를 제대로 검출하는 데 높은 미토콘드리아 순도가 필요하지 않기 때문에 가능할 때마다 단계 수, 시간 및 부피를 줄였습니다.
따라서, 저속 원심분리에 의한 핵 및 파괴되지 않은 세포의 균질화 및 제거 후, 미토콘드리아를 포함하는 상층액은 1.5mL 폴리프로필렌 튜브로 전달되고, 조잡한 미토콘드리아 분획을 얻기 위한 후속 원심분리는 기존 프로토콜에 비해 속도를 높이고 시간 및 부피를 줄임으로써 미세분리기에서 수행됩니다. 이를 통해 상대적으로 짧은 시간에 여러 샘플을 처리 할 수 있습니다 : 면밀한 추정은 10 개의 샘플을 ~ 2-2.5 시간 내에 처리 할 수 있다는 것입니다 (균질화 시작 (프로토콜 단계 1.6. 또는 조직에 대한 동등성) 겔에 적재 준비가된 SCs 분획의 집착 (프로토콜 단계 3.7) 활동을 유지하면서 손실을 최소화합니다. 원래 Schägger의 그룹 프로토콜과 관련된 또 다른 변화는 SCs 분획의 폐쇄를 멤브레인 용해화 후 초원심분리 단계를 간단한 미세분리 원심분리(프로토콜 단계 3.4)로 대체하는 것입니다.
절차에는 몇 가지 중요한 단계가 있습니다. 첫째, 세포 파괴의 효율성, 특히 배양 세포의 경우(프로토콜 단계 1.8 이후의 참고 참조) 및 특히 작은 세포의 경우. 조직과 세포주는 세포 파괴에 있어 다양한 난이도를 나타냅니다: 예를 들어, 심장과 근육에서 이 단계는 일반적으로 간이나 비장보다 덜 효율적이지만, 전자가 더 높은 미토콘드리아 함량을 가지고 있기 때문에 수율로 보상됩니다. 근육이나 심장에서 분리할 때 미토콘드리아 수율을 향상시키는 한 가지 대안은 균질화 전에 샘플에 트립신을 투여하는 것입니다. 뇌는 수동 균질화로 인해 세포 파괴 효율이 낮은 또 다른 조직으로, 이는 더 온화하고 덜 효율적이며, 이전에 보고된 바와 같이 이 조직의 세포 유형 변동이 더 높기 때문일 수도 있습니다 42. 이는 프로토콜(2.7.4단계)에서 제안한 대로 두 번째 균질화 단계로 부분적으로 보상할 수 있습니다. 반면에, 세포 파손이 과도하면 SC를 포함하는 최종 샘플이 전기 영동 작동을 방해할 수 있는 핵 DNA 단편으로 오염될 수 있습니다. 이 문제는 미토콘드리아 막을 용해시키기 위해 디지토닌을 첨가할 때 샘플의 점도가 증가하는 것으로 나타나며 DNAse I로 처리하여 해결할 수 있습니다.
둘째, 세제 대 단백질 비율이 너무 낮으면 멤브레인 용해의 효율성이 떨어지고 응집체 형성이 가능해집니다. 이는 겔에서 고분자량 SC에서 불량한 분리능으로 나타나거나( 그림 4 참조) 올리고머(43)에 해당하는 여러 밴드를 제공하는 CIV로 나타날 수 있습니다. 비율이 너무 높으면 SC(주로 CI-SC)의 세분화로 이어질 수 있습니다. 셋째, 전체 절차 동안 샘플을 가열하지 않고( 그림 4 참조) SC 조립 상태에 영향을 줄 수 있으므로 반복적인 동결-해동 주기를 피하는 것이 중요합니다.
표 2에서는 여러 세포 유형 및 조직 샘플에 대한 예상 수율의 요약을 제시합니다. 값은 근사치이며 셀 파괴 효율과 소스의 특성에 따라 달라집니다. 조직의 경우, 출발 물질이 동결되면 신선한 샘플보다 더 높은 수율을 제공하는 경향이 있습니다. 로딩할 수 있는 레인의 수(레인당 50-60μg의 미토콘드리아 단백질 부하를 고려)의 추정치가 제시됩니다.
여기에 제시된 프로토콜은 작은 변형으로 다양한 조직 및 세포 유형을 다루며, 신선 또는 냉동 샘플과 함께 사용할 수 있으며, 값비싼 정제 키트 또는 그래디언트를 사용하지 않고 간단한 장비와 상대적으로 저렴한 비용이 필요합니다. 그러나 예를 들어 뇌 시냅스 미토콘드리아 또는 근육 근막하 미토콘드리아와 같은 특정 미토콘드리아 집단이 분석 대상인 경우뿐만 아니라 특정 세포 유형 또는 샘플에 사용하기 위해 몇 가지 조정이 필요할 수 있습니다.
정확한 생리학적 역할과 병리학적 상황에서 SC의 잠재적 관여는 아직 정의되지 않았기 때문에 SC의 역학과 SC의 조립, 안정성 및 기능에 영향을 미치는 요인에 대한 분석이 필요합니다. 당사의 프로토콜은 특히 여러 실험 조건을 비교해야 하는 경우, 작은 샘플 크기와 다양한 세포 유형 및 조직에서 SC 패턴에 대해 재현 가능한 결과를 얻을 수 있는 귀중한 도구가 될 수 있습니다29.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 https://ciencia.sede.gob.es/(Ministerio de Ciencia e Innovación)의 보조금 번호 "PGC2018-095795-B-I00"과 https://www.aragon.es/(Diputación General de Aragón)의 보조금 "Grupo de Referencia: E35_17R" 및 보조금 번호 "LMP220_21"를 통해 PF-S 및 RM-L에 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid | PanReac | 131008 | |
| Aminocaproic acid | Fluka Analytical | 7260 | |
| ATP | Sigma-Aldrich | A2383 | |
| Bis Tris | Acrons Organics | 327721000 | |
| Bradford assay | Biorad | 5000002 | |
| Coomassie Blue G-250 | Serva | 17524 | |
| Coomassie Blue R-250 | Merck | 1125530025 | |
| Cytochrome c | Sigma-Aldrich | C2506 | |
| Diamino benzidine (DAB) | Sigma-Aldrich | D5637 | |
| Digitonin | Sigma-Aldrich | D5628 | |
| EDTA | PanReac | 131669 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Fatty acids free BSA | Roche | 10775835001 | |
| Glycine | PanReac | A1067 | |
| Homogenizer Teflon pestle | Deltalab | 196102 | |
| Imidazole | Sigma-Aldrich | I2399 | |
| K2HPO4 | PanReac | 121512 | |
| KH2PO4 | PanReac | 121509 | |
| Mannitol | Sigma-Aldrich | M4125 | |
| Methanol | Labkem | MTOL-P0P | |
| MgSO4 | PanReac | 131404 | |
| Mini Trans-Blot Cell | BioRad | 1703930 | |
| MOPS | Sigma-Aldrich | M1254 | |
| MTCO1 Monoclonal Antibody | Invitrogen | 459600 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NADH | Roche | 10107735001 | |
| NativePAGE 3 to 12% Mini Protein Gels | Invitrogen | BN1001BOX | |
| NativePAGE Cathode Buffer Additive (20x) | Invitrogen | BN2002 | |
| NativePAGE Running Buffer (20x) | Invitrogen | BN2001 | |
| NDUFA9 Monoclonal Antibody | Invitrogen | 459100 | |
| Nitroblue tetrazolium salt (NBT) | Sigma-Aldrich | N6876 | |
| Pb(NO3)2 | Sigma-Aldrich | 228621 | |
| PDVF Membrane | Amersham | 10600023 | |
| Phenazine methasulfate (PMS) | Sigma-Aldrich | P9625 | |
| Pierce ECL Substrate | Thermo Scientific | 32106 | |
| PMSF | Merck | PMSF-RO | |
| SDHA Monoclonal Antibody | Invitrogen | 459200 | |
| Sodium succinate | Sigma-Aldrich | S2378 | |
| Streptomycin/penicillin | PAN biotech | P06-07100 | |
| Sucrose | Sigma-Aldrich | S3089 | |
| Tris | PanReac | A2264 | |
| UQCRC1 Monoclonal Antibody | Invitrogen | 459140 | |
| XCell SureLock Mini-Cell | Invitrogen | EI0001 |
참고문헌
- Acin-Perez, R., Fernandez-Silva, P., Peleato, M. L., Perez-Martos, A., Enriquez, J. A. Respiratory active mitochondrial supercomplexes. Mol Cell. 32 (4), 529-539 (2008).
- Schagger, H., Pfeiffer, K. Supercomplexes in the respiratory chains of yeast and mammalian mitochondria. EMBO J. 19 (8), 1777-1783 (2000).
- Schagger, H., Pfeiffer, K. The ratio of oxidative phosphorylation complexes I-V in bovine heart mitochondria and the composition of respiratory chain supercomplexes. J Biol Chem. 276 (41), 37861-37867 (2001).
- Acin-Perez, R., Enriquez, J. A. The function of the respiratory supercomplexes: the plasticity model. Biochim Biophys Acta. 1837 (4), 444-450 (2014).
- Cogliati, S., Cabrera-Alarcon, J. L., Enriquez, J. A. Regulation and functional role of the electron transport chain supercomplexes. Biochem Soc Trans. 49 (6), 2655-2668 (2021).
- Genova, M. L., Lenaz, G. Functional role of mitochondrial respiratory supercomplexes. Biochim Biophys Acta. 1837 (4), 427-443 (2014).
- Kohler, A., Barrientos, A., Fontanesi, F., Ott, M. The functional significance of mitochondrial respiratory chain supercomplexes. EMBO Rep. 24 (11), e57092 (2023).
- Lapuente-Brun, E., et al. Supercomplex assembly determines electron flux in the mitochondrial electron transport chain. Science. 340 (6140), 1567-1570 (2013).
- Milenkovic, D., et al. Preserved respiratory chain capacity and physiology in mice with profoundly reduced levels of mitochondrial respirasomes. Cell Metab. 35 (10), 1799-1813 (2023).
- Vercellino, I., Sazanov, L. A. The assembly, regulation and function of the mitochondrial respiratory chain. Nat Rev Mol Cell Biol. 23 (2), 141-161 (2022).
- Moreno-Loshuertos, R., Fernández-Silva, P., Ostojic, S. . Clinical Bioenergetics. , 3-60 (2021).
- Fernandez-Vizarra, E., Ugalde, C. Cooperative assembly of the mitochondrial respiratory chain. Trends Biochem Sci. 47 (12), 999-1008 (2022).
- Javadov, S., Jang, S., Chapa-Dubocq, X. R., Khuchua, Z., Camara, A. K. S. Mitochondrial respiratory supercomplexes in mammalian cells: structural versus functional role. Journal of Molecular Medicine. 99 (1), 57-73 (2021).
- Lopez-Fabuel, I., et al. Complex I assembly into supercomplexes determines differential mitochondrial ROS production in neurons and astrocytes. Proc Natl Acad Sci U S A. 113 (46), 13063-13068 (2016).
- Mukherjee, S., Ghosh, A. Molecular mechanism of mitochondrial respiratory chain assembly and its relation to mitochondrial diseases. Mitochondrion. 53, 1-20 (2020).
- Nesci, S., et al. Molecular and supramolecular structure of the mitochondrial oxidative phosphorylation system: implications for pathology. Life (Basel). 11 (3), 242 (2021).
- Frenzel, M., Rommelspacher, H., Sugawa, M. D., Dencher, N. A. Ageing alters the supramolecular architecture of OxPhos complexes in rat brain cortex. Exp Gerontol. 45 (7-8), 563-572 (2010).
- Morant-Ferrando, B., et al. Fatty acid oxidation organizes mitochondrial supercomplexes to sustain astrocytic ROS and cognition. Nat Metab. 5 (8), 1290-1302 (2023).
- McKenzie, M., Lazarou, M., Thorburn, D. R., Ryan, M. T. Mitochondrial respiratory chain supercomplexes are destabilized in Barth Syndrome patients. J Mol Biol. 361 (3), 462-469 (2006).
- Rosca, M. G., et al. Cardiac mitochondria in heart failure: decrease in respirasomes and oxidative phosphorylation. Cardiovasc Res. 80 (1), 30-39 (2008).
- Ramirez-Camacho, I., Garcia-Nino, W. R., Flores-Garcia, M., Pedraza-Chaverri, J., Zazueta, C. Alteration of mitochondrial supercomplexes assembly in metabolic diseases. Biochim Biophys Acta Mol Basis Dis. 1866 (12), 165935 (2020).
- Gonzalez-Rodriguez, P., et al. Disruption of mitochondrial complex I induces progressive parkinsonism. Nature. 599 (7886), 650-656 (2021).
- Novack, G. V., Galeano, P., Castano, E. M., Morelli, L. Mitochondrial supercomplexes: physiological organization and dysregulation in age-related neurodegenerative disorders. Front Endocrinol (Lausanne). 11, 600 (2020).
- Ramirez-Camacho, I., Flores-Herrera, O., Zazueta, C. The relevance of the supramolecular arrangements of the respiratory chain complexes in human diseases and aging. Mitochondrion. 47, 266-272 (2019).
- Hollinshead, K. E. R., et al. Respiratory Supercomplexes Promote Mitochondrial Efficiency and Growth in Severely Hypoxic Pancreatic Cancer. Cell Rep. 33 (1), 108231 (2020).
- Ikeda, K., et al. Mitochondrial supercomplex assembly promotes breast and endometrial tumorigenesis by metabolic alterations and enhanced hypoxia tolerance. Nat Commun. 10 (1), 4108 (2019).
- Kamada, S., Takeiwa, T., Ikeda, K., Horie, K., Inoue, S. Emerging roles of COX7RP and mitochondrial oxidative phosphorylation in breast cancer. Front Cell Dev Biol. 10, 717881 (2022).
- Marco-Brualla, J., et al. Mutations in the ND2 subunit of mitochondrial complex I are sufficient to confer increased tumorigenic and metastatic potential to cancer cells. Cancers (Basel). 11 (7), 1027 (2019).
- Moreno-Loshuertos, R., et al. How hot can mitochondria be? Incubation at temperatures above 43 degrees C induces the degradation of respiratory complexes and supercomplexes in intact cells and isolated mitochondria. Mitochondrion. 69, 83-94 (2023).
- Vonck, J., Schafer, E. Supramolecular organization of protein complexes in the mitochondrial inner membrane. Biochim Biophys Acta. 1793 (1), 117-124 (2009).
- Althoff, T., Mills, D. J., Popot, J. L., Kuhlbrandt, W. Arrangement of electron transport chain components in bovine mitochondrial supercomplex I1III2IV1. EMBO J. 30 (22), 4652-4664 (2011).
- Cogliati, S., et al. Mechanism of super-assembly of respiratory complexes III and IV. Nature. 539 (7630), 579-582 (2016).
- Gonzalez-Franquesa, A., et al. Mass-spectrometry-based proteomics reveals mitochondrial supercomplexome plasticity. Cell Rep. 35 (8), 109180 (2021).
- Wittig, I., Schagger, H. Features and applications of blue-native and clear-native electrophoresis. Proteomics. 8 (19), 3974-3990 (2008).
- Wittig, I., Schagger, H. Native electrophoretic techniques to identify protein-protein interactions. Proteomics. 9 (23), 5214-5223 (2009).
- Garcia-Cazarin, M. L., Snider, N. N., Andrade, F. H. Mitochondrial isolation from skeletal muscle. J Vis Exp. (49), e2452 (2011).
- Lai, N., et al. Isolation of mitochondrial subpopulations from skeletal muscle: Optimizing recovery and preserving integrity. Acta Physiol (Oxf). 225 (2), e13182 (2019).
- Schagger, H. Native electrophoresis for isolation of mitochondrial oxidative phosphorylation protein complexes. Methods Enzymol. 260, 190-202 (1995).
- Wittig, I., Braun, H. P., Schagger, H. Blue native PAGE. Nat Protoc. 1 (1), 418-428 (2006).
- Chomyn, A., et al. Platelet-mediated transformation of mtDNA-less human cells: analysis of phenotypic variability among clones from normal individuals--and complementation behavior of the tRNALys mutation causing myoclonic epilepsy and ragged red fibers. Am J Hum Genet. 54 (6), 966-974 (1994).
- Moreno-Loshuertos, R., et al. Differences in reactive oxygen species production explain the phenotypes associated with common mouse mitochondrial DNA variants. Nat Genet. 38 (11), 1261-1268 (2006).
- Fernández-Vizarra, E., Fernández-Silva, P., Enríquez, J. A., Celis, J. E. . Cell Biology (Third Edition). , 69-77 (2006).
- Cogliati, S., Herranz, F., Ruiz-Cabello, J., Enríquez, J. A. Digitonin concentration is determinant for mitochondrial supercomplexes analysis by BlueNative page. Biochim Biophys Acta Bioenerg. 1862 (1), 148332 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유