Method Article
갈색 지방 조직에서 생체 내 대사산물 교환을 측정하기 위한 동정맥 대사체학
* 이 저자들은 동등하게 기여했습니다
요약
이 프로토콜에서는 마우스 모델에서 GC-MS를 사용하는 BAT에 최적화된 동정맥 대사체학과 관련된 방법을 간략하게 설명합니다. 이러한 방법을 통해 유기체 수준에서 BAT 매개 대사 산물 교환에 대한 귀중한 통찰력을 얻을 수 있습니다.
초록
갈색 지방 조직(BAT)은 비떨림 열발생으로 알려진 독특한 에너지 소비 과정을 통해 대사 항상성을 조절하는 데 중요한 역할을 합니다. 이를 위해 BAT는 높은 신진대사 수요를 지원하기 위해 다양한 순환 영양소 메뉴를 활용합니다. 또한 BAT는 대사 연료 또는 신호 분자 역할을 할 수 있는 대사 산물 유래 생체 활성 인자를 분비하여 BAT에 의해 매개 조직 내 및/또는 조직 간 통신을 촉진합니다. 이는 BAT가 전신 대사 산물 교환에 적극적으로 참여한다는 것을 시사하며, 이는 이제 연구되기 시작한 흥미로운 특징입니다. 여기에서는 생체 내 마우스 수준에 최적화된 BAT 동정맥 대사체학을 위한 프로토콜을 소개합니다. 이 프로토콜은 견갑간 BAT 유래 정맥혈과 전신 동맥혈을 선택적으로 배출하는 Sulzer 정맥을 사용하는 동정맥 혈액 샘플링 기술과 열발생 자극을 위한 관련 방법에 중점을 둡니다. 다음으로, 이러한 혈액 샘플을 사용하는 가스 크로마토그래피 기반 대사체학 프로토콜을 시연합니다. 이 기법을 사용하면 BAT에 의한 대사 산물의 순 흡수 및 방출을 측정하여 장기 간 수준에서 BAT 조절 대사 산물 교환에 대한 이해를 넓힐 수 있습니다.
서문
갈색 지방 조직(BAT)은 미토콘드리아 분리 단백질 1(UCP1) 의존성 및 UCP1 독립적 메커니즘 1,2,3,4,5를 모두 포함하는 비떨림 열발생(NST)으로 알려진 고유한 에너지 소비 특성을 가지고 있습니다. 이러한 특징은 BAT가 전신 대사 조절과 비만, 제2형 당뇨병, 심혈관 질환 및 암 악액질을 포함한 대사 질환의 발병기전을 암시합니다 6,7,8. 최근의 후향적 연구는 BAT 질량 및/또는 그 대사 활동과 인간의 비만, 고혈당증 및 심장 대사 건강 사이의 반비례 관계를 보여주었습니다 9,10,11.
최근 BAT는 발열 연료로서 상당한 양의 순환 영양소를 필요로 하기 때문에 NST를 유지하는 대사 싱크로 제안되었습니다 6,7. 또한, BAT는 내분비 및/또는 부분비 신호로 작용하는 갈색 아디포카인 또는 BATokine이라고 하는 생체 활성 인자를 생성 및 방출할 수 있으며, 이는 시스템 수준의 대사 항상성에 적극적으로 관여함을 나타냅니다 12,13,14,15. 따라서 BAT의 영양 대사를 이해하면 체온 조절 기관으로서의 전통적인 역할을 넘어 인간에 대한 병태생리학적 중요성에 대한 이해가 향상될 것입니다.
비대사성 방사성 추적자를 사용하는 고전적인 영양소 흡수 연구와 안정 동위원소 추적자를 사용하는 대사체 연구는 BAT가 우선적으로 어떤 영양소를 흡수하고 어떻게 활용하는지에 대한 이해를 크게 향상시켰습니다 16,17,18,19,20,21,22,23,24,25,26,27. 예를 들어, 방사성 추적자 연구는 저온 활성 BAT가 포도당, 지단백질 결합 지방산 및 분지 사슬 아미노산 16,17,18,19,20,21,22,23,27을 흡수한다는 것을 입증했습니다. 대사체 연구와 결합된 최근의 동위원소 추적을 통해 조직 및 배양 세포 내에서 이러한 영양소의 대사 운명과 흐름을 측정할 수 있게 되었습니다 24,25,26,28,29,30. 그러나 이러한 분석은 주로 영양소의 개별 활용에 초점을 맞추기 때문에 장기 대사 산물 교환에서 BAT의 시스템 수준 역할에 대한 지식은 제한적입니다. BAT가 소비하는 특정 순환 영양소와 탄소 및 질소 측면에서 양적 기여도에 대한 질문은 여전히 파악하기 어렵습니다. 또한, BAT가 영양소를 사용하여 대사 산물 유래 BATokine(예: 리포카인)을 생성 및 방출할 수 있는지에 대한 탐구는 이제 막 시작되었습니다 12,13,14,15,31,32.
동정맥혈 분석은 장기/조직에서 순환 분자의 특정 흡수 또는 방출을 평가하는 데 사용되는 고전적인 생리학적 접근 방식입니다. 이 기술은 이전에 산소와 여러 대사 산물을 측정하기 위해 쥐의 견갑골 간 BAT에 적용되어 BAT를 이화 전위 33,34,35,36,37을 가진 적응 열 발생의 주요 부위로 설정했습니다. 최근 쥐의 견갑간 BAT를 사용한 동정맥 연구는 트랜스오믹스 접근법과 결합되어 열발생 자극 BAT38에 의해 방출되는 발견되지 않은 BATokine을 식별했습니다.
최근 고감도 가스 크로마토그래피 및 액체 크로마토그래피 질량분석법(GC-MS 및 LC-MS) 기반 대사체학의 발전으로 장기 특이적 대사산물 교환의 정량 분석을 위한 동정맥 연구에 대한 관심이 다시 높아졌습니다 39,40,41. 이러한 기술은 높은 분해능과 질량 정확도를 통해 소량의 시료를 사용하여 광범위한 대사 산물을 포괄적으로 분석할 수 있습니다.
이러한 발전에 발맞추어, 최근의 한 연구는 쥐 수준에서 BAT를 연구하기 위해 동정맥 대사체학을 성공적으로 채택하여, 다양한 조건 하에서 BAT의 대사체 교환 활성에 대한 정량적 분석을 가능하게 했다42. 이 기사에서는 C57BL/6J 마우스 모델에서 GC-MS를 사용하는 BAT 표적 동정맥 대사체학 프로토콜을 제시합니다.
프로토콜
모든 실험은 성균관대학교 동물보호이용위원회(IACUC)의 승인을 받아 진행되었다. 마우스는 매일 12시간의 빛/어둠 주기에 따라 22°C 및 45% 습도로 설정된 클린룸에 위치한 IACUC 승인 동물 시설에 수용되었습니다. 그들은 환기가 잘 되는 선반에 보관되었고 표준 차우 다이어트 광고(탄수화물 60%, 단백질 16%, 지방 3%로 구성)를 이용할 수 있었습니다. 침구와 둥지 재료는 매주 교체되었습니다. 이 연구를 위해 12주 된 25g에서 30g 사이의 체중이 나가는 수컷 C57BL/6J 마우스가 사용되었습니다. 이 동물들은 상업 공급 업체로부터 공급되었습니다 ( 재료 표 참조).
1. 온도 순응과 약리학적인 자극을 통한 갈색 지방이 많은 조직의 변화 활동의 조절
참고: 며칠에서 몇 주에 걸친 온도 적응 또는 β-아드레날린 수용체 작용제를 사용한 약리학적 자극은 BAT 활성을 조절하기 위해 일반적으로 사용되는 방법입니다1. 따라서 독자가 필요에 따라 적절한 접근 방식을 선택할 수 있도록 방법에 대한 간략한 개요가 아래에 제공됩니다. 대사적으로 비활성(열발생이 적은) BAT를 얻기 위해 C57BL/6J 마우스에 대해 열중성(28-30°C)이라고 하는 기준선 온열 온도를 선택합니다. 이 범위는 쥐가 일정한 체온을 유지하기 위해 추가 에너지를 소비할 필요가 없도록 합니다. 대사적으로 적당히 또는 고활성(열발생) BAT를 얻기 위해 각각 온화한 추위(20-22°C) 또는 심한 추위(6°C) 온도를 선택할 수 있습니다. 이 실험의 목적을 위해, 마우스는 22°C의 표준 사육 조건에서 사육되었으며, 이는 마우스의 경우 약간 차갑지만 약리학적 자극을 수반하지 않았습니다.
- 온도 적응
- 온도 적응을 시작하기 최소 1주일 전에 케이지당 1마리 또는 2마리의 마우스를 수용하도록 마우스를 분리합니다. 환기, 온도 및 습도 조절 기능을 갖춘 설치류 인큐베이터를 원하는 조건으로 준비합니다.
- 선택한 유형의 온도 적응에 적합한 날에 케이지를 각각의 설치류 인큐베이터로 옮깁니다.
- 생쥐 수의 분포가 케이지 당 1 개 또는 2 개의 생쥐로 모든 그룹에 균등하게 분포되어 있는지 확인하십시오. 단일 하우징은 그룹 하우징(43)에 비해 온도에 의해 유도된 생리적 변화에 더 민감하기 때문에 선호된다. 각 그룹의 구체적인 주거 조건은 다음과 같습니다.
- 열 중성(30°C) 그룹: 이 그룹의 마우스를 최대 4주 동안 30°C의 온도에서 지속적으로 유지합니다.
- 심한 추위 그룹: 처음에는 둥지 재료 없이 이 그룹의 쥐를 18°C에서 수용합니다. 매주 기온이 점진적으로 낮아져 넷째 주에는 6°C에 도달합니다. 온도 진행은 18°C → 14°C → 10°C → 6°C입니다.
- 온화한 추위 그룹(20-22°C): 이 그룹의 쥐를 앞서 언급한 표준 하우징 조건과 동일한 조건에서 설치류 인큐베이터에 수용합니다.
- 급성 한랭 챌린지: 급성 한랭 챌린지의 경우, 둥지 재료 없이 케이지당 1-2마리의 쥐를 배치하고 6°C로 설정된 설치류 인큐베이터에 최대 8시간 동안 노출시킵니다.
참고: 이러한 하우징 조건과 온도 변화는 다양한 온도 환경이 BAT 활성 및 신진대사에 미치는 영향을 연구하는 데 필수적입니다.
- 매주 케이지를 교체하고 음식과 물을 보충하십시오. 보충하기 최소 24시간 전에 각각의 온도(설치류 인큐베이터)에서 케이지를 사전 적응시킵니다.
알림: 적절한 온도 자극의 방해를 방지하려면 둥지 구축으로 이어질 수 있는 마우스 농축제를 제공하지 않는 것이 중요합니다. 혹독한 추위에 반응하여 쥐는 체온을 유지하기 위해 더 많은 에너지를 소비하므로 음식 섭취가 증가하고 배설률이 높아집니다. 따라서 일주일에 최소 2-3번(현지 기관 지침에 따라) 케이지를 점검하여 쥐가 음식과 물을 충분히 공급받고 있는지, 케이지가 과도하게 젖지 않았는지 확인하는 것이 중요합니다. 이 모니터링은 연구 기간 동안 쥐의 웰빙과 건강을 유지하는 데 필수적입니다.
- β3-아드레날린 수용체 작용제 CL316,243을 이용한 약리자극1
- 자극 효과를 극대화하려면 주입 전 2-4주 동안 열중성(30°C)에서 마우스를 미리 보관합니다.
- 적응 기간 후 복강내 주사 1mg/kg CL316,243.
참고: β3-아드레날린 수용체 작용제를 사용한 만성 자극(예: 3일에서최대 1,44,45주까지)의 경우 약물 안정성으로 인해 매일 주사해야 합니다. 희석된 CL316,243은 안정성을 위해 주사 당일에 준비해야 합니다.
2. 동정맥혈 채취
참고: 12-14주 이상의 마우스는 동정맥혈 샘플링에 가장 권장됩니다. 어린 마우스는 견갑간 BAT46에서 정맥혈을 특이적으로 배출하는 뚜렷한 혈관인 슐처 정맥(Sulzer's veins)의 크기가 충분하지 않을 수 있습니다.
- 유도를 위해 3% 이소플루란(205 x 265 x 200mm 크기 챔버에서) 및 유지 관리를 위해 2% 이소플루란(가스 마취 마스크 사용)으로 보정된 기화기를 사용하여 부드럽게 마취합니다.
알림: 전체 동정맥혈 채취 절차는 마취 후 즉시 수행해야 합니다. 심부 체온을 유지하기 위해 마취 중에 물 가열 온열 패드를 사용할 수 있습니다.
주의 : 이소플루란은 흡입 시 휘발성이 높고 독성이 있습니다. 따라서 1차 마취는 흄 후드 아래에서 수행해야 합니다. - 마취가 적절한 깊이에 도달했는지 확인하기 위해 발 후퇴와 같은 동물의 반사 신경을 확인합니다.
- 슐처의 정맥에서 정맥혈 채취
- 마우스를 배치하여 등쪽 피부가 노출되도록 하고 절개 직전에 발가락 꼬집을 통해 마취 깊이를 확인합니다. 등쪽 피부에 70% 에탄올을 충분히 적셔 털이 빠지지 않도록 하고 흉부 아래쪽에서 목까지 등을 절개합니다.
참고: 견갑골 간 BAT는 피부 바로 아래에 있으며 얇은 흰색 지방 조직으로 덮인 두 개의 지방 패드로 구성되어 있습니다. 가스 마취 마스크를 통해 마우스가 마취 상태를 유지하는지 확인하는 것이 중요합니다. - 구부러진 끝 겸자로 견갑간 BAT를 부드럽게 들어 올리고 대부분 근육인 부착된 조직을 조심스럽게 자릅니다. 지방 패드를 머리 쪽으로 들어 올리고 부착된 조직을 계속 자르고 설처 정맥(견갑간 BAT의 양쪽 지방 패드에 연결된 큰 'Y'자 모양의 짙은 빨간색 혈관)이 노출될 때까지 해당 부위를 조심스럽게 엽니다.
참고: 견갑간 BAT의 전방 및 측면 부위와 연결된 근육 조직의 모세혈관을 절단하지 않도록 주의하십시오. - Sulzer의 정맥을 조심스럽게 자르고 바닥을 자른 200μL 피펫 팁과 P100 피펫을 사용하여 약 40μL의 혈액을 수집합니다. 혈액을 채혈 튜브에 보관하고 혈청 채혈 과정이 진행될 때까지 튜브를 얼음 위에 두십시오.
참고: Sulzer 정맥의 Y자형 분단점 바로 아래에서 혈액을 채취하여 상대정맥47에서 혈액 오염을 방지하는 것이 중요합니다. 혈액을 너무 많이 모으면 슐처 정맥의 특성이 약해집니다. 따라서 분석을 위해 Sulzer의 정맥에서 필요한 최소한의 혈액을 수집해야 합니다. 혈청과 혈장이 서로 다른 대사 산물 프로파일 48,49,50을 생성하므로 채혈 튜브를 선택할 때 신중해야 합니다. 혈장 채취를 위해서는 헤파린 코팅 튜브를 사용해야 합니다. 이 실험에서는 혈청을 얻기 위해 응고 활성제 코팅 튜브를 선택했습니다. EDTA는 질량 분석 신호51,52에 큰 영향을 미치므로 어떠한 경우에도 EDTA 코팅 튜브를 사용해서는 안 됩니다.
- 마우스를 배치하여 등쪽 피부가 노출되도록 하고 절개 직전에 발가락 꼬집을 통해 마취 깊이를 확인합니다. 등쪽 피부에 70% 에탄올을 충분히 적셔 털이 빠지지 않도록 하고 흉부 아래쪽에서 목까지 등을 절개합니다.
- 좌심실에서 동맥혈 채취
- 콧방울과의 접촉을 잃지 않고 마우스를 뒤집어 복부 피부를 노출시킵니다. 절개하기 전에 발가락 꼬집기를 통해 마취 깊이를 확인합니다. 복부 피부에 70%의 에탄올을 충분히 적셔 모발이 빠지지 않도록 하고, 흉강을 가위로 조심스럽게 열어 내부 구조를 손상시키지 않고 심장을 노출시킵니다.
- 29G(1/2") 바늘이 있는 1mL 주사기를 사용하여 좌심실의 정점 부위를 정확하게 찔렀습니다. 1/2'' 바늘의 2/3를 심장 정점의 오른쪽 수평으로 3-5mm까지 삽입하고(그림 1B) 주사기를 뒤로 당겨 좌심실(50-100μL)에서 혈액을 수집합니다. 좌심실에서 나오는 혈액은 산소가 공급된 동맥혈로 선홍색입니다. 혈액을 채혈 튜브에 보관하고 혈청 채혈 과정이 진행될 때까지 튜브를 얼음 위에 보관합니다.
알림: 심장에 접근하기 위해 흉강을 최소한으로 절개해야 합니다. 과도하게 절개하면 국소 출혈이 발생하여 저혈압이 발생할 수 있습니다. 이는 좌심실에서 채취한 동맥혈의 질에 영향을 미칠 수 있습니다. 심장을 회전시키거나 뒤집으면 좌심실의 정확한 위치를 파악하기 어려울 수 있으므로 피하십시오. - 안락사를 수행하고 지역 기관의 지침에 따라 적절한 방법으로 안락사를 보장합니다. 예를 들어, 안락사는 자궁 경부 탈구를 통해 수행 될 수 있으며 심장 박동의 정지로 확인 될 수 있습니다.
- 혈액 샘플을 10,000 x g 에서 4°C에서 10분 동안 원심분리합니다. 피펫을 사용하여 상층액을 조심스럽게 수집합니다. 상층액에는 사용되는 혈액 수집 튜브의 유형에 따라 혈청 또는 혈장이 포함되어야 합니다. 여기서 멈추고 GC-MS 분석을 위한 혈청 처리까지 -20°C에서 샘플을 보관할 수 있습니다.
알림: 붉은 색의 상층액이 관찰되면 용혈이 잠재적으로 발생할 수 있습니다. 용혈을 방지하려면 응고가 완료되기 전에 샘플을 소용돌이치십시오. 글루타민과 젖산을 포함한 일부 적혈구가 풍부한 대사 산물은 데이터 해석을 잘못 초래할 수 있지만 대부분의 대사 산물은 용혈의 영향을 크게 받지 않을 수 있습니다. 일주일 이내에 혈청/혈장을 분석하는 것이 좋습니다.
3. 혈청과 화학 유도체화에서 대사 산물 적출
- 추출 준비
참고: 대사산물 추출, 유도체화 및 데이터 분석을 포함한 모든 방법은 이전에 설명된 방법53,54의 약간 수정된 버전입니다.- 내부 표준물질인 DL-노르발린 100μM 용액( 재료 표 참조)을 MS 등급 메탄올에 첨가하여 추출 완충액을 준비합니다.
- 모든 실험 절차가 얼음 위에서 수행되는지 확인하십시오.
- Sulzer의 정맥 또는 좌심실에서 추출한 10μL의 마우스 혈청을 40μL의 추출 완충액이 들어 있는 1.5mL 미세 원심분리 튜브로 옮깁니다.
- 세포 파편과 단백질을 제거하기 위해 혈청 샘플을 잠시 소용돌이친 다음 4°C에서 30분 동안 최대 속도(18,000 x g)로 원심분리합니다.
- 원심분리 후 40μL의 상층액을 유리 바이알에 조심스럽게 옮긴 다음 4°C의 진공 원심분리기에서 3시간 동안 건조합니다.
참고: 후속 유도체화 단계 전반에 걸쳐 사용되는 플라스틱 반응성 화학 물질로 인해 플라스틱 튜브 대신 유리 삽입물( 재료 표 참조)을 사용하는 것이 좋습니다. - 혈청 대사 산물의 GC-MS 분석을 위해 건조된 샘플에 두 개의 연속 유도체화 단계를 적용합니다.
알림: 다음 단계는 용매의 자극 위험으로 인해 흄 후드 아래에서 수행해야 합니다.- 피리딘에 용해된 10mg/mL 메톡시아민 염산염( 재료 표 참조) 30μL에 건조된 혈청 추출물을 재현탁시키고 37°C에서 30분 동안 배양합니다.
- 70°C에서 1시간 동안 70μL의 N-메틸-N-tert-부틸디메틸실리플루오로아세트아미드(MTBSTFA, 재료 표 참조)로 대사 산물의 실릴화를 위한 샘플을 유도체화합니다.
알림: 플라스틱과 반응하는 유도체화 용매로 인해 다음 단계에서 플라스틱 팁 대신 유리 주사기를 사용하는 것이 좋습니다.
4. GC-MS를 이용한 대사체학 분석
참고: 단일 4중 GC-MS( 재료 표 참조)를 사용하여 Sulzer 정맥 및 좌심실의 유도체화된 샘플에서 탄수화물, 아미노산 및 TCA 회로 중간체를 포함한 다양한 혈청 대사 산물을 측정했습니다. 다른 컬럼을 대안으로 사용할 수 있지만, 온도 프로그램을 포함한 실험 설정은 사용되는 컬럼의 유형에 따라 달라질 수 있습니다.
- 헬륨을 1.500mL/min(설정점)의 운반 가스로 사용하여 280°C(입구 온도)에서 비분할 모드로 유도체화된 시료 1μL를 GC에 주입합니다.
- 사중극자를 200°C로 설정하고 GC-MS 인터페이스를 300°C로 설정합니다.
알림: 모든 대사 산물 분석을 위한 오븐 프로그램은 60°C에서 시작하여 1분 동안 유지된 다음 온도가 10°C에 도달할 때까지 320°C/분의 속도로 증가합니다. - 70eV로 설정된 전자 이온화(EI)로 데이터를 수집하고 스캔 모드(50-550m/z)53에서 샘플 데이터를 수집합니다. 이 연구에 사용된 모든 대사 산물은 이전에 질량 스펙트럼 및 머무름 시간을 확인하기 위한 표준으로 검증되었습니다.
- 시중에서 판매되는 분석 소프트웨어를 사용하여 피크 면적 적분을 수행합니다( 재료 표 참조).
- 화합물을 각 TBMDS 유도체의 생성물 이온과 일치시킵니다. 그런 다음 해당 피크 영역에 단편 이온의 m/z 값을 적분하여 추출 이온 크로마토그램(EIC)을 얻은 다음 내보냅니다. 단편 이온은 표 1에 나타내었다.
참고: 각 화합물의 EIC는 각 샘플에서 DL-노르발린의 EIC로 정규화되었습니다. 데이터는 정규화된 각 EIC 값을 사용하여 좌심실에 대한 로그2 슐처 정맥(Log2(SV/LV))으로 표시됩니다.
결과
그림 1 은 BAT에 최적화된 AV 대사체학의 실험 방식을 보여줍니다. 프로토콜 섹션에서 언급한 바와 같이, 차등적으로 자극된 갈색 지방 조직을 얻기 위해 마우스는 설치류 인큐베이터를 사용하여 온도 적응을 거치거나 β-아드레날린성 수용체 작용제와 같은 약리학적 투여를 받습니다. 그 후, 마우스를 마취하고 대사체 분석을 위해 혈액 샘플을 수집합니다(그림 1A). 혈액 채취의 경우, 견갑간 BAT에서 특이적으로 배출되는 정맥혈은 슐처 정맥을 통해 채취하는 반면, 동맥혈은 심장의 좌심실에서 직접 채취합니다(그림 1B).
그림 2 는 GC-MS를 사용한 혈청 대사체학의 개략도를 나타냅니다(그림 2). 간단히 말해서, 메탄올 용액을 혈청 샘플에 첨가한 후 원심분리하여 혈청 단백질을 제거합니다. 대사 산물을 함유하는 상층액을 SpeedVac에서 건조시키고, 건조된 샘플을 메톡시아민(MOX) 및 MTBSTFA(N-tert-부틸디메틸실릴-N-메틸트리플루오로아세트아미드)를 사용하여 2단계 유도체화를 실시하였다. 유도체화 단계는 대사 산물의 극성 작용기를 TBDMS 에스테르로 치환하여 TBDMS 유도체로서 대사 산물의 GC-MS 검출을 가능하게 하는 것을 목표로 합니다. 유도체화된 샘플은 단일 4중 GC-MS를 사용하여 분석되었습니다. 대사 산물은 물리화학적 특성에 따라 컬럼에서 분리됩니다. 전자 이온화(EI)는 대사 산물을 질량 검출기에 의해 검출된 고유한 단편 이온으로 분해하는 데 사용됩니다. 화합물 식별은 화합물 특이적 단편 이온의 검출을 통해 수행됩니다. 실험에서 화합물 특이적 단편 이온의 m/z 값과 머무름 시간은 표에 나와 있습니다(표 1). 추출된 이온 크로마토그램(EIC)은 대사 산물의 풍부도를 정의하는 대사 산물의 피크 영역에서 화합물 특이적 단편 이온의 신호를 통합하는 데 사용됩니다.
BAT가 일련의 대사 산물을 방출 또는 흡수하는지 여부를 결정하기 위해 슐처 정맥과 좌심실 사이의 이온 수의 Log2 비율(Log2(SV/LV))을 계산할 수 있습니다(그림 3). 특정 대사 산물에 대한 Log2(SV/LV) 값이 >0이면 대사 산물이 LV보다 SV에 더 풍부하다는 것을 나타내며, 이는 견갑골 간 BAT 그물이 대사 산물을 방출한다는 것을 시사합니다. 반대로, 특정 대사 산물에 대한 Log2 (SV / LV) 값이 <0이면 대사 산물이 견갑간 BAT에 의해 흡수되었음을 나타냅니다.
이 접근법을 사용하여 약한 냉 자극 BAT는 포도당, 젖산염, 3-하이드록시부티레이트(3-HB), BCAA, 아스파르테이트, 라이신 및 트립토판을 크게 소비하는 반면 BAT는 숙시네이트와 팔미테이트를 크게 방출하는 것으로 나타났습니다(그림 3A). 이러한 현상의 대부분은 만성 감기 BAT42에 대한 이전 연구에서 관찰되었으며, 이는 경미한 감기 BAT가 정도는 덜하지만 대사적으로 만성 감기 BAT와 유사하다는 것을 시사합니다. 데이터에 대한 빠른 시각적 개요를 제공하기 위해 로그2(SV/LV) 값을 표시하는 히트 맵이 표시되어 있습니다(그림 3B). 히트맵은 그룹 내의 Z-점수를 나타내므로 데이터를 신중하게 해석하는 것이 중요합니다.
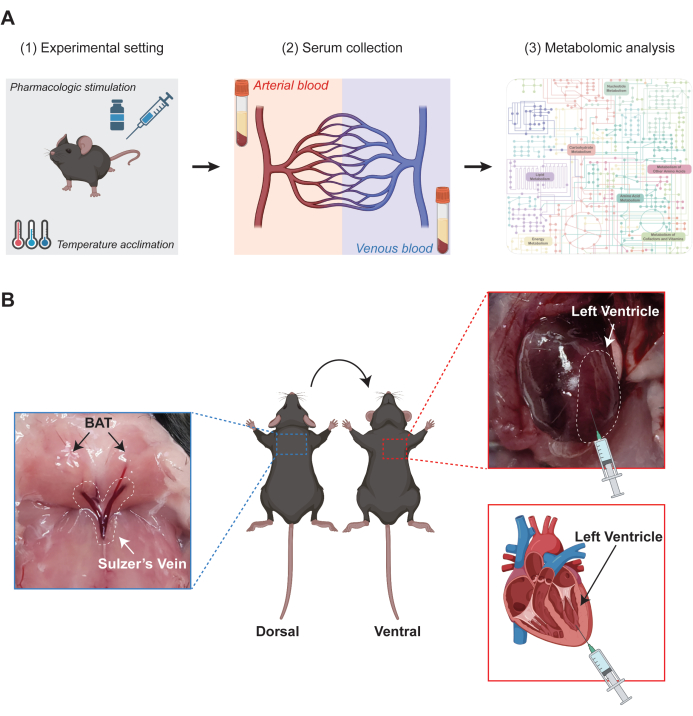
그림 1: BAT에 최적화된 동정맥(AV) 대사체학의 실험 계획. (A) AV 대사체학의 워크플로우를 보여주는 다이어그램. (1) 대사 자극 갈색 지방 조직(BAT)의 다양한 버전을 유도하기 위해 마우스를 다른 온도에 적응시키거나 약리학적 약물 주사를 받습니다. (2) 이어서, 동맥혈 및 정맥혈 샘플을 각각 생쥐의 좌심실과 슐처 정맥에서 채취한다. (3) 얻어진 혈청 샘플은 대사 산물 추출 후 대사체 분석을 거칩니다. (B) 혈액 채취 절차에 대한 지침을 제공하는 대표 이미지. 동맥혈은 좌심실에서 채취하고, 정맥혈은 BAT에서 혈액을 빼내는 슐처 정맥에서 채취합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: GC/MS 기반 표적 대사체학. GC/MS 기반 표적 대사체학의 실험 계획. TBDMS: tert-부틸디메틸실릴, EI: 전자 이온화, EIC: 이온 크로마토그램 추출. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
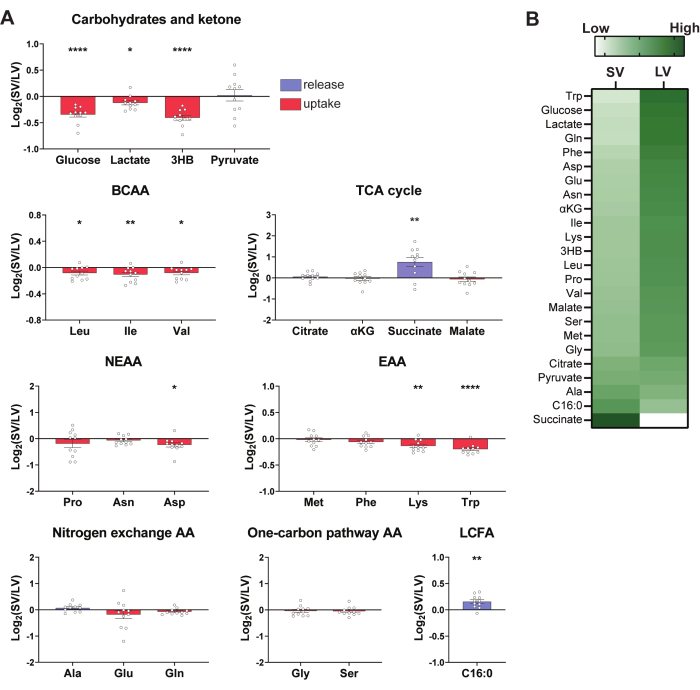
그림 3: 대표적인 AV 대사체학 데이터. (A) BAT에 의한 선택된 널리 퍼져 있고 매우 활동적인 순환 연료 대사 산물의 흡수 및 후속 방출은 각 그룹에 따라 분류됩니다. 이 데이터는 Log2 Sulzer의 정맥 대 좌심실(SV/LV) 비율을 보여줍니다. 평균 Log2 (SV/LV) <0 의 대사 산물을 나타내는 막대는 빨간색으로 표시되고 Log2 (SV/LV) >0 은 파란색으로 표시됩니다. 개별 데이터 포인트는 각 마우스를 나타냅니다. n = 11입니다. 데이터는 평균± SEM입니다. *p < 0.05, **p < 0.01, ***p < 0.001입니다. BCAA(기원전 사슬 백분기준) 분지사슬아미노산; EAA; 필수 아미노산; 네아; 비필수 아미노산. (B) 슐처 정맥(SV)과 좌심실(LV) 혈액 사이의 대사 산물의 차이를 보여주는 히트 맵. 각 열에는 그룹 내 평균값의 Z-점수가 표시됩니다. n = 11입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 화합물 | 조각 이온의 m/z | 보유 기간 | 포뮬러 | TBDMS 유도체 포뮬러 |
| 피루브산 | 174.1 | 8.72 | C3H4O3 시리즈 | C15H33O3NSi2 |
| 아스파르테이트 | 418.2 | 18.45 | C4H7NO4 | C22H49NO4Si3 시리즈 |
| α-케토글루타레이트 | 346.2 | 17.27 | C5H6O5 시리즈 | C18H37NO5Si2 시리즈 |
| C16:0(팔미틴산염) | 313.3 | 19.72 | C16H32O2 | C22H46O2Si |
| 젖산 | 261.2 | 11.66 | C3H6O3 | C15H34O3Si2 시리즈 |
| 신 | 200.2 | 14 | C6H13NO2 | C18H41NO2Si2 시리즈 |
| 이소류신 | 200.2 | 14.34 | C6H13NO2 | C18H41NO2Si2 시리즈 |
| 발린 | 186.2 | 13.53 | C5H11NO2 | C17H39NO2Si2 시리즈 |
| 알라닌 | 260.2 | 12.17 | C3H7NO2 | C15H35NO2Si2 시리즈 |
| 세린 | 390.2 | 17.04 | C3H7NO3 | C21H49NO3Si3 시리즈 |
| 글리신 | 218.1 | 12.43 | C2H5NO2 | C14H33NO2Si2 시리즈 |
| 라이신(Lysine) | 300.2 | 20.48 | C6H14N2O2 | C24H56N2O2Si3 시리즈 |
| 숙시네이트 | 289.1 | 14.65 | C4H6O4 시리즈 | C16H34O4Si2 시리즈 |
| 프롤린 | 258.2 | 14.73 | C5H9NO2 | 재질 보기 C17H37NO2Si2 |
| 페닐알라닌 | 336.2 | 18 | C9H11NO2 | C21H39NO2Si2 시리즈 |
| 메티오닌 | 320.2 | 16.84 | C5H11NO2S | C17H39NO2SSi2 |
| 시스테인 | 406.2 | 19 | C3H7NO2S | C21H49NO2SSi3 시리즈 |
| 아스파라긴 | 417.2 | 19.86 | C4H8N2O3 | C22H50N2O3Si3 시리즈 |
| 3-하이드록시부티레이트(3HB) | 275.2 | 12.81 | C4H8O3 시리즈 | C16H36O3Si2 시리즈 |
| 트립토판 | 375.2 | 22.97 | C11H12N2O2 | C23H40N2O2Si2 |
| 말라테 | 419.2 | 18.19 | C4H6O5 시리즈 | C22H48O5Si3 시리즈 |
| 조미료 | 432.3 | 19.59 | C5H9NO4 | C23H51NO4Si3 |
| 글루타민 | 431.3 | 20.85 | C5H10N2O3 | C23H52N2O3Si3 |
| 시트르산 | 459.2 | 22.38 | C6H8O7 시리즈 | C30H64O7Si4 시리즈 |
| 포도당 | 476.3 | 22.7 | C6H12O6 | C30H68O6Si4 시리즈 |
표 1: 통합에 사용되는 GC/MS 화합물 단편 이온. 이 표는 본 방법에서 확인된 25개의 혈청 대사산물 목록을 포함하며, 머무름 시간 및 각 화합물에 해당하는 단편 이온을 포함합니다.
토론
전신 에너지 균형에서 BAT의 대사 잠재력을 이해하는 데 중요한 단계는 BAT가 소비하는 영양소, 대사 처리 방법, 순환계로 방출되는 대사 산물을 정의하는 것입니다. 이 프로토콜은 C57BL/6J 마우스에서 견갑간 BAT의 정맥 혈관 및 전신 동맥 혈관에 접근할 수 있는 특수 동정맥 샘플링 기술을 도입하며, 이는 최근 Park etal 42에 의해 개발 및 검증되었습니다. 다음은 프로토콜을 따를 때 비판적으로 고려해야 할 핵심 사항입니다.
열발생 자극의 경우 주요 고려 사항은 실험 설정에 가장 적합한 열발생 자극 유형을 선택하는 것입니다. 예를 들어, 실험군(대조군)을 사용하고 BAT의 대사 적응 능력(최대 비떨림 열발생 잠재력에 중요)의 차이를 관찰하는 것을 목표로 하는 경우, 만성 저온 순응 또는 β-아드레날린성 수용체 자극(3일에서 4주 이상 지속)이 적합합니다 1,45. BAT가 급성 추위에 노출되면(24시간 미만) BAT는 신진대사에 적응하는 대신 고유하게 저장된 연료를 대사하고 최적의 열 발생을 위해 떨리는 근육과 대사적으로 통신합니다1. β-아드레날린성 수용체 작용제는 BAT 열발생 1,14를 유발하는 신경 반응을 나타내며, 열발생 프로그램(55,56,57,58,59,60)을 강화하는 다른 내분비 인자가 있다. 위에서 언급한 바와 같이 열발생 자극을 수행할 때마다 열중성(30°C)에서 기준선 대조를 갖는 것이 자극이 적절하게 작동하는지 확인하는 데 유용해야 합니다.
프로토콜 섹션에서 언급했듯이 최고 품질의 동정맥혈을 얻는 것이 실험의 성공적인 확립을 결정하는 열쇠입니다. 이를 위해서는 용혈을 예방하고(2.5단계 참조) 슐처 정맥(슐처 정맥에서 40μL 미만)에서 정맥혈의 뚜렷한 특성이 희석되지 않도록 일정한 양의 혈액을 수집하는 것이 필수적입니다. 이를 위해 초기 설정 중에 저자는 Sulzer 정맥의 혈액뿐만 아니라 비 BAT 배출 정맥혈(예: 하대정맥)의 혈액을 사용하여 대사 산물 측정을 위한 파일럿 실험을 수행할 것을 강력히 권장합니다. 이는 Sulzer 정맥의 혈청이 비 BAT 정맥 혈관과 비교하여 뚜렷한 대사 산물 프로파일링을 나타내는지 여부를 확인하는 데 도움이 됩니다. 좌심실에서 동맥혈을 채취하는 것과 관련하여, 카디오카인 수치의 변화를 최소화하기 위해 좌심실의 동일한 부위를 지속적으로 천공하는 것이 중요하다61,62. 이러한 변화는 동정맥 대사체학 또는 단백질체학에서 혼란스러운 결과를 초래할 수 있습니다.
질량분석법과 결합된 크로마토그래피는 대사체학을 위한 가장 강력한 도구 중 하나이며, 그 방법 중 하나가 GC-MS63입니다. 실제로, GC-MS를 사용하여 생물학적으로 관련된 대사 산물을 측정하는 것은 커버리지 문제로 인해 어려운 것으로 간주되었습니다. GC-MS 응용 분야는 일반적으로 조직 및 생체 유체의 수많은 극성 대사 산물과 달리 휘발성이 높고 비극성 특성을 가진 대사 산물의 분석으로 제한됩니다. 그러나 다양한 추출 및 유도체화 방법의 개발과 함께 우수한 피크 분해능, 재현성 및 편리한 피크 식별을 가능하게 하는 광범위한 질량 스펙트럼 라이브러리를 포함한 GC-MS의 장점은 생물학적으로 관련된 대사 산물64,65을 분석하기 위한 매력적인 옵션으로 이러한 플랫폼으로 이어졌습니다.
이 프로토콜에서 GC-MS 플랫폼은 앞서 언급한 기술을 사용하여 수집된 혈청 내 25개의 대사 산물 분석에 사용됩니다. 이를 위해, 80% 메탄올 용액을 이용하여 대사산물 추출을 실시하였다. 참고로, 이 단계에서는 시료의 유기 물질 오염을 최소화하기 위해 Eppendorf tube를 포함한 특정 유형의 튜브를 사용하는 것이 좋습니다. 혈청에서 단백질 파편을 제거하기 위해 추출 후 펠릿에서 상층액을 조심스럽게 분리해야 하며, 이는 MS-이온 소스 성능을 유지하는 데 매우 중요합니다.
유도체화 단계는 아릴 유도체, 실릴화, 및 아실화를 포함하는 유도체화의 유형에 기초하여 다양화될 수 있다(66). 저자는 대사산물 시알릴화를 위해 N-메틸-N-tert-부틸디메틸실릴리플루오로아세트아미드(MTBSTFA)를 사용한 2단계 유도체화를 사용했는데, 이는 당을 포함한 생물학적으로 관련된 극성 대사 산물을 안정적으로 검출할 수 있다는 장점이 있는 일반적으로 사용되는 방법이지만, 분석 단계64 동안 아민 및 아미노산의 N-트리메틸실릴기가 가끔 손실된다는 단점이 있습니다. 참고로, 샘플은 시약과 유도체의 수분 민감성 때문에 유도체화 단계 전에 완전히 건조되어야 합니다.
일반적으로 GC 분석의 주요 한계 중 하나는 특히 LC-MS 기반 분석과 비교하여 극성 대사체 검출과 관련하여 GC-MS 용량을 향상시키는 앞서 언급한 유도체화 단계에도 불구하고 여전히 검출 가능한 대사 산물의 범위로 귀결됩니다. LC-MS를 이용한 정량적 대사체학은 전신 대사산물 교환과 관련하여 BAT의 대사 스펙트럼에 대한 더 나은 통찰력을 얻는 데 크게 도움이 될 수 있습니다 24,42.
동맥 대 대사 산물 농도 구배의 프로토콜 측정에 사용되는 계산이지만. 정맥혈; Log2(SV/LV)는 BAT에 의한 부분 흡수 및 방출 변화를 정량화하므로 데이터 해석에 주의가 필요합니다. 특히, 분수 순 교환 값이 '0'인 대사 산물(예: 구연산염, αKG, 말레이트, 메티오닌, 알라닌, 글루타민)의 경우 그 결과는 흡수/방출이 없거나 동등하게 활성화된 이화작용 및 합성(흡수 및 방출이 모두 높은 경우)에 기인할 수 있습니다. 두 가지 가능성 중 어느 것이 옳은지 확인하기 위해서는, 흡수된 대사산물 및/또는 그 기질과 함께 생체 내 동위원소 추적을 사용하는 추가적인 대사 플럭스 실험이 필요하다39.
분수 계산의 한계는 그 대사 산물42,67를 위한 흡수 그리고 방출의 양이 많은 조경을 제공하지 않는다 이다. 예를 들어, Log2(SV/LV) 값이 포도당과 3-하이드록시부티레이트(3HB) 사이의 비교 가능한 상대적 순 흡수를 나타내지만, 포도당의 혈중 농도가 3HB보다 훨씬 높다는 사실과 포도당이 4개의 탄소를 더 포함하기 때문에(포도당에는 6개의 탄소가 있고, 3HB에는 2개의 탄소가 있음) 탄소원에 대한 포도당의 실제 기여도는 3-HB보다 훨씬 높아야 합니다. 필요한 경우 혈류율, 각 대사 산물의 실제 혈액 농도 및 화학 방정식과 같은 추가 매개 변수를 통합하는 포괄적 인 분석은 흡수 / 방출 된 대사 산물의 정량적 기여도와 총 탄소 또는 질소 플럭스42,67에 대한 기여도를 알려야합니다.
쥐 수준에서 동정맥혈 샘플링 및 대사체 분석을 위한 이 소형화된 방법론의 주요 이점은 갈색 지방 조직 대사 및 생리학을 연구하기 위한 다양한 유전자 모델과의 시너지 조합입니다(예: UCP1-KO, UCP1-Cre 기반 BAT 특이적 기능 상실 모델, 형질전환 모델). 대사체 프로파일링을 위해 미량의 혈청만 필요한 최근의 대사체 분석은 더 작은 유기체에서 이 접근법을 더 실현 가능하게 합니다(프로토콜 3 참조)39. 그러나 대사체학과 함께 고려할 때 더 나은 통찰력을 제공할 수 있는 단백질체 분석에는 더 많은 양의 샘플이 필요할 수 있습니다. 이와 관련하여, 쥐를 이용한 종래의 동정맥 시료 채취가 더 적합할 수 있다. 우리는 독자들에게 쥐의 BAT에 대한 동정맥 혈액 샘플링에 대한 가장 최근의 프로토콜을 참조하도록 합니다., Mestres-Arenas와 동료47에 의해 작성됨.
비록 현재의 프로토콜이 문헌[Park et al.42]에 기술된 바와 같이 이소플루란을 이용한 마취 절차를 채택하고 있지만, 이러한 접근법은 생체내에서 갈색 지방세포 및/또는 갈색 지방조직의 열발생 대사에 부정적인 영향을 미칠 수 있다 68,69,70,71. 따라서 펜토바르비탈을 활용한 향후 동정맥 대사체학에 대한 조사가 필요하다.
요약하면, 이 프로토콜은 다양한 열발생 자극에 대한 BAT 특이적 순 대사 활동(소비 대 생산)을 측정하기 위한 기본 방법론을 제공합니다. 이를 통해 주요 대사 연료와 분비된 대사 산물을 정량적으로 나열함으로써 전신 영양 싱크대이자 공급자로서의 BAT의 역할에 대한 귀중한 통찰력을 얻을 수 있습니다. 또한, 이는 이전에 연구되지 않은 대사산물 유래 갈색 아디포카인을 식별하는 데 유용할 수 있으며, 특히 발견 기반 대사체 플랫폼으로 작동할 때 유용합니다.
공개
저자는 보고할 이해 상충이 없음을 선언합니다.
감사의 말
방법론적 논의를 해주신 최 및 정 연구실 모든 분들께 감사드립니다. 조언과 피드백을 주신 C. Jang과 D. Guertin에게 감사드립니다. 원고를 비판적으로 읽어주신 M.S. Choi에게 감사드립니다. 이 작업은 NRF-2022R1C1C1012034에서 SMJ에 자금을 지원했습니다. NRF-2022R1C1C1007023에서 DWC로; NRF-2022R1A4A3024551 - S.M.J. 및 DWC 이 연구는 충남대학교의 지원을 받아 진행되었으며, 그림 1과 그림 2는 BioRender(http://biorender.com/)를 이용하여 제작되었다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5-20 µL Filter Tips | Axygen | AX.TF-20-R-S | |
| 1 mL Syringe with attached needle - 26 G 5/8" | BD Biosciences | 309597 | |
| Agilent 5977B GC/MSD (mass selective detector) | Agilent | G7077B | |
| Agilent 7693A Autosampler | Agilent | G4513A | |
| Agilent 8890 GC System | Agilent | G3542A | |
| Agilent J&W GC column (Capilary column) HP-5MS UI | Agilent | 19091S-433UI | |
| Agilent MassHunter Workstation software_MS Quantitative analysis(Quant-My-way) | Agilent | G3335-90240 | |
| C57BL/6J mouse | DBL | C57BL/6JBomTac | |
| CentriVap -50 °C Cold Trap (with Stainless steel Lid) | LABCONCO | 7811041 | |
| DL-Norvaline | Sigma-Aldrich | N7502-25G | |
| Eppendorf centrifuge 5430R | Eppendorf | 5428000210 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | 30120086 | |
| Glass insert 250 μL | Agilent | 5181-1270 | |
| Methanol (LC-MS grade) | Sigma-Aldrich | Q34966-1L | |
| Methoxyamine hydrochloride | Sigma-Aldrich | 226904-5G | |
| Microvette 200 Serum, 200 µL, cap red, flat base | Sarstedt | 20.1290.100 | |
| MTBSTFA | Sigma-Aldrich | 394882-100ML | |
| Pyridine(anhydrous, 99.8%) | Sigma-Aldrich | 270970-100ML | |
| Refrigerated CentriVap Complete Vaccum Concentrators | LABCONCO | 7310041 | |
| Rodent diet | SAFE | SAFE R+40-10 | |
| Rodent incubator | Power scientific | RIT33SD | |
| Ultra-Fine Pen Needles - 29 G 1/2" | BD Biosciences | 328203 | |
| Vial Cap 9 mm | Agilent | 5190-9067 | |
| Vial, ambr scrw wrtn 2 mL | Agilent | 5190-9063 | |
| Vial, ambr scrw wrtn 2 mL+A2:C40 | Axygen | PCR-02-C |
참고문헌
- Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev. 84 (1), 277-359 (2004).
- Ikeda, K., et al. UCP1-independent signaling involving SERCA2b-mediated calcium cycling regulates beige fat thermogenesis and systemic glucose homeostasis. Nat Med. 23 (12), 1454-1465 (2017).
- Kazak, L., et al. A creatine-driven substrate cycle enhances energy expenditure and thermogenesis in beige fat. Cell. 163 (3), 643-655 (2015).
- Rahbani, J. F., et al. Creatine kinase B controls futile creatine cycling in thermogenic fat. Nature. 590 (7846), 480-485 (2021).
- Ukropec, J., Anunciado, R. P., Ravussin, Y., Hulver, M. W., Kozak, L. P. UCP1-independent thermogenesis in white adipose tissue of cold-acclimated Ucp1-/- mice. J Biol Chem. 281 (42), 31894-31908 (2006).
- Chen, K. Y., et al. Opportunities and challenges in the therapeutic activation of human energy expenditure and thermogenesis to manage obesity. J Biol Chem. 295 (7), 1926-1942 (2020).
- Wolfrum, C., Gerhart-Hines, Z. Fueling the fire of adipose thermogenesis. Science. 375 (6586), 1229-1231 (2022).
- Seki, T., et al. Brown-fat-mediated tumour suppression by cold-altered global metabolism. Nature. 608 (7922), 421-428 (2022).
- Becher, T., et al. Brown adipose tissue is associated with cardiometabolic health. Nat Med. 27 (1), 58-65 (2021).
- Chondronikola, M., et al. Brown adipose tissue improves whole-body glucose homeostasis and insulin sensitivity in humans. Diabetes. 63 (12), 4089-4099 (2014).
- Yoneshiro, T., et al. Recruited brown adipose tissue as an antiobesity agent in humans. J Clin Invest. 123 (8), 3404-3408 (2013).
- Villarroya, F., Cereijo, R., Villarroya, J., Giralt, M. Brown adipose tissue as a secretory organ. Nat Rev Endocrinol. 13 (1), 26-35 (2017).
- Villarroya, J., et al. New insights into the secretory functions of brown adipose tissue. J Endocrinol. 243 (2), R19-R27 (2019).
- Scheele, C., Wolfrum, C. Brown adipose crosstalk in tissue plasticity and human metabolism. Endocr Rev. 41 (1), 53-65 (2020).
- Scheja, L., Heeren, J. The endocrine function of adipose tissues in health and cardiometabolic disease. Nat Rev Endocrinol. 15 (9), 507-524 (2019).
- Nedergaard, J., Bengtsson, T., Cannon, B. Unexpected evidence for active brown adipose tissue in adult humans. Am J Physiol Endocrinol Metab. 293 (2), E444-E452 (2007).
- Cypess, A. M., et al. Identification and importance of brown adipose tissue in adult humans. N Engl J Med. 360 (15), 1509-1517 (2009).
- Virtanen, K. A., et al. Functional brown adipose tissue in healthy adults. N Engl J Med. 360 (15), 1518-1525 (2009).
- van Marken Lichtenbelt, W. D., et al. Cold-activated brown adipose tissue in healthy men. N Engl J Med. 360 (15), 1500-1508 (2009).
- Saito, M., et al. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes. 58 (7), 1526-1531 (2009).
- Labbe, S. M., et al. In vivo measurement of energy substrate contribution to cold-induced brown adipose tissue thermogenesis. FASEB J. 29 (5), 2046-2058 (2015).
- Yoneshiro, T., et al. BCAA catabolism in brown fat controls energy homeostasis through SLC25A44. Nature. 572 (7771), 614-619 (2019).
- Ouellet, V., et al. Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans. J Clin Invest. 122 (2), 545-552 (2012).
- Jung, S. M., et al. In vivo isotope tracing reveals the versatility of glucose as a brown adipose tissue substrate. Cell Rep. 36 (4), 109459 (2021).
- Wang, Z., et al. Chronic cold exposure enhances glucose oxidation in brown adipose tissue. EMBO Rep. 21 (11), e50085 (2020).
- Hui, S., et al. Quantitative fluxomics of circulating metabolites. Cell Metab. 32 (4), 676-688 (2020).
- Bartelt, A., et al. Brown adipose tissue activity controls triglyceride clearance. Nat Med. 17 (2), 200-205 (2011).
- Held, N. M., et al. Pyruvate dehydrogenase complex plays a central role in brown adipocyte energy expenditure and fuel utilization during short-term beta-adrenergic activation. Sci Rep. 8 (1), 9562 (2018).
- Panic, V., et al. Mitochondrial pyruvate carrier is required for optimal brown fat thermogenesis. Elife. 9, e52558 (2020).
- Winther, S., et al. Restricting glycolysis impairs brown adipocyte glucose and oxygen consumption. Am J Physiol Endocrinol Metab. 314 (3), E214-E223 (2018).
- Lynes, M. D., et al. The cold-induced lipokine 12,13-diHOME promotes fatty acid transport into brown adipose tissue. Nat Med. 23 (5), 631-637 (2017).
- Shamsi, F., Wang, C. H., Tseng, Y. H. The evolving view of thermogenic adipocytes - ontogeny, niche and function. Nat Rev Endocrinol. 17 (12), 726-744 (2021).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Lett. 104 (1), 13-16 (1979).
- Foster, D. O., Frydman, M. L., Usher, J. R. Nonshivering thermogenesis in the rat. I. The relation between drug-induced changes in thermogenesis and changes in the concentration of plasma cyclic AMP. Can J Physiol Pharmacol. 55 (1), 52-64 (1977).
- Foster, D. O., Frydman, M. L. Nonshivering thermogenesis in the rat. II. Measurements of blood flow with microspheres point to brown adipose tissue as the dominant site of the calorigenesis induced by noradrenaline. Can J Physiol Pharmacol. 56 (1), 110-122 (1978).
- Foster, D. O., Frydman, M. L. Tissue distribution of cold-induced thermogenesis in conscious warm- or cold-acclimated rats reevaluated from changes in tissue blood flow: the dominant role of brown adipose tissue in the replacement of shivering by nonshivering thermogenesis. Can J Physiol Pharmacol. 57 (3), 257-270 (1979).
- Lopez-Soriano, F. J., Alemany, M. Effect of cold-temperature exposure and acclimation on amino acid pool changes and enzyme activities of rat brown adipose tissue. Biochim Biophys Acta. 925 (3), 265-271 (1987).
- Cereijo, R., et al. CXCL14, a brown adipokine that mediates brown-fat-to-macrophage communication in thermogenic adaptation. Cell Metab. 28 (5), 750-763 (2018).
- Jang, C., Chen, L., Rabinowitz, J. D. Metabolomics and Isotope Tracing. Cell. 173 (4), 822-837 (2018).
- Murashige, D., et al. Comprehensive quantification of fuel use by the failing and nonfailing human heart. Science. 370 (6514), 364-368 (2020).
- Jang, C., et al. Metabolite exchange between mammalian organs quantified in pigs. Cell Metab. 30 (3), 594-606 (2019).
- Park, G., et al. Quantitative analysis of metabolic fluxes in brown fat and skeletal muscle during thermogenesis. Nat Metab. 5 (7), 1204-1220 (2023).
- Skop, V., Xiao, C., Liu, N., Gavrilova, O., Reitman, M. L. The effects of housing density on mouse thermal physiology depend on sex and ambient temperature. Mol Metab. 53, 101332 (2021).
- Himms-Hagen, J., et al. Effect of CL-316,243, a thermogenic beta 3-agonist, on energy balance and brown and white adipose tissues in rats. Am J Physiol. 266 (4 Pt 2), R1371-R1382 (1994).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. J Lipid Res. 55 (11), 2276-2286 (2014).
- Smith, R. E., Roberts, J. C. Thermogenesis of brown adipose tissue in cold-acclimated rats. Am J Physiol. 206, 143-148 (1964).
- Mestres-Arenas, A., Cairo, M., Peyrou, M., Villarroya, F. Blood sampling for arteriovenous difference measurements across interscapular brown adipose tissue in rat. Methods Mol Biol. 2448, 273-282 (2022).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), e21230 (2011).
- Kaluarachchi, M., et al. A comparison of human serum and plasma metabolites using untargeted (1)H NMR spectroscopy and UPLC-MS. Metabolomics. 14 (3), 32 (2018).
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat Protoc. 2 (11), 2692-2703 (2007).
- Gonzalez-Dominguez, R., Gonzalez-Dominguez, A., Sayago, A., Fernandez-Recamales, A. Recommendations and best practices for standardizing the pre-analytical processing of blood and urine samples in metabolomics. Metabolites. 10 (6), 229 (2020).
- Jung, S. M., et al. Stable isotope tracing and metabolomics to study in vivo brown adipose tissue metabolic fluxes. Methods Mol Biol. 2448, 119-130 (2022).
- Ngo, J., et al. Mitochondrial morphology controls fatty acid utilization by changing CPT1 sensitivity to malonyl-CoA. EMBO J. 42 (11), e111901 (2023).
- Yoo, H. J., et al. MsrB1-regulated GAPDH oxidation plays programmatic roles in shaping metabolic and inflammatory signatures during macrophage activation. Cell Rep. 41 (6), 111598 (2022).
- Straw, J. A., Fregly, M. J. Evaluation of thyroid and adrenal-pituitary function during cold acclimation. J Appl Physiol. 23 (6), 825-830 (1967).
- Silva, J. E., Larsen, P. R. Potential of brown adipose tissue type II thyroxine 5'-deiodinase as a local and systemic source of triiodothyronine in rats. J Clin Invest. 76 (6), 2296-2305 (1985).
- Wilkerson, J. E., Raven, P. B., Bolduan, N. W., Horvath, S. M. Adaptations in man's adrenal function in response to acute cold stress. J Appl Physiol. 36 (2), 183-189 (1974).
- Wagner, J. A., Horvath, S. M., Kitagawa, K., Bolduan, N. W. Comparisons of blood and urinary responses to cold exposures in young and older men and women. J Gerontol. 42 (2), 173-179 (1987).
- Lee, P., et al. Mild cold exposure modulates fibroblast growth factor 21 (FGF21) diurnal rhythm in humans: relationship between FGF21 levels, lipolysis, and cold-induced thermogenesis. J Clin Endocrinol Metab. 98 (1), E98-E102 (2013).
- Ameka, M., et al. Liver derived FGF21 maintains core body temperature during acute cold exposure. Sci Rep. 9 (1), 630 (2019).
- Shimano, M., Ouchi, N., Walsh, K. Cardiokines: recent progress in elucidating the cardiac secretome. Circulation. 126 (21), e327-e332 (2012).
- Planavila, A., Fernandez-Sola, J., Villarroya, F. Cardiokines as modulators of stress-induced cardiac disorders. Adv Protein Chem Struct Biol. 108, 227-256 (2017).
- Dettmer, K., Aronov, P. A., Hammock, B. D. Mass spectrometry-based metabolomics. Mass Spectrom Rev. 26 (1), 51-78 (2007).
- Lu, W., et al. Metabolite measurement: pitfalls to avoid and practices to follow. Annu Rev Biochem. 86, 277-304 (2017).
- Collins, S. L., Koo, I., Peters, J. M., Smith, P. B., Patterson, A. D. Current challenges and recent developments in mass spectrometry-based metabolomics. Annu Rev Anal Chem (Palo Alto Calif). 14 (1), 467-487 (2021).
- Beale, D. J., et al. Review of recent developments in GC-MS approaches to metabolomics-based research). Metabolomics. 14 (11), 152 (2018).
- Bae, H., Lam, K., Jang, C. Metabolic flux between organs measured by arteriovenous metabolite gradients. Exp Mol Med. 54 (9), 1354-1366 (2022).
- Paulus, A., Drude, N., van Marken Lichtenbelt, W., Mottaghy, F. M., Bauwens, M. Brown adipose tissue uptake of triglyceride-rich lipoprotein-derived fatty acids in diabetic or obese mice under different temperature conditions. EJNMMI Res. 10 (1), 127 (2020).
- Ohlson, K. B., Mohell, N., Cannon, B., Lindahl, S. G., Nedergaard, J. Thermogenesis in brown adipocytes is inhibited by volatile anesthetic agents. A factor contributing to hypothermia in infants. Anesthesiology. 81 (1), 176-183 (1994).
- Ohlson, K. B., et al. Inhibitory effects of halothane on the thermogenic pathway in brown adipocytes: localization to adenylyl cyclase and mitochondrial fatty acid oxidation. Biochem Pharmacol. 68 (3), 463-477 (2004).
- Ohlson, K. B., Lindahl, S. G., Cannon, B., Nedergaard, J. Thermogenesis inhibition in brown adipocytes is a specific property of volatile anesthetics. Anesthesiology. 98 (2), 437-448 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유