Method Article
Metabolomica arterovenosa per misurare lo scambio di metaboliti in vivo nel tessuto adiposo bruno
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
In questo protocollo, vengono descritti i metodi rilevanti per la metabolomica arterovenosa ottimizzata per BAT utilizzando GC-MS in un modello murino. Questi metodi consentono l'acquisizione di preziose informazioni sullo scambio di metaboliti mediati da BAT a livello di organismo.
Abstract
Il tessuto adiposo bruno (BAT) svolge un ruolo cruciale nella regolazione dell'omeostasi metabolica attraverso un processo di dispendio energetico unico noto come termogenesi senza brividi. Per raggiungere questo obiettivo, BAT utilizza un menu diversificato di nutrienti circolanti per supportare la sua elevata domanda metabolica. Inoltre, BAT secerne fattori bioattivi derivati da metaboliti che possono fungere da combustibili metabolici o molecole di segnalazione, facilitando la comunicazione intratissutale e/o intertissutale mediata da BAT. Ciò suggerisce che BAT partecipi attivamente allo scambio sistemico di metaboliti, una caratteristica interessante che sta iniziando ad essere esplorata. Qui, introduciamo un protocollo per la metabolomica arterovenosa BAT ottimizzata a livello di topo in vivo . Il protocollo si concentra su metodi rilevanti per le stimolazioni termogeniche e su una tecnica di prelievo di sangue arterovenoso utilizzando la vena di Sulzer, che drena selettivamente il sangue venoso interscapolare derivato da BAT e il sangue arterioso sistemico. Successivamente, viene dimostrato un protocollo metabolomico basato sulla gascromatografia che utilizza quei campioni di sangue. L'uso di questa tecnica dovrebbe ampliare la comprensione dello scambio di metaboliti regolati dalle BAT a livello interorgano, misurando l'assorbimento netto e il rilascio di metaboliti da parte delle BAT.
Introduzione
Il tessuto adiposo bruno (BAT) possiede una proprietà unica di dispendio energetico nota come termogenesi non tremante (NST), che coinvolge sia i meccanismi dipendenti dalla proteina di disaccoppiamento mitocondriale 1 (UCP1) che quelli indipendenti da UCP1 1,2,3,4,5. Queste caratteristiche distintive implicano BAT nella regolazione del metabolismo sistemico e nella patogenesi delle malattie metaboliche, tra cui l'obesità, il diabete di tipo 2, le malattie cardiovascolari e la cachessia tumorale 6,7,8. Recenti studi retrospettivi hanno mostrato un'associazione inversa tra la massa di BAT e/o la sua attività metabolica con l'obesità, l'iperglicemia e la salute cardiometabolica nell'uomo 9,10,11.
Recentemente, il BAT è stato proposto come un pozzo metabolico responsabile del mantenimento della NST, in quanto richiede notevoli quantità di nutrienti circolanti come combustibile termogenico 6,7. Inoltre, BAT può generare e rilasciare fattori bioattivi, denominati adipochine brune o BATokines, che agiscono come segnali endocrini e/o paracrini, indicando il suo coinvolgimento attivo nell'omeostasi metabolica a livello di sistema 12,13,14,15. Pertanto, la comprensione del metabolismo dei nutrienti del BAT dovrebbe migliorare la nostra comprensione del suo significato fisiopatologico negli esseri umani, al di là del suo ruolo convenzionale come organo termoregolatore.
Gli studi metabolomici che impiegano traccianti isotopici stabili, in combinazione con i classici studi sull'assorbimento dei nutrienti utilizzando radiotraccianti non metabolizzabili, hanno migliorato significativamente la nostra comprensione di quali nutrienti sono assorbiti preferenzialmente da BAT e di come vengono utilizzati 16,17,18,19,20,21,22,23,24,25,26,27. Ad esempio, studi sui traccianti radioattivi hanno dimostrato che il BAT attivato a freddo assorbe glucosio, acidi grassi legati alle lipoproteine e aminoacidi a catena ramificata 16,17,18,19,20,21,22,23,27. Recenti tracciamenti isotopici combinati con studi metabolomici ci hanno permesso di misurare il destino metabolico e il flusso di questi nutrienti all'interno dei tessuti e delle cellule in coltura 24,25,26,28,29,30. Tuttavia, queste analisi si concentrano principalmente sull'utilizzo individuale dei nutrienti, lasciandoci con una conoscenza limitata dei ruoli a livello di sistema di BAT nello scambio di metaboliti d'organo. Le domande riguardanti la serie specifica di nutrienti circolanti consumati dalle BAT e i loro contributi quantitativi in termini di carbonio e azoto rimangono elusive. Inoltre, l'esplorazione della possibilità che BAT possa generare e rilasciare BATokine derivate da metaboliti (ad esempio, lipocine) utilizzando sostanze nutritive è solo all'inizio 12,13,14,15,31,32.
L'analisi del sangue arterovenoso è un approccio fisiologico classico utilizzato per valutare l'assorbimento o il rilascio specifico di molecole circolanti in organi/tessuti. Questa tecnica è stata precedentemente applicata al BAT interscapolare dei ratti per misurare l'ossigeno e diversi metaboliti, stabilendo così il BAT come il principale sito di termogenesi adattativa con il suo potenziale catabolico 33,34,35,36,37. Recentemente, uno studio arterovenoso che utilizza BAT interscapolare di ratto è stato accoppiato con un approccio trans-omico, che ha portato all'identificazione di BATokines non ancora scoperte rilasciate da BAT38 stimolate termogenicamente.
I recenti progressi nella metabolomica basata sulla gascromatografia e sulla cromatografia liquida ad alta sensibilità (GC-MS e LC-MS) hanno riacceso l'interesse per gli studi arterovenosi per l'analisi quantitativa dello scambio di metaboliti organo-specifici 39,40,41. Queste tecniche, con il loro elevato potere risolutivo e l'accuratezza della massa, consentono l'analisi completa di un'ampia gamma di metaboliti utilizzando piccole quantità di campione.
In linea con questi progressi, un recente studio ha adattato con successo la metabolomica arterovenosa per lo studio di BAT a livello di topo, consentendo l'analisi quantitativa delle attività di scambio di metaboliti in BAT in diverse condizioni42. Questo articolo presenta un protocollo di metabolomica arterovenosa mirata a BAT che utilizza GC-MS in un modello murino C57BL/6J.
Protocollo
Tutti gli esperimenti sono stati condotti con l'approvazione del Comitato istituzionale per la cura e l'uso degli animali dell'Università di Sungkyunkwan (IACUC). I topi sono stati alloggiati in una struttura per animali approvata dalla IACUC situata in una camera bianca impostata a 22 °C e 45% di umidità, seguendo un ciclo giornaliero di luce/buio di 12 ore. Erano tenuti in rastrelliere ventilate e avevano accesso a una dieta standard ad libitum (comprendente il 60% di carboidrati, il 16% di proteine e il 3% di grassi). La lettiera e i materiali per la nidificazione sono stati cambiati su base settimanale. Per questo studio sono stati utilizzati topi maschi C57BL/6J di età compresa tra 12 settimane e di peso compreso tra 25 g e 30 g. Questi animali provenivano da un fornitore commerciale (vedi Tabella dei materiali).
1. Modulazione dell'attività metabolica del tessuto adiposo bruno attraverso l'acclimatazione termica e la stimolazione farmacologica
NOTA: L'acclimatazione della temperatura per diversi giorni o settimane o la stimolazione farmacologica utilizzando agonisti del recettore β-adrenergico sono metodi comunemente impiegati per modulare l'attività del BAT1. Pertanto, di seguito viene fornita una breve panoramica del metodo per consentire ai lettori di scegliere l'approccio appropriato in base alle esigenze. Per ottenere BAT metabolicamente inattivi (meno termogenici), viene selezionata una temperatura calda di base, denominata termoneutralità (28-30 °C), per i topi C57BL/6J. Questo intervallo garantisce che i topi non abbiano bisogno di spendere energia extra per mantenere una temperatura corporea costante. Per ottenere BAT metabolicamente modestamente o altamente attive (termogeniche), è possibile scegliere rispettivamente temperature fredde miti (20-22 °C) o fredde severe (6 °C). Ai fini di questo esperimento, i topi sono stati allevati in condizioni di stabulazione standard a 22 °C, che, sebbene leggermente freddi per i topi, non hanno comportato alcuna stimolazione farmacologica.
- Acclimatazione alla temperatura
- Separare i topi per ospitare 1 o 2 topi per gabbia almeno 1 settimana prima di iniziare l'acclimatazione della temperatura. Preparare incubatrici per roditori dotate di ventilazione dell'aria, controllo della temperatura e dell'umidità con le condizioni desiderate.
- Spostare le gabbie nelle rispettive incubatrici per roditori nei giorni appropriati per il tipo di acclimatazione alla temperatura scelto.
- Assicurarsi che la distribuzione del numero di topi sia uniforme in tutti i gruppi, con 1 o 2 topi per gabbia. L'alloggio singolo è preferito in quanto è più sensibile ai cambiamenti fisiologici indotti dalla temperatura rispetto all'alloggio di gruppo43. Ecco le condizioni abitative specifiche per ogni gruppo:
- Gruppo di termoneutralità (30 °C): mantenere i topi di questo gruppo continuamente a una temperatura di 30 °C per un massimo di quattro settimane.
- Gruppo a freddo intenso: Inizialmente, alloggiare i topi in questo gruppo a 18 °C senza alcun materiale di nidificazione. Sperimenteranno una graduale diminuzione settimanale della temperatura, raggiungendo i 6 °C entro la quarta settimana. La progressione della temperatura è la seguente: 18 °C → 14 °C → 10 °C → 6 °C.
- Gruppo freddo mite (20-22 °C): Alloggiare i topi di questo gruppo in incubatrici per roditori nelle stesse condizioni delle condizioni di stabulazione standard menzionate in precedenza.
- Sfide da freddo acuto: per le sfide da freddo acuto, posizionare 1-2 topi per gabbia senza materiali di nidificazione ed esporli a un'incubatrice per roditori impostata a 6 °C per un massimo di 8 ore.
NOTA: Queste condizioni di stabulazione e variazioni di temperatura sono essenziali per studiare gli effetti di ambienti a temperatura diversa sull'attività e sul metabolismo delle BAT.
- Cambia le gabbie e rifornisci cibo e acqua ogni settimana. Preacclimatare le gabbie almeno 24 ore prima dell'integrazione, alla rispettiva temperatura (incubatrice per roditori).
NOTA: Per evitare il disturbo dello stimolo termico appropriato, è importante non fornire arricchimenti di topi che potrebbero portare alla costruzione del nido. In risposta al freddo intenso, i topi consumano più energia per mantenere la temperatura corporea, con conseguente aumento dell'assunzione di cibo e tassi di escrezione più elevati. Pertanto, è fondamentale controllare le gabbie almeno due o tre volte a settimana (seguendo le linee guida istituzionali locali) per assicurarsi che i topi abbiano un'adeguata scorta di cibo e acqua e che le gabbie non siano eccessivamente bagnate. Questo monitoraggio è essenziale per mantenere il benessere e la salute dei topi durante lo studio.
- Stimolazione farmacologica1 con l'agonista del recettore β3-adrenergico CL316,243
- Per massimizzare l'effetto stimolante, pre-alloggiare i topi a termoneutralità (30 °C) per 2-4 settimane prima delle iniezioni.
- Dopo il periodo di acclimatazione, iniettare per via intraperitoneale 1 mg/kg CL316,243.
NOTA: Per la stimolazione cronica con l'agonista del recettore β3-adrenergico (ad es. da 3 giorni fino alle settimane 1,44,45), sono necessarie iniezioni giornaliere a causa della stabilità del farmaco. CL316,243 diluito deve essere preparato il giorno dell'iniezione a causa della stabilità.
2. Prelievo di sangue arterovenoso
NOTA: I topi di età superiore a 12-14 settimane sono meglio raccomandati per il prelievo di sangue arterovenoso. I topi più giovani potrebbero non avere vene di Sulzer di dimensioni sufficienti, un vaso sanguigno distinto che drena specificamente il sangue venoso dal BAT46 interscapolare.
- Anestetizzare delicatamente utilizzando il vaporizzatore calibrato con isoflurano al 3% per induzione (in una camera di dimensioni 205 x 265 x 200 mm) e isoflurano al 2% per il mantenimento (con una maschera per anestesia gassosa).
NOTA: L'intera procedura di prelievo di sangue arterovenoso deve essere eseguita tempestivamente dopo l'anestesia. Un cuscinetto riscaldante riscaldato ad acqua può essere utilizzato durante l'anestesia per mantenere la temperatura corporea interna.
ATTENZIONE: L'isoflurano è altamente volatile e tossico se inalato. Pertanto, l'anestesia primaria deve essere eseguita sotto una cappa aspirante. - Verificare i riflessi dell'animale, come la retrazione delle zampe, per confermare che l'anestesia abbia raggiunto una profondità adeguata.
- Raccolta di sangue venoso dalla vena del Sulzer
- Posizionare il mouse in modo da esporre la pelle dorsale, confermare la profondità dell'anestesia con un pizzicotto del dito del piede prima di eseguire l'incisione. Inumidire la pelle dorsale con abbondante etanolo al 70% per evitare il distacco dei peli e praticare un'incisione lungo la schiena dalla parte inferiore del torace fino al collo.
NOTA: Il BAT interscapolare si trova proprio sotto la pelle, costituito da due cuscinetti adiposi ricoperti da sottili tessuti adiposi bianchi. È importante assicurarsi che il topo rimanga sotto anestesia attraverso la maschera per anestesia gassosa. - Sollevare delicatamente il BAT interscapolare con una pinza a punta piegata e tagliare con cura i tessuti attaccati, la maggior parte dei quali sono muscoli. Sollevare il cuscinetto adiposo verso la testa, continuare a tagliare i tessuti attaccati e aprire con cautela la regione fino a quando la vena di Sulzer (un grande vaso rosso scuro a forma di "Y" collegato a entrambi i cuscinetti adiposi della BAT interscapolare) è esposta.
NOTA: Fare attenzione a non tagliare i vasi capillari dei tessuti muscolari che sono collegati con la regione anteriore e laterale del BAT interscapolare, poiché ciò ridurrà significativamente la quantità e la qualità del sangue che drena dalla vena di Sulzer. - Tagliare con cura la vena di Sulzer e raccogliere circa 40 μL di sangue utilizzando puntali per pipette da 200 μL tagliati dal basso e una pipetta P100. Conservare il sangue in una provetta per la raccolta del sangue e tenere la provetta su ghiaccio fino al processo di raccolta del siero.
NOTA: È importante raccogliere il sangue appena sotto il punto di divisione a forma di Y della vena di Sulzer, per evitare la contaminazione del sangue dalla vena cava superiore47. Raccogliere troppo sangue diminuirà le caratteristiche della vena di Sulzer. Pertanto, assicurati di raccogliere la quantità minima di sangue necessaria dalla vena di Sulzer per l'analisi. Prestare attenzione quando si selezionano le provette per la raccolta del sangue, poiché il siero e il plasma producono diversi profili di metaboliti 48,49,50. Per la raccolta del plasma, è necessario utilizzare provette rivestite di eparina. In questo esperimento, sono stati scelti tubi rivestiti di attivatori della coagulazione per ottenere il siero. In nessun caso devono essere utilizzate provette rivestite di EDTA, poiché l'EDTA ha un impatto significativo sui segnali di spettrometria di massa51,52.
- Posizionare il mouse in modo da esporre la pelle dorsale, confermare la profondità dell'anestesia con un pizzicotto del dito del piede prima di eseguire l'incisione. Inumidire la pelle dorsale con abbondante etanolo al 70% per evitare il distacco dei peli e praticare un'incisione lungo la schiena dalla parte inferiore del torace fino al collo.
- Prelievo di sangue arterioso dal ventricolo sinistro
- Capovolgere il mouse senza perdere il contatto con l'ogiva nasale, per esporre la pelle ventrale. Confermare la profondità dell'anestesia pizzicando un dito del piede prima di eseguire l'incisione. Inumidire la pelle ventrale con un'ampia quantità di etanolo al 70% per prevenire il distacco dei capelli e aprire con cautela la cavità toracica con le forbici per esporre il cuore senza danneggiare alcuna struttura interna.
- Perforare accuratamente l'area apicale del ventricolo sinistro utilizzando una siringa da 1 ml con un ago da 29 G (1/2"). Inserire due terzi di un ago da 1/2'' a 3-5 mm all'orizzontale destra dell'apice del cuore (Figura 1B) e tirare indietro la siringa per raccogliere il sangue dal ventricolo sinistro (50-100 μL). Il sangue proveniente dal ventricolo sinistro è sangue arterioso ossigenato di colore rosso vivo. Conservare il sangue in una provetta per la raccolta del sangue e tenere la provetta su ghiaccio fino al processo di raccolta del siero.
NOTA: È necessario praticare un'incisione minima nella cavità toracica per l'accesso al cuore. Un'incisione eccessiva potrebbe portare a sanguinamento locale, che può successivamente provocare un abbassamento della pressione sanguigna. Ciò potrebbe influire sulla qualità del sangue arterioso raccolto dal ventricolo sinistro. Evita di ruotare o capovolgere il cuore, poiché renderà difficile determinare la posizione precisa del ventricolo sinistro. - Eseguire l'eutanasia e assicurarla con un metodo appropriato seguendo le linee guida delle istituzioni locali. Ad esempio, l'eutanasia può essere eseguita attraverso la lussazione cervicale e confermata dalla cessazione del battito cardiaco.
- Centrifugare i campioni di sangue a 10.000 x g per 10 minuti a 4 °C. Raccogliere con cura il surnatante utilizzando una pipetta. Il surnatante deve contenere siero o plasma a seconda del tipo di provetta per la raccolta del sangue utilizzata. Ci si può fermare qui e conservare i campioni a -20 °C fino all'elaborazione del siero per l'analisi GC-MS.
NOTA: L'emolisi può potenzialmente essersi verificata se si osserva un surnatante di colore rosso. Per evitare l'emolisi, ruotare il campione prima che la coagulazione sia completata. Alcuni metaboliti arricchiti di globuli rossi, tra cui la glutammina e il lattato, potrebbero portare a un'interpretazione errata dei dati, sebbene la maggior parte dei metaboliti non sia significativamente influenzata dall'emolisi. Si raccomanda di analizzare il siero/plasma entro una settimana.
3. Estrazione di metaboliti dal siero e derivatizzazione chimica
- Preparazione per l'estrazione
NOTA: Tutti i metodi, tra cui l'estrazione dei metaboliti, la derivatizzazione e l'analisi dei dati, sono versioni leggermente modificate dei metodi descritti in precedenza53,54.- Preparare il tampone di estrazione aggiungendo una soluzione di 100 μM di DL-norvalina, standard interno (vedere la tabella dei materiali), al metanolo di grado MS.
- Assicurarsi che tutte le procedure sperimentali siano condotte su ghiaccio.
- Trasferire 10 μL di siero di topo estratto dalla vena di Sulzer o dal ventricolo sinistro in una provetta per microcentrifuga da 1,5 mL contenente 40 μL di tampone di estrazione.
- Per rimuovere i detriti cellulari e le proteine, far vorticare brevemente i campioni di siero, quindi centrifugare alla massima velocità (18.000 x g) per 30 minuti a 4 °C.
- Dopo la centrifugazione, trasferire con cautela 40 μL di surnatante in un flaconcino di vetro, seguiti da 3 ore di essiccazione in una centrifuga sottovuoto a 4 °C.
NOTA: Si consiglia un inserto in vetro (vedere la tabella dei materiali) al posto dei tubi di plastica a causa delle sostanze chimiche reattive alla plastica utilizzate durante la successiva fase di derivatizzazione. - Sottoporre i campioni essiccati a due fasi di derivatizzazione consecutive per l'analisi GC-MS dei metaboliti sierici.
NOTA: I seguenti passaggi devono essere eseguiti sotto una cappa aspirante a causa dei rischi di irritazione dei solventi.- Risospendere gli estratti di siero essiccato in 30 μL di 10 mg/mL di metossiamina cloridrato (vedere Tabella dei materiali) disciolti in piridina e incubare a 37 °C per 30 min.
- Derivatizzare i campioni per la sililazione dei metaboliti con 70 μL di N-metil-N-terz-butildimetilsilrifluoroacetammide (MTBSTFA, vedere la tabella dei materiali) a 70 °C per 1 ora.
NOTA: Si consiglia l'uso di una siringa di vetro piuttosto che di una punta di plastica nei passaggi seguenti a causa dei solventi di derivatizzazione che reagiscono con la plastica.
4. Analisi metabolomica mediante GC-MS
NOTA: La GC-MS quadrupla singola (vedi Tabella dei materiali) è stata impiegata per misurare i vari metaboliti sierici tra cui carboidrati, amminoacidi e intermedi del ciclo TCA in campioni derivatizzati dalla vena di Sulzer e dal ventricolo sinistro. In alternativa, è possibile utilizzare altre colonne, anche se le impostazioni sperimentali, incluso il programma di temperatura, possono variare a seconda dei tipi di colonne utilizzate.
- Iniettare 1 μL del campione derivatizzato nel GC in modalità splitless a 280 °C (temperatura di ingresso), utilizzando l'elio come gas di trasporto con una portata di 1.500 mL/min (set point).
- Impostare il quadrupolo a 200 °C con interfaccia GC-MS a 300 °C.
NOTA: Il programma del forno per tutte le analisi dei metaboliti inizia a 60 °C, viene mantenuto per 1 min, quindi viene aumentato a una velocità di 10 °C/min fino a quando la temperatura raggiunge i 320 °C. - Raccogliere i dati mediante ionizzazione elettronica (EI) impostata a 70 eV e acquisire i dati del campione in modalità di scansione (50-550 m/z)53. Tutti i metaboliti utilizzati in questo studio sono stati precedentemente convalidati con standard per confermare gli spettri di massa e i tempi di ritenzione.
- Eseguire l'integrazione dell'area di picco utilizzando un software di analisi disponibile in commercio (vedi Tabella dei materiali).
- Abbinare i composti con lo ione prodotto di ciascun derivato TBMDS. Quindi, ottenere il cromatogramma ionico di estrazione (EIC) integrando il valore m/z dello ione frammento nell'area del picco corrispondente, quindi esportarlo. Gli ioni frammento sono mostrati nella Tabella 1.
NOTA: L'EIC di ciascun composto è stato normalizzato da quello della DL-norvalina in ciascun campione. I dati sono rappresentati dalla vena di Sulzer al ventricolo sinistro (Log2(SV/LV)) utilizzando ciascun valore EIC normalizzato.
Risultati
La Figura 1 illustra lo schema sperimentale della metabolomica AV ottimizzata per BAT. Come accennato nella sezione Protocollo, per ottenere tessuti adiposi bruni stimolati in modo differenziale, i topi vengono sottoposti ad acclimatazione termica utilizzando incubatrici per roditori o ricevono somministrazione farmacologica come agonisti del recettore β-adrenergico. Successivamente, i topi vengono anestetizzati e vengono raccolti campioni di sangue per l'analisi metabolomica (Figura 1A). Per il prelievo di sangue, il sangue venoso che drena specificamente dal BAT interscapolare viene raccolto attraverso la vena di Sulzer, mentre il sangue arterioso viene raccolto direttamente dal ventricolo sinistro del cuore (Figura 1B).
La Figura 2 rappresenta gli schemi della metabolomica sierica utilizzando GC-MS (Figura 2). In breve, la soluzione di metanolo viene aggiunta ai campioni di siero seguita da centrifugazione per rimuovere le proteine del siero. Il surnatante contenente i metaboliti è stato essiccato in uno SpeedVac e i campioni essiccati sono stati sottoposti a derivatizzazione in due fasi utilizzando metossiamina (MOX) e MTBSTFA (N-terz-Butildimetilsilil-N-metiltrifluoroacetammide). La fase di derivatizzazione mira alla sostituzione dei gruppi funzionali polari dei metaboliti con l'estere TBDMS, consentendo la rilevazione GC-MS dei metaboliti come derivati TBDMS. I campioni derivatizzati sono stati analizzati utilizzando GC-MS quadrupla singola. I metaboliti sono separati nella colonna in base alle loro proprietà fisico-chimiche. La ionizzazione elettronica (EI) viene impiegata per scomporre i metaboliti in frammenti di ioni unici rilevati da un rivelatore di massa. L'identificazione dei composti viene effettuata attraverso il rilevamento di ioni frammento specifici del composto. Il valore m/z e il tempo di ritenzione degli ioni frammento specifici del composto nell'esperimento sono mostrati nella tabella (Tabella 1). Un cromatogramma ionico estratto (EIC) viene utilizzato per integrare il segnale di uno ione frammento specifico del composto nell'area del picco del metabolita, che definisce l'abbondanza dei metaboliti.
Per determinare se BAT rilascia o assorbe una serie di metaboliti, è possibile calcolare i rapporti Log2 della conta ionica tra la vena di Sulzer e il ventricolo sinistro (Log2(SV/LV)) (Figura 3). Se il valore Log2 (SV/LV) per un particolare metabolita è >0, indica che il metabolita è più abbondante nel SV rispetto al LV, suggerendo che la rete BAT interscapolare rilascia il metabolita. Al contrario, se il valore di Log2 (SV/LV) per un determinato metabolita è <0, suggerisce che il metabolita è assorbito dalla BAT interscapolare.
Utilizzando questo approccio, è stato riscontrato che il BAT leggermente stimolato dal freddo consuma in modo significativo glucosio, lattato, 3-idrossibutirrato (3-HB), BCAA, aspartato, lisina e triptofano, mentre il BAT rilascia significativamente succinato e palmitato (Figura 3A). La maggior parte di questi fenomeni sono stati osservati nei nostri studi precedenti sulla BAT42 per il raffreddore cronico, suggerendo che la BAT per il raffreddore moderato assomiglia metabolicamente alla BAT per il raffreddore cronico, anche se in misura minore. Per fornire una rapida panoramica visiva dei dati, viene illustrata una mappa termica che mostra i valori del Log2 (SV/LV) (Figura 3B). È essenziale interpretare i dati con cautela, poiché la mappa di calore rappresenta i punteggi Z all'interno del gruppo.
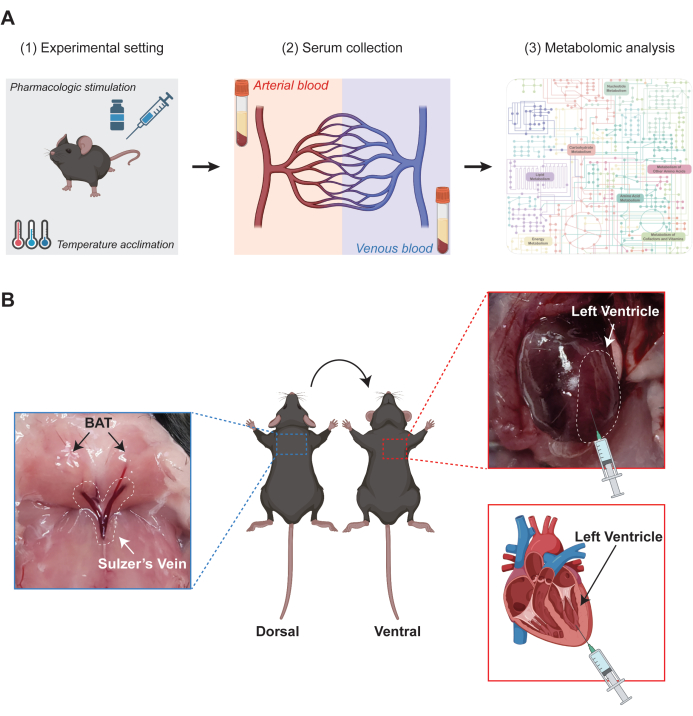
Figura 1: Schema sperimentale della metabolomica arterovenosa (AV) ottimizzata per BAT. (A) Diagramma che mostra il flusso di lavoro della metabolomica AV. (1) Per indurre diverse versioni di tessuto adiposo bruno (BAT) stimolato metabolicamente, i topi vengono acclimatati a temperature diverse o ricevono iniezioni farmacologiche. (2) Successivamente, i campioni di sangue arterioso e venoso vengono raccolti rispettivamente dal ventricolo sinistro e dalla vena di Sulzer dei topi. (3) I campioni di siero ottenuti vengono sottoposti all'estrazione dei metaboliti, seguita dall'analisi metabolomica. (B) Immagini rappresentative che forniscono indicazioni per le procedure di prelievo del sangue. Il sangue arterioso viene raccolto dal ventricolo sinistro, mentre il sangue venoso viene ottenuto dalla vena del Sulzer in quanto drena specificamente il sangue dal BAT. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Metabolomica mirata basata su GC/MS. Schema sperimentale di metabolomica mirata basata su GC/MS. TBDMS: terz-butildimetilsilile, EI: ionizzazione elettronica, EIC: cromatogramma ionico di estrazione. Fare clic qui per visualizzare una versione più grande di questa figura.
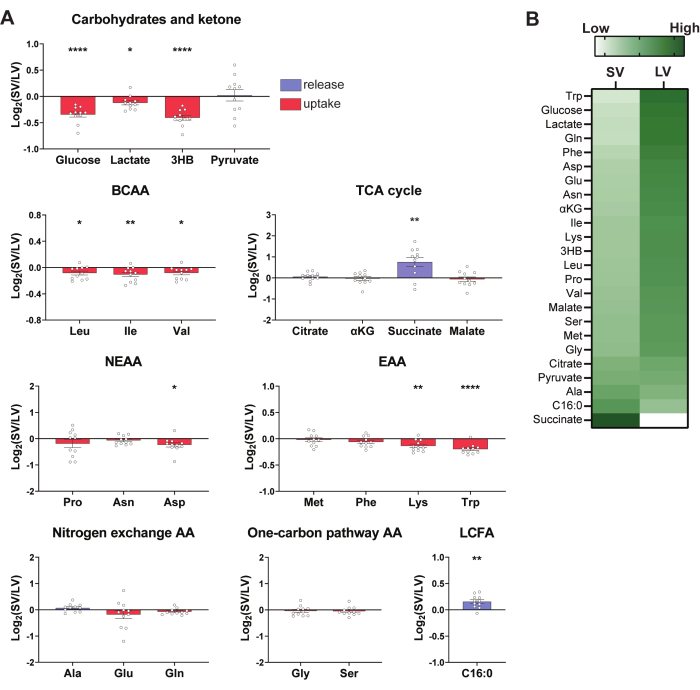
Figura 3: Dati rappresentativi della metabolomica atrioventricolare. (A) L'assorbimento e il successivo rilascio di metaboliti selezionati prevalenti e altamente attivi del combustibile circolante mediante BAT, classificati in base ai rispettivi gruppi. I dati mostrano il rapporto vena/ventricolo sinistro (SV/LV) di Log2 Sulzer. Le barre che indicano i metaboliti con Log2 medio (SV/LV) <0 sono colorate in rosso e Log2 (SV/LV) >0 sono colorate in blu. I singoli punti dati rappresentano ogni mouse; n = 11. I dati sono medi ± SEM. *p < 0,05, **p < 0,01, ***p < 0,001. BCAA; amminoacido a catena ramificata; EAA; amminoacido essenziale; NEAA; aminoacido non essenziale. (B) Una mappa termica che illustra l'abbondanza differenziale di metaboliti tra il sangue della vena di Sulzer (SV) e del ventricolo sinistro (LV). Ogni colonna mostra un punteggio Z dei valori medi all'interno del gruppo; n = 11. Fare clic qui per visualizzare una versione più grande di questa figura.
| Composto | m/z di Ioni frammento | Tempo di ritenzione | Formulario | Formulatore derivato TBDMS |
| Piruvato | 174.1 | 8.72 | C3H4O3 | C15H33O3NSi2 |
| Aspartato | 418.2 | 18.45 | C4H7NO4 | C22H49NO4Si3 |
| α-chetoglutarato | 346.2 | 17.27 | C5H6O5 | C18H37NO5Si2 |
| C16:0 (Palmitato) | 313.3 | 19.72 | C16H32O2 | C22H46O2Si |
| Lattato | 261.2 | 11.66 | C3H6O3 | C15H34O3Si2 |
| Leucina | 200.2 | 14 | C6H13NO2 | C18H41NO2Si2 |
| Isoleucina | 200.2 | 14.34 | C6H13NO2 | C18H41NO2Si2 |
| Valina | 186.2 | 13.53 | C5H11NO2 | C17H39NO2Si2 |
| Alanina | 260.2 | 12.17 | C3H7NO2 | C15H35NO2Si2 |
| Serina | 390.2 | 17.04 | C3H7NO3 | C21H49NO3Si3 |
| Glicina | 218.1 | 12.43 | C2H5NO2 | C14H33NO2Si2 |
| Lisina | 300.2 | 20.48 | C6H14N2O2 | C24H56N2O2Si3 |
| Succinato | 289.1 | 14.65 | C4H6O4 | C16H34O4Si2 |
| Prolina | 258.2 | 14.73 | C5H9NO2 | C17H37NO2Si2 |
| Fenilalanina | 336.2 | 18 | C9H11NO2 | C21H39NO2Si2 |
| Metionina | 320.2 | 16.84 | C5H11NO2S | C17H39NO2SSi2 |
| Cisteina | 406.2 | 19 | C3H7NO2S | C21H49NO2SSi3 |
| Asparagina | 417.2 | 19.86 | C4H8N2O3 | C22H50N2O3Si3 |
| 3-idrossibutirrato (3HB) | 275.2 | 12.81 | C4H8O3 | C16H36O3Si2 |
| Triptofano | 375.2 | 22.97 | C11H12N2O2 | C23H40N2O2Si2 |
| Malato | 419.2 | 18.19 | C4H6O5 | C22H48O5Si3 |
| Glutammato | 432.3 | 19.59 | C5H9NO4 | C23H51NO4Si3 |
| Glutammina | 431.3 | 20.85 | C5H10N2O3 | C23H52N2O3Si3 |
| Citrato | 459.2 | 22.38 | C6H8O7 | C30H64O7Si4 |
| Glucosio | 476.3 | 22.7 | C6H12O6 | C30H68O6Si4 |
Tabella 1: ioni frammento composto GC/MS utilizzati per l'integrazione. Questa tabella contiene un elenco di 25 metaboliti sierici identificati nel presente metodo, con il tempo di ritenzione e gli ioni frammento corrispondenti a ciascun composto.
Discussione
Un passo fondamentale per comprendere il potenziale metabolico del BAT nell'equilibrio energetico di tutto il corpo è definire quali nutrienti consuma, come vengono metabolicamente elaborati e quali metaboliti vengono rilasciati nella circolazione. Questo protocollo introduce una tecnica specializzata di campionamento arterovenoso che consente l'accesso alla vascolarizzazione venosa del BAT interscapolare e alla vascolarizzazione arteriosa sistemica nei topi C57BL/6J, che è stata recentemente sviluppata e convalidata da Park et al42. Di seguito sono riportati i punti chiave da considerare in modo critico quando si segue il protocollo.
Per la stimolazione termogenica, una considerazione chiave è la scelta del tipo di stimolazione termogenica più appropriato per il tuo ambiente sperimentale. Ad esempio, quando si utilizza un gruppo sperimentale (rispetto al controllo) e si mirano a osservare le differenze nella capacità di adattamento metabolico (cruciale per il suo massimo potenziale termogenico non rabbrividente) della BAT, è adatta l'acclimatazione cronica al freddo o la stimolazione del recettore β-adrenergico (che dura da più di 3 giorni a 4 settimane) 1,45. Quando il BAT è esposto a un'esposizione acuta al freddo (poche ore in meno di 24 ore), invece di adattarsi metabolicamente, il BAT metabolizza i suoi combustibili immagazzinati intrinseci e comunica metabolicamente con i muscoli tremanti per una termogenesi ottimale1. Un agonista del recettore β-adrenergico rappresenta una risposta neuronale per innescare la termogenesi BAT 1,14 e ci sono altri fattori endocrini che migliorano il programma termogenico 55,56,57,58,59,60. Ogni volta che si esegue la stimolazione termogenica come menzionato sopra, avere un controllo di base a termoneutralità (30 °C) dovrebbe essere utile per confermare se la stimolazione ha funzionato in modo appropriato.
Come accennato nella sezione del protocollo, l'ottenimento di sangue arterovenoso della massima qualità è fondamentale per determinare il successo dell'esperimento. A tal fine, è essenziale prevenire l'emolisi (vedere il punto 2.5) e raccogliere una quantità consistente di sangue per evitare la diluizione delle caratteristiche distinte del sangue venoso dalla vena di Sulzer (meno di 40 μL dalla vena di Sulzer). A tal fine, durante la configurazione iniziale, gli autori raccomandano vivamente di eseguire un esperimento pilota per la misurazione dei metaboliti utilizzando non solo il sangue della vena di Sulzer, ma anche il sangue del sangue venoso drenante non BAT (ad esempio la vena cava inferiore). Ciò contribuirà a confermare se il siero della vena di Sulzer rivela un profilo di metaboliti distinto rispetto ai vasi venosi non BAT. Per quanto riguarda la raccolta di sangue arterioso dal ventricolo sinistro, è importante perforare costantemente la stessa area sul ventricolo sinistro per ridurre al minimo le variazioni dei livelli di cardiochine61,62. Tali variazioni potrebbero produrre risultati confusi nella metabolomica arterovenosa o nella proteomica.
La cromatografia accoppiata alla spettrometria di massa è uno degli strumenti più potenti per la metabolomica, uno dei metodi è GC-MS63. In effetti, la misurazione dei metaboliti biologicamente rilevanti utilizzando GC-MS è stata considerata impegnativa a causa del problema della copertura; L'applicazione della GC-MS è solitamente limitata all'analisi di metaboliti con proprietà altamente volatili e non polari rispetto ai numerosi metaboliti polari nei tessuti e nei fluidi biologici. Tuttavia, lo sviluppo di vari metodi di estrazione e derivatizzazione, insieme ai vantaggi della GC-MS, tra cui l'eccellente risoluzione dei picchi, la riproducibilità e le ampie librerie spettrali di massa che consentono una comoda identificazione dei picchi, ha portato a una piattaforma come opzione interessante per l'analisi di metaboliti biologicamente rilevanti64,65.
In questo protocollo, la piattaforma GC-MS viene impiegata per l'analisi di 25 metaboliti nel siero raccolto utilizzando la suddetta tecnica. A tal fine, l'estrazione dei metaboliti è stata effettuata utilizzando una soluzione di metanolo all'80%. Da notare che, durante questa fase, si consiglia di utilizzare alcuni tipi di provette, tra cui le provette Eppendorf, per ottenere i livelli più bassi di contaminazione da sostanze organiche nei campioni. Un'attenta separazione del surnatante dai pellet dopo l'estrazione è necessaria anche per rimuovere i detriti proteici dal siero, che è fondamentale per il mantenimento delle prestazioni della sorgente di ioni MS.
La fase di derivatizzazione può essere diversificata in base ai tipi di derivatizzazioni, inclusi i derivati arilici, la sililazione e l'acilazione66. Gli autori hanno impiegato la derivatizzazione in due fasi con N-metil-N-terz-butildimetilsilrifluoroacetammide (MTBSTFA) per la sialilazione dei metaboliti, che è un metodo comunemente usato con il vantaggio di un rilevamento stabile di metaboliti polari biologicamente rilevanti, compresi gli zuccheri, ma con uno svantaggio per quanto riguarda la perdita occasionale del gruppo N-trimetilsilil di ammine e amminoacidi durante la fase64 dell'analisi. Da notare che i campioni devono essere completamente asciugati prima della fase di derivatizzazione, a causa della sensibilità all'umidità dei reagenti e dei derivati.
Uno dei principali limiti dell'analisi GC, in generale, si riduce ancora alla gamma di metaboliti rilevabili, nonostante le suddette fasi di derivatizzazione che migliorano la capacità GC-MS per quanto riguarda la rilevazione dei metaboliti polari, soprattutto rispetto all'analisi basata su LC-MS. La metabolomica quantitativa che utilizza LC-MS può aiutare notevolmente a ottenere una migliore comprensione dello spettro metabolico dei BAT rispetto allo scambio sistemico di metaboliti24,42.
Sebbene il calcolo utilizzato nel protocollo-misurazione del gradiente di concentrazione dei metaboliti tra l'arterioso vs. sangue venoso; Log2 (SV/LV) - quantifica l'assorbimento frazionato e la variazione del rilascio da parte della BAT, è necessaria cautela per l'interpretazione dei dati. In particolare, per quei metaboliti il cui valore di scambio netto frazionario è «0» (ad esempio citrato, αKG, malato, metionina, alanina, glutammina), il risultato potrebbe essere attribuito all'assenza di assorbimento/rilascio o al catabolismo e alla sintesi ugualmente attivi (in cui sia l'assorbimento che il rilascio sono elevati). Per verificare quale delle due possibilità sia corretta, sono necessari ulteriori esperimenti di flusso metabolico utilizzando il tracciamento isotopico in vivo con il metabolita assorbito e/o il suo substrato39.
Il limite del calcolo frazionario consiste nel fatto che non fornisce il panorama quantitativo dell'assorbimento e del rilascio di tali metaboliti 42,67. Ad esempio, sebbene il valore di Log2 (SV/LV) indichi un assorbimento netto relativo comparabile tra glucosio e 3-idrossibutirrato (3HB), il contributo effettivo del glucosio alle fonti di carbonio dovrebbe essere molto più alto del 3-HB a causa del fatto che la concentrazione ematica di glucosio è molto più alta di quella del 3HB e perché il glucosio contiene quattro atomi di carbonio in più (il glucosio ha sei atomi di carbonio; il 3HB ne ha due). Se necessario, un'analisi completa che includa parametri aggiuntivi, come la velocità del flusso sanguigno, le concentrazioni ematiche effettive di ciascun metabolita e le loro equazioni chimiche, dovrebbe informarci sui contributi quantitativi dei metaboliti assorbiti/rilasciati e sui loro contributi al flusso totale di carbonio o azoto42,67.
Uno dei principali vantaggi di questa metodologia miniaturizzata per il prelievo di sangue arterovenoso e l'analisi metabolomica a livello murino è la sua combinazione sinergica con vari modelli genetici per studiare il metabolismo e la fisiologia del tessuto adiposo bruno (ad es. modelli di perdita di funzione specifici per BAT guidati da UCP1-KO, UCP1-Cre, modelli transgenici). La recente analisi metabolomica, che richiede solo tracce di siero per la profilazione metabolomica, rende questo approccio più fattibile con organismi più piccoli (vedi protocollo 3)39. Tuttavia, l'analisi proteomica, che può fornire informazioni migliori se considerata insieme alla metabolomica, può richiedere maggiori quantità di campioni. A questo proposito, il campionamento arterovenoso convenzionale con ratti può essere più adatto. Rimandiamo i lettori al più recente protocollo per il prelievo di sangue arterovenoso per BAT nei ratti, scritto da Mestres-Arenas e colleghi47.
Sebbene l'attuale protocollo adotti la procedura di anestesia utilizzando l'isoflurano come descritto in Park et al.42, questo approccio può avere un impatto negativo sul metabolismo termogenico degli adipociti bruni e/o del tessuto adiposo bruno in vivo 68,69,70,71. Pertanto, la futura metabolomica arterovenosa che utilizza il pentobarbital giustifica l'indagine.
In sintesi, questo protocollo fornisce una metodologia fondamentale per misurare l'attività metabolica netta specifica della BAT (consumo vs. produzione) su varie stimolazioni termogeniche. Questo dovrebbe fornirci preziose informazioni sul ruolo di BAT come pozzo di assorbimento sistemico dei nutrienti e come fornitore, elencando quantitativamente i principali combustibili metabolici e i metaboliti secreti. Inoltre, questo può anche essere utile per identificare adipochine brune derivate da metaboliti precedentemente non studiate, specialmente se operate con piattaforme metabolomiche basate sulla scoperta.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse da segnalare.
Riconoscimenti
Ringraziamo tutti i membri dei laboratori Choi e Jung per la discussione metodologica. Ringraziamo C. Jang e D. Guertin per i consigli e i feedback. Si ringrazia M.S. Choi per la lettura critica del manoscritto. Questo lavoro è stato finanziato da NRF-2022R1C1C1012034 a S.M.J.; NRF-2022R1C1C1007023 a D.W.C; NRF-2022R1A4A3024551 a S.M.J. e D.W.C. Questo lavoro è stato supportato dalla Chungnam National University per W.T.K. La Figura 1 e la Figura 2 sono state create utilizzando BioRender (http://biorender.com/).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.5-20 µL Filter Tips | Axygen | AX.TF-20-R-S | |
| 1 mL Syringe with attached needle - 26 G 5/8" | BD Biosciences | 309597 | |
| Agilent 5977B GC/MSD (mass selective detector) | Agilent | G7077B | |
| Agilent 7693A Autosampler | Agilent | G4513A | |
| Agilent 8890 GC System | Agilent | G3542A | |
| Agilent J&W GC column (Capilary column) HP-5MS UI | Agilent | 19091S-433UI | |
| Agilent MassHunter Workstation software_MS Quantitative analysis(Quant-My-way) | Agilent | G3335-90240 | |
| C57BL/6J mouse | DBL | C57BL/6JBomTac | |
| CentriVap -50 °C Cold Trap (with Stainless steel Lid) | LABCONCO | 7811041 | |
| DL-Norvaline | Sigma-Aldrich | N7502-25G | |
| Eppendorf centrifuge 5430R | Eppendorf | 5428000210 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppendorf | 30120086 | |
| Glass insert 250 μL | Agilent | 5181-1270 | |
| Methanol (LC-MS grade) | Sigma-Aldrich | Q34966-1L | |
| Methoxyamine hydrochloride | Sigma-Aldrich | 226904-5G | |
| Microvette 200 Serum, 200 µL, cap red, flat base | Sarstedt | 20.1290.100 | |
| MTBSTFA | Sigma-Aldrich | 394882-100ML | |
| Pyridine(anhydrous, 99.8%) | Sigma-Aldrich | 270970-100ML | |
| Refrigerated CentriVap Complete Vaccum Concentrators | LABCONCO | 7310041 | |
| Rodent diet | SAFE | SAFE R+40-10 | |
| Rodent incubator | Power scientific | RIT33SD | |
| Ultra-Fine Pen Needles - 29 G 1/2" | BD Biosciences | 328203 | |
| Vial Cap 9 mm | Agilent | 5190-9067 | |
| Vial, ambr scrw wrtn 2 mL | Agilent | 5190-9063 | |
| Vial, ambr scrw wrtn 2 mL+A2:C40 | Axygen | PCR-02-C |
Riferimenti
- Cannon, B., Nedergaard, J. Brown adipose tissue: function and physiological significance. Physiol Rev. 84 (1), 277-359 (2004).
- Ikeda, K., et al. UCP1-independent signaling involving SERCA2b-mediated calcium cycling regulates beige fat thermogenesis and systemic glucose homeostasis. Nat Med. 23 (12), 1454-1465 (2017).
- Kazak, L., et al. A creatine-driven substrate cycle enhances energy expenditure and thermogenesis in beige fat. Cell. 163 (3), 643-655 (2015).
- Rahbani, J. F., et al. Creatine kinase B controls futile creatine cycling in thermogenic fat. Nature. 590 (7846), 480-485 (2021).
- Ukropec, J., Anunciado, R. P., Ravussin, Y., Hulver, M. W., Kozak, L. P. UCP1-independent thermogenesis in white adipose tissue of cold-acclimated Ucp1-/- mice. J Biol Chem. 281 (42), 31894-31908 (2006).
- Chen, K. Y., et al. Opportunities and challenges in the therapeutic activation of human energy expenditure and thermogenesis to manage obesity. J Biol Chem. 295 (7), 1926-1942 (2020).
- Wolfrum, C., Gerhart-Hines, Z. Fueling the fire of adipose thermogenesis. Science. 375 (6586), 1229-1231 (2022).
- Seki, T., et al. Brown-fat-mediated tumour suppression by cold-altered global metabolism. Nature. 608 (7922), 421-428 (2022).
- Becher, T., et al. Brown adipose tissue is associated with cardiometabolic health. Nat Med. 27 (1), 58-65 (2021).
- Chondronikola, M., et al. Brown adipose tissue improves whole-body glucose homeostasis and insulin sensitivity in humans. Diabetes. 63 (12), 4089-4099 (2014).
- Yoneshiro, T., et al. Recruited brown adipose tissue as an antiobesity agent in humans. J Clin Invest. 123 (8), 3404-3408 (2013).
- Villarroya, F., Cereijo, R., Villarroya, J., Giralt, M. Brown adipose tissue as a secretory organ. Nat Rev Endocrinol. 13 (1), 26-35 (2017).
- Villarroya, J., et al. New insights into the secretory functions of brown adipose tissue. J Endocrinol. 243 (2), R19-R27 (2019).
- Scheele, C., Wolfrum, C. Brown adipose crosstalk in tissue plasticity and human metabolism. Endocr Rev. 41 (1), 53-65 (2020).
- Scheja, L., Heeren, J. The endocrine function of adipose tissues in health and cardiometabolic disease. Nat Rev Endocrinol. 15 (9), 507-524 (2019).
- Nedergaard, J., Bengtsson, T., Cannon, B. Unexpected evidence for active brown adipose tissue in adult humans. Am J Physiol Endocrinol Metab. 293 (2), E444-E452 (2007).
- Cypess, A. M., et al. Identification and importance of brown adipose tissue in adult humans. N Engl J Med. 360 (15), 1509-1517 (2009).
- Virtanen, K. A., et al. Functional brown adipose tissue in healthy adults. N Engl J Med. 360 (15), 1518-1525 (2009).
- van Marken Lichtenbelt, W. D., et al. Cold-activated brown adipose tissue in healthy men. N Engl J Med. 360 (15), 1500-1508 (2009).
- Saito, M., et al. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes. 58 (7), 1526-1531 (2009).
- Labbe, S. M., et al. In vivo measurement of energy substrate contribution to cold-induced brown adipose tissue thermogenesis. FASEB J. 29 (5), 2046-2058 (2015).
- Yoneshiro, T., et al. BCAA catabolism in brown fat controls energy homeostasis through SLC25A44. Nature. 572 (7771), 614-619 (2019).
- Ouellet, V., et al. Brown adipose tissue oxidative metabolism contributes to energy expenditure during acute cold exposure in humans. J Clin Invest. 122 (2), 545-552 (2012).
- Jung, S. M., et al. In vivo isotope tracing reveals the versatility of glucose as a brown adipose tissue substrate. Cell Rep. 36 (4), 109459 (2021).
- Wang, Z., et al. Chronic cold exposure enhances glucose oxidation in brown adipose tissue. EMBO Rep. 21 (11), e50085 (2020).
- Hui, S., et al. Quantitative fluxomics of circulating metabolites. Cell Metab. 32 (4), 676-688 (2020).
- Bartelt, A., et al. Brown adipose tissue activity controls triglyceride clearance. Nat Med. 17 (2), 200-205 (2011).
- Held, N. M., et al. Pyruvate dehydrogenase complex plays a central role in brown adipocyte energy expenditure and fuel utilization during short-term beta-adrenergic activation. Sci Rep. 8 (1), 9562 (2018).
- Panic, V., et al. Mitochondrial pyruvate carrier is required for optimal brown fat thermogenesis. Elife. 9, e52558 (2020).
- Winther, S., et al. Restricting glycolysis impairs brown adipocyte glucose and oxygen consumption. Am J Physiol Endocrinol Metab. 314 (3), E214-E223 (2018).
- Lynes, M. D., et al. The cold-induced lipokine 12,13-diHOME promotes fatty acid transport into brown adipose tissue. Nat Med. 23 (5), 631-637 (2017).
- Shamsi, F., Wang, C. H., Tseng, Y. H. The evolving view of thermogenic adipocytes - ontogeny, niche and function. Nat Rev Endocrinol. 17 (12), 726-744 (2021).
- Trayhurn, P. Fatty acid synthesis in vivo in brown adipose tissue, liver and white adipose tissue of the cold-acclimated rat. FEBS Lett. 104 (1), 13-16 (1979).
- Foster, D. O., Frydman, M. L., Usher, J. R. Nonshivering thermogenesis in the rat. I. The relation between drug-induced changes in thermogenesis and changes in the concentration of plasma cyclic AMP. Can J Physiol Pharmacol. 55 (1), 52-64 (1977).
- Foster, D. O., Frydman, M. L. Nonshivering thermogenesis in the rat. II. Measurements of blood flow with microspheres point to brown adipose tissue as the dominant site of the calorigenesis induced by noradrenaline. Can J Physiol Pharmacol. 56 (1), 110-122 (1978).
- Foster, D. O., Frydman, M. L. Tissue distribution of cold-induced thermogenesis in conscious warm- or cold-acclimated rats reevaluated from changes in tissue blood flow: the dominant role of brown adipose tissue in the replacement of shivering by nonshivering thermogenesis. Can J Physiol Pharmacol. 57 (3), 257-270 (1979).
- Lopez-Soriano, F. J., Alemany, M. Effect of cold-temperature exposure and acclimation on amino acid pool changes and enzyme activities of rat brown adipose tissue. Biochim Biophys Acta. 925 (3), 265-271 (1987).
- Cereijo, R., et al. CXCL14, a brown adipokine that mediates brown-fat-to-macrophage communication in thermogenic adaptation. Cell Metab. 28 (5), 750-763 (2018).
- Jang, C., Chen, L., Rabinowitz, J. D. Metabolomics and Isotope Tracing. Cell. 173 (4), 822-837 (2018).
- Murashige, D., et al. Comprehensive quantification of fuel use by the failing and nonfailing human heart. Science. 370 (6514), 364-368 (2020).
- Jang, C., et al. Metabolite exchange between mammalian organs quantified in pigs. Cell Metab. 30 (3), 594-606 (2019).
- Park, G., et al. Quantitative analysis of metabolic fluxes in brown fat and skeletal muscle during thermogenesis. Nat Metab. 5 (7), 1204-1220 (2023).
- Skop, V., Xiao, C., Liu, N., Gavrilova, O., Reitman, M. L. The effects of housing density on mouse thermal physiology depend on sex and ambient temperature. Mol Metab. 53, 101332 (2021).
- Himms-Hagen, J., et al. Effect of CL-316,243, a thermogenic beta 3-agonist, on energy balance and brown and white adipose tissues in rats. Am J Physiol. 266 (4 Pt 2), R1371-R1382 (1994).
- Mottillo, E. P., et al. Coupling of lipolysis and de novo lipogenesis in brown, beige, and white adipose tissues during chronic beta3-adrenergic receptor activation. J Lipid Res. 55 (11), 2276-2286 (2014).
- Smith, R. E., Roberts, J. C. Thermogenesis of brown adipose tissue in cold-acclimated rats. Am J Physiol. 206, 143-148 (1964).
- Mestres-Arenas, A., Cairo, M., Peyrou, M., Villarroya, F. Blood sampling for arteriovenous difference measurements across interscapular brown adipose tissue in rat. Methods Mol Biol. 2448, 273-282 (2022).
- Yu, Z., et al. Differences between human plasma and serum metabolite profiles. PLoS One. 6 (7), e21230 (2011).
- Kaluarachchi, M., et al. A comparison of human serum and plasma metabolites using untargeted (1)H NMR spectroscopy and UPLC-MS. Metabolomics. 14 (3), 32 (2018).
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nat Protoc. 2 (11), 2692-2703 (2007).
- Gonzalez-Dominguez, R., Gonzalez-Dominguez, A., Sayago, A., Fernandez-Recamales, A. Recommendations and best practices for standardizing the pre-analytical processing of blood and urine samples in metabolomics. Metabolites. 10 (6), 229 (2020).
- Jung, S. M., et al. Stable isotope tracing and metabolomics to study in vivo brown adipose tissue metabolic fluxes. Methods Mol Biol. 2448, 119-130 (2022).
- Ngo, J., et al. Mitochondrial morphology controls fatty acid utilization by changing CPT1 sensitivity to malonyl-CoA. EMBO J. 42 (11), e111901 (2023).
- Yoo, H. J., et al. MsrB1-regulated GAPDH oxidation plays programmatic roles in shaping metabolic and inflammatory signatures during macrophage activation. Cell Rep. 41 (6), 111598 (2022).
- Straw, J. A., Fregly, M. J. Evaluation of thyroid and adrenal-pituitary function during cold acclimation. J Appl Physiol. 23 (6), 825-830 (1967).
- Silva, J. E., Larsen, P. R. Potential of brown adipose tissue type II thyroxine 5'-deiodinase as a local and systemic source of triiodothyronine in rats. J Clin Invest. 76 (6), 2296-2305 (1985).
- Wilkerson, J. E., Raven, P. B., Bolduan, N. W., Horvath, S. M. Adaptations in man's adrenal function in response to acute cold stress. J Appl Physiol. 36 (2), 183-189 (1974).
- Wagner, J. A., Horvath, S. M., Kitagawa, K., Bolduan, N. W. Comparisons of blood and urinary responses to cold exposures in young and older men and women. J Gerontol. 42 (2), 173-179 (1987).
- Lee, P., et al. Mild cold exposure modulates fibroblast growth factor 21 (FGF21) diurnal rhythm in humans: relationship between FGF21 levels, lipolysis, and cold-induced thermogenesis. J Clin Endocrinol Metab. 98 (1), E98-E102 (2013).
- Ameka, M., et al. Liver derived FGF21 maintains core body temperature during acute cold exposure. Sci Rep. 9 (1), 630 (2019).
- Shimano, M., Ouchi, N., Walsh, K. Cardiokines: recent progress in elucidating the cardiac secretome. Circulation. 126 (21), e327-e332 (2012).
- Planavila, A., Fernandez-Sola, J., Villarroya, F. Cardiokines as modulators of stress-induced cardiac disorders. Adv Protein Chem Struct Biol. 108, 227-256 (2017).
- Dettmer, K., Aronov, P. A., Hammock, B. D. Mass spectrometry-based metabolomics. Mass Spectrom Rev. 26 (1), 51-78 (2007).
- Lu, W., et al. Metabolite measurement: pitfalls to avoid and practices to follow. Annu Rev Biochem. 86, 277-304 (2017).
- Collins, S. L., Koo, I., Peters, J. M., Smith, P. B., Patterson, A. D. Current challenges and recent developments in mass spectrometry-based metabolomics. Annu Rev Anal Chem (Palo Alto Calif). 14 (1), 467-487 (2021).
- Beale, D. J., et al. Review of recent developments in GC-MS approaches to metabolomics-based research). Metabolomics. 14 (11), 152 (2018).
- Bae, H., Lam, K., Jang, C. Metabolic flux between organs measured by arteriovenous metabolite gradients. Exp Mol Med. 54 (9), 1354-1366 (2022).
- Paulus, A., Drude, N., van Marken Lichtenbelt, W., Mottaghy, F. M., Bauwens, M. Brown adipose tissue uptake of triglyceride-rich lipoprotein-derived fatty acids in diabetic or obese mice under different temperature conditions. EJNMMI Res. 10 (1), 127 (2020).
- Ohlson, K. B., Mohell, N., Cannon, B., Lindahl, S. G., Nedergaard, J. Thermogenesis in brown adipocytes is inhibited by volatile anesthetic agents. A factor contributing to hypothermia in infants. Anesthesiology. 81 (1), 176-183 (1994).
- Ohlson, K. B., et al. Inhibitory effects of halothane on the thermogenic pathway in brown adipocytes: localization to adenylyl cyclase and mitochondrial fatty acid oxidation. Biochem Pharmacol. 68 (3), 463-477 (2004).
- Ohlson, K. B., Lindahl, S. G., Cannon, B., Nedergaard, J. Thermogenesis inhibition in brown adipocytes is a specific property of volatile anesthetics. Anesthesiology. 98 (2), 437-448 (2003).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon