Method Article
다중 혈청학적 검사에서 다양한 항체 등급의 동시 검출
* 이 저자들은 동등하게 기여했습니다
Erratum Notice
요약
유럽과 북미에서 라임 보렐리아증을 유발하는 다양한 보렐리아 종의 여러 항원에 대해 유도된 IgG 및 IgM에 대한 혈청 샘플을 동시에 평가하는 비드 기반 다중 면역분석을 개발하기 위해 3채널 이중 리포터 형광 흐름 분석 시스템을 사용했습니다.
초록
감염성 질환의 진행을 모니터링하기 위해서는 다양한 항원 결정 인자에 대한 면역 반응성을 평가하고, 숙주 면역 반응의 여러 단계에서 나타나는 다양한 항체 동형을 측정하는 것이 유용합니다. 라임 보렐리오증(Lyme borreliosis)의 경우, 병원성 병원체는 보렐리아 종의 여러 구성원 중 하나일 수 있습니다. 그러므로, 정확한 표본 분류는 다른 Borrelia 종의 다른 항원에 대하여 면역 반응성을 평가할 것을 요구합니다. 또한 항병원체 IgG 및 IgM 반응은 질병 진행 중에 서로 다른 유도 시간 경과를 가질 수 있습니다. 여기서는 동일한 반응에서 서로 다른 박테리아 항원에 대한 IgG 및 IgM 면역 반응을 동시에 평가하여 인간 혈청 샘플에서 Borrelia 특이적 면역 반응을 식별하는 데 유용한 2-리포터 다중 면역분석법의 개발을 보여줍니다. 이 이중 리포터 접근법은 단일 리포터 분석법의 분석 성능을 유지하면서 시간과 자원을 절약하고 샘플 크기 요구 사항을 줄입니다. 이 분석을 통해 혈액 샘플에서 혈청학적 정보를 절반의 시간에 두 배로 생성할 수 있습니다.
서문
라임 보렐리아증(Lyme borreliosis)은 북반구의 온화한 기후에서 가장 흔한 진드기 매개 전염병이다1. 보렐리야(Borrelia) 속의 스피로헤테(spirochete) 박테리아에 의해 발생하며, 지리적 분포가 다른 5가지 알려진 인간 병원체가 있다2. 유럽의 주요 병원성 보렐리아 종은 B. afzelii 및 B. garinii이며, B. burgdorferi s.s., B. spielmanii 및 B. bavariensis는 덜 자주 연루됩니다. 북아메리카에서는 B. burgdorferi s.s.가 라임 보렐리아증 2,3의 유일한 원인균이다. 보렐리아 병원균은 진드기 속 익소데스(Ixodes)에 속하며, 진드기에 물린 후 24시간 이내에 전염될 수 있다4.
라임 보렐리아증 진단은 일반적으로 임상 증상에 의해 이루어지며 이후 혈청학으로 확인됩니다. 유럽과 북미 모두에서 진단 지침은 보렐리아 특이적 항원 1,5,6,7,8,9에 대한 항체 반응을 평가하기 위해 반사 면역블롯이 있는 효소 결합 면역 흡착 분석(ELISA)으로 구성된 2단계 테스트 시리즈를 권장합니다 . 그러나 이 접근법은 민감도가 부족하고 특히 혈청전환이 불완전하고 항-보렐리아 IgG 및 IgM 역가가 너무 낮은 감염 초기 단계에서 최적이 아니다6.
멀티플렉스 면역분석법은 한 번에 하나의 표적만 측정하는 기존의 면역분석을 개선하며, 하나 이상의 항원에 대한 여러 항체 동형형 반응을 동시에 평가할 수 있습니다 10,11,12. ELISA와 같은 분석은 반응당 단일 분석물을 식별하고 정량화하는 것으로 제한되며, 현재 보렐리아 감염 후 단일 박테리아 항원에 대해 유도된 순환 IgG 또는 IgM입니다. 이 보고서는 인간 혈청 샘플에서 본 명세서에서 선택한 보렐리아 항원에 대해 IgG 및 IgM 항체를 동시에 검출하는 다중 면역 분석법의 개발을 위해 비드 기반 분석물 프로파일링 기술을 사용하는 방법을 설명합니다. 우리는 유럽에서 자생하는 가장 흔한 병원성 보렐리아 종을 함께 포함하는 4개의 항원을 선택했습니다(B. 가리니, B. 아프젤리, B. 부르그도르페리 s.s.) 및 북미 (B. burgdorferi s.s.) (표 1) 2,3입니다. 이를 통해 결정적인 병원체를 식별하고 환자 샘플에서 초기 IgM 및 이후 더 내구성 있는 IgG 면역 반응을 식별할 수 있습니다.
| 대상 아이소타입 | 리포터 채널 | 항원 | 보렐리아 종 | 거르다 | 항원 커플링 농도 |
| 이그엠 | 체육 | 오피씨 | B. 가리니 | 20047 | 5.0μg/6 비드 10개 |
| IgG (이그지) | BV421 시리즈 | VlsE | B. burgdorferi s.s | 나31 | 1.25μg/6 비드 10개 |
| IgG (이그지) | BV421 시리즈 | 디비파이 | B. burgdorferi s.s. | ZS7 시리즈 | 10.0μg/10 6 비드 |
| IgG (이그지) | BV421 시리즈 | 디비파이 | B. 아프젤리 | PKo (피코) | 5.0μg/6 비드 10개 |
표 1: 멀티플렉스 분석 개발에 사용되는 대표적인 보렐리아 항원.
우리는 처음에 두 개의 개별 반응에서 항 보렐리아 항원 IgG 또는 IgM 항체를 검출하는 단일 리포터 면역분석을 개발한 다음 이러한 분석을 동일한 반응 혼합물에서 두 항체 동형을 모두 측정하는 듀얼 리포터 다중 분석으로 병합했습니다. 마그네틱 비드는 관심 병원체 표적 항원에 결합된 다음 환자 혈청 샘플과 함께 배양됩니다. 비드 결합 항원은 병원체 항원에 대한 면역 반응에서 생성된 혈청에서 순환하는 IgG와 IgM에 의해 인식되고 포착됩니다. 분석 IgG 대 IgM 특이성은 각각 두 개의 2차 항체와 관련된 뚜렷한 형광단 신호를 가진 IgG 또는 IgM에 결합하는 2차 항체의 선택에 의해 결정됩니다. 각 형광 신호는 IgG 또는 IgM(여기서는 각각 Brilliant Violet 421 또는 phycoerythrin)을 검출하는 데 사용되는 단일 형광단에 특화된 서로 다른 여기 레이저 및 방출 캡처가 있는 기기의 두 Reporter 채널(즉, 듀얼 리포터) 중 하나에서 검출됩니다. 기기 분류 채널은 다양한 비드 세트에 내재된 색상으로 구분된 염료를 식별합니다. 따라서, 여러 표적 항원을 서로 다르게 염색된 비드에 결합할 수 있으며, 비드 세트를 함께 혼합하여 혈청 샘플에서 다양한 항병원체 면역 활성을 종합적으로 평가하는 데 사용할 수 있습니다. 분류 채널은 각 개별 비드 세트(즉, 특정 항원)를 식별하고 해당 항원에 대한 IgG 또는 IgM과 관련된 형광을 측정합니다. 그 결과 멀티플렉스 분석은 덜 포괄적인 기존 검사에 비해 시간과 자원을 절약하고 제한된 샘플 부피에서 라임 면역 반응을 정확하게 분류합니다. SARS-CoV-2 감염13과 같은 다른 병리학에서 면역 반응을 분류하기 위해 유사한 이중 보고자 접근 방식이 이전에 사용되었지만, 이 보고서에서는 라임 보렐리오증의 면역 반응을 특성화하기 위한 다중 형광 분석 기술의 적용에 대해 자세히 설명합니다.
프로토콜
이 실험 시리즈에서 인간 혈청 샘플을 사용하기 위해 적절한 기관 검토 위원회/윤리 위원회의 승인을 받았습니다. 샘플은 SARS-CoV-2 혈청 유병률에 대한 독일 국가 연구에서 익명화된 잔류 물질이었다14. 인체 샘플 사용에 대한 승인은 독일 하노버 의과대학 윤리위원회(9086_BO_S_2020)에서 승인되었습니다. 이번 연구에서는 총 21개의 인간 혈청 샘플이 사용되었다.
1. 인체 시료 사용에 대한 윤리적 승인
- 인체 샘플 사용에 대한 적절한 윤리적 승인을 획득합니다.
2. 시약 및 장비
- 인간 혈청 샘플: 이전에 라임 보렐리아증 진단을 받았거나 보렐리아 음성 면역 상태12,14로 진단된 사람의 혈청 샘플을 사용하여 기술 분석 검증 및 품질 관리를 수행합니다.
- 단일 리포터 계측. 초기 분석 개발 및 기술 검증을 위해 2채널 단일 리포터 기기(재료 표)를 사용합니다.
참고: 단일 리포터 시스템에는 1) 비드 세트별 형광을 식별 및 정량화하여 사용되는 경우 서로 다른 비드 세트를 구별하고(분류 채널), 2) 비드 결합 표적 특이적 피코에리트린(PE) 형광을 검출 및 정량화(리포터 채널, 532nm 여기, "주황색" 565-585nm 방출)의 두 가지 레이저가 있습니다. 따라서 단일 항체 동형 클래스(예: IgG 또는 IgM)만 단일 리포터 채널을 사용하여 한 번에 분석할 수 있습니다.- 초기 검증 연구를 수행하여 항 보렐리아 IgG 및 IgM을 두 항체 클래스 모두에 대해 PE 표지 검출 시약을 사용하는 단일 리포터 96웰 형식으로 별도로 평가합니다.
참고: 현재 분석법은 대표적인 예로 Borrelia 항원 VlsE 및 DbpA의 두 가지 변이체에 특이적인 순환 IgG와 항원 OspC에 특이적인 순환 IgM을 평가합니다. 이 분석은 원하는 대로 다른 항-보렐리아 항원에 대한 혈청 면역 반응을 평가하기 위해 확장될 수 있다12.
- 초기 검증 연구를 수행하여 항 보렐리아 IgG 및 IgM을 두 항체 클래스 모두에 대해 PE 표지 검출 시약을 사용하는 단일 리포터 96웰 형식으로 별도로 평가합니다.
- 듀얼 리포터 계측. 이중 IgM/IgG 분석의 개발 및 기술 검증을 위해 동일한 반응에서 동시 IgG/IgM 분석이 가능한 3채널 이중 리포터 기기(재료 표)를 사용합니다(아래 자세히 설명). 이 기기에는 총 3개의 형광 검출 채널이 있으며, 그 중 2개는 표적 Ig 관련 신호를 평가하는 리포터 채널입니다.
참고: 듀얼 리포터 시스템에는 세 가지 레이저가 있습니다: 1) 비드 세트별 형광(분류 채널)을 식별하고 정량화합니다. 2) 표적 특이적 피코에리트린(PE) 형광(리포터 채널 1, 532nm 여기, "주황색" 565-585nm 방출)을 검출 및 정량화하고, 3) 두 번째 표적 분석물의 표적 특이적 Brilliant Violet 421(BV421) 형광을 평가합니다(리포터 채널 2, 405nm 여기, "청색" 421-441nm 방출). 듀얼 리포터 시스템은 96웰 및 384웰 마이크로타이터 플레이트(반자동 처리) 분석 형식과 모두 호환됩니다. 일반적인 분석 계획은 그림 1에 나와 있습니다. 프로토콜 단계는 아래에 자세히 설명되어 있습니다.
3. 항원 커플링
- 보렐리아 항원을 자성, 카르복실화 및 형광 색으로 구분된 6.5μm 마이크로스피어(비드; 재료 목차) 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드(EDC)/설포-N-하이드록시숙신이미드(sNHS) 화학을 사용합니다.
참고: 자세한 설명은 참조11및 참조12에서 찾을 수 있습니다. 표 1에서 각 항원의 결합 농도를 찾으십시오. 결합된 비드는 사용할 때까지 4°C의 어두운 곳에 보관해야 합니다. 커플링 및 검출 반응에 사용되는 모든 완충액은 보충 자료에 자세히 설명되어 있습니다.
4. 분석 절차: 단일 리포터 IgG 또는 IgM 혈청학적 분석: 96웰 형식
- 샘플을 2단계로 희석합니다(2단계, 모두 96웰 플레이트에서, 200배 혈청 샘플 희석은 분석 완충액에서).
참고: 분석 완충액 조성물은 1%(w/v) 소 혈청 알부민을 함유하는 Low Cross Buffer: PBS의 1:4 혼합물입니다. Tween-20을 혼합물에 첨가하여 최종 농도 0.05%(v/v)로 만듭니다.- 시료 희석 1단계: 혈청 시료 5μL를 분석 완충액 120μL와 혼합합니다(25배 희석).
- 시료 희석 2단계: 희석액 10μL와 분석 완충액 70μL를 혼합하여 25배 희석액을 추가로 8배 희석하여 최종 시료 희석액을 200배로 만듭니다.
- 마그네틱 비드 혼합 희석
- 비드 모집단당(즉, 고유한 표적 항원당) 1.0 × 106 beads/mL를 포함하는 비드 혼합물을 준비합니다.
- 준비된 비드 혼합물을 분석 완충액에 25배 희석하여 이 희석된 현탁액의 최종 비드 농도가 이제 비드 모집단당(즉, 고유한 표적 항원당) 4 × 104 비드/mL가 되도록 합니다.
- 비드를 사용한 혈청 샘플 배양
- 25μL의 희석된 결합 멀티플렉스 비드 현탁액(4.0 × 104 beads/set/mL 포함)을 96웰 반면적 마이크로타이터 플레이트의 할당된 웰에 피펫팅합니다(재료 표).
- 25μL의 200배 희석된 혈청 샘플(위 4.1단계)을 25μL의 결합 비드 현탁액이 포함된 적절한 웰에 추가합니다.
참고: 이렇게 하면 추가로 2배 희석되므로 웰의 최종 혈청 샘플 희석은 400배이고 최종 비드 수는 1000 비드/비드 세트/50μL 반응입니다. - 96웰 반응 플레이트를 마이크로플레이트 씰(접착 호일 또는 플라스틱 플레이트 커버)로 덮습니다.
- 플레이트 셰이커에서 20 °C, 750 rpm에서 2 시간 동안 플레이트를 배양합니다.
- 비드 세척
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 조심스럽게 제거합니다.
- 96웰 반응 플레이트를 플레이트 와셔에 넣습니다.
- 자동 마그네틱 플레이트 와셔를 사용하여 100μL 세척 버퍼(1× PBS + 0.05% v/v Tween 20)로 비드를 세 번 세척합니다.
- 세척된 비드를 100μL의 세척 버퍼에 재현탁하고 접착 호일 또는 플라스틱 플레이트 커버로 플레이트를 덮고 플레이트 셰이커에서 플레이트를 20rpm에서 1000분 동안 흔듭니다.
- 세척 된 구슬을 쪼갠다
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 조심스럽게 제거합니다.
- 피펫팅을 5회 위아래로 하여 반응을 혼합하고 각 100μL 반응 부피 50μL를 2개의 새로운 96웰 반응 플레이트(IgG 검출용 플레이트 1개, IgM 검출용 플레이트 1개)에 각각 전달합니다.
- 검출 항체/시약 배양
참고: 이 시점에서 표적 항원 결합 비드를 혈청 샘플과 함께 배양하여 항원과 반응하는 혈청 내 순환 항체(존재하는 경우)를 추출합니다. 면역글로불린이 결합된 반응 비드는 두 개의 플레이트로 나뉘었으며, 이제 PE 라벨이 있는 아이소타입 특이적 2차 항체를 사용하여 IgG와 IgM을 별도의 플레이트에서 검출 및 정량화합니다. 20분까지 시차 플레이트 처리- 마그네틱 플레이트 와셔를 사용하여 자성 비드가 포함된 웰에서 상층액을 흡입합니다.
- 각 플레이트에 대해 분석 버퍼에 PE 접합 염소 항인간 IgG(3μg/mL) 또는 PE 접합 당나귀 항인간 IgM(5μg/mL)을 포함하는 적절한 Ig 검출 시약 혼합물(항-IgG 또는 항-IgM)을 만듭니다. 각 비드 함유 웰에 대해 30μL의 검출 시약이 사용됩니다. 반응 웰을 위한 충분한 IgG 및 IgM 검출 시약 용량을 준비하고, 피펫팅 손실을 수용할 수 있는 충분한 용량을 준비합니다.
- IgG 플레이트의 반응 비드가 들어 있는 각 웰에 30μL의 IgG 검출 시약을 피펫팅하고 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- IgM 플레이트의 반응 비드가 들어 있는 각 웰에 30μL의 IgM 검출 시약을 피펫팅하고 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- 플레이트 셰이커에서 750rpm으로 흔들면서 20°C에서 45분 동안 배양합니다.
- 비드 세척
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 조심스럽게 제거합니다.
- 96웰 반응 플레이트를 마그네틱 플레이트 와셔에 넣습니다.
- 마그네틱 플레이트 와셔를 사용하여 100μL 세척 버퍼로 비드를 3회 세척합니다.
- 100μL의 세척 버퍼에 비드를 재현탁시킵니다.
- 단일 리포터 기기에서 결과를 분석합니다.
- 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- 플레이트 셰이커에서 20rpm에서 20°C에서 1000웰 반응 플레이트를 3분 동안 흔듭니다.
- 플레이트 셰이커에서 96웰 반응 플레이트를 옮기고 단일 리포터 유량 분석기 기기(재료 표)에 넣습니다.
- 각 샘플에 대해 흡수량 = 80μL, 카운트 = 50/비드 모집단, 타임아웃 = 60초, 게이팅 = 7,500-15,000)12,13 기기 설정을 사용하여 형광 강도 중앙값(MFI)을 분석합니다.
5. 분석 절차: 이중 리포터 IgG 및 IgM 혈청학적 분석: 96웰 형식
- 시료 희석(2단계, 모두 96웰 플레이트에서 사용, 분석 완충액에서 혈청 시료 희석 200배)
- 시료 희석 1단계: 5μL 혈청 시료를 120μL 분석 완충액과 혼합합니다(25배 희석).
- 시료 희석 2단계: 첫 번째 희석액 10μL(섹션 5.1.1의 25배 희석 시료)와 70μL 분석 완충액(8배 희석)을 혼합하여 25배 희석된 시료를 추가로 8배 희석하여 최종 시료 희석액을 200배로 희석합니다.
- 마그네틱 비드 혼합 희석
- 비드 모집단당(즉, 고유한 표적 항원당) 1.0 × 106 표적 항원 결합 비드/mL를 포함하는 비드 혼합물을 준비합니다.
참고: 이 실험 시리즈에서는 각 반응에서 4개의 고유한 보렐리아 항원에 대해 IgG 및 IgM 면역 반응을 모두 평가했습니다. - 준비된 비드 혼합물을 분석 완충액에 50배 희석합니다. 이 희석된 현탁액의 비드 농도는 이제 비드 모집단당 2.0 × 104 비드/mL입니다.
참고: 예비 연구에서 비드 수의 절반을 사용할 때 형광 신호가 선형 정량 범위 내에서 유지되는 것을 확인한 후 이중 분석 반응의 비드 수는 단일 리포터 반응에 사용된 비드 수보다 절반으로 줄어 두 분석 간의 직접적인 비교를 허용하고 리소스를 절약합니다.
- 비드 모집단당(즉, 고유한 표적 항원당) 1.0 × 106 표적 항원 결합 비드/mL를 포함하는 비드 혼합물을 준비합니다.
- 비드를 사용한 혈청 샘플 배양
- 25μL의 희석된 표적 항원 결합 비드 현탁액(2.0 × 104 beads/set/mL 포함)을 96웰 반면적 마이크로타이터 플레이트의 사전 할당된 웰에 피펫팅합니다. 반응 웰의 정확한 수와 플레이트에서의 위치는 작업자가 결정한 테스트된 총 샘플 수와 샘플당 단일 웰 또는 반복 웰을 실행할지 여부에 따라 달라집니다.
참고: 표적 항원 결합 마그네틱 비드는 인간 혈청 샘플과 반응합니다. 항 보렐리아 항원 면역 반응성 IgG와 IgM은 모두 샘플에 존재하는 경우 동일한 항원 결합 비드에 결합하고 고정됩니다. 결합된 IgG 및 IgM의 2차 항체 정량화는 분화를 가능하게 하는 IgG 및 IgM 식별을 위해 서로 다른 형광단을 사용하여 동일한 반응에서 동일한 비드에 대해 수행됩니다. - 25μL의 혼합 표적 항원 결합 비드 현탁액(5.2단계)을 포함하는 각 웰에 25μL의 200배 희석된 혈청(위 5.1단계)을 추가합니다.
참고: 이렇게 하면 추가로 2배 희석되므로 웰의 최종 혈청 샘플 희석량은 400배이고 최종 비드 수는 500 비드/비드 세트/50μL 반응입니다. - 96웰 반응 플레이트를 마이크로플레이트 씰(접착 호일 또는 플라스틱 플레이트 커버)로 덮습니다.
- 플레이트 셰이커에서 20 °C, 750 rpm에서 2 시간 동안 비드가 있는 플레이트를 배양합니다.
- 25μL의 희석된 표적 항원 결합 비드 현탁액(2.0 × 104 beads/set/mL 포함)을 96웰 반면적 마이크로타이터 플레이트의 사전 할당된 웰에 피펫팅합니다. 반응 웰의 정확한 수와 플레이트에서의 위치는 작업자가 결정한 테스트된 총 샘플 수와 샘플당 단일 웰 또는 반복 웰을 실행할지 여부에 따라 달라집니다.
- 비드 세척(과도한 혈청 샘플 제거용)
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 제거합니다.
- 96웰 반응 플레이트를 마그네틱 플레이트 와셔에 넣습니다.
- 마그네틱 플레이트 와셔를 사용하여 100μL 세척 버퍼로 비드를 3회 세척합니다.
- 마지막 세척 단계 후 비드에서 최종 세척량을 흡입합니다.
- 검출 항체 (Incubation - Part I)
- 분석 완충액에서 PE 접합 당나귀 항인간 IgM(5μg/mL)과 함께 비오틴화된 염소 항인간 IgG(1μg/mL)를 포함하는 신선한 IgG 및 IgM 이중 검출 시약을 만듭니다. 각 비드 함유 웰에 대해 30μL의 이중 검출 시약이 사용됩니다. 반응 웰을 위한 충분한 IgG 및 IgM 이중 검출 시약 용량을 준비하고, 피펫팅 손실을 수용할 수 있는 충분한 용량을 준비합니다.
- 30μL의 IgG 및 IgM 이중 검출 시약을 할당된 각 웰에 피펫팅하고 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- 플레이트 셰이커에서 750rpm으로 흔들면서 20°C에서 45분 동안 플레이트를 배양합니다.
- 비드 세척(과잉 검출 항체 제거용)
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 조심스럽게 제거합니다.
- 96웰 반응 플레이트를 자동 마그네틱 플레이트 와셔에 넣습니다.
- 자동 마그네틱 플레이트 와셔를 사용하여 100μL 세척 버퍼로 비드를 세 번 세척합니다.
- 마지막 세척 단계 후 비드에서 최종 세척량을 흡입합니다.
- 스트렙타비딘 복합 리포터(배양 - 파트 II)
- 신선한 BV421 표지 Streptavidin을 분석 완충액에 0.2μg/mL 농도로 희석합니다. 각 비드 함유 웰에 대해 30μL의 BV421 표지된 Streptavidin이 사용됩니다. 반응 웰을 위한 충분한 BV421 표지 Streptavidin 부피를 준비하고, 피펫팅 손실을 수용할 수 있는 충분한 여분을 준비합니다.
- 희석된 BV421-Streptavidin 30μL를 각 반응 웰에 피펫팅하고 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- 플레이트 셰이커에서 750rpm으로 흔들면서 20°C에서 30분 동안 플레이트를 배양합니다.
- 워시 비즈(여분의 BV421-스트렙타비딘을 제거하기 위해)
- 플레이트 셰이커에서 96웰 반응판을 제거하고 접착판 씰을 조심스럽게 제거합니다.
- 96웰 반응판을 마그네틱 플레이트 와셔에 넣습니다.
- 자동 마그네틱 플레이트 와셔를 사용하여 100μL 세척 버퍼로 비드를 세 번 세척합니다.
- 웰 내의 비드를 세척 완충액에서 최종 부피 100μL까지 재현탁시킵니다.
- 듀얼 리포터 기기에서 결과 분석
- 96웰 반응 플레이트를 마이크로플레이트 씰로 덮습니다.
- 플레이트 셰이커에서 20rpm으로 20°C에서 3분 동안 96웰 반응 플레이트를 1000분 동안 배양합니다.
- 96웰 반응 플레이트를 플레이트 셰이커에서 듀얼 리포터 유량 분석기 기기로 옮깁니다(재료 표).
- 제조업체 지침(기기 설정: 듀얼 리포터 모드, 흡수량 = 80μL, 카운트 = 50/비드 모집단, 타임아웃 = 60초, 게이팅 = 7,500-15,000)에 따라 시료 중간 형광 강도(MFI)를 평가합니다.
6. 이중 리포터 IgG 및 IgM 혈청학적 분석: 384웰 반자동 형식
- 섹션 5에 자세히 설명된 분석 단계를 사용하여 384웰 플레이트 형식의 듀얼 리포터 분석을 수행하되, 피펫팅 로봇과 자동 마그네틱 플레이트 와셔(재료 표)를 사용하여 샘플을 처리합니다. 384웰 형식에서 1450rpm에서 배양 및 세척하는 동안 플레이트를 흔들고 형광을 측정하기 전에 21°C 및 1800rpm에서 5분 동안 플레이트를 흔듭니다.
결과
실험 개요
단일 리포터 및 듀얼 리포터 비드 기반 Borrelia 분석에 대한 일반적인 계획은 그림 1에 나와 있습니다. 주어진 보렐리아 항원에 대해 생성된 단일 항체 표적(즉, IgG 또는 IgM)의 경우, 보고를 위해 PE 접합 항-동형 항체를 사용하여 인간 혈청 샘플에서 두 항체 클래스를 독립적으로 평가했습니다. IgG 및 IgM 면역 반응성을 동시에 분석하는 이중 리포터 분석을 위해 Borrelia 항원 특이적 IgG 검출은 IgM 검출을 위해 PE 접합 리포터(주황색 형광)를 유지하면서 비오틴화된 항인간 IgG + BV421 표지된 Streptavidin(청색 형광) 리포터 시스템을 사용했습니다. 이중 리포터 분석의 워크플로우는 2채널 형광 검출 시약 BV421-Streptavidin을 사용한 추가 검출 시스템 배양을 제외하고는 단일 리포터 분석과 유사합니다.

그림 1: 단일 리포터 및 듀얼 리포터 비드 기반 Borrelia 분석의 개략도. (A) 단일 리포터 기기는 "주황색" 스펙트럼에서 신호를 방출하는 피코에리트리틴(PE) 형광 리포터 라벨을 사용하여 항 보렐리아 IgG 또는 IgM을 개별적으로 특성화하는 비드 기반 분석을 개발하고 초기에 검증하는 데 사용되었습니다. 원하는 보렐리아 항원을 비드에 결합하고 혈청 샘플에 존재하는 IgG 또는 IgM을 캡처하고 정량화하는 데 사용할 수 있습니다. 주어진 항원에 대한 IgG 및 IgM 반응성을 모두 평가하기 위해 두 개의 개별 면역분석이 필요합니다. (B) 이중 리포터 시스템은 동일한 웰의 모든 개별 보렐리아 항원에 대한 IgG 및 IgM 항체 모두에 대한 혈청 샘플을 동시에 분석할 수 있도록 했습니다. 이 접근법은 항 보렐리아 IgM을 표적으로 하는 것과 동일한 PE 접합 검출 항체를 사용하지만, PE 기반 시스템에서 30분의 추가 검출 시스템 배양 단계가 필요한 비오틴화된 1차 검출 항체 및 BV421 표지된 Streptavidin("파란색" 방출기)을 사용하는 것으로 IgG 검출을 대체합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
인트라 어세이 정밀도
세 가지 대표적인 보렐리아 항원에 대한 Spearman 상관 분석(그림 2)은 인간 혈청에 존재하는 항 보렐리아 항체를 검출할 때 MFI 값의 균일한 재현성을 보여주었습니다.

그림 2: 이중 리포터 비드 기반 Borrelia 분석의 인트라 분석 정밀도. Spearman의 상관 분석은 PE 검출 시스템을 사용하여 Borrelia 특이적 IgM 항체(A)를 검출하고 BV421 검출 시스템을 사용하여 Borrelia 특이적 IgG 항체(B, C)를 검출했을 때 이중 리포터 분석의 높은 분석 내 정밀도를 보여주었습니다. 총 21개의 혈청 샘플을 반자동 절차를 사용하여 중복으로 분석했습니다. 각 그래프에서 MFI 신호는 서로에 대해 표시되고 선형 회귀로 분석되었습니다. 빨간색 점선으로 표시된 선형 곡선(x=y)은 감지 시스템에 대한 동일한 MFI 신호를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
분석 간 정밀도
우수한 분석-분석 재현성은 dual-reporter 분석에서 관찰되었습니다. 7개의 독립적인 실행에 걸쳐 측정된 품질 관리 샘플의 MFI 값이 포함된 Levey-Jennings 차트(그림 3)는 모든 대표 항원에 대한 높은 분석 간 정밀도를 보여주었습니다. 4 개의 대표적인 보렐리아 항원의 평균 백분율 변동 계수 (CV % = 표준 편차 / 평균 × 100)는 5.3 %였습니다.
희석 선형성
원래의 단일 리포터 분석과 새로운 듀얼 리포터 분석은 서로 다른 유세포 분석 플랫폼을 사용하기 때문에 두 유세포 분석 기기 간에 동일한 항원 면역분석의 형광 출력 중앙값을 비교했습니다(그림 4). 시료 희석 시리즈는 IgM 및 IgG 평가 모두에 대해 선형 희석 곡선을 제공했으며, 평가된 전체 희석 범위(1:100-1:12,800)에서 기기 간 용량-반응의 양호한 병렬성을 보였습니다.
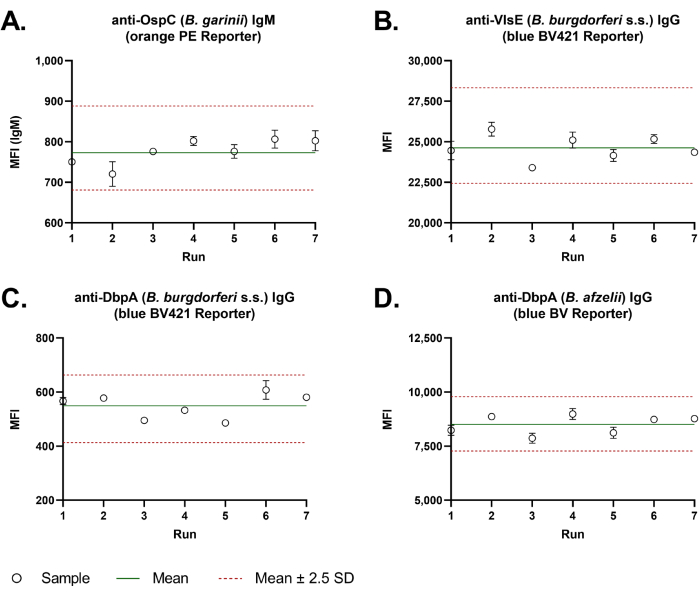
그림 3: 듀얼 리포터 비드 기반 Borrelia 분석의 분석 간 정밀도. 분석 간 정밀도를 평가하기 위해 품질 관리 샘플의 Borrelia 특이적 IgM(A) 및 IgG(B-D) 항체 반응을 매번 중복 웰에서 7번의 독립적인 실행에 걸쳐 분석했습니다. 분석은 수동으로 수행되었습니다. MFI 값은 Levey-Jennings 차트에 표시되었습니다. 녹색 선은 모든 값의 평균을 나타냅니다. 두 개의 빨간색 점선은 분석 간 정밀도의 허용 오차 범위를 나타냅니다. 이것은 평균값에서 표준 편차(2.5 S.D.±의 2.5배로 계산되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 이중 리포터 비드 기반 Borrelia 분석의 희석 선형성. 100배에서 12,800배의 시료 희석에서 IgM 검출(A) 및 IgG 검출(B)에 대한 희석 곡선은 단일 리포터 기기와 이중 리포터 기기를 사용하여 수동으로 수행했을 때 유사했습니다. 테스트된 모든 희석에서 MFI 값은 이중 리포터 기기(파란색 기호)보다 단일 리포터 기기(빨간색 기호)를 사용할 때 약간 더 높았습니다. 표시된 것은 2개의 대표적인 항원에 대한 희석 곡선이며, 각 희석점은 표준 편차(SD *)가 오차 막대로 표시된 삼중 웰의 평균 측정값을 나타냅니다. 참고: 작은 SD는 이 축척에서 볼 수 없습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 자료. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 보고서는 혈청 샘플에서 항 보렐리아 면역 활성을 재현 가능하고 민감하게 결정하는 2 리포터 비드 기반 보렐리아 면역 분석법의 개발을 강조합니다12. 라임 보렐리아증을 유발하는 다양한 병원성 보렐리아 종은 변이체 특이적 항원 이질성 6,7,8,9에 의해 구별될 수 있다. 다중 분석은 동일한 반응 웰 내에서 IgG 및 IgM 매개 항 보렐리아 면역 활성을 동시에 평가하여 두 개의 단일 분석 분석을 별도로 수행하는 데 필요한 시약, 노동력 및 샘플 재료를 보존합니다. 시간 경과에 따른 IgM 반응과 IgG 반응을 비교하면 감염 후 IgM에서 IgG로의 혈청전환이 발생함에 따라 질병 진행을 더 잘 추적할 수 있다6.
이중 리포터 시스템은 두 개의 서로 다른 검출 항체 시스템(13,15)을 사용한다. 관련 실험에서는 두 항체 등급이 동일한 반응 웰에서 함께 분석되었을 때 Borrelia 항-IgM 및 항-IgG 검출 시스템 간에 유의미한 검출 가능한 교차 반응성이 없음을 보여주었습니다12. IgG 항체16,17에 비해 IgM의 낮은 결합 친화도를 고려하여, PE는 면역분석에서 일상적으로 사용되는 가장 강력한 방출 형광단 중 하나이기 때문에 IgM 검출을 위해 PE 접합 검출 항체(이중 리포터 기기의 첫 번째 리포터 채널)를 선택했습니다18. IgG 평가를 위해 비오틴화 검출 항체를 사용했으며, 이후 BV421 접합 스트렙타비딘(기기의 두 번째 리포터 채널)19으로 조명했습니다. 단일 리포터 시스템에 비해 30분의 추가 배양 단계에도 불구하고 듀얼 리포터 시스템은 반응당 두 배의 정보를 제공합니다. 전반적으로, 이중 리포터 다중 분석은 두 개의 단일 리포터 분석을 실행하는 것보다 누적 시간과 재료 투입이 덜 필요합니다.
다중화 Borrelia 분석의 강력한 성능과 안정성은 intra- 및 inter-assay 정밀 연구에서 높은 재현성, 그리고 IgG 및 IgM 평가 모두에 대한 광범위한 샘플 농도에 대한 희석 선형성 및 희석 평행성의 시연에 의해 예시되었습니다. 단일 채널 기기를 사용하는 동일한 형광단에 대해 이중 채널 시스템에 비해 더 높은 절대 형광 방출 수준을 관찰했으며(PE의 경우 ≈1.7× 더 높음), 이는 두 기기 간의 광학 및 보정 설정의 차이에 기인합니다(그림 4). 그럼에도 불구하고, 두 형광단을 가진 형광 방출 곡선은 높고 낮은 표본 희석 극단에 두 계기 전부의 선형 범위 안에 남아 있었고, 측정된 절대 형광에 있는 어떤 어긋도 Borrelia 노출 상태의 분류에 영향을 미치지 않았다. 12의
이 비드 기반 보렐리아 멀티플렉스 분석의 주요 장점은 분석이 다른 또는 추가 분석물을 평가하기 위해 수정되거나 확장될 수 있는 용이성입니다., 예를 들어, 추가 보렐리아 종의 항원에 대한 항체를 검출하기 위해. xMAP 마그네틱 비드 세트에는 기기의 분류 채널에서 구별할 수 있는 다양한 염료 조합이 포함되어 있으며, 이론적으로 동일한 시료 내에서 최대 500개의 고유한 분석물을 동시에 평가할 수 있는 멀티플렉스 분석으로 구현할 수 있습니다. 현재 연구는 분석 기능 및 안정성을 입증하고 단일 및 이중 보고자 시스템을 비교하기 위해 4개의 대표적인 보렐리아 항원을 강조하는 반면, 최종 분석은 유럽과 북미 전역에 순환하는 5개의 임상 관련 보렐리아 병원체를 모두 식별할 수 있는 8개의 항원을 조사합니다12.
반자동 분석 형식의 표준 384웰 마이크로타이터 플레이트를 사용하여 고처리량 성능을 발휘할 수 있습니다. 96웰 및 384웰 플레이트와의 분석 및 기기 호환성을 통해 Borrelia 멀티플렉스 분석은 국가 연구20과 같은 대규모 샘플 세트를 신속하게 분석하기 위한 효율적인 스크리닝 도구로 사용할 수 있습니다. 분석의 수동 수행은 더 작은 96웰 플레이트를 사용하는 더 작은 샘플 세트에 대해 여전히 가능합니다.
연구 한계에는 소수의 인간 혈청 샘플에서 소수의 보렐리아 면역 반응 표적만 비교 평가가 포함됩니다. 그러나, 본래 학문은 IgG와 IgM 둘 다를 위한 분석 성과가 더 큰 표본 세트12 내의 모든 5개의 알려진 Borrelia 종에서 8개의 항원을 분석할 때 유지된다는 것을 확인했다. 또한 이중 리포터 기기는 각 반응 내에서 두 개의 항체 동형만 동시에 평가할 수 있으므로 완전한 동형 프로파일링을 위해서는 추가 분석 반응을 수행해야 합니다13.
결론적으로, 이 보고서는 인간 혈청 샘플에서 병원성 Borrelia 특이적 IgG 및 IgM 항체를 동시에 평가할 수 있는 이중 리포터 분석법으로 bead-based single-reporter immunoassay의 성공적인 병합 및 전환에 대해 자세히 설명합니다. 이 결합된 접근 방식은 총 시간, 재료 및 인력 투입을 절약하여 두 개의 독립적인 단일 리포터 분석과 동일한 데이터 볼륨을 생성합니다. 멀티플렉스 분석은 96웰에서 384웰 마이크로타이터 플레이트 형식으로 확장할 수 있으며 로봇 플레이트 및 액체 처리 기기를 사용하여 반자동화할 수 있어 대규모 인구 조사와 같은 고처리량 응용 분야에 적합합니다. 비드 기반 이중 리포터 분석 시스템은 예를 들어 다른 바이러스 및 박테리아 병원체에 대한 면역 반응을 평가하고13,21 장기 이식에서 HLA 에피토프에 대한 동종 항체 반응을 평가하고22 자가면역 질환의 메커니즘을 탐색하는 데 유용성을 입증했습니다23. 현재 보고서는 실험실이 다양한 병리학에서 복잡한 면역 메커니즘을 탐구하기 위해 이 접근 방식을 적용할 수 있는 방법의 예로서 라임병을 유발하는 보렐리아 병원체에 대한 노출을 식별하기 위해 다중 기술을 사용하는 방법을 자세히 설명했습니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
이 보고서는 Luminex(텍사스 주 오스틴)의 지원을 받았습니다. 저자는 분석 및 과학 편집에 도움을 준 Matthew Silverman PhD(Biomedical Publishing Solutions, Panama City, FL, mattsilver@yahoo.com)에게 감사를 표합니다. 저자는 또한 연구에 사용된 보렐리아 항원을 제공한 tgcBIOMICS GmbH(Bingen, Germany)의 Harald Klein과 Christoph von Eichel-Streiber에게 감사를 표합니다. 기술 분석 검증 및 품질 관리를 위한 인간 혈청 샘플은 다음에서 얻었습니다: 1) 독일 브라운슈바이크에 있는 헬름홀츠 감염 연구 센터 역학과를 통해 독일의 SARS-CoV-2에 대한 항체에 대한 다국소 및 연속 유병률 연구; 2) Sächsisches Krankenhaus Rodewisch(독일 Rodewisch) 신경과. 인체 샘플 사용에 대한 승인은 독일 하노버 의과대학 윤리위원회(9086_BO_S_2020)에서 승인되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Antibodies and Detection Reagents | Source | Catalog Number | |
| Biotinylated Goat Anti-Human IgG | Jackson ImmunoResearch (Dianova) | 109-066-098 | |
| Brilliant Violet 421-Streptavidin | BD Biosciences | 563259 | |
| Donkey Anti-Human IgM | Jackson ImmunoResearch (Dianova) | 709-116-073 | |
| Borrelia Antigens | tgcBIOMICS (Bingen, Germany) | ||
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | Thermo Scientific Pierce | 77149 ProteoChem (100 mg) | |
| 10x PBS | Fisher Scientific | BP399-4 | |
| BSA | Carl Roth | T844.3 | |
| MES (2-ethanesulfonic acid; zwitterionic buffer) | Carl Roth | 4256.2 | |
| Na2HPO4 | Carl Roth | 4984.1 | |
| ProClin300 | Sigma | 48914-U | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Scientific Pierce | 24510 (500 mg) | |
| Triton X-100 | Thermo Scientific | 85111 | |
| Instrumentation and Ancillary Lab Supplies | Source | ||
| 384-well plate | Corning, Cat# 3570 | ||
| 96-well deep-well plates | ThermoFisher Scientific, Cat# 95040450 | ||
| 96-well half-area plates | Corning, Cat# 3690 | ||
| BioTek 405 TS Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| BioTek MultiFlo FX Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| DynaMag Spin Magnet (for isolating beads in microcentrifuge tubes) | ThermoFisher, Cat# 12320D | ||
| Flexmap 3D (two-channel, single-reporter instrument) | Luminex Corp., Austin, TX | ||
| KingFisher Magnetic Particle Processor (for isolating beads in 96-well plates) | ThermoFisher, Cat# A31508 | ||
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp., Austin, TX | ||
| SmartBlock Plates | Eppendorf, Cat# 5363000039 | ||
| ThermoMixer C | Eppendorf, Cat# 5382000015 | ||
| ThermoTop | Eppendorf, Cat# 5308000003 | ||
| xMAP Intelliflex (three-channel, dual-reporter instrument) | Luminex Corp., Austin, TX |
참고문헌
- Stanek, G., Strle, F. Lyme borreliosis-from tick bite to diagnosis and treatment. FEMS Microbiology Reviews. 42 (3), 233-258 (2018).
- Stanek, G., Wormser, G. P., Gray, J., Strle, F. Lyme borreliosis. The Lancet. 379 (9814), 461-473 (2012).
- Rizzoli, A., et al. Lyme borreliosis in Europe. Eurosurveillance. 16 (27), 19906(2011).
- Cook, M. J. Lyme borreliosis: a review of data on transmission time after tick attachment. International Journal of General Medicine. 8, 1-8 (2015).
- Strle, F., Stanek, G. Clinical Manifestations and Diagnosis of Lyme Borreliosis. Lyme Borreliosis: Biological and Clinical Aspects. Lipsker, D., Jaulhac, B. , Karger. 51-110 (2009).
- Wilske, B., Fingerle, V., Schulte-Spechtel, U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunology and Medical Microbiology. 49 (1), 13-21 (2007).
- Dessau, R. B., et al. To test or not to test? Laboratory support for the diagnosis of Lyme borreliosis: a position paper of ESGBOR, the ESCMID study group for Lyme borreliosis. Clinical Microbiology and Infection. 24 (2), 118-124 (2018).
- Eldin, C., et al. Review of European and American guidelines for the diagnosis of Lyme borreliosis. Médecine et Maladies Infectieuses. 49 (2), 121-132 (2019).
- Lantos, P. M., et al. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clinical Infectious Diseases. 72 (1), e1-e48 (2021).
- Gerritzen, A., Brandt, S. Serodiagnosis of Lyme borreliosis with bead based immunoassays using multiplex technology. Methods. 56 (4), 477-483 (2012).
- Embers, M. E., et al. Five-antigen fluorescent bead-based assay for diagnosis of Lyme disease. Clinical Vaccine Immunology. 23 (4), 294-303 (2016).
- Häring, J., et al. Borrelia multiplex: a bead-based multiplex assay for the simultaneous detection of Borrelia specific IgG/IgM class antibodies. BMC Infectious Diseases. 22 (1), 859(2022).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments. 170, (2021).
- Gornyk, D., et al. SARS-CoV-2 Seroprevalence in Germany. Deutsches Ärzteblatt International. 118 (48), 824-831 (2021).
- Luminex Corporation. xMAP Cookbook. Angeloni, S., Das, S., De Jager, W., Dunbar, S. , 5th ed, https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrer=https%3A%2F%2Fwww.luminexcorp.com%2F (2022).
- Racine, R., Winslow, G. M. IgM in microbial infections: Taken for granted. Immunology Letters. 125 (2), 79-85 (2009).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature Reviews Immunology. 10 (11), 778-786 (2010).
- Kovaleski, G., et al. Extraction and purification of phycobiliproteins from algae and their applications. Frontiers in Chemistry. 10, 1065355(2022).
- Chattopadhyay, P. K., et al. Brilliant violet fluorophores: A new class of ultrabright fluorescent compounds for immunofluorescence experiments. Cytometry Part A. 81 (6), 456-466 (2012).
- Coors, A., et al. Regional seropositivity for Borrelia burgdorferi and associated risk factors: findings from the Rhineland Study, Germany. Parasites & Vectors. 15 (1), 241(2022).
- Gürsoy, M., et al. Salivary IgA and IgG antibody responses against periodontitis-associated bacteria in Crohn's Disease. International Journal of Molecular Science. 24 (3), 2385(2023).
- Argani, H. Anti-HLA Antibody: The role of epitopes in organ transplantation. Experimental and Clinical Transplantation. 17 (Suppl 1), 38-42 (2019).
- Laman, J. D., Huizinga, R., Boons, G. J., Jacobs, B. C. Guillain-Barré syndrome: expanding the concept of molecular mimicry. Trends in Immunology. 43 (4), 296-308 (2022).
Erratum
Formal Correction: Erratum: Simultaneous Detection of Different Antibody Classes in a Multiplexed Serological Test
Posted by JoVE Editors on 8/16/2023. Citeable Link.
An erratum was issued for: Simultaneous Detection of Different Antibody Classes in a Multiplexed Serological Test. The Authors section was updated to correct an Affiliation. It was updated from:
Julia Häring1
Tanja Michel1
Matthias Becker1
Daniel Junker1
Tatia Tchitchagua2
Olaf Leschnik2
Berit Lange3,4
Stefanie Castell3,4
Gérard Krause3,4
Monika Strengert3
Alex Dulovic1
Nicole Schneiderhan-Marra1
1NMI Natural and Medical Sciences Institute, University of Tübingen
2Department of Neurology, Sächsisches Krankenhaus Rodewisch
3Department of Epidemiology, Helmholtz Centre for Infection Research
4German Centre for Infection Research (DZIF)
to:
Julia Häring1
Tanja Michel1
Matthias Becker1
Daniel Junker1
Tatia Tchitchagua2
Olaf Leschnik2
Berit Lange3,4
Stefanie Castell3,4
Gérard Krause3,4
Monika Strengert3
Alex Dulovic1
Nicole Schneiderhan-Marra1
1NMI Natural and Medical Sciences Institute at the University of Tübingen
2Department of Neurology, Sächsisches Krankenhaus Rodewisch
3Department of Epidemiology, Helmholtz Centre for Infection Research
4German Centre for Infection Research (DZIF)
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유