Method Article
マルチプレックス血清学的検査における異なる抗体クラスの同時検出(英語)
* これらの著者は同等に貢献しました
Erratum Notice
要約
3チャンネルデュアルレポーター蛍光フロー分析システムを使用して、ヨーロッパおよび北米でライムボレリア症を引き起こす異なる ボレリア 種の複数の抗原に対して誘発されたIgGおよびIgMの血清サンプルを同時に評価するビーズベースのマルチプレックスイムノアッセイを開発しました。
要約
感染症の進行をモニタリングするには、さまざまな抗原決定因子に対する免疫反応性を評価し、宿主の免疫応答のさまざまな段階で現れるさまざまな抗体アイソタイプを測定することが有用です。ライムボレリア症では、病原体は ボレリア 種の複数のメンバーの1つである可能性があります。したがって、サンプルを正しく分類するには、異なる ボレリア 種の異なる抗原に対する免疫反応性を評価する必要があります。さらに、抗病原体IgGおよびIgM応答は、疾患の進行中に異なる誘発時間経過をとる可能性があります。本研究では、異なる細菌抗原に対するIgGとIgMの両方の免疫反応性を同時に評価することにより、ヒト血清サンプル中の ボレリア特異的免疫応答を同定するのに役立つ2レポーターマルチプレックスイムノアッセイの開発を実証します。このデュアルレポーターアプローチは、シングルレポーター法の分析性能を維持しながら、時間とリソースを節約し、サンプルサイズの要件を低減します。このアッセイにより、血液サンプルから血清学的情報を半分の時間で生成することができます。
概要
ライムボレリア症は、北半球の温暖な気候で最も一般的なダニ媒介感染症です1。これは、ボレリア属のスピロヘータ菌によって引き起こされ、地理的分布が異なる5つの既知のヒト病原体があります2。ヨーロッパにおける主な病原性ボレリア種は B. afzelii と B. garinii であり、B. burgdorferi s.s.、B. spielmanii および B. bavariensis はそれほど頻繁には関与していない。北米では、B. burgdorferi s.s.がライム・ボレリア症の唯一の原因物質である2,3。ボレリア病原体は、マダニ属のIxodesのメンバーによって伝染し、マダニに咬まれてから24時間以内に伝染する可能性があります4。
ライムボレリア症の診断は通常、臨床症状によって行われ、その後血清学によって確認されます。ヨーロッパと北米の両方で、診断ガイドラインでは、ボレリア特異的抗原に対する抗体反応を評価するために、反射免疫ブロットによる酵素結合免疫吸着アッセイ(ELISA)からなる2段階の検査シリーズを推奨しています1,5,6,7,8,9 .しかし、このアプローチは感度に欠けており、特にセロコンバージョンが不完全で、抗ボレリアIgGおよびIgM力価が低すぎる感染の初期段階では最適ではありません6。
マルチプレックスイムノアッセイは、一度に1つのターゲットのみを測定する従来のイムノアッセイを改良し、1つ以上の抗原に対する複数の抗体アイソタイプ応答を同時に評価することができます10,11,12。ELISAなどのアッセイは、1回の反応で1つの分析種を同定・定量することに限定されており、現在のケースでは、ボレリア菌に感染した後、単一の細菌抗原に対して誘導されたIgGまたはIgMを循環させます。このレポートでは、ヒト血清サンプル中のボレリア抗原のいずれかに対してIgG抗体とIgM抗体の両方を同時に検出するマルチプレックスイムノアッセイの開発に、ビーズベースの分析種プロファイリング技術を使用していることを説明しています。ヨーロッパ原産の最も一般的な病原性ボレリア種(B.garinii, B. afzelii, B. burgdorferi s.s.)北アメリカ (B. burgdorferi s.s.)(表1)2、3。これにより、決定的な病原体同定が可能になり、患者サンプル中の早期のIgMおよびその後のより耐久性のあるIgG免疫反応性を識別する能力が得られます。
| ターゲットアイソタイプ | レポーターチャンネル | 抗原 | ボレリア種 | 濾す | 抗原カップリング濃度 |
| 免疫グロブリンM | PEの | OspC(オースプシー) | B.ガリニイ | 20047 | 5.0 μg/10 ビーズ6 個 |
| IgG(免疫グログラム) | BV421型 | VlsE (英語) | B. burgdorferi s.s | B31の | 1.25 μg/10ビー ズ6個 |
| IgG(免疫グログラム) | BV421型 | DbpAの | B. burgdorferi s.s. | ZS7の | 10.0 μg/106 ビーズ |
| IgG(免疫グログラム) | BV421型 | DbpAの | B.アフゼリイ | PKoの | 5.0 μg/10 ビーズ6 個 |
表1:マルチプレックスアッセイ開発に用いた 代表的なボレリア 抗原。
私たちはまず、抗ボレリア 抗原IgG抗体またはIgM抗体のいずれかを2つの別々の反応で検出するシングルレポーターイムノアッセイを開発し、次にこれらのアッセイをデュアルレポーターマルチプレックスアッセイに統合し、同じ反応混合物中の両方の抗体アイソタイプを測定しました。磁気ビーズを目的の病原体標的抗原に結合させ、患者の血清サンプルとインキュベートします。ビーズ共役抗原は、病原体抗原に対する免疫応答で生成される血清中の循環IgGとIgMの両方によって認識され、捕捉されます。アッセイIgG対IgMの特異性は、IgGまたはIgMのいずれかに結合し、それぞれが2つの二次抗体に関連する異なる蛍光色素シグナルを持つ二次抗体の選択によって決定されます。各蛍光シグナルは、IgGまたはIgM(ここではそれぞれBrilliant Violet 421またはフィコエリトリン)の検出に使用される単一の蛍光色素に特異的な異なる励起レーザーと発光捕捉を持つ、装置の2つのレポーターチャンネル(デュアルレポーター)の1つで検出されます。装置の分類チャンネルは、異なるビーズセットに固有の色分けされた色素を識別します。したがって、複数の標的抗原を異なる染色ビーズに結合させ、ビーズセットを混合して使用することで、血清サンプル中の多様な抗病原体免疫反応性を包括的に評価することができます。分類チャンネルは、個々のビーズセット(特異的抗原)を識別し、その抗原に対するIgGまたはIgMに関連する蛍光を測定します。得られたマルチプレックスアッセイは、包括的でない従来の検査と比較して時間とリソースを節約し、限られたサンプル量でライム免疫反応性を正確にカタログ化します。SARS-CoV-2感染など他の病態における免疫応答を分類するために、同様のデュアルレポーターアプローチが以前に使用されてきたが13、この報告では、ライムボレリア症における免疫反応性を特徴付けるためのマルチプレックス蛍光アッセイ技術の適用について詳述している。
プロトコル
適切な治験審査委員会/倫理委員会の承認を得て、この実験シリーズでのヒト血清サンプルの使用が認められました。サンプルは、SARS-CoV-2の血清有病率に関するドイツの全国研究から得られた匿名化された残留物質でした14。ヒトサンプルの使用は、ドイツのハノーバー医科大学の倫理委員会によって承認されました(9086_BO_S_2020)。今回の研究では、合計21のヒト血清サンプルが使用されました。
1. ヒト試料使用の倫理的承認
- ヒトサンプルの使用について適切な倫理的承認を取得します。
2. 試薬・機器
- ヒト血清サンプル:以前にライムボレリア症と診断された人、またはボレリア陰性の免疫状態が実証された人からの血清サンプルを使用して、技術的なアッセイの検証と品質管理を実行します12,14。
- シングルレポーターインストゥルメンテーション。2チャンネルのシングルレポーター装置(材料表)を使用して、初期アッセイ開発と技術的バリデーションを行います。
注:シングルレポーターシステムには2つのレーザーがあります:1)ビーズセット特異的な蛍光を識別して定量し、使用する場合は異なるビーズセットを識別します(分類チャンネル)、2)ビーズ結合ターゲット特異的フィコエリトリン(PE)蛍光を検出および定量します(レポーターチャンネル;532 nm励起、「オレンジ」565-585 nm発光)。したがって、単一のレポーターチャンネルを使用して一度に分析できる抗体アイソタイプクラス(IgGまたはIgMなど)のみです。- 抗ボレリア IgG と IgM を別々に評価するための初期バリデーション試験を、両方の抗体クラスに PE 標識検出試薬を使用するシングルレポーター 96 ウェルフォーマットで実施します。
注:現在のアッセイでは、 ボレリア 抗原VlsEおよびDbpAの2つの変異体に特異的な循環IgGと、抗原OspCに特異的な循環IgMを代表例として評価しています。アッセイは、必要に応じて、他の抗ボレリア 抗原に対する血清免疫反応性を評価するために拡張することができます12。
- 抗ボレリア IgG と IgM を別々に評価するための初期バリデーション試験を、両方の抗体クラスに PE 標識検出試薬を使用するシングルレポーター 96 ウェルフォーマットで実施します。
- デュアルレポーターインストゥルメンテーション。デュアル IgM/IgG アッセイの開発および技術的検証には、同じ反応で IgG/IgM の同時分析が可能な 3 チャンネルデュアルレポーター装置(材料表)を使用します(詳細は以下を参照)。この装置には合計3つの蛍光検出チャンネルがあり、そのうち2つは標的のIg関連シグナルを評価するレポーターチャンネルです。
注:デュアルレポーターシステムには3つのレーザーがあります:1)ビーズセット特異的な蛍光(分類チャネル)を識別して定量化します。2)ターゲット特異的フィコエリトリン(PE)蛍光(レポーターチャンネル1;532 nm励起、「オレンジ」565-585 nm発光)を検出および定量し、3)第2のターゲット分析種のターゲット特異的ブリリアントバイオレット421(BV421)蛍光を評価します(レポーターチャンネル2;405 nm励起、「青」421-441 nm発光)。デュアルレポーターシステムは、96ウェルと384ウェルの両方のマイクロタイタープレート(半自動ハンドリング)アッセイフォーマットに対応しています。一般的なアッセイスキームを 図1に示します。プロトコルの手順については、以下で詳しく説明します。
3. 抗原カップリング
- ボレリア抗原を磁性、カルボキシル化、蛍光色分けされた6.5μmマイクロスフェア(ビーズ;資料表)1-エチル-3-(3-ジメチルアミノプロピル)カルボジイミド(EDC)/スルホ-N-ヒドロキシコハク酸イミド(sNHS)ケミストリーを使用。
注: 詳細な説明は、参考文献11および参考文献12 に記載されています。各抗原のカップリング濃度を表1に示します。結合ビーズは、使用するまで4°Cの暗所で保管してください。カップリング反応および検出反応に使用されるすべてのバッファーは、 補足資料に詳述されています。
4. アッセイ手順:シングルレポーターIgGまたはIgM血清学的アッセイ:96ウェルフォーマット
- サンプルを 2 ステップで希釈します(2 ステップ、どちらも 96 ウェルプレート、血清サンプルをアッセイバッファーで 200 倍希釈)。
注:アッセイバッファーの組成は、1%(w/v)ウシ血清アルブミンを含む低クロスバッファー:PBSの1:4混合物です。Tween-20 を最終濃度 0.05 %(v/v)になるように混合物に添加します。- サンプル希釈ステップ1:血清サンプル5 μLとアッセイバッファー120 μLを混合します(25倍希釈)。
- サンプル希釈ステップ2:希釈液10 μLとアッセイバッファー70 μLを混合して、25倍のサンプル希釈液をさらに8倍に希釈し、最終的なサンプル希釈を200倍にします。
- 磁気ビーズ混合希釈
- ビーズ集団あたり(すなわち、固有の標的抗原あたり)に1.0×106ビーズ/mLを含むビーズミックスを調製します。
- 調製したビーズミックスをアッセイバッファーで25倍に希釈し、この希釈懸濁液中の最終的なビーズ濃度がビーズ集団あたり(つまり、固有の標的抗原あたり)に×4〜104ビーズ/mLになるようにします。
- ビーズによる血清サンプルのインキュベーション
- 25 μL の希釈結合ビーズ懸濁液(4.0 × 104 ビーズ/セット/mL を含む)を、96 ウェル半面積マイクロタイタープレートの割り当てられたウェルにピペットで移します(材料表)。
- 25 μLの200倍希釈血清サンプル(上記のステップ4.1から)を、25 μLの結合ビーズ懸濁液を含む適切なウェルに加えます。
注:これにより、さらに 2 倍希釈が得られるため、ウェル内の最終的な血清サンプル希釈は 400 倍になり、最終的なビーズ数は 1000 ビーズ/ビーズセット/50 μL 反応になります。 - 96ウェル反応プレートをマイクロプレートシール(粘着ホイルまたはプラスチックプレートカバー)で覆います。
- プレートシェーカーで20°C、750rpmで2時間インキュベートします。
- ビーズ洗浄
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを慎重に取り外します。
- 96ウェル反応プレートをプレートウォッシャーに入れます。
- 自動磁気プレートウォッシャーを使用して、100 μLの洗浄バッファー(1× PBS + 0.05% v/v Tween 20)でビーズを3回洗浄します。
- 洗浄したビーズを100 μLの洗浄バッファーに再懸濁し、プレートを粘着ホイルまたはプラスチックプレートカバーで覆い、プレートシェーカーでプレートを20°C、1000rpmで1分間振とうします。
- 洗ったビーズを割る
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを慎重に取り外します。
- ピペッティングで反応液を 5 回上下させて混合し、100 μL の各反応容量 50 μL を 2 つの新しい 96 ウェル反応プレート (IgG 検出用と IgM 検出用プレート) のそれぞれに移します。
- 検出抗体/試薬のインキュベーション
注:この時点で、標的抗原共役ビーズは血清サンプルとインキュベートされ、抗原と反応する血清中の循環抗体(存在する場合)が抽出されています。免疫グロブリンが結合した反応ビーズは2つのプレートに分けられ、IgGとIgMはPE標識付きのアイソタイプ特異的二次抗体を使用して別々のプレートで検出および定量されます。プレートの取り扱いを20分ずらします。- 磁気プレートワッシャーを使用して、磁気ビーズを含むウェルから上清を吸引します。
- 各プレートについて、アッセイバッファーにPE標識ヤギ抗ヒトIgG(3 μg/mL)またはPE標識ロバ抗ヒトIgM(5 μg/mL)を含む適切なIg検出試薬ミックス(抗IgGまたは抗IgM)を調製します。各ビーズ含有ウェルについて、30μLの検出試薬を使用する。反応ウェルに十分な量のIgGおよびIgM検出試薬を調製し、ピペッティングの損失に対応するのに十分な量を確保します。
- 30 μL の IgG 検出試薬を、IgG プレート上の反応ビーズを含む各ウェルにピペットで移し、96 ウェル反応プレートをマイクロプレートシールで覆います。
- 30 μL の IgM 検出試薬を、IgM プレート上の反応ビーズを含む各ウェルにピペットで移し、96 ウェル反応プレートをマイクロプレートシールで覆います。
- プレートシェーカーで750rpmで振とうしながら、20°Cで45分間インキュベートします。
- ビーズ洗浄
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを慎重に取り外します。
- 96ウェル反応プレートを磁気プレートワッシャーに入れます。
- 磁気プレートワッシャーを使用して、100 μLの洗浄バッファーでビーズを3回洗浄します。
- ビーズを100 μLの洗浄バッファーに再懸濁します。
- 単一のレポーター装置で結果を解析します。
- 96ウェル反応プレートをマイクロプレートシールで覆います。
- プレートシェーカーで 96 ウェル反応プレートを 20 °C、1000 rpm で 3 分間振とうします。
- プレートシェーカーから96ウェル反応プレートを移し、シングルレポーターフローアナライザー装置に入れます(材料表)。
- 各サンプルについて、次の装置設定を使用して蛍光強度の中央値(MFI)を分析します:取り込み量 = 80 μL、カウント = 50/ビーズ集団、タイムアウト = 60秒、ゲーティング = 7,500-15,000)12,13。
5. アッセイ手順:デュアルレポーターIgGおよびIgM血清学的アッセイ:96ウェルフォーマット
- サンプル希釈(2ステップ、いずれも96ウェルプレート、アッセイバッファー中で200倍の血清サンプル希釈)
- サンプル希釈ステップ1:5 μLの血清サンプルを120 μLのアッセイバッファーと混合します(25倍希釈)。
- サンプル希釈ステップ2:最初の希釈液10 μL(セクション5.1.1の25倍希釈サンプル)と70 μLアッセイバッファー(8倍希釈)を混合して、25倍のサンプル希釈液をさらに8倍に希釈し、最終的なサンプル希釈を200倍に希釈します。
- 磁気ビーズ混合希釈
- ビーズ集団あたり(すなわち、固有の標的抗原あたり)1.0×10 6ターゲット抗原共役ビーズ/mLを含むビーズミックスを調製します。
注:この実験シリーズでは、各反応で4つのユニークな ボレリア 抗原に対するIgGとIgMの両方の免疫反応性を評価しました。 - 調製したビーズミックスをアッセイバッファーで50倍に希釈します。この希釈懸濁液中のビーズ濃度は、ビーズ集団あたり 2.0 × 104 ビーズ/mL です。
注:予備調査で、ビーズ数の半分を使用した場合、蛍光シグナルが定量直線範囲内に維持されることが確認されたため、2 つのアッセイ間の直接的な比較可能性を可能にし、リソースを節約するために、二本鎖アッセイ反応におけるビーズの数は、シングルレポーター反応で使用したビーズの数から半分に減らしました。
- ビーズ集団あたり(すなわち、固有の標的抗原あたり)1.0×10 6ターゲット抗原共役ビーズ/mLを含むビーズミックスを調製します。
- ビーズによる血清サンプルのインキュベーション
- 25 μLの希釈標的抗原共役ビーズ懸濁液(2.0 × 104 ビーズ/セット/mLを含む)を、96ウェルハーフエリアマイクロタイタープレートのあらかじめ割り当てられたウェルにピペットで移します。反応ウェルの正確な数とプレート上の配置は、オペレーターが決定したテストされたサンプルの総数と、サンプルごとに単一ウェルと複製ウェルのどちらを実行するかによって異なります。
注:標的抗原共役磁気ビーズは、ヒト血清サンプルと反応します。抗ボレリア 抗原免疫反応性IgGとIgMの両方がサンプル中に存在する場合、同じ抗原共役ビーズに結合し、固定化されます。次に、結合したIgGとIgMの二次抗体定量を、同じ反応で同じビーズに対して実行し、IgGとIgMの同定に異なる蛍光色素を使用して、それらの分化を可能にします。 - 25 μLの200倍希釈血清(上記のステップ5.1から)を、25 μLの混合標的抗原共役ビーズ懸濁液を含む各ウェルに加えます(ステップ5.2)。
注:これにより、さらに 2 倍希釈が生成されるため、ウェル内の最終的な血清サンプル希釈は 400 倍になり、最終的なビーズ数は 500 ビーズ/ビーズセット/50 μL 反応になります。 - 96ウェル反応プレートをマイクロプレートシール(粘着箔またはプラスチックプレートカバー)で覆います。
- プレートをビーズとともに、プレートシェーカー上で20°C、750rpmで2時間インキュベートします。
- 25 μLの希釈標的抗原共役ビーズ懸濁液(2.0 × 104 ビーズ/セット/mLを含む)を、96ウェルハーフエリアマイクロタイタープレートのあらかじめ割り当てられたウェルにピペットで移します。反応ウェルの正確な数とプレート上の配置は、オペレーターが決定したテストされたサンプルの総数と、サンプルごとに単一ウェルと複製ウェルのどちらを実行するかによって異なります。
- ビーズ洗浄(余分な血清サンプルを除去するため)
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを取り外します。
- 96ウェル反応プレートを磁気プレートワッシャーに入れます。
- 磁気プレートワッシャーを使用して、100 μLの洗浄バッファーでビーズを3回洗浄します。
- 最終洗浄ステップ後のビーズから最終洗浄量を吸引します。
- 検出抗体(インキュベーション - パートI)
- ビオチン化ヤギ抗ヒトIgG(1 μg/mL)とPE標識ロバ抗ヒトIgM(5 μg/mL)を含む新鮮なIgGおよびIgMデュアル検出試薬をアッセイバッファーに作製します。ビーズ含有ウェルごとに、30 μLのデュアル検出試薬を使用します。反応ウェルに十分な量の IgG および IgM デュアル検出試薬を調製し、ピペッティングの損失に対応するのに十分な量を確保します。
- 30 μL の IgG および IgM デュアル検出試薬を割り当てられた各ウェルにピペットで移し、96 ウェル反応プレートをマイクロプレートシールで覆います。
- プレートシェーカーで750rpmで振とうしながら、プレートを20°Cで45分間インキュベートします。
- ビーズ洗浄(過剰検出抗体の除去)
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを慎重に取り外します。
- 96ウェル反応プレートを自動磁気プレート洗浄機に入れます。
- 自動磁気プレートウォッシャーを使用して、100 μLの洗浄バッファーでビーズを3回洗浄します。
- 最終洗浄ステップ後のビーズから最終洗浄量を吸引します。
- ストレプトアビジン標識レポーター(インキュベーション - パートII)
- 新鮮なBV421標識ストレプトアビジンをアッセイバッファーで0.2 μg/mLの濃度に希釈します。ビーズ含有ウェルごとに、30 μLのBV421標識ストレプトアビジンを使用します。反応ウェル用に十分な量のBV421標識ストレプトアビジンを調製し、ピペッティングの損失に対応するのに十分な量を余分に用意します。
- 希釈したBV421-ストレプトアビジン30 μLを各反応ウェルにピペットで移し、96ウェル反応プレートをマイクロプレートシールで覆います。
- プレートシェーカーで750rpmで振とうしながら、プレートを20°Cで30分間インキュベートします。
- 洗浄ビーズ(余分なBV421-ストレプトアビジンを除去するため)
- プレートシェーカーから96ウェルリアクションプレートを取り外し、接着プレートシールを慎重に取り外します。
- 96ウェル反応プレートを磁気プレートワッシャーに入れます。
- 自動磁気プレートウォッシャーを使用して、100 μLの洗浄バッファーでビーズを3回洗浄します。
- ウェル内のビーズを洗浄バッファー中に最終容量100 μLになるまで再懸濁します。
- デュアルレポーター装置で結果を分析
- 96ウェル反応プレートをマイクロプレートシールで覆います。
- 96ウェル反応プレートをプレートシェーカーで20°C、1000rpmで3分間インキュベートします。
- 96ウェル反応プレートをプレートシェーカーからデュアルレポーターフローアナライザー装置に移します(材料表)。
- メーカーの指示に従ってサンプルの蛍光強度(MFI)の中央値を評価します(装置設定:デュアルレポーターモード、取り込み量 = 80 μL、カウント = 50/ビーズ集団、タイムアウト = 60秒、ゲーティング = 7,500-15,000)。
6. デュアルレポーターIgGおよびIgM血清学的アッセイ:384ウェル半自動フォーマット
- デュアルレポーターアッセイは、セクション5で詳述したアッセイステップを使用して384ウェルプレートフォーマットで実施しますが、サンプルはピペッティングロボットと自動磁気プレートウォッシャーを使用して処理します(材料表)。384ウェルフォーマットでは、インキュベーション中にプレートを振とうし、1450 rpmで洗浄し、蛍光を測定する前に、プレートを21°Cおよび1800 rpmで5分間振とうします。
結果
実験の概要
シングルレポーターおよびデュアルレポータービーズベースのボレリアアッセイの一般的なスキームを図 1 に示します。特定のボレリア抗原に対して生成された単一の抗体ターゲット(すなわち、IgGまたはIgM)について、報告用のPE標識抗アイソタイプ抗体を使用して、ヒト血清サンプルで両方の抗体クラスを独立して評価しました。IgGとIgMの両方の免疫反応性を同時に分析するデュアルレポーターアッセイでは、ボレリア抗原特異的IgG検出では、ビオチン化抗ヒトIgG + BV421標識ストレプトアビジン(青色蛍光)レポーター系を使用し、IgM検出用のPE標識レポーター(オレンジ色蛍光)を保持しました。デュアルレポーターアッセイのワークフローはシングルレポーターアッセイと似ていますが、セカンドチャンネル蛍光検出試薬BV421-ストレプトアビジンとの30分間の検出システムインキュベーションが追加されています。

図1:シングルレポーターおよびデュアルレポータービーズベースの ボレリア アッセイの概略図。 (A)シングルレポーター装置を使用して、抗ボレリア IgGまたはIgMのいずれかを個別に特徴付けるビーズベースのアッセイを開発し、最初に検証しました。任意のボ レリア 抗原をビーズに結合させ、血清サンプル中に存在するIgGまたはIgMのいずれかを捕捉および定量するために使用できます。特定の抗原に対するIgGとIgMの両方の反応性を評価するには、2つの別々のイムノアッセイが必要です。(B)デュアルレポーターシステムにより、同じウェル内の個々の ボレリア 抗原に対するIgG抗体とIgM抗体の両方の血清サンプルを同時に分析することができました。このアプローチでは、抗ボレリア IgMを標的とする同じPE標識検出抗体を使用しますが、PEベースのシステムからのIgG検出を、ビオチン化一次検出抗体とBV421標識ストレプトアビジン(「青色」エミッター)の使用に置き換え、30分間の追加検出システムインキュベーションステップが必要です。 この図の拡大版をご覧になるには、ここをクリックしてください。
アッセイ内精度
3つの代表的な ボレリア 抗原のスピアマン相関解析(図2)により、ヒト血清中に存在する抗ボレリア 抗体を検出した場合、MFI値の均一な再現性が実証されました。

図2:アッセイ内 デュアルレポータービーズベースの ボレリア アッセイの精度。 Spearmanの相関解析では、PE検出システムを使用して ボレリア特異的IgM抗体(A)を検出し、BV421検出システムを使用して ボレリア 特異的IgG抗体(B、C)を検出した場合、デュアルレポーターアッセイのアッセイ内精度が高いことが示されました。合計 21 の血清サンプルを、半自動手順を使用して重複して分析しました。各グラフでは、MFI信号を互いにプロットし、線形回帰によって分析しました。赤い破線で示された線形曲線(x=y)は、検出システムのMFI信号が同一であることを示します。 この図の拡大版をご覧になるには、ここをクリックしてください。
アッセイ間の精度
アッセイ間の良好な再現性は、デュアルレポーターアッセイで観察されました。Levey-Jenningsチャート(図3)は、7回の独立した分析で測定された品質管理サンプルのMFI値で、すべての代表的な抗原について高いアッセイ間精度を示しました。代表的な 4つのボレリア 抗原の平均変動率(CV%=標準偏差/平均×100)は5.3%でした。
希釈直線性
従来のシングルレポーターアッセイと新しいデュアルレポーターアッセイでは、異なるフローサイトメトリープラットフォームを使用しているため、同じ抗原イムノアッセイの蛍光出力の中央値を2台のフローサイトメトリー装置間で比較しました(図4)。サンプル希釈シリーズは、IgM と IgG の両方の評価に線形希釈曲線を提供し、評価された希釈範囲全体(1:100-1:12,800)にわたって装置間の用量反応の良好な平行性を示しました。
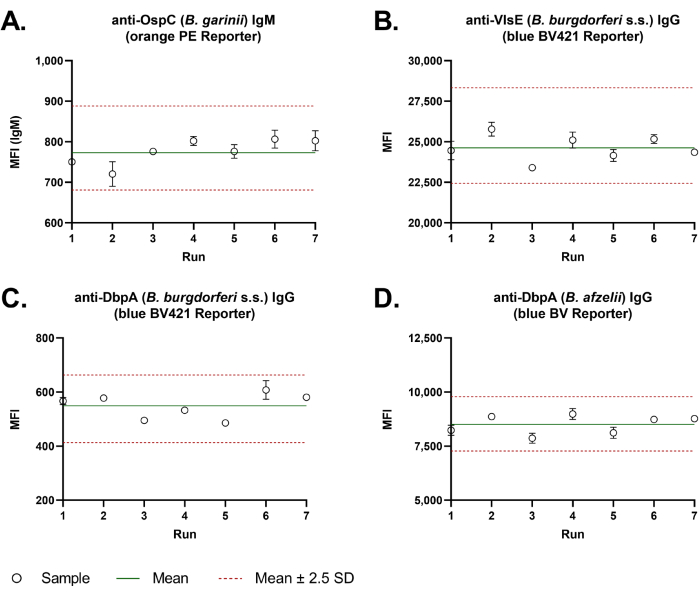
図3:デュアルレポータービーズベースの ボレリア アッセイのアッセイ間精度。 アッセイ間の精度を評価するために、品質管理サンプルの ボレリア特異的IgM(A)およびIgG(B-D)抗体レスポンスを、毎回重複したウェルで7回独立して分析しました。アッセイは手作業で行いました。MFI値はLevey-Jenningsチャートにプロットされました。緑の線は、すべての値の平均を示します。2本の赤い破線は、アッセイ間精度の許容範囲を示しています。これは、標準偏差(2.5 S.D.)の2.5倍±平均値から計算されました。 この図の拡大版をご覧になるには、ここをクリックしてください。

図4:デュアルレポータービーズベースの ボレリア アッセイの希釈直線性。 サンプル希釈倍率を 100 倍から 12,800 倍にした場合、IgM 検出(A)と IgG 検出(B)の希釈曲線は、シングルレポーター装置とデュアルレポーター装置で手動で行った場合と同様でした。テストしたすべての希釈率で、MFI 値は、シングルレポーター装置(赤色の記号)を使用した場合、デュアルレポーター装置(青色の記号)よりもわずかに高かった。2 つの代表的な抗原の希釈曲線を示しており、各希釈点は、標準偏差(SD *)で示す三重ウェルの平均測定値を表しています。注: この縮尺では、小型の SD は表示されません。 この図の拡大版をご覧になるには、ここをクリックしてください。
ディスカッション
この報告は、血清サンプル中の抗ボレリア免疫反応性を再現性と感度で測定する2レポータービーズベースのボレリア免疫測定法の開発に焦点を当てています12。ライムボレリア症を引き起こす様々な病原性ボレリア種は、変異体特異的抗原の不均一性によって区別することができる6,7,8,9。マルチプレックスアッセイは、IgGおよびIgMを介した抗ボレリア免疫反応性を同じ反応ウェル内で同時に評価するため、2つのシングルプレックスアッセイを別々に実行するために必要な試薬、労力、およびサンプル材料を節約できます。IgMとIgGの応答を経時的に比較することで、感染後にIgMからIgGへの血清変換が起こるため、疾患の進行をより適切に追跡できる可能性があります6。
デュアルレポーターシステムは、2つの異なる検出抗体システム13,15を使用する。関連する実験では、ボレリア抗IgM検出システムと抗IgG検出システムの間に有意な検出可能な交差反応性は示されませんでした 両方の抗体クラスを同じ反応ウェルで一緒に分析した場合12。IgM抗体とIgG抗体の結合親和性が低いことを考慮し16,17、PEはイムノアッセイで日常的に使用される最も強い発光蛍光色素の1つであるため、IgM検出(デュアルレポーター装置の最初のレポーターチャネル)にはPE標識検出抗体を選択しました18。IgG評価には、ビオチン化検出抗体を使用し、その後、BV421標識ストレプトアビジン(装置の2番目のレポーターチャネル)で照射しました19。シングルレポーターシステムと比較して30分のインキュベーションステップが追加されますが、デュアルレポーターシステムでは、反応ごとに2倍の情報が得られます。全体として、デュアルレポーターマルチプレックスアッセイは、シングルレポーターアッセイを2回実行するよりも、累積的な時間と材料のインプットが少なくて済みます。
マルチプレックスボレリアアッセイの優れた性能と安定性は、アッセイ内およびアッセイ間の精密研究における高い再現性、およびIgGおよびIgM評価の両方において幅広いサンプル濃度にわたる希釈直線性と希釈平行度の実証によって実証されました。2つの装置間の光学系とキャリブレーション設定の違いにより、シングルチャンネル装置を使用した場合とデュアルチャンネルシステムを使用した場合(PEで≈1.7×高い)では、同じ蛍光色素の絶対蛍光発光レベルが高いことが観察されました(図4)。それにもかかわらず、両方の蛍光色素の蛍光発光曲線は、サンプル希釈率の極端さが高い場合と低い場合、両方の装置の線形範囲内にとどまり、測定された絶対蛍光の不一致は、ボレリアの曝露状態の分類に影響を与えませんでした。12名
このビーズベースの ボレリア マルチプレックスアッセイの主な利点は、アッセイを変更または拡張して、異なる分析種または追加の分析種を評価すること、 たとえば、他の ボレリア 種の抗原に対する抗体を検出することが容易であることです。xMAP磁気ビーズセットには、装置の分類チャンネルで区別できるさまざまな色素の組み合わせが含まれており、理論的には、同じサンプル内で最大500の固有の分析種を同時に評価できるマルチプレックスアッセイに実装できます。今回の研究では、アッセイの機能と安定性を実証し、シングルレポーターとデュアルレポーターシステムを比較するために、4つの代表的な ボレリア 抗原に焦点を当てていますが、最終的なアッセイでは、ヨーロッパと北米で循環している臨床的に関連する5つの ボレリア 病原体すべてを同定できる8つの抗原を調査します12。
半自動アッセイフォーマットの標準的な384ウェルマイクロタイタープレートを使用して、ハイスループット性能を実現します。96ウェルプレートと384ウェルプレートの両方に対応したアッセイと装置の互換性により、 ボレリア マルチプレックスアッセイは、全国的な研究20などの大規模なサンプルセットを迅速に分析するための効率的なスクリーニングツールとして使用できます。アッセイの手動による実施は、より小さな96ウェルプレートを使用する小さなサンプルセットでも可能です。
研究の限界には、少数のヒト血清サンプル中の少数の ボレリア 免疫反応性標的の比較評価が含まれます。しかし、最初の研究では、より大きなサンプルセット内の5つの既知の ボレリア 種すべてからの8つの抗原を分析しても、IgGとIgMの両方のアッセイ性能が維持されることが確認されました12。また、デュアルレポーター装置は、各反応で同時に2つの抗体アイソタイプしか評価できないため、完全なアイソタイププロファイリングを行うには、追加のアッセイ反応を実行する必要があります13。
結論として、このレポートでは、ビーズベースのシングルレポーターイムノアッセイを、ヒト血清サンプル中の病原性ボレリア特異的IgG抗体とIgM抗体を同時に評価できるデュアルレポーターアッセイへの合併と変換の成功について詳しく説明しています。この複合アプローチにより、合計時間、材料、労力を節約し、2つの独立したシングルレポーターアッセイと同じデータ量を生成できます。マルチプレックスアッセイは、96ウェルから384ウェルのマイクロタイタープレートフォーマットまでスケールアップでき、ロボットプレートとリキッドハンドリング機器を使用して半自動化できるため、大規模な人口調査などのハイスループットアプリケーションに適しています。ビーズベースのデュアルレポーターアッセイシステムは、例えば、他のウイルスおよび細菌性病原体に対する免疫応答の評価13,21、臓器移植におけるHLAエピトープに対する同種抗体応答の評価22、自己免疫疾患のメカニズムの探索23において有用性が実証されています。今回の報告書では、ライム病の原因となるボレリア病原体への曝露を特定するためのマルチプレックス技術の使用について詳述しており、多様な病状における複雑な免疫メカニズムを探求するためにこのアプローチを研究室がどのように適応させることができるかの例として紹介しています。
開示事項
著者は何も開示していません。
謝辞
このレポートは、Luminex(テキサス州オースティン)から資金提供を受けました。著者らは、Matthew Silverman PhD(Biomedical Publishing Solutions, Panama City, FL; mattsilver@yahoo.com)の分析的および科学的な編集支援に感謝します。また、著者らは、この研究で使用した ボレリア 抗原を提供してくれたtgcBIOMICS GmbH(ドイツ、ビンゲン)のHarald Klein氏とChristoph von Eichel-Streiber氏にも感謝の意を表します。技術的アッセイの検証と品質管理のためのヒト血清サンプルは、以下から入手しました: 1) ドイツにおける SARS-CoV-2 に対する抗体に関する多局所および連続有病率研究 ドイツ、ブラウンシュヴァイクのヘルムホルツ感染研究センター疫学部門による。2)神経科、Sächsisches Krankenhaus Rodewisch(Rodewisch、ドイツ)。ヒトサンプルの使用は、ドイツのハノーバー医科大学(9086_BO_S_2020)の倫理委員会によって承認されました。
資料
| Name | Company | Catalog Number | Comments |
| Antibodies and Detection Reagents | Source | Catalog Number | |
| Biotinylated Goat Anti-Human IgG | Jackson ImmunoResearch (Dianova) | 109-066-098 | |
| Brilliant Violet 421-Streptavidin | BD Biosciences | 563259 | |
| Donkey Anti-Human IgM | Jackson ImmunoResearch (Dianova) | 709-116-073 | |
| Borrelia Antigens | tgcBIOMICS (Bingen, Germany) | ||
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | Thermo Scientific Pierce | 77149 ProteoChem (100 mg) | |
| 10x PBS | Fisher Scientific | BP399-4 | |
| BSA | Carl Roth | T844.3 | |
| MES (2-ethanesulfonic acid; zwitterionic buffer) | Carl Roth | 4256.2 | |
| Na2HPO4 | Carl Roth | 4984.1 | |
| ProClin300 | Sigma | 48914-U | |
| Sulfo-NHS (N-hydroxysulfosuccinimide) | Thermo Scientific Pierce | 24510 (500 mg) | |
| Triton X-100 | Thermo Scientific | 85111 | |
| Instrumentation and Ancillary Lab Supplies | Source | ||
| 384-well plate | Corning, Cat# 3570 | ||
| 96-well deep-well plates | ThermoFisher Scientific, Cat# 95040450 | ||
| 96-well half-area plates | Corning, Cat# 3690 | ||
| BioTek 405 TS Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| BioTek MultiFlo FX Plate Washer | BioTek Instruments/Agilent Technologies, Santa Clara, CA | ||
| DynaMag Spin Magnet (for isolating beads in microcentrifuge tubes) | ThermoFisher, Cat# 12320D | ||
| Flexmap 3D (two-channel, single-reporter instrument) | Luminex Corp., Austin, TX | ||
| KingFisher Magnetic Particle Processor (for isolating beads in 96-well plates) | ThermoFisher, Cat# A31508 | ||
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp., Austin, TX | ||
| SmartBlock Plates | Eppendorf, Cat# 5363000039 | ||
| ThermoMixer C | Eppendorf, Cat# 5382000015 | ||
| ThermoTop | Eppendorf, Cat# 5308000003 | ||
| xMAP Intelliflex (three-channel, dual-reporter instrument) | Luminex Corp., Austin, TX |
参考文献
- Stanek, G., Strle, F. Lyme borreliosis-from tick bite to diagnosis and treatment. FEMS Microbiology Reviews. 42 (3), 233-258 (2018).
- Stanek, G., Wormser, G. P., Gray, J., Strle, F. Lyme borreliosis. The Lancet. 379 (9814), 461-473 (2012).
- Rizzoli, A., et al. Lyme borreliosis in Europe. Eurosurveillance. 16 (27), 19906(2011).
- Cook, M. J. Lyme borreliosis: a review of data on transmission time after tick attachment. International Journal of General Medicine. 8, 1-8 (2015).
- Strle, F., Stanek, G. Clinical Manifestations and Diagnosis of Lyme Borreliosis. Lyme Borreliosis: Biological and Clinical Aspects. Lipsker, D., Jaulhac, B. , Karger. 51-110 (2009).
- Wilske, B., Fingerle, V., Schulte-Spechtel, U. Microbiological and serological diagnosis of Lyme borreliosis. FEMS Immunology and Medical Microbiology. 49 (1), 13-21 (2007).
- Dessau, R. B., et al. To test or not to test? Laboratory support for the diagnosis of Lyme borreliosis: a position paper of ESGBOR, the ESCMID study group for Lyme borreliosis. Clinical Microbiology and Infection. 24 (2), 118-124 (2018).
- Eldin, C., et al. Review of European and American guidelines for the diagnosis of Lyme borreliosis. Médecine et Maladies Infectieuses. 49 (2), 121-132 (2019).
- Lantos, P. M., et al. Clinical Practice Guidelines by the Infectious Diseases Society of America (IDSA), American Academy of Neurology (AAN), and American College of Rheumatology (ACR): 2020 Guidelines for the Prevention, Diagnosis and Treatment of Lyme Disease. Clinical Infectious Diseases. 72 (1), e1-e48 (2021).
- Gerritzen, A., Brandt, S. Serodiagnosis of Lyme borreliosis with bead based immunoassays using multiplex technology. Methods. 56 (4), 477-483 (2012).
- Embers, M. E., et al. Five-antigen fluorescent bead-based assay for diagnosis of Lyme disease. Clinical Vaccine Immunology. 23 (4), 294-303 (2016).
- Häring, J., et al. Borrelia multiplex: a bead-based multiplex assay for the simultaneous detection of Borrelia specific IgG/IgM class antibodies. BMC Infectious Diseases. 22 (1), 859(2022).
- Angeloni, S., Cameron, A., Pecora, N. D., Dunbar, S. A rapid, multiplex dual reporter IgG and IgM SARS-CoV-2 neutralization assay for a multiplexed bead-based flow analysis system. Journal of Visualized Experiments. 170, (2021).
- Gornyk, D., et al. SARS-CoV-2 Seroprevalence in Germany. Deutsches Ärzteblatt International. 118 (48), 824-831 (2021).
- Luminex Corporation. xMAP Cookbook. Angeloni, S., Das, S., De Jager, W., Dunbar, S. , 5th ed, https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrer=https%3A%2F%2Fwww.luminexcorp.com%2F (2022).
- Racine, R., Winslow, G. M. IgM in microbial infections: Taken for granted. Immunology Letters. 125 (2), 79-85 (2009).
- Ehrenstein, M. R., Notley, C. A. The importance of natural IgM: scavenger, protector and regulator. Nature Reviews Immunology. 10 (11), 778-786 (2010).
- Kovaleski, G., et al. Extraction and purification of phycobiliproteins from algae and their applications. Frontiers in Chemistry. 10, 1065355(2022).
- Chattopadhyay, P. K., et al. Brilliant violet fluorophores: A new class of ultrabright fluorescent compounds for immunofluorescence experiments. Cytometry Part A. 81 (6), 456-466 (2012).
- Coors, A., et al. Regional seropositivity for Borrelia burgdorferi and associated risk factors: findings from the Rhineland Study, Germany. Parasites & Vectors. 15 (1), 241(2022).
- Gürsoy, M., et al. Salivary IgA and IgG antibody responses against periodontitis-associated bacteria in Crohn's Disease. International Journal of Molecular Science. 24 (3), 2385(2023).
- Argani, H. Anti-HLA Antibody: The role of epitopes in organ transplantation. Experimental and Clinical Transplantation. 17 (Suppl 1), 38-42 (2019).
- Laman, J. D., Huizinga, R., Boons, G. J., Jacobs, B. C. Guillain-Barré syndrome: expanding the concept of molecular mimicry. Trends in Immunology. 43 (4), 296-308 (2022).
Erratum
Formal Correction: Erratum: Simultaneous Detection of Different Antibody Classes in a Multiplexed Serological Test
Posted by JoVE Editors on 8/16/2023. Citeable Link.
An erratum was issued for: Simultaneous Detection of Different Antibody Classes in a Multiplexed Serological Test. The Authors section was updated to correct an Affiliation. It was updated from:
Julia Häring1
Tanja Michel1
Matthias Becker1
Daniel Junker1
Tatia Tchitchagua2
Olaf Leschnik2
Berit Lange3,4
Stefanie Castell3,4
Gérard Krause3,4
Monika Strengert3
Alex Dulovic1
Nicole Schneiderhan-Marra1
1NMI Natural and Medical Sciences Institute, University of Tübingen
2Department of Neurology, Sächsisches Krankenhaus Rodewisch
3Department of Epidemiology, Helmholtz Centre for Infection Research
4German Centre for Infection Research (DZIF)
to:
Julia Häring1
Tanja Michel1
Matthias Becker1
Daniel Junker1
Tatia Tchitchagua2
Olaf Leschnik2
Berit Lange3,4
Stefanie Castell3,4
Gérard Krause3,4
Monika Strengert3
Alex Dulovic1
Nicole Schneiderhan-Marra1
1NMI Natural and Medical Sciences Institute at the University of Tübingen
2Department of Neurology, Sächsisches Krankenhaus Rodewisch
3Department of Epidemiology, Helmholtz Centre for Infection Research
4German Centre for Infection Research (DZIF)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved