Method Article
쥐 장 중간엽의 분리로 텔로세포의 높은 수율
* 이 저자들은 동등하게 기여했습니다
요약
여기에서 우리는 텔로세포를 포함한 쥐의 장 중간엽을 분리하는 프로토콜을 제시합니다. 이들은 마우스 또는 인간 유래 오가노이드와의 공동 배양과 같은 여러 응용 분야에 사용하여 성장을 지원하고 원래 조직의 상황을 더 잘 반영할 수 있습니다.
초록
쥐의 소장 또는 결장 중간엽은 혈액 및 림프 내피, 신경, 섬유아세포, 근섬유아세포, 평활근 세포, 면역 세포 및 최근에 확인된 세포 유형인 텔로세포를 포함한 뚜렷한 세포 유형을 포함하는 매우 이질적입니다. 텔로세포는 세포질 과정이 긴 독특한 중간엽 세포로 세포체에서 수십에서 수백 미크론의 거리에 도달합니다. 텔로세포는 최근 줄기 및 전구 세포 증식에 필수적인 Wnt 단백질을 제공하는 중요한 장 줄기 세포 틈새 성분으로 부상했습니다.
마우스 장에서 중간엽을 분리하는 방법에 대한 프로토콜을 사용할 수 있지만 이러한 절차가 텔로세포의 효율적인 분리를 허용하는지 여부는 명확하지 않습니다. 텔로세포를 효율적으로 분리하려면 텔로세포와 인접 세포 사이의 강력한 세포-세포 접촉을 생존력에 영향을 미치지 않으면서 해리할 수 있는 특별한 프로토콜 조정이 필요합니다. 여기에서 사용 가능한 장 중간엽 분리 프로토콜은 상대적으로 높은 수율의 생존 가능한 단일 세포 텔로세포를 포함하는 중간엽의 성공적인 분리 및 배양을 지원하도록 조정되었습니다.
수득된 단세포 현탁액은 면역염색, 세포 분류, 이미징 및 mRNA 실험과 같은 여러 기술에 의해 분석될 수 있다. 이 프로토콜은 텔로세포의 충분히 보존된 항원 및 기능적 특성을 가진 중간엽을 생성하며 여러 응용 분야에 사용할 수 있습니다. 예를 들어, 마우스 또는 인간 유래 오가노이드와의 공동 배양에 사용하여 성장 인자 보충 없이 오가노이드 성장을 지원하고 원래 조직의 상황을 더 잘 반영할 수 있습니다.
서문
소장과 결장은 모두 줄기 세포의 존재로 인해 재생성이 높은 조직이며, 줄기 세포는 증식하고 재생을 촉진합니다1. 상피를 둘러싸고 있는 중간엽은 세포외 기질 단백질과 상피 세포의 반응을 조절하는 신호 분자2를 분비함으로써 구조적 및 기능적 지원을 제공한다. 텔로세포는 큰 중간엽 세포로, 지금까지 주로 전자 현미경으로 텔로포데스(telopodes)라고 하는 긴 세포질 과정을 가진 세포로 설명되었으며, 이 세포는 겹쳐서 미로 네트워크 3,4,5,6,7을 생성합니다. 최근에, 전사 인자 FOXL1을 발현하는 장내 텔로세포는 줄기 및 전구 세포 기능에 중요한 Wnt 단백질을 제공하는 중요한 줄기 세포 틈새 성분으로 부상하고 있다. 장내 텔로사이트는 Wnt, Bmp, Tgfb, Shh와 같은 주요 신호전달 경로 단백질과 많은 성장 인자를 발현한다8.
텔로세포가 생체 내에서 중요한 줄기 세포 틈새 구성 요소라는 점을 감안할 때, 생체 외에서 이들을 분리하고 배양하는 프로토콜을 개발하면 생체 외에서 성장과 분화를 지원하기 위해 신호 분자 및 성장 인자의 공급원으로 사용할 수 있습니다. 잘 확립된 프로토콜을 사용하여 결장 또는 장 상피 선와를 분리하고 오가노이드 9,10,11로 알려진 3D 구조를 형성할 수 있습니다. 3차원 오가노이드는 생체 외 장 상피의 생리학과 병리를 모두 조사하는 강력한 도구입니다. 생체 외 시스템에서 오가노이드는 생존 및 성장 인자의 외인성 보충에 의존한다10. 분리된 중간엽은 마우스 및 인간 유래 오가노이드 모두와 함께 배양할 수 있으며 원래 조직의 상황을 더 잘 반영하기 위해 외인성 보충 대신 성장 인자의 공급원으로 사용할 수 있습니다. 생체 외 텔로세포를 연구하면 정상 또는 병리학적 세포 행동, 조직 항상성 메커니즘 및 세포-세포 상호 작용을 더 자세히 조사하는 데 많은 이점이 있습니다.
마우스 장에서 중간엽을 분리하는 방법을 설명하는 프로토콜을 사용할 수 있지만 이러한 절차가 텔로세포의 효율적인 분리를 초래하는지 여부는 명확하지 않습니다. 텔로사이트의 성공적인 분리는 텔로세포와 인접 세포 사이의 강한 세포-세포 접촉의 해리를 허용하는 특별한 프로토콜 조정이 필요합니다., 생존력에 영향을 미치지 않으면서. 이러한 한계를 극복하기 위해 이 논문은 충분히 보존된 항원 및 기능적 특성을 가진 비교적 많은 양의 텔로세포를 포함하는 매우 생존 가능한 단일 세포 현탁액을 일관되게 생성하는 수정된 프로토콜을 제시합니다. 이러한 텔로세포는 성장 인자 보충 없이 성장을 지원하기 위해 마우스 또는 인간 유래 오가노이드와의 공동 배양을 포함한 여러 응용 분야에 사용할 수 있습니다. 이것은 차례로 원래 조직의 상황을 더 잘 반영합니다.
우리는 FOXL1-Cre:Rosa-mTmG 마우스 모델8을 사용했는데, 여기서 텔로사이트는 녹색의 녹색 형광 단백질(GFP)의 막 결합 버전으로 표지되어 연구자가 텔로세포 전체를 추적할 수 있습니다. 다른 모든 중간엽 세포는 빨간색으로 막 결합된 tdTomato로 표시됩니다. 현재의 프로토콜은 텔로세포 수율 및 생존력을 향상시키기 위해 장 중간엽12 를 분리하는 프로토콜로부터 수정되었다.
프로토콜
아래에 설명된 모든 절차는 예루살렘 히브리 대학교의 기관 동물 관리 및 사용 위원회(IACUC)의 승인을 받았습니다.
1. 시약 및 완충액의 제조
- 수조를 37°C로 예열합니다.
- 표 1의 모든 용액을 준비하십시오.
2. 장 중간엽 분리
- 마우스를CO2 흡입으로 안락사시키고, 즉시 자궁경부 탈구를 한다.
- 마우스를 앙와위 자세로 놓고 복부에 70% EtOH를 뿌립니다. 복부 피부를 들어 올리고 정중선을 따라 세로로 절단하여 복강을 노출시킵니다( 그림 1 I, II 참조).
- 위를 찾아 식도에서 잘라내어 장을 복강에서 천천히 빼냅니다. 집게를 사용하여 과도한 지방과 결합 조직을 청소하십시오. 십이지장에서 맹장에서 약 0.5cm까지 소장을 절제합니다(그림 1 III,IV).
- 차가운 멸균 PBS가 들어있는 페트리 접시에서 장을 씻으십시오. 볼 팁 가위를 사용하여 장 튜브를 세로로 열고 대변을 씻어냅니다 (그림 1 V). 장을 신선하고 차가운 PBS가 들어있는 새 접시에 옮기고 다시 씻으십시오.
- 소장을 1cm 길이의 세그먼트로 자르고 8mL의 PBS로 채워진 15mL 원추형 튜브로 옮깁니다. 1분 동안 1회 또는 2회 cycle/s로 튜브를 수동으로 흔듭니다.
- 집게를 사용하여 세그먼트를 새로 만든 용액 A 20mL로 채워진 50mL 원뿔형 튜브에 옮깁니다( 표 1 참조). 튜브를 37°C의 오비탈 셰이커 인큐베이터에 20분 동안 놓습니다. 배양 후 1분 동안 4-5 cycles/s에서 손으로 튜브를 세게 흔들어 상피를 분리합니다.
- 2.6단계를 한 번 반복합니다.
- 세그먼트를 10mL의 멸균 PBS로 채워진 새 50mL 튜브로 옮기고 1분 동안 1회 또는 2주기/초로 튜브를 뒤집습니다.
- 세그먼트를 10mL의 멸균 PBS로 채워진 새 15mL 튜브로 옮기고 2분 동안 1회 또는 2주기/초로 부드럽게 위아래로 기울입니다.
- 생물 안전 캐비닛 아래에서 집게를 사용하여 세그먼트를 멸균 실험실 물티슈에 올려 건조시킵니다. 건조되면 세그먼트를 0.5cm 조각으로 더 자릅니다.
- 집게를 사용하여 작은 세그먼트를 웰당 4mL의 예열 소화 용액으로 채워진 6웰 플레이트로 옮깁니다. 37°C에서 50분 동안 배양합니다. 20분마다 손으로 접시를 부드럽게 흔듭니다.
- 파스퇴르 피펫을 사용하여 세그먼트를 4mL의 DMEM으로 채워진 15mL 원뿔형 튜브에 옮깁니다. 튜브를 4 또는 5 cycles/s에서 1분 동안 수동으로 흔들어 단일 세포 현탁액을 얻습니다.
- 100μm 스트레이너를 통해 50mL 원뿔형 튜브에 현탁액을 여과합니다. 여과액을 700 × g 에서 4°C에서 5분 동안 원심분리한다.
- 흡인에 의해 상층액을 버리고 세포 펠릿을 2% FBS/PBS 5mL에 재현탁합니다. 현탁액을 700 × g 에서 4°C에서 5분 동안 원심분리한다.
- 흡인에 의해 상청액을 버리고, 세포 펠릿을 12mL의 배양 배지로 재현탁하고, 웰당 1mL를 2개의 6웰 플레이트에 시딩합니다. 다음날, 죽어가는 세포를 세척하고 흡인하고 사용한 배지를 새 배지로 교체하십시오.
참고: 배양의 최적 유지를 위해 2일마다 배지를 교체하는 것이 좋습니다. 마우스 균주, 유전적 배경 및 연령에 따라 중간엽이 공동 배양 실험을 준비하는 데 4일에서 2주가 필요합니다. 추가 공동 배양 실험을 위해 중간엽은 그림 2와 같이 평평하고 완전히 늘어난 세포 형태를 나타내어 합류점에 도달해야 합니다. 일반적으로 둥근 형태를 가진 세포는 생존 가능하거나 기능적이지 않습니다.
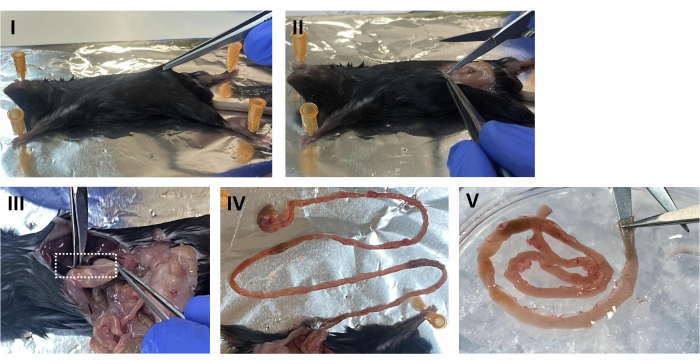
그림 1: 마우스 해부 . (I) 마우스를 앙와위 자세로 놓고 복부에 70% EtOH를 뿌립니다. 복부 피부를 들어 올리십시오. (II) 정중선을 따라 세로로 복강을 엽니다. (III) 위를 부드럽게 당기면서 식도를 절단합니다. (IV) 위를 꼬집고 천천히 장을 빼냅니다. (V) 볼팁 가위의 끝을 루멘에 삽입하고 장 튜브를 세로로 엽니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 계대 배양 또는 공동 배양을 위한 중간엽 재현탁
- 6웰 플레이트에 0.25% 트립신-0.5mM EDTA/웰 2mL로 중간엽을 재현탁합니다. 37°C에서 5분 동안 배양합니다. 배양 후 여러 세포가 아직 접시에서 분리되기 시작하지 않은 경우 추가로 2분 동안 배양합니다.
- 셀 스크레이퍼를 사용하여 우물 표면을 부드럽게 긁어냅니다. 세포 현탁액을 15mL 원뿔형 튜브로 옮깁니다. 2mL의 DMEM-F12/웰을 넣고 현탁액을 위아래로 부드럽게 피펫팅합니다.
알림: 튜브 부피의 50% 이상을 튜브에 넘치게 채우지 않는 것이 중요합니다. 따라서 2개의 웰마다 8mL의 현탁액으로 채워진 15mL 원추형 튜브를 사용하는 것이 좋습니다. - 세포를 세십시오.
참고: 완전히 합류하는 웰은 2 ×10 6 셀과 2.5 × 106 셀 사이를 생성합니다. - 세포 현탁액을 희석하여 3-5 × 105 cells/mL의 파종 밀도를 달성합니다. 4°C에서 500 × g 에서 5분 동안 원심분리하고 조심스럽게 흡인하여 상층액을 버린다.
알림: 가능한 한 많은 액체를 제거하는 것이 중요합니다. - 세포 펠릿을 예열된 배양 배지와 플레이트에 재현탁합니다.
4. 텔로세포 정제를 위한 유세포 분석
- 중간엽 세포 펠릿을 얻는다(단계 2.14). 세포 펠릿을 1mL의 FACS 완충액에 재현탁하고 40μm 스트레이너를 통해 여과합니다.
- 알로피코시아닌(APC) 접합 CD326(1:100), CD45(1:400) 및 CD31(1:250) 항체와 함께 세포 현탁액을 실온에서 15분 동안 400μL의 FACS 완충액에 배양하여 상피, 면역 및 내피 세포를 각각 분류에서 제외합니다.
- 1 mL의 FACS 완충액을 첨가하여 세포를 세척하고, 4°C에서 5분 동안 700 × g에서 스핀 다운시킨다. 400μL의 FACS 완충액에 재현탁하고 유세포 분석을 위해 4',6-디아미디노-2-페닐인돌(DAPI, 5mg/mL, 1:1,000)을 추가합니다. SSC-높이에 따라 SSC-area에 따라 단세포를 게이트합니다. 그림 3과 같이 DAPI-살아있는 세포를 게이트하고 CD45+/CD31+/CD326+를 게이트아웃하여 GFP+ 텔로세포를 분류합니다.
결과
상기 장 중간엽 분리 프로토콜은 Wu et al.12 및 Shoshkes-Carmel et al.8 둘 다에 기술된 프로토콜로부터 변형되었다. Wu et al.에 기술된 프로토콜은 결장에 대한 것이고 Shoshkes-Carmel et al.에 의한 프로토콜은 소장에 대한 것이므로 소화 조건은 이 두 프로토콜 사이의 효소 조합, 작업 농도 및 배양 시간이 다릅니다. 여기서, 기술된 프로토콜은 텔로세포를 포함한 장 중간엽 세포를 분리하고 배양하는 데 성공적으로 사용되었다. 간단히 말해서, 우리는 FOXL1-Cre: Rosa-mTmG 마우스 모델8을 사용하여 십이지장에서 회장까지 소장을 해부했으며, 여기서 텔로세포는 막-GFP(녹색)로 표지되었고 다른 중간엽 세포는 막-tdTomato(빨간색)로 표지되었습니다. 우리는 소화 효소를 사용하여 조직을 해리하고 6웰 플레이트에 중간엽을 뿌렸습니다. 해리 후, 텔로사이트는 세포 특성을 상실하여 둥근 세포 형태를 보여주며(그림 2A), 이는 다음 날과 비교하여 1일째에 GFP+ 세포의 정량화가 미흡한 결과를 나타냅니다(그림 2F). 며칠 후, 텔로사이트는 짧은 세포 과정과 함께 작은 스트레칭 세포 형태를 나타냅니다(그림 2B,C). 그러나 파종 후 7-10일이 지나면 텔로세포는 세포 특성을 회복하여 긴 세포질 과정(그림 2D, E)을 통해 크게 늘어난 세포 형태를 나타내며 오가노이드와의 공동 배양에 사용할 준비가 되어 성장을 지원합니다.
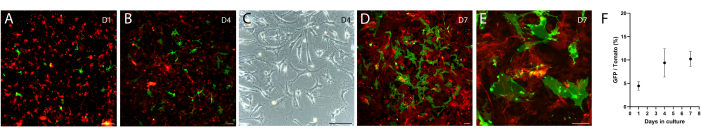
그림 2: FOXL1Cre: Rosa-mTmG 마우스 장에서 분리된 배양된 중간엽. FOXL1+ 텔로세포는 GFP로 표지되고 다른 중간엽 세포는 tdTomato+로 표지됩니다. (A-E) 현재 프로토콜을 사용하여 분리된 배양된 중간엽의 대표 이미지를 6웰 플레이트에 도말하고 배양 1일(A), 4일(B,C) 및 7일(D,E)일 후에 이미지화했습니다. 스케일 바 = 100μm. (F) 배양 1일, 4일 및 7일에 시야당 GFP/tdTomato 세포 비율(백분율)의 정량화. 약어: FOXL1 = 포크헤드 박스 L1 단백질; GFP = 녹색 형광 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이 분리 프로토콜을 평가하고 세포 조성을 밝히기 위해 유세포 분석법으로 얻은 세포 현탁액을 분석했습니다(그림 3). 전체적으로, 분리된 세포의 69%는 DAPI 염색에 기초하여 생존 가능하였다(도 3 III); 살아있는 세포 중 60.9%는 상피 오염과 면역 및 내피 세포(CD326+, CD45+ 및 CD31+; 그림 3 IV). 텔로세포 분획(GFP+)은 각각 100k 및 70k FSC 및 SSC 위에 산재되어 있으며(그림 3 VI), 개폐 중간엽(살아있는 CD45-, CD326-, CD31-)에서 거의 10%를 나타냈습니다(그림 3 V).
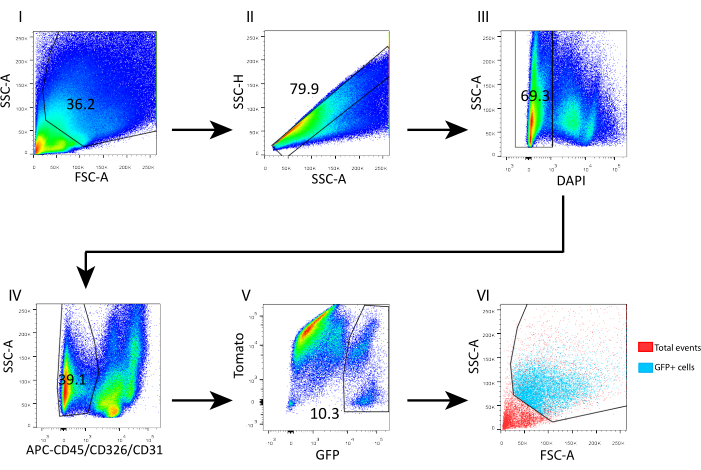
그림 3: 분리된 성인 마우스 장 중간엽에서 텔로세포를 분류하기 위한 유세포 분석 게이팅 전략. (I) 낮은 수준의 측면 산란 이벤트는 제외되었습니다. (II) 단세포를 SSC-높이에 따라 SSC-면적에 따라 게이팅하였다. (III) DAPI+ 이벤트는 죽은 세포를 분류에서 제외하기 위해 게이트아웃되었습니다. (IV) DAPI-CD45+/CD326+/CD31+ 사건은 각각 면역, 상피 및 내피 세포를 배제하기 위해 게이팅되었습니다. (V) GFP+ 텔로세포는 DAPI-CD45-/CD326-/CD31- 세포의 10.3%를 차지했습니다. (VI) 역게이팅 분석은 FSC-A/SSC-A 플롯에서 GFP+ 텔로세포의 좌표를 밝혀냈습니다. 약어: SSC-A = 측면 산란-피크 면적; FSC-A = 전방 산란-피크 면적; SSC-H = 측면 산란-피크 높이; DAPI = 4',6-디아미디노-2-페닐인돌; GFP = 녹색 형광 단백질; APC = 알로피코시아닌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
병행하여, 우리는 또한 야생형(WT) C57Bl6 마우스 장에서 중간엽을 분리했으며, 여기서 텔로세포 분획은 FOXL1Cre: Rosa-mTmG 마우스 모델에서 분리된 중간엽에서 이전에 분석된 표면 마커의 조합을 사용하여 평가되었으며, 여기서 텔로세포 분획은 GFP 표지되었습니다. 우리는 텔로세포의 하위 집합이 CD201 및 포도플라닌(GP38)에 대한 양성 염색으로 정의될 수 있음을 발견했습니다(그림 4). 또한, 분리 및 배양 1일 후 면역염색에서 이러한 마커를 사용하여 세포가 아직 세포 특성을 나타내지 않았지만 GFP+ 텔로사이트의 70%-80%에서 염색을 나타내는 이러한 분자 마커의 발현을 얻었음을 확인했습니다(그림 5).
표면 마커에 의해 정의된 텔로세포 분획은 FOXL1 구동 리포터 마우스를 사용하여 얻은 것과 동일하지 않습니다. Telocyte는 매우 이질적이며 여러 하위 집합을 포함합니다. 텔로사이트 정의를 위해 표면 마커를 FOXL1 라벨링과 결합할 필요가 있습니다. FOXL1Cre: Rosa-mTmG 마우스의 소장에서 GFP+ 세포의 60%-70%는 CD201 양성이고 65%-80%는 GP38에 대해 양성입니다. 표면 마커를 사용할 때 항체의 부적절한 보관 및 반복적인 동결-해동 주기가 결합 효율을 감소시킨다는 점에 유의하는 것이 중요합니다. 또한, 효소 소화는 표면 마커 발현을 방해할 수 있습니다. 우리는 중간엽 세포에서 발현되는 막횡단 프로테오글리칸인 CD138의 발현이 해리에 따라 중단되고 크게 감소하는 것을 관찰했습니다.
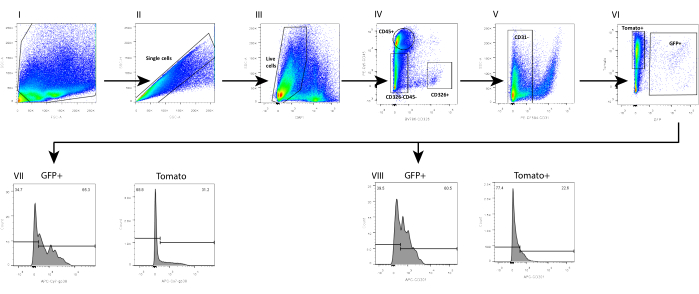
도 4: 현재 프로토콜을 사용하여 FOXL1Cre: Rosa-mTmG 마우스 소장으로부터 분리된 단세포 중간엽 현탁액의 FACS 분석. (I-II) 단일 세포, (III) DAPI-, (IV-VI) Lin-(CD45-, CD326-, CD31-) GFP+ 세포에 대한 FACS 분석에서 (VII) GFP+의 65.3%와 Tomato+의 31.2%가 GP38에 대해 양성인 반면, (VIII) GFP+의 60.5% 및 Tomato+의 22.6%가 CD201에 대해 양성임을 보여줍니다. 약어: SSC-A = 측면 산란-피크 면적; FSC-A = 전방 산란-피크 면적; SSC-H = 측면 산란-피크 높이; DAPI = 4',6-디아미디노-2-페닐인돌; GFP = 녹색 형광 단백질; APC = 알로피코시아닌; PE = 피코에리트린. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 1일째 배양된 중간엽, 중간엽 마커에 대해 고정 및 염색됨. (A-D) GP38에 대해 염색된 배양된 중간엽의 대표적인 이미지. (에프아이) CD201에 대해 염색된 배양된 중간엽의 대표적인 이미지. 스케일 바 = 100μm. (E) 총 토마토+에서 토마토+ GP38+ 및 토마토+ CD201+ 이중 양성의 정량화. (J) 총 GFP+에서 GFP+ GP38+ 및 GFP+ CD201+ 이중 양성의 정량화. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 해결 방법 A: | HBSS는 2% FBS, 1mM DL-디티오트레이톨(DTT), 2mM EDTA(pH 8.0)로 보충되었습니다. | |||
| 보완 매체 1640 (CM1640) : | RPMI 1640 배지는 10% FBS, Pen/Strep(100단위 페니실린/mL, 100μg 스트렙토마이신/mL)으로 보충되었습니다. | |||
| 소화 용액 : | 100U/mL 콜라게나제 유형 VIII, 75mg/mL DNase I 4mL의 예열 CM1640. 참고: 분해 절차가 시작되기 직전에 콜라게나제와 DNase I을 추가합니다. | |||
| 문화 매체: | 10μg/mL 겐타마이신, 10mM HEPES, 글루타민, Pen/Strep(페니실린 100단위/mL, 스트렙토마이신 100μg)이 보충된 DMEM-F12 배지. | |||
| FACS 버퍼: | PBS는 5% FBS 및 1 mM EDTA로 보충되었다. | |||
표 1: 프로토콜에 사용된 모든 솔루션의 구성.
보충 표 S1: 현재 프로토콜과 두 참조 프로토콜 간의 주요 차이점이 여기에 나열되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
여기에서 우리는 연구자들이 텔로세포를 다른 중간엽 세포와 구별할 수 있도록 하는 FOXL1-Cre: Rosa26-mTmG 마우스 모델을 사용하여 마우스 소장에서 중간엽을 분리하는 프로토콜을 개발했습니다. 이 프로토콜에서 따라야 할 몇 가지 중요한 단계가 있습니다. 첫째, 중간엽 분리 중에 대부분의 상피 세포를 버리기 위해 4 또는 5 cycle/s에서 튜브를 세게 흔드는 것이 중요합니다. 효소 소화를 위한 배양 시간은 소화 효율에 따라 최적화되어야 합니다. 배양 동안, 플레이트는 매 20분마다 몇 초 동안 수평으로 부드럽게 흔들어져야 한다. 조직이 필라멘트와 같아지면 프로토콜 단계 2.12로 진행하여 배양을 중단해야 합니다. 긴 소화 시간 동안 조직을 노출시키면 세포 생존율과 수율이 낮아질 수 있습니다. 효소 소화 후, 튜브는 더 많은 단일 세포를 현탁액으로 방출하기 위해 기계적으로 흔들려야 합니다. 이상적으로는 용액이 흐리게 보이고 조직 조각이 보이지 않아야합니다. 그렇지 않은 경우 효소 소화를 60 분으로 연장하십시오.
멸균 상태를 유지하고 잠재적인 박테리아 오염을 피하는 것은 1차 조직 배양 작업을 할 때 중요한 단계 중 하나입니다. 멸균 해부 도구, 시약 및 완충액을 사용해야 합니다. 장갑을 교체해야하며 동물 작업을 할 때는 작업 영역을 청소해야합니다. 세포 현탁액이 얻어지면 층류 생물학적 후드 아래에서 작업을 수행해야합니다. 도금 후, 세포는 부착에 영향을 줄 수 있으므로 방해 없이 밤새 배양해야 합니다. 또한, 파종 후 하루 만에 배양액을 교체하는 것이 중요한데, 이는 비부착성 세포가 배양 생존율에 영향을 미칠 수 있기 때문이다.
이 프로토콜에 사용된 표면 마커는 에피토프와 강하게 반응했습니다. 그러나, 효소 분해가 결합 반응성에 영향을 미칠 수 있고, 따라서 FACS 분석 결과에 영향을 미칠 수 있다. 이 프로토콜의 또 다른 한계는 근섬유층의 과소 표현입니다. 근육층 세포 분리의 효율성을 높이려면 점막층에서 근육을 기계적으로 분리하고 각 층에 대해 효소 분해를 분리하는 것이 좋습니다. 간질로부터 상피를 해리시키기 위해, 기계적 분리 또는 킬레이트 제 (EDTA 또는 DTT)가 사용될 수있다; 그러나, 단일 세포를 얻기 위한 효소 소화는 이 프로토콜에서 최적화되었다.
장 중간엽의 분리는 이전에 기술되었다8; 커버슬립으로 융모를 긁어내면 융모와 함께 일부 중간엽, 특히 Lgr5+ 융모 팁 텔로사이트(villus tip telocytes)와 같은 융모 팁 중간엽 세포가 손실될 수 있다13. 이 프로토콜에서는 콜라게나제가 매트릭스에서 중간엽 세포를 보다 효율적으로 방출하기 때문에 디스파제 II 대신 콜라게나제 유형 VIII와 트립신을 DNase I과 함께 사용합니다. 처리 시간(>90분 대 35분)이 길어지지만 두 프로토콜은 유사한 세포 생존율을 산출했습니다. 현재의 프로토콜은 일반적으로 중간엽 세포, 특히 텔로세포 분획의 수율을 향상시켰다. 현재 프로토콜은 약 10%의 GFP+ 텔로게이트를 생성했으며, 이는 시각화 및 FACS 분석에 의해 확인된 반면, 이전 프로토콜은 2% GFP+ 텔로게이트를 생성했습니다. 현재 프로토콜과 두 참조 프로토콜 간의 주요 차이점은 보충 표 S1에 나열되어 있습니다.
FOXL1+GFP+ 세포를 상피하 텔로세포로 식별하는 것은 생체 내 연구를 기반으로 합니다. 텔로세포의 더 높은 수율을 생산하기 위해 사용 가능한 중간엽 분리 프로토콜을 개발하고 수정해야 할 필요성과 이를 달성하는 방법에 대한 지식은 상피 세포에 밀접하게 부착된 긴 세포 돌기를 가진 큰 세포인 생체 내에서 FOXL1+ 텔로세포의 구조와 기능에 대한 이해를 기반으로 했습니다.
흥미롭게도, 생체 외 GFP+ 텔로세포는 장에서 생체 내 특징과 유사한 세포 특성을 나타내므로 오가노이드 성장에 대한 이상적인 지원 역할을 하는 것으로 제안됩니다. 이 프로토콜은 주로 소장에서 텔로세포 분리에 대해 논의하지만, 최근에 기술된 MAP3K2 조절 장 기질 세포(MRISC)12와 같이 약간의 변형이 있는 유사한 프로토콜을 사용할 수 있고 결장 중간엽 세포에 쉽게 적용할 수 있습니다.
중간엽 세포가 늘어나고 융합도에 도달하면 성장 인자 무함유 Matrigel을 사용하여 마우스 또는 인간 유래 오가노이드를 사용한 3D 공동 배양과 같은 몇 가지 추가 응용 분야에 사용할 수 있습니다. 중간엽은 일반적으로 외인성 성장 인자 보충 없이 오가노이드 형성 및 성장을 완전히 지원하는 네트워크를 형성합니다. 장 기질은 상피에 기계적 지지를 제공할 수 있는 내재적 3D 특징을 가지고 있다(14). 따라서 이 프로토콜은 중간엽을 분리하여 3D 바이오 프린팅 스캐폴드에 통합하고 추가 이종이식 실험에 활용하는 데에도 사용할 수 있습니다.
공개
저자는 선언 할 이해 상충이 없습니다.
감사의 말
이 연구는 이스라엘 과학 재단 (MSC 개인 보조금)의 보조금과 이스라엘 과학 재단과 중국 국립 자연 과학 재단 간의 공동 프로그램으로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Corning | 430052 | |
| 50 mL Centrifuge Tubes | Corning | 430828 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell-strainer cap | Corning | 352235 | |
| 6 Well Cell Culture Plate | Costar | 3516 | |
| APC Anti-Mouse CD31 | Biolegend | 102509 | |
| APC Anti-Mouse CD326 | Biolegend | 118213 | |
| APC Anti-Mouse CD45 | Biolegend | 103111 | |
| Cell Lifter | Corning | 3008 | |
| Cell Strainer 100μm Nylon Yellow | Corning | CLS431752 | |
| Collagenase type VIII | Sigma | C2139-500MG | |
| DL-Dithiothreitol (DTT) | Sigma | 43815-1G | |
| DMEM/F-12 (HAM) 1:1 | Biological Industries | 01-170-1A | |
| DNase I | Sigma | DN25-1G | |
| Dulbecco's Modified Eagle Medium (DMEM) | Biological Industries | 01-055-1A | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D1283-500ML | 10x |
| EDTA 0.5 M, pH 8.0 | Biological Industries | 01-862-1B | |
| FBS | Biological Industries | 04-007-1A | |
| Gentamicin | Sigma | G1914-250MG | 100x |
| Gluta Max-I | Gibco | 35050-038 | 100x |
| Hank’s Balanced Salt Solution (HBSS) | Biological Industries | 02-017-5A | 10x |
| HEPES | Gibco | 15630-080 | 100x |
| Penicillin-Streptomycin (Pen/Strep) | Biological Industries | 03-033-1B | 100x |
| RPMI 1640 medium | Gibco | 21875-034 | |
| Trypsin EDTA Solution B | Sartorius | 03-052-1A |
참고문헌
- Carroll, T. D., Newton, I. P., Chen, Y., Blow, J. J., Näthke, I. Lgr5+ intestinal stem cells reside in an unlicensed G1 phase. The Journal of Cell Biology. 217 (5), 1667-1685 (2018).
- Kinchen, J., et al. Structural remodeling of the human colonic mesenchyme in inflammatory bowel disease. Cell. 175 (2), 372-386 (2018).
- Popescu, L. M., Faussone-Pellegrini, M. -. S. TELOCYTES - a case of serendipity: The winding way from Interstitial Cells of Cajal (ICC), via Interstitial Cajal-Like Cells (ICLC) to TELOCYTES. Journal of Cellular and Molecular Medicine. 14 (4), 729-740 (2010).
- Gherghiceanu, M., Manole, C. G., Popescu, L. M. Telocytes in endocardium: electron microscope evidence. Journal of Cellular and Molecular Medicine. 14 (9), 2330-2334 (2010).
- Ceafalan, L., Gherghiceanu, M., Popescu, L. M., Simionescu, O. Telocytes in human skin—are they involved in skin regeneration. Journal of Cellular and Molecular Medicine. 16 (7), 1405-1420 (2012).
- Hinescu, M. E., Gherghiceanu, M., Suciu, L., Popescu, L. M. Telocytes in pleura: two- and three-dimensional imaging by transmission electron microscopy. Cell and Tissue Research. 343 (2), 389-397 (2011).
- Popescu, L. M., et al. Telocytes in human epicardium. Journal of Cellular and Molecular Medicine. 14 (8), 2085-2093 (2010).
- Shoshkes-Carmel, M., et al. Subepithelial telocytes are an important source of Wnts that supports intestinal crypts. Nature. 557 (7704), 242-246 (2018).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Bahar Halpern, K., et al. Lgr5+ are a signaling source at the intestinal villus tip. Nature Communication. 11 (1), 1936 (2020).
- Koliaraki, V., Pallangyo, C. K., Greten, F. R., Kollias, G. Mesenchymal cells in colon cancer. Gastroenterology. 152 (5), 964-979 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유