Method Article
Aislamiento del mesénquima intestinal murino que resulta en un alto rendimiento de telocitos
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para aislar el mesénquima intestinal murino, incluidos los telocitos. Estos se pueden utilizar para varias aplicaciones, como el cocultivo con ratones u organoides derivados de humanos, para apoyar el crecimiento y reflejar mejor la situación en el tejido original.
Resumen
El intestino delgado murino, o mesénquima de colon, es altamente heterogéneo, y contiene distintos tipos de células, incluyendo sangre y endotelio linfático, nervios, fibroblastos, miofibroblastos, células musculares lisas, células inmunes y el tipo de célula recientemente identificado, telocitos. Los telocitos son células mesenquimales únicas con largos procesos citoplasmáticos, que alcanzan una distancia de decenas a cientos de micras del cuerpo celular. Los telocitos han surgido recientemente como un importante componente de nicho de células madre intestinales, proporcionando proteínas Wnt que son esenciales para la proliferación de células madre y progenitoras.
Aunque los protocolos sobre cómo aislar el mesénquima del intestino del ratón están disponibles, no está claro si estos procedimientos permiten el aislamiento eficiente de los telocitos. Aislar los telocitos de manera eficiente requiere ajustes especiales de protocolo que permitan la disociación del fuerte contacto célula-célula entre los telocitos y las células vecinas sin afectar su viabilidad. Aquí, los protocolos de aislamiento de mesénquimas intestinales disponibles se ajustaron para apoyar el aislamiento y cultivo exitosos de mesénquimas que contienen un rendimiento relativamente alto de telocitos unicelulares viables.
La suspensión unicelular obtenida se puede analizar mediante varias técnicas, como inmunotinción, clasificación celular, imágenes y experimentos de ARNm. Este protocolo produce mesénquima con propiedades antigénicas y funcionales suficientemente conservadas de los telocitos, y puede ser utilizado para varias aplicaciones. Por ejemplo, se pueden usar para el cocultivo con organoides derivados de ratones o humanos para apoyar el crecimiento de organoides sin suplementos de factor de crecimiento, para reflejar mejor la situación en el tejido original.
Introducción
Tanto el intestino delgado como el colon son tejidos altamente regenerativos debido a la presencia de células madre, que proliferan y alimentan la regeneración1. El mesénquima que rodea el epitelio proporciona soporte estructural y funcional mediante la secreción de proteínas de la matriz extracelular y moléculas de señalización2, que modulan la respuesta de las células epiteliales. Los telocitos son células mesenquimales grandes, descritas principalmente hasta ahora por microscopía electrónica como células con largos procesos citoplasmáticos llamados telópodos, que se superponen para crear una red laberíntica 3,4,5,6,7. Recientemente, los telocitos intestinales que expresan el factor de transcripción FOXL1 se han convertido en un importante componente de nicho de células madre que proporciona proteínas Wnt, que son cruciales para la función de las células madre y progenitoras. Los telocitos intestinales expresan altos niveles de proteínas clave de la vía de señalización como Wnt, Bmp, Tgfb y Shh, así como muchos factores de crecimiento8.
Dado que los telocitos son un componente crítico del nicho de células madre in vivo, el desarrollo de protocolos para aislarlos y cultivarlos ex vivo permitirá su uso como fuente de moléculas de señalización y factores de crecimiento, para apoyar el crecimiento y la diferenciación ex vivo. Utilizando protocolos bien establecidos, las criptas epiteliales de colon o intestino pueden aislarse y formar estructuras 3D conocidas como organoides 9,10,11. Los organoides tridimensionales representan una poderosa herramienta para investigar tanto la fisiología como la patología del epitelio intestinal ex vivo. En un sistema ex vivo, los organoides se basan en la suplementación exógena de factores para la supervivencia y el crecimiento10. El mesénquima aislado puede cultivarse con organoides derivados de ratones y humanos y usarse como fuente de factores de crecimiento, en lugar de suplementos exógenos, para reflejar mejor la situación en el tejido original. El estudio de los telocitos ex vivo tiene numerosos beneficios en la investigación de comportamientos celulares normales o patológicos, mecanismos de homeostasis tisular e interacciones célula-célula con mayor detalle.
Aunque los protocolos que describen cómo aislar el mesénquima del intestino del ratón están disponibles, no está claro si estos procedimientos resultan en el aislamiento eficiente de los telocitos. El aislamiento exitoso de los telocitos requiere ajustes especiales del protocolo que permitirían la disociación del fuerte contacto célula-célula entre los telocitos y las células vecinas, sin afectar su viabilidad. Para superar estas limitaciones, este documento presenta un protocolo modificado que produce consistentemente una suspensión unicelular altamente viable que contiene una cantidad relativamente alta de telocitos con propiedades antigénicas y funcionales suficientemente conservadas. Estos telocitos se pueden usar para varias aplicaciones, incluido el cocultivo con organoides derivados de ratones o humanos, para apoyar el crecimiento sin suplementos de factor de crecimiento. Esto a su vez refleja mejor la situación en el tejido original.
Utilizamos el modelo8 de ratón FOXL1-Cre: Rosa-mTmG, en el que los telocitos se marcan con una versión unida a la membrana de la proteína fluorescente verde (GFP) en verde, lo que permite al investigador seguir los telocitos en su totalidad; todas las demás células mesenquimales están marcadas con un tdTomato unido a la membrana en rojo. El protocolo actual se modificó a partir de un protocolo de aislamiento del mesénquima intestinal12 para mejorar el rendimiento y la viabilidad de los telocitos.
Protocolo
Todos los procedimientos descritos a continuación fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad Hebrea de Jerusalén.
1. Preparación de reactivos y tampones
- Precalentar un baño maría a 37 °C.
- Prepare todas las soluciones de la Tabla 1.
2. Aislamiento del mesénquima intestinal
- Eutanasia del ratón por inhalación deCO2 , seguida inmediatamente de luxación cervical.
- Coloque el ratón en posición supina y rocíe el abdomen con 70% de EtOH. Levante la piel abdominal y corte longitudinalmente a lo largo de la línea media para exponer la cavidad peritoneal (ver Figura 1 I, II).
- Localice el estómago, corte desde el esófago y retire lentamente el intestino de la cavidad peritoneal. Limpie el exceso de grasa y tejido conectivo con fórceps. Extirpar el intestino delgado del duodeno a aproximadamente 0,5 cm del ciego (Figura 1 III, IV).
- Lave el intestino en una placa de Petri que contenga PBS estéril en frío. Con tijeras de punta de bola, abra el tubo intestinal longitudinalmente y lave las heces (Figura 1 V). Transfiera el intestino a un nuevo plato que contenga PBS fresco y frío y lávelo nuevamente.
- Corte el intestino delgado en segmentos de 1 cm de largo y transfiéralo a un tubo cónico de 15 ml lleno de 8 ml de PBS. Agite el tubo manualmente a uno o dos ciclos/s durante 1 min.
- Transfiera los segmentos usando fórceps a un tubo cónico de 50 ml lleno con 20 ml de solución A recién hecha (ver Tabla 1). Colocar los tubos en una incubadora agitadora orbital a 37 °C durante 20 min. Después de la incubación, agitar el tubo vigorosamente a mano a cuatro o cinco ciclos/s durante 1 minuto para disociar el epitelio.
- Repita el paso 2.6 una vez.
- Transfiera los segmentos a un nuevo tubo de 50 ml lleno de 10 ml de PBS estéril e invierta el tubo a uno o dos ciclos/s durante 1 min.
- Transfiera los segmentos a un nuevo tubo de 15 ml lleno de 10 ml de PBS estéril e inclínelos suavemente hacia arriba y hacia abajo a uno o dos ciclos/s durante 2 min.
- Debajo de un gabinete de bioseguridad, use fórceps para colocar los segmentos en una toallita de laboratorio estéril para secarlos. Una vez secos, cortar los gajos en trozos de 0,5 cm.
- Transfiera los segmentos pequeños usando fórceps a una placa de 6 pocillos llena con 4 ml de solución de digestión precalentada por pocillo. Incubar a 37 °C durante 50 min. Agite suavemente el plato con la mano cada 20 minutos.
- Transfiera los segmentos con una pipeta Pasteur a un tubo cónico de 15 ml lleno de 4 ml de DMEM. Agite el tubo manualmente a cuatro o cinco ciclos/s durante 1 minuto para obtener una suspensión de una sola celda.
- Filtrar la suspensión a través de un filtro de 100 μm en un tubo cónico de 50 ml. Centrifugar el filtrado a 700 × g durante 5 min a 4 °C.
- Desechar el sobrenadante por aspiración y resuspender el pellet celular en 5 mL de FBS/PBS al 2%. Centrifugar la suspensión a 700 × g durante 5 min a 4 °C.
- Deseche el sobrenadante por aspiración, resuspenda el pellet celular con 12 ml de medio de cultivo y siembre 1 ml por pocillo en dos placas de 6 pocillos. Al día siguiente, lave y aspire cualquier célula moribunda y reemplace el medio gastado con un medio fresco.
NOTA: Para un mantenimiento óptimo del cultivo, se recomienda cambiar el medio cada 2 días. Dependiendo de la cepa de ratón, los antecedentes genéticos y la edad, se necesitan de 4 días a 2 semanas para que el mesénquima esté listo para los experimentos de cocultivo. Para experimentos adicionales de cocultivo, el mesénquima debe alcanzar la confluencia, mostrando una morfología celular plana y completamente estirada como se muestra en la Figura 2. En general, las células con morfología redonda no son viables ni funcionales.
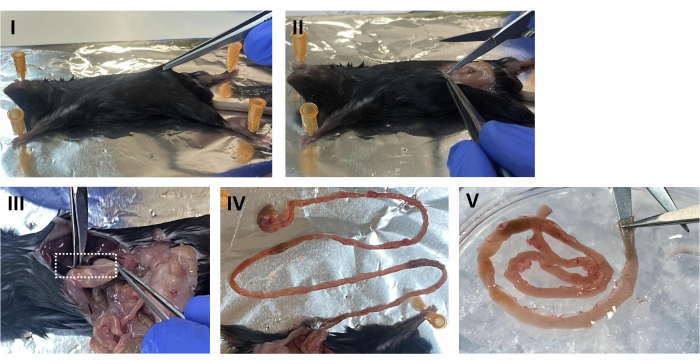
Figura 1: Disección del ratón. (I) Coloque el ratón en posición supina y rocíe el abdomen con EtOH al 70%. Levante la piel abdominal. (II) Abrir la cavidad peritoneal longitudinalmente a lo largo de la línea media. (III) Mientras tira suavemente del estómago, corte el esófago. (IV) Pellizque el estómago y saque lentamente el intestino. (V) Inserte la punta de las tijeras de punta de bola en el lumen y abra el tubo intestinal longitudinalmente. Haga clic aquí para ver una versión más grande de esta figura.
3. Resuspensión del mesénquima para pasaging o co-cultura
- Resuspender el mesénquima con 2 mL de tripsina-0,5 mM EDTA/pocillo al 0,25% en una placa de 6 pocillos. Incubar durante 5 min a 37 °C. Después de la incubación, si varias células aún no han comenzado a desprenderse del plato, incubar durante 2 minutos adicionales.
- Usando un raspador de celdas, raspe suavemente la superficie del pozo. Transfiera la suspensión celular a un tubo cónico de 15 ml. Añadir 2 ml de DMEM-F12/pocillo y pipetear suavemente la suspensión hacia arriba y hacia abajo.
NOTA: Es importante no sobrellenar el tubo con más del 50% del volumen del tubo. Por lo tanto, se recomienda utilizar un tubo cónico de 15 ml lleno de 8 ml de suspensión por cada dos pocillos. - Cuenta las celdas.
NOTA: Un pozo totalmente confluente produce entre 2 × 10 6 celdas y 2.5 × 106 células. - Diluir la suspensión celular para lograr una densidad de siembra de 3-5 × 105 células/ml. Centrifugar durante 5 min a 500 × g a 4 °C y desechar el sobrenadante mediante una aspiración cuidadosa.
NOTA: Es importante eliminar la mayor cantidad de líquido posible. - Resuspender el pellet celular en medio de cultivo precalentado y placa.
4. Análisis de citometría de flujo para la purificación de telocitos
- Obtener el pellet de células mesenquimales (paso 2.14). Resuspender el pellet celular en 1 ml de tampón FACS y filtrar a través de un filtro de 40 μm.
- Incubar la suspensión celular con anticuerpos CD326 (1:100), CD45 (1:400) y CD31 (1:250) conjugados con aloficocianina (APC) en 400 μL de tampón FACS durante 15 min a temperatura ambiente para excluir las células epiteliales, inmunes y endoteliales, respectivamente, de la clasificación.
- Lavar las células añadiendo 1 ml de tampón FACS y girar hacia abajo a 700 × g durante 5 min a 4 °C. Resuspender en 400 μL de tampón FACS y añadir 4',6-diamidino-2-fenilindol (DAPI, 5 mg/ml, 1:1.000) para análisis de citometría de flujo. Puerta de las celdas individuales de acuerdo con la altura de SSC por área de SSC. Bloquee las células vivas DAPI y elimine CD45+/CD31+/CD326+ para clasificar los telocitos GFP+, como se muestra en la Figura 3.
Resultados
El protocolo de aislamiento del mesénquima intestinal anterior fue modificado a partir de los protocolos descritos tanto en Wu et al.12 como en Shoshkes-Carmel et al.8. El protocolo descrito en Wu et al. es para el colon, y el de Shoshkes-Carmel et al. es para el intestino delgado, por lo que la condición de digestión es diferente en combinación de enzimas, concentración de trabajo y tiempo de incubación entre estos dos protocolos. Aquí, el protocolo descrito se ha utilizado con éxito para aislar y cultivar células mesenquimales intestinales, incluidos los telocitos. Brevemente, diseccionamos el intestino delgado desde el duodeno hasta el íleon usando un modelo8 de ratón FOXL1-Cre: Rosa-mTmG, en el que los telocitos se marcaron con GFP de membrana (verde), mientras que otras células mesenquimales se marcaron con membrana-tdTomato (rojo). Disociamos el tejido usando enzimas digestivas y sembramos el mesénquima en una placa de 6 pocillos. Después de la disociación, los telocitos pierden sus características celulares, mostrando una morfología celular redonda (Figura 2A) que se refleja en la subcuantificación de las células GFP+ en el día 1 en comparación con los días siguientes (Figura 2F). Después de unos días, los telocitos exhiben una pequeña morfología celular estirada con procesos celulares cortos (Figura 2B, C). Sin embargo, 7-10 días después de la siembra, los telocitos recuperan sus características celulares, mostrando una gran morfología celular estirada con largos procesos citoplasmáticos (Figura 2D, E), y están listos para ser utilizados en cocultivo con organoides y apoyar su crecimiento.
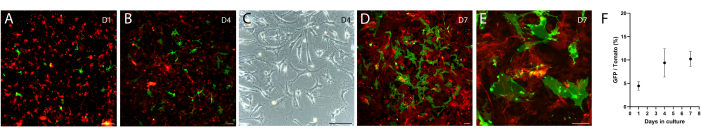
Figura 2: Mesénquima cultivado aislado de FOXL1Cre: Rosa-mTmG intestino de ratón. Los telocitos FOXL1+ están marcados con GFP, mientras que otras células mesenquimales son tdTomato+. (A-E) Imágenes representativas de mesénquimas cultivados aislados utilizando el protocolo actual, chapados en una placa de 6 pocillos y fotografiados después de 1 (A), 4 (B, C) y 7 (D, E) días de cultivo. Barras de escala = 100 μm. (F) Cuantificación de la relación de células GFP/tdTomato por campo de visión (porcentajes) en los días 1, 4 y 7 de cultivo. Abreviaturas: FOXL1 = proteína L1 de la caja de horquilla; GFP = proteína verde fluorescente. Haga clic aquí para ver una versión más grande de esta figura.
Para evaluar este protocolo de aislamiento y revelar la composición celular, analizamos la suspensión celular obtenida por citometría de flujo (Figura 3). En general, el 69% de las células aisladas fueron viables en base a la tinción DAPI (Figura 3 III); de las células vivas, 60,9% representaban contaminación epitelial y células inmunes y endoteliales (CD326+, CD45+ y CD31+; Figura 3 IV). La fracción de telocitos (GFP+) se dispersó por encima de 100k y 70k FSC y SSC, respectivamente (Figura 3 VI), y representó casi el 10% del mesénquima cerrado (CD45-, CD326-, CD31-) vivo (Figura 3 V).
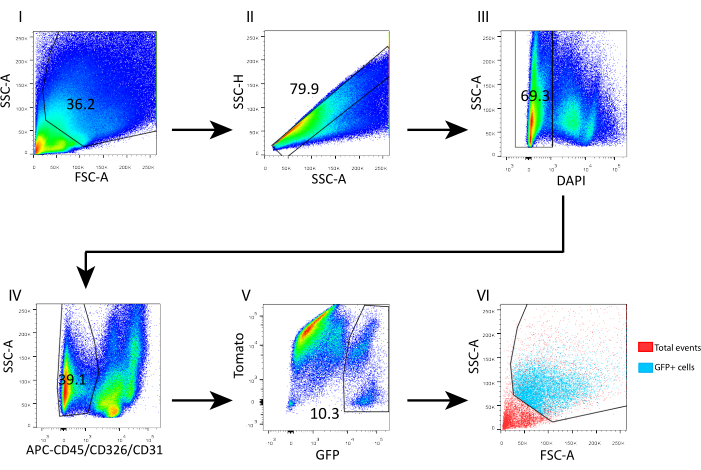
Figura 3: Estrategia de activación por citometría de flujo para clasificar telocitos de mesénquima intestinal de ratón adulto aislado. (I) Se excluyeron los eventos de dispersión lateral de bajo nivel. (II) Las celdas individuales fueron cerradas de acuerdo con la altura de SSC por el área de SSC. (III) Los eventos DAPI+ se eliminaron para excluir las células muertas de la clasificación. (IV) Los eventos DAPI- CD45+/CD326+/CD31+ fueron eliminados para excluir las células inmunes, epiteliales y endoteliales, respectivamente. (V) Los telocitos GFP+ representaron el 10,3% de las células DAPI-CD45-/CD326-/CD31-. (VI) El análisis de retroceso reveló las coordenadas de los telocitos GFP+ en una gráfica FSC-A/SSC-A. Abreviaturas: SSC-A = área de pico de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; SSC-H = altura del pico de dispersión lateral; DAPI = 4',6-diamidino-2-fenilindol; GFP = proteína verde fluorescente; APC = aloficocianina. Haga clic aquí para ver una versión más grande de esta figura.
Paralelamente, también aislamos mesénquimas de un intestino de ratón C57Bl6 de tipo salvaje (WT), en el que se evaluó la fracción de telocitos mediante el uso de una combinación de marcadores de superficie previamente analizados en mesénquima aislado de un modelo de ratón FOXL1Cre: Rosa-mTmG, en el que la fracción de telocitos estaba marcada con GFP. Encontramos que un subconjunto de los telocitos puede definirse por una tinción positiva a CD201 y podoplanina (GP38) (Figura 4). Además, el uso de estos marcadores en inmunotinción 1 día después del aislamiento y cultivo confirmó que, aunque las células aún no exhibían sus características celulares, obtuvieron la expresión de estos marcadores moleculares, mostrando tinción en el 70%-80% de los telocitos GFP+ (Figura 5).
La fracción de telocitos definida por los marcadores de superficie no es idéntica a la obtenida mediante el uso del ratón reportero impulsado por FOXL1; El telocito es altamente heterogéneo y contiene varios subconjuntos. Es necesario combinar el marcador de superficie con el etiquetado FOXL1 para la definición de telocitos. En el intestino delgado del ratón FOXL1Cre: Rosa-mTmG, el 60%-70% de las células GFP+ son CD201 positivas, y el 65%-80% son positivas para GP38. Cuando se utilizan marcadores de superficie, es importante tener en cuenta que el almacenamiento inadecuado y los ciclos repetitivos de congelación-descongelación de anticuerpos disminuyen la eficiencia de unión. Además, la digestión enzimática puede alterar la expresión del marcador de superficie. Observamos que la expresión de CD138, un proteoglicano transmembrana expresado en células mesenquimales, se interrumpió y disminuyó en gran medida con la disociación.
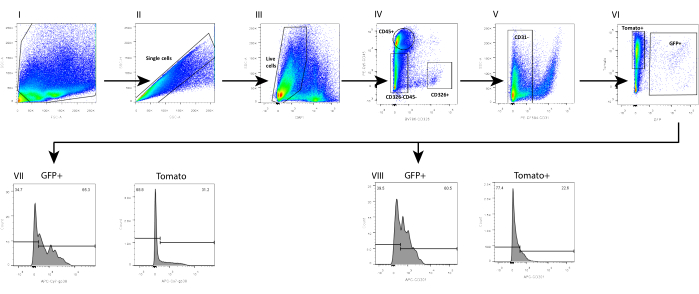
Figura 4: Análisis FACS de suspensión de mesénquima unicelular aislada de FOXL1Cre: intestino delgado de ratón Rosa-mTmG utilizando el protocolo actual. Análisis FACS en células individuales (I-II), (III) DAPI-, (IV-VI) LIN-(CD45-, CD326-, CD31-) células GFP+, que muestran que (VII) el 65,3% de la GFP+ y el 31,2% de la Tomato+ son positivas para GP38, mientras que (VIII) el 60,5% de la GFP+ y el 22,6% de la Tomato+ son positivas para CD201. Abreviaturas: SSC-A = área de pico de dispersión lateral; FSC-A = área de pico de dispersión hacia adelante; SSC-H = altura del pico de dispersión lateral; DAPI = 4',6-diamidino-2-fenilindol; GFP = proteína verde fluorescente; APC = aloficocianina; PE = ficoeritrina. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Mesénquima cultivado el primer día, fijado y teñido para marcadores mesenquimales. (A-D) Imágenes representativas de mesénquima cultivado teñido para GP38. (F-I) Imágenes representativas de mesénquima cultivado teñido para CD201. Barras de escala = 100 μm. (E) Cuantificación de Tomato+ GP38+ y Tomato+ CD201+ doble positivo a partir de Tomate+ total. (J) Cuantificación de GFP+ GP38+ y GFP+ CD201+ doblemente positivos a partir del total de GFP+. Haga clic aquí para ver una versión más grande de esta figura.
| Solución A: | HBSS suplementado con 2% FBS, 1 mM DL-ditiothreitol (DTT), 2 mM EDTA (pH 8.0). | |||
| Medio complementado 1640 (CM1640): | RPMI 1640 medio suplementado con 10% FBS, Pen/Strep (100 unidades de penicilina/mL, 100 μg de estreptomicina/mL). | |||
| Solución digestiva: | 100 U/mL colagenasa tipo VIII, 75 mg/mL DNasa I en 4 mL de CM1640 precalentada. Nota: Agregue colagenasa y DNasa I justo antes de que comience el procedimiento de digestión. | |||
| Medios de cultivo: | DMEM-F12 medio suplementado con 10 μg/mL de gentamicina, 10 mM de HEPES, glutamina, Pen/Strep (100 unidades de penicilina/mL, 100 μg de estreptomicina/mL). | |||
| Búfer FACS: | PBS suplementado con 5% FBS y 1 mM EDTA. | |||
Tabla 1: Composición de todas las soluciones utilizadas en el protocolo.
Tabla suplementaria S1: Las principales diferencias entre el protocolo actual y los dos protocolos de referencia se enumeran aquí. Haga clic aquí para descargar este archivo.
Discusión
Aquí, desarrollamos un protocolo para aislar el mesénquima del intestino delgado del ratón utilizando el modelo de ratón FOXL1-Cre: Rosa26-mTmG, que permite a los investigadores distinguir los telocitos de otras células mesenquimales. Hay algunos pasos críticos a seguir en este protocolo. En primer lugar, es importante agitar el tubo vigorosamente a cuatro o cinco ciclos/s, para descartar la mayoría de las células epiteliales durante el aislamiento del mesénquima. El tiempo de incubación para la digestión enzimática debe optimizarse en función de la eficiencia digestiva. Durante la incubación, las placas deben agitarse suavemente horizontalmente durante unos segundos cada 20 minutos. Una vez que el tejido se vuelve filamentoso, la incubación debe detenerse procediendo al paso del protocolo 2.12. Exponer el tejido durante largos tiempos de digestión puede resultar en una baja tasa de viabilidad celular y rendimiento. Después de la digestión enzimática, el tubo debe agitarse mecánicamente para liberar más células individuales en suspensión; Idealmente, la solución debe verse turbia y no deben ser visibles fragmentos de tejido. Si este no es el caso, prolongar la digestión enzimática a 60 min.
Mantener condiciones estériles y evitar la posible contaminación bacteriana es uno de los pasos críticos cuando se trabaja con cultivos de tejidos primarios. Se deben utilizar herramientas de disección, reactivos y tampones estériles; Los guantes deben cambiarse y el área de trabajo debe limpiarse cuando se trabaja con animales. Una vez obtenida la suspensión celular, el trabajo debe realizarse bajo una campana biológica laminar. Después del recubrimiento, las células deben incubarse durante la noche sin perturbaciones, ya que esto puede afectar la adherencia. Además, es importante reemplazar el medio de cultivo un día después de la siembra, ya que las células no adherentes pueden afectar la viabilidad del cultivo.
Los marcadores de superficie utilizados en este protocolo reaccionaron fuertemente con sus epítopos; sin embargo, es posible que la digestión enzimática pueda afectar la reactividad de unión y, por lo tanto, los resultados del análisis de FACS. Otra limitación de este protocolo es la subrepresentación de la capa muscular. Para mejorar la eficiencia del aislamiento celular de la capa muscular, recomendamos la separación mecánica del músculo de las capas mucosas y la digestión enzimática separada para cada una de las capas. Para disociar el epitelio del estroma, se pueden usar agentes de separación mecánica o quelantes (EDTA o DTT); Sin embargo, la digestión enzimática para la obtención de células individuales se ha optimizado en este protocolo.
El aislamiento del mesénquima intestinal ha sido descrito previamente8; raspar las vellosidades con un cubreobjetos causaría la pérdida de algún mesénquima junto a las vellosidades, especialmente las células mesenquimales de la punta de las vellosidades, como los telocitos de la punta de las vellosidades Lgr5+ 13. En este protocolo, utilizamos colagenasa tipo VIII en lugar de dispasa II y tripsina en combinación con DNasa I, ya que la colagenasa libera de manera más eficiente las células mesenquimales de la matriz. Aunque prolonga el tiempo de procesamiento (>90 min vs. 35 min), los dos protocolos arrojaron tasas de viabilidad celular similares; El protocolo actual mejoró el rendimiento de las células mesenquimales en general, y más específicamente de la fracción de telocitos. El protocolo actual produjo aproximadamente un 10% de telocitos GFP+, confirmados tanto por visualización como por análisis FACS, mientras que el protocolo anterior produjo un 2% de telocitos GFP+. Las principales diferencias entre el protocolo actual y los dos protocolos de referencia se enumeran en la Tabla Suplementaria S1.
La identificación de células FOXL1+GFP+ como telocitos subepiteliales se basa en estudios in vivo . La necesidad de desarrollar y modificar los protocolos de aislamiento de mesénquimas disponibles para producir mayores rendimientos de telocitos, y el conocimiento de cómo lograrlo se basó en nuestra comprensión de la estructura y función de los telocitos FOXL1+ in vivo, como células grandes con largas proyecciones celulares estrechamente unidas a las células epiteliales.
Curiosamente, los telocitos GFP+ ex vivo exhiben características celulares similares a sus características in vivo en el intestino y, por lo tanto, se sugiere que sirven como un soporte ideal para el crecimiento de organoides. Aunque este protocolo discute principalmente el aislamiento de telocitos del intestino delgado, un protocolo similar con modificaciones menores puede ser utilizado y aplicado fácilmente para las células mesenquimales del colon, como la recientemente descrita célula del estroma intestinal regulada por MAP3K2 (MRISC)12.
Una vez que las células mesenquimales se han estirado y alcanzado la confluencia, se pueden usar para varias aplicaciones adicionales, como el cocultivo 3D con organoides derivados de ratones o humanos, utilizando Mastrigel libre de factor de crecimiento. El mesénquima típicamente forma una red que apoya completamente la formación y el crecimiento de organoides sin suplementación con factor de crecimiento exógeno. El estroma intestinal tiene características 3D intrínsecas que pueden proporcionar al epitelio soporte mecánico14. Por lo tanto, este protocolo también se puede utilizar para aislar el mesénquima para integrarlo en un andamio bioimpreso en 3D y utilizarlo para otros experimentos de xenoinjerto.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Este trabajo fue apoyado por subvenciones de la Fundación de Ciencia de Israel (subvención personal MSC) y el programa conjunto entre la Fundación de Ciencias de Israel y la Fundación Nacional de Ciencias Naturales de China.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL Centrifuge Tubes | Corning | 430052 | |
| 50 mL Centrifuge Tubes | Corning | 430828 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell-strainer cap | Corning | 352235 | |
| 6 Well Cell Culture Plate | Costar | 3516 | |
| APC Anti-Mouse CD31 | Biolegend | 102509 | |
| APC Anti-Mouse CD326 | Biolegend | 118213 | |
| APC Anti-Mouse CD45 | Biolegend | 103111 | |
| Cell Lifter | Corning | 3008 | |
| Cell Strainer 100μm Nylon Yellow | Corning | CLS431752 | |
| Collagenase type VIII | Sigma | C2139-500MG | |
| DL-Dithiothreitol (DTT) | Sigma | 43815-1G | |
| DMEM/F-12 (HAM) 1:1 | Biological Industries | 01-170-1A | |
| DNase I | Sigma | DN25-1G | |
| Dulbecco's Modified Eagle Medium (DMEM) | Biological Industries | 01-055-1A | |
| Dulbecco's Phosphate Buffered Saline | Sigma | D1283-500ML | 10x |
| EDTA 0.5 M, pH 8.0 | Biological Industries | 01-862-1B | |
| FBS | Biological Industries | 04-007-1A | |
| Gentamicin | Sigma | G1914-250MG | 100x |
| Gluta Max-I | Gibco | 35050-038 | 100x |
| Hank’s Balanced Salt Solution (HBSS) | Biological Industries | 02-017-5A | 10x |
| HEPES | Gibco | 15630-080 | 100x |
| Penicillin-Streptomycin (Pen/Strep) | Biological Industries | 03-033-1B | 100x |
| RPMI 1640 medium | Gibco | 21875-034 | |
| Trypsin EDTA Solution B | Sartorius | 03-052-1A |
Referencias
- Carroll, T. D., Newton, I. P., Chen, Y., Blow, J. J., Näthke, I. Lgr5+ intestinal stem cells reside in an unlicensed G1 phase. The Journal of Cell Biology. 217 (5), 1667-1685 (2018).
- Kinchen, J., et al. Structural remodeling of the human colonic mesenchyme in inflammatory bowel disease. Cell. 175 (2), 372-386 (2018).
- Popescu, L. M., Faussone-Pellegrini, M. -. S. TELOCYTES - a case of serendipity: The winding way from Interstitial Cells of Cajal (ICC), via Interstitial Cajal-Like Cells (ICLC) to TELOCYTES. Journal of Cellular and Molecular Medicine. 14 (4), 729-740 (2010).
- Gherghiceanu, M., Manole, C. G., Popescu, L. M. Telocytes in endocardium: electron microscope evidence. Journal of Cellular and Molecular Medicine. 14 (9), 2330-2334 (2010).
- Ceafalan, L., Gherghiceanu, M., Popescu, L. M., Simionescu, O. Telocytes in human skin—are they involved in skin regeneration. Journal of Cellular and Molecular Medicine. 16 (7), 1405-1420 (2012).
- Hinescu, M. E., Gherghiceanu, M., Suciu, L., Popescu, L. M. Telocytes in pleura: two- and three-dimensional imaging by transmission electron microscopy. Cell and Tissue Research. 343 (2), 389-397 (2011).
- Popescu, L. M., et al. Telocytes in human epicardium. Journal of Cellular and Molecular Medicine. 14 (8), 2085-2093 (2010).
- Shoshkes-Carmel, M., et al. Subepithelial telocytes are an important source of Wnts that supports intestinal crypts. Nature. 557 (7704), 242-246 (2018).
- Dekkers, J. F., et al. A functional CFTR assay using primary cystic fibrosis intestinal organoids. Nature Medicine. 19 (7), 939-945 (2013).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Vonk, A. M., et al. Protocol for application, standardization and validation of the forskolin-induced swelling assay in cystic fibrosis human colon organoids. STAR Protocols. 1 (1), 100019 (2020).
- Wu, N., et al. MAP3K2-regulated intestinal stromal cells define a distinct stem cell niche. Nature. 592 (7855), 606-610 (2021).
- Bahar Halpern, K., et al. Lgr5+ are a signaling source at the intestinal villus tip. Nature Communication. 11 (1), 1936 (2020).
- Koliaraki, V., Pallangyo, C. K., Greten, F. R., Kollias, G. Mesenchymal cells in colon cancer. Gastroenterology. 152 (5), 964-979 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados