Method Article
ApoE에서 뒷다리 허혈의 변형 된 수술 모델-/- 소형 절개를 사용하여 마우스
요약
이 문서는 작은 절개를 가진 마우스에 있는 심각한 허혈을 확립하기 위하여 능률적인 외과 접근을 보여줍니다. 이 방법은 실험실 업그레이드없이 대부분의 연구 그룹에 의해 적용 될 수있다.
초록
이 연구의 목적은 대부분의 동물 실험실에서 구현 될 수있는 마우스에서 급성 허혈을 유도하기 위해 수정 된 수술 방법을 도입하고 평가하는 것입니다. 대퇴동맥(DLFA)의 이중 결찰에 대한 기존의 접근법과는 달리, DLFA를 수행하기 위해 근위 대퇴동맥(FA)을 노출시키기 위해 올바른 인게날 부위에 대한 작은 절개가 이루어졌다. 이어서, 7-0 봉합사를 사용하여, 절개는 말단 FA를 노출하기 위해 무릎 영역으로 끌려갔다. 수술 후 0, 1, 3, 5 및 7일 동안, 뒷사지의 기능적 회복은 탈로프 스케일을 사용하여 시각적으로 평가되고 등급화되었다. 히스토로지평가는 DLFA 이후 7일 후에 동물을 안락사한 후 수행되었다. 절차는 성공적으로 10 ApoE-/- 마우스에 있는 오른쪽 다리에, 그리고 어떤 마우스는 후속 관찰 도중 정지했습니다. 10마리의 마우스 의 절개 크기는 5mm(4.2± 0.63mm) 미만이었다. MRI 결과는 허혈성 측의 FA 혈류가 명확하게 차단되었다는 것을 보여주었습니다. Tarlov 스케일 결과는 수술 후 뒷다리 기능이 현저히 감소하고 다음 7일 동안 서서히 회복되었다는 것을 보여주었습니다. 조직학적 평가는 허혈성 측에 상당한 염증 반응을 보였고 허혈성 뒷두발의 미세 혈관 밀도를 감소시키는 것으로 나타났다. 결론적으로, 이 연구는 DLFA를 사용하여 뒷다리 허혈 (HLI)을 수행하기 위해 소형 절개를 사용하여 수정 된 기술을 소개합니다.
서문
말초 동맥 질환 (PAD)과 같은 혈관 질환연구를 위한 전임상 동물 모델에 대한 충족되지 않은 필요성이 있습니다. 진단 및 치료의 고급 발달에도 불구하고 2018 년1에서 PAD를 가진 2 억 명 이상의 환자가 있었고 그 수는 지속적으로 증가하고 있습니다. 비록 몇몇 새로운 치료 접근법2,3,4,5,6,7이 기술되었지만, 이러한 치료 양식의 성공적인 번역을 임상 응용 프로그램으로 성공적으로 번역하는 것은 어려운 작업으로 남아 있다. 따라서, 인간 질환 상태를 시뮬레이션하는 생체 내 실험 모델에서 안정적이고 관련성이 높은 이러한 새로운 치료 접근법의 잠재적 기전및 효율을 조사하여 PAD6,7을치료해야 한다.
고지혈증과 죽상 경화증 (AS)은 PAD의 발달을위한 주요 위험 요소입니다. ApoE-/-- 마우스(고지방 식단)는 비정상적인 지방 대사와 고지혈증을 표시하고, 이후ApoE-/-마우스를 임상적으로 관련 있는 PAD를 시뮬레이션하는 최선의 선택으로 동맥 경화성 플라크를 개발한다. 전임상 HLI 동물 모델은 전 세계8, 9,10, 11,12,13,14,15에 걸쳐 실험실에서 가장 널리 사용되는 접근법인 대퇴동맥(DLFA)의 이중 결찰을 통해 생성된다. 그러나, 이 접근은 일반적으로 상대적으로 크고 침략적인 절개를 요구합니다. 더욱이, 그것은 필연적으로 증가 된 통증 손상 및 염증으로 고통받는 동물 (특히 마우스)으로 이어지며, 이는 또한 후속 실험 결과에 영향을 미치는5,6,16,17. 이 논문은 매우 작은 절개를 사용하여APOE-/-마우스의 급성 만성 HLI 모델을 설명합니다.
프로토콜
참고: 모든 실험 절차는 EC 지침 EC 2010/63/EU에 따라 수행되었으며 현지 독일 법률(35-9185.81/G[1]239/18)의 승인을 받았습니다. C57BL/6J 배경이 29.6-38.0g인 10마리의 수컷 아포에 마우스는 12시간 광/암흑주기에 보관되어 서양 식단(콜레스테롤 1.25%, 지방 21%)과 8주 부터 12주 동안 물 광고 리비툼을 공급하였다. HLI는 아래에 설명된 바와 같이 20주 된 마우스에 수행되었다.
1. ApoE에서 HLI 유도-/- 마우스
- 수술에 필요한 장비와 도구를 준비합니다(재료 표 및 그림 1참조). 사용하기 전에 오토클레이브를 통해 수술 기구를 살균하고 수술 중에 유리 비드 멸균제를 사용하십시오.
- 미다졸람(5mg/kg), 메데토미딘(0.05 mg/ml/kg), 펜타닐(0.5 mg/kg)의 혼합물을 모든 수술 전에 피하 주사(S.C.)로 마우스를 마취시킵니다.
- 마취가 발병한 후, 눈에 수의사 연고를 사용하여 건조함을 방지하고 앞다리와 뒷다리에 페달 철수 반사가 없는지 확인합니다.
- 그 후 마우스를 가열 패드에 배치하여 코어 체온을 약 37°C로 유지합니다. 면 봉면과 제모 크림을 사용하여 오른쪽의 뒷다리 피부에서 모발을 조심스럽게 제거합니다.
참고: 제모 크림은 뒷다리, 특히 절개가 만들어질 인귀부위를 덮기 위해 충분한 양으로 사용되어야 합니다. 제모 크림은 3 분 미만의 기간 동안 사용되어야하며, 나중에 촉촉한 면 봉면 2 ~ 3 번 제거해야합니다. - 해부 현미경아래 가열 패드의 척추 위치에 마우스를 놓습니다. 마우스의 피부를 소독하기 위해 피부 방부제 (재료의 표참조)를 사용합니다. 그 후, 뾰족한 집게와 외과 가위를 사용하여 잉구이 영역의 중간에 약 3-4mm 절개를 합니다. 절차의 회로도는 그림 2를 참조하십시오.
- 피하 지방 조직을 미세한 뾰족한 집게의 도움으로 조심스럽게 제거하여 근위 대퇴 신경 혈관 번들을 노출시하십시오. 조심스럽게 대퇴 칼집의 막을 관통하기 위해 미세 한 뾰족한 집게를 사용합니다. 대퇴신경(FN)과 대퇴정맥(FV)에서 조심스럽게 대퇴동맥(FA)을 옮기려면 식염수로 촉촉한 면봉을 사용한다.
- 근교 FA를 통해 7-0으로 흡수 가능한 봉합사 2개를 통과하고 스프링 가위를 사용하여 더블 매듭을 만들어 두 동점 사이를 오가며 FA를 통과합니다.
- 실사 FA를 노출하려면 절개 하부 가장자리를 통해 7-0 흡수 가능한 봉합사를 통과하고 절개를 뒷다리의 무릎 오른쪽 영역으로 부드럽게 드래그합니다.
- 피하 조직을 조심스럽게 옆으로 움직여 신경 혈관 번들을 노출시하십시오. 미세 한 뾰족한 집안집을 사용하여 대퇴 칼집의 막을 관통하고 FV 및 FN에서 FA를 해부하십시오.
- 실사 FA를 통해 흡수 가능한 봉합사 2개를 통과하고 더블 매듭을 만듭니다. 스프링 가위를 사용하여 두 관계 사이에 FA를 변환합니다.
참고: 왼쪽 사지에서 리시레이션이 수행되지 않았으며, 이는 각 마우스의 컨트롤역할을 합니다. - 그 후 6-0 흡수성 봉합사를 사용하여 절개를 바느질하십시오. 깨끗한 케이지에 가열 패드에 마우스를 놓고 복구 될 때까지 중요한 매개 변수를 계속 모니터링합니다. 수술 후 진통제 제공: Buprenorphine s.c. (0.1 mg/kg 체중 마다 8 시간 마다 48 h). 48 h 작업 후, 식수에서 메타미졸을 관리 (24 mg/5mL의 물은 200 mg/kg 4 배 매일).
2. 자기 공명 이미징
참고: DLFA 가 끝난 지 하루 만에 마우스는 FA 막힘을 평가하기 위해 MRI 검사를 받아야 합니다.
- 마우스를 투명 유도 챔버에 놓고 마우스를 1.5-2%의 이소플루란으로 마취하여 오른쪽 반사를 상실할 때까지 주변 공기에 시동을 놓습니다.
- 마우스를 물린 홀더가 장착된 가열된 동물 침대에 놓고 레이저 제어 시스템으로 자석쪽으로 배치합니다. 체온을 37±1°C에서 유지합니다.
- 이미지 수집 중에 주변 공기에서 1.5-2 %의 이소플루란으로 마취를 유지하고 압력 프로브를 사용하여 호흡을 모니터링합니다.
- 3차원(3D) 비행 시간(TOF) 혈관조영서열을 사용하여 횡단 슬라이스 방향으로 이미지를 획득하여 파라미터 에코 시간(TE)/반복 시간(TR)/플립 각도(FA) = 2ms/12 ms/13°, 4개의 평균, 178 x 144의 획득 매트릭스를 256 x 192및 12111로 재구성하여 1211mm의 해상도로 재구성하였다. 정맥에서 신호를 억제하려면 채도 슬라이스를 뒷다리에 disation로 배치합니다.
3. 임상 평가 및 후속 조치
- 기능적 점수매기를 이용하여 수술 후1,3rd,5일및7일 동안 기능적 회복을 추정한다18,19(표 1).
4. 히토로지 평가
- 수술 후 7일 후, 펜토바르비탈 주사(115 mg/kg)를 적용하여 마우스를 안락사시킵니다.
- 좌측 심장 심실(마우스당 100mL)을 통해 1% 파라포름알데히드(PFA)를 함유한 인산염 완충식염(PBS). 4°C에서 하룻밤 사이에 4% PFA에서 마우스의 양측 위트로테미에(Gm)를 수정한다.
- 이전에 설명된프로토콜(20)에따라 파라핀에 샘플을 포함하였다.
- 마이크로톤에 파라핀 임베디드 조직 블록의 4-5 μm 두께의 부분을 잘라냅니다. 둥근 페인트 브러시의 도움으로 42 °C에서 유지 되는 수조에 절단 조직 섹션을 배치합니다.
- 현미경 슬라이드를 45° 각도로 물에 삽입하고 수집할 섹션 그룹 아래에 조심스럽게 배치합니다.
- 조심스럽게 물에서 슬라이드를 들어 올리고, 섹션이 슬라이드에 부착하고 37 ° C에서 벤치 탑 인큐베이터에서 밤새 건조 할 수 있습니다.
- 파라핀 섹션의 헤마톡시린/에오신(HE) 염색을 수행한다.
- 섹션이 포함된 슬라이드를 슬라이드 홀더에 배치합니다. 신선한 자일렌 3개의 용기를 준비하고 슬라이드를 각 용기에 5분 동안 배치하여 섹션을 분리합니다.
- 슬라이스를 96%, 80%, 70%, 50%, 30% 에탄올, 탈온수 5분으로 연속적으로 찍어 섹션을 수분화합니다.
- 10 분 동안 헤마톡슬린 용액에 얼룩.
- 슬라이스를 탈이온된 물 용기에 옮기고 흐르는 수돗물 아래에 5분 동안 놓아 헹구는 것입니다.
- 현미경을 사용하여 헤마톡슬린 염색의 강도를 확인하십시오. 염색이 세포 핵을 명확하게 식별할 수 있으면 다음 단계로 계속하십시오. 염색 강도가 세포 핵의 식별을 용이하게하지 않거나 염색강도가 희미해지면 헤마톡시린 용액에 슬라이드를 1 분 동안 넣고 물로 세척을 반복한 다음 다시 확인하십시오.
- 5 분 동안 eosin-Y 솔루션에 카운터 스테인.
- 슬라이스를 탈수하여 분해된 물과 30%, 50%, 70%, 80%, 96%의 에탄올을 각각 10s씩 연속적으로 담그면 단면을 탈수합니다. 다음으로, 각각 10 초에 신선한 자일렌의 세 용기에 섹션을 순차적으로 놓습니다.
- 슬라이드를 미세한 슬라이드 저장 맵에 수평으로 배치하고 섹션은 위쪽으로 향합니다. 슬라이드에 충분한 장착 매체를 추가하고 슬라이드에 커버립을 장착합니다.
- 파라핀 섹션의 면역히스토케미칼(IHC) 염색을 수행한다.
- 반복 비카페인화 및 재수화 단계 4.4.1-4.4.2. 이어서, 10mM 나트륨 구연산 버퍼, pH 6로 용기에 섹션을 담그고, 마이크로웨이브에서 시료를 끓이도록 한다.
참고: 시료의 과다 또는 과소 가열로 인해 일관되지 않은 염색이 발생할 수 있으므로 10분 동안 끓는 점 바로 아래에서 온도를 유지합니다. - 다음으로 벤치탑의 섹션을 30분 동안 식힙니다. 그 후, PBS에서 섹션을 5 분 동안 세 번 씻으시면 하십시오. 조심스럽게 샘플 주변의 영역을 건조하고 소수성 펜을 사용하여 샘플 주위에 큰 원을 그립니다. .
참고: 샘플을 만지지 마십시오. 소수성 펜으로 표시하는 것은 소수성 경계를 생성하여 더 적은 양의 항체 용액의 사용을 용이하게 합니다. - 10분 동안 PBS에서 0.3% H2O2로 섹션을 배치하여 내인성 과옥시다제 활성을 담금질한다. 400μL의 블록 버퍼(PBS포함 3% 소 세럼 알부민 및 비이온 세제의 0.3%)를 가습 챔버의 실온에서 1시간 동안.
- PBS에서 5 분 동안 섹션을 씻으면 하십시오. 다음으로, 단면을 커버할 수 있을 만큼 희석된 안티CD31 항체(1:250)의 100-400 μL을 추가한다. 이에 따라, 가습 챔버에서 4 °C에서 하룻밤 동안 섹션을 배양한다.
참고: 단면도가 항체 용액으로 완전히 덮여 있는지 확인합니다. - 1 차적인 항체를 제거하고, PBS에서 각각 5 분 동안 섹션을 세 번 씻는다.
- DAB 농축액 1mL에 DAB 농축액 1방울을 첨가하여 3, 3'-디아미노벤지딘(DAB) 혼합물을 준비하고 잘 섞는다. 그 후, 단면에 DAB 혼합물의 100-400 μL을 추가하고, 허용 가능한 염색 강도가 관찰될 때까지 2분 동안 눈으로 면밀히 모니터링한다.
참고: 단면도가 DAB 혼합물로 완전히 덮여 있는지 확인합니다. - 그 후, 흐르는 수돗물 아래에서 5 분 동안 헹구십시오. 단계 4.4.3-4.4.5에 설명된 바와 같이 헤마톡슬린 염색을 수행한다.
- 4.4.6 단계에서 설명된 eosin-Y 염색을 수행한다. 4.4.7 단계에서 설명된 탈수 단계를 수행한다.
- 마운팅 매체를 사용하여 커버립으로 섹션을 장착했습니다. ImageJ를 사용하여 이전에 설명된 21과 같이 미세 혈관 밀도로 간주될 수 있는 5개의 무작위로 선택된 필드(40x)에서CD31양성 영역(%)의 백분율을 추정한다.
- 반복 비카페인화 및 재수화 단계 4.4.1-4.4.2. 이어서, 10mM 나트륨 구연산 버퍼, pH 6로 용기에 섹션을 담그고, 마이크로웨이브에서 시료를 끓이도록 한다.
5. 통계 분석
- 통계 분석 소프트웨어를 사용하여 결과를 표준 편차로 ± 표현하고 비교에 대해 페어링되지 않은 t-test를 수행합니다. P < 0.05가 통계적으로 유의하다고 생각해 보십시오.
결과
아포에의 특성-/-- 마우스
DLFA 수술은 HLI 모델을 확립하기 위해 10마리의 마우스에서 성공적으로 수행되었으며, 수술 후 마우스 중 누구도 사망하지 않았습니다. 체중의 변화를 따르기 위해, 마우스는 DLFA 절차 (PRE DLFA) 및 DLFA 수술 후 7 일 전에 무게를 측정했다 (포스트 DLFA). 사전 DLFA 가중치는 29.6에서 38.0g(평균 34.74 ± 2.47g)이며, DLFA 이후 의 무게는 26.5에서 34.1g(평균 30.77 ± 2.15g)으로, 이는 전 DLFA가중치(P < 0.05, 피겨 3)보다현저히 낮았다. 수술 시간은 15분에서 47분까지 다양했다(평균 34.2± 8.82분, 마취 시간을 포함하지 않음). 10마우스의 절개 크기는 3mm에서 5mm(평균 4.2 ± 0.63 mm)에 구역수색되었습니다.
MRI 스캔 및 기능 복구
MRI 스캔은 매우 명확하게 오른쪽 FA의 근위 및 탈구 영역이 이 방법의 성공을 나타내는 관류(도 3C)를보여주지 않았다는 것을 나타냈다. 수술 후 하루 만에 탈로프 스케일 결과가 크게 감소했습니다(P< 0.05). 결과는 다음 날에 서서히 증가했지만 7 일째까지 기준선보다 여전히 낮았습니다(P < 0.05, 그림 3B). 이러한 추세는 이전 보고서20과일치합니다. 어떤 마우스의 뒷다리의 양측 측에서 괴사 또는 괴사 조직 개발이 관찰되지 않았다. 그러나, 7 마우스에 있는 허혈성 뒷다리의 발은 반대로 측에 비교된 자연적으로 스트레칭할 수 없었습니다. 또한, 4마우스에서 허혈성 뒷다리의 발은 상반면(도3D)에비해 약간의 변색을 나타냈다.
조직학적 분석
오른쪽 Gm 근육의 HE 염색에서, 근섬유는 불규칙한 허혈성 괴사를 전시했습니다. 증식 위성 세포는 괴사 성 근섬유를 대체하고 질량 및 / 또는 불규칙한 분산으로 배포되었다. 근섬유는 다핵대식 세포에 의한 염증성 침투를 나타냈다. 염증 부위의 근섬유는 정상적인 형태학적 특성을 잃었으며, 재생된 근섬유가 거의 없었습니다. 이러한 재생된 근섬유의 횡단 구간은 둥글고, 세포질은 적색으로 염색되었고, 하나의 작은 핵 또는 다중 핵이 중앙에 위치하였다. 대조적으로, 이러한 종류의 염증 패턴은 왼쪽Gm(도 4)에서관찰되지 않았다. CD31 항체 염색은 GM 샘플에서 용기의 내피 세포를 식별하기 위해 수행되었으며, ImageJ는 CD31 양성 영역-각 샘플에 대한 5개의 시야(40x) 각각의 마이크로혈관 밀도에 대한 대리를 평가하기 위해 사용되었다. 허혈성 뒷사지는 비허혈측(P < 0.05, 도 5)보다훨씬 더 많은 미세혈관 밀도를 나타냈다.
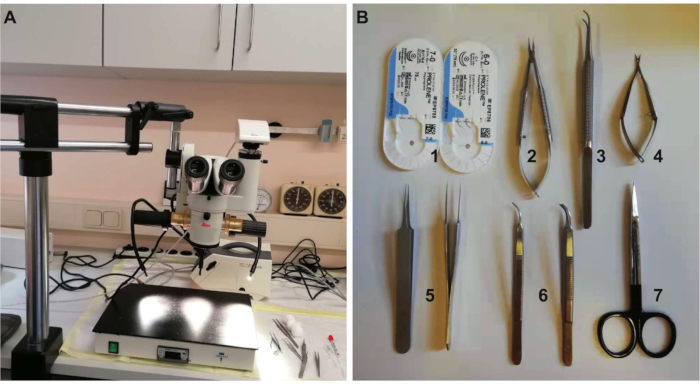
그림 1: 실험에 필요한 장비 및 도구. (A)수술에 필요한 현미경 및 가열 패드를 해부한다. (B)외과 도구: 1. 7-0 및 6-0 흡수성 봉합사, 2. 바늘 홀더, 3. 이가없는 집게, 4. 스프링 가위, 5. 미세 뾰족한 집게, 6. 뾰족한 집게 및 7. 수술 가위. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
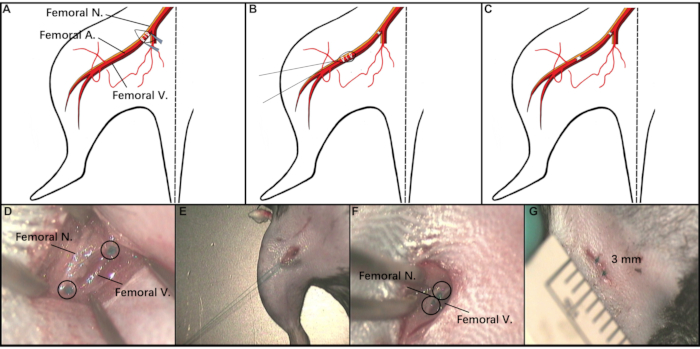
도 2: 절차의 회로도 예시. (A 및 D)개칭 부위에 작은 절개가 이루어지며, 이는 계열대 대퇴율 A를 노출한다. (B와 E)6-0 봉합사는 결찰되는 실태형 대퇴A를 노출시키기 위해 무릎 부위로 절개를 드래그하는 데 사용된다. (C, F, G) 절개 의 바느질. 약어: 대퇴 A = 대퇴 동맥; 대퇴N = 대퇴신경; 대퇴골 V = 대퇴 정맥. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
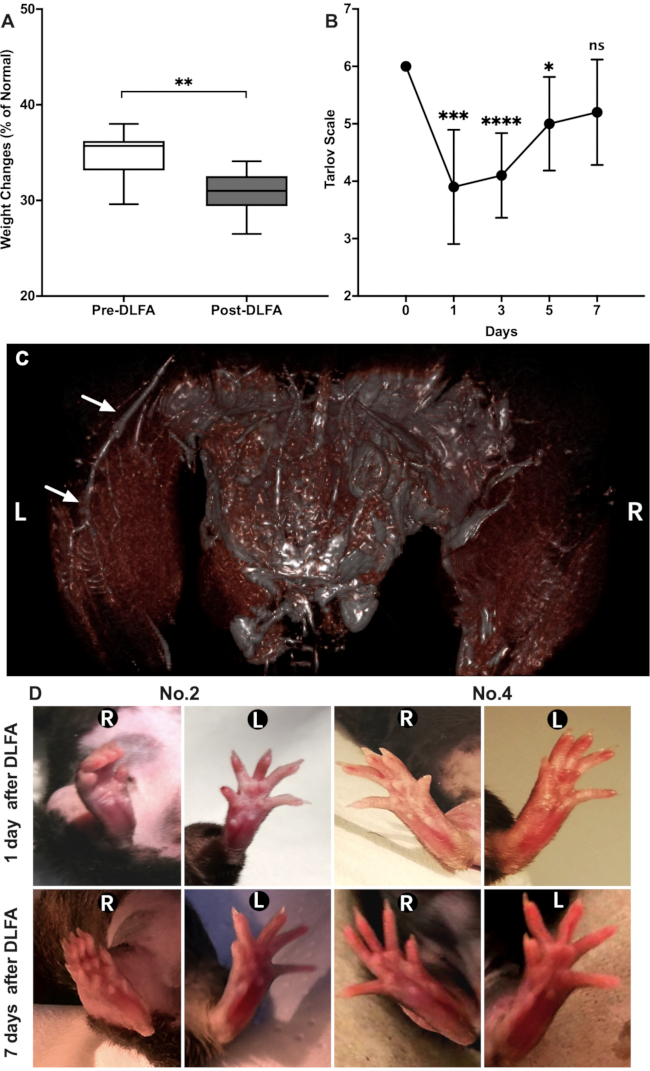
도 3: PAD 마우스 모델의 특성. (A)DLFA 후 7 일 전 과 7 일 의 체중비교. (B)탈로프 스케일에 의해 평가된 기능적 회수. (C)자기 공명 혈관 조영술은 왼쪽 뒷다리 (흰색 화살표)의 근위 및 단면 FA를 나타내고 오른쪽에, 근위 및 단면 FA가 사라집니다. (D)DLFA 후 2번 과 4번, 1번 및 7일 후 마우스의 양측 뒷사지의 출현에 변화가 있었다. 표시된 값은 표준 편차에 ± 의미입니다. *P < 0.05, ** P < 0.001, *** P < 0.0001, **** P < 0.00001; 페어링되지 않은 t-test. 약어 : 패드 = 말초 동맥 질환; DLFA = 대퇴동맥의 이중 결찰; FA = 대퇴동맥; L = 왼쪽; R = 오른쪽. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: 위트롬혈근육의 HE 염색. (A)DLFA 시술 후 7일 후 올바른 GM의 염색을 보여주는 저배율 영상. 염증은 오른쪽 Gm에서 관찰되었다.(B)오른쪽 GM에서, 괴사 심섬유는 대식세포에 의한 염증 성 침투를 나타냈다(흰색 화살표). 근육 섬유는 정상적인 형태 학적 특성을 잃게됩니다. 재생된 심근섬유(검은 화살표)는 거의 없었습니다. (C)오른쪽 GM의 정상적인 심섬유의 HE 염색.(D)금단/왼쪽 GM(nonischemic) 근육은 정상적인 조직학적 패턴을 나타낸다. 스케일 바: A = 200 μm, B-D = 50 μm. 약어: HE = 헤마톡시린-에오신; DLFA = 대퇴동맥의 이중 결찰; Gm = 위장혈증; L = 왼쪽; R = 오른쪽. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 양측 위트로네미즘 근육의 미세 혈관 밀도 비교. (A)CD31-IHC 염색 오른쪽 GM 섹션 (검은 화살표). (B)왼쪽 GM 섹션 (검은 화살표)의 CD31-IHC 염색. (C)오른쪽의 미세 혈관 밀도의 정량화는 왼쪽에 있는 것보다 훨씬 적다. 표시된 값은 표준 편차에 ± 의미입니다. P < 0.00001; 페어링되지 않은 t-test. 스케일 바: A, B = 20 μm. 약어: CD31 = 분화 31의 클러스터; IHC = 면역히스토케미칼; Gm = 위장혈증. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 탈로프 스코어 | 0 | 무브먼트 없음 |
| 1 | 거의 인식 할 수없는 움직임, 비 중량 베어링 | |
| 2 | 빈번한 움직임, 비 중량 베어링 | |
| 3 | 중량, 부분 중량 베어링 지원 | |
| 4 | 가벼운 적자로 걷기 | |
| 5 | 정상이지만 느린 걷기 | |
| 6 | 완전하고 빠른 걷기 |
표 1: 기능 점수 매기기.
보충 표 S1: PAD 모델의 설립에 대한 현재 문헌에서 25 논문의 요약. 이 테이블을 다운로드하려면 여기를 클릭하십시오.
토론
이 연구는 필요한 실험실 업그레이드없이 3-4mm 절개를 통해 FA의 근위 및 탈산 영역에서 이중 결찰을 사용하여ApoE-/-마우스에 HLI 모델을 확립하기 위한 수정, 단순화 및 외과 효율적인 접근법을 보고합니다. 이 방법의 주요 특징은 마우스 HLI 모델8,9,10,11,12,15,20,22, 23,24를 설명하는 이전에 보고된 연구 결과에 비해 절개크기가작다.
역사적으로, 절개는 0.5에서 2cm 이상9,11,15,19,22,25,26 (보충 표 S1에요약)에 이르기까지 더 나은 노출을 위해 무릎에서 미디어 꽉, inguinal, 또는 복부에 만들어졌습니다. 이 논문은 DLFA를 달성하기 위한 수술 기법을 설명하고 그 결과, HLI는 5mm(4.2± 0.63mm)< 절개를 한 마우스에서 설명합니다. FA는 포라이트 동맥과 사페누스 동맥으로 분기하기 전에 결찰되어 뒷다리에 있는 몇몇 근육 단에 있는 허혈을 일으키는 원인이 되고 마우스에 있는 적당한 긴장의 결과로. 마우스는 수술 후7일째(6일 0± 0,1일째 수술 후 0.9± 0.99 ± 0.99 ± 0.92까지 기능적으로 회복되었지만, 조직학적 수준에서 Gm에서 허혈성 손상을 관찰하였다. 첫째, 허혈성 다리 심섬유에서 GM은 불규칙한 허혈성 괴사를 나타내고 PAD환자(27,28)에서보고된 것과 유사한 다핵대식세포에 의해 침투되었다. 근섬유 위축에도 불구하고, 몇몇 재생된 심근섬유는 또한 관찰되었습니다, 이는 이전 보고에 줄에있는 (29). 둘째, 결찰 후7일째에 허혈성 Gm의 미세혈관 밀도는 비허혈성 다리보다 높았으며, 이는 또한 Ministro 등30에의해 보고되었다. PAD 치료에 최근 초점은 비 허혈측에 비해 미세 혈관 밀도를 증가시키는 것뿐만 아니라 성장 인자와 생체 역학 적 지원31의매트릭스를 제공함으로써 새로운 혈관 형성을 지원하는 생존 근육 조직의 허혈 유발 손실의 복원에 만국되어 있습니다. 따라서,이 모델은 또한 이러한 초점과 새로운 치료의 효과를 테스트하는 넓은 창을 제공합니다. 더욱이, 수술 절차의 세련미로서 동물 실험의 3R 개념에 맞는 작은 절개로 HLI를 달성하는 것은 외상과 수술 후 통증을 감소시다.
이상적인 동물 모델은 비교적 긴 치료 창을 제공합니다. 마우스에서 허혈을 확립하기 위한 다양한 외과적 절차가 보고되고 적용되었으며, 혈류회복(21)에상이한 효과를 발휘하고 있다. HLI의 유도를 위해, 외과 방법은 일반적으로 장악동맥(12,19,23,32,대퇴동맥24,33,34,및 그들의 가지11,35,대퇴정맥36,37)에초점을 맞추고 있다. 혈관 결찰의 수준이 혈류 회복에 영향을 미치지 않기 때문에, 결정적인 요인은 혈관나무(21)의부상 정도이다. 대퇴 또는 상골 동맥의 단일 결찰을 위해, 다른 가지 상호 작용이 여전히 유지되는 동안, 인기구 또는 복부 영역에서 작은 절개가 이루어지고, 마우스 뒷다리의 관류 복원은 7 일21,38이내에 완전히 회복된다. 따라서, 단일 결찰은 상이한 치료의 효과를 시험하기 위하여 적당한 치료 창을 제공하는 측면에서 충분하지 않습니다. FA의 분기도 결찰되어야 하는 경우 피부 절개가 더 커져 수술 시간이 길어져야 합니다. 따라서, 마우스에서 DLFA에 의한 HLI는 치료에 의해 유도된 개선이9,21,22,25를효율적으로 모니터링할 수 있는 적합한 치료 창을 제공한다.
임상적으로 관련된 HLI 동물 모델을 확립하는 것은 PAD2,3,4에대한 새로운 치료 접근법, 즉 세포, 줄기 세포 또는 유전자 치료의효율을시험하는 것이 중요하다. 여러 PAD 모델은마우스(15,21,랫트39,토끼40,41)에서개발되었다. Del Giudice 및 동료는 기존 동물모델(40)의일부 한계를 극복할 수 있는 보정된 입자로 경피성, 트랜스아큘러, 탈모성 동맥 색전화에 의해 생성된 토끼 힌다리 허혈 모델을 확립하였다. Liddell외. 41은 또한 혈관 내 접근을 통해 피상적 인 FA를 코일링하여 토끼 PAD 모델을 만들어 뒷사지 레퍼퓨전을 감소시다. 토끼와 같은 더 큰 동물은40,41의더 설득력있는 결과를 얻을 수 있지만, 임상 적용에 한 걸음 더 가까이 치료를 복용, 그러나 그들은 결과를 얻기 위해 증가 비용과 시간이 필요합니다.
유전 및 행동인자(42)를포함한 PAD를 가진 대부분의 환자의 이기종 위험 프로필에도 불구하고, ApoE-/-마우스는 총 콜레스테롤, 트리글리세라이드, 매우 저밀도 지단백 및 중간 밀도 지단백과 같은 비정상적인 지방 대사 및 고지혈증 증상을 나타내며 PAD 를 가진 환자에서 관찰된 주요 특성 중 일부를 복제합니다. 또한, 고지방 식단으로 이러한 지표가 크게 증가합니다. Lo Sasso 등은 이러한 마우스에서 동맥 지방 축적이43세의3개월에 발생하며,43세의나이로 AS 병변이 증가하여 발생한다고 보고하였다. 따라서,ApoE-/-마우스는 PAD를 가진 환자에 일반적으로 존재하는 콜레스테롤혈증을 재구성하고 허혈성 사지의 신생혈관화를 촉진하는 것을 표적으로 한 각종 치료를 평가하기 위하여 적합한 플랫폼을 제공하기 때문에 급성 만성 허혈-PAD 모형에 특히 적합합니다. 또한, ApoE-/--마우스를 가진 새로운 치료법을 시험하는 것의 가격 성과 비율은 타의 추종을 불허합니다.
위의 단락에 언급 된 장점에도 불구하고이 모델에는 두 가지 제한이 있습니다. 첫째, 이 방법을 마스터하려면 실험자가 마우스 뒷다리의 해부학에 충분한 미세 수술 경험과 친숙함을 가져야 합니다. 둘째,ApoE-/-마우스의 뒷사지에서 제한된 수술 노출 및 피하 지방 조직의 양이 수술 난이도를 증가시다. 따라서 이 기술을 성공적으로 구현하려면 일부 관련 관행이 필요합니다. 결론적으로, 이 연구는 작은 절개를 사용하여ApoE-/-마우스에 HLI 모델을 확립하기 위한 수정되고 구현하기 쉬운 외과적으로 효율적인 접근법을 보고합니다. 작은 절개는 동물에 대한 외상을 크게 감소시키며 실험실 업그레이드없이 대부분의 연구 그룹에 의해 적용 될 수 있습니다.
공개
저자는 기사 콘텐츠가 잠재적 이해 상충으로 해석 될 수있는 상업적 또는 재정적 관계가없는 경우 구성되었다고 선언합니다.
감사의 말
저자는 뛰어난 기술 지원에 대한 빅토리아 스쿠드, 알렉산더 슐룬드, 펠릭스 회너에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffer saline | Roth | 9143.1 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| 30% H2O2 | Roth | 9681.2 | Used for immunohistochemistry stain |
| 6-0 absorbable sutures | PROLENE | 8776H | Used for stitching the skin |
| 6-0 absroable suture | PROLENE | EP8706 | Used in Surgery |
| 7-0 absorbable sutures | PROLENE | EH8021E | Used for ligating the artery |
| 7-0 absroable suture | PROLENE | EP8755 | Used in Surgery |
| Acetic acid | Roth | 6755.1 | Used for haematoxylin and eosin stain |
| Albumin Fraktion V | Roth | 8076.2 | Used for immunohistochemistry stain |
| Autoclave | Systec GmbH | Systec VX-150 | Used for the sterilisation of the surgical instruments |
| Axio vert A1 microscope | Carl Zeiss | ZEISS Axio Vert.A1 | Used for viewing and taking the pictures from haematoxylin and eosin stain and immunohistochemistry stain |
| Bruker BioSpec 94/20 AVIII | Bruker Biospin MRI GmbH | N/A | Scan the femoral artery blockage |
| Buprenovet Sine 0,3mg/ml | Bayer AG | 2542 (WDT) | Used in post operative pain-management. Dose - 0.1 mg/kg body weight every 8 hours for 48 h after operation |
| CD31 antibody | Abcam | ab28364 | Used for immunohistochemistry stain |
| Eosin Y solution 0.5 % in water | Roth | X883.1 | Used for haematoxylin and eosin stain |
| Epitope Retrieval Solution pH 6 | Leica Biosystems | 6046945 | Used for immunohistochemistry stain |
| Ethanol ≥ 99,5 % | Roth | 5054.1 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| Fentanyl | Cayman Chemical | 437-38-7 | Used for anesthesia |
| Fine point forceps | Medixplus | 93-4505S | Used for separating the artery from nerve and vein |
| Glass bead sterilisator | Simon Keller | Type 250 | Used for sterilisation of the surgical instruments |
| Graefe iris forceps curved | VUBU | VUBU-02-72207 | Used for blunt separation of skin and subcutaneous tissue |
| Hair Remover cream, Veet (with aloe vera) | Reckitt Benckiser | 108972 | Remove hair from mice hind limbs |
| Heating plate | STÖRK-TRONIC | 7042092 | Keep the satble temperature of mice |
| Hematoxylin | Roth | T865.2 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| Leica surgical microscope | Leica | M651 | Enlarge the field of view to facilitate the operation |
| Liquid DAB+Substrate Chromogen System | Dako | K3468 | Used for immunohistochemistry stain |
| Male ApoE-/- mice | Charles River Laboratories | N/A | Used for establish the Peripheral artery disease mice model |
| Medetomidine | Cayman Chemical | 128366-50-7 | Used for anesthesia |
| Micro Needle Holder | Black & Black Surgical | B3B-18-8 | Holding the needle |
| Micro suture tying forceps | Life Saver Surgical Industries | PS-MSF-145 | Used to assist in knotting during surgery |
| Microtome | Biobase | Bk-Mt268m | Used for tissue sectioning |
| Midazolam | Ratiopharm | 44856.01.00 | Used for anesthesia |
| MR-compatible Small Animal Monitoring and Gating System Model 1025 | SA Instruments | N/a | monitoring vital signs of animal during MRI scan |
| Octeniderm farblos | Schülke & Mayr GmbH | 180212 | used for disinfection of the skin |
| Ointment for the eyes and nose | Bayer AG | 1578675 | Keep the eyes wet under the anesthesia |
| Paraformaldehyde | Roth | 0335.1 | Used for fixation of the tissue |
| Pentobarbital | Nembutal | 76-74-4 | Used for anesthesia |
| Saline | DeltaSelect | 1299.99.99 | Used for anesthesia |
| Spring handle scissors with fine, sharp tips | Black & Black Surgical | B66167 | Used for cutting the artery |
| SuperCut Scissors | Black & Black Surgical | B55992 | Used for cutting the skin |
| Triton X-100 | Roth | 9002-93-1 | Used for immunohistochemistry stain |
| Western diet, 1.25% Cholesterol | ssniff Spezialdiäten GmbH | E15723-34 | Diet for the mice |
| Xylene | Roth | 4436.3 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
참고문헌
- Shu, J., Santulli, G. Update on peripheral artery disease: Epidemiology and evidence-based facts. Atherosclerosis. 275, 379-381 (2018).
- Tateishi-Yuyama, E., et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 360 (9331), 427-435 (2002).
- Wang, Z. X., et al. Efficacy of autologous bone marrow mononuclear cell therapy in patients with peripheral arterial disease. Journal of Atherosclerosis and Thrombosis. 21 (11), 1183-1196 (2014).
- Botham, C. M., Bennett, W. L., Cooke, J. P. Clinical trials of adult stem cell therapy for peripheral artery disease. Methodist Debakey Cardiovascular Journal. 9 (4), 201-205 (2013).
- van Weel, V., et al. Vascular endothelial growth factor overexpression in ischemic skeletal muscle enhances myoglobin expression in vivo. Circulation Research. 95 (1), 58-66 (2004).
- Olea, F. D., et al. Vascular endothelial growth factor overexpression does not enhance adipose stromal cell-induced protection on muscle damage in critical limb ischemia. Arteriosclerosis, Thrombosis, and Vascular Biology. 35 (1), 184-188 (2015).
- Peeters Weem, S. M. O., Teraa, M., de Borst, G. J., Verhaar, M. C., Moll, F. L. Bone marrow derived cell therapy in critical limb ischemia: a meta-analysis of randomized placebo controlled trials. European Journal of Vascular and Endovascular Surgery. 50 (6), 775-783 (2015).
- Crawford, R. S., et al. Divergent systemic and local inflammatory response to hind limb demand ischemia in wild-type and ApoE-/- mice. Journal of Surgical Research. 183 (2), 952-962 (2013).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. Journal of Visualized Experiments: JoVE. (23), e1035 (2009).
- Brenes, R. A., et al. Toward a mouse model of hind limb ischemia to test therapeutic angiogenesis. Journal of Vascular Surgery. 56 (6), 1669-1679 (2012).
- Peck, M. A., et al. A functional murine model of hindlimb demand ischemia. Annals of Vascular Surgery. 24 (4), 532-537 (2010).
- Lejay, A., et al. A new murine model of sustainable and durable chronic critical limb ischemia fairly mimicking human pathology. European Journal of Vascular and Endovascular Surgery. 49 (2), 205-212 (2015).
- Nagase, H., Yao, S., Ikeda, S. Acute and chronic effects of exercise on mRNA expression in the skeletal muscle of two mouse models of peripheral artery disease. PLoS One. 12 (8), 0182456 (2017).
- Fu, J., et al. Hydrogen molecules (H2) improve perfusion recovery via antioxidant effects in experimental peripheral arterial disease. Molecular Medicine Reports. 18 (6), 5009-5015 (2018).
- Yu, J., Dardik, A. A murine model of hind limb ischemia to study angiogenesis and arteriogenesis. Methods in Molecular Biology. 1717, 135-143 (2018).
- Pu, L. Q., et al. Enhanced revascularization of the ischemic limb by angiogenic therapy. Circulation. 88 (1), 208-215 (1993).
- Takeshita, S., et al. Therapeutic angiogenesis. A single intraarterial bolus of vascular endothelial growth factor augments revascularization in a rabbit ischemic hind limb model. Journal of Clinical Investigation. 93 (2), 662-670 (1994).
- Tarlov, I. M. Spinal cord compression studies. III. Time limits for recovery after gradual compression in dogs. AMA Archives of Neurology and Psychiatry. 71 (5), 588-597 (1954).
- Westvik, T. S., et al. Limb ischemia after iliac ligation in aged mice stimulates angiogenesis without arteriogenesis. Journal of Vascular Surgery. 49 (2), 464-473 (2009).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. European Journal of Vascular and Endovascular Surgery. 40 (6), 796-803 (2010).
- Liu, Q., et al. CRISPR/Cas9-mediated hypoxia inducible factor-1α knockout enhances the antitumor effect of transarterial embolization in hepatocellular carcinoma. Oncology Reports. 40 (5), 2547-2557 (2018).
- Padgett, M. E., McCord, T. J., McClung, J. M., Kontos, C. D. Methods for acute and subacute murine hindlimb ischemia. Journal of Visualized Experiments: JoVE. (112), e54166 (2016).
- Pellegrin, M., et al. Experimental peripheral arterial disease: new insights into muscle glucose uptake, macrophage, and T-cell polarization during early and late stages. Physiological Reports. 2 (2), 00234 (2014).
- Sun, Z., et al. VEGF-loaded graphene oxide as theranostics for multi-modality imaging-monitored targeting therapeutic angiogenesis of ischemic muscle. Nanoscale. 5 (15), 6857-6866 (2013).
- Craige, S. M., et al. NADPH oxidase 4 promotes endothelial angiogenesis through endothelial nitric oxide synthase activation. Circulation. 124 (6), 731-740 (2011).
- Kant, S., et al. Neural JNK3 regulates blood flow recovery after hindlimb ischemia in mice via an Egr1/Creb1 axis. Nature Communications. 10 (1), 4223 (2019).
- Chevalier, J., et al. Obstruction of small arterioles in patients with critical limb ischemia due to partial endothelial-to-mesenchymal transition. iScience. 23 (6), 101251 (2020).
- Kosmac, K., et al. Correlations of calf muscle macrophage content with muscle properties and walking performance in peripheral artery disease. Journal of the American Heart Association. 9 (10), 015929 (2020).
- Mohiuddin, M., et al. Critical limb ischemia induces remodeling of skeletal muscle motor unit, myonuclear-, and mitochondrial-domains. Scientific Reports. 9 (1), 9551 (2019).
- Ministro, A., et al. Assessing therapeutic angiogenesis in a murine model of hindlimb ischemia. Journal of Visualized Experiments: JoVE. (148), e59582 (2019).
- Kilarski, W. W., Samolov, B., Petersson, L., Kvanta, A., Gerwins, P. Biomechanical regulation of blood vessel growth during tissue vascularization. Nature Medicine. 15 (6), 657-664 (2009).
- Portou, M. J., et al. Hyperglycaemia and ischaemia impair wound healing via Toll-like receptor 4 pathway activation in vitro and in an experimental murine model. European Journal of Vascular and Endovascular Surgery. 59 (1), 117-127 (2020).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117 (9), 1207-1215 (2008).
- Hazarika, S., et al. MicroRNA-93 controls perfusion recovery after hindlimb ischemia by modulating expression of multiple genes in the cell cycle pathway. Circulation. 127 (17), 1818-1828 (2013).
- Fan, W., et al. mTORC1 and mTORC2 play different roles in the functional survival of transplanted adipose-derived stromal cells in hind limb ischemic mice via regulating inflammation in vivo. Stem Cells. 31 (1), 203-214 (2013).
- Terry, T., et al. CD34(+)/M-cadherin(+) bone marrow progenitor cells promote arteriogenesis in ischemic hindlimbs of ApoE(-)/(-) mice. PLoS One. 6 (6), 20673 (2011).
- Kwee, B. J., et al. Treating ischemia via recruitment of antigen-specific T cells. Science Advances. 5 (7), (2019).
- Nakada, M. T., et al. Clot lysis in a primate model of peripheral arterial occlusive disease with use of systemic or intraarterial reteplase: addition of abciximab results in improved vessel reperfusion. Journal of Vascular and Interventional Radiology: JVIR. 15 (2), 169-176 (2004).
- Carr, A. N., et al. Efficacy of systemic administration of SDF-1 in a model of vascular insufficiency: support for an endothelium-dependent mechanism. Cardiovascular Research. 69 (4), 925-935 (2006).
- Del Giudice, C., et al. Evaluation of a new model of hind limb ischemia in rabbits. Journal of Vascular Surgery. 68 (3), 849-857 (2018).
- Liddell, R. P., et al. Endovascular model of rabbit hindlimb ischemia: a platform to evaluate therapeutic angiogenesis. Journal of Vascular and Interventional Radiology: JVIR. 16 (7), 991-998 (2005).
- Aboyans, V., et al. 2017 ESC guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). European Heart Journal. 39 (9), 763-816 (2018).
- Lo Sasso, G., et al. The Apoe(-/-) mouse model: a suitable model to study cardiovascular and respiratory diseases in the context of cigarette smoke exposure and harm reduction. Journal of Translational Medicine. 14 (1), 146 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유