Method Article
ApoEにおける後肢虚血の改変外科モデル-/- ミニチュア切開を用いたマウス
要約
この記事は、小さな切開を有するマウスにおける急性虚血を確立するための効率的な外科的アプローチを示す。このアプローチは、ほとんどの研究グループが、実験室でのアップグレードなしで適用できます。
要約
本研究の目的は、ほとんどの動物実験で実施できるマウスに急性虚血を誘導する改変外科的アプローチを導入し、評価することにある。大腿動脈(DLFA)の二重結紮に対する従来のアプローチとは対照的に、右のインギナル領域に小さな切開部が、DLFAを行うために近位大腿動脈(FA)を露出するようになされた。次いで、7-0縫合を用いて、切開を膝領域に引きずり込んで遠位FAを露出させ、手術後にFA閉塞を検出するために両側後肢に磁気共鳴画像(MRI)を使用した。手術後0、1、3、5、および7日目に、後肢の機能的回復を目視で評価し、Tarlovスケールを用いて採点した。組織学的評価は、DLFAの7日後に動物を安楽死させた後に行った。この処置は10匹のApoE-/- マウスで右足で正常に行われ、その後の観察中に死亡したマウスはなかった。全10匹のマウスの切開サイズは5mm(4.2±0.63mm)未満であった。MRIの結果は虚血側のFA血流が明確に遮断されたことを示した。Tarlovスケールの結果は、後肢の機能が処置後に有意に低下し、次の7日間にわたってゆっくりと回復することを示した。組織学的評価は虚血性側に顕著な炎症反応を示し、虚血後肢の微小血管密度を低下させた。結論として、この研究は、DLFAを使用して後肢虚血(HLI)を行うためにミニチュア切開を使用して変更された技術を導入する。
概要
末梢動脈疾患(PAD)などの血管疾患の研究のための前臨床動物モデルのための満たされていないニーズがあります。診断と治療の発展にもかかわらず、2018年1年にはPAD患者数が2億人以上で、その数は絶えず増加しています。いくつかの新しい治療アプローチ2、3、4、5、6、7が記載されているが、臨床応用へのこれらの治療様式の翻訳の成功は困難な作業のままである。従って、ヒト疾患状態をシミュレートする生体内の実験モデルにおいて信頼性が高く、関連するが、PAD6,7を治療するためのこれらの新しい治療アプローチの潜在的なメカニズムおよび効率を調べる必要がある。
高脂血症およびアテローム性動脈硬化症(AS)は、PADの開発のための主な危険因子である。ApoE-/-マウス(高脂肪食)は異常な脂肪代謝と高脂血症を示し、その後、臨床的に関連するPADをシミュレートするための最良の選択としてApoE-/-マウスをレンダリングするアテローム硬化性プラークを開発する。前臨床HLI動物モデルは、世界中の実験室で最も広く使用されている大腿動脈(DLFA)の二重結紮によって生成される8、9、10、11、12、13、14、15急性慢性虚血をシミュレートする。しかし、このアプローチは通常、比較的大きく侵襲的な切開を必要とする。さらに、必然的に、痛み傷害や炎症の増加に苦しむ動物(特にマウス)につながり、その後の実験結果5、6、16、17にも影響を与える。この論文では、APOE-/- マウスにおける急性慢性HLIモデルについて、非常に小さな切開を用いて説明する。
プロトコル
注:すべての実験手順はECガイドラインEC 2010/63/EUに従って行われ、現地のドイツの法律(35-9185.81/G[1]239/18)によって承認されています。体重29.6-38.0gのC57BL/6Jバックグラウンドを持つ10匹の雄のApoE-/- マウスを12時間の明暗サイクルに収容し、8週間から12週間、西洋の食事(1.25%コレステロールと21%脂肪)と水 アドリビタム を与えた。HLIは、以下に説明する20週齢マウスに対して行った。
1. アポエにおけるHLI誘導-/- マウス
- 手術に必要な機器とツールを準備します ( 資料一覧 および 図 1を参照)。使用前にオートクレーブ処理を介して手術器具を殺菌し、手術中にガラスビーズ滅菌器を使用します。
- すべての外科的処置の前にミダゾラム(5mg/kg)、メデトミジン(0.05 mg/ml/kg)、フェンタニル(0.5mg/kg)の混合物の皮下注射(S.C.)でマウスを麻酔する。
- 麻酔の発症後、目の獣医軟膏を使用して乾燥を防ぎ、前肢および後肢にペダル離脱反射がないことを確認する。
- その後、マウスを加熱パッドに置き、コア体温を約37°Cに保ちます。 綿棒と脱毛クリームを使用して、右側の後肢の皮膚から慎重に髪を取り除きます。
注:脱毛クリームは、後肢、特に切開が行われるインギナル領域をカバーするのに十分な量で使用する必要があります。脱毛クリームは3分未満の持続時間のために使用する必要があり、その後、湿った綿棒2〜3回で除去する必要があります。 - マウスを、解剖顕微鏡の下の加熱パッドの仰向けの位置に置きます。マウスの皮膚を消毒するために、皮膚消毒剤(材料表参照)を使用してください。その後、尖った鉗子と外科用はさみを使用して、インギナル領域の真ん中に約3〜4mmの切開を行います。手順の概略図については、 図 2 を参照してください。
- 皮下脂肪組織を細かく尖った鉗子の助けを借りて慎重に取り除き、近位大腿神経血管束を露出させる。細かい尖った鉗子を慎重に使用して、大腿骨鞘の膜を貫通する。生理食動物で湿らせた綿棒を使用して、大腿動脈(FA)を大腿神経(FN)と大腿静脈(FV)から慎重に離します。
- 近位FAを通して2つの7-0吸収可能縫合糸を渡し、2つのネクタイ間のFAをトランセクトするためにスプリングハサミを使用してダブルノットを作ります。
- 遠位FAを露出させるために、切開の下端を通して7-0吸収性縫合糸を通過し、後肢の膝の右側の領域に切開を静かにドラッグします。
- 皮下組織を慎重に脇に移動し、神経血管束を露出させる。細かい尖った鉗子を使用して大腿骨鞘の膜を突き刺し、FVおよびFNからFAを解剖する。
- 遠位FAを通して2つの7-0吸収性縫合糸を渡し、二重結び目を作る。スプリングハサミを使用して、2つのネクタイの間にFAをトランセクトします。
注:左四肢にはライゲーションは行われず、各マウスのコントロールとして働いた。 - その後、6-0吸収性縫合糸を使用して切開をステッチします。きれいなケージの暖房パッドの上にマウスを置き、回復するまでその重要なパラメータを監視し続けます。術後鎮痛薬を提供する:ブプレノルフィンs.c(48時間ごとに0.1mg / kg体重)。48時間後、飲料水中にメタミゾールを投与する(24mg/5mLの水は1日4回200mg/kgの用量に相当する)。
2. 磁気共鳴画像
注:DLFAの翌日、マウスはFA閉塞を評価するためにMRIスキャンを受けなければなりません。
- 透明な誘導室にマウスを置き、右反射が失われるまで周囲の空気中の1.5-2%イソフルランでマウスを麻酔します。
- 咬傷ホルダーを備えた加熱された動物のベッドの上にマウスを置き、レーザー制御システムで磁石の方に置きます。体温は37±1 °Cに保ちます。
- 画像取得中、周囲空気中の1.5~2%のイオブルランで麻酔を維持し、圧力プローブを用いて呼吸を監視します。
- パラメータエコー時間(TE)/繰り返し時間(TR)/フリップ角度(FA)=2 ms/12 ms/13°、4つの平均、178 x 144の取得行列を256 x 192および121スライスで3次元(3D)飛行(TOF)血管造影シーケンスを使用して、横スライスの向きの画像を取得し、0.15の等度分解を引き起こします。静脈からの信号を抑制するには、後肢に遠位に飽和スライスを配置します。
3. 臨床評価とフォローアップ
- 機能的スコアリング Tarlov スケール18,19 (表 1) を使用して、手術後 1日、 3日、5日目、7日目の機能回復を推定します。
4. 組織学的評価
- 手術の7日後、ペントバルビタール注射(115mg/kg)を適用してマウスを安楽死させる。
- パーフューズリン酸緩衝生理食塩(PBS)は、左心心室(1マウスあたり100 mL)を通して1%パラホルムアルデヒド(PFA)を含有する。マウスの両側胃腸(Gm)を4°Cで一晩4%PFAで固定する。
- 前述のプロトコル20に従ってパラフィンにサンプルを埋め込む。
- パラフィン埋め込み組織ブロックの厚さ4~5μmをミクロトームに切り取ります。丸いペンキのブラシの助けを借りて、42°Cに維持水浴に切断ティッシュセクションを置きます。
- 顕微鏡スライドを45°の角度で水中に挿入し、収集するセクションのグループの下に慎重に配置します。
- 慎重に水からスライドを持ち上げ、セクションがスライドに取り付け、37°Cのベンチトップインキュベーターで一晩乾燥させます。
- パラフィン切片のヘマトキシリン/エオシン(HE)染色を行う。
- セクションを含むスライドをスライドホルダに配置します。フレッシュキシレンの3容器を準備し、各容器にスライドを5分間入れ、切片を脱パラフィン化します。
- スライスを96%、80%、70%、50%、30%エタノール、および5分間脱イオン水に連続して浸漬して、切片を水分補給します。
- ヘマトキシリン溶液中のステインを10分間使用した。
- スライスを脱イオン水の容器に移し、水道水を5分間流してすすいます。
- 顕微鏡を使用して、ヘマトキシリン染色の強度を確認します。染色によって細胞核の同定が明確に可能な場合は、次のステップに進みます。染色強度が細胞核の同定を容易にしない場合、または染色強度が薄い場合は、ヘマトキシリン溶液にスライドを1分間置き、水で洗浄を繰り返し(ステップ4.4.4)、再度確認します。
- 5分間のエオシン-Y溶液中のカウンターステイン。
- 各々10sの期間に対して、スライスを脱イオン水30%、50%、70%、80%、96%エタノールを連続して含む容器に浸漬して、切片を脱水する。次に、各10 sの新鮮なキシレンの3つの容器に順番にセクションを置きます。
- スライドを、横断を上向きにして、顕微鏡スライドストレージマップ上に水平に配置します。スライドに十分なマウントメディアを追加し、スライドをカバースリップで取り付けます。
- パラフィン切片の免疫体化学(IHC)染色を行う。
- デパラフィン化と水分補給のステップ 4.4.1~4.4.2 を繰り返します。その後、10 mMクエン酸ナトリウムバッファーを容器に浸し、pH6、サンプルをマイクロ波で沸騰させます。
注:サンプルの過熱または過加熱は、一貫性のない染色を引き起こす可能性がありますので、10分間、沸点のすぐ下に温度を維持します。 - 次に、ベンチトップのセクションを30分間冷やします。その後、5分間、PBSで3回洗浄します。サンプルの周りを慎重に乾燥させ、疎水性ペンを使ってサンプルの周りに大きな円を描きます。.
メモ:サンプルに触れないでください。疎水性ペンでマーキングすると疎水性の境界が生じ、抗体溶液の少量の使用が容易になります。 - Pbsで10分間0.3%H2O2にセクションを入れることにより、内因性ペルオキシダーゼ活性をクエンチする。ブロックバッファーの400 μL(PBSは3%のウシ血清アルブミンと非イオン性洗剤の0.3%を含む)を加湿したチャンバ内の室温で1時間ブロックセクション。
- PBSで5分間、セクションを洗います。次に、薄めた抗CD31抗体(1:250)を100~400μL添加して、セクションを覆うほどの量を増やします。これに続いて、加湿チャンバ内で4°Cで一晩の切片をインキュベートする。
注: セクションが完全に抗体溶液で覆われていることを確認します。 - 一次抗体を取り出し、各5分間、PBSで切片を3回洗います。
- DAB濃縮物をDAB希釈液の1mLに1滴加えて3、3'-ジアミノベンジジン(DAB)混合物を調製し、よく混合する。その後、100~400 μLのDAB混合物をセクションに加え、許容可能な染色強度が観察されるまで2分間注意深く監視します。
注: セクションが DAB の混合で完全に覆われていることを確認します。 - その後、水道水を流して5分間すすります。手順 4.4.3-4.4.5 で説明されているようにヘマトキシリン染色を行います。
- ステップ4.4.6で説明したeosin-Y染色を行う。ステップ 4.4.7 で説明した脱水処理を行います。
- 取り付け媒体を使用してカバースリップでセクションを取り付けました。ImageJを使用して、前に述べたように微小血管密度とみなすことができる5つの無作為選択フィールド(40倍)におけるCD31陽性領域(%)のパーセントを推定する。
- デパラフィン化と水分補給のステップ 4.4.1~4.4.2 を繰り返します。その後、10 mMクエン酸ナトリウムバッファーを容器に浸し、pH6、サンプルをマイクロ波で沸騰させます。
5. 統計分析
- 統計解析ソフトウェアを使用して、結果を標準偏差±平均として表現し、比較に対していない t-test を実行します。 P < 0.05 は統計的に有意であると考えてください。
結果
アポエの特徴-/- マウス
DLFA手術はHLIモデルを確立するために10匹のマウスで正常に行われ、処置後に死亡したマウスはいずれも死亡しなかった。体重の変化に従うために、マウスはDLFA処置(プレDLFA)の前およびDLFA手術の7日後(ポストDLFA)の後に体重を量った。プレDLFAウェイトは29.6~38.0g(平均34.74±2.47g)、DLFA後重みは26.5~34.1g(平均30.77±2.15g)の範囲で、DLFA前の重みよりも有意に低かった(P <0.05、 図3A)。手術時間は15分から47分(麻酔時間を含まない8.82分±平均34.2分)10匹のマウスの切開サイズは3〜5mm(平均4.2±0.63mm)の範囲でした。
MRIスキャンと機能回復
MRIスキャンは、右FAの近位領域および遠位領域が灌流を示さなかったことを非常に明確に示した(図3C)、この方法の成功を示す。手術の翌日、タルロフスケールの結果は有意に減少した(P<0.05)。結果は次の日に徐々に増加しましたが、7日目まではベースラインよりも低いままでした(P < 0.05、図3B)。これらの傾向は、以前のレポート20と一致しています。マウスの後肢の両側では壊死や壊疽組織の発達は認められなかった。しかし、7匹のマウスの虚血性後肢の足は、対側側と比較して自然に伸びることができなかった。また、4匹のマウスにおける虚血性後肢の足は、対側側と比べてわずかな変色を示した(図3D)。
組織学的分析
右Gm筋肉のHE染色では、筋線維は不規則な虚血性壊死を示した。増殖衛星細胞は壊死性筋繊維を置き換え、質量および/または不規則な分散液で分布していた。筋繊維は多核マクロファージによる炎症性浸潤を示した。炎症性領域の筋繊維は正常な形態学的特徴を失い、再生筋繊維はほとんどなかった。これらの再生された筋繊維の横断切片は丸く、細胞質は赤色に染色され、1つの小さな核または複数の核が中心に位置していた。これに対し、この種の炎症パターンは左Gmでは認められなかった(図4)。GMサンプル中の血管の内皮細胞を同定するためにCD31抗体染色を行い、ImageJを用いて、各サンプルの5つの視野(40x)のそれぞれにおける微小血管密度の代理であるCD31陽性領域を評価した。虚血性後肢は非虚血側よりも有意に多くの微小血管密度を示した(P<0.05、図5)。
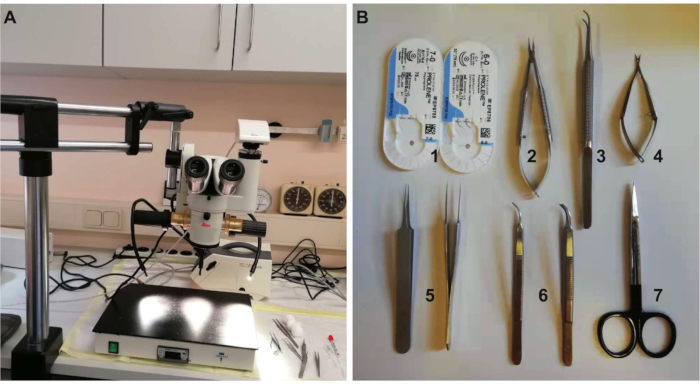
図1: 実験に必要な装置と工具( A)手術に必要な顕微鏡と加熱パッドの解剖(B)手術用具:1.7-0および6-0吸収性縫合糸、2.針ホルダー、3.歯のない鉗子、4.スプリングハサミ、5.細かい尖った鉗子、6.尖った鉗子、および7.外科用ハサミ。 この図の大きなバージョンを表示するには、ここをクリックしてください。
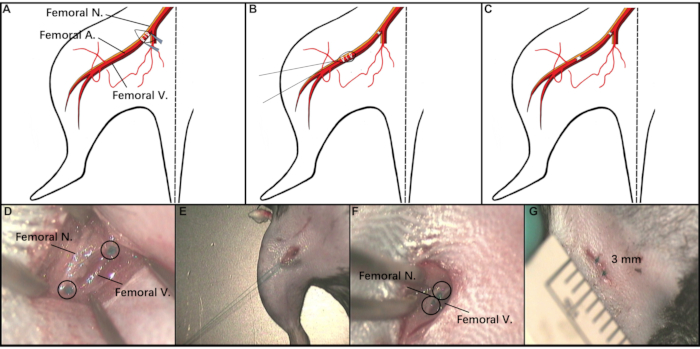
図2:手順の模式図. (AとD) 小さな切開がインギナル領域に作られ、結紮された近位大腿骨Aを露出する。(BおよびE)A6-0縫合糸を使用して、切開を膝領域にドラッグして、結紮された遠位大腿Aを露出させる。(C, F, G)切開のステッチング。略語: 大腿骨 A = 大腿動脈;大腿N=大腿神経;大腿V=大腿静脈。この図の大きなバージョンを表示するには、ここをクリックしてください。
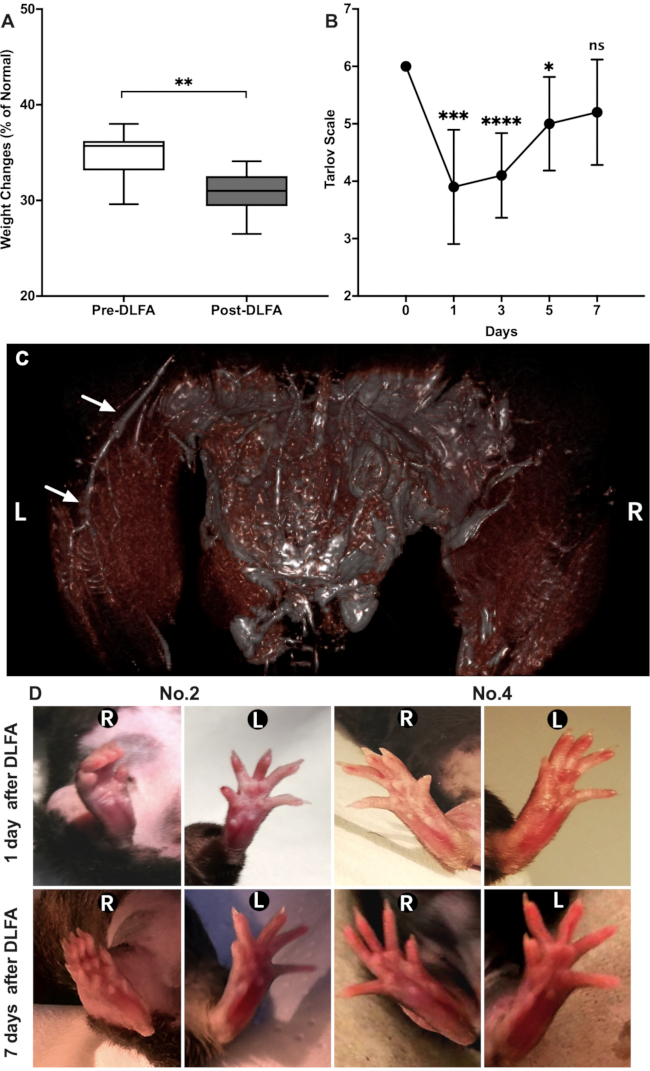
図3: PADマウスモデルの特徴(A)DLFAの前と7日後の体重の比較。(B) Tarlov スケールで評価された機能回復。(C)磁気共鳴血管造影は、左後肢(白い矢印)の近位および遠位FAを示し、右側には近位および遠位FAが消失する。(D) マウス2と4の両側後肢の出現の変化、DLFAの1および7日後。表示される値は、標準偏差±平均値です。*P < 0.05, ** P < 0.001, *** P < 0.0001, **** P < 0.00001;ペアになっていないt-test です。略語: PAD = 末梢動脈疾患;DLFA = 大腿動脈の二重結紮;FA =大腿動脈;L = 左。R = 右。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:胃腸筋のHE染色(A)DLFA処置後7日目の右GmのHE染色を示す低倍率画像。右Gm(B)では、右Gm(B)において、壊死性筋線維がマクロファージ(白矢印)による炎症性浸潤を示した。筋線維は、通常の形態学的特徴を失う。再生された筋繊維(黒い矢印)はほとんどありませんでした。(C)右Gmの正常な筋線維のHE染色(D)とは、逆側/左Gm(非虚血性)筋が正常組織学的パターンを示す。スケールバー:A = 200 μm、B-D = 50 μm。略語: HE = ヘマトキシリン-エオジン;DLFA = 大腿動脈の二重結紮;Gm = 胃腸炎;L = 左。R= 右。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:両側胃腸筋の微小血管密度の比較(A)右Gm部のCD31-IHC染色(黒矢印)。(B)左GmセクションのCD31-IHC染色(黒矢印)。(C)右側の微小血管密度の定量化は、左側のそれよりはるかに少なかった。表示される値は、標準偏差±平均値です。P < 0.00001;ペアになっていないt-test です。スケールバー:A、B = 20μm。略語: CD31 = 分化 31 のクラスター;IHC =免疫ヒストリカル;Gm = 胃腸。この図の大きなバージョンを表示するには、ここをクリックしてください。
| タルロフスコア | 0 | 動きなし |
| 1 | かろうじて知覚可能な動き、非体重負荷 | |
| 2 | 頻繁な動き、非重量軸受け | |
| 3 | 重量、部分的な重量の負担をサポート | |
| 4 | 軽度の赤字で歩く | |
| 5 | 普通だが歩きが遅い | |
| 6 | 完全かつ高速な歩行 |
表 1: 機能スコアリング
補足表S1:PADモデルの確立に関する現在の文献から25の論文の概要。このテーブルをダウンロードするには、ここをクリックしてください。
ディスカッション
この研究は、必要な実験室のアップグレードなしに3〜4mmの切開を介してFAの近位および遠位領域で二重結紮を使用してApoE-/-マウスにHLIモデルを確立するための修正され、簡素化され、外科的に効率的なアプローチを報告する。この方法の主な特徴は、マウスHLIモデル8、9、10、11、12、15、20、22、23、24を説明する以前に報告された研究と比較して、切開の小さいサイズである。
歴史的に、0.5から2cm以上の9、11、15、19、22、25、26(補足表S1に要約)の範囲で、膝からメディアに対して、きつい、りとり、あるいは腹部まで、より良い露出をするために切開がなされてきた。本論文では、5mm(4.2±0.63mm)の <切開を有するマウスにおけるDLFAおよび結果としてHLIを達成するための外科技術について説明する。FAは、大窩動脈および伏在動脈に分岐する前に結紮され、後肢のいくつかの筋肉群に虚血を引き起こし、マウスで中等度のストレスを引き起こした。マウスは手術後7日目までに機能的に回復したが(手術6日前±0、手術後1日目±0.99対7日目の手術5.2±0.92後の1日目)、Gmにおいて虚血損傷が組織学的レベルで観察された。まず、虚血性脚筋線維中のGmは不規則な虚血性壊死を示し、多核マクロファージによって浸潤した、PAD患者27,28と同様である。筋線維萎縮にもかかわらず、いくつかの再生された筋繊維も観察され、これは前回の報告29に沿ったものである。第2に、結紮後7日目の虚血性Gmにおける微小血管密度は非虚血性脚よりも高く、Ministroららでも報告されている。PAD療法における最近の焦点は、非虚血側に比べて微小血管密度を増加させるだけでなく、虚血誘発性の生存性筋組織の回復に限定されるだけでなく、成長因子および生体力学的支持体31のマトリックスを提供することによって新しい血管形成を支える虚血誘発性筋肉組織の回復に関する。したがって、このモデルはまた、これらの病巣で新しい治療法の有効性をテストするための広いウィンドウを提供する。さらに、小さい切開でHLIを達成することは、手術の細化として動物実験の3R概念に適合する、すなわち、小さな皮膚切開サイズは外傷および術後疼痛を減少させる。
理想的な動物モデルはまた比較的長い治療の窓を提供する。マウスにおける虚血を確立するための様々な外科的処置が報告され、適用され、血流回復21に対して異なる効果を発揮する。HLIの誘導のために、外科的方法は通常、腸骨動脈12、19、23、32、大腿動脈24、33、34、およびそれらの枝11、35、大腿静脈を含む一部の36、37に焦点を当てる。血管結紮のレベルは血流回復に影響を及ぼさないので、決定因子は血管樹木21における傷害の程度である。大腿骨または腸骨動脈の単一の結紮では、小さな切開が、他の枝の相互作用が維持されている間、他の枝の相互作用は維持され、マウス後肢の灌流回復は7日以内に完全に回復する21、38。したがって、単一の結紮は、異なる治療の効果を試験するのに適した治療窓を提供するという点では十分ではない。FAからの枝も結紮する必要がある場合、皮膚切開はさらに大きくする必要があり、手術時間を長くする。したがって、マウスにおけるDLFAによるHLIは、治療によって誘発される改善を効率的に監視できる適切な治療ウィンドウを提供する9、21、22、25。
臨床的に関連するHLI動物モデルの確立は、新規治療アプローチ、すなわち、細胞、幹細胞、またはPAD2、3、4のための遺伝子治療の効率をテストするために重要である。いくつかのPADモデルはマウス15、21、ラット39、およびウサギ40、41で開発されている。Del Giudiceたちの研究グループは、既存の動物モデル40の制限の一部を克服し得る較正粒子による経皮的、経大動脈、遠位大腿動脈塞栓術によって作成されたウサギの後肢虚血モデルを確立した。Liddell et al.41はまた、血管内アプローチを介して表面的なFAを巻き、後肢再灌流を減少させることによってウサギPADモデルを作成した。ウサギのような大きな動物は、より説得力のある結果を生み出すかもしれないが、40、41、治療を臨床応用に一歩近づけるかもしれないが、結果を得るためにはコストと時間の増加が必要である。
遺伝的および行動因子42を含むPADのほとんどの患者の異種リスクプロファイルにもかかわらず、ApoE-/-マウスは、総コレステロール、トリグリセリド、非常に低密度リポタンパク質、および中間密度リポタンパク質などの異常な脂肪代謝および高脂血症症状を示し、PAD患者で観察された主な特徴の一部を複製する。さらに, 高脂肪食と, これらの指標は大幅に増加します。.Lo Sasso et al. は、これらのマウスにおいて、動脈脂肪蓄積が43歳の3ヶ月で起こり、また43歳の増加とともにAS病変の増加が起こることを報告した。したがって、ApoE-/-マウスは、PAD患者によく存在する高コレステロール血症を再現し、虚血性肢の新生血管化を促進することを目的とした様々な治療法を評価するのに適したプラットフォームを提供するため、急性慢性虚血-PADモデルに特に適している。さらに、ApoE-/-マウスを用いた新規治療法のテストの価格パフォーマンス比は無敵です。
上記の段落で述べた利点にもかかわらず、このモデルには2つの制限があります。まず、この方法を習得するには、実験者が十分な微小外科的経験とマウス後肢の解剖学に精通している必要があります。第二に、ApoE-/- マウスの後肢における限られた外科的暴露および皮下脂肪組織の量は、外科的困難を増大させる。したがって、この手法をうまく実装するには、いくつかの関連する方法が必要です。結論として、この研究は、小さな切開を使用してApoE-/- マウスにHLIモデルを確立するための修正され、実装しやすく、外科的に効率的なアプローチを報告する。小さな切開は、動物への外傷を有意に減少させ、実験室のアップグレードなしでほとんどの研究グループによって適用することができる。
開示事項
著者らは、記事の内容は、潜在的な利益相反と解釈される可能性のある商業的または財政的関係がない場合に構成されたと宣言している。
謝辞
著者はヴィクトリア・スクデ、アレクサンダー・シュルンド、フェリックス・ヘルナーに優れた技術サポートをしてくれたことに感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffer saline | Roth | 9143.1 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| 30% H2O2 | Roth | 9681.2 | Used for immunohistochemistry stain |
| 6-0 absorbable sutures | PROLENE | 8776H | Used for stitching the skin |
| 6-0 absroable suture | PROLENE | EP8706 | Used in Surgery |
| 7-0 absorbable sutures | PROLENE | EH8021E | Used for ligating the artery |
| 7-0 absroable suture | PROLENE | EP8755 | Used in Surgery |
| Acetic acid | Roth | 6755.1 | Used for haematoxylin and eosin stain |
| Albumin Fraktion V | Roth | 8076.2 | Used for immunohistochemistry stain |
| Autoclave | Systec GmbH | Systec VX-150 | Used for the sterilisation of the surgical instruments |
| Axio vert A1 microscope | Carl Zeiss | ZEISS Axio Vert.A1 | Used for viewing and taking the pictures from haematoxylin and eosin stain and immunohistochemistry stain |
| Bruker BioSpec 94/20 AVIII | Bruker Biospin MRI GmbH | N/A | Scan the femoral artery blockage |
| Buprenovet Sine 0,3mg/ml | Bayer AG | 2542 (WDT) | Used in post operative pain-management. Dose - 0.1 mg/kg body weight every 8 hours for 48 h after operation |
| CD31 antibody | Abcam | ab28364 | Used for immunohistochemistry stain |
| Eosin Y solution 0.5 % in water | Roth | X883.1 | Used for haematoxylin and eosin stain |
| Epitope Retrieval Solution pH 6 | Leica Biosystems | 6046945 | Used for immunohistochemistry stain |
| Ethanol ≥ 99,5 % | Roth | 5054.1 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| Fentanyl | Cayman Chemical | 437-38-7 | Used for anesthesia |
| Fine point forceps | Medixplus | 93-4505S | Used for separating the artery from nerve and vein |
| Glass bead sterilisator | Simon Keller | Type 250 | Used for sterilisation of the surgical instruments |
| Graefe iris forceps curved | VUBU | VUBU-02-72207 | Used for blunt separation of skin and subcutaneous tissue |
| Hair Remover cream, Veet (with aloe vera) | Reckitt Benckiser | 108972 | Remove hair from mice hind limbs |
| Heating plate | STÖRK-TRONIC | 7042092 | Keep the satble temperature of mice |
| Hematoxylin | Roth | T865.2 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
| Leica surgical microscope | Leica | M651 | Enlarge the field of view to facilitate the operation |
| Liquid DAB+Substrate Chromogen System | Dako | K3468 | Used for immunohistochemistry stain |
| Male ApoE-/- mice | Charles River Laboratories | N/A | Used for establish the Peripheral artery disease mice model |
| Medetomidine | Cayman Chemical | 128366-50-7 | Used for anesthesia |
| Micro Needle Holder | Black & Black Surgical | B3B-18-8 | Holding the needle |
| Micro suture tying forceps | Life Saver Surgical Industries | PS-MSF-145 | Used to assist in knotting during surgery |
| Microtome | Biobase | Bk-Mt268m | Used for tissue sectioning |
| Midazolam | Ratiopharm | 44856.01.00 | Used for anesthesia |
| MR-compatible Small Animal Monitoring and Gating System Model 1025 | SA Instruments | N/a | monitoring vital signs of animal during MRI scan |
| Octeniderm farblos | Schülke & Mayr GmbH | 180212 | used for disinfection of the skin |
| Ointment for the eyes and nose | Bayer AG | 1578675 | Keep the eyes wet under the anesthesia |
| Paraformaldehyde | Roth | 0335.1 | Used for fixation of the tissue |
| Pentobarbital | Nembutal | 76-74-4 | Used for anesthesia |
| Saline | DeltaSelect | 1299.99.99 | Used for anesthesia |
| Spring handle scissors with fine, sharp tips | Black & Black Surgical | B66167 | Used for cutting the artery |
| SuperCut Scissors | Black & Black Surgical | B55992 | Used for cutting the skin |
| Triton X-100 | Roth | 9002-93-1 | Used for immunohistochemistry stain |
| Western diet, 1.25% Cholesterol | ssniff Spezialdiäten GmbH | E15723-34 | Diet for the mice |
| Xylene | Roth | 4436.3 | Used for haematoxylin and eosin stain and immunohistochemistry stain |
参考文献
- Shu, J., Santulli, G. Update on peripheral artery disease: Epidemiology and evidence-based facts. Atherosclerosis. 275, 379-381 (2018).
- Tateishi-Yuyama, E., et al. Therapeutic angiogenesis for patients with limb ischaemia by autologous transplantation of bone-marrow cells: a pilot study and a randomised controlled trial. Lancet. 360 (9331), 427-435 (2002).
- Wang, Z. X., et al. Efficacy of autologous bone marrow mononuclear cell therapy in patients with peripheral arterial disease. Journal of Atherosclerosis and Thrombosis. 21 (11), 1183-1196 (2014).
- Botham, C. M., Bennett, W. L., Cooke, J. P. Clinical trials of adult stem cell therapy for peripheral artery disease. Methodist Debakey Cardiovascular Journal. 9 (4), 201-205 (2013).
- van Weel, V., et al. Vascular endothelial growth factor overexpression in ischemic skeletal muscle enhances myoglobin expression in vivo. Circulation Research. 95 (1), 58-66 (2004).
- Olea, F. D., et al. Vascular endothelial growth factor overexpression does not enhance adipose stromal cell-induced protection on muscle damage in critical limb ischemia. Arteriosclerosis, Thrombosis, and Vascular Biology. 35 (1), 184-188 (2015).
- Peeters Weem, S. M. O., Teraa, M., de Borst, G. J., Verhaar, M. C., Moll, F. L. Bone marrow derived cell therapy in critical limb ischemia: a meta-analysis of randomized placebo controlled trials. European Journal of Vascular and Endovascular Surgery. 50 (6), 775-783 (2015).
- Crawford, R. S., et al. Divergent systemic and local inflammatory response to hind limb demand ischemia in wild-type and ApoE-/- mice. Journal of Surgical Research. 183 (2), 952-962 (2013).
- Niiyama, H., Huang, N. F., Rollins, M. D., Cooke, J. P. Murine model of hindlimb ischemia. Journal of Visualized Experiments: JoVE. (23), e1035(2009).
- Brenes, R. A., et al. Toward a mouse model of hind limb ischemia to test therapeutic angiogenesis. Journal of Vascular Surgery. 56 (6), 1669-1679 (2012).
- Peck, M. A., et al. A functional murine model of hindlimb demand ischemia. Annals of Vascular Surgery. 24 (4), 532-537 (2010).
- Lejay, A., et al. A new murine model of sustainable and durable chronic critical limb ischemia fairly mimicking human pathology. European Journal of Vascular and Endovascular Surgery. 49 (2), 205-212 (2015).
- Nagase, H., Yao, S., Ikeda, S. Acute and chronic effects of exercise on mRNA expression in the skeletal muscle of two mouse models of peripheral artery disease. PLoS One. 12 (8), 0182456(2017).
- Fu, J., et al. Hydrogen molecules (H2) improve perfusion recovery via antioxidant effects in experimental peripheral arterial disease. Molecular Medicine Reports. 18 (6), 5009-5015 (2018).
- Yu, J., Dardik, A. A murine model of hind limb ischemia to study angiogenesis and arteriogenesis. Methods in Molecular Biology. 1717, 135-143 (2018).
- Pu, L. Q., et al. Enhanced revascularization of the ischemic limb by angiogenic therapy. Circulation. 88 (1), 208-215 (1993).
- Takeshita, S., et al. Therapeutic angiogenesis. A single intraarterial bolus of vascular endothelial growth factor augments revascularization in a rabbit ischemic hind limb model. Journal of Clinical Investigation. 93 (2), 662-670 (1994).
- Tarlov, I. M. Spinal cord compression studies. III. Time limits for recovery after gradual compression in dogs. AMA Archives of Neurology and Psychiatry. 71 (5), 588-597 (1954).
- Westvik, T. S., et al. Limb ischemia after iliac ligation in aged mice stimulates angiogenesis without arteriogenesis. Journal of Vascular Surgery. 49 (2), 464-473 (2009).
- Hellingman, A. A., et al. Variations in surgical procedures for hind limb ischaemia mouse models result in differences in collateral formation. European Journal of Vascular and Endovascular Surgery. 40 (6), 796-803 (2010).
- Liu, Q., et al. CRISPR/Cas9-mediated hypoxia inducible factor-1α knockout enhances the antitumor effect of transarterial embolization in hepatocellular carcinoma. Oncology Reports. 40 (5), 2547-2557 (2018).
- Padgett, M. E., McCord, T. J., McClung, J. M., Kontos, C. D. Methods for acute and subacute murine hindlimb ischemia. Journal of Visualized Experiments: JoVE. (112), e54166(2016).
- Pellegrin, M., et al. Experimental peripheral arterial disease: new insights into muscle glucose uptake, macrophage, and T-cell polarization during early and late stages. Physiological Reports. 2 (2), 00234(2014).
- Sun, Z., et al. VEGF-loaded graphene oxide as theranostics for multi-modality imaging-monitored targeting therapeutic angiogenesis of ischemic muscle. Nanoscale. 5 (15), 6857-6866 (2013).
- Craige, S. M., et al. NADPH oxidase 4 promotes endothelial angiogenesis through endothelial nitric oxide synthase activation. Circulation. 124 (6), 731-740 (2011).
- Kant, S., et al. Neural JNK3 regulates blood flow recovery after hindlimb ischemia in mice via an Egr1/Creb1 axis. Nature Communications. 10 (1), 4223(2019).
- Chevalier, J., et al. Obstruction of small arterioles in patients with critical limb ischemia due to partial endothelial-to-mesenchymal transition. iScience. 23 (6), 101251(2020).
- Kosmac, K., et al. Correlations of calf muscle macrophage content with muscle properties and walking performance in peripheral artery disease. Journal of the American Heart Association. 9 (10), 015929(2020).
- Mohiuddin, M., et al. Critical limb ischemia induces remodeling of skeletal muscle motor unit, myonuclear-, and mitochondrial-domains. Scientific Reports. 9 (1), 9551(2019).
- Ministro, A., et al. Assessing therapeutic angiogenesis in a murine model of hindlimb ischemia. Journal of Visualized Experiments: JoVE. (148), e59582(2019).
- Kilarski, W. W., Samolov, B., Petersson, L., Kvanta, A., Gerwins, P. Biomechanical regulation of blood vessel growth during tissue vascularization. Nature Medicine. 15 (6), 657-664 (2009).
- Portou, M. J., et al. Hyperglycaemia and ischaemia impair wound healing via Toll-like receptor 4 pathway activation in vitro and in an experimental murine model. European Journal of Vascular and Endovascular Surgery. 59 (1), 117-127 (2020).
- Dokun, A. O., et al. A quantitative trait locus (LSq-1) on mouse chromosome 7 is linked to the absence of tissue loss after surgical hindlimb ischemia. Circulation. 117 (9), 1207-1215 (2008).
- Hazarika, S., et al. MicroRNA-93 controls perfusion recovery after hindlimb ischemia by modulating expression of multiple genes in the cell cycle pathway. Circulation. 127 (17), 1818-1828 (2013).
- Fan, W., et al. mTORC1 and mTORC2 play different roles in the functional survival of transplanted adipose-derived stromal cells in hind limb ischemic mice via regulating inflammation in vivo. Stem Cells. 31 (1), 203-214 (2013).
- Terry, T., et al. CD34(+)/M-cadherin(+) bone marrow progenitor cells promote arteriogenesis in ischemic hindlimbs of ApoE(-)/(-) mice. PLoS One. 6 (6), 20673(2011).
- Kwee, B. J., et al. Treating ischemia via recruitment of antigen-specific T cells. Science Advances. 5 (7), (2019).
- Nakada, M. T., et al. Clot lysis in a primate model of peripheral arterial occlusive disease with use of systemic or intraarterial reteplase: addition of abciximab results in improved vessel reperfusion. Journal of Vascular and Interventional Radiology: JVIR. 15 (2), Pt 1 169-176 (2004).
- Carr, A. N., et al. Efficacy of systemic administration of SDF-1 in a model of vascular insufficiency: support for an endothelium-dependent mechanism. Cardiovascular Research. 69 (4), 925-935 (2006).
- Del Giudice, C., et al. Evaluation of a new model of hind limb ischemia in rabbits. Journal of Vascular Surgery. 68 (3), 849-857 (2018).
- Liddell, R. P., et al. Endovascular model of rabbit hindlimb ischemia: a platform to evaluate therapeutic angiogenesis. Journal of Vascular and Interventional Radiology: JVIR. 16 (7), 991-998 (2005).
- Aboyans, V., et al. 2017 ESC guidelines on the diagnosis and treatment of peripheral arterial diseases, in collaboration with the European Society for Vascular Surgery (ESVS): Document covering atherosclerotic disease of extracranial carotid and vertebral, mesenteric, renal, upper and lower extremity arteriesEndorsed by: the European Stroke Organization (ESO)The Task Force for the Diagnosis and Treatment of Peripheral Arterial Diseases of the European Society of Cardiology (ESC) and of the European Society for Vascular Surgery (ESVS). European Heart Journal. 39 (9), 763-816 (2018).
- Lo Sasso, G., et al. The Apoe(-/-) mouse model: a suitable model to study cardiovascular and respiratory diseases in the context of cigarette smoke exposure and harm reduction. Journal of Translational Medicine. 14 (1), 146(2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved