Method Article
메카노생물학적 연구를 위한 궤도 셰이커에 6웰 플레이트에서 내피 세포의 분할 성장
요약
본 프로토콜은 궤도 셰이커 모델을 사용하여 전단 응력 응용을 위한 6웰 플레이트의 특정 영역으로 내피 세포 성장을 제한하는 코팅 방법을 설명한다.
초록
혈액의 흐름에 의해 동맥 벽에 부과 된 전단 스트레스는 내피 세포 형태와 기능에 영향을 미칩니다. 낮은 크기, 진동 및 다방향 전단 응력은 모두 내피 세포에서 프로 죽상 경화성 표현형을 자극하기 위해 가정되어 왔지만, 반면 높은 크기와 단방향 또는 단방향 또는 단방향 전단은 내피 집집성을 촉진하는 것으로 생각된다. 이러한 가설은 추가 조사를 필요로하지만, 전통적인 체외 기술은 한계가 있으며, 세포에 다방향 전단 응력을 부과하는 특히 가난합니다.
점점 더 많은 사용을 얻고 있는 한 가지 방법은 궤도 셰이커의 플랫폼에 표준 다중 우물 판에서 내피 세포를 배양하는 것입니다. 이 간단하고 저렴한 고처리량 및 만성 방법에서 소용돌이 치는 매체는 다방향 전단을 포함한 다양한 패턴과 전단의 크기를 우물의 다른 부분에서 생성합니다. 그러나, 한 영역의 세포는 한 가지 유형의 흐름에 노출되어, 다른 흐름에 노출된 웰의 다른 부분에서 세포에 영향을 미치는 배지로 중재자를 방출할 수 있으므로 흐름과 표현형 사이의 명백한 관계를 왜곡할 수 있다.
여기서 우리는 세포가 특정 전단 응력 특성에만 노출 될 수있는 방법의 쉽고 저렴한 수정을 제시한다. 세포 파종은 섬유넥틴으로 관심 영역을 코팅한 다음 통과 용액을 사용하여 통과함으로써 우물의 정의된 영역으로 제한됩니다. 이어서, 플레이트는 셰이커에 소용돌이칠 수 있으며, 그 결과 위치에 따라 저크기 다방향 전단 또는 높은 크기의 단방향 전단과 같은 잘 정의된 전단 프로파일에 세포가 노출될 수 있다. 이전과 마찬가지로 표준 세포 배양 플라스틱웨어를 사용하면 세포에 대한 간단한 추가 분석이 가능합니다. 수정은 이미 잘의 다른 곳에 있는 세포에 영향을 미치는 정의된 전단 응력 특성의 밑에 내피성에서 풀어 놓인 수용성 중재자의 데모를 허용했습니다.
서문
그들의 기계적 환경에 혈관 세포의 반응은 혈관의 정상적인 기능과 질병1의발달에서 중요하다. 모든 혈관의 내부 표면을 일렬로 세이는 내피 세포(EC)의 기계생물학은 EC가 혈류에 의해 생성되는 전단 스트레스를 직접 경험하기 때문에 메카노생물학적 연구의 특정 초점이었습니다. 염증 반응, 변형된 강성 및 형태학, 혈관 활성 물질의 방출 및 접합 단백질의 국소화 및 발현과 같은 다양한 표현성 변화는 전단 응력2,3,4에EC 노출에 의존한다. 전단 의존성 내피 특성은 죽상 동맥 경화증5,6,7과같은 질병의 패치 개발을 설명할 수도 있다.
응력을 제어할 수 있는 문화권에서 전단이 IC에 미치는 영향을 연구하는 것이 유용하며, 다른 세포 유형으로부터 EC를 분리할 수 있습니다. 일반적으로 전단 응력적용을 위해 시험관내 장치에 사용되는 경우 병렬 플레이트 흐름 챔버와 원뿔 및 플레이트 바이코커만 포함하지만, 단원성 안정성, 진동 및 맥동유만8,9를적용할 수 있다. 스테노틱 기하학을 모방하는 테이퍼 또는 분기 형상 및 미세 유체 칩이 있는 수정된 유동 챔버가 개발되었지만, 낮은 처리량과 상대적으로 짧은 배양 기간은도전 10, 11을제기한다.
궤도 셰이커의 플랫폼에 배치된 표준 세포 배양 플라스틱웨어에서 세포가 재배되는 내피 메카노트랜스덕션 연구를 위한 궤도 셰이커(또는 소용돌이 잘 잘 돌리는) 방법은 만성적으로 복잡하고 공간적으로 다양한 전단 응력 패턴을 높은 처리량으로 EC에 부과할 수 있기 때문에 주목받고 있다(또는 소용돌이 잘 잘 돌리는) 방법(Warboys etalal12참조). 전산 유체 역학(CFD) 시뮬레이션은 소용돌이치는 우물에서 전단 응력의 공간 적 및 측두적인 변화를 특성화하기 위해 사용되었습니다. 플레이트가 배치되는 셰이커 플랫폼의 궤도 이동에 의해 야기되는 배양 배지의 소용돌이 운동은 6웰 플레이트의 우물 가장자리에 있는 중앙 및 고진도 동축 흐름(HMUF, 또는 putheroprotectionprotection flow)의 저진도 다방향 흐름(LMMF 또는 putativeandpro-atherogenic flow)으로 이어집니다. 예를 들어, 시간 평균 벽 전단 응력(TAWSS)은 중앙에 약 0.3Pa, 5mm 궤도 반경13로150rpm에서 소용돌이치는 6웰 플레이트 가장자리에서 0.7 Pa이다. 이 방법은 시판되는 플라스틱 제품과 궤도 셰이커 자체만 필요합니다.
그러나, 방법(및 시험관내에서 흐름을 부과하는 다른 방법에 대한 단점)에 대한 단점이 있다: EC는 전단 의존성 방식으로 용해성 중재자 및 미세입자를방출14,15,16 및 이 분비물은 소용돌이 치는 매체의 혼합으로 인해 방출된 것 이외의 우물의 영역에서 EC에 영향을 미칠 수 있다. 이것은 EC 표현형에 전단 응력의 실제 효력을 마스크할 수 있습니다. 예를 들어, Ghim 외는 이것이 큰 입자의 세포간 수송에 대한 다른 전단 프로파일의 명백히 동일한 영향을 차지한다고추측했다(17).
여기서 우리는 플루론 F-127을 사용하여 표면을 통과시키고 다른 곳에서 성장을 방지하는 동안 섬유네틴 코팅을 사용하여 6웰 플레이트의 특정 영역에서 인간 배빌루칼 정맥 내피 세포(HUVEC) 접착을 촉진하는 방법을 설명한다. 이 방법은 셀 성장을 분할함으로써 EC가 한 종류의 전단 프로파일만 경험하고 우물의 다른 다른 프로파일에 노출된 다른 프로파일에 노출된 EC의 분비에 의해 영향을 받지 않기 때문에 위에서 설명한 한계를 해결합니다.
프로토콜
1. 장치 제조 및 시약 준비
- 스테인레스 스틸 모듈 의 제조
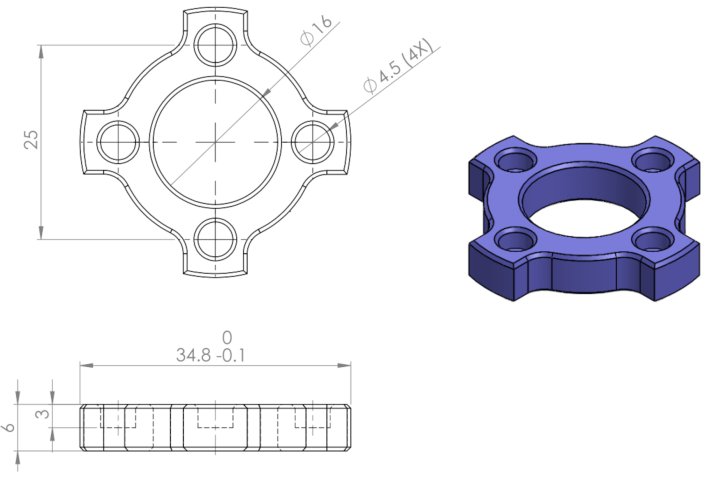
- 제공된 엔지니어링 도면에 따라 CNC 밀링 머신을 사용하여 316등급 스테인리스 스틸 모듈을 제조한다(도1).
- 폴리디메틸실록산(PDMS) 금형의 3D 프린팅
- 제공된 엔지니어링 도면에 따라 SolidWorks를 사용하여 PDMS 금형의 3D 컴퓨터 지원 설계(CAD) 모델을 준비한다(그림2).
- CAD 모델을 STL 파일로 내보내고 STL 파일을 큐라 2.6.2로 가져옵니다.
- 50mm/s의 인쇄 속도와 60%의 채우기 밀도로 모델을 레이어로 슬라이스합니다.
- 파일을 G 코드로 내보내고 인쇄를 위해 Ultimaker2 3D 프린터에 업로드합니다. 폴리락산(PLA)을 인쇄재료로 사용한다.
- PDMS 링 주조
- PDMS 베이스 및 경화제(실리콘 엘라스토머 키트에서 모두)를 90.9% 염기 및 9.1%의 경화제의 비율로 혼합합니다.
- 잘 혼합된 용액의 약 2.6mL을 3D 인쇄 금형에 붓습니다.
- 진공 탈기 챔버에서 거품을 제거합니다.
- 80°C 용광로에서 1h로 치료합니다.
- PDMS 링이 실온으로 냉각된 다음 경화 된 PDMS 링을 금형에서 조심스럽게 제거합니다. PDMS 링의 엔지니어링 도면은 그림 3에표시됩니다.
- 1% 푸론 F-127 의 준비
- 플러론 F-127 5 g의 무게를 내걸고 유리 병에 붓고 100mL의 멸균물을 유리 병에 넣습니다. 이것은 5 % 플로론 F-127 솔루션을 제공합니다.
- 모든 플로론 F-127 분말이 물에 잠기고 캡을 닫고 액체 살균 주기 프로그램을 사용하여 자동 복제되도록 하십시오.
- 오토클레이브 후 사용 전에 실온으로 용액을 식히십시오.
- 10mL5% 플로론 F-127 용액을 40mL의 오토클레이브 멸균 수에 추가하여 1% 플로론 F-127 용액을 만듭니다. 바이오 세이프티 캐비닛(BSC) 후드에서 희석을 수행합니다.
- 실온에서 1%와 5%의 플로론 F-127을 모두 보관하십시오.
- 4% 파라포름알데히드(PFA) 준비
- 800mL의 인산염 완충식식염(PBS)을 유리 비커에 넣고 교반하는 동안 60°C로 가열합니다(1.5.1단계에서 1.5.5단계부터 교반유지).
- PFA 파우더 40g의 무게를 달고 따뜻한 PBS 용액에 추가합니다.
주의: PFA는 연기 후드에서 1.5.2 ~ 1.5.6 단계를 수행하며 위험합니다. - 1M 수산화나트륨(NaOH)을 PFA 용액에 천천히 떨어뜨려 용액이 맑아질 때까지 넣습니다.
- PFA 용액의 pH를 염산산(HCl)의 1M로 약 7.4로 조정한다.
- 1X PBS로 1L로 솔루션을 위로 합니다. 이것은 4 % PFA의 1 L을 제공합니다.
- PFA 용액을 0.2 μm 필터로 필터링하여 미립자, 알리쿼트 및 동결을 -20°C 냉동고에서 제거합니다.
- 0.1% 트리톤-X 의 준비
- 순수한 트리톤 X 50 μL을 PBS 50mL에 추가하여 0.1% 트리톤-X 용액을 만듭니다.
- 1% 소 세럼 알부민 (BSA) 준비
- BSA의 무게 0.5 g, 50 mL 원심 분리기 튜브에 부어, 다음 튜브에 PBS의 50 mL을 추가.
- 롤러의 실온에서 1시간 동안 굴려 녹입니다.
- 최대 2주 동안 4°C에 1% BSA를 보관하십시오.
2. 6 웰 플레이트의 코팅
- 자동 클러브 스테인레스 스틸 모듈, PDMS 링 및 핀셋을 사용하기 전에 사용하십시오. BSC 후드에서 모든 후속 절차를 수행하고 멸균을 보장하기 위해 무균 기술을 관찰하십시오.
- 핀셋을 사용하여 PDMS 링을 6웰에 배치합니다. PDMS 링의 외부 림을 사용하여 PDMS 링을 웰과 동심으로 정렬합니다.
참고: 잘 처리된 비조직 배양만 사용해야 합니다. - 핀셋을 사용하여 PDMS 링 위에 스테인리스 스틸 모듈을 배치합니다.
- 내부 고정 링 펜치의 팁을 고정 링의 그립 구멍에 삽입하고 홀더를 짜서 고정 링의 직경을 줄입니다. 6웰에 맞추어 스테인리스 스틸 모듈에 단단히 누르고 펜치를 놓아 PDMS 링을 잘 고정하십시오.
- PDMS 링 및 스테인레스 스틸 모듈의 개방을 통해 5 μg /mL 섬유 네틴의 1 mL을 우물의 중심 또는 가장자리에 추가합니다 (관심 영역에 따라 다름).
- 섬유넥틴 용액이 관심의 모든 영역을 커버할 수 있도록 플레이트를 소용돌이.
- 95% 공기/5% CO2하에서 가습된 인큐베이터에서 37°C에서 30분 동안 배양한다.
- 잘에서 섬유 네틴 용액을 제거하고 PBS로 두 번 세척합니다. 완전히 우물에서 PBS를 제거합니다.
- 웰에서 고정 링, 스테인레스 스틸 모듈 및 PDMS 링을 제거합니다.
- 1%의 플루론 F-1271을 1.5mL의 플루론 F-127을 웰의 중앙 또는 가장자리에 넣고(코팅되지 않은 표면)을 실온에서 1시간 동안 배양하여 코팅되지 않은 표면을 통과시합니다.
- 플루론 F-127 용액을 우물에서 제거하고 PBS로 세 번 세척하십시오.
- 코팅된 코팅을 즉시 사용하거나 코팅된 PBS 층으로 최대 2주 동안 4°C에 보관하십시오.
3. 후브의 씨앗
- 실험에서 5번 통로 아래 의 HUVEC를 사용하십시오.
- PBS로 모든 배양 배지를 제거하고 세포를 한 번 세척하십시오.
- 95% 공기/5% CO2하에서 가습된 인큐베이터에서 37°C에서 3분 동안 3mL의 트립신과 인큐베이터를 3분 간 첨가한다. 플라스크를 부드럽게 눌러 세포를 빼냅니다.
참고: 이 프로토콜은 HUVEC를 사용하여 테스트되었으며 트립신의 농도와 그 잠복기는 다른 유형의 EC와 다를 수 있습니다. - 용액을 15mL 원심분리기 튜브로 이송하고 37°C로 예온된 6mL의 배양 배지(예를 들어, Lonza EGM-2)를 사용하여 트립신을 중화한다.
- 원심 분리기 200 x g에서 5 분 동안. 중화 트립신 용액을 제거하고 예온 배양 배지의 1 mL로 세포를 다시 중단합니다.
- 전동 배양 배지의 1.5mL에서 혈우세포계와 종자 180k 세포를 코팅된 6웰 플레이트로 셀을 계산한다.
- 우물 판을 측면으로 흔들어 세포가 우물에서 균등하게 분포되도록 합니다.
- 하룻밤 사이에 95% 공기/5% CO2 하에서 37°C 가습 인큐베이터에 둡니다.
- 부착되지 않은 세포 및 배양 배지를 제거하고 예온 배양 배지의 2mL로 대체하십시오.
참고: 배지에 떠있는 많은 부착되지 않은 셀이 예상됩니다.
4. 궤도 셰이커를 사용하여 전단 응력 응용 프로그램
- HUVECs는 성장 3 일 후에 합류에 도달해야합니다. 배지를 예온 배양 배지의 1.9mL로 교체하십시오(높이 2mm).
- 95% 공기/5% CO2 아래가습된 인큐베이터에 궤도 셰이커의 플랫폼에 판을 놓고 3일 동안 150rpm에서 소용돌이를 휘두십시오.
참고: 인큐베이터에 넣기 전에 70% 에탄올을 사용하여 궤도 셰이커의 외부 표면을 닦아냅니다. - (선택 사항) 전단 2 일 후, 사이토카인은 사이토카인과 전단 스트레스 사이의 상호 작용을 조사하기 위해 배양 배지에 첨가 할 수 있습니다. 치료 후, 다른 하루 동안 세포를 전단. 이 연구에서는 TNF-α 세포를 활성화하는 데 사용되었습니다.
- 전단 응력 적용 3일 후에 분석을 수행합니다.
5. 세포의 염색 및 이미징
- 3 일간의 전단 후, 인큐베이터에서 접시를 제거하고 PBS로 셀을 두 번 세척하십시오.
- 우물에 4% PFA의 1.5 mL을 추가하여 세포를 고정하고 실온에서 10 분 동안 배양하십시오.
- 우물에서 4 % PFA를 제거하고 PBS로 두 번 씻으시면됩니다.
- 우물에 0.1% 트리톤 X를 추가하여 세포를 충혈하고 실온에서 5 분 동안 배양합니다.
- 우물에서 0.1% 트리톤-X 용액을 제거하고 1% BSA의 1.5mL을 블로킹을 위해 우물에 추가합니다. 실온에서 1 시간 동안 1 % BSA로 세포를 배양하십시오.
- 토끼 항인간 ZO-1 항체를 1:200 희석시 1% BSA로 희석하였다. 희석 된 항체의 1.5 mL을 우물에 넣고 4 °C에서 하룻밤 동안 세포로 배양하십시오.
- 하룻밤 잠복 후, 희석 된 항체를 제거하고 PBS로 세포를 세 번 세척하십시오.
- 희석 알렉사 플루어 488 라벨 염소 안티 토끼 IgG 이차 항체에 1:300 PBS에서 희석. 희석된 이차 항체 1.5mL을 우물에 넣고 실온에서 1시간 동안 세포와 함께 배양합니다.
- 희석 된 이차 항체를 제거하고 PBS로 두 번 세포를 세척하십시오.
- PBS에서 1:1000의 희석으로 DRAQ5를 희석하십시오. 희석 된 DRAQ5 1.5 mL을 우물에 넣고 실온에서 15 분 동안 세포와 배양하여 세포 핵을 얼룩지게합니다.
- 희석 된 DRAQ5를 제거하고 PBS로 세 번 세척하십시오.
- 공초점 현미경으로 우물의 중심으로 가장자리에서 타일 스캔을 수행합니다.
6. 모양 지수 및 셀 수의 정량화
- 후면 MATLAB R2016a를 사용하여 이미지를 처리합니다.
- 공초점 현미경에서 MATLAB로 LIF 파일을 읽고 병합된 타일 스캔을 이진 이미지로 변환한 다음 영역과 강도별로 이미지를 임계값으로 임계값을 지정하여 핵을 배경과 구별합니다.
- 이진 타일 스캔을 1mm 방사형 세그먼트로 세분화합니다.
- 각 개별 핵에 타원을 맞춥시게 한다.
- 각 방사형 세그먼트 내의 타원 수를 계산하여 셀 번호를 지정합니다.
- 셰이프 인덱스 = SI = 4π x 영역/둘레2로정의합니다. 각 타원에 대한 셰이프 인덱스를계산합니다(18)
결과
섬유넥틴으로 코팅되지 않은 웰 플레이트의 영역에 HUVECs의 접착은 Pluronic F-127 패시비션에 의해 파괴되었다; 성장은 전단 응력적용(도 4A, 도 4C)의사용 및 없이 72h 문화의 후에도 섬유네틴으로 코팅된 부위에 국한되었다. 플루론 F-127 패시베이션없이, HUVECs는 섬유 네틴없이 표면에 부착하고 문화의 72 h에 의해 더 확산했다(그림 4B, 도 4D).
HUVECs의 정렬 및 신장은 HMUF가있는 소용돌이 우물의 가장자리에서 분명하며, LMMF가있는 우물의 중심에있는 세포는 조약돌 형태와 정렬 없음을 나타내었다(도 5A, 도 5B). HUVECs의 신장은 형상 인덱스로 정량화되었다: 4π x 영역/둘레2. 셰이프 인덱스가 1인 경우 원을 나타내고 값0은 선을 나타냅니다. 모양 지수는 중심에서 방사형 거리로 감소했으며, 분할된 우물과 전체 우물 사이에는 큰 차이가 없었습니다. TNF-α 처리는 처리되지 않은 대조군(도 5C)에비해 HUVEC의 신장을 증가시다. HMUF는 또한 두 조건 모두에서 LMMF에 비해 mm2당 HUVEC의 수를 증가시켰습니다. 반지름을 따라 거리로 HUVEC의 수가 점차 증가했습니다. 세분화된 및 전체우물(그림 6)에서재배된 HUVEC의 수에서 유의한 차이가 관찰되지 않았다.
치수는 mm입니다.

그림 2 PDMS 금형의 엔지니어링 도면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
치수는 mm입니다.

그림 3 우물을 분할하는 데 사용되는 PDMS 링의 엔지니어링 도면.
치수는 mm입니다. 기용 외13에서.

도 4현미경 이미지는 Pluronic F-127이 섬유네틴 코팅없이 지역에 인간 탯정맥 내피 세포 (HUVECs) 접착을 방지함을 보여주는.
24시간(A) 및 72h(C) 성장 후, 플루론 F-127로 패시션 하기 전에 섬유네틴으로사전 처리되지 않은웰 표면의 일부에 HUVEC가 부착되지 않았다. 후록F-127 패시베이션 없이, HUVEC는 파종후24h파성 후 섬유네틴(24h)없이 표면에 부착되었고 72h(D)로 더 증식하였다. (배율 막대 = 500 μm). 기용 외13에서.

그림 5분할 또는 전체 우물에서 시어드 HUVECs의 형태.
핵(적색) 얼룩은 중앙에 있는 시어드 후브(A)의 형태와 (B)의 형태를 전체 우물의 가장자리에 나타낸다(스케일 바 = 100 μm). A와 B는 또한 ZO-1(녹색)의 면역 염색에 의해 묘사된 세포 윤곽선을 보여줍니다. 가장자리에서 세포의 정렬 및 신장을 참고하지만 중앙 (C)에서 하지 않는 핵 형상 지수에 유의한 차이, 전체 우물에서 자란 HUVEC 사이의 둥근 경위를 나타내는 처리되지 않은 또는 TNF-α 처리 HUVEC에 대해 볼 수 있었다. 세포는 우물의 가장자리 근처에 더 길었다. TNF-α 처리된 HUVECs에서 더 큰 신장을 위한 경향은 지역 전반에 걸쳐 일관되게 중요하지 않았습니다. (양방향 ANOVA와 본페로니의 포스트 호크 테스트; n = 3). 이 그림은 김 등에서수정되었습니다. 13

그림 6 mm2당 HUVEC의 수는 소용돌이 치는 웰 플레이트에서 방사형 거리로 증가했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
(A) 처리되지 않은 밀도와 (B) TNF-α 처리된 HUVECs의 밀도에서 전체 및 분할 된 우물 사이에는 다른 방사형 위치에서 유의한 차이가 관찰되지 않았습니다. 두 경우 모두, 우물의 중심보다 가장자리에 단위 영역 당 더 많은 세포가 있었다. (양방향 ANOVA와 본페로니의 포스트 호크 테스트; n = 3). 이 수치는 김 외13에서수정되었습니다.
토론
소용돌이 잘 하는 방법은 단일 우물에서 복잡한 흐름 프로파일을 생성할 수 있습니다- 중앙에 낮은 크기 다방향 흐름 (LMMF) 및 웰의 가장자리에 높은 크기 동방 흐름 (HMUF). 그러나, 용해 성 중재자의 전단 응력 매개 분비물은 소용돌이 배지에서 혼합되고 전체적으로 세포에 영향을 미치며, 잠재적으로 세포에 특정 전단 응력 프로파일의 진정한 효과를 마스킹한다.
여기서 입증된 코팅 방법은 세포의 성장을 우물의 특정 영역으로 제한함으로써 이러한 문제점을 극복한다. 세포는 전형적으로 소수성 표면보다는 소수성 표면에 부착합니다. 이러한 이유로 폴리스티렌 배양 도자기는 플라즈마 산화로 사전 처리됩니다. 대안적으로, 소수성 표면은 이 프로토콜에서 입증된 바와 같이 섬유네틴과 같은 세포외 매트릭스 단백질로 코팅될 수 있다; 비섬유넥틴 코팅 부위는 소수성 표면에 대한 잔류 접착을 방지하기 위해 Pluronic F-127로 통과되었다.
이 프로토콜은 인쇄된 금형의 정확도에 따라 달라집니다. 3D 프린터에 따라 금형의 정확한 치수가 변할 수 있습니다. 이렇게 하면 최종 PDMS 구성에 영향을 미치므로 셀이 웰 내에서 잘못된 위치에 준수됩니다. 따라서 세포는 CFD를 모델링한 전단 응력 프로파일을 경험합니다. 3D 프린터를 사용하는 또 다른 단점은 인쇄 중에 뒤틀기 때문에 금형이 평평하지 않을 수 있다는 것입니다. 이로 인해 최종 PDMS 구조로 인해 플루론 F-127이 누출되어 세포가 원하는 위치에 준수되는 것을 방지할 수 있습니다. 따라서 사용하기 전에 누수를 확인하고 PDMS 구성의 크기를 측정하는 것이 중요합니다.
이 방법은 특정 유형의 전단 응력(HMUF 또는 LMMF)을 세포에 적용하도록 허용하는 데 간단하면서도 효과적입니다. 또한 대부분의 소모품, 시약 및 장비를 시판할 수 있으므로 설치가 편리합니다. 이 방법을 사용하면 잘 정의된 흐름에 노출된 세포의 검사 또는 수확을 허용할 뿐만 아니라 해당 세포에 의해 조절된 중간 체채를 허용합니다. 이 방법은 내피 성 메카노생물학을 조사하는 새로운 길을 제공합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 감사하게 영국 심장 재단 프로젝트 보조금을 인정 (PDW), 국립 의학 연구 위원회 싱가포르 TAAP 및 DYNAMO 보조금 (XW, NMRC / OFLCG/ 004/2018, NMRC / OFLCG / 0017), A * 스타 대학원 장학금 (KTP에), 및 연구 우수 의 영국 심장 재단 센터 (MAP에).
자료
| Name | Company | Catalog Number | Comments |
| Cell and Media | |||
| Endothelial Growth Medium (EGM-2) | Lonza | cc-3162 | |
| Human Umbilical Vein Endothelial Cells | NA | NA | Isolated from cords obtained from donors with uncomplicated labour at the Hammersmith Hospital |
| Reagents and Materials | |||
| Alexa Fuor 488-labelled goat anti-rabbit IgG | Thermofisher Scientific | A11008 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Falcon 6 Well Clear Flat Bottom Not Treated | Scientific Laboratory Supplies Ltd | 351146 | |
| Fibronectin from Bovine Plasma | Sigma-Aldrich | F1141-5MG | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Phosphate-Buffered Saline | Sigma-Aldrich | D8537-6X500ML | |
| Pluronic F-127 | Sigma-Aldrich | P2443 | |
| Recombinant Human TNF-a | Peprotech | 300-01A | |
| RS PRO 2.85 mm Black PLA 3D Printer Filament, 1 kg | RS | 832-0264 | |
| Stainless Steel 316 | Metal Supermarket | NA | |
| Sylgard184 Silicone Elastomer kit | Farnell | 101697 | |
| Triton X-100 | Sigma-Aldrich | X100-100ML | |
| Trypsin-EDTA solution | Sigma-Aldrich | T4049-100ML | |
| Zonula Occludens-1 (ZO-1) antibody | Cell Signaling Technology | 13663 | |
| DRAQ5 (5mM) | Bio Status | DR50200 | |
| Equipments | |||
| Grant Orbital Shaker PSU-10i | Scientific Laboratory Supplies Ltd | SHA7930 | |
| Leica TCS SP5 Confocal Microscope | Leica | NA | |
| Retaining Ring Pliers | Misumi | RTWP32-58 | |
| Retaining Rings/Internal/C-Type | Misumi | RTWS35 | |
| Ultimaker 2+3-D printer | Ultimaker | NA | |
| Softwares | |||
| Cura 2.6.2 | Ultimaker | NA | |
| MATLAB | The MathWorks | NA | |
| Solidworks 2016 | Dassault Systemes | NA |
참고문헌
- Hahn, C., Schwartz, M. A. Mechanotransduction in vascular physiology and atherogenesis. Nature Reviews Molecular Cell Biology. 10 (1), 53-62 (2009).
- Wang, C., Baker, B. M., Chen, C. S., Schwartz, M. A. Endothelial Cell Sensing of Flow Direction. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (9), 2130-2136 (2013).
- Tzima, E., et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress. Nature. 437, 426-431 (2005).
- Potter, C. M. F., Schobesberger, S., Lundberg, M. H., Weinberg, P. D., Mitchell, J. A., Gorelik, J. Shape and compliance of endothelial cells after shear stress in vitro or from different aortic regions: Scanning ion conductance microscopy study. PLoS ONE. 7 (2), 1-5 (2012).
- Asakura, T., Karino, T. Flow Patterns and Spatial Distribution of Atherosclerotic Lesions in Human. Circulation Research. 66 (4), 1045-1067 (1990).
- Bond, A. R., Iftikhar, S., Bharath, A. A., Weinberg, P. D. Morphological evidence for a change in the pattern of aortic wall shear stress with age. Arteriosclerosis, Thrombosis, and Vascular Biology. 31 (3), 543-550 (2011).
- Giddens, D. P., Zarins, C. K., Glagov, S. The role of fluid mechanics in the localization and detection of atherosclerosis. Journal of biomechanical engineering. 115, 588-594 (1993).
- Schnittler, H. J., Franke, R. P., Akbay, U., Mrowietz, C., Drenckhahn, D. Improved in vitro rheological system for studying the effect of fluid shear stress on cultured cells. The American journal of physiology. 265, 289-298 (1993).
- Levesque, M. J., Nerem, R. M. The elongation and orientation of cultured endothelial cells in response to shear stress. Journal of biomechanical engineering. 107 (4), 341-347 (1985).
- Chiu, J., et al. Analysis of the effect of disturbed flow on monocytic adhesion to endothelial cells. Journal of Biomechanics. 36 (12), 1883-1895 (2003).
- Venugopal Menon, N., et al. A tunable microfluidic 3D stenosis model to study leukocyte-endothelial interactions in atherosclerosis. APL Bioengineering. 2 (1), 016103 (2018).
- Warboys, C. M., Ghim, M., Weinberg, P. D. Understanding mechanobiology in cultured endothelium: A review of the orbital shaker method. Atherosclerosis. 285, 170-177 (2019).
- Ghim, M., Pang, K. T., Arshad, M., Wang, X., Weinberg, P. D. A novel method for segmenting growth of cells in sheared endothelial culture reveals the secretion of an anti-inflammatory mediator. Journal of Biological Engineering. 12 (1), 15 (2018).
- Sage, H., Pritzl, P., Bornstein, P. Secretory phenotypes of endothelial cells in culture: comparison of aortic, venous, capillary, and corneal endothelium. Arteriosclerosis. 1 (6), 427-442 (1981).
- Tunica, D. G., et al. Proteomic analysis of the secretome of human umbilical vein endothelial cells using a combination of free-flow electrophoresis and nanoflow LC-MS/MS. Proteomics. 9, 4991-4996 (2009).
- Griffoni, C., et al. Modification of proteins secreted by endothelial cells during modeled low gravity exposure. Journal of Cellular Biochemistry. 112, 265-272 (2011).
- Ghim, M., et al. Visualization of three pathways for macromolecule transport across cultured endothelium and their modification by flow. American Journal of Physiology-Heart and Circulatory Physiology. 313 (5), 959-973 (2017).
- Levesque, M. J., Liepsch, D., Moravec, S., Nerem, R. M. Correlation of endothelial cell shape and wall shear stress in a stenosed dog aorta. Arteriosclerosis: An Official Journal of the American Heart Association, Inc. 6 (2), 220-229 (1986).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유