Method Article
세포 전 형 구조의 슈퍼 해상도 라이브 세포 이미징
요약
여기에 제출된 것은 손상되지 않은 조직에서 초해상도 라이브 세포 이미징을 위한 프로토콜입니다. 우리는 그것의 네이티브 조직 환경에 있는 높게 민감한 성인 줄기 세포 인구를 화상 진찰을 위한 조건을 표준화했습니다. 이 기술은 살아있는 조직에서 생물학적 현상의 직접적인 관찰을 허용하는 시간적 및 공간 해상도의 균형을 포함한다.
초록
이미징에서 공간과 시간적 해상도 사이에는 오랫동안 중요한 절충이 있었습니다. 빛의 회절 한계를 넘어 화상 진찰은 전통적으로 강한 형광 신호로 표지된 조직의 외부의 고정 된 견본 또는 살아있는 세포에만 이용되는 것을 제한되었습니다. 현재 의수분해능 라이브 셀 이미징 기술은 특수 형광 프로브, 높은 조명, 인수 후 처리를 사용한 여러 이미지 수집 또는 종종 이러한 프로세스의 조합을 사용해야 합니다. 이러한 전제 조건은 이 기술이 적용될 수 있는 생물학적 샘플 및 컨텍스트를 크게 제한합니다.
여기서는 시투에서 수퍼 분해능(~140nm XY-해상도) 시간 경과 형광 라이브 세포 이미징을 수행하는 방법을 설명합니다. 이 기술은 또한 낮은 형광 강도와 호환, 예를 들어, EGFP 또는 mCherry 내인성 낮은 발현 유전자에 태그. 원칙의 증거로, 우리는 Drosophila 고환에 있는 다중 세포극 구조물을 구상하기 위하여 이 방법을 이용했습니다. 조직 준비 중, 세포 구조와 조직 형태는 해부 된 고환 내에서 유지된다. 여기서는 이 기술을 사용하여 마이크로튜블러 역학, 마이크로투블러와 핵멤브레인 간의 상호 작용, 미로펠에 대한 마이크로투블러 부착을 이미지화합니다.
이 기술은 시료 준비, 시료 장착 및 시편의 고정에 특별한 절차가 필요합니다. 추가적으로, 견본은 세포 기능 및 활동을 손상시키지 않고 해부 후에 몇 시간 동안 유지되어야 합니다. 우리는 Drosophila 남성 생식선 줄기 세포 (GSCs) 및 해부 된 고환 조직에서 선천성 세균 세포에서 특히 살아있는 슈퍼 해상도 이미징을위한 조건을 최적화했지만,이 기술은 다양한 다른 세포 유형에 광범위하게 적용됩니다. 공간적 또는 현세적 해상도를 희생하지 않고 생리학적 조건하에서 세포를 관찰하는 능력은 세포 생물학에서 중요한 질문을 해결하려는 연구진에게 귀중한 도구가 될 것입니다.
서문
빛의 회절 한계를 넘어 분해와 라이브 세포에서 세포 극체 구조 및 단백질 역학을 시각화하는 것은 일반적으로 매우 도전1-3. 스토차스-광학-재건-현미경 검사법(STORM), 사진 활성화-국소화-현미경검사(PALM) 및 자극-방출 고갈(STED)4,5,6 현미경 검사법과 같은 다수의 초해상도 기술이 개발되었지만, 표본 제제의 합병증뿐만 아니라 생존력 및 활동 전 생체 내 사용을 유지해야 할 필요성뿐만 아니라 종래의 초심 마이크로 이미징의 사용을 제한한다. 종래의 공초점 현미경 검사는 ~230nm XY 해상도를 넘어 공간 해상도에 도달할 수 없으며 복잡한 세포 하위 구조를 관찰하기에는 종종 충분하지 않습니다5,6. 그러나, 최근 공초점 현미경검사, Airyscan 초해상도 이미징의 개발은 약 140nm(XY-해상도)7,8을 달성할 수 있으며, 라이브 이미징과 호환되는 비교적 간단한 시료 제제를 갖는다. 이 이미징 감지 시스템은 긴 수집 시간이 필요하기 때문에 높은 공간 해상도는 시간적 해상도9의비용으로 제공됩니다. 따라서 라이브 셀 이미징이 높은 공간 해상도로 확장되도록 하는 방법이 필요합니다.
여기서, 우리는 상세한 공간 정보로 세포 극체 구조를 해독하기 위한 최적 해상도로 그대로 조직으로 살아있는 세포를 관찰하는 방법을 개발했습니다. 이 방법은 시료를 이동하거나 퇴행성없이 장시간(~10시간) 동안 안정적으로 장착할 수 있도록 설계되었습니다. 이 기술에 사용되는 살아있는 세포 매체는 세포 기능을 지원하고 초해상도 현미경으로 최대 10 시간 동안 표백을 피할 수 있습니다. 마지막으로, 이 프로토콜은 저산소증, 습도 및 온도 의 변화, 영양소 피로와 같은 오랜 기간 동안 레이저의 지속적인 조명으로 인한 대부분의 스트레스를 최소화합니다.
이 프로토콜을 사용하여 Drosophila 남성 생식선 줄기 세포 (GSC)를 이미지, 우리는 마이크로 투비의 비대칭 활동이 후생 유전학적으로 구별 자매 크로마티드와 우선 상호 작용을 허용하는 방법을 관찰 할 수 있었다10,11,12,13. 이러한 유형의 세포 이벤트는 매우 역동적이며 STORM, PALM 또는 STED와 같은 다른 초해상도 이미징 방법을 사용하여 라이브 셀에서 시각화하기가 매우 어렵습니다. 우리는 이 방법이 조직에 거주하는 살아있는 세포의 동적 세포 극성 구조를 이해하는 것을 목표로 세포 생물학자에게 매우 유용해질 것으로 예상합니다. 이 방법은 단백질의 역학을 공부하는 것과 같은 많은 지역에 적용될 수 있습니다; 세포의 움직임을 이해; 및 계보 추적 및 셀룰러 분화 프로세스, 다른 가능한 응용 프로그램 중.
프로토콜
1. 라이브 셀 이미징 칵테일 준비 (라이브 셀 미디어)
- 15% 태아 소 혈청 (FBS) 및 0.6 x 페니실린 /연쇄 절제술을 가진 슈나이더의 Drosophila 매체를 보충합니다. pH를 약 7.0으로 조정합니다.
- 매체를 사용하기 직전에 인슐린을 200 μg/mL의 최종 농도에 추가하십시오.
참고: 이 매체는 시간 경과 영상10,14동안 Drosophila 고환의 정상적인 세포 분열 및 발달을 유지하는 데 중요합니다.
2. 유리 바닥 세포 배양 접시의 준비
- 드로소필라 고환을 위해 직경 35mm의 폴리 L-리신 코팅 유리 바닥 세포 배양 접시를 사용하십시오. 접시의 내부 우물은 직경 23mm의 유리 바닥과 1mm의 고도가있는 면을 가지고 있습니다(그림 1A-a).
참고: 작업 거리가 짧고 숫자 조리개가 크고 배율 목표가 높은 유리 바닥 접시를 선택합니다. 이러한 기능은 초해상도 이미지를 얻는 데 매우 중요합니다. - 기체 교환을 허용하는 투석 막(MWCO: 12-14kD)을 사용하십시오. 멤브레인을 작은 조각으로 자른다.
참고 : 멤브레인 조각은 접시의 유리 영역보다 작아야하지만 표본을 덮을 만큼 충분히 커야합니다. - 100 μL의 라이브 셀 미디어로 멤브레인을 흡수하십시오 . 그것은 그것을 손상시킬 수 있으므로, 샘플에 건조 멤브레인을 사용하지 마십시오. 멤브레인은 저산소 스트레스를 방지하는 데 도움이됩니다.
- 조직이 떠 있지 않도록 멤브레인에 넣을 2-3 개의 경량 유리 또는 플라스틱 조각을 준비하십시오. 이렇게하려면 먼저 50 mL 원심 분리기 튜브의 외부 링을 가져 와서 작은 조각으로 자릅니다. 그런 다음 사용하기 전에 70 % 에탄올로 조각을 살균하십시오.
참고: 이 단계는 샘플이 이미징 중에 표면에 남아 있고 최적의 결과를 얻는 데 중요한 부동하지 않도록 합니다. - 직경 25mm의 링을 준비하고 접시의 높은 쪽에 놓습니다. 커버슬립을 두 개의 챔버를 생성합니다. 상부 챔버는 샘플이 건조되는 것을 방지하기 위해 습도 챔버 역할을하는 동안 하단 챔버는 샘플을 포함합니다.
- 이 링을 만들려면 50mL 원심분리기 튜브에서 외부 링을 잘라 35mm 접시의 높은 측면에 단단히 맞출 수 있습니다. 유사한 링은 다른 방법으로 만들 수 있습니다,예를 들어, 고무 밴드 또는 플라스틱 트위스트 넥타이를 사용하여 제대로 샘플을 방해하지 않고 커버 슬립을 유지하기 위해 접시의 높은 측면에 맞게.
참고: 이 단계는 특히 저산소 조건과 같은 스트레스에 민감한 샘플및 온도 및 습도의 변화에 매우 중요합니다.
- 이 링을 만들려면 50mL 원심분리기 튜브에서 외부 링을 잘라 35mm 접시의 높은 측면에 단단히 맞출 수 있습니다. 유사한 링은 다른 방법으로 만들 수 있습니다,예를 들어, 고무 밴드 또는 플라스틱 트위스트 넥타이를 사용하여 제대로 샘플을 방해하지 않고 커버 슬립을 유지하기 위해 접시의 높은 측면에 맞게.
3. 수컷 파리와 장착에서 고환의 해부
- ~10명의 젊은 남성 파리(2~3일)를 복용하여 라이브 셀 미디어에서 고환을 해부하여 ~10쌍의 드로소필라 성인 고환을 얻습니다.
- 미세 한 집게를 사용하여 해부 접시에 해부 현미경으로 파리를 해부.
참고: 드로소필라 멜라노가스터(과일 플라이) 균주는 초기 세균 세포 드라이버 nanos-Gal4에 의해 구동되는 UAS-α-Tubulin-GFP 트랜스진을 운반합니다. - CRISPR-Cas9 기술을 사용하여 다음과 같은 노크인 드로소필라 멜라노가스터 균주를 생성합니다: 라빈-mCherry(C-말단 태그) 및 CENP-A-Dendra2-CENP-A [내부 사이트 태그(118-119번째 코돈 사이).
참고: 각 실험에 우수한 품질의 하나의 고환만 있으면 충분한 수의 조직(15-20) 또는 세포를 장착하면 시간 경과 이미징을 위한 우수한 형광 신호가 있는 적어도 하나의 건강한 샘플이 있는지 확인할 수 있습니다.
- 미세 한 집게를 사용하여 해부 접시에 해부 현미경으로 파리를 해부.
- 해부 접시에 라이브 셀 미디어에서 두 번 고환을 세척합니다.
- 파이펫을 사용하여 미디어를 추가한 다음 라이브 셀 미디어를 세척 단계로 제거합니다.
- 집게를 사용하여 과도한 조직을 제거하십시오. 여분의 조직은 이미징을 방해할 것입니다.
참고: 특정 세포 성분의 역학에 영향을 줄 수 있기 때문에 세척에 인산염 완충식식염(PBS)을 사용하지 마십시오.
- 100-150 μL의 라이브 셀 미디어를 접시에 넣고(2.1단계에서 준비)하고 파이펫 팁을 사용하여 유리 표면에 퍼드세요. 표면에 미디어를 확산하면 조직이 제대로 접시에 충실 할 수 있습니다.
- 고환을 미세한 집게를 사용하여 접시에 옮기고 접시의 중앙으로 가져온다(그림1A-b).
참고: 이미징을 방해하고 이미지의 품질을 저하시킬 수 있으므로 이물질을 옮기지 마십시오. - 조직이 평평해지고 접시에 제대로 붙일 수 있도록 과도한 라이브 셀 미디어(약 10μL의 미디어 를 남겨주세요)를 제거하십시오. 이 단계를 신속하게 수행하여 시료건조를 방지합니다.
- 전습멤브레인(2.2단계 및 2.3단계에서 제조)을 고환 위에 놓습니다(도1A-c).
- 2-3개의 작은 플라스틱 가중치(2.4단계에서 제조)를 멤브레인에 넣어 시료가 부유하지 않도록 하고 라이브 셀 미디어의 100-150 μL(그림1A-d)을빠르게 추가합니다.
참고: 미디어를 빠르고 부드럽게 추가하면 샘플이 건조하거나 변위되지 않도록 합니다. - 접시의 높은 쪽에 플라스틱 링 (2.5 단계에서 준비)을 놓습니다(그림 1B-a).
- 링 위에 22mm x 22mm 커버슬립을 놓습니다(그림1B-b). 이렇게 하면 두 개의 챔버가 생성됩니다.
- 티슈 페이퍼 를 가져 가서 물로 감은 다음 소용돌이쳐 커버 슬립에 올려 습한 챔버(그림 1B-c)를만듭니다. 접시의 뚜껑을 닫고(그림 1B-d)라이브 세포 이미징을 시작합니다.
참고: 샘플이 빛에 민감한 경우 어두운 에서 섹션 3을 수행합니다.
4. 드로소필라 남성 생식선 줄기 세포 (GSC)의 라이브 세포 이미징
- 초해상도 현미경 아래에 접시를 놓고 무대 클램프로 고정하십시오.
- 이미징 소프트웨어를 열고, 전달된 빛을 켜고, 63x 목표를 사용하여 초점 노브를 사용하여 고환 조직에 집중합니다.
참고: 63x 목표의 샘플을 찾는 데 어려움이 있는 경우 먼저 40배 또는 20배 목표를 사용하여 63x로 전환합니다. - 레이저를 켜고 라이브를클릭하고 최적의 위치와 조건으로 GSC를 찾습니다. 낮은 형광 신호가 있거나 허브(틈새 시장)가 표면에서 멀리 떨어져 있는 고환을 피하십시오.
참고: 드로소필라 고환에서는 GSC가 허브에 부착됩니다.
- 이미징 소프트웨어를 열고, 전달된 빛을 켜고, 63x 목표를 사용하여 초점 노브를 사용하여 고환 조직에 집중합니다.
- GSC의 초점을 조정하고 레이저 전력, 전자 곱셈(EM) 게인, 평균 및 Airyscan 모드의 확대/축소를 포함하여 시료에 적합한 설정을 식별합니다. 초기 단계 세균 세포에서 EGFP 태그 α-tubulin을 표현하는 Drosophila 고환에 대한 예로 다음 설정을 사용합니다.
- 프레임크기를 클릭하여 프레임 크기를 512 x 512 픽셀과 1024 x 1024 픽셀 사이로 설정합니다.
- 평균을 클릭하여 프레임 평균을 1 또는 2로 설정합니다.
참고: 프레임 크기(>1024 x 1024 픽셀)를 늘리고 평균(즉, 2개 이상)을 수행하면 광표백이나 광독성이 발생할 수 있습니다. - 레이저를 클릭하여 레이저 전력을 1%-2%로 설정합니다.
참고: 레이저 전력을 증폭하면 광표백이나 광독성이 발생할 수도 있습니다. - 마스터 게인을클릭하여 EM 게인을 권장 수준(< 800)보다 낮게 설정합니다.
참고: EM 이득이 높을수록 아티팩트가 생성될 수 있습니다. - 영역 또는 관심 셀을 확대하여 이미지 수집 시간을 줄이고 광표백을 줄입니다. 이것은 또한 견본이 더 긴 시간 동안 살아남을 수 있습니다.
- 실험 시작을클릭하여 Airyscan 모드를 사용하여 시간 경과 이미지 캡처를 시작합니다.
- 실험 시작을클릭하기 전에 획득이 최적으로 구성된지 확인합니다.
- "Airyscan 획득이 최적으로 구성되지 않음"이라는 알림과 함께 경고가 표시되면 프레임 크기 섹션에서 최적 을 클릭하고 z 스택 섹션에서 최적 을 클릭하고 스캔 영역 섹션에 대한 최적 섹션을 클릭합니다 (초해상도 이미징에는 최소 1.3 줌이 필요합니다).
- 실험 설계 및 시편의 유형에 따라 시간 간격, z-슬라이스 수 및 시간 경과 이미징의 지속 시간을 최적화하여 이미지의 품질이 손상되지 않고 세포가 세포 주기의 특정 단계에서 체포되지 않도록 합니다.
- 예를 들어, 초기 생식선에서 EGFP 태그α-tubulin을 표현하는 Drosophila 고환의 시간 경과 화상 진찰을 위한 매개 변수는 다음 단계에 도시된다.
- 5시간 이상의 시간 경과 이미징의 경우 1% 레이저 출력으로 10분 간격으로 이미지를 만들고 매 시점에서 최대 30z-슬라이스를 사용합니다.
- 마이크로투블러 역학과 같은 매우 역동적인 세포 공정의 경우 시간 지점 간에 2분 간격을 설정하고, 1% 레이저 출력으로 1-2시간 시간 경과 이미징을 수행하고, 매 시 최대 30z-슬라이스를 사용합니다.
- 초기 텔로위상 크로마틴 역학(2-3분 이벤트)까지의 드문 세포 이벤트의 경우, 시간 지점 사이의 간격이 1분 간격으로 라이브 셀 이미징을 설정하고, 1% 레이저 파워에서 30분 타임랩스 이미징을 수행하고, 매 시점에서 최대 30z-슬라이스를 복용합니다.
참고: 이러한 매개 변수는 샘플마다 다를 수 있으므로 특정 샘플에 대한 최적의 사용을 위해 변경이 필요합니다.
- 샘플의 감도와 실험 설계에 따라 타임랩스 이미징 또는 라이브 스냅샷 이미징을 수행합니다.
참고: 단편 영화는 15~30분이며, 긴 영화는 5시간 이상입니다. - 샘플이 매우 민감하고 초해상도 현미경으로 시간 경과 이미징에 의해 연구될 수 없는 경우, Drosophila 남성 GSC의 경우와 마찬가지로, 다른 세포 주기 단계에서 샘플의 초해상도 라이브 스냅샷(SRLS)을 수행한다(도 2, 도 3, 도 4).
- 희귀 세포 생물학적 이벤트가 포착되거나 관심 있는 단백질이 발현 수준이 낮은 경우 SRLS를 수행하십시오.
- SRLS의 경우 관심 있는 특정 세포 주기 단계에서 셀을 찾으십시오. 예를 들어, 미세 투부 -키네토초레 바인딩에 초점을 맞춘 경우, 다음 prometaphase 또는 메타 단계에서 세포를 사용합니다.
참고: 이것은 당신이 더 긴 영화 도중 생길 수 있는 형광료의 견본 또는 표백에 광독성을 위험하지 않고 적시에 관심있는 세포의 고품질 심상을 얻는 것을 도울 것입니다. - SRLS를 사용하는 경우 여러 셀에 걸쳐 관심의 다른 세포 주기 단계를 이미지하 고 연대 순으로 이러한 이미지를 정렬 합니다.
참고: 신호 및 조직 건강을 극대화하면서 일시적인 이벤트를 구성하여 특히 민감한 샘플이나 낮은 신호가 있는 시료에 대한 이벤트의 탁월한 시간적 분해능을 얻을 수 있습니다.
5. 라이브 셀 이미지의 에어리스캔 처리
- 이미징 소프트웨어로 이미지 수집 후 처리를선택하고 배치를클릭한 다음 Airyscan 처리를 선택합니다.
- 처리할 이미지를 선택한 다음 Run/Process를 클릭하여 초해상도 이미지를 가져옵니다.
- 기본 설정을 사용하여 처리를 수행합니다.
참고: Airyscan 처리는 Airyscan 이미징에 대해 이미징 설정이 제대로 설정된 경우에만 작동합니다.
결과
Drosophila 조직에 있는 회절 한계를 넘어 살아있는 세포 화상 진찰, 특히 GSCs를 위해, 세포 주기 진행의 맥락에서 세포 극성 사건의 역학을 조사할 기회를 제공합니다. 최근, 이 프로토콜을 이용한 연구는 어머니 중심에서 미세수염 활동이 딸 중심체에 비해 일시적으로 GSC10에서비대칭임을 보여주었다. 어머니 중추는 미토틱 입력 전에 약 4 시간 전에 마이크로 투하를 방출하는 반면, 딸 중심은 미토시스발병시 미세투부류만 방출합니다. 어머니 중등에서 고도로 활동적인 마이크로튜브는 핵막과 상호 작용하고 편광 핵 봉투 분해(NEBD)를 유도한다. 현지 NEBD는 허브에 근위체이며 어머니 중심에서 미세 투삽이 핵에 들어가고 더 강한 자매 운동 장및 자매 센트로메트어에 우선적으로 부착하여 미래의 줄기 세포로 분리되도록 합니다. 이러한 관측은 미세투부, 핵막, 키네토콜레 및 센트로메트가 궁극적으로10,11,12에적절한 비무작위 염색체 분리를 보장하기 위해, 빈자리 조절 방식으로 상호 작용하는 비대칭 미토틱축이 존재한다는것을 시사한다.
이러한 각 결과는 여기에 설명된 SRLS 접근 방식을 사용하여 지원되었습니다. 초기 단계 세균 세포에서 α-tubulin-GFP를 표현하는 Drosophila 고환의 살아있는 세포 화상 진찰을 수행해서, 우리는 GSCs에서 microtubule 활동에서 측두엽 비대칭을 확인할 수 있었습니다(그림 2). 우리는 또한 회전 디스크 공초점 현미경(도 2A)을사용하여 어머니 중심체에서 밝은 신호와 딸 중심측에서 상대적으로 약한 신호로 두 중심체에서 GFP 신호의 비대칭 강도를 볼 수 있었다. 밝기의 차이는 미세투포클 핵의 측두체 비대칭에 의해 반영될 가능성이 높지만, 미세투부의 상세한 형태와 양은 회전 디스크 공초점 현미경검사법(그림2A)을사용하여 해결할 수 없었다. 대조적으로, 살아있는 세포 초해상도 화상 진찰은 우리가 형태를 시각화하고 마이크로투블러의 수를 정량화하는 것을 허용했습니다(그림 2B). 그것의 향상된 해상도는 비대칭 미세투포핵의 패턴을 드러냈습니다, 신장, 및 핵막과의 상호 작용 증가(도 2B). 예를 들어, α-튜툴린-GFP 표현 GSC의 타임랩스 영화는 1차 연구 논문(동영상 S3 및 비디오 S5)10에게재되었다.
다음으로, 우리는 Drosophila 고환에 살아있는 세포 화상 진찰을 1 단계 세균 세포에 있는 Lamin-MFp와 α-Tubulin-GFP 또는 α-Tubulin-mCherry를 가진 공동 표현했습니다. 우리의 결과는 비대칭 미세tubule 활동이 GSC에서 비대칭 NEBD와 일치한다는 것을 보여줍니다(그림 3). 회전 디스크 공초점 현미경을 사용하여, 우리는 직접 핵을 입력 개별 마이크로 투튜플하지만 비대칭 핵 막 질(도 3A)을시각화 할 수 있습니다. 대조적으로, 이 살아있는 세포 슈퍼 해상도 기술은 우리가 마이크로투알과 핵 라미나 둘 다(그림 3B)를화상 진찰하여 이 사건을 직접 관찰하는 것을 허용했습니다.
다음으로, 우리는 초기 단계 세균 세포에 있는 α-Tubulin-mCherry 및 CENP-A-Dendra2 또는 CENP-A-GFP (Centromere 단백질 A)를 표현하는 Drosophila 고환에 살아있는 세포 화상 진찰을 수행했습니다. 마이크로튜블러와 센트로메어 부착물을 더 잘 시각화하기 위해, 우리는 그들의 부착을 안정화하기 위해 낮은 온도(~18°C)에서 이미지를 이미지화합니다. 필요한 경우, 샘플은 마이크로투블러-센트로메르 부착을 안정화하고 부착되지 않은 마이크로튜블러를 분해하기 위해 4-5분 동안 얼음 또는 얼음냉이 살아있는 세포 매체로 잠시 냉각될 수 있다. 우리의 결과는 초기 활성 어머니 중심에서 방출되는 마이크로 투부가 더 강한 자매 센트로메르(그림 4)에우선적으로 부착한다는 것을 보여줍니다. 회전 디스크 공초점 현미경을 사용하여 α-Tubulin-mCherry 신호는 두 센트로솜 근처의 비대칭 밝기를 표시했습니다. 우리는 또한 도 4A (메타페이드)에 도시된 바와 같이 두 자매 중심을 하나의 신호로 검출할 수 있었지만, 마이크로튜블러-센트로메르 부착물(도4A, 메타페이드)을시각화할 수 없었다. 대조적으로, 슈퍼 해상도 라이브 이미징은 우리가 마이크로 튜블러 -centromere 부착(도 4B)을시각화 할 수 있었습니다. 우리의 결과는 어머니 중구 방출 마이크로 투부가 딸 중심 방출 마이크로 투튜플(그림 4B,초기 prophase)에 앞서 센트로메어에 부착한다는 것을 보여줍니다.
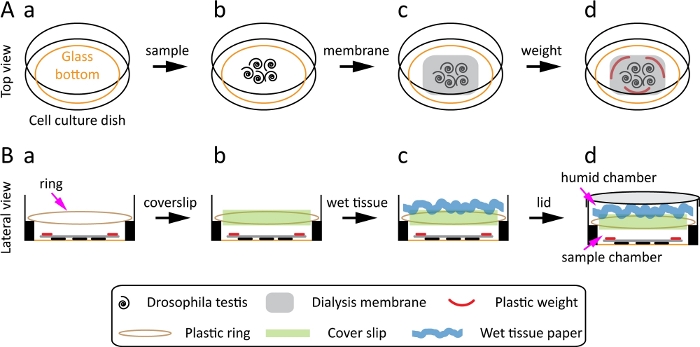
그림 1: 드로소필라 고환의 준비 및 장착을 위한 계획입니다. (A)상단 보기: 유리 바닥 세포 배양 접시(A-a), 드로소필라 고환을 접시(A-b)의 중심으로 옮기고, 고환(A-c)의 상단에 투석막을 놓고 투석막(A-d)에 3개의 플라스틱 무게를 놓습니다. (B)측면 보기: 플라스틱 링을 접시(B-a)의 높은 쪽에 놓고, 플라스틱 링(B-b)에 22mm × 커버슬립을 놓고, 커버슬립(B-c)에 소용돌이및 젖은 티슈 페이퍼를 놓고 뚜껑(B-d)로 접시를 닫는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
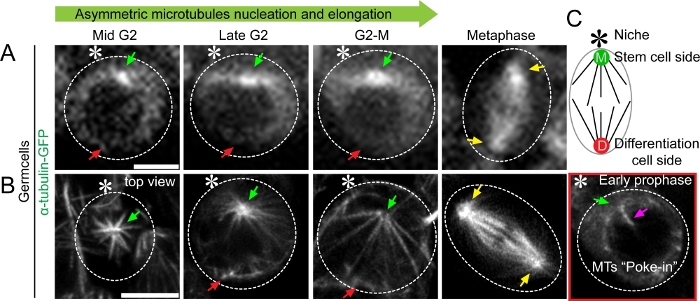
도 2: 드로소필라 조직(testes)에서 마이크로튜블러 역학의 초분해능 시간 경과 이미징을 통해 α-tubulin-GFP(A) 종래의 공초점 현미경 라이브 세포 영상을 발현하여 G2 단계에서 미세투필 역학을 형이상으로 나타낸다. (B)Airyscan 현미경 라이브 셀 이미지는 상세한 구조 정보와 함께 중간 G2 단계에서 딸 중심체대 어머니로부터 방출되는 비대칭 미세투벌을 나타내며, 상세한 구조 정보를 가지고 있다. 만화는 드로소필라 남성 생식선 줄기 세포를 묘사합니다. 스케일 바: 5μm; 별표: 허브 (틈새 시장); 녹색 화살표: 어머니 중척추 (줄기 세포 측 [M]); 빨간 화살표 : 딸 중심 (분화 딸 세포 측 [D]); 노란 화살: 정자 세포에서 중척추 (선구 비 줄기 세균 세포); 마젠타 화살표 : 핵에 찌르는 미세 투벌. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
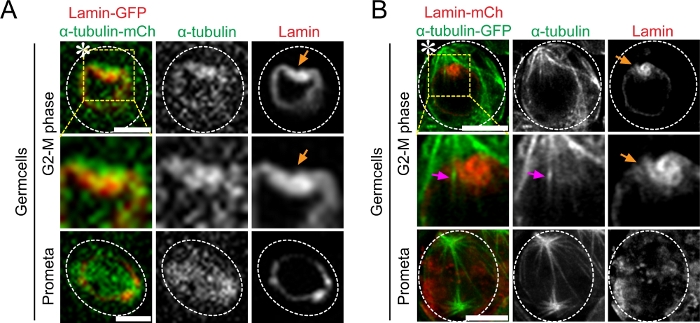
그림 3: 마이크로튜블러 찌르기 활동의 슈퍼 해상도 시간 경과 영상 과 드로소필라 조직 (testes)에서 비대칭 핵 봉투 고장 라민 -mCherry와 α-Tubulin-GFP를 공동 표현. (A)G2-M 상에서 미토시스까지 의 미세투알 역학을 보여주는 기존의 공초점 현미경 라이브 세포 영상. 줄기 세포 측에서 더 높은 α-Tubulin-GFP 강도와 핵막과의 상호 작용을 보여주는 이미지. (B)혈중 세포 측에서 마이크로투룰 포핑 및 비대칭 NEBD를 보여주는 Airyscan 현미경 라이브 셀 이미지. 스케일 바: 5μm; 별표: 허브 (틈새 시장); 주황색 화살표 : 핵 막에서 마이크로 투덜르 파고의 사이트; 마젠타 화살표 : 줄기 세포 측에 찌르는 마이크로 투비. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 드로소필라 조직(고환)에서 마이크로튜블러 및 센트로메르 부착의 초분해능 시간 경과 이미징이 α-투굴린-mCherry 및 CENP-A-Dendra2를 발현한다. (A)종래의 공초점 현미경 살아있는 세포 이미지는 초기 단계에서 메타상까지 의 미세투막 및 원로메로메어 상호 작용을 보여 주어 있다. 줄기 세포 측과 CENP-A-GFP 신호에서 더 높은 α-Tubulin-mCherry 강도를 보여주는 이미지. (B)Airyscan 현미경 은 초기 prophase에서 강한 중추에 어머니 중심및 부착에서 방출되는 현미경을 보여주는 살아있는 세포 심상. 메타단계에서, 센트로메는 반대극 (바이 오리엔테이션)에 부착됩니다. 스케일 바: 5μm; 별표: 허브 (틈새 시장); 마젠타 화살표: 키네토초레 섬유 또는 K-섬유(센트로메트에 부착된 마이크로투알). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
초해상도 현미경 법은 나노미터4,5,6의10초까지 높은 공간 해상도를 제공한다. STORM 및 PALM 현미경 검사법은 최대 20~50nm(XY 해상도)의 해상도를 허용하며, STED 현미경 검사법은 20~100nm(XY 해상도)의 해상도를 제공합니다. SIM 현미경 검사법의 공간 해상도는 100nm15로제한됩니다. 그러나, 그것의 높은 광자 밀도 및 긴 취득 시간으로 인해, 라이브 세포 화상 진찰을 위해 이 기술을 사용하는 것은 극단적으로 어렵습니다.
조직 내 의 살아있는 세포에 있는 세포골격, 염색체 및 세포기관과 같은 화상 진찰 세포 구조는, 아직도 높은 공간 해상도를 가진 동안 초감과민및 비침습적 둘 다 기술을 요구합니다. 여기에 제시된 Airyscan 슈퍼 해상도 기술은 공초점 이미징과 0.2 Airy Unit 핀홀, 픽셀 재할당 및 디콘볼루션을 결합합니다. 이 기술은 기존의 공초점 현미경검사법 7보다1.7 배 더 높은 해상도를 달성 할 수 있습니다. 종래의 공초점 현미경검사의 ~220-230 nm 해상도는 빛의 회절 한계에 의해 제한되지만, 이 이미징 기술은 SIM(110-120 nm에서해상도)과같은 다른 널리 사용되는 초해상도 기술과 유사한 약 140nm XY 해상도를 달성할 수 있다.
Airyscan 공초점 현미경 검사법의 적응성 및 다기능성은 이 프로토콜이 다양한 유형의 조직 및 세포에 적용되어 다양한 수의 세포 생물학 과정을 연구할 수 있게 한다7,16. 이 기술을 사용하여 연구원은 전례없는 현면 세부 사항으로 셀룰러 역학을 시각화하기 위해 초해상도 수준에서 시간 경과 이미지를 얻을 수 있습니다.
이 기술의 중요한 단계는 시간 경과 이미징 중에 이동하거나 부동하지 않도록 샘플을 접시에 장착하는 것입니다. 시편을 이미징 표면에 가깝게 유지하거나(즉, 접시의 유리 바닥)를 유지하는 것은 초해상도 이미지를 획득하고 시료에 대한 최적의 미세 환경을 유지하는 데 매우 중요합니다. 이것은 저산소증과 같은 조건 및 온도 또는 습도의 변경으로 인해 견본이 강조되지 않는다는 것을 보장합니다.
이 프로토콜의 유용성에도 불구하고 몇 가지 주의 사항이 있습니다. Airyscan 모드를 가진 시간 경과 화상 진찰은 기존의 공초점 현미경 화상 진찰에 비해 상대적으로 느린 과정입니다. 따라서 샘플의 약간의 물리적 변화조차도 해상도가 좋지 않게 발생할 수 있습니다. 이러한 상황은 이미징 표면에 시편을 부착하기 위해 고정법을 사용하여 방지될 수 있다(예를 들어, 폴리 L-리신 코팅 또는 시료와 호환되는 다른 코팅). 또한, 투석 막을 조직 위에 배치하고 이 프로토콜에 설명된 바와 같이 몇 가지 작은 가중치를 추가하면 조직 운동이나 부동을 방지하는 동시에 기체 교환을 허용하는 데 도움이 된다. 초해상도 모드로 조직 깊숙이 위치한 시간 경과 이미징 세포는 높은 조명을 필요로 하며 광표백을 일으킬 수 있습니다. 이는 z-슬라이스 수, 조명 전력 및 평균 알고리즘을 조정하여 샘플에 대한 최적의 설정을 달성함으로써 최소화될 수 있습니다. 세포 또는 조직이 레이저 독성, 저산소증 또는 이미징 중 다른 스트레스에 민감한 경우 세포 주기 체포가 발생할 수 있습니다. 또한 단백질이 발현이 매우 낮거나, 반감기가 짧거나, 형광 신호가 적으면, 광표백이 발생하여 품질이 좋지 않은 이미지가 발생할 수 있습니다. SRLS를 복용하거나, 짧은 영화를 만들거나, 연속 시간 지점 사이의 긴 간격으로 촬영하여 이를 피할 수 있습니다. 또한 현미경 설정 및 시간 경과 이미징 매개 변수(이 프로토콜에 설명된 대로)는 시료에 맞게 최적화되어야 합니다.
샘플이 공정 중에 이동하거나 퇴화하지 않는 것이 필수적이기 때문에 이미지 해상도를 손상시키지 않고 하룻밤 또는 하루 이상 지속되는 장기간의 시간 경과 이미징이 어려울 수 있습니다.
기존 방법은 주로 초해상도 현미경 검사법과 시간 경과 이미징 매개변수를 별도로1,9로최적화하는 데 중점을 둡니다. 그러나, 이러한 방법은 시료 준비 또는 장착 파라미터에 관한 세부 사항을 제공하지 않으며, 이는 시료의 생존가능성과 시간 경과 이미징 동안 원하는 슈퍼 분해능을 달성하기 위해 현미경의 적응성을 보장하는 데 매우 중요합니다. 이 방법에서, 우리는 시간 경과 이미징이 샘플의 변성과 해상도를 모두 위험하지 않고 슈퍼 해상도 이미지를 획득하기 위해 오랜 시간 동안 수행 될 수 있도록 이미징 매개 변수, 샘플 준비 및 장착 매개 변수를 최적화했습니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
저자는 현미경 및 데이터 분석 소프트웨어에 대한 존스 홉킨스 대학의 통합 이미징 코어 시설에 감사드립니다. J. 스네데커와 Q. E. 유에게 교정과 제안을 해주신 것에 대해 감사드리며, X.C. NIGMS/NIH R35GM127075, 하워드 휴즈 의학 연구소, 데이비드와 루실 패커드 재단, 존스 홉킨스 대학 스타트업 펀드(X.C.)가 지원합니다.
자료
| Name | Company | Catalog Number | Comments |
| Adobe Illustrator CS6 (figure making software) | Adobe | N/A | |
| Dialysis membrane | Spectra/Por 1-4 Standard RC Dialysis Membrane | Cat No. 08-67121 | |
| FBS | Thermo Fisher Scientific | Cat. no. 26140079 | 15% (V/V) |
| Fiji (analysis software) | NIH | N/A | Image fluorescence intensity quantification |
| Glass bottom cell culture dishes (FluroDish) | World Precision Instrument, Inc. | FD35PDL-100 | |
| Imaris (image reconstruction software) | Bitplane | N/A | 3D image reconstruction |
| Imerssion oil | Zeiss | Immersol 518F/30 °C | |
| Insulin | Sigma | Cat. No. 15550 | 200 µg/ml |
| Penicillin/streptomycin | Invitrogen | Cat No. - 15140-122 | 0.6x |
| Schneider Drosophila media | Invitrogen | Cat No. - 11720-034 | |
| Spinning disc confocal microscope | Zeiss | N/A | equipped with an evolve camera (Photometrics), using a 63x Zeiss objective (1.4 NA). |
| Tissue paper | Kimwipe | N/A | Wet to form humid chamber |
| LSM 800 confocal microscope with AiryScan super-resolution module | Zeiss | N/A | equipped with highly sensitive GaAsP (Gallium Arsenide Phosphide) detectors using a 63x Zeiss objective (1.4 NA) |
| ZEN (imaging software) | Zeiss | N/A |
참고문헌
- Breedijk, R. M. P., et al. A live-cell super-resolution technique demonstrated by imaging germinosomes in wild-type bacterial spores. Scientific Reports. 10 (1), 5312 (2020).
- Maddox, P. S., et al. Imaging the mitotic spindle. Methods in Enzymology. 505, 81-103 (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
- Bates, M., Jones, S. A., Zhuang, X. Stochastic optical reconstruction microscopy (STORM): A method for super resolution fluorescence imaging. Cold Spring Harbor Protocols. 2013 (6), 075143 (2013).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nature Methods. 5 (5), 417-423 (2008).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nature Methods. 15 (3), 173-182 (2018).
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12 (12), (2015).
- Huff, J., et al. The new 2D superresolution mode for ZEISS Airyscan. Nature Methods. 14 (12), 1223 (2017).
- Korobchevskaya, K., Lagerholm, B., Colin-York, H., Fritzsche, M. Exploring the potential of Airyscan microscopy for live cell imaging. Photonics. 4 (4), 41 (2017).
- Ranjan, R., Snedeker, J., Chen, X. Asymmetric centromeres differentially coordinate with mitotic machinery to ensure biased sister chromatid segregation in germline stem cells. Cell Stem Cell. 25 (5), 666-681 (2019).
- Kahney, E. W., Ranjan, R., Gleason, R. J., Chen, X. Symmetry from asymmetry or asymmetry from symmetry. Cold Spring Harbor Symposia on Quantitative Biology. 82, 305-318 (2017).
- Wooten, M., Ranjan, R., Chen, X. Asymmetric histone inheritance in asymmetrically dividing stem cells. Trends in Genetics. 36 (1), 30-43 (2020).
- Wooten, M., et al. Asymmetric histone inheritance via strand-specific incorporation and biased replication fork movement. Nature Structural & Molecular Biology. 26 (8), 732-743 (2019).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. Journal of Cell Biology. 190 (2), 165-175 (2010).
- Sivaguru, M., et al. Comparative performance of airyscan and structured illumination superresolution microscopy in the study of the surface texture and 3D shape of pollen. Microscopy Research and Technique. 81 (2), 101-114 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유