Method Article
Imaging di cellule vive super-risoluzione di strutture subcellulari
In questo articolo
Riepilogo
Presentato qui è un protocollo per l'imaging a cellule vive a super-risoluzione nel tessuto intatto. Abbiamo standardizzato le condizioni per l'imaging di una popolazione di cellule staminali adulte altamente sensibile nel suo ambiente di tessuti nativi. Questa tecnica prevede il bilanciamento della risoluzione temporale e spaziale per consentire l'osservazione diretta dei fenomeni biologici nei tessuti vivi.
Abstract
Da tempo c'è stato un compromesso cruciale tra risoluzione spaziale e temporale nell'imaging. L'imaging oltre il limite di diffrazione della luce è stato tradizionalmente limitato per essere utilizzato solo su campioni fissi o cellule vive al di fuori del tessuto etichettate con un forte segnale fluorescente. Le attuali tecniche di imaging a celle vive a super-risoluzione richiedono l'uso di speciali sonde a fluorescenza, alta illuminazione, acquisizioni di immagini multiple con elaborazione post-acquisizione o spesso una combinazione di questi processi. Questi prerequisiti limitano significativamente i campioni biologici e i contesti a cui questa tecnica può essere applicata.
Qui descriviamo un metodo per eseguire l'imaging a celle vive a fluorescenza a super risoluzione (~140 nm XY-resolution) in situ. Questa tecnica è anche compatibile con la bassa intensità fluorescente, ad esempio, EGFP o mCherry etichettati endogenamente con geni a bassa espressa. Come prova di principio, abbiamo usato questo metodo per visualizzare più strutture subcellulari nel testicolo drosofila. Durante la preparazione dei tessuti, sia la struttura cellulare che la morfologia dei tessuti vengono mantenute all'interno del testicolo sezionato. Qui, usiamo questa tecnica per immaginiamo la dinamica dei microtubuli, le interazioni tra i microtubuli e la membrana nucleare, così come l'attacco dei microtubuli ai centromeri.
Questa tecnica richiede procedure speciali nella preparazione del campione, nel montaggio del campione e nell'immobilizzazione dei campioni. Inoltre, i campioni devono essere mantenuti per diverse ore dopo la dissezione senza compromettere la funzione e l'attività cellulare. Mentre abbiamo ottimizzato le condizioni per l'imaging vivo a super risoluzione specificamente nelle cellule staminali germinali maschili drosophila (GSC) e nelle cellule germinali progenitrici nel tessuto testicolo sezionato, questa tecnica è ampiamente applicabile a una varietà di diversi tipi di cellule. La capacità di osservare le cellule nelle loro condizioni fisiologiche senza sacrificare la risoluzione spaziale o temporale servirà come strumento inestimabile per i ricercatori che cercano di affrontare questioni cruciali nella biologia cellulare.
Introduzione
Visualizzare le strutture subcellulari e la dinamica proteica nelle cellule vive con risoluzione oltre il limite di diffrazione della luce è in genere moltoimpegnativo 1-3. Mentre sono state sviluppate molteplici tecniche di super-risoluzione come Stochastic-Optical-Reconstruction-Microscopy (STORM), Photo-Activated-Localization-Microscopy (PALM) e Stimulated-Emission-Depletion (STED)4,5,6 microscopia, complicazioni nella preparazione del campione e la necessità di mantenere la vitalità e l'attività ex vivo, limitare l'uso della microscopia a super-risoluzione convenzionale per l'imaging di campioni vivi. La microscopia confocale convenzionale non può raggiungere una risoluzione spaziale oltre ~ 230 nm di risoluzione XY ed è spesso insufficiente per osservare intricate sottostrutture cellulari5,6. Tuttavia, un recente sviluppo nella microscopia confocale, airyscan super-resolution imaging, è in grado di raggiungere circa 140 nm (risoluzione XY)7,8 e ha una preparazione del campione relativamente semplice compatibile con l'imaging dal vivo. Poiché questo sistema di rilevamento delle immagini richiede un lungo tempo di acquisizione, la sua elevata risoluzione spaziale ha un costo di risoluzionetemporale 9. Pertanto, è necessario un metodo per garantire che l'imaging delle cellule vive sia esteso con un'alta risoluzione spaziale.
Qui, abbiamo sviluppato un metodo per osservare le cellule vive nel tessuto intatto alla sua risoluzione ottimale per decifrare le strutture subcellulari con informazioni spaziali dettagliate. Questo metodo è progettato come tale in modo che i campioni possano essere montati stabilmente per un lungo periodo di tempo (~ 10 h) senza muoversi o degenerare. Il supporto cellulare vivo utilizzato in questa tecnica può supportare la funzione cellulare ed evitare il fotobleaching per un massimo di 10 ore sotto un microscopio a super risoluzione. Infine, questo protocollo riduce al minimo la maggior parte delle sollecitazioni causate dalla costante illuminazione dei laser per lunghi periodi di tempo come ipossia, cambiamenti di umidità e temperatura, nonché esaurimento dei nutrienti.
Utilizzando questo protocollo per l'immagine delle cellule staminali germinali maschili Drosophila (GSC), siamo stati in grado di osservare come l'attività asimmetrica dei microtubuli consenta un'interazione preferenziale con cromatidi sorelle epigeneticamentedistinte 10,11,12,13. Questi tipi di eventi cellulari sono altamente dinamici e sono molto difficili da visualizzare nelle cellule vive utilizzando altri metodi di imaging a super risoluzione come STORM, PALM o STED. Prevediamo che questo metodo diventerà molto utile per i biologi cellulari in quanto mirano a comprendere le strutture subcellulari dinamiche delle cellule vive residenti nei tessuti. Ci sono molte aree in cui questo metodo può essere applicato, come lo studio della dinamica delle proteine; comprendere il movimento delle cellule; e processi di tracciamento del lignaggio e differenziazione cellulare, tra le altre possibili applicazioni.
Protocollo
1. Preparazione di cocktail di imaging cellulare vivo (media cellulari vivi)
- Integrare il mezzo Drosophila di Schneider con il 15% di siero bovino fetale (FBS) e 0,6x penicillina/streptomicina. Regolare il pH a circa 7,0.
- Poco prima di utilizzare il mezzo, aggiungere insulina a una concentrazione finale di 200 μg/mL.
NOTA: Questo supporto è fondamentale per mantenere la normale divisione cellulare e lo sviluppo del testicolo drosophila durante l'imaging time-lapse10,14.
2. Preparazione del piatto di coltura della cella inferiore in vetro
- Utilizzare un piatto di coltura cellulare con fondo di vetro rivestito in poli L-lisina con un diametro di 35 mm per il testicolo Drosophila. Il pozzo interno del piatto ha un fondo di vetro con un diametro di 23 mm e un lato con un'elevazione di 1 mm(Figura 1A-a).
NOTA: scegli un piatto con fondo di vetro che consenta una distanza di lavoro più breve, un'apertura numerica più ampia e un obiettivo di ingrandimento più elevato; queste funzionalità sono fondamentali per ottenere un'immagine a super risoluzione. - Utilizzare una membrana di dialisi (MWCO: 12-14kD) che consenta lo scambio gassoso. Tagliare la membrana a piccoli pezzi.
NOTA: I pezzi di membrana devono essere più piccoli dell'area di vetro del piatto ma abbastanza grandi da coprire l'esemplare. - Immergere la membrana con 100 μL di supporti cellulari vivi per ~ 5 minuti. Non utilizzare una membrana secca sul campione, in quanto potrebbe danneggiarlo. La membrana aiuta a prevenire lo stress ipossia.
- Preparare 2-3 pezzi leggeri di vetro o plastica da mettere sulla membrana in modo che il tessuto non galleggi. Per fare questo, prima prendi l'anello esterno del tubo di centrifuga da 50 ml e taglialo a piccoli pezzi. Quindi, sterilizzare i pezzi con il 70% di etanolo prima dell'uso.
NOTA: Questo passaggio assicura che il campione rimanga sulla superficie durante l'imaging e non galleggi, il che è fondamentale per ottenere risultati ottimali. - Preparare un anello di ~ 25 mm di diametro e posizionarlo sul lato elevato del piatto. Mettici un copripata per generare due camere. La camera inferiore conterrà il campione mentre la camera superiore fungerà da camera di umidità per impedire l'essiccazione del campione.
- Per realizzare questo anello, tagliare l'anello esterno da un tubo di centrifuga da 50 ml, che gli permetterà di adattarsi saldamente sul lato sopraelevato del piatto da 35 mm. Un anello simile può essere realizzato in altri modi, ad esempio utilizzando un elastico o una cravatta di torsione in plastica per adattarsi al lato elevato del piatto per tenere correttamente il copripata senza interferire con il campione.
NOTA: Questo passaggio è fondamentale, specialmente per campioni sensibili a sollecitazioni come condizioni ipossiche e variazioni di temperatura e umidità.
- Per realizzare questo anello, tagliare l'anello esterno da un tubo di centrifuga da 50 ml, che gli permetterà di adattarsi saldamente sul lato sopraelevato del piatto da 35 mm. Un anello simile può essere realizzato in altri modi, ad esempio utilizzando un elastico o una cravatta di torsione in plastica per adattarsi al lato elevato del piatto per tenere correttamente il copripata senza interferire con il campione.
3. Dissezione dei tester dalle mosche maschili e montaggio
- Prendi ~10 giovani mosche maschili (2-3 giorni) e seziona i teste nel supporto cellulare vivo per ottenere ~ 10 paia di teste adulte Drosophila.
- Sezionare le mosche al microscopio a dissezione in un piatto di dissezione usando forcep fini.
NOTA: Il ceppo Drosophila melanogaster (mosca della frutta) trasporta il transgene UAS-α-Tubulin-GFP guidato da un nanos-Gal4, primo driver di cellule germinali. - Genera i seguenti ceppi di drosophila melanogaster knock-in utilizzando la tecnologia CRISPR-Cas9: Lamin-mCherry (tag C-terminale) e CENP-A-Dendra2-CENP-A [tag nel sito interno (tra il 118 ° - 119 ° codone)].
NOTA: Mentre per ogni esperimento è necessario un solo testicolo di eccellente qualità, il montaggio di un numero sufficiente di tessuti (15-20) o cellule garantirà che ci sia almeno un campione sano con eccellenti segnali di fluorescenza per l'imaging time-lapse.
- Sezionare le mosche al microscopio a dissezione in un piatto di dissezione usando forcep fini.
- Lavare i tester due volte in mezzi cellulari vivi nella piastra di dissezione.
- Utilizzare una pipetta per aggiungere un supporto seguito rimuovendo il supporto della cella viva come passaggio di lavaggio.
- Rimuovere il tessuto in eccesso usando le forcelle. Qualsiasi tessuto extra interferirà con l'imaging.
NOTA: Non utilizzare salina tamponata da fosfati (PBS) per il lavaggio, perché può influenzare la dinamica di alcuni componenti cellulari.
- Aggiungere 100-150 μL di supporti cellulari vivi nel piatto (preparato nel passaggio 2.1) e stenderlo sulla superficie del vetro usando una punta di pipetta. La diffusione del supporto sulla superficie consentirà al tessuto di attaccarsi correttamente al piatto.
- Trasferire i tester sul piatto utilizzando forcep fini e portarli al centro del piatto(Figura 1A-b).
NOTA: Evitare il trasferimento dei detriti perché interferisce con l'imaging e potrebbe ridurre la qualità dell'immagine. - Rimuovere i mezzi cellulari vivi in eccesso (lasciare circa 10 μL di supporto) per consentire al tessuto di appiattirsi e attaccarsi correttamente al piatto. Eseguire rapidamente questo passaggio per evitare di asciugare il campione.
- Posizionare la membrana pre-bagnata (preparata nei primi step 2.2 e 2.3) sopra i tester(figura 1A-c).
- Mettere 2-3 piccoli pesi plastici (preparati nel passaggio 2.4) sulla membrana in modo che il campione non galleggi e aggiungere rapidamente 100-150 μL di supporti cellulari vivi (Figura 1A-d).
NOTA: L'aggiunta rapida e delicata di supporti garantisce che il campione non si asciughi o si sposti. - Posizionare l'anello di plastica (preparato al punto 2.5) sul lato sopraelevato del piatto(Figura 1B-a).
- Posizionare un coverslip da 22 mm x 22 mm sopra l'anello (Figura 1B-b). Questo genera due camere.
- Prendi un pezzo di carta velina, inumidilo con acqua, quindi giralo e mettilo sul copriletto, per creare una camera umida(Figura 1B-c). Chiudere il coperchio del piatto ( Figura1B-d) e iniziare l'imaging delle cellule vive.
NOTA: Se il campione è sensibile alla luce, eseguire la sezione 3 al buio.
4. Imaging a cellule vive delle cellule staminali germinali maschili drosophila (SGC) in situ
- Posizionare il piatto al microscopio a super risoluzione e fissarlo con i morsetti del palco.
- Aprire il software di imaging, accendere la luce trasmessa e utilizzare l'obiettivo 63x per concentrarsi sul tessuto testicolo con la manopola di messa a fuoco.
NOTA: Se c'è una difficoltà nell'individuare un campione con l'obiettivo 63x, utilizzare prima l'obiettivo 40x o 20x prima di passare al 63x. - Accendere i laser, fare clic su Livee trovare l'SGC con la posizione e le condizioni ottimali. Evitare teste che hanno un segnale a bassa fluorescenza o hanno il mozzo (nicchia) lontano dalla superficie.
NOTA: Nei tester Drosophila, i GSC sono collegati all'hub.
- Aprire il software di imaging, accendere la luce trasmessa e utilizzare l'obiettivo 63x per concentrarsi sul tessuto testicolo con la manopola di messa a fuoco.
- Regola lo stato attivo per i GSC e identifica le impostazioni giuste per il campione, tra cui potenza laser, guadagno di moltiplicazione elettronica (EM), media e zoom per la modalità Airyscan. Utilizzare le seguenti impostazioni come esempio per i tester Drosophila che esprimono EGFP taggato α-tubulina nelle cellule germinali in fase iniziale.
- Impostare la dimensione del fotogramma tra 512 x 512 pixel e 1024 x 1024 pixel facendo clic su Dimensioni fotogramma.
- Impostare la media fotogramma su 1 o 2 facendo clic su Media.
NOTA: L'aumento delle dimensioni del fotogramma (>1024 x 1024 pixel) e l'esecuzione di una media maggiore (ad esempio, più di 2) potrebbero causare fotobleaching o fototossicità. - Impostare la potenza del laser sull'1%-2% facendo clic su Laser .
NOTA: L'aumento della potenza del laser può anche portare al fotoligione o alla fototossicità. - Impostare il guadagno em al di sotto del livello consigliato (< 800) facendo clic su Guadagno master.
NOTA: un guadagno EM più elevato può generare artefatti. - Ingrandisci l'area o la cella di interesse per ridurre i tempi di acquisizione dell'immagine e ridurre il fotobleaching. Questo permette anche all'esemplare di sopravvivere più a lungo.
- Avviare l'acquisizione dell'immagine time-lapse utilizzando la modalità Airyscan facendo clic su Avvia esperimento.
- Prima di fare clic su Avviaesperimento , assicurarsi che l'acquisizione sia configurata in modo ottimale.
- Se viene visualizzato un avviso con l'avviso "L'acquisizione di Airyscan non è configurata in modo ottimale", fare clic su Ottimale nella sezione dimensioni fotogramma, su Ottimale nella sezione z-stack e quindi su Ottimale per la sezione area di scansione (è necessario un minimo di zoom 1.3 per l'imaging a super risoluzione).
- Ottimizzare l'intervallo di tempo, il numero di z-slice e la durata dell'imaging time-lapse in base al progetto sperimentale e al tipo di campione, in modo che la qualità dell'immagine non venga compromessa e le celle non verranno arrestate in particolari fasi del ciclo cellulare.
- Ad esempio, i parametri per l'imaging time-lapse dei tester Drosophila che esprimono α-tubulina taggata da EGFP nella linea germinale precoce sono mostrati nei seguenti passaggi.
- Per più di 5 ore di imaging time-lapse, immagine a un intervallo di 10 minuti con 1% di potenza laser e prendere fino a 30 z-slice in ogni punto di tempo.
- Per processi cellulari altamente dinamici, come la dinamica dei microtubuli, impostare un intervallo di 2 minuti tra i punti di tempo, eseguire l'imaging time-lapse di 1-2 ore con una potenza laser dell'1% e assumere fino a 30 z-slice in ogni punto di tempo.
- Per eventi cellulari rari, come l'anafase alla dinamica della cromatina telofane precoce (eventi da 2 a 3 minuti), impostare l'imaging delle cellule vive con un intervallo di 1 minuto tra i punti di tempo, eseguire immagini time-lapse di 30 minuti con una potenza laser dell'1% e prendere fino a 30 z-slice in ogni momento.
NOTA: Questi parametri possono variare per diversi campioni, quindi sarà necessaria un'alterazione per un uso ottimale per il campione specifico.
- Eseguire immagini time-lapse o immagini snapshot dal vivo, a seconda della sensibilità del campione e del progetto sperimentale.
NOTA: un cortometraggio è di 15-30 minuti e un lungo film è più di 5 ore. - Se il campione è molto sensibile e non può essere studiato mediante imaging time-lapse con un microscopio a super risoluzione, come spesso accade con i GSC maschi Drosophila, eseguire un'istantanea dal vivo a super risoluzione (SRLS) del campione in diverse fasi del ciclo cellulare (come mostrato nella figura 2, Figura 3, Figura 4).
- Se viene catturato un evento biologico cellulare raro o la proteina di interesse ha un basso livello di espressione, eseguire SRLS.
- Per SRLS, trova una cella nella specifica fase del ciclo cellulare che ti interessa. Ad esempio, se ci si concentra sul legame microtubuli-cinetocore, utilizzare una cellula in prometafase o metafase.
NOTA: Questo ti aiuterà a ottenere un'immagine di alta qualità della cella di interesse al momento giusto senza rischiare la fototossicità del campione o lo sbiancamento dei fluorofori, che può verificarsi durante un film più lungo. - Se si utilizza SRLS, immagini diverse fasi del ciclo cellulare di interesse su più celle e disporre queste immagini in ordine cronologico.
NOTA: Questo può essere utilizzato per costruire un ordine temporale di eventi massimizzando al contempo la salute del segnale e dei tessuti, per ottenere un'eccellente risoluzione temporale dell'evento per campioni particolarmente sensibili o campioni con segnale basso.
5. Elaborazione Airyscan delle immagini delle celle live
- Dopo l'acquisizione dell'immagine con il software di imaging, selezionare Elaborazione, Batche quindi Elaborazione Airyscan.
- Selezionare le immagini da elaborare e quindi fare clic su Esegui/Elabora per ottenere le immagini a super risoluzione.
- Eseguire l'elaborazione utilizzando l'impostazione predefinita.
NOTA: l'elaborazione Airyscan funzionerà solo se le impostazioni di imaging sono correttamente stabilite per l'imaging Airyscan.
Risultati
L'imaging cellulare vivo oltre il limite di diffrazione nel tessuto Drosophila, specialmente per i GSC, offre l'opportunità di indagare la dinamica degli eventi subcellulari nel contesto della progressione del ciclo cellulare. Recentemente, uno studio che utilizza questo protocollo ha dimostrato che le attività dei microtubuli al centrosoma madre rispetto al centrosoma della figlia sono temporaneamente asimmetriche nei GSC10. Il centrosoma madre emana microtubuli circa 4 ore prima dell'ingresso mitotico, mentre il centrosoma della figlia emana solo microtubuli all'inizio della mitosi. I microtubuli altamente attivi del centrosoma madre interagiscono con la membrana nucleare e inducono la rottura polarizzata dell'involucro nucleare (NEBD). Il NEBD locale è prossimale al mozzo e consente ai microtubuli del centrosoma madre di entrare nel nucleo e si attaccano preferenzialmente al cinetocore gemello più forte e al centromero gemello per assicurarsi che si segreghino alla futura cellula staminale. Queste osservazioni suggeriscono che esiste un asse mitotico asimmetrico in cui i microtubuli, la membrana nucleare, il cinetocore e i centromeri interagiscono in modo strettamente controllato, al fine di garantire una corretta segregazione cromosomica non casuale allafine 10,11,12.
Ognuno di questi risultati è stato supportato utilizzando l'approccio SRLS qui delineato. Eseguendo l'imaging a cellule vive di tester di Drosophila che esprimono α-tubulina-GFP nelle cellule germinali in fase iniziale, siamo stati in grado di identificare l'asimmetria temporale nell'attività dei microtubuli nei GSC (Figura 2). Siamo stati anche in grado di vedere l'intensità asimmetrica dei segnali GFP ai due centrosomi come un segnale più luminoso al centrosoma madre e un segnale relativamente più debole sul lato centrosoma della figlia usando un microscopio confocale del disco rotante (Figura 2A). La differenza di luminosità è probabilmente riflessa dall'asimmetria temporale della nucleazione dei microtubuli, ma la morfologia dettagliata e la quantità di microtubuli non potevano essere risolte utilizzando la microscopia confocale del disco rotante (Figura 2A). Al contrario, l'imaging a super-risoluzione delle cellule vive ci ha permesso di visualizzare la morfologia e quantificare il numero di microtubuli (Figura 2B). La sua migliore risoluzione ha rivelato modelli di nucleazione asimmetrica del microtubulo, allungamento e maggiore interazione con la membrana nucleare (Figura 2B). Ad esempio, i film time-lapse dei GSC che esprimono α-tubulina-GFP sono stati pubblicati in un documento di ricerca principale (Video S3 e Video S5)10.
Successivamente, abbiamo eseguito l'imaging di cellule dal vivo su tester drosophila co-esprimendo α-tubulina-GFP con Lamin-mCherry o α-Tubulin-mCherry con Lamin-GFP nelle cellule germinali in fase iniziale. I nostri risultati mostrano che l'attività asimmetrica dei microtubuli ha coinciso con il NEBD asimmetrico nei GSC(figura 3). Utilizzando il microscopio confocale del disco rotante, potremmo visualizzare l'invaginazione asimmetrica della membrana nucleare ma non i singoli microtubuli che sono entrati direttamente nel nucleo(Figura 3A). Al contrario, questa tecnica di super-risoluzione delle cellule vive ci ha permesso di osservare direttamente questi eventi imagingando simultaneamente sia i microtubuli che la lamina nucleare (Figura 3B).
Successivamente, abbiamo eseguito l'imaging a cellule vive su tester drosophila che esprimono α-tubulina-mCherry e CENP-A-Dendra2 o CENP-A-GFP (Proteina Centromere A) nelle cellule germinali in fase iniziale. Per visualizzare meglio il microtubulo e l'attacco del centromero, viviamo li abbiamo immaginiti a una temperatura inferiore (~ 18 °C) per stabilizzare il loro attaccamento. Se necessario, il campione può essere brevemente raffreddato con ghiaccio o ghiaccio-freddo vivo per 4-5 minuti per stabilizzare l'attacco microtubulo-centromero e depolimerizzare qualsiasi microtubulo non attaccato. I nostri risultati mostrano che i microtubuli provenienti dalla madre attiva precoce si attaccano preferenzialmente al centromero gemello più forte (Figura 4). Utilizzando il microscopio confocale a disco rotante, i segnali α-Tubulina-mCherry mostravano una luminosità asimmetrica vicino ai due centrosomi. Potremmo anche rilevare entrambi i centromeri sorelle come un unico segnale, come mostrato nella figura 4A (metafase), ma non siamo stati in grado di visualizzare l'attacco microtubulo-centromero (Figura 4A, metafase). Al contrario, l'imaging dal vivo a super risoluzione ci ha permesso di visualizzare l'attacco microtubulo-centromero (Figura 4B). I nostri risultati mostrano che i microtubuli madre centrosomasi si attaccano al centromero prima dei microtubuli che emanano centrosomali(Figura 4B,prophase precoce).
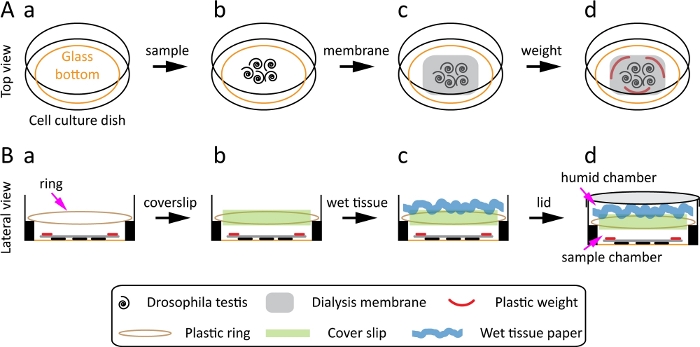
Figura 1: Schema per la preparazione e il montaggio della Drosophila testis. (A) Vista dall'alto: il piatto di coltura cellulare con fondo di vetro (A-a), trasferisce il testicolo drosophila verso il centro del piatto (A-b), posiziona una membrana di dialisi sulla parte superiore del testicolo (A-c), posiziona tre pesi di plastica sulla membrana di dialisi (A-d). (B) Vista laterale: posizionare l'anello di plastica sul lato sopraelevato del piatto (B-a), posizionare un copripazzo da 22 mm × 22 mm sull'anello di plastica (B-b), mettere un vortice e carta velina bagnata sul coperchio (B-c), chiudere il piatto con il coperchio (B-d). Clicca qui per visualizzare una versione più grande di questa figura.
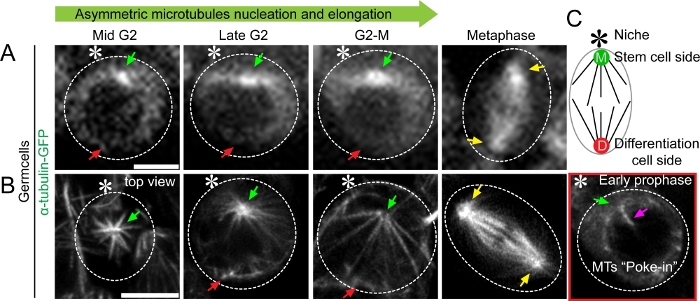
Figura 2: Imaging time-lapse a super-risoluzione della dinamica dei microtubuli nel tessuto Drosophila (teste) che esprime l'immagine a cellule vive α-tubulina-GFP (A)Microscopia confocale convenzionale che mostra la dinamica dei microtubuli nella fase media G2 alla metafase. (B) Immagine cellulare viva al microscopio Airyscan che mostra microtubuli asimmetrici che emanano da centrosomi madre contro figlia nella fase media G2 alla metafase, con informazioni strutturali dettagliate. Un cartone animato raffigura la cellula staminale germinale maschile Drosophila. Barra di scala: 5μm; asterisco: hub (nicchia); freccia verde: madre centrosoma (lato cellule staminali [M]); freccia rossa: figlia centrosoma (differenziazione lato cella figlia [D]); freccia gialla: centrosoma nella cellula spermatogonia (cellula germinale progenitrice non staminali); freccia magenta: microtubulo che fruga nel nucleo. Clicca qui per visualizzare una versione più grande di questa figura.
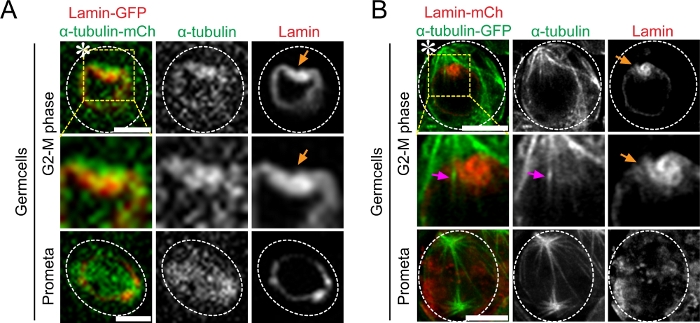
Figura 3: Imaging time-lapse a super risoluzione dell'attività di poking-in dei microtubuli e ripartizione asimmetrica dell'involucro nucleare nel tessuto Drosophila (teste) co-esprimere Lamin-mCherry e α-Tubulin-GFP. (A) Immagine convenzionale a cellule vive confocale che mostra la dinamica dei microtubuli dalla fase G2-M alla mitosi. Immagine che mostra una α intensità di 10-tubulina-GFP sul lato delle cellule staminali e la sua interazione con la membrana nucleare. (B) Immagine cellulare viva al microscopio Airyscan che mostra microtubuli che frugano e NEBD asimmetrico sul lato delle cellule staminali. Barra di scala: 5μm; asterisco: hub (nicchia); freccia arancione: sito di microtubuli che frugano nella membrana nucleare; freccia magenta: microtubuli che spuntano sul lato delle cellule staminali. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Imaging time-lapse a super risoluzione di microtubuli e attacco centromero nel tessuto Drosophila (teste) che esprime α-Tubulina-mCherry e CENP-A-Dendra2. (A) Microscopia confocale convenzionale immagine cellulare viva che mostra l'interazione di microtubuli e centromeri dalla prophase precoce alla metafase. Immagine che mostra una α di preoccupazione-tubulina-mIncronia sul lato delle cellule staminali e segnale CENP-A-GFP. (B) Immagine cellulare viva al microscopio Airyscan che mostra microtubuli provenienti dal centrosoma madre e attaccamento ai centromeri più forti nei primi propase. Alla metafase, i centromeri sono attaccati al polo opposto (bi-orientamento). Barra di scala: 5μm; asterisco: hub (nicchia); freccia magenta: fibra di cinetocore o fibra K (microtubuli attaccati al centromero). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
I metodi di microscopia a super risoluzione forniscono una risoluzione spaziale fino a 10 di nanometri4,5,6. I metodi di microscopia STORM e PALM consentono una risoluzione fino a 20-50 nm (risoluzione XY), mentre la microscopia STED offre una risoluzione da 20 a 100 nm (risoluzione XY). La risoluzione spaziale della microscopia SIM è limitata a 100-130 nm15. Tuttavia, a causa della sua alta densità di fotoni e del lungo tempo di acquisizione, è estremamente difficile utilizzare queste tecniche per l'imaging di cellule vive.
L'imaging di strutture subcellulari, come il citoscheletro, i cromosomi e gli organelli nelle cellule vive all'interno dei tessuti, richiede che la tecnica sia sia ultrasensibile che non invasiva pur avendo un'alta risoluzione spaziale. La tecnica di super-risoluzione Airyscan qui presentata combina l'imaging confocale con un foro a foro airy unit 0.2, insieme alla riassegnazione dei pixel e alla deconvoluzione. Questa tecnica può ottenere una risoluzione 1,7 volte superiore a quella della microscopia confocale convenzionale7. La risoluzione ~ 220-230 nm della microscopia confocale convenzionale è limitata dal limite di diffrazione della luce, ma questa tecnica di imaging è in grado di ottenere circa 140 nm di risoluzione XY, che è paragonabile ad altre tecniche di super-risoluzione ampiamente utilizzate, come SIM (risoluzione a 110-120 nm)16.
L'adattabilità e la versatilità della microscopia confocale Airyscan consentiranno a questo protocollo di essere applicabile a vari altri tipi di tessuti e cellule per studiare un numero diversificato di processi di biologiacellulare 7,16. Utilizzando questa tecnica, i ricercatori possono ottenere immagini time-lapse a un livello di super-risoluzione per visualizzare dinamiche cellulari con dettagli spatiotemporali senza precedenti.
Il passaggio critico di questa tecnica è il montaggio del campione sul piatto in modo che non si muova o galleggi durante l'imaging time-lapse. Mantenere il campione vicino o attaccato alla superficie di imaging (cioè il fondo di vetro del piatto) è fondamentale per acquisire immagini a super risoluzione e mantenere il microambiente ottimale per il campione. Ciò garantisce che il campione non sia stressato a causa di condizioni come ipossia e cambiamenti di temperatura o umidità.
Nonostante l'utilità di questo protocollo, ci sono alcuni avvertimenti. L'imaging time-lapse con la modalità Airyscan è un processo relativamente lento rispetto all'imaging convenzionale al microscopio confocale. Pertanto, anche il minimo spostamento fisico del campione potrebbe comportare una scarsa risoluzione. Questa situazione può essere prevenuta utilizzando un metodo di immobilizzazione per aderire ai campioni alla superficie di imaging (ad esempio, rivestimento in poli L-lisina o altro rivestimento compatibile con il campione). Inoltre, posizionare una membrana di dialisi sopra il tessuto e aggiungere alcuni piccoli pesi come descritto in questo protocollo aiuta a prevenire il movimento dei tessuti o galleggiare, consentendo allo stesso tempo lo scambio gassoso. Le cellule di imaging time-lapse che si trovano in profondità nel tessuto con la modalità super-risoluzione richiedono un'illuminazione elevata e possono causare fotobleaching. Questo può essere ridotto al minimo regolando il numero di z-slice, la potenza di illuminazione e l'algoritmo di media per ottenere le impostazioni ottimali per il campione. Se la cellula o il tessuto è sensibile alla tossicità laser, all'ipossia o a qualsiasi altro stress durante l'imaging, può verificarsi l'arresto del ciclo cellulare. Inoltre, se una proteina ha un'espressione estremamente bassa, un'emivita breve o un segnale a bassa fluorescenza, può verificarsi il fotobleaching che si tradurrà in un'immagine di cattiva qualità. Questo può essere evitato prendendo una SRLS, facendo un cortometraggio o girando con lunghi intervalli tra punti di tempo consecutivi. Inoltre, l'impostazione del microscopio e il parametro di imaging time-lapse (come descritto in questo protocollo) devono essere ottimizzati per adattarsi al campione.
Poiché è essenziale che il campione non si muova o degeneri durante il processo, l'imaging prolungato che dura durante la notte o più di un giorno senza compromettere la risoluzione dell'immagine può essere impegnativo.
I metodi esistenti si concentrano principalmente sull'ottimizzazione della microscopia a super risoluzione e dei parametri di imaging time-lapseseparatamente 1,9. Tuttavia, questi metodi non forniscono dettagli relativi alla preparazione del campione o ai parametri di montaggio, che sono fondamentali per garantire la vitalità del campione e l'adattabilità del microscopio per ottenere la super-risoluzione desiderata durante l'imaging time-lapse. In questo metodo, abbiamo ottimizzato i parametri di imaging, la preparazione del campione e i parametri di montaggio in modo che l'imaging time-lapse possa essere eseguito per un lungo periodo di tempo per acquisire immagini a super-risoluzione senza rischiare sia la degenerazione del campione che la risoluzione.
Divulgazioni
Gli autori non dichiarano alcun conflitto di interessi.
Riconoscimenti
Gli autori ringraziano la struttura Integrated Imaging Core della Johns Hopkins University per microscopi e software di analisi dei dati. Ringraziamo J. Snedeker e Q. E. Yu per la correzione di bozze e i suggerimenti e i membri del laboratorio X.C. per discussioni e suggerimenti utili. Supportato da NIGMS/NIH R35GM127075, dall'Howard Hughes Medical Institute, dalla David and Lucile Packard Foundation e dai fondi di avviamento della Johns Hopkins University (X.C.).
Materiali
| Name | Company | Catalog Number | Comments |
| Adobe Illustrator CS6 (figure making software) | Adobe | N/A | |
| Dialysis membrane | Spectra/Por 1-4 Standard RC Dialysis Membrane | Cat No. 08-67121 | |
| FBS | Thermo Fisher Scientific | Cat. no. 26140079 | 15% (V/V) |
| Fiji (analysis software) | NIH | N/A | Image fluorescence intensity quantification |
| Glass bottom cell culture dishes (FluroDish) | World Precision Instrument, Inc. | FD35PDL-100 | |
| Imaris (image reconstruction software) | Bitplane | N/A | 3D image reconstruction |
| Imerssion oil | Zeiss | Immersol 518F/30 °C | |
| Insulin | Sigma | Cat. No. 15550 | 200 µg/ml |
| Penicillin/streptomycin | Invitrogen | Cat No. - 15140-122 | 0.6x |
| Schneider Drosophila media | Invitrogen | Cat No. - 11720-034 | |
| Spinning disc confocal microscope | Zeiss | N/A | equipped with an evolve camera (Photometrics), using a 63x Zeiss objective (1.4 NA). |
| Tissue paper | Kimwipe | N/A | Wet to form humid chamber |
| LSM 800 confocal microscope with AiryScan super-resolution module | Zeiss | N/A | equipped with highly sensitive GaAsP (Gallium Arsenide Phosphide) detectors using a 63x Zeiss objective (1.4 NA) |
| ZEN (imaging software) | Zeiss | N/A |
Riferimenti
- Breedijk, R. M. P., et al. A live-cell super-resolution technique demonstrated by imaging germinosomes in wild-type bacterial spores. Scientific Reports. 10 (1), 5312 (2020).
- Maddox, P. S., et al. Imaging the mitotic spindle. Methods in Enzymology. 505, 81-103 (2012).
- Frigault, M. M., Lacoste, J., Swift, J. L., Brown, C. M. Live-cell microscopy - tips and tools. Journal of Cell Science. 122 (6), 753-767 (2009).
- Bates, M., Jones, S. A., Zhuang, X. Stochastic optical reconstruction microscopy (STORM): A method for super resolution fluorescence imaging. Cold Spring Harbor Protocols. 2013 (6), 075143 (2013).
- Shroff, H., Galbraith, C. G., Galbraith, J. A., Betzig, E. Live-cell photoactivated localization microscopy of nanoscale adhesion dynamics. Nature Methods. 5 (5), 417-423 (2008).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nature Methods. 15 (3), 173-182 (2018).
- Huff, J. The Airyscan detector from ZEISS: confocal imaging with improved signal-to-noise ratio and super-resolution. Nature Methods. 12 (12), (2015).
- Huff, J., et al. The new 2D superresolution mode for ZEISS Airyscan. Nature Methods. 14 (12), 1223 (2017).
- Korobchevskaya, K., Lagerholm, B., Colin-York, H., Fritzsche, M. Exploring the potential of Airyscan microscopy for live cell imaging. Photonics. 4 (4), 41 (2017).
- Ranjan, R., Snedeker, J., Chen, X. Asymmetric centromeres differentially coordinate with mitotic machinery to ensure biased sister chromatid segregation in germline stem cells. Cell Stem Cell. 25 (5), 666-681 (2019).
- Kahney, E. W., Ranjan, R., Gleason, R. J., Chen, X. Symmetry from asymmetry or asymmetry from symmetry. Cold Spring Harbor Symposia on Quantitative Biology. 82, 305-318 (2017).
- Wooten, M., Ranjan, R., Chen, X. Asymmetric histone inheritance in asymmetrically dividing stem cells. Trends in Genetics. 36 (1), 30-43 (2020).
- Wooten, M., et al. Asymmetric histone inheritance via strand-specific incorporation and biased replication fork movement. Nature Structural & Molecular Biology. 26 (8), 732-743 (2019).
- Prasad, M., Jang, A. C. C., Starz-Gaiano, M., Melani, M., Montell, D. J. A protocol for culturing Drosophila melanogaster stage 9 egg chambers for live imaging. Nature Protocols. 2 (10), 2467-2473 (2007).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. Journal of Cell Biology. 190 (2), 165-175 (2010).
- Sivaguru, M., et al. Comparative performance of airyscan and structured illumination superresolution microscopy in the study of the surface texture and 3D shape of pollen. Microscopy Research and Technique. 81 (2), 101-114 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon