Method Article
상용 자동화 시스템 및 소프트웨어를 사용한 유충 제브라피시의 놀람 반응의 프리펄스 억제에 대한 약리학적 검증
요약
여기에서는 유충 제브라피시에서 PPI(Prepulse Inhibition) 분석을 약리학적으로 검증하기 위해 상업적으로 이용 가능한 자동화 시스템을 활용하는 프로토콜에 대해 설명합니다.
초록
설치류에서 PPI(Prepulse Inhibition) 분석을 수행하기 위한 상업적이고 표준화된 자동화 시스템과 소프트웨어가 풍부하지만, 우리가 아는 한 제브라피시에서 수행된 모든 PPI 분석은 지금까지 개별 그룹에서만 사용할 수 있는 맞춤형 시스템을 사용하여 수행되었습니다. 이로 인해 특히 데이터 재현성 및 표준화 문제와 관련하여 문제가 발생했습니다. 본 연구에서는 유충 제브라피쉬의 PPI 분석을 약리학적으로 검증하기 위해 상업적으로 이용 가능한 자동화 시스템을 활용하는 프로토콜을 생성했습니다. 발표된 연구 결과와 일치하게, 수정 후 6일 제브라피시 유충의 PPI 반응에 대해 아포모르핀, 할로페리돌 및 케타민의 결과를 재현할 수 있었습니다.
서문
제브라피쉬(Danio rerio) 유충은 수많은 장점이 있기 때문에 정신분열증(Gawel et al.1에 의해 검토됨)과 같은 정신 질환을 모델링하는 데 적합한 후보입니다. 여기에는 인간 orthologues와 70%의 염기서열 상동성을 가진 완전히 염기서열화된 게놈2, 게놈을 조작하고 주어진 유전자가 발달 또는 질병에 미치는 기여도를 확인하기 위한 순방향 및 역방향 유전 도구의 존재3, 제브라피시 뇌에 주요 인간/설치류 신경전달물질의 존재4가 포함됩니다. 제브라피시에는 불안, 학습 및 기억과 같은 여러 신경 표현형 영역이 있습니다3. 주요 신경성 약물 종류에 대한 광학적 투명성과 민감성으로 인해 약리학적 조작 및 표현형 약물 스크리닝에 이상적인 후보로 선택되고 있습니다 5,6.
고처리량 약물 스크리닝을 수행하기 위해서는 자동화와 강력한 내표현형의 존재가 매우 중요합니다7. 예를 들어, 제브라피시의 유충 행동을 측정하기 위해 thigmotaxis, 놀람 반응, 광운동 반응, 광운동 반응, 습관화, 먹이 포획, 수면/각성 행동, 운동 행동 및 기타 여러 가지 행동과 같은 다양한 자동 기록 기술이 개발되었습니다6. 일부 실험실에서는 이러한 거동 중 일부에 대한 자동 측정 및 분석을 위한 맞춤형 시스템을 개발하지만 상업적으로 이용 가능한 이미징 및 소프트웨어 시스템이 있습니다 8,9,10,11. 깜짝 놀랄 자극이 일어나기 전에 약한 놀람이 아닌 자극이 잠깐 제시될 때 놀람 반응이 감소하는 감각 운동 게이팅의 한 형태인 사전 펄스 억제(Prepulse Inhibition, PPI)는 동물 모델에서 정신분열증을 연구하기 위한 내표현형(endophenotype)으로 사용되어 왔다(12,13에 의해 검토됨). 또한 음향 놀람 반응(ASR) 및 PPI는 제브라피시14,15를 포함한 동물 모델에서 청각 및 청각 기능을 연구하는 데 유용한 역할을 했습니다. 유충 제브라피쉬는 예상치 못한 깜짝 놀랄 자극에 대한 반응으로 특징적인 C-start를 보이며, 이는 프리펄스(prepulse)라고 하는 약한 자극에 의해 감소합니다. C-start는 오랫동안 별개의 신경 세포 집단에 의해 제어되는 탈출 행동으로 설명되어 왔으며 유충 제브라피시 15,16,17에서 철저히 특성화되었습니다.
설치류18,19,20에서 PPI 분석을 수행하기 위한 상업적이고 표준화된 자동화 시스템 및 소프트웨어가 풍부합니다. 그러나 우리가 아는 한, 지금까지 제브라피시에서 수행된 모든 PPI 분석은 개별 그룹 15,16,21,22에서만 사용할 수 있는 맞춤형 시스템을 사용하여 수행되었습니다. 이는 표준화23과 관련하여 데이터 재현성 및 복제성을 달성하는 데 어려움을 안겨줍니다.
최근 제브라피시 커뮤니티의 알려진 공급업체는 유충 제브라피시24에서 PPI 분석을 수행하기 위해 고속 카메라와 PPI 생성기 애드온이 내장된 설정을 개발했습니다. 카메라는 초당 1000프레임으로 녹화하여 C-start와 같은 빠른 동작 동작을 기록할 수 있으며, PPI 생성기는 다양한 음향 자극을 사용자가 제어하여 놀람 반응을 유발할 수 있도록 합니다24. 여기서, 우리는 앞서 언급한 시스템을 복잡한 행동11의 자동화된 분석을 위해 설계된 상업적으로 이용 가능한 종합 소프트웨어 패키지와 결합하여 유충 제브라피시에서 PPI 반응 분석을 수행하기 위한 프로토콜을 생성합니다. 우리는 1) PPI 결핍을 유발하는 것으로 알려진 도파민 작용제인 아포모르핀을 사용하여 PPI 반응을 약리학적으로 검증합니다. 2) PPI를 향상시키는 것으로 알려진 도파민 길항제이자 항정신병 약물인 할로페리돌 및 3) PPI를 조절하는 것으로 알려진 NMDA 수용체 길항제인 케타민.
프로토콜
모든 동물 실험은 노르웨이 식품안전청(Norwegian Food Safety Authority) 실험동물관리국의 감독 및 적용 시스템(FOTS-18/106800-1)의 승인을 받았습니다.
1. 제브라피시 사육
- 야생형 성체 수컷과 암컷 제브라피쉬(Danio rerio) 어종의 짝짓기를 설정하고 전날 저녁표준 조건 25 로 유지됩니다. 여기서, Tupfel long-fin(TL) 변형이 사용됩니다.
- 다음날 아침에 장벽을 제거하고 자연 산란을 통해 짝짓기를 할 수 있도록 합니다.
- 짝짓기 탱크에서 알을 모으십시오.
- 수정되지 않은 난자 및 기타 잔해물을 제거한 다음 난자를 페트리 접시(n = 60)로 옮기고 배아 배지(1.5mM HEPES, pH 7.6, 17.4mM NaCl, 0.21mM KCl, 0.12mM MgSO4 및 0.18mM Ca(NO3)2)에서 28°C의 인큐베이터에서 키웁니다.
- 배아 배지의 절반을 재생하고 6 dpf까지 매일 죽은 유충을 제거합니다.
참고: 모든 실험은 수정 후 6일(dpf)에 개별 유충에 대해 수행되었습니다.
2. 약리학 적 제제 및 유충의 전처리
- 아포모르핀과 케타민을 E3 배지에 용해시켜 각각 500μM 및 10mM 원액을 만듭니다.
- 할로페리돌을 100% 디메틸 설폭사이드(DMSO)에 용해시켜 10mM 원액을 만듭니다. 사용된 DMSO의 최종 농도는 0.1%였습니다.
- 0.1% DMSO 및 E3 매체를 차량 제어로 사용합니다.
- 다음 최종 농도의 약물을 사용하십시오 : 10 mg / mL의 아포 모르핀, 1 mM 케타민 및 20 μM 할로페리돌16.
- 아포모르핀 및 케타민 그룹 유충을 10분 동안 사전 노출시키고 할로페리돌 및 DMSO 차량 대조군을 20분 동안 사전 노출시킵니다16.
3. 동작 테스트 전 설정
- 실험 당일, 유충과 모든 관련 물질을 실험실로 옮깁니다. 실험실을 27 ± 1 °C의 온도로 설정합니다.
- 테스트 챔버의 배경 소음이 가능한 한 낮은지, 가급적이면 45dB 음압 레벨(SPL)을 넘지 않는지 확인하십시오.
- 테스트 챔버에 데시벨(dB) 미터의 초음파 마이크 마이크를 설치합니다(설치 구멍은 이미 제조업체에서 뚫었습니다).
- 실내의 배경 소음을 줄이려면 맞춤형 사운드 부스로 테스트 챔버를 단열하십시오(이상view 설정).
- 프리펄스 억제 테스트를 위해 96웰 플레이트를 준비합니다.
참고: 비디오 카메라의 해상도는 2048 × 500픽셀이므로 한 번에 최대 3레인(33웰)만 이미지화할 수 있습니다.- 그림자의 간섭을 줄이기 위해 96웰 형식의 맞춤형 아크릴 플레이트를 사용하십시오.
알림: 맞춤형 플레이트에 대한 측정은 다음 웹사이트에서 찾을 수 있습니다. https://zenodo.org/record/3739378#.XooyLW5uKas
- 그림자의 간섭을 줄이기 위해 96웰 형식의 맞춤형 아크릴 플레이트를 사용하십시오.
- 이송 피펫을 사용하여 유충 1마리가 포함된 310μL의 노출 용액/배지를 각 웰로 이송합니다.
- 스테레오의 볼륨 노브를 사용하여 자극 강도를 보정하고 측정합니다 ampliifier와 데시벨 미터는 각각 입니다.
- "레벨 참조" 섹션에서 최대 사운드 강도를 등록하십시오.
4. 자극 매개 변수 및 비디오 획득
- 컴퓨터를 켜고, ampliifier 시스템 및 dB 미터(이상view 설정).
- 볼륨 노브를 최소 또는 최대로 돌려 사용하여 사운드 강도를 조정합니다.
- 매번 dB 미터로 사운드 레벨을 확인하고 볼륨 노브를 조정합니다. 이것은 설정에서 생성할 수 있는 최대 및 최소 사운드 강도를 찾는 데 중요합니다.
참고: dB 미터는 자극에 대한 RMS dB 출력을 계산합니다. 이 시스템은 테스트 챔버의 고체 구성 요소 내부에서 소리를 생성하여 플레이트를 견고하게 유지하면서 전체 플레이트 지지대의 수평면에서 진동을 생성합니다.- 볼륨 노브를 최대로 조정하고 dB 미터로 사운드 강도를 측정한 다음 이 값을 사용합니다.
- 매번 dB 미터로 사운드 레벨을 확인하고 볼륨 노브를 조정합니다. 이것은 설정에서 생성할 수 있는 최대 및 최소 사운드 강도를 찾는 데 중요합니다.
- PPI 생성기의 인터페이스에서 매개변수를 정의합니다: Delay로 표시되는 inter-stimulus interval; 획득 델타 시간으로 표시되는 재판 간 간격; prepulse 등의 지속 시간
- prepulse 단독 시험의 경우, Startle 매개변수에 대한 "진폭" 또는 자극 지속 시간이 0으로 설정되고 그 반대의 경우도 마찬가지입니다.
- 평가판 목록을 생성하려면 추가를 선택하고 평가판에 이름을 지정합니다>. 예를 들어, "Prepulse 50 dB alone"입니다.
참고: 원하는 만큼 평가판을 생성할 수 있지만 프로그램이 충돌할 수 있으므로 목록의 길이에 주의하십시오.- 의사 랜덤 순서를 사용하는 모든 PPI 실험에서 펄스 단독 시험과 프리펄스 시험을 인터리브합니다. 실험에서 여러 자극이 제시되는 경우 30초의 재판 간 간격(ITI)이 사용됩니다.
참고: 이 연구에서는 660Hz의 100ms 놀람 자극(펄스)과 440Hz의 5ms 사전 펄스 자극이 사용되었습니다. PPI 실험의 경우, 자극 간 구간(ISI)은 100ms였습니다.
- 의사 랜덤 순서를 사용하는 모든 PPI 실험에서 펄스 단독 시험과 프리펄스 시험을 인터리브합니다. 실험에서 여러 자극이 제시되는 경우 30초의 재판 간 간격(ITI)이 사용됩니다.
- 프로토콜을 저장하려면 파일 > 다른 이름으로 저장을 선택합니다.
- 다음과 같이 테스트 챔버의 조명 조건을 조정합니다.
- USB 측정 컴퓨팅을 시작하고 아날로그 출력을 선택한 다음 D/A OUT O(P13)로 이동하여 조명을 변경합니다. 값이 0이면 조명이 없음을 의미하고 D/A OUT O 값을 증가시키면 상자 내의 빛의 강도가 증가합니다. 모든 실험에 100의 광도가 사용되었습니다.
- 카메라 설정
- 소프트웨어를 실행하고 카메라가 로드될 때까지 기다립니다.
- 조정(오른쪽에 있음)을 선택하고 획득 프레임 속도를 1,000으로 설정한 다음 적용을 클릭하여 변경 사항을 적용합니다.
- 실험을 시작하기 전에 5분 동안 100% 조명이 켜진 테스트 챔버에 유충을 적응시킵니다.
- 실험을 시작하려면 PPI 생성기에서 실험 메뉴를 선택하고 실행을 클릭한 다음 웰 형식(예: 33웰)을 선택합니다.
- 실험을 실행하기 전에 항상 카메라 소프트웨어가 올바른 설정으로 실행되었는지 확인하십시오.
- 각 평가판에 대해 2초 비디오를 획득하십시오.
- 획득 프레임 속도가 1,000으로 설정되어 있는지 확인합니다.
5. 음향 놀람 응답 및 PPI의 자동화된 추적 및 분석
- 프로토콜 설정.
- 해석 소프트웨어를 시작합니다( 재료 표 참조). 템플릿에서 새로 만들기를 선택하고 미리 정의된 템플릿을 적용> 다음 다른 메뉴로 이동합니다(아래 세부 정보 참조).
- 비디오 소스 아래의 비디오 파일에서 선택합니다.
- 비디오 파일을 찾습니다. 주제를 fish > zebrafish 유충 > 구역 템플릿으로 설정합니다(템플릿 없음). 아레나 아래에서 아레나 수를 지정합니다.
- Subjects에서 Number of subjects per arena (1로 설정)를 지정합니다.
- 추적된 피쳐에서 중심점, 노즈 포인트 및 꼬리 기반 감지를 선택합니다(그림 2A, B 참조).
참고: 이것은 C-start 응답의 몸체 각도를 계산하는 데 중요합니다( 그림 2C 참조). - Name(이름)> 다른 이름으로 저장(Save As)을 클릭합니다. 사용되는 단위는 각각 거리, 시간 및 회전에 대한 mm, s, deg입니다.
알림: 저울을 교정할 때 동일한 단위를 사용하는 것을 잊지 마십시오.
- 아레나 설정을 선택합니다.
- 배경 이미지 가져오기를 클릭합니다.
- 오른쪽 메뉴의 단계를 진행합니다(확실하지 않은 경우 도움말 메뉴 사용).
- 원형 그리기 도구를 선택하여 경기장을 그립니다.
- 평가판 제어 설정을 선택하여 새 > 이름을 만들>.
- 검색 설정을 선택하고 오른쪽 메뉴의 단계를 진행합니다.
- 샘플 속도를 25로 설정합니다. 고급 검색 설정을 선택합니다. 방법에서 dynamic subtraction, advanced model/adult fish를 선택한 다음 배경과 비교한 Subject color 를 Darker 로 설정하고 슬라이더를 이동하여 유충의 대비를 정의합니다.
- 피험자 윤곽선에서 먼저 erode를 선택한 다음 동물이 완전히 감지될 때까지 윤곽 침식 및 팽창 값을 확장하고 증가시킵니다.
- 프로토콜을 저장하고 수집된 PPI 비디오의 후속 분석에 사용합니다.
- 해석 소프트웨어를 시작합니다( 재료 표 참조). 템플릿에서 새로 만들기를 선택하고 미리 정의된 템플릿을 적용> 다음 다른 메뉴로 이동합니다(아래 세부 정보 참조).
- 평가판 목록 설정.
- 시험 목록을 선택하고 유충 ID, 치료, 자극 유형 등과 같은 독립 변수를 정의합니다. 비디오의 경로를 선택하고 배치 획득을 위한 평가판 목록을 정의합니다.
- 획득 설정.
참고: 평가판 목록이 생성된 경우 비디오의 일괄 획득을 수행할 수 있습니다.- 일부 트랙이 손실된 경우 트랙 편집기를 사용하여 추적된 기능을 조정합니다.
- 트랙 편집기를 사용한 후 해결되지 않은 상태로 남아 있는 추적 오류를 분석에서 제외합니다.
- 트랙 스무딩 프로파일을 1mm로 설정하여 데이터의 노이즈를 줄입니다. 이것은 유충의 배경 활동에 따라 조정할 수 있습니다.
- 해석 설정.
- 분석할 시도를 선택하려면 데이터 프로필을 선택하고 관심 있는 독립 변수를 기반으로 추적을 정의합니다.
참고: 구성 요소가 숨겨져 있으면 오른쪽 상단 모서리에 있는 눈 기호를 클릭하여 표시합니다.- 분석할 임상시험의 일부를 필터링합니다(예: 치료 또는 자극 그룹의 유형을 기반으로 함).
- 분석할 트랙의 일부를 선택합니다(중첩). 이 연구를 위해 데이터는 자극 시작과 자극 시작 후 100ms 사이의 추적에 대해 중첩되었습니다.
- 지침을 완료하려면 모든 필터와 중첩 상자를 화살표 선으로 연결하는 것을 잊지 마십시오.
- 분석할 종속 변수를 정의하고, 분석 프로파일을 선택하고, 관심 있는 변수를 지정합니다(종속 변수 아래의 본문에 초점).
참고: 구성 요소가 숨겨져 있으면 오른쪽 상단 모서리에 있는 눈 기호를 클릭하여 표시합니다.- 몸체 각도를 두 번 클릭합니다. 절대 절곡부를 선택합니다. 평가판 설정으로 이동하여 최대값을 선택한 다음 추가를 클릭합니다.
- 본체 각도 상태를 두 번 클릭합니다. 평균 간격을 5개 샘플로 설정합니다. 절곡부 각도 임계값을 설정합니다. 굽힘에 대한 통계를 계산하려면 평가판 통계를 살펴보고 먼저 추가할 > 대기 시간을 선택합니다. 다양한 임계값(20–80° 사이가 사용됨)을 얻을 때까지 단계를 반복하고 그에 따라 이름을 지정합니다.
- 통계 및 차트 생성.
- 통계 및 차트> 분석 > 결과를 선택한 다음 계산을 클릭합니다.
- 각 섹션 아래에 여러 템플릿을 만들 수 있으므로 데이터 및 분석 프로필이 올바른 템플릿으로 설정되어 있는지 확인하십시오.
- 시험 및 그룹 통계를 처리 및 분석을 위해 스프레드시트 파일로 내보냅니다.
- 분석할 시도를 선택하려면 데이터 프로필을 선택하고 관심 있는 독립 변수를 기반으로 추적을 정의합니다.
6. 데이터 분석
- 시행 통계가 포함된 스프레드시트 파일을 엽니다.
- Body angle Maximum deg, Bent latency(다양한 신체 각도 임계값) 열을 선택합니다.
- 자극 시작 후 50ms의 컷오프 대기 시간 내에 30°≥ 신체 각도의 모든 변화를 긍정적인 C-start 반응(즉, 반응자)으로 간주합니다. 신체 각도< 30°인 사람들은 반응하지 않습니다.
- 이진 방식으로, 각 플레이트에 대해 반응하는 유충에 1을 할당하고 응답하지 않는 유충에 0을 할당합니다.
- 각 플레이트에 대한 응답자와 비응답자 유충의 총 수를 계산합니다. 각 경우의 응답자(%)를 (응답하는 유충 수/총 유충 수) × 100으로 계산합니다. 놀람 자극에 30% 미만으로 반응하는 유충은 분석에서 제외한다16.
참고: 유충의 70% 또는 그 이상으로 C-start 반응을 이끌어낼 수 있는 모든 자극 강도는 적절한 놀람 자극16으로 간주된다.
- 각 플레이트에 대한 응답자와 비응답자 유충의 총 수를 계산합니다. 각 경우의 응답자(%)를 (응답하는 유충 수/총 유충 수) × 100으로 계산합니다. 놀람 자극에 30% 미만으로 반응하는 유충은 분석에서 제외한다16.
- %PPI를 100으로 계산합니다×(놀람 자극에 반응하는 백분율 - 프리펄스 + 놀람 시퀀스에 반응하는 백분율)/ (놀람 자극에 반응하는 백분율)16.
7. 통계 분석
- 데이터를 표준 편차± 평균으로 제시, S.D. (통계 소프트웨어는 재료 표 참조).
- 유충 반응에 대한 다양한 prepulse intensitys의 효과를 one-way ANOVA와 Tukey의 post-hoc test를 사용하여 확인합니다.
- 양방향 분산 분석(two-way ANOVA)과 Holm-Sidak의 사후 검정(post-hoc test)을 사용하여 다양한 프리펄스 강도에서 % PPI 반응에 대한 약물 치료의 효과를 확인합니다.
결과
유충 제브라피시에서 음향 놀람 반응의 사전 펄스 억제를 분석하기 위해 여러 시스템을 결합하는 프로토콜을 검증하기 위해 세 가지 실험이 수행되었습니다. 첫째, 음향 자극을 정확하게 전달하고 놀람 자극에 대한 유충의 반응을 포착하는 능력을 테스트했습니다. 다음으로, 프리펄스(prepulse) 자극이 제시될 때 놀람 반응을 감쇠하는 능력을 검증하는 것이었습니다. 마지막으로, 아포모르핀(apomorphine), 할로페리돌(haloperidol) 및 케타민(ketamine) 약물에 의한 놀람 반응의 프리펄스(prepulse) 억제의 약리학적 조절을 검출하는 능력이 확립되었다.
유충 얼룩말은 음향 놀람 자극에 반응합니다.
이전 연구는 애벌레 제브라피쉬가 놀라운 음향 자극을 받았을 때 특징적인 C-start를 나타낸다는 것을 보여주었다16. 놀람 자극에 대한 유충의 행동을 자극하고 포착하는 능력이 테스트되었습니다. 기록된 유충은 C-start 반응을 나타내는 것으로 관찰되었습니다(그림 2). 70dB re(100ms, 660Hz, 보충 그림 1A)의 자극은 유충의 ≥70%에서 반응을 이끌어낼 만큼 충분히 강했습니다(그림 3A). 30초의 실험 간 간격으로 30회 반복적으로 제시했을 때, 70dB 재 자극은 그림 3B와 같이 유충 습관화(N = 3회 반복, 16회 유충/복제)를 초래하지 않았습니다.
Prepulse는 음향 자극에 대한 유충 제브라피쉬의 놀람 반응을 감소시킵니다.
많은 증거에 따르면 프리펄스 자극은 놀람 자극에 대한 유충 반응을 조절합니다 15,21,22,26. 두 개의 펄스 패러다임이 사용되었는데, 여기서 프리펄스(prepulse)라고 불리는 약한 자극이 펄스(pulse)라고 불리는 놀람을 유발하는 자극보다 선행했습니다. 사용된 사전 펄스 자극은 70dB re로 설정된 펄스 자극보다 20, 17 또는 14dB 낮았습니다. 프리펄스(5ms, 440Hz)는 항상 펄스가 시작되기 100ms 전에 표시되었습니다(보충 그림 1B). 테스트된 각 사전 펄스 자극은 펄스에 대한 유충 반응을 현저히 감소시켰습니다. 그림 4에서 음향 놀람 자극에 대한 유충 반응(%)은 E3 매체에서 6 dpf TL, N = 6(16 유충/그룹)에 대해 표시됩니다. 놀람 자극(맥박)에 반응하는 유충의 비율은 79.86 ± 9.772였다. 예상대로, 놀람 자극이 50, 53 또는 56dB의 프리펄스에 선행했을 때, 유충 반응은 각각 40.87%± 11.30%, 39.58%, 7.345%± 29.17%, 9.350%± 감소했다. 일원 분산 분석은 유충에 대한 자극 효과의 통계적 차이를 보여주었으며(F (3, 48) = 57.23, P < 0.0001), Tukey의 다중 비교 검정은 95% 신뢰 구간에서 그룹 간에 통계적 유의성을 보여주었습니다.
prepulse 억제의 약리학적 조절
이전 연구에서는 도파민 약물인 아포모르핀(apomorphine)과 할로페리돌(haloperidol)과 글루타메이터성 약물인 케타민(ketamine)이 포유류 및 설치류와 마찬가지로 유충의 프리펄스(prepulse) 억제를 유의하게 조절하는 것으로 나타났다16. 설정의 검증을 위한 농도는 이러한 연구를 기반으로 선택되었습니다. 모든 약리학 실험에 대한 자극 간 간격(ISI)은 100ms였습니다.
프리펄스 억제에 대한 아포모르핀의 효과
그림 5에서, 10mg/mL 아포모르핀으로 10분 동안 전처리된 유충은 E3 대조군 유충에 비해 PPI가 전반적으로 감소한 것으로 나타났습니다(양방향 ANOVA, non RM(요인: 처리 및 프리펄스 강도; 처리: F(1, 34) = 16.21, p = 0.0003; 프리펄스 강도: F(2, 34) = 8.674, P = 0.0009, 이는 유의하지 않은 상호작용을 보여주었습니다: F(2, 34) = 2.514, p = 0.0959). 차이를 더 자세히 조사하기 위해 Holm-Sidak의 사후 테스트는 E3 대조군과 아포모르핀 처리된 유충 간의 놀람 반응에서 사전 펄스 강도 53(p = 0.0126) 및 56(p = 0.0044)에서 그러나 50dB(p = 0.5813)에서는 그렇지 않은 놀람 반응에서 상당한 차이를 보여주었습니다.
프리펄스 억제에 대한 할로페리돌의 효과
그림 6 은 E3 매체와 비교하여 20μM 할로페리돌로 20분 동안 전처리된 유충의 %PPI의 전반적인 증가를 보여줍니다(양방향 ANOVA, non RM(요인: 처리 및 사전 펄스 강도; 처리: F(1, 32) = 20.75, p < 0.0001, 사전 펄스 강도: F(2, 32) = 3.147, p = 0.0565, 유의한 상호 작용 없음: F(2, 32) = 0.7455, p = 0.4826). Holm-Sidak의 사후 검정을 사용하여 통계적 유의성의 존재는 사전 펄스 강도 53(p = 0.00489 및 56(p = 0.0348)에서만 관찰되었지만 50dB(p = 0.067)에서는 관찰되지 않았습니다.
프리펄스 억제에 대한 케타민의 효과
그림 7 은 서로 다른 프리펄스 자극 강도에서 1.0mM 케타민에서 E3 대조군 유충과 10분 동안 전처리된 유충 간의 놀람 반응에 차이가 있음을 보여줍니다(양방향 ANOVA, non RM(요인: 처리 및 사전 펄스 강도; 처리: F(1, 35) = 25.46, p < 0.0001; 사전 펄스 강도: F(2, 35) = 6.018, p = 0.0057, 유의한 상호 작용 없음: F (2, 35) = 0.8450, p = 0.4381). Holm-Sidak의 사후 테스트는 50(p = 0.0039) 및 53(p = 0.0027)의 사전 펄스 강도에서만 유의성을 보였지만 56dB(p = 0.0802)에서는 유의성을 보여주지 않았습니다.

그림 1: 테스트 장치. (A) 장비 설정 개요. (B) 실험 중 배경 소음을 최소화하기 위해 설치 장비의 사내 단열. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
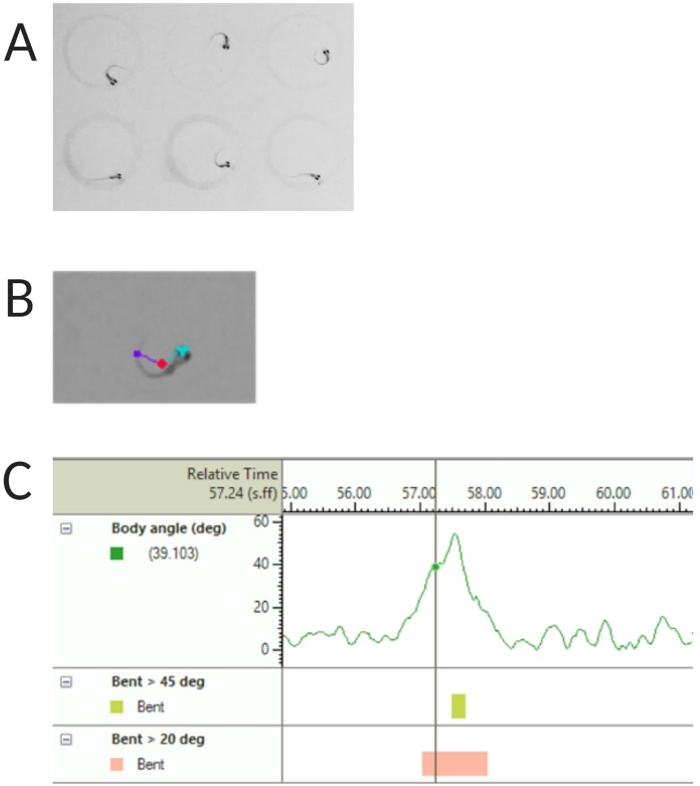
그림 2: 유충 제브라피쉬의 음향 놀람 반응 분석. (A) 6 dpf에서 6 제브라 피쉬 유충에 의해 표시되는 특징적인 C-start. (B) 6 dpf 유충에 겹쳐진 세 가지 추적 된 특징의 대표 이미지 : center point (빨간색), nose-point (청록색) 및 tail-base (보라색). (C) 6-dpf TL 야생형 유충이 표시하는 절대 굽힘 각도의 대표 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: acoustic startle threshold의 결정. (A) 70dB(빨간색 점선으로 표시)의 자극 강도는 유충의 >70%(N = 33, 6dpf TL)에서 C-start 반응을 이끌어낼 수 있습니다. (B) 유충은 30초의 실험 간 간격으로 30회(시험) 제시된 70dB re 자극에 습관화되지 않습니다(N = 3회 반복, 16회 유충/복제). 데이터는 평균 ± S.D.로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 사전 펄스로 인한 유충 반응 감소(%). 20, 17 및 14 dB에서 70 dB보다 낮은 사전 펄스 자극은 야생형 TL 유충 C-start 반응자의 수를 감소시킵니다. 평균 ± S.D., N = 5(유충 16개/그룹), ****p < 0.0001로 표시되는 모든 데이터는 일원 분산 분석 후 Tukey의 사후 검정에 의한 놀람 자극과 유의하게 다릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 아포모르핀으로 인한 %PPI 결핍. 모든 데이터는 평균 ± S.D., N = 4\u20125(유충 16마리/그룹)로 표시되며, 이는 양방향 분산 분석 후 Holm-Sidak의 사후 검정에 의해 통계적으로 유의한 차이입니다. *p = 0.0126, 53dB에서 E3 ctl/아포모르핀 처리군; **p = 0.0044, 56dB에서 E3 ctl/아포모르핀 투여군. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
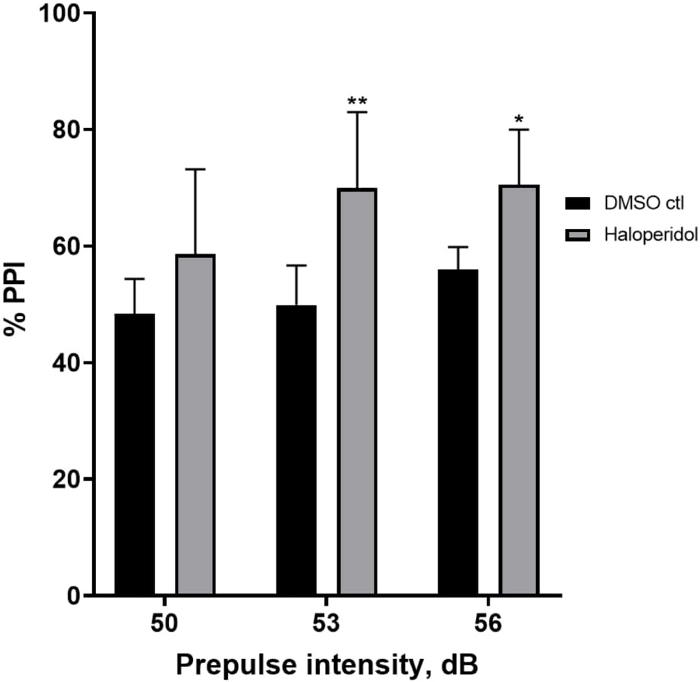
그림 6: 할로페리돌은 %PPI에서 향상을 유도했습니다. 모든 데이터는 평균 ± S.D., N = 4\u20125(16 유충/그룹)로 표시되며, 이는 양방향 분산 분석 후 Holm-Sidak의 사후 검정에 의해 통계적으로 유의미한 차이입니다. **p = 0.0048, 53dB에서 DMSO ctl/아포모르핀 처리군; *p = 0.0348, 56dB에서 DMSO ctl/아포모르핀 처리군. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7: 케타민은 %PPI에서 향상을 유도했습니다. 평균 ± S.D, N = 4\u20125 (유충 16명/그룹)로 표시되는 모든 데이터는 양방향 무분석 **p = 0.0039, 50dB에서 E3 ctl/아포모르핀 처리군, **p = 0.0027, 53dB에서 E3 ctl/아포모르핀 처리군 후 Holm-Sidak의 사후 검정에 의해 통계적으로 유의한 차이로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 영상 1: 70dB의 음향 놀람 자극에 반응하여 C-start를 나타내는 유충의 대표적인 영상. 이 비디오를 다운로드하려면 여기를 클릭하십시오.
보충 그림 1: PPI 생성기를 사용하여 생성된 자극 조건의 대표적인 예. (A) 자극 단독 시험, (B) 사전 펄스 억제 시험(사전 펄스 + 펄스), (C) 자극되지 않은 유충의 임계값 기준선 굽힘 각도를 측정하기 위한 자극 없음 시험. 이 그림을 다운로드하려면 여기를 클릭하십시오.
토론
신경행동 연구를 위한 프로토콜을 개선하고 개선하기 위해 새로운 행동 분석 시스템을 검증하는 것이 필수적입니다. 현재 조사에서는 제브라피시 유충에서 음향 놀람 반응을 유도하고 이전에 설명된 이러한 행동의 약리학적 조절을 감지하고 정량화하는 두 가지 상용 시스템 및 소프트웨어의 능력을 평가했습니다.
설정을 최적화하기 위해 여러 가지 수정 및 문제 해결이 수행되었습니다. C-start 반응 분석을 위한 기본 소프트웨어는 모든 실험에 대한 데이터를 획득한 후 분석이 자동으로 진행되는 것이었습니다(22회 시행/플레이트가 하나의 실험으로 구성됨). 이로 인해 하루에 실행할 수 있는 플레이트의 수가 줄어들어 처리량(하루에 5개의 플레이트)이 줄었습니다. 이러한 제한을 피하기 위해 데이터 수집 프로세스에서 분석 소프트웨어를 분리해야 했으며, 이로 인해 처리량이 하루 평균 10개의 플레이트로 증가했습니다. 따라서 비실시간 분석을 위해 독립적인 분석 소프트웨어로 전환하기로 한 결정은 성공적이고 효율적인 것으로 입증되었습니다. 데이터에 노이즈를 유발하는 그림자 또는 기타 파편의 간섭을 피하려면 우물을 매체로 완전히 채우고 모든 기포를 제거하며 유충으로 오인되어 데이터에서 노이즈를 생성할 수 있는 음식 입자 등을 피하는 것이 좋습니다. 소리 자극의 구경측정 후에, 테스트 약실에 있는 처음 배경 소음은 60 dB re인 그러나, dB 미터에 의해 붙잡은 것과 같이 증폭기 체계에 의해 도달할 수 있는 최대 강렬은 85 dB re이었습니다. 이로 인해 작동할 수 있는 dB 창이 좁아졌습니다. 따라서 배경 소음을 가능한 한 최소화하는 것이 중요했습니다. 이를 달성하기 위해 파라폰 음향 재료( 재료 표 참조)를 사용하여 테스트 챔버 주변에 추가 절연층을 구축하고 보컬 부스 번들을 사용하여 추가 절연층을 구축했습니다( 재료 표 참조). 이러한 절연 층을 통해 테스트 챔버 내부의 배경 소음이 초기 60dB에서 45dB로 성공적으로 감소했습니다.
현재 이 설정의 한 가지 장점은 모든 구성 요소가 상업적으로 이용 가능하며 따라서 소수의 실험실에만 국한되지 않는다는 것입니다. 코딩 언어에 대한 지식이 부족한 개인은 프로토콜이 이해하고 따르기가 다소 쉽기 때문에 사용할 수 있습니다. 예를 들어, PPI 시스템을 사용하여 다양한 자극 간 및 시험 간 간격으로 펄스와 프리 펄스를 전달할 수 있을 뿐만 아니라 이러한 자극에 대한 유충 반응을 캡처할 수 있었습니다. 이러한 행동이 포착되면 분석 소프트웨어를 사용하여 대응자와 비대응자로 분류할 수 있습니다. 응답자 그룹은 <50ms의 잠복시에서 30° 이상의 C-start를 보이는 유충으로 분류되었습니다. 또한, PPI 반응은 도파민 및 글루타메이터 신호 전달을 표적으로 하는 약물에 의해 조절됩니다(Geyer와 동료에 의해 검토됨27). 이전 연구와 일관되게 비선택적 도파민 수용체 작용제인 아포모르핀은 유충 제브라피시에서 놀람 반응의 사전 펄스 억제를 감소시켰고, 도파민 길항제인 할로페리돌은 반응을 향상시켰습니다. 유충 제브라피쉬에서 케타민은 ISI16의 지속 시간에 따라 PPI를 차등적으로 조절하는 것으로 나타났습니다. 앞서 언급한 연구에서 유충 PPI는 30ms에서 향상되었지만 케타민으로 전처리했을 때 500ms ISI에서 억제되었습니다. 이 연구는 가변 ISI를 사용하지 않았지만 케타민이 100ms의 ISI에서 PPI를 향상시킨다는 관찰은 30ms의 ISI를 사용했을 때 이전 연구의 데이터와 비교할 수 있습니다. 이 연구는 이러한 상업적으로 이용 가능한 시스템을 결합함으로써 PPI 분석을 수행하고 제브라피시 유충 PPI 반응에서 약리학적으로 유도된 변화를 안정적으로 감지할 수 있음을 보여주었습니다. 이 시스템의 한계는 분석 소프트웨어에 의해 추적되는 코-포인트 특징이 항상 유충의 눈 중 하나에 떨어지기 때문에 기준선 각도가 생성된다는 것입니다. 이를 극복하기 위해서는 항상 자극되지 않은 유충의 기준선 굽힘 각도를 결정해야 하며, 이는 본 연구에서 사용된 유충에 대해 ~30°인 것으로 나타났습니다. 따라서, 놀란 유충에서 긍정적인 C-start 반응으로 간주되는 임계값으로 30°를 선택하는 기초를 형성했습니다. 이러한 점을 고려하면 설정 장비에 액세스할 수 있는 모든 실험실에서 PPI 분석을 수행할 수 있어야 합니다. 이 논문은 지연 시간의 가변성 범위 때문에 앞서16 보고된 바와 같이 놀람 반응의 운동학을 짧은 지연 시간과 긴 지연 시간으로 분류하는 데 초점을 맞추지 않았습니다. 따라서, 자극 시작 후 50ms 15.
균주 차이는 여러 분석에서 제브라피시 행동에 영향을 미치는 것으로 보고되었습니다 28,29,30,31 청력 민감도에도 영향을 미칠 뿐만 아니라32. 따라서 테스트된 각 변형률의 기준선 굽힘 각도를 결정하는 것이 중요합니다. 청력 민감도도 다를 수 있기 때문에 기준선 놀람 반응, 각 긴장에 대한 사전 펄스 또는 놀람 자극으로 가장 적합한 소리 강도 및 자극이 제시되는 지속 시간을 결정하는 것이 중요합니다. ISI는 일부 약물이 프리펄스와 깜짝 자극 발병 사이의 간격에 따라 PPI를 강화하거나 감소시킬 수 있기 때문에 신중하게 고려해야 하는 또 다른 매개변수입니다16. 인지 기능, 신경 정신 장애 및 청각(청각 기능) 연구에 관심이 있는 실험실은 이 PPI 설정 및 프로토콜이 약리학 및/또는 유전 모델을 스크리닝하는 데 유용할 것으로 기대합니다. 이 프로토콜은 또한 화합물 라이브러리의 고처리량 스크리닝을 위한 기초를 제공합니다.
공개
저자는 경쟁하는 재정적 이해관계가 없다고 선언합니다.
감사의 말
물고기를 잘 관리하고 방음 부스 테스트 및 설치에 귀중한 도움을 준 Ana Tavara와 João Paulo R. P. Santana에게 감사드리며, EthoVision 소프트웨어 설정에 대한 초기 지원을 해주신 Wietske van der Ent 박사님께 감사드립니다. 이 연구는 노르웨이 연구 위원회(ISP, BIOTEK2021/DigiBrain)의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
참고문헌
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유