Method Article
商用自動化システムとソフトウェアを使用したゼブラフィッシュ幼生の驚愕反応のプレパルス阻害の薬理学的検証
要約
ここでは、ゼブラフィッシュの幼生におけるプレパルス阻害(PPI)アッセイを薬理学的に検証するために、市販の自動化システムを利用するプロトコールについて説明します。
要約
げっ歯類のプレパルス阻害(PPI)アッセイを実施するための市販の標準化された自動化システムやソフトウェアは豊富にありますが、私たちの知る限りでは、ゼブラフィッシュで実施されるすべてのPPIアッセイは、これまで個々のグループのみが利用できるカスタムメイドのシステムを使用して行われてきました。そのため、特にデータの再現性と標準化の問題に関して課題が生じています。本研究では、ゼブラフィッシュの幼生におけるPPIアッセイを薬理学的に検証するために、市販の自動化システムを利用したプロトコールを作成しました。発表された知見と一致して、アポモルヒネ、ハロペリドール、ケタミンの結果を、ゼブラフィッシュの幼生の受精後6日間のPPI応答で再現することができました。
概要
ゼブラフィッシュ(Danio rerio)の幼生は、多くの利点があるため、統合失調症などの精神疾患のモデリングに適した候補です(Gawel et al.1によるレビュー)。これらには、ヒトのオルソログ2と70%の配列相同性を持つ完全に配列決定されたゲノム、ゲノムを操作し、特定の遺伝子の発生または疾患への寄与を特定するための順方向および逆方向の遺伝ツールの存在3、およびゼブラフィッシュの脳4における主要なヒト/げっ歯類の神経伝達物質の存在が含まれます。ゼブラフィッシュには、不安、学習、記憶など、いくつかの神経表現型領域があります3。光学的透明性と神経向性薬の主要なクラスに対する感度により、薬理学的操作や表現型薬物スクリーニングの理想的な候補となっています5,6。
ハイスループットの薬物スクリーニングを行うには、自動化と堅牢なエンドフェノタイプの存在が非常に重要です7。例えば、チグモタキシス、驚愕反応、視運動反応、光運動反応、慣れ、獲物捕獲、睡眠/覚醒行動、自発運動行動など、ゼブラフィッシュの幼生の行動を測定するためのさまざまな自動記録技術が開発されてきた6。一部の研究室では、これらの挙動の一部を自動測定および分析するためのカスタムビルドシステムを開発していますが、市販のイメージングおよびソフトウェアシステム8,9,10,11があります。プレパルス阻害(PPI)は、驚愕刺激の少し前に弱い非驚愕刺激が提示されると驚愕反応が低下する感覚運動ゲーティングの一種であり、動物モデルで統合失調症を研究するためのエンドフェノタイプとして使用されてきた(12,13によるレビュー)。さらに、音響驚愕反応(ASR)とPPIは、ゼブラフィッシュ14,15を含む動物モデルにおける聴覚および聴覚機能の研究において有用な役割を果たしています。ゼブラフィッシュの幼生は、予期せぬ驚くべき刺激に反応して特徴的なCスタートを示しますが、プレパルスと呼ばれる弱い刺激によって軽減されます。Cスタートは、異なる神経細胞集団によって制御される逃避行動として長い間説明されており、ゼブラフィッシュの幼生15,16,17で徹底的に特徴付けられてきました。
げっ歯類18,19,20でPPIアッセイを実施するための商用および標準化された自動化システムとソフトウェアが豊富にあります。しかし、私たちの知る限りでは、これまでゼブラフィッシュで実施されたすべてのPPIアッセイは、個々のグループ15、16、21、22のみが利用できるカスタムメイドのシステムを使用して行われてきました。このことは、標準化23に関してデータの再現性と再現性を達成するための課題を提示する。
最近、ゼブラフィッシュコミュニティの有名なベンダーが、ゼブラフィッシュの幼生24でPPIアッセイを実施するための高速カメラとPPIジェネレーターアドオンが組み込まれたセットアップを開発しました。カメラは毎秒1000フレームで記録し、Cスタートなどの高速動作の記録を可能にし、一方、PPIジェネレータは、驚愕反応を呼び起こすためのさまざまな音響刺激のユーザー制御の配信を可能にする24。ここでは、前述のシステムを、複雑な挙動の自動分析用に設計された市販の包括的なソフトウェアパッケージ11と組み合わせて、ゼブラフィッシュの幼生におけるPPI応答アッセイを実施するためのプロトコルを生成する。1) アポモルヒネを使用して PPI 応答を薬理学的に検証します。これは、PPI の欠損を引き起こすことが知られているドーパミン アゴニストです。2)ハロペリドール、PPIを増強することが知られているドーパミン拮抗薬および抗精神病薬、3)ケタミン、PPIを調節することが知られているNMDA受容体拮抗薬。
プロトコル
すべての動物実験は、ノルウェー食品安全局の実験動物管理局の監督および申請システム(FOTS-18/106800-1)によって承認されました。
1.ゼブラフィッシュの飼育
- 野生型の成体ゼブラフィッシュ(Danio rerio)の成体ゼブラフィッシュ(Danio rerio)の交配を設定し、前夜に標準条件25 で維持します。ここでは、Tupfelロングフィン(TL)株を使用します。
- 翌朝、障壁を取り除き、自然産卵を通じて交尾できるようにします。
- 交配タンクから卵を集めます。
- 未受精卵やその他の破片を取り除き、卵をシャーレ(n = 60)に移し、胚培地(1.5 mM HEPES、pH 7.6、17.4 mM NaCl、0.21 mM KCl、0.12 mM MgSO4、および0.18 mM Ca(NO3)2)のインキュベーターで飼育します。
- 胚培地の半分を更新し、死んだ幼虫を6 dpfまで毎日取り除きます。
注:すべての実験は、受精後6日(dpf)で個々の幼虫に対して行われました。
2. 幼虫の薬理学的薬剤と前処理
- アポモルヒネとケタミンをE3培地に溶解して、それぞれ500 μMと10 mMのストック溶液を調製します。
- ハロペリドールを100%ジメチルスルホキシド(DMSO)に溶解して、10 mMのストック溶液を作ります。使用したDMSOの最終濃度は0.1%でした。
- 車両制御として0.1%DMSOおよびE3媒体を使用します。
- 次の最終濃度の薬物を使用してください:10 mg / mLのアポモルヒネ、1 mMケタミン、および20 μMハロペリドール16。.
- アポモルヒネ群とケタミン群の幼虫を 10 分間、ハロペリドール群と DMSO ビヒクル制御群を 20 分間16 回事前に曝露します。
3. 動作テスト前のセットアップ
- 実験当日は、幼虫と関連物質を全て実験室に移します。実験室の温度を27°C±1°Cに設定します。
- テストチャンバー内のバックグラウンドノイズができるだけ低いことを確認してください(できれば45dBの音圧レベル(SPL)以下)。
- デシベル(dB)メーターの超音波計マイクをテストチャンバーに取り付けます(取り付け用の開口部はメーカーによってすでに穴が開けられています)。
- 室内のバックグラウンドノイズを低減するには、特注のサウンドブースでテストチャンバーを断熱します(セットアップの概要については、 図1B を参照してください)。
- プレパルス阻害試験用の96ウェルプレートを調製します。
注:ビデオカメラの解像度は2048ピクセル×500ピクセルで、一度に撮影できるレーンは最大3レーン(33ウェル)のみです。- 96ウェルフォーマットのカスタムメイドアクリル板を使用して、影からの干渉を減らします。
注意: カスタムプレートの測定は、次のサイトにあります https://zenodo.org/record/3739378#.XooyLW5uKas
- 96ウェルフォーマットのカスタムメイドアクリル板を使用して、影からの干渉を減らします。
- トランスファーピペットを使用して、1匹の幼虫を含む310μLの露光溶液/培地を各ウェルに移します。
- ステレオアンプとデシベルメーターのボリュームノブをそれぞれ使用して、刺激強度を校正および測定します。
- 「レベルリファレンス」セクションに最大音の強度を登録します。
4. 刺激パラメータとビデオ取得
- コンピュータ、 amplifierシステム、dBメーター(セットアップの概要については 、図1A を参照してください)。
- 音量つまみを最小または最大に回して、音の強さを調整します。
- 毎回dBメーターで音量を確認し、音量つまみを調整します。これは、セットアップによって生成される最大音と最小の音の強さを見つけるために重要です。
注:dBメーターは、刺激のRMS dB出力を計算します。このシステムは、試験室の固体部品の内部で音を発生させ、プレートをしっかりと保ちながら、プレートサポート全体の水平面に振動を発生させます。- 音量つまみを最大に調整し、dBメーターで音の強さを測定し、この値を使用します。
- 毎回dBメーターで音量を確認し、音量つまみを調整します。これは、セットアップによって生成される最大音と最小の音の強さを見つけるために重要です。
- PPIジェネレータのインターフェースで、パラメータを定義します: 遅延として表される刺激間間隔。 Acquisition delta timeとして表される試行間間隔。プレパルスの持続時間など
- プレパルス単独の試行では、Startle パラメータの「Amplitude」または「Duration of stimulus」がゼロに設定されていることを確認し、Startle 単独の試行ではその逆も同様であることを確認してください。
- 試用版の一覧を生成するには、[ 追加 ] を選択し>試用版に名前を付けます。たとえば、「Prepulse 50 dB alone」などです。
注:必要な数の試行を生成できますが、プログラムがクラッシュする可能性があるため、リストの長さに注意してください。- 疑似ランダム順序を使用したすべての PPI 実験で、プレパルス試行とパルス単独試行をインターリーブします。実験で複数の刺激が提示される場合、30秒の試行間間隔(ITI)が使用されます。
注:この研究では、660Hzの100msの驚愕刺激(パルス)と440Hzの5msのプリパルス刺激を使用しました。PPI実験では、刺激間間隔(ISI)は100ミリ秒でした。
- 疑似ランダム順序を使用したすべての PPI 実験で、プレパルス試行とパルス単独試行をインターリーブします。実験で複数の刺激が提示される場合、30秒の試行間間隔(ITI)が使用されます。
- プロトコルを保存するには、[ ファイル ] > [名前を付けて保存] を選択します。
- 試験室内の照明条件を以下のように調整してください。
- USB測定コンピューティングを起動し、アナログ出力を選択してから、D/A OUT O(P13)に移動して照明を変更します。値がゼロの場合は光がないことを意味し、D/A OUT O 値を増やすと、ボックス内の光の強度が増加します。すべての実験で100の光強度を使用しました。
- カメラのセットアップ
- ソフトウェアを起動し、カメラがロードされるのを待ちます。
- [調整](右側にあります)を選択し、取得フレームレートを1,000に設定し、[適用]をクリックして変更を有効にします。
- 実験を開始する前に、幼虫を100%光で照らされたテストチャンバーに5分間順応させます。
- 実験を開始するには、PPIジェネレーターの[Experiment]メニューを選択し、[Run]をクリックして、選択ウェル形式(例:33ウェル)を選択します。
- 実験を実行する前に、カメラソフトウェアが正しい設定で起動されていることを常に確認してください。
- 試行ごとに 2 秒のビデオを取得します。
- 取得フレームレートが1,000に設定されていることを確認してください。
5. 音響驚愕反応とPPIの自動追跡と分析
- プロトコルのセットアップ。
- 解析ソフトウェアを起動します( 材料の表を参照)。[ テンプレートから新規 作成] > [定義済みのテンプレートを適用する ] を選択し、他のメニュー (詳細は以下を参照) に移動します。
- [ビデオソース]の下のビデオファイルから選択します。
- ビデオファイルを参照します。テーマを魚>ゼブラフィッシュの幼生>ゾーンテンプレート(テンプレートなし)として設定します。アリーナでアリーナの数を指定します。
- 「Subjects」で「Number of subjects per aren」(1に設定)を指定します。
- [追跡対象] で [Center-point]、[nose-point]、および [tail-base detection] を選択します (図 2A、B を参照)。
注:これは、Cスタート応答のボディ角度を計算するために重要です( 図2Cを参照)。 - 名前を付けて保存>[名前]をクリックします。使用される単位は、距離、時間、回転のそれぞれを表すmm、s、degです。
注意: スケールのキャリブレーションには同じ単位を使用することを忘れないでください。
- アリーナ設定を選択します。
- [背景画像を取得] をクリックします。
- 右側のメニューにある手順を実行します(不明な場合は、[ ヘルプ ]メニューを使用してください)。
- 円描画ツールを選択してアリーナを描画します。
- [試用管理の設定] を選択して>新しい>名を作成します。
- [ 検出設定] を選択し、右側のメニューの手順に従います。
- サンプルレートを 25 に設定します。検出の詳細設定を選択します。[方法] で、[動的減算]、[高度なモデル/成魚] の順に選択し、[背景と比較した対象色] を [暗い色] に設定し、スライダーを動かして幼虫のコントラストを定義します。
- [Subject contour] で、最初に [erode] を選択し、次に動物が完全に検出されるまで [contour erosion] と [dilation] の値を拡張して増加させます。
- プロトコルを保存し、取得したPPIビデオのその後の解析に使用します。
- 解析ソフトウェアを起動します( 材料の表を参照)。[ テンプレートから新規 作成] > [定義済みのテンプレートを適用する ] を選択し、他のメニュー (詳細は以下を参照) に移動します。
- 試用版リストの設定。
- 試行リストを選択し、幼虫のID、処理、刺激タイプなどの独立変数を定義します。ビデオのパスを選択し、バッチ取得の試行リストを定義します。
- 取得のセットアップ。
注:トライアルリストが生成されている場合は、ビデオのバッチ取得を実行できます。- 一部のトラックが失われた場合は、トラック エディタを使用してトラッキング フィーチャを調整します。
- トラックエディタの使用後に未解決のままのトラッキングエラーを分析から除外します。
- トラックのスムージング プロファイルを 1 mm に設定して、データからのノイズを減らします。これは、幼虫の背景活動に基づいて調整できます。
- 解析設定。
- 分析する試行を選択するには、[ データプロファイル ] を選択し、対象の独立変数に基づいてトラックを定義します。
注:コンポーネントが非表示になっている場合は、右上隅にある目の記号をクリックして表示します。- 解析する試験の一部をフィルタリングします(例:治療や刺激群の種類に基づく)。
- 解析するトラックの一部を選択します(ネスト)。この研究では、刺激の開始から刺激の開始の100ミリ秒後までのトラックのデータをネストしました。
- すべてのフィルターとネストボックスを矢印線で接続して、指示を完了することを忘れないでください。
- 分析する従属変数を定義し、分析プロファイルを選択して、関心のある変数を指定します(従属変数の下のボディに焦点を当てます)。
注:コンポーネントが非表示になっている場合は、右上隅にある目の記号をクリックして表示します。- [ボディ角度]をダブルクリックします。絶対ベンドを選択します。試用設定を通過し、最大を選択してから、[追加]をクリックします。
- ボディアングルの状態をダブルクリックします。平均化間隔を 5 サンプルに設定します。ベンド角度のしきい値を設定します。bent の統計を計算するには、トライアル統計 に移動し、最初に追加するレイテンシー>選択します。さまざまな閾値が得られるまで手順を繰り返し(20〜80°を使用)、それに応じて名前を付けます。
- 統計とグラフの生成。
- 「分析」>「結果」>「統計とグラフ」を選択し、「計算」をクリックします。
- 各セクションの下に複数のテンプレートを作成できるため、データと分析プロファイルが正しいテンプレートに設定されていることを確認してください。
- トライアル統計とグループ統計をスプレッドシートファイルとしてエクスポートし、処理と分析を行います。
- 分析する試行を選択するには、[ データプロファイル ] を選択し、対象の独立変数に基づいてトラックを定義します。
6. データ分析
- 試行統計を含むスプレッドシート ファイルを開きます。
- [ボディ角度の最大度]、[ベント レイテンシ] (さまざまなボディ角度のしきい値) 列を選択します。
- 刺激開始後 50 ミリ秒のカットオフ潜時内に体角が 30° ≥変化するたびに、正の C スタート反応 (つまり、レスポンダー) と見なします。体の角度が30°<人はノンレスポンダーです。
- バイナリ方式では、各プレートの応答する幼虫に 1 を割り当て、応答しない幼虫に 0 を割り当てます。
- 各プレートのレスポンダーとノンレスポンダーの幼虫の総数を数えます。(応答する幼虫の数/幼虫の総数)×100として計算された各ケースのレスポンダー(%)を計算します。驚愕刺激に対して30%未満しか反応しない幼虫を分析から除外します16。
注:幼虫の70%以上でCスタート応答を誘発することができる任意の刺激強度は、適切な驚愕刺激16と考えられる。
- 各プレートのレスポンダーとノンレスポンダーの幼虫の総数を数えます。(応答する幼虫の数/幼虫の総数)×100として計算された各ケースのレスポンダー(%)を計算します。驚愕刺激に対して30%未満しか反応しない幼虫を分析から除外します16。
- %PPIを100 ×(驚愕刺激に反応する割合 − プレパルス+驚愕シーケンスに応答する割合)/(驚愕刺激に反応する割合)16として計算します。
7. 統計解析
- データを平均標準偏差 (S.D.) ±として表示します (統計ソフトウェアについては 、資料の表 を参照してください)。
- プレパルス強度の変化が幼虫の反応に及ぼす影響を、一元配置ANOVAとそれに続くテューキーの 事後 検定を使用して決定します。
- 二元配置分散分析とそれに続くHolm-Sidakの 事後 検定を使用して、さまざまなプレパルス強度での% PPI応答に対する薬物治療の影響を判断します。
結果
ゼブラフィッシュの幼生における音響驚愕応答のプレパルス阻害を解析するために、複数のシステムを組み合わせるプロトコルを検証するために、3つの実験が行われました。まず、音響刺激を正確に伝達する能力と、驚愕刺激に対する幼虫の反応を捉える能力がテストされました。次に、プレパルス刺激が提示されたときに驚愕反応を減衰させる能力を検証することでした。最後に、アポモルヒネ、ハロペリドール、ケタミンという薬物による驚愕反応のプレパルス阻害の薬理学的調節を検出する能力が確立されました。
音響驚愕刺激に対するゼブラフィッシュの幼生の反応
これまでの研究で、ゼブラフィッシュの幼生は、驚くべき音響刺激が与えられたときに特徴的なCスタートを示すことが実証されている16。驚愕の刺激に対して幼虫の行動を誘発し、捕らえる能力が試されました。記録された幼虫は、Cスタート応答を示すことが観察されました(図2)。70 dB re(100 ms、660 Hz、 補足図1A)の刺激は、幼虫の≥70%で応答を引き出すのに十分な強さでした(図3A)。30秒の試行間隔で30回繰り返し提示した場合、 図3Bに示すように、70dBの再刺激は幼虫の慣れをもたらさなかった(N = 3回の複製;16匹の幼虫/反復)。
Prepulseは音響刺激に対するゼブラフィッシュの幼生の驚愕反応を減少させる
多くの証拠が、プレパルス刺激が驚愕刺激15,21,22,26に対する幼虫の反応を調節することを示しています。2パルスパラダイムが使用され、プレパルスと呼ばれる弱い刺激がパルスと呼ばれる驚愕を誘発する刺激に先行しました。使用されたプレパルス刺激は、70 dB reに設定されたパルス刺激よりも20、17、または14 dB小さかった。プレパルス(5 ms、440 Hz)は、常にパルス開始の100 ms前に提示されました(補足図1B)。テストされた各プレパルス刺激は、パルスに対する幼虫の反応を有意に減少させました。図4では、E3培地中の6 dpf TL、N = 6(16匹の幼虫/グループ)について、音響驚愕刺激に対する幼虫の反応(%)が示されています。驚愕刺激(パルス)に反応した幼虫の割合は79.86±9.772でした。予想通り、驚愕刺激の前に50dB、53dB、または56dBのプレパルスが先行すると、幼虫の反応はそれぞれ11.30%±40.87%、39.58%±7.345%、29.17±9.350%に減少しました。一元配置ANOVA解析では、幼虫に対する刺激効果の統計的な差(F(3, 48)= 57.23、P < 0.0001)が明らかになり、テューキーの多重比較検定では、95%信頼区間でのグループ間の統計的有意性が明らかになりました。
プレパルス阻害の薬理学的調節
以前の研究では、ドーパミン作動薬であるアポモルヒネとハロペリドール、およびグルタミン酸作動薬であるケタミンが、哺乳類やげっ歯類の同等物と同様に、幼虫のプレパルス阻害を有意に調節することが示されました16。セットアップの検証のための濃度は、これらの研究に基づいて選択されました。すべての薬理学的実験の刺激間間隔(ISI)は100ミリ秒でした。
プレパルス阻害に対するアポモルヒネの効果
図 5 では、10 mg/mL アポモルヒネで 10 分間前処理した幼虫は、E3 対照幼虫と比較して % PPI の全体的な減少を示しました(二元配置 ANOVA、非 RM (因子: 処理およびプレパルス強度; 処理: F (1, 34) = 16.21, p = 0.0003; プレパルス強度: F (2, 34) = 8.674, P = 0.0009、これは有意でない相互作用を示しました: F (2, 34) = 2.514、 p = 0.0959)。違いをより詳細に調査するために、Holm-Sidakの事後試験では、E3コントロールとアポモルヒネ処理幼虫との間の驚愕反応に、プレパルス強度53(p = 0.0126)および56(p = 0.0044)での驚愕反応に有意差があることが明らかになりましたが、50dB(p = 0.5813)では有意差がありませんでした。
プレパルス阻害に対するハロペリドールの効果
図6 は、E3中程度(二元配置分散分析、非RM(因子:治療およびプレパルス強度;治療:F(1、32)= 20.75、p<0.0001;プレパルス強度:F(2、32)= 3.147、p = 0.0565、有意な相互作用なし:F(2、32)= 0.0565、 p = 0.4826)。Holm-Sidakの 事後 検定を使用すると、統計的有意性の存在は、プレパルス強度53(p = 0.00489)および56(p = 0.0348)でのみ観察され、50dB(p = 0.067)では観察されませんでした。
プレパルス阻害に対するケタミンの効果
図7 は、異なるプレパルス刺激強度において、E3コントロール幼虫と1.0 mMケタミンで10分間前処理された幼虫との間に驚愕反応に差があったことを示しています(二元配置分散分析、非RM(因子:治療およびプレパルス強度;治療:F(1, 35)= 25.46、p < 0.0001;プレパルス強度:F(2, 35)= 6.018、p = 0.0057、有意な相互作用はありませんでした。 F(2, 35)= 0.8450、p = 0.4381)。Holm-Sidakの 事後 試験では、50(p = 0.0039)と53(p = 0.0027)のプレパルス強度でのみ有意性が示され、56 dB(p = 0.0802)では有意性が示されませんでした。

図1:試験装置。 (A)機器のセットアップの概要。(B)実験中のバックグラウンドノイズを最小限に抑えるためのセットアップ機器の社内断熱。 この図の拡大版を表示するには、ここをクリックしてください。
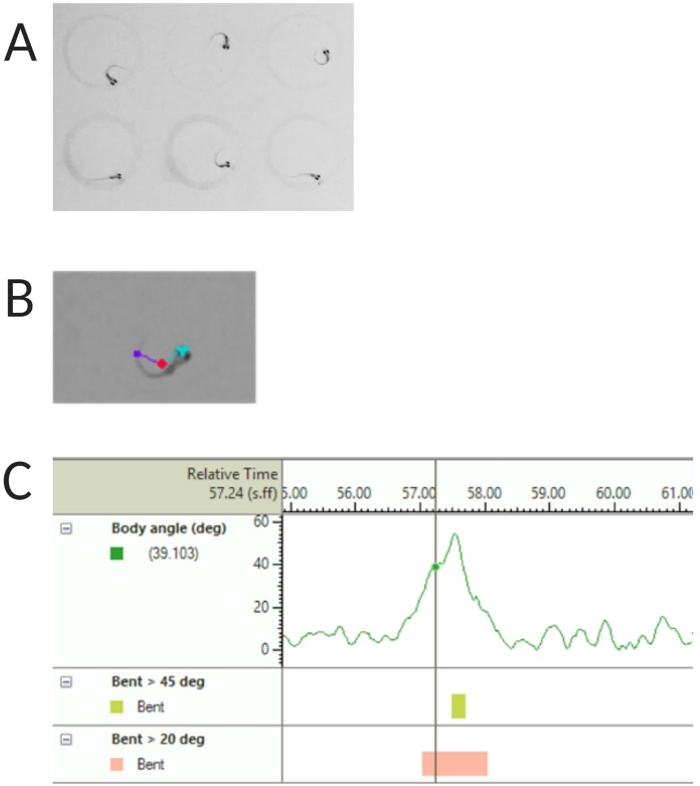
図2:ゼブラフィッシュの幼生の音響驚愕反応の解析。 (A)6dpfで6匹のゼブラフィッシュの幼生が示す特徴的なCスタート。(B)6 dpfの幼虫に重ね合わせた3つの追跡特徴の代表的な画像:中心点(赤)、鼻点(シアン)、尾根(紫)。(C)6-dpf TL野生型幼虫が示す絶対曲げ角度の代表画像。 この図の拡大版を表示するには、ここをクリックしてください。

図3:音響驚愕閾値の決定。 (A)70dBの刺激強度(赤い破線で表される)は、幼虫の>70%でCスタート応答を誘発することができる(N=33;6dpf TL)。(B)幼虫は、30秒の試行間間隔(N = 3回の反復;16匹の幼虫/反復)で30回(試行)提示された70dBの再刺激に慣れません。データは平均±SDとして示 されています この図の拡大版を表示するには、ここをクリックしてください。

図4:パルス前による幼虫の反応(%)の低下。 70 dBの驚愕刺激よりも20、17、および14 dB低いプレパルス刺激は、野生型TL幼虫Cスタートレスポンダーの数を減少させます。すべてのデータは、平均± S.D.、N = 5(16匹の幼虫/グループ)、****p < 0.0001として表され、一元配置ANOVA後のテューキーの 事後 検定による驚愕刺激とは有意に異なっていました。 この図の拡大版を表示するには、ここをクリックしてください。

図5:アポモルヒネによる%PPIの欠損。 すべてのデータは、平均± S.D.、N = 4\u20125(16匹の幼虫/グループ)として示され、Holm-Sidakの二元配置ANOVA後の事 後 検定による統計的に有意な差があります。*p = 0.0126、E3 ctl/アポモルヒネ処理群、53 dB;**p = 0.0044、E3 ctl/アポモルヒネ処理群、56 dB。 この図の拡大版を表示するには、ここをクリックしてください。
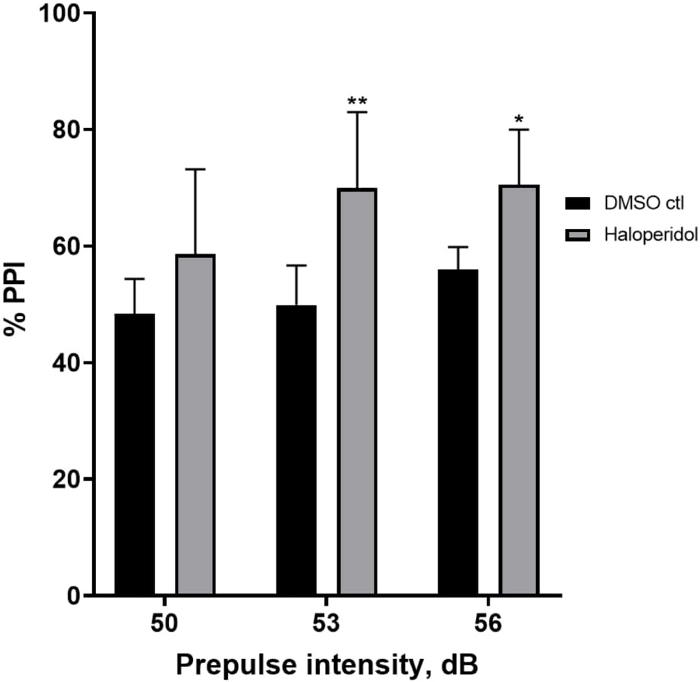
図6:ハロペリドールは%PPIの増強を誘導しました。 すべてのデータは、平均± S.D.、N = 4\u20125(16匹の幼虫/グループ)として示され、Holm-Sidakの二元配置分散分析後の事 後 検定による統計的に有意な差があります。**p = 0.0048、DMSO ctl/アポモルヒネ治療群、53 dB;*p = 0.0348、DMSO ctl/アポモルヒネ処理群、56 dB。 この図の拡大版を表示するには、ここをクリックしてください。

図7:ケタミンによる%PPIの増強。 すべてのデータは平均± S.D、N = 4\u20125(16匹の幼虫/グループ)、二元配置分散分析後のHolm-Sidakの 事後 検定による統計的に有意な差として表されました。これは、2元配置分散分析**p = 0.0039、E3 ctl/アポモルヒネ処理群50 dB、E3 ctl/アポモルヒネ処理群53 dBでした。 この図の拡大版を表示するには、ここをクリックしてください。
補足ビデオ1:70dBの音響驚愕刺激に反応してCスタートを示す幼虫の代表的なビデオ。このビデオをダウンロードするには、ここをクリックしてください。
補足図1:PPIジェネレータを使用して生成された刺激条件の代表的な例。 (A)刺激単独の試行、(B)パルス前抑制の試行(パルス前+パルス)、(C)刺激されていない幼虫の閾値ベースライン曲げ角度を測定するための刺激試行なし。 この図をダウンロードするには、ここをクリックしてください。
ディスカッション
神経行動学研究のプロトコルを改善および改良することを目的として、新しい行動アッセイシステムを検証することが不可欠です。今回の研究では、ゼブラフィッシュの幼生に音響驚愕反応を誘発し、そのような行動の薬理学的調節を以前に検出および定量化する、2つの市販のシステムとソフトウェアの能力を評価しました。
セットアップを最適化するために、いくつかの変更とトラブルシューティングが行われました。Cスタート応答の解析のためのデフォルトのソフトウェアは、各実験のデータを取得した後に自動的に解析が進行するようなものでした(22試行/プレートが実験を構成しました)。これにより、1日あたりに実行できるプレートの数が減り、スループットが低下しました(1日あたり5プレート)。この制限を回避するために、分析ソフトウェアをデータ収集プロセスから切り離す必要があり、これによりスループットが1日平均10プレートに増加しました。したがって、非ライブ分析のために独立した分析ソフトウェアに頼るという決定は成功し、より効率的であることが証明されました。データにノイズをもたらす影やその他の破片からの干渉を避けるために、井戸を媒体で完全に満たし、すべての気泡を取り除き、幼虫と間違われる可能性のある食物粒子などを避けて、データにノイズを発生させることをお勧めします。音刺激のキャリブレーション後、dBメーターによってキャプチャされたアンプシステムが到達可能な最大強度は85dBreでしたが、テストチャンバー内の初期バックグラウンドノイズは60dBreでした。これにより、操作するdBウィンドウが狭くなってしまいました。そのため、バックグラウンドノイズをできるだけ最小限に抑えることが重要でした。これを実現するために、Parafon Acoustics Material( 表の材料を参照)を使用して、テストチャンバーの周囲に追加の断熱材の層を構築し、ボーカルブースバンドルを使用して追加の断熱材の層を構築しました( 材料の表を参照)。これらの絶縁層により、試験チャンバー内のバックグラウンドノイズは、初期の60dBから45dBreに減少することに成功しました。
現在、このセットアップの利点の1つは、すべてのコンポーネントが市販されているため、一部のラボに限定されないことです。コーディング言語の知識が限られている個人でも、プロトコルが理解しやすく、従うのが簡単なため、使用できます。例えば、PPIシステムを用いることにより、刺激間および試行間間隔を変化させてパルスおよびプレパルスを送達すること、ならびにそのような刺激に対する幼虫の反応を捕捉することを可能にした。これらの行動がキャプチャされると、分析ソフトウェアを使用してレスポンダーとノンレスポンダーに分類できます。レスポンダーグループは、<50ミリ秒の潜伏時間で30°以上のCスタートを示した幼虫に分類されました。さらに、PPI応答は、ドーパミン作動性およびグルタミン酸作動性シグナル伝達を標的とする薬物によって調節されます(Geyerらによるレビュー27)。これまでの研究と同様に、非選択的ドーパミン受容体作動薬であるアポモルヒネは、ゼブラフィッシュ幼生の驚愕反応のプレパルス阻害を減少させ、ドーパミン拮抗薬であるハロペリドールは反応を増強しました。ゼブラフィッシュの幼生では、ケタミンがISI16の持続時間に基づいてPPIを異なる方法で調節することが示されています。前述の研究では、幼虫のPPIはケタミンで前処理した場合、30 msで増強されましたが、500 msのISIで抑制されました。この研究では変数ISIは使用していませんが、ケタミンが100ミリ秒のISIでPPIを向上させるという観察結果から、30ミリ秒のISIを使用した場合の以前の研究のデータに匹敵します。この研究では、これらの市販のシステムを組み合わせることで、PPIアッセイを実施し、ゼブラフィッシュの幼生のPPI応答の薬理学的に誘発された変化を確実に検出できることが実証されました。このシステムの制限は、分析ソフトウェアによって追跡される鼻先の特徴が、常に幼虫の片方の目に当たるため、ベースライン角度が作成されることです。これを克服するためには、刺激を受けていない幼虫のベースライン曲げ角度を常に決定する必要があり、この研究で使用した幼虫は~30°であることがわかりました。したがって、驚いた幼虫の陽性のCスタート反応と考えられていたものの閾値として30°を選択するための基礎を形成しています。これらの点を考慮に入れれば、セットアップ機器にアクセスできるどのラボでもPPIアッセイを実施できるはずです。この論文では、レイテンシの変動性の範囲のため、以前に報告した16のように、驚愕応答の運動学を短いレイテンシと長いレイテンシに分類することには焦点を当てていませんでした16。したがって、刺激開始後<50ミリ秒のCスタート応答のみが使用された15。
系統の違いは、いくつかのアッセイ28、29、30、31 でゼブラフィッシュの行動に影響を与えるだけでなく、聴覚感度32にも影響を与えると報告されています。したがって、テストする各ひずみのベースライン曲げ角度を決定することが不可欠です。聴覚感度も異なる可能性があるため、ベースラインの驚愕反応、各ひずみのプレパルス刺激または驚愕刺激として最も適した音の強さ、および刺激が提示される時間を決定することが重要です。ISIは、一部の薬物がプレパルスと驚愕刺激開始16の間の間隔に基づいてPPIを強化または減少させることができるため、慎重に検討すべき別のパラメータである。認知機能、神経精神障害、聴覚(聴覚機能)の研究に関心のある研究室は、このPPIのセットアップとプロトコルが薬理学的および/または遺伝子モデルのスクリーニングに役立つことが期待されています。このプロトコールは、化合物ライブラリーのハイスループットスクリーニングの基礎にもなります。
開示事項
著者は、競合する金銭的利益を宣言しません。
謝辞
Ana Tavara 氏と João Paulo R. P. Santana 氏には、優れた魚の手入れと防音ブースのテストと設置に貴重な支援をいただき、EthoVision ソフトウェアのセットアップに初期サポートを提供してくださった Wietske van der Ent 博士に感謝します。この研究は、ノルウェー研究評議会(ISP、BIOTEK2021/ DigiBrain)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
参考文献
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved