Method Article
세포외 플럭스 분석기를 사용하여 마우스 정자 주입 중 글리코용해 및 산화 인산화의 변화를 측정합니다.
요약
우리는 마우스 정자 capacitation 도중 당해 및 산화 인산화에 있는 실시간 변경을 감시하기 위하여 세포외 플럭스 분석기의 응용을 기술합니다.
초록
포유류 정자는 capacitation로 알려져 있는 프로세스에 있는 여성 생식 기관에 있는 풍부하게 함 용량을 취득합니다. 정전 관련 공정에는 에너지가 필요합니다. 정자 진보적 인 운동성 연료 ATP를 생성하는 소스에 대한 지속적인 논쟁이 남아있다, 용량, 과소 활성화, 및 곡예 반응. 여기에서, 우리는 마우스 정액 capacitation 도중 에너지 물질 대사에 있는 변경을 분석하는 공구로 세포외 플럭스 분석기의 응용을 기술합니다. H+및O2- 민감한 형광을 사용하여, 이 방법은 비 커패시타이드 대 정전 용량 정자에서 실시간으로 글리코용및 산화 인산화를 모니터링할 수 있게 합니다. 다른 에너지 기판 및 /또는 약리 활성제 및 / 또는 억제제의 존재에서이 분석법을 사용하여 다른 대사 경로의 기여와 정자 capacitation 동안 신호 캐스케이드와 신진 대사 사이의 교차점에 중요한 통찰력을 제공 할 수 있습니다.
서문
질량 분석법의 적용은 신진 대사의 연구에 혁명을 일으켰습니다. 표적 대사 프로파일링 및 대사체 추적을 통해 에너지 대사 의 변화를 정밀하게 모니터링할 수 있습니다. 그러나 대사체학을 성공적으로 수행하려면 광범위한 교육, 숙련된 직원, 고가의 고감도 질량 분석기가 모든 실험실에서 쉽게 구할 수 없습니다. 최근에는 해마 XFe96과 같은 세포외 플럭스 분석기를 사용하여 다양한 세포 유형1,2,3,4,5에서에너지 대사의 변화를 측정하는 대리 방법으로 인기를 끌고 있다.
정자는 고도로 전문화된 운동성 세포입니다; 그의 임무는 난모세포에 친자 게놈을 전달하는 것입니다. 사정 후 남성 생식 기관을 떠나는 정자는 여전히 기능적으로 미숙하며 난모세포의 조끼를 관통할 수 없기 때문에 난모세포를 비옥하게 할 수 없습니다. 정자는충혈6,7로알려진 성숙 과정에서 여성 생식기관을 통과하면서 수정 능력을 습득한다. 갓 사정된 정자 또는 고다 부고환에서 해부된 정자는Ca2+및 중탄산염(HCO3-)또는 세포 투과성 cAMP 아날로그(예를 들어, dibutyryl-cAMP), 콜레스테롤 수용자 (예를 들어, 소 혈청 알부민, BSA), 및 에너지 원 (예를 들어, 포도당). capacitation 도중, 정액은 과활성화8,9에게불린 수영 모드를 나타내는 비대칭 편모 박동으로 그들의 운동성 패턴을 수정하고, 그(것)들은 곡예 반응7을겪을 수 있는 유능한 되고, 여기서 proteolytic 효소는 oocytes의 조끼를 소화하는 풀어 놓입니다. 이러한 과정은 에너지를 필요로 하고, 체세포와 유사하게, 정자는 당해용해뿐만 아니라 미토콘드리아 TCA 주기 및 산화 인산화(oxphoylation)10을통해 ATP 및 기타 고에너지 화합물을 생성한다. 여러 연구는 당해가 정자 capacitation11,12,13,14를지원하기에 필요하고 충분하다는 것을 입증하는 동안, 옥스포스의 기여는 덜 분명하다. 글리콜리시스가 TCA 주기에 물리적으로 결합되는 다른 세포 유형과는 달리, 정자는 고도로 구획화되고 별도의 편모 구획에서 이러한 과정을 유지하는 것으로 생각됩니다: 미드피스는 미토콘드리아 기계를 농축하는 반면, 글리콜리시스의 주요 효소는 주요 조각15,16으로제한되는 것으로 보입니다. 이러한 구획화는 글리코분해에 의해 주체에서 생산된 피루브산이 미드피스에서 미토콘드리아 옥스포스를 지원할 수 있는지, 그리고 미드피스에서 옥스포스에 의해 생성된 ATP가 주체17,18, 19의원단 부분에서 에너지 요구 사항을 지원하기 위해 깃넬럼의 길이를 따라 충분히 빠르게 확산될 수 있는지에 대한 지속적인 논쟁을 낳는다. 또한 정자 capacitation에 oxphos에 대 한 역할의 지원이 있다. 옥스포스는 글리콜리시스보다 16배 더 많은 ATP를 생성할 뿐만 아니라, 중간 체량과 미토콘드리아 함량은 포유류 종의 생식 적합성과 직접적으로 상관관계가 있으며, 이는짝20의경우 남성간의 경쟁이 더 치열합니다. 이 질문을 해결하는 것은 정액 capacitation 도중 glycolysis와 oxphos의 상대적인 기여를 검토하기 위한 방법을 요구합니다.
Tourmente 등은 24웰 세포외 플럭스 분석기를 적용하여 현저히 다른 정자 성능파라미터(21)와밀접하게 관련된 마우스 종의 에너지 대사를 비교한다. 비 정전 용량 정자의 기저 ECAR 및 OCR 값을보고하는 대신, 여기에서, 우리는 실시간으로 마우스 정자 capacitation 동안 에너지 대사의 변화를 모니터링하기 위해 96 잘 세포 외 플럭스 분석기를 사용하여 자신의 방법을 적응. 산소(O2)와 양성자(H+)의 유속을 측정하여 최대 12개의 다른 실험 조건에서 기모를 이겨내며정자에서 글리코용해와 옥스포스를 실시간으로 모니터링할 수 있는 방법을 개발하였다(그림1A). Glycolysis 동안 젖산질화에 대한 피루브산염의 고장으로 인해 TCA 사이클을 통해CO2의 생산, 비-커패시테이트 및 정전 용량 정자 돌출 H+는 H+민감한 형광을 통해 세포 외 플럭스 분석기에 의해 검출되는 분석 매체내로 센서 카트리지의 프로브 팁에 고정된다. 병행하여, 산화인산화에 의한O2 소비는 동일한 프로브 팁에 고정화된O2-민감성형광체를 통해 검출된다(도1B). 방출된H+와 소비된O2의 효과적인 검출은 중탄산염 또는 페놀 적색 없이 낮은 완충 용량을 가진 수정된 정자 완충을 필요로 한다. 따라서, 중탄산염의 부재에서 의 한축을 유도하기 위해, 우리는 광범위 PDE 억제제 IBMX22와함께 주입된 세포 투과성 cAMP 아날로그의 사용을 채택했다. 3개의 추가 독립적인 주입 포트는 약리활성제 및/또는 억제제를 주입할 수 있게 해주며, 이를 통해 실험 조작으로 인한 세포 호흡 및 당해 비율의 변화를 실시간으로 감지할 수 있습니다.
프로토콜
정자는 8-16주령의 CD-1 수컷 마우스로부터 수집된다. 동물 실험은 웨일 코넬 의학의 기관 동물 관리 및 사용위원회 (IACUC)에 의해 승인되었다.
1. 분석 전날
-
센서 카트리지 및 세포외 플럭스 분석기 교정기 준비
- 센서 카트리지에 수분을 공급하려면 XFe96 세포외 플럭스 분석 키트에서 센서 카트리지를 제거하고 센서 카트리지를 유틸리티 플레이트 옆에 거꾸로 놓습니다.
- 다중 채널 파이펫을 사용하여 25 mL의 이중 증류 H2O로 용액 저장소를 채우고 유틸리티 플레이트의 각 웰에 200 μL의 H2O를추가하십시오. 센서 카트리지를 유틸리티 플레이트에 다시 넣고 37°C비CO2 인큐베이터에서 밤새 배양합니다.
참고: 카트리지는 최소 4시간 동안 수분을 공급해야 합니다. - 세포외 플럭스 분석기 교정제의 Aliquot 25 mL을 50 mL 원추형 튜브내로 교정하고 37°C비CO2 인큐베이터에서 하룻밤 동안 배양하였다.
-
코나 코팅 마이크로플레이트 의 준비
- 2.5 mg의 ConA를 이중 증류H2O5mL에 용해하여 0.5 mg/mL(w/v) 스톡을 준비합니다.
- 다중 채널 파이펫을 사용하여 0.5 mg/mL Con A 용액의 50 μL로 세포외 플럭스 분석기 96웰 플레이트의 각 웰을 채웁니다. 뚜껑을 열어 놓고 접시를 실온에서 밤새 건조시키십시오.
참고: 여러 플레이트를 한 번에 코팅하고 4°C에서 최대 4주간 보관할 수 있습니다.
-
정자 완충제의 준비
- 138 mM NaCl, 4.7 mM KCl, 1.7 mM CaCl2,1.2 mM KH2PO4,1.2 mM MgSO4,5.6 mM 포도당 및 1 mM HEPES를 포함하는 낮은 HEPES로 세포 외 플럭스 분석기 TYH 완충제 250 mL을 준비합니다. 완충액을 37°C로 가열하고 pH를 7.4로 조정합니다.
2. 분석의 날
- 카트리지 교정 준비
- 유틸리티 플레이트의H2O를 웰당 200 μL의 XF 교정란트로 교체하고 비 CO2 37°C 인큐베이터에서 적어도 1시간 동안 배양한다.
참고: 교정제 대신 멸균 여과 된 PBS, pH 7.4를 사용할 수 있습니다. - 37°C에서 TYH 완충액 50 mL를 가열합니다.
- 유틸리티 플레이트의H2O를 웰당 200 μL의 XF 교정란트로 교체하고 비 CO2 37°C 인큐베이터에서 적어도 1시간 동안 배양한다.
- 세포외 플럭스 분석기를 위한 웨이브 템플릿 생성
- 세포외 플럭스 분석기를 켜고 온도가 37°C로 안정화되도록 합니다.
- 웨이브 소프트웨어를 열고 빈 템플릿을 열어 새 템플릿을 디자인합니다(보조 파일 1,웨이브 템플릿 참조).
- 그룹 정의 탭을 엽니다. pH 7.4 및 마우스 정자로 세포 유형, 주사 전략 및 전처리 빈 두고. 각 분석 조건에 대해 다른 그룹을 만듭니다. 이 예제에서는 6개의 다른 그룹(TYH, TYH + db-cAMP/IBMX, 2-DG, 2-DG + db-cAMP/IBMX, 개미/부패, 개미/부패 + db-cAMP/IBMX)이 있습니다. 디부티릴 cAMP(db-cAMP) 및 3-이소부틸-1-메틸산틴(IBMX)은 글리콜분해 억제제로서, 2-디옥시글루스(2-DG)를 유도하며, 항마이신 A(antA) 및 로테네(rot)는 전자 수송 사슬의 복합III 및 복합I의 억제제로 한다.
참고: 웰 간의 가변성을 고려하려면 조건당 최소 7-8개의 웰을 병렬로 측정해야 합니다. - 플레이트 맵 탭을 열고 특정 웰에 그룹을 할당하여 플레이트 맵을 정의합니다.
참고 : 네 개의 코너 웰 (A1, A12, H1, H12)은 TYH 버퍼 (정자 없음)로 채워지고 나중에 배경 빼기위해 사용됩니다. - 프로토콜 탭을 열고 4개의 다른 측정 주기를 추가하고, 각각의 포트를 선택하고 측정 세부 사항을 편집합니다(그림2, 표 1). 주입 후 측정을 강조하고 평형을강조 표시하지 않습니다.
- 분석 템플릿을 저장하고 프로젝트 요약을 작성하고 결과 파일의 저장 위치를 정의합니다.
- 센서 카트리지에 로드할 화합물 준비
- TYH 완충액에서 9.8 mg의 화합물을 용해시킴으로써 50 mM db-cAMP의 2 mL를 준비하고 IBMX를 5 mM의 최종 농도에 추가합니다.
참고: IBMX는 TYH 버퍼에서 희석된 후 침전되는 경향이 있습니다. 침전제는 37°C 열 블록에서 5분 동안 TYH/db-cAMP/IBMX 용액을 와류 및 인큐베이팅하여 용해될 수 있다. - TYH 완충액에서 82.1 mg의 화합물을 용해시킴으로써 500 mM 2-DG의 1 mL을 준비한다.
- TYH 완충제에서 두 약물을 모두 희석하여 AntA/Rot의 5 μM 의 1 mL을 준비합니다.
참고 : 화합물은 세포 외 플럭스 분석기 카트리지에 주입하여 10 배 희석됩니다. 따라서 사출 솔루션이 10배 더 집중되어 있는지 확인하십시오.
- TYH 완충액에서 9.8 mg의 화합물을 용해시킴으로써 50 mM db-cAMP의 2 mL를 준비하고 IBMX를 5 mM의 최종 농도에 추가합니다.
- 마우스 정자의 격리
- 이소플루란에 의해 8 및 16주 사이에 3명의 수컷 마우스를 마취시키고 발가락 꼬집기에 대한 반응이 검출된 후 자궁경부 탈구에 의해 마우스를 희생시켰다. 카우다 부고디미드와 바사 deferentia를 제거합니다.
- 각 카우다를 500 μL의 미리 온난한 TYH 완충재를 24웰 플레이트에 잘 놓고, 한 쌍의 집게를 사용하여 플레이트 바닥에 카우다를 고정시키고 깃털 가위로 5-7개의 작은 절개를 하여 조직을 엽니다.
- 플레이트를 즉시 비CO2 37°C 인큐베이터로 옮기고 정자가 15분 동안 분산시키게 한다.
- 센서 카트리지 로딩
- 세포외 플럭스 키트에는 포트 A및 D 및 포트 B 및 C용 두 개의 포트 로딩 가이드가 제공됩니다. 특정 포트를 로드하는 경우 센서 카트리지에서 뚜껑을 제거하고 각 포트 로딩 가이드의 문자를 카트리지의 왼쪽 위 모서리에 맞춥니다. 주입하는 동안 비주입 손의 손끝을 사용하여 포트 로딩 가이드를 제자리에 고정하고 파이펫 팁을 포트 로딩 가이드 구멍에 수직으로 삽입합니다.
- 포트 A: 다중 채널 파이펫을 사용하여 TYH 버퍼의 20 μL을 모든 열에 주입합니다.
- 포트 B: TYH 완충액 22 μL을 컬럼 1-4에 주입하고, 500 mM 2-DG의 22 μL을 컬럼 5-8에 주입하고, 5 μM AntA/Rot의 25 μL을 컬럼 9-12에 주입합니다.
- 포트 C: 25 μL의 TYH 버퍼를 홀수로 모든 열에 주입하고, 짝수로 모든 열에 10mM db-cAMP/500 μM IBMX의 25 μL을 주입합니다.
- 교정 플레이트가 있는 센서 카트리지를 세포외 플럭스 분석기에 넣고 분석을 시작합니다. 교정은 10 - 15 분 이 소요됩니다.
- 정자 판의 준비
- TYH 완충액 15 mL(3 mg/mL w/v)에 BSA 45 mg을 용해하고 5 mL 원심분리기 튜브에 각각 3mL BSA/TYH 용액3개의 aliquots를 준비합니다.
- 1.5 mL 원심 분리튜브에 각각 2개의 정자를 결합하고, 혈세포계를 사용하여 정자를 계산하고 정자를 2 x 107 정자/mL의 농도로 희석시다.
참고: 세포손상을 방지하기 위해 정자를 파이펫팅하기 위해 절단 파이펫 팁을 사용하십시오. - 700 x g에서3 분 동안 정자를 원심 분리하고 상류를 제거하고 TYH 완충액 1 mL을 추가하십시오. 원심 분리 단계를 반복하고 상복부를 제거하고 각 정자 현탁액을 BSA / TYH 3 mL로 5 mL 원심 분리튜브 1 개에 옮긴다.
- 180 μL의 TYH 버퍼를 각 구석웰(A1, A12, H1, H1, H12)에 코나 코팅 플레이트의 잘 놓습니다. 180 μL의 정자 현탁액을 ConA 코팅 플레이트의 각 빈 우물에 넣습니다 (1.2 x 106 정자 / 우물).
- 정자 판을 250 x g에서 1 분 동안 원심 분리하고 플레이트를 180 °로 회전시키고 원심 분리기를 250 x g에서 1 분 (가장 낮은 제동 속도 1)으로 다시 원심 분리합니다.
- 세포외 플럭스 분석기에서 교정 플레이트를 제거하고 정자 플레이트를 추가합니다. 분석을 계속합니다.
- 데이터 추출 및 분석
- 분석 을 완료 한 후, 카트리지를 제거, 결과 파일을 열고, 내보내기 탭을 클릭하고 그래프 패드 프리즘 파일로 완료 된 실행을 내보내기(보충 파일 2: 그림 3에사용되는 기본 예제 데이터).
- 새 탭을 클릭한 다음 중복 패밀리... 탭(그림3A)을클릭하여 ECAR 및 OCR 파일을 복제합니다.
- 데이터의 처음 7행을삭제합니다(그림 3B).
- 기준선 빼기 행 1에 의해 cAMP/IBMX 주입 전에 데이터 포인트로 정규화합니다. 분석 탭을 클릭한 다음 기준선 및 열 수학 제거 탭에서 선택된 행 강조 표시: 첫 번째 행, 계산: 비율:값/기준선및 하위 열: 하위 열 무시. 확인을 클릭합니다(그림3C).
결과
이 방법은 세포외 플럭스 분석기를 사용하여 마우스 정자 주입 중 당해 및 옥스포스 의 비율의 실시간 변화를 모니터링합니다. 도 4는 정자가 유일한 에너지 기판으로서 포도당의 존재에서 정전되었고 2-DG 및 항마이신 및 로테인을 약리학적 변조기로서 가꾸어낸 예시적인 실험을 나타낸다. 세포외 플럭스 분석기 TYH 버퍼 및 약리학적 변조기 내의 에너지 기질은 실험의 목표에 따라 자유롭게 선택될 수 있다. BSA/TYH에 있는 비 정전 용량 마우스 정액은 그들의 머리를 통해 ConA 코팅된 과도 마이크로 챔버의 바닥에 부착되었습니다. 이 예에서, 검출된 모든 웰 들 사이의 평균 기저 ECAR 및 OCR 값은 각각 12.76±2.75 mpH/min 및 23.64±2.78 pmol/min이었다.
TYH 완충액을 가진 모의 주입 후에, 당해 및 산화 인산화를 억제하기 위하여 2-DG 및 개미/부패의 주입에 선행된, 각각, 정액 capacitation는 db-cAMP/IBMX의 주입에 의해 유도되었다.
대표적인 결과는 포도당의 존재에서, capacitation는 2-DG로 glycolysis를 차단해서 억제되는 세포외 산성화 비율 (ECAR)에 있는 7 배 증가를 동반한다는 것을 보여줍니다(그림 4A). 정전 용량 정자는 비 정전 용량 정자에 비해 산소 소비 속도 (OCR)의 20 배 증가를 보여(그림 4B),마우스 정자는 용량 동안 증가 에너지 수요를 지원하기 위해 글리코 용해와 산화 인산화를 모두 향상 것을 입증. 정자 capacitation 동안 ECAR의 상승은 당분해 억제제 2-DG에 의해 억제되지만 산화 인산화 억제제항마이신 A 및 로테논의 영향을 받지않음(도 4C),ECAR의 변화는 주로 Glycolysis로부터의H+방출에 의해 구동된다는 것을 나타낸다. OCR의 증가는 예상대로, 항마이신 A 및 로테논(도4D)에의해 차단되지만, 또한 2-DG(도4B)에의해 억제되어 정자 충혈 동안 옥스포스의 증가가 당분해 활성에 의존한다는 것을 밝혀낸다.

그림 1: 세포외 플럭스 분석기의 원리. (A) 당분해 시 젖산염으로 인한 포도당의 붕괴와 TCA 주기를 통한CO2생성으로 인해, 글리콜분해 및 옥스포스의 변화는 세포외 매체로H+배설을 동반한다. XFe96 분석기는 ECAR로 세포 외 H+ 농도에서 이러한 변화를 감지합니다. 병렬로, 산화 인산화에 의한O2 소비로 인한 세포외O2 농도의 변화는 OCR로 측정된다. 2-디옥시글루코스(2-DG)로 당분해를 차단하거나 복합체 I 및 복합 III 억제제 로테온 및 항마이신 A를 통한 호흡을 차단하면 대사 경로가 정자 수용 기간 동안 증가하는 에너지 수요를 지원하는 것으로 나타났습니다. (B) 마우스 정자는 코나 코팅 된 마이크로 챔버의 바닥에 자신의 머리를 통해 부착; 그들의 편모는 자유롭게 움직이고 있습니다. 세포외H+와 O2 농도의 변화가H+에의해 검출되는 동안- 및O-민감한형광단은 센서 프로브에 고정되어, 최대 4개의 상이한 화합물을 순차적으로 주입할 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
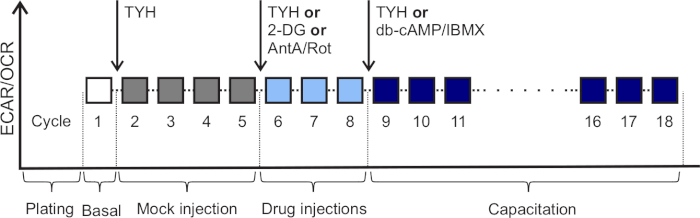
도 2: 예시적인 실험의 개략적 표현. ECAR (mpH /min) 및 OCR (pmol O2/min)의 변화는 세포 외 플럭스 분석기를 사용하여 비 정전 및 정전 용량 정자에서 검출됩니다. 주기 1: 기초 ECAR 및 OCR 값입니다. 주기 2-5: TYH 모의 주입 후 시스템 안정화. 주기 6-8: 약물 배양. 주기 9-27: 정자 capacitation. 화살표는 주사를 나타냅니다. 2-DG: 최종 농도 50 mM, AntA/Rot: 최종 농도 0.5 μM, db-cAMP: 최종 농도 1 mM, IBMX: 최종 농도 500 μM. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
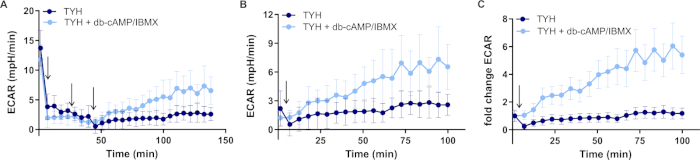
그림 3: 데이터 분석. (A) 마우스 정자 용량 동안 ECAR의 변화의 원시 데이터. (B) 처음 7개의 데이터 포인트를 제거한 후의 데이터. (C) cAMP/IBMX 주입 전에 데이터 포인트로 정규화된 데이터입니다. 데이터는 7-8웰±S.E.M. 주사의 평균으로 화살표로 나타내어 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 마우스 정자 capacitation 동안 당해 및 산화 인산화의 변화. (A) 50 mM 2-DG의 존재와 부재에서 비 정전 및 정전 용량 마우스 정자에서 정규화 된 ECAR. (b) 50 mM 2-DG의 존재 와 부재에서 비 정전 및 정전 용량 마우스 정자에서 정규화 된 OCR. (c) 0.5 μM 항마이신 A 및 로테논의 존재 및 부재 시 비정전 및 정전 용량 마우스 정자에서 정규화된 ECAR. (d) 0.5 μM 항마이신 A 및 로테논의 존재 및 부재 시에 비정전 및 정전 용량 마우스 정자에서 정규화 된 OCR. 데이터는 db-cAMP/IBMX 주입 전에 데이터 포인트로 정규화된 평균 ±S.E.M으로 표시된다; n = 6. 주사는 화살표로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 포트 | 사이클 수 | 믹스 (최소) | 대기 (분) | 측정(최소) | |
| A: 기초 ECAR/OCR | 포트 없음 | 1 | 2:00 | 0:00 | 3:00 |
| B: 모의 주입 | 1 | 4 | 2:00 | 0:00 | 3:00 |
| C: 약물 주사 | 2 | 3 | 2:00 | 0:00 | 3:00 |
| D: 용량 | 3 | 18 | 2:00 | 0:00 | 3:00 |
표 1: 측정 세부 정보.
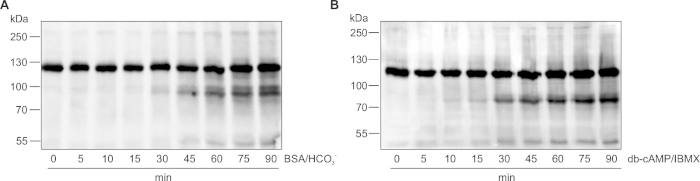
보충 그림 1: 세포외 플럭스 분석기 TYH 완충제에서 마우스 정자의 용량. 25 mM HCO 3- -3 mg / mL BSA 및 20 mM HEPES 또는 (B) 세포 외 플럭스 분석기 TYH에서 25 mM HCO3- 또는 (B) 세포 외 플럭스 분석기 TYH에서 25 mM HCO에서 배양 후 capacitation (0 - 90 분) 동안 다른 시점에서 검출 된 마우스 정자의 티로신 잔류물의 인산화, 5 mM db-cAMP와 α-인광티로신 항체로 검출된 500 μM IBMX 및 1 mM HEPES. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 파일 1: 마우스 정자 capacitation 도중 글리코용해 및 산화 인산화에 있는 변경을 검출하기 위하여 파기 분석 템플릿. 웨이브 데스크톱 소프트웨어는 등록 양식(www.agilent.com/en/products/cell-analysis/cell-analysis-software/data-analysis/wave-desktop-2-6)을작성하고 윈도우 7, 8 또는 10에 설치 한 후 무료로 다운로드 할 수 있습니다 (Mac OSx 10.11 (이상) 병렬 12 (이상). 따라서, 파형 템플릿은 세포외 플럭스 분석기로부터 독립적으로 생성될 수 있으며, 모든 세포외 플럭스 분석기의 웨이브 소프트웨어로 내보내고 수입할 수 있다. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
보충 파일 2: 예시적인 데이터 분석을 통해 웨이브 소프트웨어에서 내보낸 그래프 패드 프리즘 파일. 이 파일을 보려면 여기를 클릭하십시오 (다운로드 오른쪽 버튼을 클릭하십시오).
토론
특정 신진 대사 기질 또는 중요한 신진 대사 효소의 부재에 있는 정액 capacitation의 손실은 성공적인 풍부하게 함을 지원하는 중요한 요인으로 에너지 물질 대사를 밝혔습니다. 세포 활성화 도중 신진 대사 스위치는 그밖 세포 모형에 있는 잘 확립된 개념입니다, 그러나, 우리는 정액이 capacitation 도중 증가하는 에너지 수요에 그들의 물질 대사를 적응하는 방법을 이해하기 시작했습니다. 세포외 플럭스 분석기를 사용하여, 우리는 정자 capacitation 도중 실시간으로 글리코용해 및 산화 인산화에 있는 변경을 감시하기 위하여 쉽게 적용 가능한 공구를 개발했습니다. 센서 프로브에 고정된 형광단을 사용하여 세포외H+와 O2의 변화를 감지하는 것은 최소 침습적이며, 4개의 개별적으로 작동된 주입 포트는 용량 화 과정 전이나 동안 별개의 시점에서 약리학적 억제제 또는 활성제와 함께 조작할 수 있습니다. 이 프로토콜은 마우스 정자 용량 실험의 한 가지 예만 제공합니다. 결과의 해석을 단순화하기 위해 우리는 포도당이 유일한 에너지원으로 사용된 예시적인 실험을 선택했습니다. 조건은 실험의 목표에 따라 가변적이며, 최대 12개의 상이한 조건(즉, 포도당 대 포도당 및 피루브산과 같은 상이한 에너지원)을 병렬로 측정할 수 있다. 또한, 4개의 독립적인 주사 포트를 통해 약리작용제 및/또는 억제제의 주입을 용량 전이나 도중 원하는 시점에서 주입할 수 있습니다. 이는 세포외 플럭스 분석기를 반고처리량 스크리닝 장치로 사용할 수 있는 가능성을 열어준다. 마우스 정자와 유사, 인간 또는 소 같은 다른 종에서 그것은 여전히 수수께끼 어떻게 정자 는 capacitation 동안 그들의 신진 대사를 변경. 프로토콜을 쉽게 조정할 수 있습니다. 따라서, 우리는 실제 실험을 시작하기 전에 매번 정자 농도를 최적화하는 것이 좋습니다.
이 프로토콜의 가장 큰 한계는 중탄산염이 없는 경우에만 고품질의 결과를 얻을 수 있다는 것입니다. 정액 액체에 있는 중탄산염은 사정 다음 폭포를 신호하는 정액의 capacitation 신호를 시작하는 생리적인 신호입니다. 중탄산염은 용해성 아데닐사이클아제(sAC; ADCY10) 이는 ATP를 cAMP23으로변환하는 촉매제. cAMP의 증가는 단백질 키나아제 A에 의해 매개된 신호 캐스케이드를 구동하며, 이는 궁극적으로 표적 단백질의 하류 티로신 인산화(예를 들어, 이온 채널, 대사 효소 및 구조 단백질24,25)로이어집니다. 중탄산염에 대한 이러한 제한은 중탄산염 활성화 sAC, cAMP의 생성물인 cAMP를 주입함으로써 극복됩니다. 우리는 광포성 인산화효소에 의한 db-cAMP의 급격한 분해를 방지하는 광특이성 인산화 억제제 IBMX와 병행하여 5mMM의 세포 투과성 cAMP 아날로그 db-cAMP를 사용합니다. 이러한 조합은 중탄산염과 유사한 운동성으로 cAMP 조절 된 용량 신호 신호 경로 포스트 sAC 활성화를 효과적으로 시작한다(보충 도 1). 중탄산염과 병행하여, 콜레스테롤 수용자(예를 들어, BSA)는 염소부형으로부터 해부된 갓 사정된 정자 또는 정자를 시험관 내 카파자테이트에 사용한다. 알부민은 주사 포트를 막히기 때문에 주입 할 수 없으므로 세포를 도금하기 전에 정자 완충액에 추가해야합니다. BSA의 존재 또는 부재에서 실험을 수행 하는 정자 capacitation 동안 ECAR및 OCR의 증가 콜레스테롤 수용자와 는 무관 하다는 것을 밝혔다. 그러나, 정자 버퍼에 BSA의 존재는 다른 우물과 실험 사이 검출 된 ECAR 및 OCR 값에 변동을 감소; 따라서, 우리는 매우 재현성을 높이기 위해 정자 완충액에 BSA를 포함하는 것이 좋습니다.
카우다 부고환에서 정액을 격리하는 것은 부고환 액체를 가진 정액의 오염 귀착됩니다. 정액 액체 분대 때문에 인공적인 결과를 피하기 위하여는, 실험을 위해 그(것)들을 사용하기 전에 정액을 두 번 세척하는 것이 좋습니다. 정자 농도 및 도금은 실험의 성공을 결정하는 또 다른 중요한 요소입니다. 신뢰할 수 있는 결과를 위해 제조업체는 초기 ECAR 값이 10보다 크고 OCR 값이 20보다 커야 한다고 권장합니다. 이 프로토콜에 사용된 정자 농도는 조건당 측정된 7-8웰의 평균 기저 ECAR 및 OCR 값이 각각 10 및 20 이상이되도록 최적화되었다. 자유롭게 움직이는 정자는 세포 외 H+ 및 O2의변화의 검출을 방해합니다. 따라서, 판의 바닥에 그들의 머리를 가진 모든 정액을 붙이는 것이 중요합니다. 우리는 ConA, 특히 외부 곡예 막과 상호 작용하고 일반적으로 곡자 검정26에사용되는 식물 렉틴으로 플레이트를 코팅하여 정자를 준수 성공을 발견 , 부드럽게 플레이트를 회전하여 (단계 2.7.3 참조). 이 방법으로, 정자는 그들의 머리를 통해서만 우물의 바닥에 현지화됩니다 그래서 그들은 아직도 자유롭게 그들의 편모를 움직이고 capacitation 도중 그들의 깃발 박동 패턴을 바꿀 수 있습니다.
정자는 지속적으로 H+ 및O2 둘 다에서, 비 정전 및 정전 용량 상태를 돌출. 초기 ECAR 및 OCR을 가능한 한 정확하게 결정하려면 마지막 세척 단계 이후에 가능한 한 빨리 실험을 시작하는 것이 중요합니다. 이는 정자가 수영하는 동안 센서 카트리지를 적재하고 첫 번째 세척 단계 전에 세포외 플럭스 분석기에서 방법을 시작하여 수행할 수 있습니다. 계측기를 교정하는 데는 셀세척 및 도금 및 플레이트 회전과 거의 같은 시간이 소요됩니다. 제조업체는 첫 번째 실제 데이터 포인트를 측정하기 전에 시스템이 안정화될 수 있도록 평형 단계를 권장합니다. 프로토콜에는 용량이 시작되기 전에 8개의 측정 주기가 포함되므로 시간을 절약하기 위해 평형 단계는 이 프로토콜에서 제외됩니다.
분석 기간 동안 용액을 주입하고 호흡 및 당해 반응에 미치는 영향을 실시간으로 관찰하는 능력은 세포외 플럭스 분석기의 핵심 기능입니다. 센서 카트리지로드는 프로토콜의 중요한 단계 중 하나이며 신중하게 수행해야 합니다. 모든 웰에 적절한 주입을 보장하기 위해 각 포트 시리즈는 배경 우물을 포함하여 동일한 볼륨을 포함해야 합니다. 다중 채널 파이펫으로 포트를 로드하려면 몇 가지 연습이 필요하지만 가변성과 로딩 시간이 상당히 줄어듭니다. 포트 로딩 가이드를 사용하되 포트를 동시에 4개만 삽입하는 것이 좋습니다. 또한 로딩 중에 사출 량이 점차 증가하여 웰의 부피 증가를 보상한다는 점을 평가하는 것이 중요합니다. 센서 카트리지를 로드하는 동안 포트에 팁을 완전히 삽입하지 않는 것이 중요합니다. 이렇게 하면 포트 오리피스를 통해 주입 솔루션을 조기에 푸시할 수 있습니다. 방법을 확립 하는 동안 우리는 잘 정자에 액체를 주입 하는 것은 원치 않는 주입 유물 발생 발견, 아마 우물에 정자의 희석 및/또는 잘 바닥에서 정자를 대체. 첫 번째 주입은 가장 큰 주입 아티팩트를 발생, 그래서 우리는 프로토콜의 시작 부분에 모든 우물에 정자 버퍼와 모의 주입을 포함.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 록펠러 높은 처리량 및 분광학 자원 센터에서 박사 라보이시에 라모스 -Espiritu의 지원을 인정하고자합니다.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| 2-Deoxy-D-glucose | Sigma-Aldrich | D8375 | 2-DG |
| 3-Isobutyl-1-methylxanthine | Sigma-Aldrich | I7018 | IBMX; prepare a 500 mM stock solution in DMSO (111.1 mg/ml) and store in small aliquots |
| Antimycin A | Sigma-Aldrich | A8674 | AntA; prepare a 5 mM stock solution in DMSO (2.7 mg/ml) and store in small aliquots |
| Bovine serum albumin | Sigma-Aldrich | A1470 | BSA |
| Calcium chloride | Sigma-Aldrich | C1016 | CaCl2 |
| Concanacalin A, Lectin from Arachis hypogaea (peanut) | Sigma-Aldrich | L7381 | ConA |
| Glucose | Sigma-Aldrich | G7528 | |
| Hepes | Sigma-Aldrich | H0887 | |
| Isothesia | Henry Schein Animal Health | 1169567761 | Isoflurane |
| Magnesium sulfate | Sigma-Aldrich | M2643 | MgSO4 |
| N6,2'-O-Dibutyryladenosine 3',5'-cyclic monophosphate sodium salt | Sigma-Aldrich | D0627 | db-cAMP |
| Potassium chloride | Sigma-Aldrich | P9333 | KCl |
| Potassium dihydrogen phosphate | Sigma-Aldrich | P5655 | KH2PO4 |
| Rotenone | Cayman Chemical Company | 13995 | Rot; prepare a 5 mM stock solution in DMSO (2mg/ml) and store in small aliquots |
| Sodium bicarbonate | Sigma-Aldrich | S5761 | NaHCO3- |
| Sodium chloride | Sigma-Aldrich | S9888 | NaCl |
| Equipment and materials | |||
| 12 channel pipette 10-100 μL | eppendorf | ES-12-100 | |
| 12 channel pipette 50-300 μL | vwr | 613-5257 | |
| 37 °C, non-CO2 incubator | vwr | 1545 | |
| 5 mL cetrifuge tubes | eppendorf | 30119380 | |
| 50 mL conical centrifuge tubes | vwr | 76211-286 | |
| Centrifuge with plate adapter | Thermo Scientific | IEC FL40R | |
| Dissection kit | World Precision Instruments | MOUSEKIT | |
| Inverted phase contrast microscope with 40X objective | Nikon | ||
| OctaPool Solution Reservoirs, 25 ml, divided | Thomas Scientific | 1159X93 | |
| OctaPool Solution Reservoirs, 25 mL, divided | Thomas Scientific | 1159X95 | |
| Seahorse XFe96 Analyzer | Agilent | ||
| Seahorse XFe96 FluxPak | Agilent | 102416-100 | Also sold as XFe96 FluxPak mini (102601-100) with 6 instead of 18 cartidges. |
참고문헌
- Wu, M., et al. Multiparameter metabolic analysis reveals a close link between attenuated mitochondrial bioenergetic function and enhanced glycolysis dependency in human tumor cells. American Journal of Physiology - Cell Physiology. 292 (1), C125-C136 (2007).
- Amo, T., Yadava, N., Oh, R., Nicholls, D. G., Brand, M. D. Experimental assessment of bioenergetic differences caused by the common European mitochondrial DNA haplogroups H and T. Gene. 411 (1-2), 69-76 (2008).
- Choi, S. W., Gerencser, A. A., Nicholls, D. G. Bioenergetic analysis of isolated cerebrocortical nerve terminals on a microgram scale: spare respiratory capacity and stochastic mitochondrial failure. Journal of Neurochemistry. 109 (4), 1179-1191 (2009).
- de Groof, A. J., et al. Increased OXPHOS activity precedes rise in glycolytic rate in H-RasV12/E1A transformed fibroblasts that develop a Warburg phenotype. Molecular Cancer. 8, 54 (2009).
- Chao, L. C., et al. Insulin resistance and altered systemic glucose metabolism in mice lacking Nur77. Diabetes. 58 (12), 2788-2796 (2009).
- Chang, M. C. Fertilizing capacity of spermatozoa deposited into the fallopian tubes. Nature. 168 (4277), 697-698 (1951).
- Austin, C. R., Bishop, M. W. Role of the rodent acrosome and perforatorium in fertilization. Proceedings of the Royal Society of London. Series B, Biological Sciences. 149 (935), 241-248 (1958).
- Ishijima, S., Baba, S. A., Mohri, H., Suarez, S. S. Quantitative analysis of flagellar movement in hyperactivated and acrosome-reacted golden hamster spermatozoa. Molecular Reproduction and Development. 61 (3), 376-384 (2002).
- Suarez, S. S. Control of hyperactivation in sperm. Human Reproduction Update. 14 (6), 647-657 (2008).
- Goodson, S. G., Qiu, Y., Sutton, K. A., Xie, G., Jia, W., O'Brien, D. A. Metabolic substrates exhibit differential effects on functional parameters of mouse sperm capacitation. Biology of Reproduction. 87 (3), 75 (2012).
- Travis, A. J., et al. Functional relationships between capacitation-dependent cell signaling and compartmentalized metabolic pathways in murine spermatozoa. Journal of Biological Chemistry. 276 (10), 7630-7636 (2001).
- Urner, F., Leppens-Luisier, G., Sakkas, D. Protein tyrosine phosphorylation in sperm during gamete interaction in the mouse: the influence of glucose. Biology of Reproduction. 64 (5), 1350-1357 (2001).
- Danshina, P. V., et al. Phosphoglycerate kinase 2 (PGK2) is essential for sperm function and male fertility in mice. Biology of Reproduction. 82 (1), 136-145 (2010).
- Miki, K., et al. Glyceraldehyde 3-phosphate dehydrogenase-S, a sperm-specific glycolytic enzyme, is required for sperm motility and male fertility. Proceedings of the National Academy of Sciences. 101 (47), 16501-16506 (2004).
- Mori, C., et al. Mouse spermatogenic cell-specific type 1 hexokinase (mHk1-s) transcripts are expressed by alternative splicing from the mHk1 gene and the HK1-S protein is localized mainly in the sperm tail. Molecular Reproduction and Development. 49 (4), 374-385 (1998).
- Westhoff, D., Kamp, G. Glyceraldehyde 3-phosphate dehydrogenase is bound to the fibrous sheath of mammalian spermatozoa. Journal of Cell Science. 110 (15), 1821-1829 (1997).
- Nevo, A. C., Rikmenspoel, R. Diffusion of ATP in sperm flagella. Journal of Theoretical Biology. 26 (1), 11-18 (1970).
- Adam, D. E., Wei, J. Mass transport of ATP within the motile sperm. Journal of Theoretical Biology. 49 (1), 125-145 (1975).
- Tombes, R. M., Shapiro, B. M. Enzyme termini of a phosphocreatine shuttle. Purification and characterization of two creatine kinase isozymes from sea urchin sperm. Journal of Biological Chemistry. 262 (33), 16011-16019 (1987).
- Gomendio, M., Tourmente, M., Roldan, E. R. Why mammalian lineages respond differently to sexual selection: metabolic rate constrains the evolution of sperm size. Proceedings of the Royal Society of Biological Sciences. 278 (1721), 3135-3141 (2011).
- Tourmente, M., Villar-Moya, P., Rial, E., Roldan, E. R. Differences in ATP generation via glycolysis and oxidative phosphorylation and relationships with sperm motility in mouse species. Journal of Biological Chemistry. 290 (33), 20613-20626 (2015).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121 (4), 1139-1150 (1995).
- Buck, J., Sinclair, M. L., Schapal, L., Cann, M. J., Levin, L. R. Cytosolic adenylyl cyclase defines a unique signaling molecule in mammals. PNAS. 96 (1), 79-84 (1999).
- Visconti, P. E., Bailey, J. L., Moore, G. D., Pan, D., Olds-Clarke, P., Kopf, G. S. Capacitation of mouse spermatozoa. I. Correlation between the capacitation state and protein tyrosine phosphorylation. Development. 121 (4), 1129-1137 (1995).
- Morgan, D. J., et al. Tissue-specific PKA inhibition using a chemical genetic approach and its application to studies on sperm capacitation. PNAS. 105 (52), 20740-20745 (2008).
- Lybaert, P., Danguy, A., Leleux, F., Meuris, S., Lebrun, P. Improved methodology for the detection and quantification of the acrosome reaction in mouse spermatozoa. Histology and Histopathology. 24 (8), 999-1007 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유