Method Article
일방적인 기관내 산 성 증착에 의한 자가 제한 급성 폐 손상의 모델
요약
마우스에서 좌측 폐에 선택적 기관차 산 주입은 위산 흡인에 의해 유도된 인간 급성 호흡 곤란 증후군(ARDS)을 모델로 하는 일방적이고 자가 제한적인 급성 폐 손상을 초래한다.
초록
소변 왼쪽 메인스템 기관지의 선택적 기관지 내 점심은 인간 급성 호흡 곤란 증후군 (ARDS)과 유사한 조직 병리학 적 발견으로 급성 조직 손상을 일으킨다. 결과 폐포 부종, 폐포 모세관 장벽 손상 및 백혈구 침윤은 주로 왼쪽 폐에 영향을 미치며, 오른쪽 폐를 손상되지 않은 대조군으로 보존하고 동물이 살아남을 수 있게합니다. 자가 제한급성 폐 손상의 이 모형은 apoptotic 호중구의 대식세포 efferocytosis와 폐포 모세관 장벽 무결성의 회복과 같은 조직 해결책 기계장치의 조사를 가능하게 합니다. 이 모형은 ARDS를 가진 환자를 위한 새로운 치료 접근의 발달을 위한 기초를 제공하는 전문화한 pro-resolution 중재자 (SPM)를 포함하여 해결책 작용제에 대한 중요한 역할을 확인하는 것을 도왔습니다.
서문
급성 호흡 곤란 증후군 (ARDS)은 급성호흡 부전의 중요한 원인 1. 그것은 전 세계적으로 중환자실에 입원한 모든 환자의 10%에서 생기는 일반적이고치명적인 또는 무능하게 하는 질병입니다 2. 베를린 정의3에따르면, ARDS는 저산소 성 호흡 부전 (&1 주)의 급성 발병에 의해 정의되며 심장 부전으로 설명되지 않는 흉부 방사선 촬영에 양측 폐 침윤제4. 근본적인 병리학은 과도한 염증 반응을 특징으로합니다. 폐는 폐렴이나 위산 흡인과 같은 직접적인 부상을 입었거나, 패혈증이나 다중 수혈 후와같이 간접적으로 다질 수 있다 4. 초기 모욕에 이어, ARDS 병인은 삼출성, 증식 및 섬유성 단계 1의3단계로 진행됩니다. 이 단계는 ARDS 환자를 위한 예후를 결정하는 명백한 분자 및 세포 면역 및 복구 기계장치를 특징으로 합니다. 지원 배려는 ARDS 환자를 위한 주류로 남아 있습니다; 현재, ARDS를 위한 효과적인 약리학 적인 처리가 없습니다, 그래서 이 파괴적인 조건에 새로운 연구를 위한 긴급한 필요가있습니다4.
삼출기 동안 선천성 면역 반응의 조절은 ARDS및 관련 호흡 부전의급성 발병에 기여한다 1. 강력한 염증성 중재자 신호신호는 초기 면역 반응을 조율하여 폐포-모세관 장벽의 붕괴, 확산 폐포 부종 및 폐 조직 손상 부위에 대한 호중구 침윤을 초래한다4. ARDS에서, 급성 염증에 대한 비효율적인 제동 신호는 폐 부전을 걸리기 쉽고 부상당한 폐 조직의 적시 촉매를 지연시킬 수 있다5. 이를 위해, ARDS의 내인성 발동 및 프로 분해 메커니즘에 대한 전임상 조사는 새로운 치료 전략을 발견할 수 있습니다. 그 같은 조사는 인간 ARDS의 특징을 밀접하게 닮은 급성 폐 상해의 생체 내 실험 모형을 요구합니다, 조직 상해의 개시 그리고 해결책 단계의 기초가 되는 기계장치의 심문을 허용하.
여기에 제시된 뮤린 모형은 삼출성 ARDS의 추기경 병리학적인 프로세스, 즉 폐포 모세관 장벽 중단 및 호중구 침투를 보여주는 직접적인 급성 폐 상해를 일으킵니다. 이 방법은 왼쪽 메인 스템 기관지의 통조림을 통해 HCl의 선택적 기관지 내 주입에 의존, 왼쪽 폐에 부상 및 염증 반응을 국소화; 손상되지 않은 오른쪽 폐는 조직 손상 및 염증의 선택 결정에 대한 내부 제어로 사용할 수 있습니다. 또한, 일방적 인 폐 부상은 치명적이지 않으며 해결 프로그램을 발표합니다. 이것은 내인성 프로 해결 중재자 및 세포 메커니즘의 식별을 위해 활용 될 수있는 폐 염증의 해상도로 뚜렷한 창을 제공하고 해상도 생리학을 강조하는 ARDS에 대한 새로운 치료 방법을 열고 약리학.
프로토콜
아래의 모든 동물 절차는 브리검 여성 병원의 기관 동물 관리 및 사용위원회 (프로토콜 #2016N000356)에 의해 검토되고 승인되었습니다.
참고: 모든 생존 절차에 대해 멸균 기술을 따랐습니다. 외과 의사는 멸균 수술 장갑, 모자, 마스크 및 깨끗한 실험실 코트를 착용하는 동안, 멸균 드레이프 타월을 사용하여 각 수술에 대한 멸균 필드를 설립했다. 모든 수술 기구는 오토클레이브를 사용하여 멸균되었고, 비드 멸균기를 사용하여 멸균을 유지시켰다.
1. 0.1 N HCl의 준비
- 호박색 유리 병에 ddH2O 11 mL을 추가합니다. 37% HCl(12 N)의 1mL를 천천히 추가하여 1 N HCl 작업 재고를 만듭니다.
주의 사항: HCl이 물에 추가되었는지 확인하십시오. 산에 직접 물을 추가하면 산이 끓고 병에서 튀어 나올 수 있기 때문에 이것은 안전 문제입니다. 농축 된 HCl을 취급 할 때, 산이 환기 화학 후드에 보관하고 실험실 코트, 장갑 및 안전 안경을 포함하여 적절한 개인 보호 장비를 착용해야합니다. - 이전에 희석된 HCl 작업 스톡의 4 mL을 50 mL 원엽 튜브에 35 mL의 ddH2O에 천천히 추가하여 0.1 N HCl 실험 스톡을 만듭니다.
- 낮은 pH 용액을 사용하여 2점 교정 후 전자 pH 프로브를 사용하여 실험 스톡의 pH를 측정합니다. 최종 부피가 40 mL이되도록 필요에 따라 NaOH 또는 HCl 스톡 솔루션을 사용하여 pH 1.1로 적정합니다.
참고: 낮은 pH 값을 측정하는 것은 어려울 수 있습니다. 정확한 측정을 위해 낮은 pH 표준을 사용하여 pH 프로브를 적절하게 보정하여 측정의 과잉 외삽을 방지하십시오. - 실험 직전에, 실험용 HCl 스톡의 1-2 mL을 0.22 μm 멸균 필터를 멸균 미세원원지 튜브내로 여과한다.
2. HCl의 선택적 기관내 주입
-
수술 부위 준비
- 케타민 (100 mg / kg)과 자일라진 (10 mg / kg) 혼합물을 복강 내 주사로 전달하여 전신 마취를 유도하십시오. 꼬리 또는 뒷발의 끝을 부드럽게 압착하여 마우스가 완전히 마취되었는지 확인합니다. 피부 절개를 하기 전에 철수 반응의 부족이 필요합니다. 필요한 경우 추가 마취 볼러스를 투여하십시오.
- 목 덜미에서 피하로 0.1 mg/kg의 부프레노르핀을 전달합니다. 수술 전 진통제는 마취의 효과를 강화하고 절차로 인한 수술 전 및 사후 통증을 개량합니다.
- 전기 클리퍼를 사용하여 천천히 아래쪽으로 스트로크를 사용하여 마우스의 복부 표면, 목의 자궁 경부 부위의 턱 아래 수술 부위를 부드럽게 면도하십시오. 느슨한 털을 제거하여 기본 피부를 완전히 노출시지 하십시오.
- 10 % 포비도 - 요오드 용액으로 면도 부위를 스와핑하여 수술 부위를 준비하십시오. 무균 제를 적용 한 후, 70 % 이소 프로필 알코올 면봉을 사용하여 부위를 청소하십시오. 이 단계를 3x 반복합니다.
-
기관 격리
- 깨끗한 수술 보드에 supine 위치에 마우스를 배치하고 수술 영역의 노출을 유지하면서 멸균 수술 드레이프에 마우스를 커버. 제자리에 드레이프를 고정합니다.
- 기관 및 타액 선 위의 피부에 0.5 cm 세로 절개를합니다. 약간 구부러진 톱니 모양의 포셉을 사용하여 조심스럽게 피부를 뒤로 당기고 타액선을 부드럽게 분리하여 기관 근육을 노출시십시오.
- 무딘 해부를 위해 톱니 모양의 집게를 사용하여, 부드럽게 paratracheal 근육을 밀어 기관의 연골 고리가 완전히 노출 될 때까지 기관을 둘러싼 근막을 애타게.
- 완전히 구부러진 톱니 모양의 집게를 사용하여 기관을 들어 올리고 레트로 기관과 레트로 근막 사이의 결합 조직을 분리하십시오. 결합 조직이 분리되면 집게의 끝이 기관 뒤로 완전히 미끄러져야합니다.
- 기관 뒤에 구부러진 집게를 유지하고 집게 의 끝과 4-0 꼰 실크 봉합사의 10-15cm 조각을 잡아. 양쪽의 길이가 균일할 수 있도록 기관 뒤쪽의 봉합사를 당깁니다.
- 봉합사가 제자리에 있으면 봉합사의 측면을 마우스 뒤쪽쪽으로 부드럽게 당기고 측면을 제자리에 고정시다.
-
왼쪽 메인 스템 기관지 선택적으로 캐뉼링 및 HCl 주입
- 24 G x 3/4"angiocatheter를 가지고 바늘을 삽입, 경사, 첫 번째와 두 번째 기관 고리 사이의 기관의 전방 영역에. 기관 루멘에서 바늘 끝을 직접 시각화하여 적절한 삽입이 확인되면 봉합사를 풀어 내고 저항에 도달 할 때까지 기관으로 캐뉼러를 진행한 다음 바늘을 철회하십시오. 왼쪽 폐로 선택적 주입을 위해 왼쪽 주 줄기 기관지쪽으로 삽입 방향을 각도로합니다.
- 캐뉼라가 제자리에 있으면 카테터가 변하는 것을 방지하기 위해 주사 포트를 단단히 잡습니다.
- P200 파이펫과 멸균 P200 파이펫 팁을 사용하여 2.5 mL/kg(20g 마우스의 경우 50μL)을 카테터에 여과한 멸균 필터를 적용한 다음 동일한 양의 공기를 주입합니다.
- 카테터를 빠르게 인출하고 수술 판을 30°의 각도로 들어 올립니다.
-
수술 부위 폐쇄
- 수술 판을 평평하게 놓고 기관 뒤에서 봉합사를 제거하십시오.
- 4-0 왁스 코팅 편조 실크 봉합사를 사용하여 2-3 바늘을 사용하여 피부 절개를 닫습니다.
3. 수술 후 관리
- 절개가 닫히면 마우스가 마취에서 회복될 때까지 마우스를 따뜻한 가열 패드에 왼쪽에 놓습니다. 정상적인 하우징으로 되돌리기 전에 마우스에서 통증과 활동 수준을 모니터링하기 시작합니다.
참고: Buprenorphine에서 관리 해야 한다 0.1 mg/kg 피하 모든 6-12 처음에 대 한 시간 24 시간. 지속적인 획기적인 통증이 존재하는 경우 통증이 가라 앉을 때까지 진통 요법을 확장하십시오.
4. 전체 폐 기관지 베올라 세척 (BAL) 및 백혈구 면역 세포 면역 공형
-
2.1.1단계에서 사용되는 케타민/자일라진의 3배 용량을 투여하여 마우스를 안락사시하였다.
- 간질 및 혈관 내 호중구를 분화하기 위해, 안락사 5분 전에 선택된 형광부 표지Ly6G 항체를 정맥 주사한다. 이 라벨은 다른 형광로폴로 조직 준비 중에 표지 될 폐 간질 및 폐포 호중구에서 혈관 내 호중구를 구별하기 위해 유세포 분석에 의한 검출에 적합해야합니다 (아래 참조).
- 수술 보드에 마우스를 놓고 2-0 꼰 실크 봉합사의 루프 주위에 전방 앞니를 후크.
- 2.2.2-2.2.6 단계를 따릅니다. 을 위해 기관을 준비합니다.
참고: 횡포가 폐 세척 시 트랜스 폐포 팽창 압력을 최대화하기 위해 구멍이 뚫리지 않았는지 확인하십시오. 왼쪽 폐 규정 준수 는 폐 세척에 대한 높은 트랜스 폐포 압력 요구 사항을 필요로 할 수 있습니다 부상 다음 감소. - 2.3.1 단계 다음 기관을 칸넬화하지만 카테터를 카리나 아래에 진행시키지 마십시오. 카테터를 기관에 평행하게 삽입하십시오.
- 카테터를 삽입하면 기관 주위의 봉합사를 묶어 카테터를 제자리에 고정시됩니다.
- 1 cc 주사기를 사용하여 0.6 mM EDTA로 얼음 차가운 PBS -/- (마그네슘 또는 칼슘 제외)의 연속 1 mL aliquots를 2 회 연속으로 인출합니다. 유세포 분석에 의한 면역 세포질의 경우, 각 알리쿼트를 제거하고 얼음 위에 5 mL 폴리스티렌 FACS 튜브로 돌아갑니다.
- 안락사를 보장하려면 수술용 가위를 사용한 후 심장 천자가 있는 대두 절제술을 실시하십시오. 폐는 추가 처리를 위해 수확될 수 있습니다.
- BAL을 4°C에서 800 g에서 10분 동안 펠렛세포에.
- 상급체를 2 mL 마이크로원심지 튜브로 하고 1.5 mL 마이크로원심지 튜브에 알리쿼트를 넣습니다. 후속 분석을 위해 -80°C에서 보관하십시오.
- 유세포 분석에 의한 백혈구 차동 분석을 위한 2% FBS로 PBS -/-에서 세포 펠릿을 다시 중단합니다.
- 간질 및 혈관 내 호중구를 분화하기 위해, 왼쪽 및 오른쪽 폐를 별도로 제거하고 Abdulnour et al. 20146에서와 같이 유세포 측정을 위해 폐를 처리한다.
- 선택된 FACS 항체를 사용하여 생성된 세포 현탁액을 염색하고, 4.1.1단계에서Ly6G 항체와 는 다른 형광포와 공액되는 Ly6G에 대한 얼룩을 확인한다.
5. 에반의 청색염료(EBD)를 이용한 폐포 장벽 투과성 평가
- 안락사 30분 전에 에반의 청색염료(40 mg/kg)를 정맥 주사합니다.
- 케타민/자일라진 과다 복용(4.1단계)을 사용하여 마우스를 안락사시한다.
- 폐포 장벽 무결성을 측정하려면 BAL 수집에 대해 4.2-4.9 단계를 따르십시오.
- 100 μL의 BALF를 투명한 바닥 96웰 마이크로플레이트로 옮기고 100 μL의 중복 EBD 표준을 전달합니다. PBS -/-를 공백으로 사용합니다.
- 마이크로플레이트 리더를 사용하여 620 nm 및 740 nm에서 BALF의 흡광도를 측정합니다. 740 nm에서 흡광도를 사용하여 샘플 7의헴 오염을 교정하십시오.
- 혈관 장벽 무결성을 측정하기 위해 심장의 우심실을 통해 5 mL의 얼음 차가운 PBS를 천천히 주입하여 폐를 정중시하십시오. 왼쪽 폐를 제거합니다.
- 왼쪽 폐를 58°C에서 72시간 동안 건조하여 여분의 물을 제거합니다.
- 라두 및 체르노프 2013 8에서와같이 말린 폐 조직을 처리하고, 620 nm 및 740 nm에서 흡광도를 측정한다.
6. 폐 역학
- 4.1-4.5 단계를 수행하여 기관을 칸에 노출시하십시오.
- 20cm H2O에서 폐를 고정하려면 링 스탠드와 클램프를 사용하여 밸브 제어 튜브가 장착 된 60 mL 주사기를 높이고 선택된 고정 용액 (예 : 아연 고정 제)으로 채워서 고정 용액의 반월 상 연골이 20cm 위에 있도록합니다. 폐.
- 튜브를 카테터에 부착하고 값을 엽니다. 팽창을 멈출 때까지 천천히 폐를 고정제로 채웁니다.
- 카테터를 3/4로 제거하십시오. 카테터를 완전히 제거하기 전에 혈관을 봉합사로 묶어 고정물의 손실을 최소화하십시오.
- 폐와 심장 을 제거 블록.
참고: 제거 중에 폐가 구멍이 뚫려 압력이 주입된 고정제를 유지하도록 하십시오. - 실온에서 25 mL의 고정제에서 24 시간 동안 폐를 고정하십시오.
- PBS -/-, 30% 에탄올 및 50% 에탄올에서 순차적으로 20분 간격으로 고정 폐를 세척합니다.
- 마지막 세척 후, Eickmeier외.2013 9에서와 같이 조직학 처리를 위한 70% 에탄올에 폐를 저장합니다.
결과
선택적 기관지 내 HCl 주입은 일방적인 급성 폐 손상의 결과
좌측 주축 기관지 내HCl의 선택적 기관지 내 증착 방법은 도 1A에예시되어 있다. 결과적인 급성 폐 손상은 전체 좌측 폐를 수반하고, EBD 및 폐 관류의 정맥투여 후, EBD는 좌측 폐에만 남아 있었다(도 1B). 좌측 폐내의 EBD 외삽은 sham 선택적 주입에 비해 유의하게 증가된 것으로 나타났다(도1C;Abdulnour etal. 2014 6). 폐 손상에 응하여, 염증조직에 백혈구 를 순환하는 diapedese. 이 모형에서는, 혈관 호중구는 부상당한 폐 간질로 trans 내피 이동을 겪습니다. 중간 호중구는 HCl 주입 후 24 시간 후 왼쪽 폐에 축적되어, 몇 개의 간질 호중구가 관찰되는 우측 폐와는 대조적이다 (도1D). 이러한 결과는 선택적 좌측 메인스템 내 기관지 점안 법이 주로 좌측 폐에 국한되고 인간 ARDS로 볼 수 있는 병리학적 변화를 일으킨 뮤린 급성 폐 손상을 초래했다는 것을 나타낸다. 폐포 모세 혈관 장벽 위반 및 호중구 침투.
일방적인 급성 폐 손상으로 해결 메커니즘의 조사 가능
산-유도 급성 폐 손상 마우스의 분해 단계를 연구하려면 초기 모욕에서 살아남을 수 있어야 한다. 골내 HCl과 구별되는, 왼쪽 메인스템 기관지만으로 점심은 그렇지 않으면 건강한 마우스에서 균일한 생존과 함께 자기 제한된 부상으로 이어집니다. 폐는 도 2A에서와 같이 초기 또는 후기 시점에서 마우스로부터 수득될 수 있다. 폐 조직학은 좌폐에 표시된 폐포 부종 및 호중구 침윤을 특징으로 하는 상해 후 24 시간 삼출성 염증으로 기관 및 세포 수준에서 조직 손상 및 염증을 보여줍니다. 유의사항으로는 중상또는 백혈구가 손상되지 않은 대조군우측 폐로 유입되지 않는다는 점에 유의한다(도 2A). 72 부상 후 시간, 부종 및 세포 침윤액이 실질적으로 감소하여 해결 된 다출 단계를 나타냅니다. 폐포 호중구는 전체 폐 세척에 의해 얻어진 유세포 분석 (CD45+/ CD68-/ F4/80-/Ly6G+/CD11b+)에 의해 모니터링 될 수 있습니다. 호중구는 초기 부상 후 24시간 왼쪽 폐에서 증가하고 48 및72h에서 실질적으로 감소한다(그림 2B). 나중에 시간 점을 조사하는 경우에, 호중구 수는 섬유증식반응과 같은 이화기의 나중 단계에서 기준선 및 기계장치로 돌아갈 것입니다, 공부될 수 있습니다.
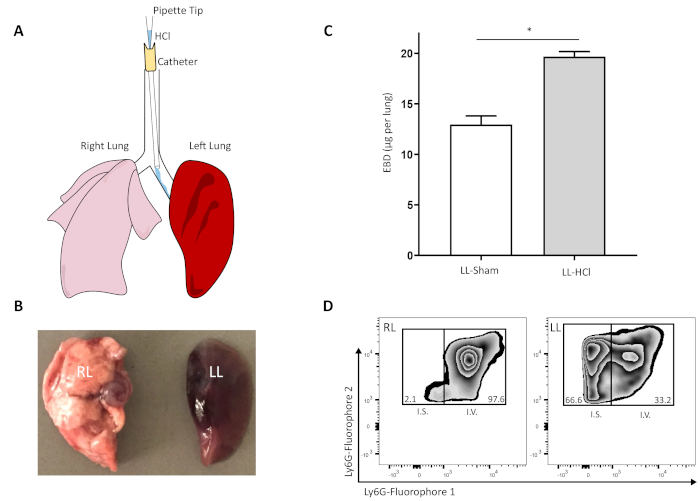
그림 1: 선택적 기관지 내 HCl 증류는 폐포 장벽 위반 및 호중구 침투에 의해 정의된 일방적인 폐 손상을 일으킵니다. (a) 왼쪽 폐로 HCl의 선택적 주입을 위한 뮤린 좌측 주스템 기관지의 통조림의 표현. (B) 선택적 산 성 주입에 노출 된 오른쪽 (RL) 및 왼쪽 (LL) 폐를 절제하고 정맥 에반의 청색 염료를 따라 침전. (C) 균질화, 침공 폐 24 시간 후 산성 상해 또는 가짜 제어로부터 간질 에반의 청색 염료의 정량화; 그림 압둘 누어 외 에서 적응 20146. 값은 n ≥ 5의 평균 ± SEM을 나타냅니다. * p< 0.05, Mann-Whitney U Test. (D) 대표적인 혈관 내(I.V.; 형광포상 1) 및 간질(I.S.; 형광소 2) 호중구는 산성 손상 후 처리된 폐에서 총 CD45+ 세포의 백분율로. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
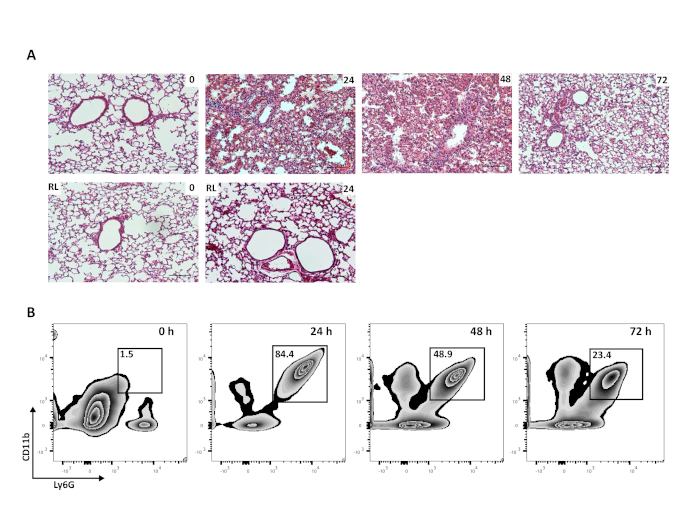
도 2: 일방적급성 폐 손상은 자가 분해이다. (a) 대표적인 H&E 역학(10x)은 동일한 마우스로부터 관련 우측 폐와 함께 상해 후 24, 48, 72시간 후 순진한 마우스(0 h) 또는 마우스로부터 수득된 왼쪽 폐(Scale bar = 250 μm)를 나타낸다. (B) 폐포 호중구의 대표적인 유세포분석 (Ly6G+ CD11b+)전체 폐 세척에서 얻은 총 CD45+ 세포의 백분율로 순진한 (0 시간) 마우스 또는 마우스 24, 48, 및 72 시간 산성 손상 후. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명된 기관지 내 점안 방법은 왼쪽 주림 기관지의 선택적 캐널을 사용하여 왼쪽 폐에 HCl을 주입하여 일방적이고 자가 제한적인 뮤린 급성 폐 손상을 초래합니다. 이러한 뮤린산 폐 손상 모델은 인간 ARDS에서 볼 수 있는 염증 반응, 조직병리학 및 생리적 장애를 밀접하게 나타내며, 여기서 위산 흡인은 일반적인 침전물 또는 기여 인자 4이다. 낮은 pH HCl에 뮤린 기도의 노출은 폐포 모세관 장벽의 증가 투과성 결과, 폐포 부종, 및 부상 부위에 깊은 호중구 침투. 이러한 이벤트는 부상을 입지 않은 오른쪽 폐에서 관찰되지 않습니다. 또한, 이 모델은 산 점안 후 24시간 이내의 피크를 생성하는 신속한 염증 반응을 생성하고, 인산분리제 D이소폼10의차등 발현과 같은 인간 ARDS와 유전자 발현의 변화를 공유한다.
이 뮤린 전임상 모델은 분자, 세포 및 조직 수준에서 ARDS의 많은 특징을 재현하지만, 인간 ARDS를 완전히 재현하지는 못한다. ARDS의 정의는 양측폐 관련 3을 포함하지만, 여기에 설명된 증원 방법은 일방적인 폐 질환의 설계에 의해 발생합니다. 더욱이, 동물은 지속적인 기계적 환기, 부동, 또는 비경구 침열이 필요하지 않다. 여기에 제시된 결과(vide supra) 및 기타6,9,11,12,13은 일방적인 산 유발 폐 손상이 대부분의 병리학적 특징을 재현한다는 것을 입증한다. ARDS는 오른쪽 폐를 내부 통제로 사용하고이 질병의 해결 단계를 연구 할 수있는 독특한 기회를 제공합니다. 이와 같이, 여기에서 논의된 모형은 ARDS 병리학을 모형하고, 또한 이 중요한 질병을 해결하기 위하여 관련있을 지도 모르다 상해 및 해결책 기계장치에 근본적인 폐 조직 반응의 기계론적인 조사를 가능하게 합니다.
HCl의 주입은 직접적인 급성 폐 손상을 나타내므로 흡인 성 폐렴과 관련된 병리생리학의 측면을 모델링합니다. 또한, 이 모델에서 초기 좌측 폐모욕은 폐렴(14)으로 이어질 수 있는 일부 인간 흡인 사건에서볼 수 있는 박테리아가 함유된 위 내용물보다는 멸균 HCl을 사용하여 생성된다. 인간에서 병원성 박테리아의 흡인은 급성 염증 반응을 악화시키는 이차 세균 성 폐렴을 초래할 수 있으며, 초기 폐 손상을 연장시키고 ARDS14를개발하는 환자 감수성을 증가시킬 수 있습니다. 이러한 잠재적 제한은 고의로 병원성 박테리아 대장균(대장균)을 주입한 후15일 멸균 HCl. 추가로, 이 방법이 병원체 매개를 조사하기 위해 사용되어 왔다. 염증; 일방적인 세균성 폐렴은 대장균16,17, 녹농균16,및 연쇄상 구균 폐렴18과 같은 박테리아의 선택적 좌폐 점안에 의해 유도될 수 있다. . 여기서 설명된 자가 제한급성 폐 손상 모델은 또한 인간 ARDS19에서사망률 증가의 중요한 원인인 인공호흡기 유도 폐 손상(VILI)을 연구하는데 사용될 수 있다. VILI의 실험 동물 모델은 일반적으로 임상적으로 폐 손상을 일으키는 데 사용되는 것보다 훨씬 높은 조수 부피를 가진 순진한 마우스에서 기계적 환기를 포함합니다 (>15 mL / kg; 이전 작업20,21참조). VILI의 보다 임상적으로 관련성이 있는 모델로, 여기에 설명된 바와 같이 기관지 내 산 점안은 먼저 비치명적인 폐 손상을 유도하고 임상 범위 내의 조수 부피에서 기계적 환기를 유도하는 데 사용될 수 있다(6-12 mL/kg). 이 가상의 동물 모델은 조사자가 한 번 개발및 검증된 임상적으로 관련성이 있는 방식으로 VILI를 연구할 수 있도록 허용할 수 있습니다. 함께, 이러한 뮤린 모델은 인간의 폐 질환과 관련된 병리와 밀접하게 유사한 일방적 인 폐 모욕을 생성하는 선택적 기관내 점원 방법의 다양성을 강조한다.
왼쪽 폐에 다양한 유해 에이전트의 선택적 주입을 허용하는 것 외에도, 기관 절제술 후 기관지 내 주입 기술은 확장 된 훈련, 긴 절차 시간 또는 복잡한 장비를 필요로하지 않으며 숙련 된 손에 동물에게 최소한의 고통을 야기합니다. 그럼에도 불구하고 실험 결과에 영향을 미칠 수 있는 선택적 HCl 주입 절차 중에 몇 가지 문제가 발생할 수 있습니다. 왼쪽 주요 줄기 기관지의 부적절한 통조림은 실험 마우스의 생존을 감소시키고 손상되지 않은 내부 대조군으로 오른쪽 폐의 사용을 혼동 양측 폐 부상을 초래할 수 있습니다. 이것은 저항이 도달할 때까지 캐nulation 도중 좌측 폐를 향해 카테터를 충분히 매달려서 피할 수 있습니다. HCl의 주입 후, 공기의 볼루스를 주입해야, 카테터를 신속하게 제거하고, 수술 보드는 60 ° 각도로 똑바로 제기. 이 단계는 산이 좌측 폐의 말단 기도에 도달하고 근위 손상을 일으키는 원인이 될 수 있는 오른쪽 폐 및 기관으로 산의 역류를 방지한다는 것을 지키기 위해 중요합니다. 내 24 시간 다음 점안, 왼쪽 폐에 부상은 광범위 한 폐 부 종확산, 원 위 및 근위 왼쪽 폐 에 영향을 미치는.
성인 8-12 주 오래 된 쥐에서 방법 개발 하는 동안, 2.5 gl/kg의 기관지 내 HCl 생산 상당한 아직 치명적인 급성 폐 손상; HCl의 낮은 복용량 은 재현 가능 하고 균일 한 폐 손상 귀 착되지 않았다. 비록 우리가 더 젊은 (예를 들어, 3-6 주 오래 된) 또는 더 오래 된 쥐 (예를 들어, 10-14 개월)에서이 모델을 수행 하지 않은, 우리는 HCl의 무게 기반 투약 8-12 주 오래 된 쥐에서 지적 하는 것과 유사한 폐 손상 표현형 귀 착될 것으로 예상. 우리는 조사자가 무게의 극단에 마우스와 실험을 수행하기 전에 폐 손상의 원하는 정도를 달성하기 위해 HCl 복용량을 적정하는 것이 좋습니다.
이 선택적 산 점원 절차는 기계적 환기와 같은 지지주의 적 치료의 필요성을 감소 멸균 조직 염증의 비 치명적인 뮤린 모델을 제공합니다. 부상당한 마우스의 연장된 생존으로, 산 유도된 염증은 자기 해결을 위한 충분한 시간이 있습니다. 이 모델의 분해 단계는 시간적으로 조절된 내인성 생리활성 지질 매개체, 리포신 A 4(LXA4), 마레신 1(MaR1), 레솔빈6과 같은 전문 프로-해결 매개체(SPM)를 식별하는 데 사용되었습니다. ,11,12,16. 부상당한 마우스에 외인성 SPM을 투여하면 염증 성 메커니즘을 약화시키고 부상당한 폐 조직의 촉매를 촉진하여 산 유발 폐 손상의 분해를 촉진합니다. 이러한 SPM은 폐포 부종(12)의 클리어런스를 촉진하고, 모집된 대식세포(16)에 의한 세포세포증을 증가시키고, 혈관을 감소시키기 위해 기도 및 폐포(12)의 재상피화를 가속화한다. 누설 및 조직 저산소증. 병원균 유도 폐 손상의 모형에서, 15-에피-레솔빈 D1은 또한 대식세포에 의한 증가된 세균식세포증및 감염된 폐로부터의향상된 세균 클리어런스를 통해 항균 작용(16)을 나타냈다. 이러한 내인성 해상도 메커니즘을 조사하면 ARDS5환자를 위한 잠재적인 새로운 치료 전략에 대한 통찰력을 제공합니다.
해상도 메커니즘의 시공간적 조절을 가장 잘 연구하려면 생체 내 실험 모델이 필요합니다. 급성 폐 손상 모델은 분자 및 세포 과정을 촉진하는 호스트 해상도의 참여와 관련된 급성 염증 반응 및 장기 기능 장애를 포함해야합니다. 이러한 메커니즘은 확립된 해상도 지수22를사용하여 정량화할 수 있습니다. 일방적인 급성 폐 손상을 발생시키기 위한 선택적 기관지 내 주입 방법은 내인성 분해물질 및 경로를 프로브하는 데 유용하다는 것이 입증되었다. 이러한 활성 해결 프로세스에 대한 우리의 이해를 심화하는 미래 연구는 염증의 해결책을 강화하고 이환율을 완화하기 위해 내인성 지질 중재자의 생체 활동을 모방하는 치료 작용제로 이어질 것이라는 약속을 가지고 있습니다. ARDS 및 기타 중요한 폐 질환의 사망률.
공개
저자는 공개 할 것이 없다.
감사의 말
저자는 조셉 미즈거드 박사가 선택적 기관지 내 방법의 개발에 기여한 것에 대해 감사드리며, 원고의 유용한 의견과 검토에 감사드립니다. 이 작품은 건강 보조금 P01GM095467 (B.D.L.) 및 K08HL130540 (R.E.A.)의 국립 연구소에 의해 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 10x Zinc Fixative | BD Biosciences | 552658 | |
| 2-0 Braided Silk Suture | Surgical Specialties | SP118 | |
| 24 G x 3/4" Disposable Safelet I.V. Catheter | Excel | 26751 | |
| 33 mm, 0.22 µm syringe filter unit | Millipore-Sigma | SLGP033RS | |
| 4" Long Serrated Slight Curve Graefe Forceps | Roboz | RS-5135 | |
| 4" Long Tip Serrated Full Curve Graefe Forceps | Roboz | RS-5137 | |
| 4.5 " Micro Dissecting Scissors | Roboz | RS-5912 | |
| 6" Crile Wood Needle Holder | Roboz | RS-7860 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| Anti-mouse FITC-Ly6G antibody | Thermo Fisher Scientific | 11-9668-82 | Preferred fluorophore can be used |
| Anti-mouse PE-Ly6G antibody | Thermo Fisher Scientific | 12-9668-82 | Preferred fluorophore can be used |
| Bead sterilizer | |||
| Betadine Solution Swabstick | Betadine | 67618-153-01 | |
| Buprenex | Reckitt Benckiser | NDC: 12496-0757-1, 12496-0757-5 | |
| Clear flat-bottomed 96-well microplate | Thermo Fisher Scientific | 12565501 | |
| Dulbeccos's Phosphate Buffered Saline (PBS) without Ca2+ or Mg+ | life technologies | 14190-144 | |
| Electric clippers | |||
| Ethylenediaminetetraacetic acid (EDTA) | Millipore-Sigma | E6758 | |
| Evans Blue Dye | Millipore-Sigma | E-2129 | |
| Heating pad | |||
| Hydrochloric acid, 37% | Millipore-Sigma | 258148 | |
| Ketamine | Henry-Schein | 56344 | |
| Microplate reader (640, 720 nm) | |||
| P200 Pipette | |||
| P200 Pipette Tips | |||
| pH probe | |||
| Ring stand with extension clamp | |||
| Sterile Alcohol Prep Pads | Thermo Fisher Scientific | 22-363-750 | |
| Sterile Mouse Drape 8" x 8" with Oval Adhesive Fenestration | Steris | 88VCSTF | |
| Sterile Nitrile Gloves | Kimberly-Clark | 56890 | |
| Sterile Towl Drape | Dynarex | 4410 | |
| Wax Coated 4-0 Braided Silk Suture | Covidien | SS733 | |
| Xylazine | AKORN | NDC: 59399-111-50 |
참고문헌
- Baron, R. M., Levy, B. D., Jameson, J. L., et al. Acute Respiratory Distress Syndrome. Harrison's Principles of Internal Medicine, 20e. , (2018).
- Bellani, G., et al. Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries. The Journal of the American Medical Association. 315 (8), 788-800 (2016).
- The ARDS Definition Task. Acute Respiratory Distress Syndrome: The Berlin DefinitionThe Berlin Definition of ARDS. The Journal of the American Medical Association. 307 (23), 2526-2533 (2012).
- Thompson, B. T., Chambers, R. C., Liu, K. D. Acute Respiratory Distress Syndrome. New England Journal of Medicine. 377 (6), 562-572 (2017).
- Krishnamoorthy, N., Levy, B. D., Walker, K. H., Abdulnour, R. -. E. E., Engstrom, B. D. Specialized Proresolving Mediators in Innate and Adaptive Immune Responses in Airway Diseases. Physiological Reviews. 98 (3), 1335-1370 (2018).
- Abdulnour, R. -. E. E., et al. Maresin 1 biosynthesis during platelet-neutrophil interactions is organ-protective. Proceedings of the National Academy of Sciences of the United States of America. 111 (46), 16526 (2014).
- Chen, H., et al. Pulmonary permeability assessed by fluorescent-labeled dextran instilled intranasally into mice with LPS-induced acute lung injury. PLoS ONE. 9 (7), (2014).
- Radu, M., Chernoff, J. An in vivo assay to test blood vessel permeability. Journal of Visualized Experiments. 73 (73), e50062 (2013).
- Eickmeier, O., et al. Aspirin-triggered resolvin D1 reduces mucosal inflammation and promotes resolution in a murine model of acute lung injury. Mucosal Immunology. 6 (2), 256-266 (2013).
- Abdulnour, R. -. E. E., et al. Phospholipase D isoforms differentially regulate leukocyte responses to acute lung injury. Journal of Leukocyte Biology. 103 (5), 919-932 (2018).
- Fukunaga, K., Kohli, P., Bonnans, C., Fredenburgh, L. E., Levy, B. D. Cyclooxygenase 2 Plays a Pivotal Role in the Resolution of Acute Lung Injury. Journal of Immunology. 174 (8), 5033 (2005).
- Colby, J. K., et al. Resolvin D3 and Aspirin-Triggered Resolvin D3 Are Protective for Injured Epithelia. American Journal of Pathology. 186 (7), 1801-1813 (2016).
- Bonnans, C., Fukunaga, K., Keledjian, R., Petasis, N. A., Levy, B. D. Regulation of phosphatidylinositol 3-kinase by polyisoprenyl phosphates in neutrophil-mediated tissue injury. The Journal of Experimental Medicine. 203 (4), 857-863 (2006).
- Mandell, L. A., Niederman, M. S. Aspiration Pneumonia. New England Journal of Medicine. 380 (7), 651-663 (2019).
- Seki, H., et al. The anti-inflammatory and proresolving mediator resolvin E1 protects mice from bacterial pneumonia and acute lung injury. Journal of Immunology. 184 (2), 836-843 (2010).
- Abdulnour, R. E., et al. Aspirin-triggered resolvin D1 is produced during self-resolving gram-negative bacterial pneumonia and regulates host immune responses for the resolution of lung inflammation. Mucosal Immunology. 9 (5), 1278-1287 (2016).
- Traber, K. E., et al. Myeloid-epithelial cross talk coordinates synthesis of the tissue-protective cytokine leukemia inhibitory factor during pneumonia. American journal of physiology. Lung Cellular and Molecular Physiology. 313 (3), L548-L558 (2017).
- Yamamoto, K., et al. Roles of lung epithelium in neutrophil recruitment during pneumococcal pneumonia. American Journal of Respiratory Cell and Molecular Biology. 50 (2), 253-262 (2014).
- Acute Respiratory Distress Syndrome Network. Ventilation with Lower Tidal Volumes as Compared with Traditional Tidal Volumes for Acute Lung Injury and the Acute Respiratory Distress Syndrome. New England Journal of Medicine. 342 (18), 1301-1308 (2000).
- Peng, X., et al. Inducible nitric oxide synthase contributes to ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 172 (4), 470-479 (2005).
- Abdulnour, R. -. E. E., et al. Mechanical stress activates xanthine oxidoreductase through MAP kinase-dependent pathways. American Journal of Physiology-Lung Cellular and Molecular Physiology. 291 (3), L345-L353 (2006).
- Serhan, C. N., Levy, B. D. Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. The Journal of Clinical Investigation. 128 (7), 2657-2669 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유