Method Article
一方的気管支内酸インスティレーションによる自己限定急性肺損傷のモデル
要約
マウスの左肺への選択的気管支内酸インスティレーションは、胃酸吸引によって誘発されるヒト急性呼吸窮迫症候群(ARDS)をモデル化する一方的で自己限定の急性肺損傷をもたらす。
要約
マウス左の主幹気管支への塩酸(HCl)の選択的気管内刺激は、ヒト急性呼吸窮迫症候群(ARDS)と同様の組織病理学的所見を伴う急性組織損傷を引き起こす。得られた肺胞浮腫、肺胞毛細血管障害、および白血病の浸潤は主に左肺に影響を与え、右肺を無傷のコントロールとして維持し、動物が生き残ることを可能にする。この自己限定急性肺損傷のモデルは、アポトーシス好中球のマクロファージエフェロサイトーシスおよび肺胞毛細血管の完全性の復帰などの組織分解機構の調査を可能にする。このモデルは、ARDS患者のための新しい治療アプローチの開発のための基盤を提供し、専門のプロ解決メディエーター(SPM)を含む解決アゴニストのための重要な役割を特定するのに役立ちました。
概要
急性呼吸窮迫症候群(ARDS)は、急性呼吸不全の重要な原因である1.これは、世界中の集中治療室に入院したすべての患者の10%で発生する一般的で致命的または無効な疾患です2.ベルリンの定義3によれば、ARDSは低酸素呼吸不全(<1週間)の急性発症および心不全によって説明されない胸部レントゲン写真上の両側肺浸潤によって定義される4。基礎となる病因は、過剰な炎症反応によって特徴付けられる。肺は、肺炎や胃酸吸引などで直接的に傷つくか、敗血症や複数の輸血後など間接的に傷つくことができる4。最初の侮辱に続いて、ARDSの病因は3つの段階で進行する:排他性、増殖性、および線維性相1。これらの段階は、ARDS患者の予後を決定する明確な分子および細胞免疫および修復機構によって特徴付けされる。サポートケアはARDS患者の主力であり続ける。現在、ARDSに対する有効な薬理学的治療法は存在しないため、この壊滅的な状態に関する新たな研究が急務となっています4.
排泄段階中の自然免疫応答の調節不全は、ARDSおよび関連する呼吸不全の急性発症に寄与する1.強力な炎症性メディエーターシグナル伝達は、初期免疫応答を調整し、肺胞毛細血管関門の破壊、拡散肺胞性歩腫、および肺組織損傷部位への好中球浸潤4につながる。ARDSでは、急性炎症に対する無効な制動信号が肺不全の素因となり、負傷した肺組織5のタイムリーな触媒を遅らせることができる。そのために、ARDSの内因性の発生およびプロイゾリューションメカニズムに関する前臨床調査は、新しい治療戦略を明らかにすることができる。このような研究は、ヒトARDSの特徴に密接に似ている急性肺損傷の生体内モデルにおける自己限定的な実験を必要とし、組織損傷の開始および解決段階の基礎となるメカニズムの尋問を可能にする。
ここで提示されるマウスモデルは、排他性ARDSの基体病原性生物学的プロセス、すなわち肺胞毛細血管障害および好中球浸潤を示す直接的な急性肺損傷を生み出す。この方法は、左の主幹気管支のカンノテーションを通じてHClの選択的気管支内インスレチレーションに依存し、左肺に対する傷害および炎症反応を局在させる。負傷していない右肺は、組織の損傷および炎症の選択決定のための内部制御として使用することができる。さらに、一方的な肺損傷は非致死であり、解決プログラムを発表する。これは、内因性のプロ溶解メディエーターと細胞機構の同定のために利用することができる肺炎症の解決への明確な窓を提供し、解像度生理学を強調するARDSのための新しい治療手段を開くために、薬理 学。
プロトコル
以下のすべての動物手順は、ブリガム・アンド・ウィメンズ病院の施設動物管理・使用委員会(議定書#2016N000356)によって審査され、承認されています。
注:無菌技術は、すべての生存手順に従った。無菌のドレープタオルを使用して手術ごとに滅菌場が設けられており、外科医は無菌の外科手袋、帽子、マスク、清潔なラボコートを着用していました。すべての手術器具はオートクレーブを使用して殺菌され、殺菌性はビーズ殺菌器を使用して維持された。
1. 0.1 N HClの調製
- オレンジ色のガラス瓶にddH2Oの11 mLを追加します。ゆっくりと37%HCl(12 N)の1 mLを加え、1 N HCl作動ストックを作成します。
注意:HCl が水に加えられたことを確認します。酸に直接水を加えると酸が沸騰し、ボトルから飛び出す可能性があるため、これは安全上の懸念事項です。濃縮されたHClを取り扱う場合は、酸が通気された化学フードに保管され、ラボコート、手袋、安全メガネなど、適切な個人用保護具が着用されていることを確認してください。 - 50 mL円錐管に、以前に希釈したHCl作業ストックの4mLを50mL円錐管に35mLにゆっくりと加え、0.1 N HCl実験ストックを作成します。
- 低pH溶液を用いて2点較正後の電子pHプローブを用いて実験ストックのpHを測定する。NaOHまたはHClストックソリューションを必要に応じてpH 1.1にtitrateし、最終容積が40mLであることを決定します。
注:低pH値の測定は困難な場合があります。正確な測定を確実に行うには、pHプローブが低いpH規格を使用して適切に校正され、測定の過剰な外挿を避けるようにしてください。 - 実験の直前に、0.22 μmの無菌フィルターを介して実験HClストックの1-2 mLを無菌マイクロ遠心管に濾過する。
2. HClの選択的気管支内刺激
-
外科区域の準備
- 経皮注射によりケタミン(100mg/kg)とキシラジン(10mg/kg)の混合物を送達することにより全身麻酔を誘導する。尾または後ろ足の先端をそっと絞って、マウスが完全に麻酔されていることを確認します。皮膚切開を行う前に撤退応答の欠如が必要です。 必要に応じて、追加の麻酔ボルスを管理します。
- 首の擦り傷の下に皮下にブプレノルフィンの0.1 mg/kgを提供します。術前鎮痛薬は麻酔の効果を強化し、手術前および術後の痛みを改善する。
- 電気バリカンを使用して、ゆっくりと下向きのストロークを使用して、マウスの腹部の外科的領域を、喉の頸部領域の顎の下に穏やかに剃ります。ゆるい毛皮を取り除き、下の皮膚を完全に露出させます。
- 10%ポビドネヨウ素溶液で剃った部位を洗い流すことによって外科区域を準備する。無菌溶液を塗布した後、70%イソプロピルアルコール綿棒を使用して部位をきれいにします。この手順を 3 回繰り返します。
-
気管の分離
- きれいな外科板の上の上の上の上の上の上の上の上の上の上の上のマウスを置き、外科区域の露出を維持している間無菌の外科ドレープでマウスをカバーする。ドレープを所定の位置に固定します。
- 気管および唾液腺の上の皮膚に0.5cm縦断切開を行う。わずかに湾曲した鋸歯状の鉗子を使用して、慎重に皮膚を引き戻し、唾液腺を穏やかに分離して気管の筋肉を露出させます。
- 鈍い解剖のための鋸歯状の鉗子を使用して、線維の筋肉をそっと押し離し、気管の軟骨環が完全に露出するまで気管を取り囲んでいる筋膜をからかう。
- 十分に湾曲した鋸歯状の鉗子を使用して気管を持ち上げ、レトロ気管とレトロ筋膜の間の結合組織を分離する。結合組織が剥離されると、鉗子の先端が気管の後ろに完全にスライドする必要があります。
- 気管の後ろに湾曲した鉗子を維持し、鉗子の先端と4-0編組シルク縫合の10-15センチメートルの部分をつかみます。両側に均一な長さがあるように気管の後ろに縫合糸を引っ張ります。
- 縫合糸が所定の位置に置いたら、縫合糸の側面をマウスの後部に向かってそっと引っ張り、両側を所定の位置に保持します。
-
左の主幹気管支を選択的に取り込み、HClを浸透させる
- 24 G x 3/4" アンジオカテターを取り、針を挿入し、最初と2番目の気管リングの間の気管の前部領域に、斜め上に挿入します。気管内腔の針先端の直接可視化によって適切な挿入が確認されたら、縫合糸を離し、抵抗が達するまで針と気管の上にカニューレを進め、その後針を引き出す。左肺への選択的な注入のための左の主要な茎の気管支に向かって挿入の方向を角度。
- カニューレが所定の位置に置いたら、カテーテルがシフトするのを防ぐために注入口をしっかりとつかむ。
- P200ピペットと無菌P200ピペットチップを使用して、2.5 mL/kg(20gマウスの場合は50μL)の無菌濾過0.1 N HClをカテーテルに注入し、その後同じ量の空気を注入します。
- 急速にカテーテルを引き出し、外科板を30sのための60°の角度に持ち上げる。
-
外科区域を閉じる
- 外科ボードを平らに置き、気管の後ろから縫合糸を取り除きます。
- 4-0ワックスコーティング編みシルク縫合糸を使用して、2-3ステッチを使用して皮膚切開を閉じます。
3. 術後ケア
- 切開が閉じたら、マウスが麻酔から回復するまで、暖かい加熱パッドの左側にマウスを置きます。通常のハウジングに戻す前に、痛みと活動レベルのマウスの監視を開始します。
注:ブプレノルフィンは、最初の24時間の6-12時間ごとに皮下に0.1 mg/kgで投与されるべきである。持続的な画期的な痛みが存在する場合は、痛みが治まるまで鎮痛療法を延長する。
4. 全肺気管支藻胞洗浄(BAL)および白血球免疫フェノタイピング
-
ステップ2.1.1で使用されるケタミン/キシラジンの用量の3倍を投与することにより、マウスを安楽死させる。
- 間質性および血管内好中球を区別するために、安楽死の5分前に選択された蛍光素標識Ly6G抗体を静脈内注射する。この標識は、異なる蛍光色素を用いた組織調製中に標識される肺間質および肺胞好中球と血管内好中球を区別するために、フローサイトメトリーによる検出に適している必要があります(下記参照)。
- 外科ボードの上にマウスを置き、2-0編組シルク縫合糸のループの周りに前部切開部をフックします。
- 手順 2.2.2 ~ 2.2.6 に従います。気管をカナンテーションの準備にする。
注:横隔膜が肺洗浄中にトランス肺胞膨張圧力を最大化するために穿刺されていないことを確認してください。左肺のコンプライアンスは、肺洗浄のためのより高い肺胞圧要件を必要とする可能性がある傷害の後に減少します。 - ステップ2.3.1に続いて気管をカニューレしますが、カリーナの下のカテーテルを進めないようにしてください。気管に平行にカテーテルを挿入します。
- カテーテルを挿入した後、気管の周りに縫合糸を結び、カテーテルを所定の位置に保持します。
- 1 cc シリンジを使用して 0.6 mM EDTA で氷冷 PBS -/-(マグネシウムまたはカルシウムを含まない)の 2 つの連続した 1 mL アリコートを注入し、撤回します。フローサイトメトリーによる免疫フェノタイピングの場合は、各アリコートを取り出し、氷上の5mLポリスチレンFACSチューブに戻ります。
- 安楽死を確実にするために、外科的はさみを用いて胸部切開を行い、その後心臓穿刺を行う。肺は、さらなる処理のために収穫されてもよい。
- BALを4°Cで800gで10分間遠心分離し、細胞をペレットする。
- 上清を2mLマイクロ遠心管とアリコートに1.5mLマイクロ遠心管にデカントします。後続の分析のために-80 °Cで保存します。
- フローサイトメトリーによる白血病分性分析のための2%FBSでPBS-/-で細胞ペレットを再中断する。
- 間質性および血管内好中球を区別するには、左右の肺を別々に取り除き、Abdulnour et al. 20146.
- 選択したFACS抗体を用いて得られた細胞懸濁液を染色し、ステップ4.1.1からLy6G抗体とは異なる蛍動体と共役であるLy6Gに対して染色することを確認する。
5. エヴァンの青色染料(EBD)を用いた肺胞バリア透過性の評価
- 安楽死の30分前にエヴァンの青い染料(40mg/kg)を静脈内注射する。
- ケタミン/キシラジン過剰摂取を用いてマウスを安楽死させる(ステップ4.1)。
- 肺胞バリアの完全性を測定するには、BAL コレクションの手順 4.2 ~ 4.9 に従ってください。
- BALFの100 μLを明確な底96ウェルマイクロプレートに、100 μLの重複EBD規格を転送します。PBS -/- をブランクとして使用します。
- マイクロプレートリーダーを使用して、620 nmおよび740 nmでBALFの吸光度を測定します。740 nmの吸光度を使用して、サンプル7のヘム汚染を補正します。
- 血管バリアの完全性を測定するには、心臓の右心室を通して5 mLの氷冷PBSをゆっくりと注入することによって肺を透過させる。左肺を取り除く。
- 余分な水を取り除くために、58 °Cで72時間左肺を乾燥させます。
- ラドゥとチェルノフ20138のように乾燥した肺組織を処理し、620 nmおよび740 nmで吸光度を測定する。
6. 肺の生物学
- 手順 4.1 ~ 4.5 に従って気管をカニューレします。
- 20 cm H2O で肺を固定する圧力を使用して、リングスタンドとクランプを使用して、バルブ制御チューブを装着し、固定液の半月膜が20cm上に肺。
- チューブをカテーテルに取り付け、値を開きます。肺が膨張しなくなるまで、ゆっくりと肺を固定剤で満たします。
- 気管から抜け出す方法のカテーテル3/4を取り外します。カテーテルを完全に取り外す前に縫合糸で気管を結び、固定の損失を最小限に抑える。
- 肺と心臓を取り除きます。
注:肺が除去中に穿刺されていないことを確認し、圧力注入固定剤を保持します。 - 室温で固定の25 mLで24時間の肺を固定します。
- PBS-/-、30%エタノール、50%エタノールで20分間隔で固定肺を洗浄します。
- 最後の洗浄の後、Eickmeier et al. 20139のように組織学処理のために70%エタノールで肺を保存します。
結果
選択的気管支内HCl刺激は一方的な急性肺損傷をもたらす
左の主幹気管支にHClの選択的気管支内注入の方法を図1Aに示す。その結果、急性肺損傷は左肺全体を伴い、EBDおよび肺灌流の静脈内投与後、EBDは左肺にのみ残った(図1B)。左肺へのEBD浸出を定量し、シャム選択的注入に対して有意に増加することが判明した(図1C;Abdulnouret al. 20146)。肺損傷に応じて、循環性白血病は炎症を起こした組織にダイアペデスする。このモデルでは、血管好中球は、損傷した肺間質に内皮移植を受ける。HClインスティテーション後に左肺に24時間蓄積した間質好中球は、間質好中球が少ない右肺とは対照的に(図1D)。これらの結果は、選択的な左心幹体気管支内インプリンチ法が、左肺に主に局在するマウス急性肺損傷をもたらし、ヒトARDSでも見られる病理学的変化を生じさせたことを示している。肺胞毛細血管の障壁違反および好中球浸潤。
一方的な急性肺損傷により、解決機構の調査が可能
酸誘発性急性肺損傷マウスの分解能段階を研究するには、最初の侮辱を生き残ることができる必要があります。気管内HClとは異なり、左の主幹気管支のみに注入すると、それ以外の場合は健康なマウスで均一な生存を伴う自己限定的な傷害につながる。肺は、図2Aのように早期または後の時点でマウスから得ることができる。肺組織学は、左肺の顕著な肺胞性歩腫および好中球浸潤を特徴とする損傷後24時間の排他炎症を伴う器官および細胞レベルでの組織損傷および炎症を示す。なお、無傷の制御右肺への顕著な外傷または白血病の流入はない(図2A)。傷害後72時間、上腫および細胞浸潤は実質的に減少し、溶解性発泡期を表す。肺胞好中球は、全肺洗浄によって得られたフローサイトメトリー(CD45+/CD68-/F4/80-/Ly6G+/CD11b+)によって監視することができる。好中球は最初の損傷に続いて左肺で24時間増加し、48および72h(図2B)で実質的に減少する。後で時間的な点を調べれば、好中球数はベースラインに戻り、線維増殖性応答などのカタベーシスの後の段階でメカニズムを調べることができます。
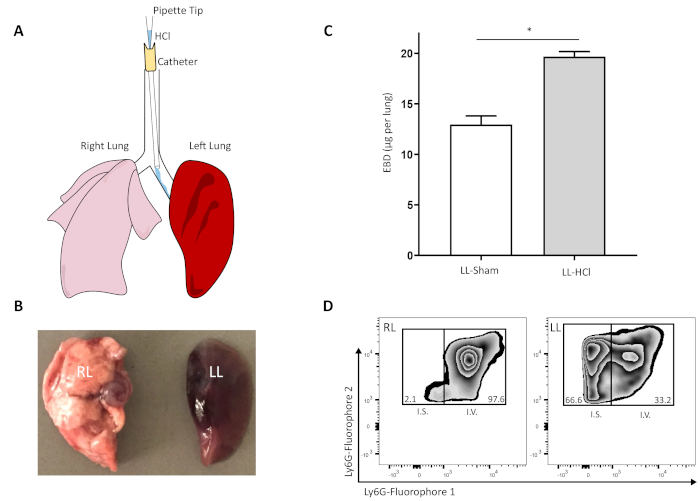
図1:選択的気管支内HCl点入りは、肺胞バリア違反および好中球浸潤によって定義される一方的な肺損傷を生む。(A) 左肺へのHClの選択的注入のためのマウス左の主幹茎気管支のカンヌレーションの表現。(B)選択的酸注入に曝露された右(RL)および左(LL)肺を切除し、静脈内エヴァンの青色染料に続いて浸透した。(C) 酸損傷またはシャムコントロール後に均質化され、肺を24時間浸透した間質性エヴァンの青色染料の定量化;図はアブドゥルヌールら 20146.値は平均 ± SEM を表し、n ≥ 5 を表します。*p< 0.05, マンホイットニーU試験(D)血管内(I.V.;蛍光素1)および間質(I.S.;蛍光素2)の代表的な流れ細胞メトリーは、酸損傷後に処理された肺の全CD45+細胞の割合として。この図のより大きなバージョンを表示するには、ここをクリックしてください。
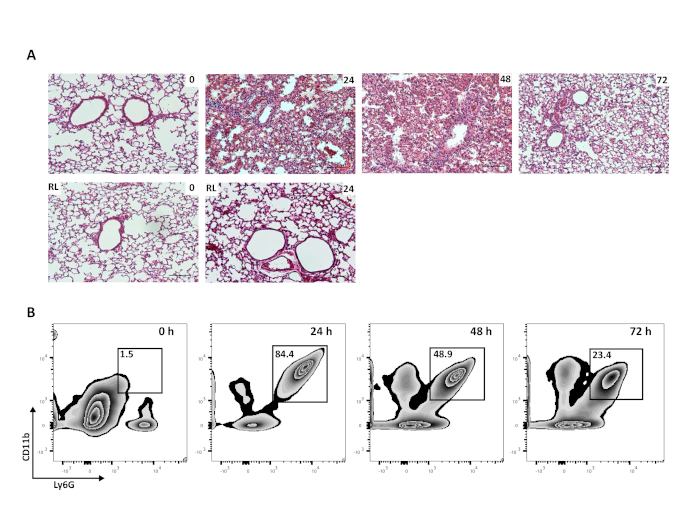
図2:一方的な急性肺損傷は自己解決である。(A) ナイーブマウス(0h)またはマウス24、48、72hから得られた左肺の代表的なH&Eヒスロジー(10倍)と、同じマウスからの関連する右肺(スケールバー=250μm)。(B)肺胞好中球の代表的な流れサイトメトリー(Ly6G+CD11b+)は、酸損傷後のナイーブ(0h)マウスまたはマウスにおける全CD45+細胞の割合として全肺洗浄から得られる。 この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで説明する気管支内注入法は、左心幹線管支の選択的なカヌエンテーションを使用して左肺にHClを注入し、一方的で自己限定のマウス急性肺損傷をもたらす。このマウス酸肺損傷モデルは、胃酸吸引が一般的な沈殿物または寄与因子4であるヒトARDSに見られる炎症反応、ヒスト病理学、および生理学的機能不全を密接に表す。低pH HClへのマウス気道の曝露は、肺胞毛細血管関門、肺胞性耳腫、および損傷部位における深部好中球浸潤の透過性の増加をもたらす。これらの事象は、負傷していない右肺では観察されない。さらに、このモデルは、酸インチレーション後24時間以内にピークを迎える急速な炎症応答を生成し、ホスホリパーゼDアイソフォーム10の差動発現などのヒトARDSと遺伝子発現の変化を共有する。
このマウス前臨床モデルは、分子レベル、細胞レベル、および組織レベルでARDSの特徴の多くを再現しますが、ヒトARDSを完全に要約するものではありません。ARDSの定義は、両側肺関与3を含み、ここで説明するインスティレーション方法は、一方的な肺疾患における設計によって生じます。さらに、動物は連続的な機械的換気、不動性、または非経口の静止を必要としない。ここで提示された結果(vide supra)および他の場所6、9、11、12、13は、一方的な酸誘発性肺損傷が病理学的特徴のほとんどを再現することを示すARDSは、右肺を内部制御として使用し、この疾患の解決段階を研究するユニークな機会を提供しながら。したがって、ここで議論されるモデルはARDS病因生物学をモデル化するだけでなく、この重要な疾患に対処するために関連する可能性のある傷害および解決機構に対する基本的な肺組織応答の機械的調査を可能にする。
HClの点所は直接急性肺損傷を表すので、吸引性肺炎に関連する病態生理学の態様をモデル化している。さらに、このモデルにおける最初の左肺侮辱は、肺炎を引き起こす可能性のあるいくつかのヒト吸引イベントで見られる細菌を含む胃内容物ではなく無菌HClを用いて生成される。ヒトにおいて、病原性細菌の吸引は、急性炎症反応を悪化させる二次細菌性肺炎をもたらし、初期肺損傷を延長し、ARDS14を発症する患者の感受性を高める。この潜在的な制限は、滅菌HClの後に病原性細菌エシェリヒア大腸菌(大腸菌)15を意図的に注入する研究者によって対処され、さらに、この方法は、病原体媒介性を調べるために使用されている。炎症;一方的な細菌性肺炎は、大腸菌16、17、シュードモナス・エルギノーサ16、連鎖球菌肺炎18などの細菌の選択的左肺刺激によって誘発されうる。.ここで説明する自己限定急性肺損傷モデルは、人工呼吸器誘発性肺損傷(VILI)を研究するためにも使用され、ヒトARDS19における死亡率の増加の重要な原因である。VILIの実験動物モデルは、通常、肺損傷を引き起こすのに臨床的に使用されるものよりもはるかに高い潮量を有するナイーブマウスの機械的換気を伴う(>15 mL/kg;前の研究20、21を参照)。VILIのより臨床的に関連するモデルに向かって、ここで説明する気管支内酸インスティレーションは、臨床範囲内(6-12 mL/kg)内の潮量での機械的換気に続いて非致死性肺損傷を誘発するために最初に使用されてもよい。この架空の動物モデルは、研究者が一度開発され、検証された臨床的に関連する方法でVILIを研究することを可能にするかもしれません。これらのマウスモデルは、ヒト肺疾患に関連する病理に密接に似た一方的な肺侮辱を生成する選択的気管支内刺激法の汎用性を強調する。
左肺に様々な有害な薬剤の選択的な浸透を可能にすることに加えて、気管支切開術後の気管支内刺激の技術は、延長された訓練、長いプロシージャ時間、または複雑な装置、および経験豊富な手で必要としない動物に最小限の苦痛を引き起こす。それにもかかわらず、実験結果に影響を与える可能性のある選択的HCl点留手順中にいくつかの問題が発生する可能性があります。左主幹気管支の不適切なカナンテーションは、実験マウスの生存を減少させ、損傷を受けていない内部制御として右肺の使用を混乱させる両側肺損傷をもたらす可能性があります。これは抵抗が抵抗に達するまでカテーテルを左肺に十分に釣ることによって避けることができる。HClの注入後、空気のボーラスを注入する必要があり、カテーテルは急速に取り外され、外科板は60°の角度に直立させた。これらのステップは、酸が左肺の遠位気道に到達し、近位損傷を引き起こす可能性のある右肺および気管への酸の逆流を防ぐために重要である。注入後24時間以内に、左肺の損傷は広範な肺水腫と拡散し、遠位および近位左肺の両方に影響を与える。
成人8-12週齢マウスの方法開発中、気管支内HClの2.5 mL/kgは実質的でありながら致命的な急性肺損傷を生じさせた。HClの低用量は、再現性と均質な肺損傷をもたらさなかった。我々は若い(例えば、3-6週齢)または古いマウス(例えば、10〜14ヶ月齢)でこのモデルを行っていないが、HClの体重ベースの投げ込みは、8-12週齢のマウスに記載されているものと同様の肺損傷表現型をもたらすと予想される。極端な体重でマウスを用いる実験を行う前に、研究者がHCl用量をtitレートして、肺損傷の所望の程度を達成することをお勧めします。
この選択的な酸の浸透のプロシージャは機械換気のような支持的な心配の必要性を減らす無菌組織の炎症の非致死的なマウスモデルを提供する。負傷したマウスの生存期間が延長された場合、酸誘発性炎症は自己解決に十分な時間を持つ。このモデルの分解能段階は、一時的に調節された生理活性脂質メディエーター、リポキシンA4(LXA4)、マレシン1(MaR1)、およびレゾルビン6などの特殊なプロ溶解メディエーター(SPM)と呼ばれる特定するために使用されてきた。 、11、12、16.傷ついたマウスに外因性SPMを投与すると、炎症機構を弱め、傷ついた肺組織の触媒を促進することにより、酸誘発性肺損傷の分解能を速める。これらのSPMは、肺胞浮腫12のクリアランスを促進し、募集マクロファージ16によるアポトーシス好中球のエフェロサイトーシスを増加させ、血管を減少させるために気道および肺胞12の再上皮化を加速する漏出および組織低酸素症。病原体誘発性肺損傷のモデルでは、15-エピ-レゾルビンD1はまた、マクロファージによる細菌性食細胞症の増加および感染した肺16からの増強された細菌クリアランスを介して抗菌作用を示した。これらの内因性分解能メカニズムを調査すると、ARDS5患者に対する潜在的な新規治療戦略に関する洞察が提供されます。
分解能機構の時空間調節を最もよく研究するためには、生体内実験モデルが必要である。急性肺損傷モデルは、分子および細胞プロセスを促進する宿主分解能の関与と関連する急性炎症反応および器官機能不全を含まなければならない。これらのメカニズムは、確立された解像度指数22を使用して定量化することができます。一方的な急性肺損傷を生成する選択的気管支内点留り法は、内因性分解能メディエーターおよび経路のプローブに関して有用であることが証明されている。これらの活性分解能プロセスの理解を深める将来の研究は、炎症の分解能を高め、罹患率を緩和するために内因性脂質メディエーターの生体作用を模倣する治療用アゴニストにつながるという約束を持っている。ARDSおよび他の重要な肺疾患の死亡率。
開示事項
著者は何も開示していない。
謝辞
著者らは、ジョセフ・ミズゲルド博士が選択的気管支内方法の開発に貢献し、彼の有用なコメントと原稿のレビューに感謝したいと思います。この研究は、国立衛生研究所の助成金P01GM095467(B.D.L.)とK08HL130540(R.E.A.)によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| 10x Zinc Fixative | BD Biosciences | 552658 | |
| 2-0 Braided Silk Suture | Surgical Specialties | SP118 | |
| 24 G x 3/4" Disposable Safelet I.V. Catheter | Excel | 26751 | |
| 33 mm, 0.22 µm syringe filter unit | Millipore-Sigma | SLGP033RS | |
| 4" Long Serrated Slight Curve Graefe Forceps | Roboz | RS-5135 | |
| 4" Long Tip Serrated Full Curve Graefe Forceps | Roboz | RS-5137 | |
| 4.5 " Micro Dissecting Scissors | Roboz | RS-5912 | |
| 6" Crile Wood Needle Holder | Roboz | RS-7860 | |
| 60 mL syringe | BD Biosciences | 309653 | |
| Anti-mouse FITC-Ly6G antibody | Thermo Fisher Scientific | 11-9668-82 | Preferred fluorophore can be used |
| Anti-mouse PE-Ly6G antibody | Thermo Fisher Scientific | 12-9668-82 | Preferred fluorophore can be used |
| Bead sterilizer | |||
| Betadine Solution Swabstick | Betadine | 67618-153-01 | |
| Buprenex | Reckitt Benckiser | NDC: 12496-0757-1, 12496-0757-5 | |
| Clear flat-bottomed 96-well microplate | Thermo Fisher Scientific | 12565501 | |
| Dulbeccos's Phosphate Buffered Saline (PBS) without Ca2+ or Mg+ | life technologies | 14190-144 | |
| Electric clippers | |||
| Ethylenediaminetetraacetic acid (EDTA) | Millipore-Sigma | E6758 | |
| Evans Blue Dye | Millipore-Sigma | E-2129 | |
| Heating pad | |||
| Hydrochloric acid, 37% | Millipore-Sigma | 258148 | |
| Ketamine | Henry-Schein | 56344 | |
| Microplate reader (640, 720 nm) | |||
| P200 Pipette | |||
| P200 Pipette Tips | |||
| pH probe | |||
| Ring stand with extension clamp | |||
| Sterile Alcohol Prep Pads | Thermo Fisher Scientific | 22-363-750 | |
| Sterile Mouse Drape 8" x 8" with Oval Adhesive Fenestration | Steris | 88VCSTF | |
| Sterile Nitrile Gloves | Kimberly-Clark | 56890 | |
| Sterile Towl Drape | Dynarex | 4410 | |
| Wax Coated 4-0 Braided Silk Suture | Covidien | SS733 | |
| Xylazine | AKORN | NDC: 59399-111-50 |
参考文献
- Baron, R. M., Levy, B. D., Jameson, J. L., et al. Acute Respiratory Distress Syndrome. Harrison's Principles of Internal Medicine, 20e. , (2018).
- Bellani, G., et al. Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries. The Journal of the American Medical Association. 315 (8), 788-800 (2016).
- The ARDS Definition Task. Acute Respiratory Distress Syndrome: The Berlin DefinitionThe Berlin Definition of ARDS. The Journal of the American Medical Association. 307 (23), 2526-2533 (2012).
- Thompson, B. T., Chambers, R. C., Liu, K. D. Acute Respiratory Distress Syndrome. New England Journal of Medicine. 377 (6), 562-572 (2017).
- Krishnamoorthy, N., Levy, B. D., Walker, K. H., Abdulnour, R. -. E. E., Engstrom, B. D. Specialized Proresolving Mediators in Innate and Adaptive Immune Responses in Airway Diseases. Physiological Reviews. 98 (3), 1335-1370 (2018).
- Abdulnour, R. -. E. E., et al. Maresin 1 biosynthesis during platelet-neutrophil interactions is organ-protective. Proceedings of the National Academy of Sciences of the United States of America. 111 (46), 16526 (2014).
- Chen, H., et al. Pulmonary permeability assessed by fluorescent-labeled dextran instilled intranasally into mice with LPS-induced acute lung injury. PLoS ONE. 9 (7), (2014).
- Radu, M., Chernoff, J. An in vivo assay to test blood vessel permeability. Journal of Visualized Experiments. 73 (73), e50062 (2013).
- Eickmeier, O., et al. Aspirin-triggered resolvin D1 reduces mucosal inflammation and promotes resolution in a murine model of acute lung injury. Mucosal Immunology. 6 (2), 256-266 (2013).
- Abdulnour, R. -. E. E., et al. Phospholipase D isoforms differentially regulate leukocyte responses to acute lung injury. Journal of Leukocyte Biology. 103 (5), 919-932 (2018).
- Fukunaga, K., Kohli, P., Bonnans, C., Fredenburgh, L. E., Levy, B. D. Cyclooxygenase 2 Plays a Pivotal Role in the Resolution of Acute Lung Injury. Journal of Immunology. 174 (8), 5033 (2005).
- Colby, J. K., et al. Resolvin D3 and Aspirin-Triggered Resolvin D3 Are Protective for Injured Epithelia. American Journal of Pathology. 186 (7), 1801-1813 (2016).
- Bonnans, C., Fukunaga, K., Keledjian, R., Petasis, N. A., Levy, B. D. Regulation of phosphatidylinositol 3-kinase by polyisoprenyl phosphates in neutrophil-mediated tissue injury. The Journal of Experimental Medicine. 203 (4), 857-863 (2006).
- Mandell, L. A., Niederman, M. S. Aspiration Pneumonia. New England Journal of Medicine. 380 (7), 651-663 (2019).
- Seki, H., et al. The anti-inflammatory and proresolving mediator resolvin E1 protects mice from bacterial pneumonia and acute lung injury. Journal of Immunology. 184 (2), 836-843 (2010).
- Abdulnour, R. E., et al. Aspirin-triggered resolvin D1 is produced during self-resolving gram-negative bacterial pneumonia and regulates host immune responses for the resolution of lung inflammation. Mucosal Immunology. 9 (5), 1278-1287 (2016).
- Traber, K. E., et al. Myeloid-epithelial cross talk coordinates synthesis of the tissue-protective cytokine leukemia inhibitory factor during pneumonia. American journal of physiology. Lung Cellular and Molecular Physiology. 313 (3), L548-L558 (2017).
- Yamamoto, K., et al. Roles of lung epithelium in neutrophil recruitment during pneumococcal pneumonia. American Journal of Respiratory Cell and Molecular Biology. 50 (2), 253-262 (2014).
- Acute Respiratory Distress Syndrome Network. Ventilation with Lower Tidal Volumes as Compared with Traditional Tidal Volumes for Acute Lung Injury and the Acute Respiratory Distress Syndrome. New England Journal of Medicine. 342 (18), 1301-1308 (2000).
- Peng, X., et al. Inducible nitric oxide synthase contributes to ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 172 (4), 470-479 (2005).
- Abdulnour, R. -. E. E., et al. Mechanical stress activates xanthine oxidoreductase through MAP kinase-dependent pathways. American Journal of Physiology-Lung Cellular and Molecular Physiology. 291 (3), L345-L353 (2006).
- Serhan, C. N., Levy, B. D. Resolvins in inflammation: emergence of the pro-resolving superfamily of mediators. The Journal of Clinical Investigation. 128 (7), 2657-2669 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved