Method Article
쥐 두뇌에 있는 Microinjections에 대 한 개인화 된 바늘
* 이 저자들은 동등하게 기여했습니다
요약
우리는 여기 석 바늘을 사용 하 여 쥐 두뇌에 있는 microinjection에 대 한 프로토콜을 설명 합니다. 이 바늘 하지 감지 조직 손상을 생산 하 고 깊은 지역에도 안정적인 전달. 또한, 그들은 맞춤된 설계에 의해 연구의 필요에 적응 시킬 수 있다 하 고 다시 사용 될 수 있습니다.
초록
Microinjections 약물 또는 특정 뇌 영역 내에서 독 소의 배달에 대 한 오랜 시간 동안 사용 되었습니다 그리고 더 최근에, 그들은 유전자 또는 세포 치료 제품에 사용 되었습니다. 불행히도, 현재 microinjection 기술 사용 여러 이유로 차선은 강철 또는 유리 바늘: 특히, 철강 바늘 조직 손상이 발생할 수 있습니다 및 대상 지역 누락, 두뇌에 깊이 인하 유리 바늘 구 부 수 있습니다. 이 문서에서는, 우리가 준비 하 고 유용한 기능의 번호를 결합 하는 석 영 바늘을 사용 하 여 프로토콜을 설명 합니다. 이러한 바늘 감지 조직 손상 생성 하지 않는다 그리고, 깊은 좌표를 사용 하는 경우에 원하는 뇌 영역에서 신뢰할 수 있는 전달 되도록 매우 엄격한 되 고. 또한, 원하는 직경의 여러 구멍을 만들어서 바늘의 디자인 맞춤 가능 하다. 여러 구멍 큰 구멍 세포의 주입을 용이 하 게 하는 반면 더 큰 영역 내에서 솔루션의 대용량의 주입을 촉진 한다. 또한, 이러한 석 영 바늘 청소 하 고 절차 비용 효과적 되는 다시 사용 될 수 있습니다.
서문
Microinjections는 특정 뇌 영역에 신경 활동을 조절 하 약리학 활성 화합물의 배달에 대 한 오랜 동안 사용 되어 왔습니다. 그들은 또한, 신경 이벤트 특정 질병, 예를 들면 6-hydroxy-도파민 nigrostriatal 도파민 시스템을 모방 하는 파 킨 슨 병에서의 특성을 모방 하기 위해 특정 신경 인구 근처 독 소를 주입 하 사용 되었습니다. 1 , 2 또는 병 해 시스템3변 하 immunotoxin 192 IgG saporin. 더 최근에, microinjection 절차 실험적인 뇌 장애4,5의 유전자 또는 세포 치료에 대 한 바이러스 성 벡터 또는 세포 이식 제공 하 사용 되었습니다.
이러한 연구에 사용 하는 바늘의 고전적인 유형의 스테인레스 스틸로 이루어집니다. 비록 간단 하 고 실용적인 사용을, 강철 바늘 문제6의 번호가: 그들은 비교적 큰 하 고 손상을 줄 수 있습니다 조직의 혈액-뇌 장벽의 누설 및 이다;의 활성화 또한, 그들은 심지어 완전히 원하는 솔루션의 흐름을 피 하거나 장애물을 만드는 바늘에 되 면 뇌 조직의 유선을 생산할 수 있습니다. 더 최근에, 유리 바늘 준비 임시 모세 혈관에서에 도입 되었습니다7,8을 사용. 이러한 중요 한 조직 손상도 사이토 활성화를 발생 하지 않습니다 하지만 상대적으로 유연 하 고 깊은 구조, 지역화 (개인적인 관측)의 정확도 감소에서 소개 될 때 구 부 수 있습니다.
따라서 만큼 손상 (특히 손상을 치료 하는 실험을 수행할) 때 정확성과 재현성을 증가 하면서 줄일 필요가 있다 (즉, 모든 솔루션 전달 하 고 올바른 지역화를 확인). 또한, 다양 한 형상의 뇌 영역에 주입 된 솔루션의 최적의 배포를 보장 하기 위해 다른 바늘 디자인을 사용 하는 것이 좋습니다 것입니다. 이 문서에서는, 우리는 준비 하 고 설치류 두뇌에 있는 microinjections에 대 한 석 영 바늘을 사용 하는 프로토콜을 설명 합니다. 높은 융해 점 때문에 석 영 모 세관 기존의 끌어당기는 사람에 뽑아 수 없습니다와 따라서 사용 되지 않은 과거에 바늘을 생성 하. 그러나 석 영,, 유리, 특히 높은 강성 및 브레이크 저항9몇 가지 중요 한 이점을 제공합니다. 그들의 강성 때문에 석 영 바늘은 이상적으로 복 부 뇌 영역으로 주사에 적합 합니다. 파손을 그들의 높은 저항 때문에 그들은 여러 구멍, 복잡 한 형상의10뇌 영역을 대상으로 하는 경우에 가장 효과적인 증명할 수 있습니다. 있는 디자인을 얻기를 포함 하도록 모델링할 수 있습니다.
프로토콜
모든 실험 프로토콜은 동물 실험에 대 한 페라라 대학 윤리 위원회 및 건강의 이탈리아 정부에 의해 승인 되었다. 도착 (동물 연구: Vivo 실험에서 보고11) 지침에 따라 되었습니다.
1입니다. 석 영 바늘의 준비
- 깨끗 하 고 증류수에 5 분, 에탄올 99%, 5 분 및 5 분 diethyl-에테르에서 그들을 배치 하 여 석 영 모 세관 ( 재료의 표참조)을 소독.
- 그들이 말리 면 완전히에 적어도 1 시간에 대 한 후드 아래 모세 혈관을 남겨 주세요.
- 개인의 요구에 따라 충분히, 충분히 얇은 바늘의 생산을 허용 하는 매개 변수에 따라 레이저 끌어당기는 사람을 사용 하 여 바늘을 준비 합니다.
참고: 우리가 사용 하는 레이저 끌어당기는 사람 ( 재료의 표참조). 당기기를 위한 두 줄 프로그램을 사용 합니다. 첫 번째 줄 (값에 해당 하 필 라 멘 트) 최대 스캔 길이 높은 전력과 아무 당기는 힘을 사용 합니다. 매개 변수이 조합의 내부/외부 대형으로 긴 바늘의 형성을 허용 가장 낮은 확장 속도와 모 세관의 큰 부분을의 용 해를 리드 하 고 정강이 감소. 이 방법에서는, 바늘 높은 기계적인 저항 및 막힘 없이 줄기 세포 또는 바이러스 성 입자의 통과 허용 하는 넓은 내부 직경을 유지 합니다. 팁 너무 작고 긴, 필요한 기계 및 모양 특성 누락 되기 전에 속도 및 지연이 프로그램 라인의 모 세관 확장을 중지 해야 합니다. 일단 석 영 식 당기 프로그램의 두 번째 줄 자동으로 실행 됩니다 (5 s). 전원, 필 라 멘 트 및 당기는 힘의 매개 변수는 가장 짧은 가능한 팁 길이와 두 바늘 팁 파열으로의 분리를 피하고 가파른 칼 팁을 잘라 작동. 정기적으로, 우리의 장비와 우리가 사용 하 여 다음과 같은: 1 (a) = 전력 990, 필 라 멘 트 5, 속도 130, 지연 110, 풀 0; (b) 선 2 전원 970, 필 라 멘 트 3, 속도 0, 70, 지연 = 0를 당겨. - 이전에 70% 에탄올으로 청소 페 트리 접시에 바늘을 넣어.
- 커버 플라스틱 파라핀 영화와 요리.
- 마이크로-것에는 모세 혈관을 잘라.
- 시작, 레이저 파워를 확인 하는 autocalibration 프로세스 실행 및 에너지 전달 하자. 절삭 매개 변수를 설정 합니다.
참고: 우리가 사용 하는 마이크로 것 ( 재료의 표참조) 및 다음 매개 변수: 레이저 펄스 에너지 (63 µJ), 최대 조리개의 20%의 레이저 빔 직경 (최대 조리개: 1.0 µ m), 및 최대 속도 (최대 10%의 절삭 속도 속도: 30 µ m/s). - 단단히 현미경 테이블에 바늘을 해결 하 고 컴퓨터 스크린의 센터에서 그것의 팁의 위치.
- 메뉴 모음에서 연필 아이콘을 클릭 하 고 바늘의 레이저 절단에 대 한 마크를 그릴을 사용 합니다.
참고: 컷 바늘 표면에 관하여 약 45 °의 각도에서 해야 합니다. - 사이드 바 기능에 수 있도록 이전에 표시 된 자리를 잘라 레이저 "컷 시작" 버튼을 포함 하는 플래그를 선택 합니다.
- 필요한 경우, 1.5.2-3;에 설명 된 절차를 반복 하 여 측면 구멍을 잘라 있다 (그림 1) 바늘 위치를 변경할 필요가 없습니다.
- 시작, 레이저 파워를 확인 하는 autocalibration 프로세스 실행 및 에너지 전달 하자. 절삭 매개 변수를 설정 합니다.
- 청소 잘라 후.
- 플라스틱 튜브를 통해 무효 펌프에 바늘을 연결 합니다.
- 펌프를 켜고 수동으로 중간 속도 (3 µ L/min)에서 앞으로 흐름 속도 설정.
- 99% 에탄올을 발음 먼저 고 다음 증류수는 절단으로 불순물을 제거.
- 99% 에탄올을 다시 건조를 쉽게 발음
참고: 각 단계 3 분 이상 지속 한다.
- 수술 날까지 제대로 커버 페 트리 접시에 바늘을 저장 합니다.
- 바늘을 다시 사용할 수 있습니다; 실험의 끝에, 표 백제 및 솔루션 및 가능한 조직 잔류물을 제거 하는 에탄올 청소. 더 완전 한 청소, 아래쪽을 가리키는 팁 micropipette 저장 항아리에 바늘을 넣어 팁 커버 때까지 증류수로 항아리를 작성, 어떤 남은 조직을 제거 후 에탄올으로 씻어 1.5 분 동안 끓여 야.
2입니다. 절차
- 펌프 사용 설명서에서 제공 하는 지침에 따라 직경/microinjection 주사기의 볼륨에 따라 펌프를 보정 하 여 0.3 µ L/min 흐름 속도 설정 설정 메뉴를 선택 합니다.
- 멸 균 물 10 mL 주사기 (무딘 바늘 (예를 들어, 해밀턴 바늘, 30 G)와 짧은 소계 튜브 장착)를 (후에 아주 조심 스럽게 피스톤을 제거 하는 데) microinjection 주사기와 주입을 채우기 위해 그것을 사용 하 여 수동 microinjection 펌프 (MMP)에 대 한 어셈블리 부품 키트.
참고: MMP 키트 정위 적 프레임 (그림 2)에서 바늘을 안전 하 게 마운트 하는 데 사용 됩니다. 키트 포함: 소계 튜빙, 루어 대 튜브 커플러, 피 펫 홀더 및 다른 외부 직경을 가진 펫에 대 한 가스 켓. - MMP 키트에 바늘을 연결 합니다.
- 10 mL 주사기를 통해 시스템에 걸쳐 더 많은 물을 플러시 고 물 바늘 나오는 여부를 확인 합니다.
참고: 작성 단계를 반복 하 여 시스템 내부의 모든 기포를 제거 해야 합니다.
- 10 mL 주사기를 통해 시스템에 걸쳐 더 많은 물을 플러시 고 물 바늘 나오는 여부를 확인 합니다.
- Microinjection 주사기의 상단에 물 한 방울을 남겨두기 위하여 피스톤을 천천히 추진 하는 동안 microinjection 주사기에서 10 mL 주사기를 분리 합니다. Microinjection 주사기에서 피스톤을 삽입 합니다.
- Microinjection 주사기 펌프에 연결 하 고 0.3 µ L/분 유량을 설정 합니다.
참고: 드롭 바늘의 팁에서 유출 될 때까지 대기 하 고 가자 또 다른 3 분. - 0.1 µ L/min에서 흐름을 설정 하 고 수술 절차를 시작 합니다. 펌프는 수술을 수행 하는 동안 진행 해야 합니다.
참고:이 문서에서 보고 하는 실험에 대 한 우리 300 g (3 개월의 나이)의 남성 Sprague Dawley 쥐 사용 합니다. 그러나, 절차는 특히 다른 종, 마우스에 적용 됩니다. - 지역 규정에 의해 승인 하는 방법을 사용 하 여 전신 마 취를 유도.
참고: 우리는 마 취의 20-50 분 85 mg/kg 케 타 민 및 8 mg/kg xylazine의 복 주사 (i.p.)의 혼합을 사용합니다. 그것은 중요 한 꼬리 및 발가락 pinches 동물 진정 완벽 하 게 보장 하기 위해 사용 됩니다. 수술 시작 하 고 수술을 수행 하는 동안 10 분 마다 모니터링 하기 전에 마 취와 기본적인 생체의 수준 평가 됩니다. 중 고 물 다시 순환가 열 패드를 사용 하 여 수술 후 동물 체온 전에 일정 유지 됩니다. 동물에 게는 완전히 복구 될 때까지 모니터링 (예: 그들은 직 립 보 행). 또한, 동물 받을 진통제 (tramadol, 5-7 mg/kg i.p.) post-operatively 모든 24 시간 3 일 동안.- 동물의 머리를 면도 하 고 무 균 수술을 위한 외과 사이트를 적절 하 게 준비. 2 단계 스크럽 요오드 기반 솔루션 (Betadine) 70% 에탄올 다음을 수행 합니다. 또한, 무 균 상태를 유지 하려면 수술 드 레이프와 외과 사이트 랩 (비디오에서 생략 되었습니다 데모 목적을 위해).
- 다시 난방 담요를 순환 하는 물 위에 stereotaxic 프레임에 쥐를 놓습니다. 수술의 사이트에 제공 하기 위해 추가 통증 완화, 0.5 %lidocaine 솔루션을 적용 (7 mg/kg을 초과 하지 않는). 미리 모든 수술 기구를 소독 살 균 물 또는 식 염 수와 린스 다음 immerging 장비 중 2%도 플러스 7.05% 페 놀 (Sporodicin 또는 Cidex)에 의해 비드 소독 기 또는 액체 냉 소독을 사용 하 여. 소독 절차 사이 수행 되어야 합니다. 멸 균된 메스를 사용 하 여 두개골에 경도 커트를 만드십시오. 과도 한 출혈을 방지 하려면 부드러운 수 있습니다. 편평한 주걱을 사용 하 여 두 피를 열고 뜨고 피부의 플랩에 수술 클립을 적용 합니다. 아주 부드럽게는 bregma와 두개골을 통해 바늘을 삽입 됩니다 영역을과 분리 합니다.
- (동안 흐름은 지속적인) 팔 stereotaxic 프레임에 탑재 고 주목 하지 팁 휴식 bregma 위에 정확히 바늘의 팁을 이동 합니다. bregma의 antero 후부 및 평점 옆 좌표에 주석을 추가 하 고 원하는 좌표에 번역. stereomicroscope에 의해 유도, 낮은 끝 거의 지는 두개골 때까지 바늘 표시 드릴링 자리 stereotaxic 팔을 약간 올리는 후.
- 드릴 (드릴 팁 Ø: 0.8 m m, 드릴 속도: 1000 rpm) 표시 된 자리에서 두개골. 하지 드릴링 절차 동안 경질을 침투를 주의 해야 합니다. 드릴링, 하는 동안 뼈 손상과 괴 사를 방지 하려면 메 마른 염 분 드립.
- 플라스틱 파라핀 영화의 작은 조각을 삭감 하 고 두개골에 배치. 10 µ L 피펫으로 사용 하 여 플라스틱 파라핀 영화에 삽입 하는 솔루션의 드롭을 확인 합니다. 펌프를 중지, 약간 펌프의 미는 사람을 검색 하 고 microinjection 주사기의 피스톤을 부드럽게 당겨서 작은 공기 방울이 모 세관에서 만들.
- 낮은 정위 적 팔 때까지 바늘의 끝에 도달 하면 드롭. (아주 천천히) 어떤 거품 형성을 피하고 microinjection 주사기의 피스톤을 잡아 당겨 샘플을 그립니다. 피스톤 접촉 펌프 미 장착 하 고 단계로 진행 하기 전에 한 방울 (몇 분)의 형성까지 0.3 µ L/분 대기의 유량에 펌프를 켭니다.
참고: 현재 예제 실험에서 인공 척수 (실제)은 주입는 (AP: 1.5, ML: ±2.7; DV:-5.0) 등 해 마에 (AP:-3.5, ML: ±2.1; DV:-3.5; mm dura)에서에서 2 µ L/사이트. 두 개의 사출 방법 간의 비교를 촉진 하기 위하여 각 뇌 영역 한 반구와 26 G 무뚝뚝한 끝에 석 영 바늘 이나 다른 30 G 베벨 팁 스테인리스 바늘을 사용 하 여 주입 했다. - 낮은 0.1 µ L/min 흐름, 경질 스테인리스 스틸 경사 팁 바늘으로 닉 및 천천히 뇌 조직 입력 dorso 복 부 도끼에 정위 적 팔. 원하는 위치에 도달 하면 추가 0.1 m m 아래로 펌프, 0.1 m m 여 정위 적 팔을 인상 멈추고 0.3 µ L/min 흐름에 펌프 다시 시작 이동 합니다.
참고: 바늘을 낮추고 있는 동안 느린 흐름을 유지 하는 이유는 바늘 자체에 직물의 작은 파편의 침투를 방지 하는 긍정적인 압력을 보장 하기 위해. 이러한 이벤트는 팁, 솔루션의 제공을 방해 방해 것 이라고. 이후 흐름 속도가 매우 느린 약 10 s/m m는 바늘과 저하의 속도 낮추는 동안,이 바늘 트랙을 따라 남아 있는 솔루션의 금액은 무시할 대상 사이트에 삽입 하는 그에 비해 의미 합니다. 측면 구멍으로 바늘을 사용 하 여이 경고를 피할 수 있습니다. - 타이머를 시작 하 고 (예를 들어 6 분 40 s 2 µ L를 주입 하는 경우) 주입을 원하는 볼륨에 따라 필요한 시간 기다립니다. 주입 하는 동안 거품 움직임을 모니터링 합니다. 끝에, 펌프를 중지 하 고 천천히 바늘을 검색 하기 전에 5 분 기다립니다. 석 영 바늘 완전히 추출 펌프를 다시 시작 하 고 바늘의 끝에 한 방울의 형성에 대 한 확인.
- 뼈 왁 스로 두개골 표면에 개통을 밀봉, hemostatic 클립을 제거 하 고 두 피를 봉합, 항생제 크림 (예를 들어, neosporin) 상처 주변 코트 그리고 홈 케이지 동물 돌아갑니다.
참고:이 문서에서 설명 하는 실험에 대 한 기관 윤리 위원회에 의해 승인 안락사 프로토콜에 따라 동물 깊이 43 mg/kg 케 타 민 및 7 mg/kg xylazine의 i.p. 주사와 마 취 고 참. 48 h를 포함 하는 파라핀 포 르 말린에 postfixed 두뇌 제거 되었다. 두뇌의 코로나 섹션 (8 µ m)는 톰을 사용 하 여 얇게 했다.
결과
우리 쥐 지 마에가 두 클래식, 26 G 무뚝뚝한 끝 및 30 G 베벨 가장자리와 비교 석 바늘 (60 µ M 외부 직경 팁; 한 20 µ M 직경 옆 구멍 유형 C, 그림 1)를 사용 하 여 직접 microinjection에 의해 유도 된 손상 비교 스테인레스 스틸의 바늘 이 목표를 우리는 오른쪽에 실제의 2 µ L를 주입 하 고 얼룩이 지는 Hematoxylin 오신 (그)를 사용 하 여 조직 손상 평가 했습니다 왼쪽 등 쪽 해 마가 각각 사용 하 여 석 영 강철 바늘과, 48 h 주입 후. 우리는 더 나은 주입 감사 다른 바늘에 의해 생산 하는 심각한 기계적 손상 후 초기 시간 포인트를 선택 (시간, 조직 복구 메커니즘 수 무명 초기 손상)7.
위에서 설명한 프로토콜에 따라 석 영 바늘 않았다와 생성 하지 감지 손상이 거의 감지 바늘 트랙 표시 손상 (그림 3)를 전시 하는 뇌 영역 26 G 철강 무뚝뚝한 끝 바늘을 통해 주입 하는 반면. 30 G 경사 각도 (30 °) 스테인리스 바늘 유도 더 제한, 아직 명확 하 게 감지 뇌 병 변 (그림 4B)가 지 마 (그림 5). 실제의 주입 실험의 별도 세트에서 두 바늘으로 동등 하 게 성공적 이었다 증명 하기 위해 우리 Trypan 파랑 (그림 4A)의 2 µ L를 주입. 중요 한 것은, 모든 검색된 석 영 바늘 했다 완벽 하 게 그대로, 즉, 우리 결코 삽입 기동으로 인해 손해를 관찰.

그림 1: 석 영 바늘 팁, 팁 및 액체의 주입을 위해 고용 하는 구멍의 다른 직경을 보여주는의 현미경 이미지. 낮은 확대 그림 (A) 및 (B) 높은 확대 및 (C). 바늘에 다른 준비 될 수 있습니다 (다른 길이, 구멍 숫자와 구멍 크기)는 해부학에 따르면의 방법 두뇌 지역, 확산 목표 및 (B)에서 볼 수 있듯이 솔루션의 점도 및 (C). 구멍 및 저전력 레이저 기정을 사용 하 여 얻은 팁의 부드러운 컷을 확인 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2: microinjections에 대 한 설정. 석 영 피 펫 (왼쪽)와 정위 적 micropositioner (오른쪽) 스테인리스 바늘을 확보 하는 데 사용 하는 키트를 보여주는 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 3: 석 영 바늘을 사용 하 여 더 적은 손상을 보여주는 코로나 섹션. 그림 1C (왼쪽)와 26 G 무뚝뚝한 끝 스테인리스 바늘 (장비에 표시 된 것 처럼 석 바늘을 사용 하 여 2 µ L 실제의 주입에 의해 손상 생산 간의 비교를 보여주는 수준에서 쥐 두뇌의 코로나 섹션 (8 µ m 두께) ht 쪽)입니다. 일부 손상 석 영 바늘의 두개골을 시추 깊이 잘못 때문에 측면에 피에서 제작 되었다. 에서 가져온 두 개의 서로 다른 동물, 이러한 이미지는 실험에 포함 된 모든 5 동물의 대표 (눈금 막대 = 500 µ m). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4: 확산 및 조직 손상. (A) 배포의 Trypan 블루는 (왼쪽), 30 G 베벨 가장자리 스테인리스 바늘 (오른쪽)와 비교 하 여 석 영 바늘으로 주입. 가의 수준에서 쥐 뇌의 (B) 코로나 섹션 그가 석 영 바늘과 30 G 베벨 가장자리 스테인리스 바늘 간의 비교를 보여주는 물 (눈금 막대 = 500 µ m). (왼쪽과 오른쪽), 손상의 높은 배율 상자에 (눈금 막대 = 200 µ m, 10 배). 이러한 이미지는 실험에 포함 된 5 동물의 대표. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
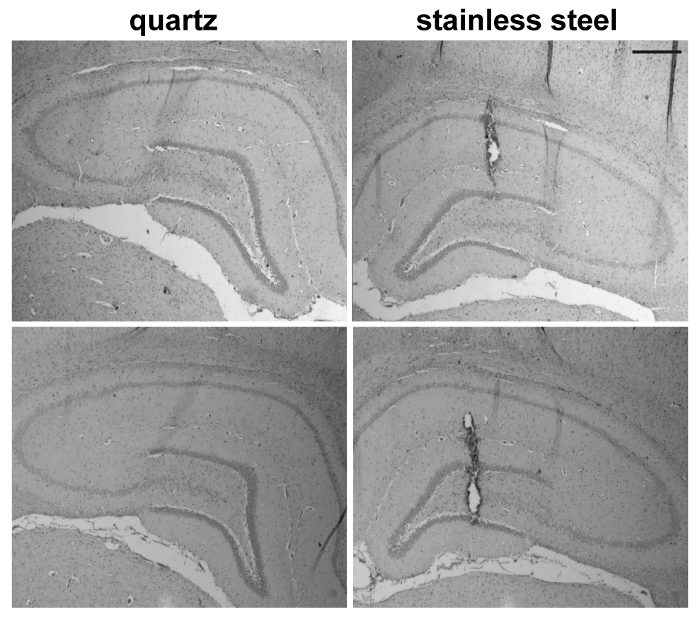
그림 5: 석 영 바늘과 지 마의 수준 26 G 베벨 가장자리 스테인리스 바늘에 의해 유도 된 손상. 여기는 대표 5 동물 실험에 포함 된 표시 된 두 가지 경우 (눈금 막대 = 400 µ m). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 문서에서 설명 하는 기술은 microinjections 다양 한 목적으로12수행 되는 최적화에 대 한 소개 에 설명 된 요구 사항을 충족. 여기에 설명 된 바늘 최소, 본질적으로 감지할 수 없는 수준; 손상을 감소합니다 (구 부 경향이 있는) 유리 바늘으로 분산, 석 바늘은 딱딱한 고 깊은 좌표에도 원하는 뇌 영역의 신뢰할 수 있는 히트를 보장. 또한, 측면 구멍 팁 구멍 뇌 조직에 삽입 하는 동안 차단 되는 경우에 솔루션의 납품을 보장 합니다.
한계와 대안입니다. 높은 융해 점 때문에 석 영 모세는 기존의 끌어당기는 사람, 즉에 뽑아 수 없습니다, 그리고 그들은 비용이 많이 드는 장비에 액세스 해야. 유리 모 세관은 피해 조직으로, 주사 깊은 구조에 대 한 신뢰할 수 있고 더 연약한 덜 (즉, 디자인 측면에서 덜 유연)을 피하고 측면에서 동등 하 게 좋다. 그러나, 경우 목표 표면 구조에 사출 같은 피 질 또는 지 마 필요는 없습니다 바늘 침입의 위험을 증가 시킬 것 이라고 하는 여러 개의 구멍, 유리 바늘은 확실히 유효 하 고 저렴 한 대안을 나타냅니다.
석 영과 유리 바늘의 한계는 그들은 다른 시간 지점에서 스테인리스 바늘 뉼 가이드 결합 처럼 여러 주사를 허용 하지 않습니다. 따라서, 철강 바늘 조언을 비교적 큰 (26 G) 또는 무딘 가장자리 바늘을 피하기 위해 이러한 응용 프로그램을 위한 최상의 옵션이 남아 있습니다.
중요 한 단계는 프로토콜. 전반적으로, 위에서 설명한 프로토콜은 매우 간단 하 고 microinjections에서 경험 하는 모든 연구원에 대 한 사용 하기 어려운 해서는 안됩니다. 바늘을 사용할 수 있습니다, 일단 일반 예방 마 취, 수술, 느린 삽입 하 고 바늘의 제거, 주입 한 minipump에 의해 규제의 지속적이 고 느린 속도 대 한 고용 좋은 재현성 결과 보장 합니다.
장점과 추가 개발입니다. 위에서 설명 했 듯이, 석 영 바늘의 주요 장점은 몇 바늘의 디자인을 개인화 가능성과 최소한의 기계적 손상입니다. 우리는 바늘 구멍 및 특정 실험적인 요구에 적응 될 수 있는 다른 직경을 준비. 예를 들어 다른 직경 필요가 있을 수 있습니다 바이러스 성 벡터와 약물 또는 독 소; 비교 셀 삽입 여러 구멍 솔루션 더 큰 영역에서 더 많은 양의의 주사를 위해 유용할 수 있습니다 하 고 어려운 형상 뇌 영역에 특히 유용 될 수 있습니다. 이 기술의 큰 다양성 또한 유전자 치료 또는 세포에 대 한 바이러스 성 벡터의 조직에 확산을 최적화 하기 위해 악용 될 수 있습니다. 사실, 이러한 바늘 사용 하 여 바이러스 성 벡터 또는 셀을 삽입 하.
다른 장점은 다시 바늘을 사용 하는 가능성을 포함 합니다. 이렇게 하려면 바늘 에탄올과 표 백제 솔루션 및 가능한 조직 잔류물 제거를 정리할 수 있습니다. 단 하나 바늘의 반복된 사용 절차 비용 효율적인 생산의 상대적으로 높은 비용에도 불구 하 고 만들 수 있습니다.
공개
저자는 공개 없다.
감사의 말
이 작품은 유럽 공동체 [FP7-사람-2011-IAPP 프로젝트 285827 (EPIXCHANGE)]에서 교부 금에 의해 지원 되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Quartz capillaries | Sutter Instruments, Novato, CA USA | Q100-50-10 | Without filament |
| Puller | Sutter | P2000 | |
| Micropipette storage jar | World Precision Instruments (WPI), Sarasota, FL, USA | E210 | |
| Laser microdissector | Leica Microsystems, Wetzlar, Germany | LMD6500 | |
| Hamilton syringe | Hamilton ILS Innovative Labor Systeme GmbH, StŸtzerbach, Germany | 19138-U | |
| Microinfusion pump | Univentor, Zejtun, Malta | Model 864 | |
| Manual microinjection pump kit | WPI | Item#: MMP-KIT | Kit allowing for micropipettes to be securely mounted to the stereotactic frame |
| Precision Drill | Proxxon | 28510 MicroMot 50/E | Ball bearing drive shaft with variable speed |
| Artficial Cerebral Spinal Fluid | Tocris | 3525 | |
| Needles 26 G Blunt and 30 G Bevel | Hamilton | 26 G Blunt: 19138-U 30 G Bevel: 20757 | |
| Microtome | Leica, Germany | LEICA RM212RT |
참고문헌
- Kirik, D., Rosenblad, C., Björklund, A. Characterization of behavioral and neurodegenerative changes following partial lesions of the nigrostriatal dopamine system induced by intrastriatal 6-hydroxydopamine in the rat. Exp Neurol. 152 (2), 259-277 (1998).
- Paolone, G., Brugnoli, A., Arcuri, A., Mercatelli, D., Morari, M. Eltoprazine prevents levodopa-induced dyskinesias by reducing striatal glutamate and direct pathway activity. Mov Disord. 30 (13), 1728-1738 (2015).
- Paolone, G., Lee, T. M., Sarter, M. Time to pay attention: attentional performance time-stamped prefrontal cholinergic activation, diurnality, and performance. J Neurosci. 32 (35), 12115-12128 (2012).
- Shoichet, M. S., Winn, S. R. Cell delivery to the central nervous system. Adv Drug Deliv Rev. 42, 81-102 (2000).
- Simonato, M., et al. Progress in gene therapy for neurological disorders. Nature RevNeurol. 9, 277-291 (2013).
- Björklund, H., Olson, L., Hahl, D., Schwarcz, R. Short-and Long-Term Consequences of Intracranial Injections of the Excitotoxin, Quinolinic Acid, as Evidenced by GFA Immunohistochemistry of Astrocytes. Brain Res. 317, 267-277 (1986).
- Paradiso, B., et al. Localized delivery of fibroblast growth factor-2 and brain-derived neurotrophic factor reduces spontaneous seizures in an epilepsy model. Proc Natl Acad Sci U S A. 106 (17), 7191-7196 (2009).
- Falcicchia, C., et al. Silencing Status Epilepticus-Induced BDNF Expression with Herpes Simplex Virus Type-1 Based Amplicon Vectors. PLoS One. 11 (3), 1-17 (2016).
- Munoz, J. L., Coles, J. A. Quartz micropipettes for intracellular voltage microelectrodes and ion-selective microelectrodes. J Neurosci Meth. 22 (1), 57-64 (1987).
- Kilkenny, C., Browne, W., Cuthill, I. C., Emerson, M., Altman, D. G. Animal research: reporting in vivo experiments: the ARRIVE guidelines. J Cereb Blood Flow Metab. 31, 991-993 (2011).
- Torres, E. M., Trigano, M., Dunnett, S. B. Translation of cell therapies to the clinic: characteristics of cell suspensions in large-diameter injection cannulae. Cell Transplant. 24, 737-749 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유