Method Article
パーソナライズされた齧歯動物の脳でのマイクロインジェクション針
* これらの著者は同等に貢献しました
要約
ここで水晶針を使用して齧歯動物の脳でのマイクロインジェクションのプロトコルについて述べる。これらの針は検出可能な組織の損傷を生成しないし、深部にも信頼性の高い配信を確保します。さらに、彼らはお好みのデザインで研究のニーズに合わせることができるし、再利用することができます。
要約
薬剤は、薬や特定の脳領域内毒素の配達のための長い時間のために使用されているし、最近では、彼らは遺伝子や細胞療法製品を提供に使用されています。残念ながら、現在のマイクロインジェクション技術使用、複数の理由で最適ではない鋼またはガラスの針: 特に、鋼の針は、組織損傷を引き起こす可能性があり、ターゲット領域が不足している脳に深く下げたときガラス針を曲げるかもしれません。この記事の準備の便利な機能の数を組み合わせる水晶針を使用するプロトコルについて述べる。これらの針は、検出可能な組織の損傷を作り出さないし、深い座標を使用する場合でも、必要な脳の領域の信頼性の高い配信を確保する非常に厳格であること。また、希望の直径の複数の穴をあけ、針のデザインをカスタマイズすることが可能です。複数の穴は、大きい穴セルの注入を容易にするのに対し大量の大きな領域内の溶液の注入を促進します。さらに、これらの水晶針を掃除し、プロシージャの費用対効果となるよう、再使用できます。
概要
薬剤は、特定の脳領域のニューロンの活動を調節する薬理活性化合物の配信のため長い間使用されています。さらに、彼らは神経変性イベント特定の病気、たとえば 6-ヒドロキシドーパミン パーキンソン病を模倣する黒質線条体ドーパミン系の特性を模倣するように、特定の神経集団近く毒素を注入するために使用されています。1,2または巣コリン作動性システム3immunotoxin 192 IgG saporin。最近では、遺伝子や細胞治療の実験的脳障害4,5ウイルスのベクトルまたは細胞移植を提供するマイクロインジェクション プロシージャが使用されています。
これらの研究で用いられる針の古典的なタイプはステンレス スチール製します。問題6数が簡単で使用する実用的な鋼の針である: 比較的大きい、血液脳関門の漏出とアストロ サイトの活性化組織の損傷を引き起こす可能性がありますまた、障害物を作成するか、目的のソリューションの流れを完全に回避する針に脳組織のコアリングを出す可能性があります。最近では、準備されたアドホック毛細血管から導入されているガラス針は7、8を使用します。これらは重要な組織の損傷もアストロ サイトの活性化が発生しないが、比較的、ローカリゼーション (個人的な観察) の精度低下の深層構造に導入されたときに曲がる可能性があります。
したがって精度と再現性を高めながら損傷と同じくらい (特にときのダメージを回復するための実験を実行する) を減らす必要がある (すなわち、すべての解決策が配信されることを確認し、正しいローカリゼーション)。また、さまざまなジオメトリと脳の領域に注入されたソリューションの最適な配分を確保するため別の針のデザインを使用することが望ましいででしょう。この記事で準備し、齧歯動物の頭脳の薬剤の水晶針を使用するプロトコルについて述べる。高融点のため水晶毛細血管は従来の引き手でプルすることはできません、したがって、使用されていない過去の針を生成します。水晶、しかし、ガラス、特に高剛性とブレーク抵抗9以上のいくつかの重要な利点を提供しています。その剛性のため水晶針は腹側脳部位への注入に最適です。破損への高抵抗のため彼らは場合でも、複雑な形状の10による脳領域をターゲットに最も効果的な証明するかもしれない設計を得る複数の穴を含むようにモデル化できます。
プロトコル
すべて実験的プロトコルは、フェラーラ大学動物実験倫理委員会およびイタリアの保健省によって承認されました。到着 (動物資源研究領域: 生体実験の報告11) ガイドラインに続いています。
1. 水晶探針の作製
- きれいにし、蒸留水で 5 分、エタノール 99% で 5 分、ジエチル エーテル 5 分を置くことによって (材料表参照) 石英毛細血管を滅菌します。
- 完全に乾燥させる、少なくとも 1 時間のためのフードの下の毛細血管を残します。
- 個々 のニーズに応じて、十分に長く、十分に細い針の生産を許可するパラメーターによるとレーザーの引き手を使用して針を準備します。
注: 我々 はレーザーの引き手を使用して (材料の表を参照してください)。引っ張るための 2 行のプログラムを使用します。最初の行は、高出力、(フィラメントの値に対応する) 最大スキャンの長さと引っ張る力を使用します。このパラメーターの組み合わせはスピードが低い拡張機能、内部/外部の大きさで長い針の形成を可能にする毛管の最大の部分の溶融につながり、シャンクを削減します。この方法では、針は、高機械的な抵抗と目詰まりせず幹細胞またはウイルス粒子の通過を可能にする広い内径を保持します。速度とこのプログラム ラインの遅延は、先端が小さすぎると、長い、不足している必要な機械および形態になる前に、毛細血管の拡張を中止すべき。水晶が冷却したら引くプログラムの 2 番目の行は、自動的に実行 (5 s)。電源、フィラメントと牽引力のパラメーターが最短の可能な先端の長さと破裂の先端 2 本の針の分離を避け、急なシャンクの先端をカットする機能。日常的に、当社設備で、我々 は次を使用: (a) 行 1 = 電源 990、フィラメント 5、速度 130、遅延 110、プル 0;(b) 2 行目 = 力 970, フィラメント 3、速度 0, 遅延 70、0 を引きます。 - エタノール 70% ときれいに以前ペトリ皿に針を置きます。
- プラスチック パラフィン フィルムで包みます。
- マイクロ切開で毛細血管をカットします。
- 起動時には、レーザー パワーを確認するための自動キャリブレーション プロセスを実行、提供されるエネルギーをしましょう。切削パラメーターを設定します。
注意: マイクロ凝固切開装置を使うこと (材料の表を参照)、次のパラメーター: パルス エネルギー (63 μ J)、最大絞り値の 20% のビーム径のレーザー (最大絞り: 1.0 μ m) と切削速度の最大速度 (最大 10%速度: 30 μ m/s)。 - しっかりと顕微鏡テーブルの上針を修正し、コンピューター画面の中央にその先端を配置します。
- メニュー バーで、鉛筆のアイコンをクリックし、針のレーザー切断のマークの描画に使用します。
注: カット針表面に対して約 45 ° の角度にする必要があります。 - サイド バー関数以前マークしたスポットをカットするレーザーを許可する「カットを開始」ボタンを含むフラグを選択します。
- 必要な場合は、1.5.2-3; で説明した手順を繰り返すことによって側穴をカットします。(図 1) 針の位置を変更する必要はありません。
- 起動時には、レーザー パワーを確認するための自動キャリブレーション プロセスを実行、提供されるエネルギーをしましょう。切削パラメーターを設定します。
- 洗浄後カットします。
- 針をプラスチック製のチューブを介してボイド ポンプに接続します。
- ポンプをオンにして適度な速度 (3 μ L/分) で前方の流量を手動で設定します。
- 99% エタノールを吸引切断による不純物を除去するには、最初で、蒸留水。
- 乾燥を容易にするためもう一度 99% エタノールを吸引します。
注: 各手順は、少なくとも 3 分を持続させるべき。
- 手術の日まできちんとカバーされたペトリ皿に針を格納します。
- 針は、再使用する可能性があります。実験の終わりには、漂白剤やソリューションと組織の残留物を除去し、エタノールできれい。針マイクロ ピペット ストレージ jar ファイルを入れて、下向きの先端とより完全なクリーニングのためのヒントが覆われるまで蒸留水の瓶を埋める、任意の残りの組織を除去し、エタノールで洗う 1.5 分煮る。
2. 手続き
- ポンプのユーザー マニュアルの指示に従って、マイクロインジェクション注射器の直径/量に応じたポンプを調整し、0.3 μ L/分の流量を設定するには、[設定] メニューを選択します。
- 滅菌水で 10 mL 注射器 (例えばハミルトン針 (30 G) 鈍針と短いポリテトラフルオロ エチレン チューブを装備) を記入し、(後にピストンを非常に慎重に取り除いた) マイクロインジェクション注射器と注入を埋めるためにそれを使用手動インジェクション ポンプ (MMP) の組立部品キットです。
メモ: MMP キットは、定位脳手術フレーム (図 2) で針を安全にマウントに使用されます。キットが含まれています: ポリテトラフルオロ エチレン チューブ、ルア-チューブ カプラー、ピペット ホルダー、異なる外径ピペット用ガスケット。 - 針を MMP キットに接続します。
- 10 mL のシリンジをシステム全体でより多くの水をフラッシュし、水が、針が出てくるかどうかを確認します。
注: 充填の手順を繰り返して、システム内部の空気の泡を削除するを確認します。
- 10 mL のシリンジをシステム全体でより多くの水をフラッシュし、水が、針が出てくるかどうかを確認します。
- マイクロインジェクション注射器の上部に水を一滴を残すためにピストンをゆっくりと押しながら、マイクロインジェクション注射器から 10 mL 注射器を外します。マイクロインジェクション注射器のピストンを挿入します。
- ポンプにマイクロインジェクション シリンジを接続し、0.3 μ L/分の流量を設定します。
注: 待機まで針の先端から漏れドロップ、それが別の 3 分のために行くみましょう。 - 0.1 μ L/分で流れを設定し、手術の手順を開始します。ポンプは、手術中継続的なする必要があります。
注: この記事で報告した実験用ラット 300 g (生後 3 か月) の男性スプレイグを使用します。ただし、手順は特に他の種、マウスに適用されます。 - 地域の規制によって承認されたメソッドを使用して全身麻酔を誘導します。
注: 我々 は麻酔の 20-50 分の 85 mg/kg 8 mg/kg とケタミン ・ キシラジンの腹腔内注入 (i. p.) のミックスを使用します。尻尾やつま先のつまみを使用して、動物が完全に鎮静を確保が重要です。手術が始まり、手術を行っている間 10 分毎を監視する前に、麻酔と基本的なバイタルのレベルが評価されます。動物の体の温度は一定に前に中、や加熱パッドを再循環水を使用しての手術後。動物は、完全に回復するまで監視される (彼らは直立、歩行など)。さらに、動物は三日間 24 h に術後に鎮痛剤 (トラマドール、i. p. 5-7 mg/kg) を受け取る。- 動物の頭を剃るし、無菌手術の手術部位を適切に準備します。ヨウ素ベースのソリューション (Betadine) 70% エタノールに続いて 2 段スクラブを実行します。さらに、無菌状態を維持するために手術用覆布で手術部位をラップ (ビデオで省略されていますデモ用)。
- 脳定位固定装置のフレームに毛布を再循環水にラットを置きます。その他の痛みの緩和を提供する手術のサイトで適用 0.5% リドカイン液 (7 mg/kg を超えないように)。すべて手術器具をあらかじめ滅菌滅菌水または生理食塩水ですすぎ 2% グルタルアルデヒド プラス 7.05% フェノール (Sporodicin または Cidex) いずれかの設備を immerging でビーズ滅菌器または液体のコールド消毒を使用して続きます。プロシージャ間でさえ、消毒を行う必要があります。頭蓋骨に滅菌メスを使用して縦方向のカットを行います。過度の出血を避けるために優しくすること。平らなヘラを使って頭皮を開き、開いたままに皮膚のフラップに外科用クリップを適用します。非常に優しく、前と、針が挿入される頭蓋骨の領域を公開する骨膜をデタッチします。
- 脳定位固定装置のフレームのアームのマウント (流れは継続されている) し、前、その先端を割らないように注意を払って上正確に針の先端を移動します。前の前後とメディオ水平座標に注釈を付ける、目的の座標に変換します。顕微鏡に導かれ、その先端はほとんど頭蓋骨を触れるまで針を下げ、マーク少し脳定位固定装置のアームの持ち上げ後掘削するスポット。
- ドリル (ドリル先端 Ø: 0.8 mm; ドリル速度: 1,000 rpm) スポットでマークされている頭蓋骨。掘削手順の中で硬膜を貫通しないには、注意が必要です。穴あけ中、骨の損傷と壊死を回避する滅菌生理食塩水を点滴します。
- プラスチック パラフィン フィルムの小片をカットし、頭蓋骨の上に置きます。10 μ L ピペットを使用して、プラスチック パラフィン フィルムに注入する溶液の一滴を作る。ポンプを停止、わずかポンプのプッシャーを取得し、インジェクション注射器のピストンをゆっくり引いて、キャピラリー中で少し空気の泡を作成します。
- 定位ロワーアームを針の先端に達するドロップまで。(非常にゆっくり) 任意の気泡を避け、マイクロインジェクション注射器のピストンを引いてサンプルを描画します。ピストンと接触してポンプの補助機関車を置き換える、次の手順に進む前にドロップ (数分) の形成まで流量 0.3 μ L/分待機でポンプを入れます。
注: 存在例実験で線条体に注入された人工髄液 (アプライド) (AP: 1.5 ML: 2.7;DV:-5.0)、背側の海馬 (AP:-3.5 ML: ±2.1;DV:-3.5;硬膜から mm)、2 μ L/サイト。2 注入法との比較を容易にするには、脳の各領域は、1 つの半球で 26 G 鈍チップ水晶針または他の 30 G ベベル ヒント ステンレス鋼針を使用して注入しました。 - 0.1 μ L/分への流れを下げる、ステンレスかさ先端針で硬膜をニックし、脳組織に入る背腹斧で定位の腕をゆっくりと下ろします。目的の位置に達すると、追加 0.1 mm、ポンプを停止、0.1 mm 定位の腕を上げるし、再び 0.3 μ L/分の流量でポンプを起動を行きます。
注意: 針を削減しながら低速流を維持する理由は、針自体の組織の小さな断片の侵入を回避する正圧を確保するためです。このようなイベントには、ヒント、ソリューションの提供を損なうことが妨害されます。流量は約 10 s/mm 針および低下の速度を下げることが非常に遅いため、これは針トラックに沿って残っている液量が無視できるターゲット サイトで注入されたものと比較することを意味します。側面の穴に針を使用する場合は、この予防措置を避けることができます。 - タイマーを開始し、注入する音量に応じて必要な時間 (2 μ L 注入する場合は 6 分 40 秒など) を待ちます。注入しながらバブルの移動を監視します。最後に、ポンプを停止し、ゆっくりと針を取得する前に 5 分を待ちます。水晶針は完全に抽出されると、再びポンプを起動し、針の先端でドロップの形成のため確認します。
- 骨ワックス頭蓋骨表面に開口部をシール、止血クリップを削除して頭皮を縫合、(例えばネオスポリン) 抗生物質のクリームで傷口周辺のコート、ホームのケージに動物を返します。
注: この資料に記載されている実験のため機関倫理委員会によって承認された安楽死プロトコルに従って動物深く 43 mg/kg ケタミンおよび 7 mg/kg キシラジン、i. p. 注射で麻酔され断頭します。48 h のパラフィン埋め込まれたホルマリンの接尾辞をつけた脳が削除されました。頭脳のコロナ セクション (8 μ m) は、ミクロトームを使用してスライスされました。
結果
ラット背側海馬、線条体の 2 つの古典的な 26 G 鈍い端 30 G ベベル エッジと比較して水晶針 (60 μ M 外径先端; 1 つ 20 μ M 径側の穴が図 1C 型) を使用して直接マイクロインジェクションによる損傷を比較しました。ステンレス スチール製の針。この目的我々 は右にアプライドの 2 μ L 注入し、左背側海馬線条体投与後、それぞれに石英の鉄の針と、48 h を使用して、我々 はヘマトキシリン ・ エオジン (HE) 染色による組織損傷を評価します。良い注入感謝さまざまな針による急性の機械的損傷後早期の時点を選びました (時間、組織修復メカニズムが無名の初期損傷)7。
上記で説明したプロトコルに従い水晶針生成されませんでした任意の検出可能な損傷とかろうじて検出可能針トラック 26 G 鋼の鈍い端針を通して注入される脳領域展示 (図 3) の著しい損傷に対し。30 G 傾斜角 (30 °) ステンレス鋼針はより限られて、まだ明確に検出可能な脳の病変 (図 4 b) 線条体と背側の海馬 (図 5) の両方を誘発しました。アプライドの注入が実験の別のセットで、両方の針を使って均等に成功したことを証明するためトリパン ブルー (図 4 a) の 2 μ L を注入しました。重要なは、すべて取得した水晶針が完全にそのまま、つまり、我々 は決して挿入演習による損傷を観察。

図 1: 表示ヒントと流体の注入に用いられる穴の直径の異なる水晶針の先端の顕微鏡像。低倍率画像 (A) と (B) の高倍率 (C)。針は別の準備かもしれないマナー (異なる長さ、穴数、穴寸法) 解剖学によると (B) に示すように、溶液の粘性、拡散目標脳の領域 (C)。穴と低消費電力のレーザー マイクロダイ セクションを用いて先端の滑らかなカットに注意してください。この図の拡大版を表示するのにはここをクリックしてください。

図 2: 薬剤を設定します。写真 (左) 石英ピペットと定位マイクロポジショナーに (右) ステンレス鋼針をセキュリティで保護するために使用キットを表示中します。この図の拡大版を表示するのにはここをクリックしてください。

図 3: 水晶針を使用してより少ない損傷を示すコロナ セクション。2 μ L アプライド図 1 (左側) と 26 G 鈍い端ステンレス鋼針 (リグのような水晶針を使用して注入による損傷生成間の比較を示す線条体のレベルでラットの頭脳のコロナ セクション (8 μ m 厚)ht 側)。いくつかの損傷は、頭蓋骨を正しく深く掘削のために、水晶針側皮質で生産されました。これらのイメージは、2 つの異なる動物から撮影実験に含まれているすべての 5 動物の代表である (スケール バー = 500 μ m)。この図の拡大版を表示するのにはここをクリックしてください。

図 4: 拡散と組織損傷。(A) 配布のトリパン ブルー 30 G ベベル エッジ ステンレス針 (右) と比較して (左) 水晶針を線条体に注入します。(B)、線条体のレベルでラット脳の冠状断面に染まった彼の水晶針と 30 G ベベル エッジ ステンレス針との間の比較を示す (スケールバー = 500 μ m)。ボックス (左、右)、損傷の高倍率 (スケールバー = 10 X 200 μ m)。これらの画像は、実験に含まれる 5 匹の動物の代表です。この図の拡大版を表示するのにはここをクリックしてください。
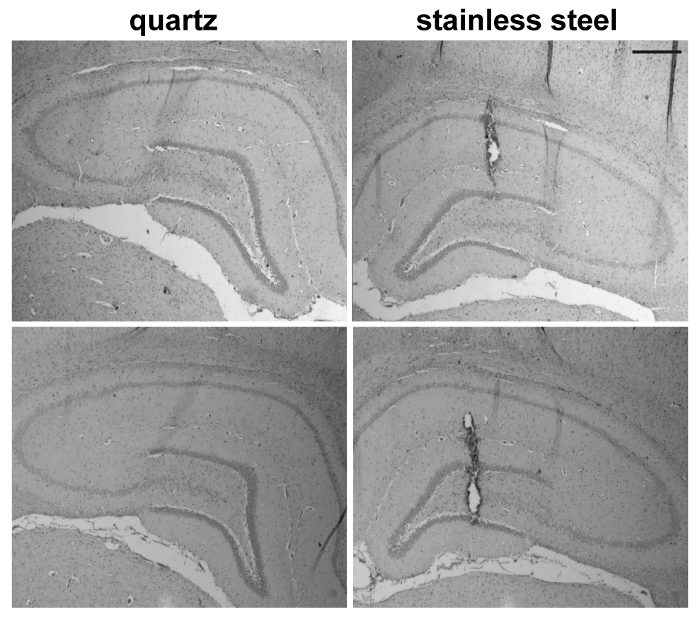
図 5: 水晶針と背側海馬のレベルで 26 G ベベル エッジ ステンレス針による損傷。ここでは、実験に含まれる 5 匹の動物の代表者を示す 2 つのケース (スケールバー = 400 μ m)。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
この資料で説明する手法は、様々 な目的の12に対して実行される薬剤を最適化するための導入に記載されているニーズを満たします。ここで説明した針は、最小、本質的に検出可能レベルに損傷を軽減します。(曲げる傾向がある) ガラス針で分散、水晶針が剛性、深い座標でも必要な脳の領域の信頼性の高いヒットを確保します。さらに、側の穴は、先端穴を取得します脳組織の挿入時に遮蔽された場合でも、ソリューションの提供を保証します。
制限と代替。高融点のため従来の引き手、すなわちに石英毛細血管が引き出せない、彼らは高価な機器へのアクセスを必要とします。ガラス管が損傷組織が以下の深部構造の注射のため信頼性が高くより壊れやすい (すなわちデザインの面でより柔軟な) の回避の面で均等に良いです。ただし、目標は、大脳皮質や背側の海馬などの表面的な構造の注射針破壊のリスクを増加させる複数の穴のための要件はありませんが、もしガラス針は確かに有効な安価な代替を表します。
水晶とガラスの針の制限は、彼らがカニューレをガイドに結合されたステンレス スチール製の針のような異なる時点で複数の注射を許可しないことです。したがって、鋼針まま比較的大きな (26 G) や縁の針を避けるためのアドバイスをこれらのアプリケーションに最適なオプションです。
プロトコルの重要なステップです。全体的に、上記で説明したプロトコルは非常に簡単で、難しい薬剤の経験豊富な研究者に使用するべきでないです。針が使用可能になるが、麻酔、手術、ゆっくり挿入と抜針、定められており、側脳室内注入率一定と遅い採用正規注意良いと再現性のある結果が保証されます。
利点と発展。前述のように、水晶針の主な利点は、針のデザインをカスタマイズする可能性のあるいくつか最小限の機械的損傷です。複数の穴と特定の実験のニーズに合わせることができる異なった直径の針をご用意しました。たとえば、異なる直径はウイルスベクターと薬物や毒素の機能を持つ細胞を注入する必要ことがあります。複数の穴は大きい区域内の溶液量の注射をする場合に役立ちます、難しいジオメトリ頭脳区域の特に有用になるかもしれない。この技術の偉大な多様性は、遺伝子治療や細胞のウイルスのベクトルの組織で普及を最適化するためにも利用できます。確かに、我々 はウイルスのベクトルまたは細胞を注入するのにこれらの針を使用します。
その他の利点には、針を再使用する可能性があります。これを行うには、針はエタノールや漂白ソリューションと組織の残余を取除くために洗浄できます。単針の反復使用は、コスト効果の高い生産コストが比較的高いにもかかわらず手順をことができます。
開示事項
著者が明らかに何もありません。
謝辞
この作品は、欧州共同体「FP7 の人々-2011 IAPP プロジェクト 285827 (EPIXCHANGE)」からの助成金によってサポートされていますいます。
資料
| Name | Company | Catalog Number | Comments |
| Quartz capillaries | Sutter Instruments, Novato, CA USA | Q100-50-10 | Without filament |
| Puller | Sutter | P2000 | |
| Micropipette storage jar | World Precision Instruments (WPI), Sarasota, FL, USA | E210 | |
| Laser microdissector | Leica Microsystems, Wetzlar, Germany | LMD6500 | |
| Hamilton syringe | Hamilton ILS Innovative Labor Systeme GmbH, StŸtzerbach, Germany | 19138-U | |
| Microinfusion pump | Univentor, Zejtun, Malta | Model 864 | |
| Manual microinjection pump kit | WPI | Item#: MMP-KIT | Kit allowing for micropipettes to be securely mounted to the stereotactic frame |
| Precision Drill | Proxxon | 28510 MicroMot 50/E | Ball bearing drive shaft with variable speed |
| Artficial Cerebral Spinal Fluid | Tocris | 3525 | |
| Needles 26 G Blunt and 30 G Bevel | Hamilton | 26 G Blunt: 19138-U 30 G Bevel: 20757 | |
| Microtome | Leica, Germany | LEICA RM212RT |
参考文献
- Kirik, D., Rosenblad, C., Björklund, A. Characterization of behavioral and neurodegenerative changes following partial lesions of the nigrostriatal dopamine system induced by intrastriatal 6-hydroxydopamine in the rat. Exp Neurol. 152 (2), 259-277 (1998).
- Paolone, G., Brugnoli, A., Arcuri, A., Mercatelli, D., Morari, M. Eltoprazine prevents levodopa-induced dyskinesias by reducing striatal glutamate and direct pathway activity. Mov Disord. 30 (13), 1728-1738 (2015).
- Paolone, G., Lee, T. M., Sarter, M. Time to pay attention: attentional performance time-stamped prefrontal cholinergic activation, diurnality, and performance. J Neurosci. 32 (35), 12115-12128 (2012).
- Shoichet, M. S., Winn, S. R. Cell delivery to the central nervous system. Adv Drug Deliv Rev. 42, 81-102 (2000).
- Simonato, M., et al. Progress in gene therapy for neurological disorders. Nature RevNeurol. 9, 277-291 (2013).
- Björklund, H., Olson, L., Hahl, D., Schwarcz, R. Short-and Long-Term Consequences of Intracranial Injections of the Excitotoxin, Quinolinic Acid, as Evidenced by GFA Immunohistochemistry of Astrocytes. Brain Res. 317, 267-277 (1986).
- Paradiso, B., et al. Localized delivery of fibroblast growth factor-2 and brain-derived neurotrophic factor reduces spontaneous seizures in an epilepsy model. Proc Natl Acad Sci U S A. 106 (17), 7191-7196 (2009).
- Falcicchia, C., et al. Silencing Status Epilepticus-Induced BDNF Expression with Herpes Simplex Virus Type-1 Based Amplicon Vectors. PLoS One. 11 (3), 1-17 (2016).
- Munoz, J. L., Coles, J. A. Quartz micropipettes for intracellular voltage microelectrodes and ion-selective microelectrodes. J Neurosci Meth. 22 (1), 57-64 (1987).
- Kilkenny, C., Browne, W., Cuthill, I. C., Emerson, M., Altman, D. G. Animal research: reporting in vivo experiments: the ARRIVE guidelines. J Cereb Blood Flow Metab. 31, 991-993 (2011).
- Torres, E. M., Trigano, M., Dunnett, S. B. Translation of cell therapies to the clinic: characteristics of cell suspensions in large-diameter injection cannulae. Cell Transplant. 24, 737-749 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved