Method Article
고압 액체 크로마토 그래피와 글루코 추출 및 분석을위한 간단한 방법 (HPLC)
요약
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
초록
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
서문
식물 화학 물질 (1)의 20 개 이상의 서로 다른 종류를 생산하는 것으로 추정된다. 이들 화합물의 소수 식물 '차 대사, 연료의 성장과 재생에 중요한 역할을하는 것 같다; 대부분의 이차 대사 산물을 소위. 그들은 꽃가루 매개자를 유치하거나 병원균과 초식 동물 (1)에 대한 공장을 방어하는 역할로 자신의 이름에도 불구하고, 이차 대사 산물은 종종 식물의 생존과 재생을 위해 중요하다.
글루코은 150 년이 공부 한 이차 대사 산물의 매우 다양한 클래스입니다. 현재까지 130 개 이상의 구조적으로 다른 글루코는 3 확인되었습니다. 넓게 글루코들은 합성하는 아미노산에 따라 다른 클래스로 분할 될 수있다. 글루코 인돌, 예를 들면, 아미노산으로부터 합성된다트립토판, 페닐알라닌 반면 방향족 글루코 (4)의 합성을위한 기본 골격을 제공한다. 클래스 내에서, 지방족 글루코의 클래스로서 생합성 경로에 순차 사슬 연장 단계에 의해 초래 또는 측쇄 변형 (예를 들어, 히드 록 실화) -4,5-입니다 구조적 다양성의 높은 수준이있다. 하나 글루코 식물 종은 다른 구조 클래스 6에 속하는 최대 37 다른 글루코를 포함 할 수있다. 식물 종은 전형적인 글루코 프로파일을 가지고 있지만, 글루코의 유형에 대한 종자 간 변화는 자주 개인과 인구 6, 7 사이에서 발견된다. 그대로 글루코은 식물 세포의 액포에 저장되어있는, 지하 또는 지상 장기 7에서 찾을 수있다 8, 9. 전지 파열 (예를 들어, 초식 동물에 의해)시, 글루코이 해제되고 겨자 기름 폭탄 (10)을 설정, 효소 myrosinase와 혼합된다. 인해 myrosinase의 활동 및 글루코, 반응 조건 및 변형 효소의 존재의 구조에 따라 상이 매운 독성 또는 유해 화합물 등 니트릴 (ISO) (11) 티오 시아 네이트와 같이 형성된다. 반응 생성물은 높은 생물학적 활성을 갖고; 예를 들면, 그들은 총합 초식 곤충 기피제 (12)의 역할을한다. 글루코의 유전 및 생합성 경로가 아니라, 주로 때문에 초식 동물과 병원균에 저항, 겨자와 양배추의 맛을 구성 요소와 가치, 그리고 부정적인 (progoitrin) 및 인간의 건강 5에 긍정적 인 (glucoraphanin) 효과에 대한 자신의 중요성, 연구한다 13, 14.
때문에 역상 고압 액체 크로마토 그래피, 자외선 (UV) 또는 포토 다이오드 어레이를 구비 (HPLC)에 기초하여 생물학적 활성 화합물을 추출 및 검출 방법과 같은 글루코에서 큰 관심 (PDA) 검출기는 일반적으로 1980 년 15부터 사용되어왔다 . 이 방법을 바탕으로, 유럽 공동체는 종자의 글루코 분석 (브라 시카 napus, 평지, 카놀라 16)에 대한 몇 가지 실험실에서 테스트되고 검증 된 표준 프로토콜을 발표했다. 기타 17 (유채에 존재하지 않는 글루코에 대한 추가 응답 인자를 결정함으로써, 예를 들어)이 메소드에 추가됩니다. 글루코 분석 (18), 액체 크로마토 그래피 질량 분석 (LC-MS) 플랫폼 및 높은 처리량 프로토콜의 증가 함에도 불구 (19)는, 원래의 HPLC-UV / PDA 방법은 아직 널리 과학자들에 의해 사용된다. 주요 이유는이 방법이 간단하고 비용 효율적인, 그리고 광범위한 화학 분석 기술 인프라없이 실험실에 상대적으로 액세스 할 수 있는지입니다. 이 지역 사회에 봉사하기 위해, 식물 재료에서 글루코의 추출 및 HPLC-PDA와의 desulfo-형태의 분석을 위해 우리는 여기에 세부 프로토콜.
프로토콜
글루코 추출에 필요한 솔루션 1. 준비
- 유리 병에 물을 70 % 메탄올 (MeOH 중) 500 ㎖ (초순수)를 준비한다. 100 샘플 5 기준 70 %의 420 mL의 메탄올의 경우에는 필요하다.
- 의 NaOAc 0.82 g의 NaOAc 또는 X 3 H 1.36 g을 첨가하여 20 MM의 아세트산 나트륨 (NaOAc) (의 pH = 5.5)을 제조 2 O 물 500ml에; 염화수소로 pH를 조정한다. 냉장고에의 NaOAc를 저장합니다. 100 샘플 5 표준 물에 20 mM의 아세트산 나트륨 (NaOAc) (PH = 5.5) 370 mL를가 필요하다.
- 열 물질을 제조 초순수 125 mL를 가교 덱스 트란 겔 (타입 G-25) 10g을 혼합한다. 냉장고 (4 ℃로)에서 생성 된 혼합물을 저장합니다.
- sulfatase 용액의 조제
- 초순수의 30 mL에 아릴 sulfatase의 10,000 단위 (유형 H-1 헬릭스 pomatia에서)를 용해시키고, 무수 에탄올 30 ㎖ (의 EtOH)를 추가합니다. 잘 솔루션을 혼합 한 250 ML의 CEN로 전송trifuge 관이나 가용성에 따라 여러 개의 작은 튜브,.
- 실온에서 20 분 (RT)에 대해 2,650 XG에서 혼합물을 원심 분리기. 비커에 뜨는 (들)을 전송; 의 EtOH 90 mL를 넣고 그것을 섞는다. RT에서 15 분 동안 1030 × g으로 하나 이상의 원심 분리기 튜브에서 혼합물을 원심 분리기.
- 상층 액을 버린다. 용해 초순수 25 ㎖의 총 펠렛을 결합한다. 소용돌이는 물론, -20 ° C에서 냉동실에 1 mL의 튜브에 분배, 저장; 그들은 1 년 이상 유지합니다.
- sinigrin 기준 용액의 제조
- 1 μg의 정확도 (예를 들면, 8.769 mg)을 함께 sinigrin 수화물 9 mg의 주위에 무게. 10 mL의 용량 플라스크로 이동 및 초순수의 10.0 mL의에 sinigrin 수화물을 용해.
- 스톡 용액의 몰 농도를 계산하고 원액 희석 50-750 μM 5 ~ sinigrin 참조를 준비한다. 자세한 예를 들어, 참조 보충 파일 S1 .
- 1.5 mL를 반응 튜브 내의 다른 sinigrin 참조를 분주하고 20 ℃에서이를 동결. 각 추출 배치에 다섯 sinigrin 참조의 시리즈를 포함합니다. 농도를 계산할 때 항상 현재 참조 sinigrin 사용에 대한 올바른 몰 농도 값을 사용합니다.
추출 설치 2. 준비
- 파스퇴르 피펫 열에 대한 열 랙을 준비합니다 (열 준비 단계 3.1 참조). 샘플 번호를 추적 할 랙 또는 열의 라벨 (도 1 참조).
- 라벨을 2ml의 마이크로 원심 튜브의 같은 번호를 가진 블록을 준비한다 (단계 3.3 및도 1 참조)
5 / 55425fig1.jpg "/>
그림 1 : 글루코 추출 랙. 앞면 (왼쪽)과 글루코 추출을위한 자체 제작 열 랙 및 블록의 평면도 (오른쪽). 높이 : 100mm 사이의 거리 (파스퇴르 피펫의 열을 유지하기 위해) 구멍을 이동 : 30mm (x 축)은 15mm (Y 축) ×. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
열 및의 microcentrifuge 튜브 3. 준비
- 샘플 당 하나의 열과 다섯 sinigrin 참조 샘플에 대한 다섯 가지 여분의 열을 준비합니다.
- 각 유리 피펫에서, 유리 섬유 약 1cm × 1 cm의 조각을 놓습니다. 피펫가 좁아 지점으로 유리 섬유를 밀어 나무 또는 유리 스틱을 사용합니다. 유리솜 아웃 실행 컬럼 재료를 방지해야하지만 컬럼 용출 저하하므로, 너무 많이 사용하지 않는다. 장갑 ㅁ 착용유리 양모 작업을 갖추고 있습니다.
- 열 선반에 열을 위 (도 1 참조). 연속 열 세척에 사용되는 용리액을 잡으려고 랩 트레이 (폐기물 트레이)의 열 선반을 두십시오.
- 플라스틱를 1ml 피펫 팁 피펫 제조 칼럼 재료 0.5ml의 선단 떨어져 제 5mm 잘라 각 열에 (물 중 G-25 겔을 단계 1.3 참조). 피펫 전에 잘 컬럼 재료를 포함하는 병을 흔들어. 새는 열 (유리 양모 층을 통해 실행 G-25 물질)을 폐기하고 새 것으로 교체합니다.
- 컬럼에 컬럼 재료 피펫 팅 한 후, 물질을 세척하는 초순수의 1 mL를 넣어.
- 샘플 당 2 mL의 반응 튜브와 다섯 sinigrin 참조 샘플에 대한 오 튜브를 준비; 그 레이블을 붙입니다. 이후 동결 건조 용 캡에 구멍을 만들기 위해 해부 바늘을 사용하고 같은 동일한 패턴으로 튜브 블록으로 제조 된 튜브를 배치열 (단계 2.2,도 1 참조).
글루코 4. 추출
- (상기 추출물의 최종 글루코 농도가 기준 곡선의 범위 내에 있어야하는 건조 중량의 일반적 50.0-100.0 mg)을 2 ㎖의 가장 가까운 0.1 mg의 표시된 원형 건조 동결 미세 어스 식물 재료 무게 -bottom 반응 튜브. 각 튜브에 지연 제를 끓는으로 두 개의 작은 금속 공 (직경 3mm)를 추가합니다.
주 :이 프로토콜은 또한 액체 질소하에 분쇄 추출 전까지 냉동 보관 된 신선한 플래시 냉동 물질에 적용될 수있다. 재료 (19)에서 물에 의해 희석을 보상하기 위해 85 % 추출액에서 추출 칭량 물질의 양 및 메탄올의 비율을 증가시킨다. - 간단히 각각의 튜브와 소용돌이에 70 % 메탄올의 피펫 1 mL를. 튜브를 닫고 w 핫로 가능한 한 빨리 그들을 배치하기 전에 안전 캡을 밀봉메탄올 그냥 종기 70 %까지 몇 분 (~ 5 분)에 대한 ater에 목욕 (90-92 °의 C). 주의 :이 단계에서 안전 고글을 착용!
- 15 분 동안 초음파 욕조에 샘플 튜브를 놓습니다. 한편, sulfatase을 가지고 냉동실 중 다섯 sinigrin 참조 샘플 RT에서 그들을 해동.
- 울트라 초음파 후, RT에서 10 분 동안 벤치 탑 원심 분리기에서 2700 XG에 시료를 원심 분리 관; 펠렛 각 튜브에 형성한다. 레이블 컬럼에 상층 액을 추가하고 별도의 컬럼에 다섯 참조 샘플을 피펫.
- 상층 액을 피펫 팅하는 동안, 피펫 식물 재료를 피하기 위해 펠렛을 통해 잘 팁을 유지한다. 건조 된 샘플을 사용하는 경우, 상청액 용적 미만 1.0 mL로되므로주의.
- 샘플 튜브에 남아있는 펠렛을 70 % 메탄올 1 mL를 넣고 15 분간 초음파 욕조에 배치하기 전에 튜브를 소용돌이. 단계 4.4에서와 같이 다시 원심 분리 튜브 및 superna 추가각각의 컬럼에 tants; 컬럼 재료의 특성으로 인해 상기 글루코의 음전하 황산기 구체적 컬럼 상에 보유된다.
- 세 순차적 인 단계에서 추출물 열을 씻으십시오.
- 각 열 위에 70 % 메탄올의 피펫 2 × 1 mL를. 다음 1 mL를 추가하기 전에 건조 실행할 수있는 열 기다립니다; 이 추출물 (예를 들어, 엽록소)에서 더 많은 비극성 화합물을 제거합니다.
- 각 컬럼에 초순수 1 ㎖를 첨가하여 메탄올을 플러시.
- 피펫 2 × 1 mL의 20 mM의의 NaOAc는 sulfatase 반응을위한 최적의 조건을 만들기 위해 각 열에 버퍼.
- 폐기물 트레이 밖으로 열이있는 랙을 가지고 조직과 랙의 발을 건조. 튜브 및 레이블 튜브 블록 위에 선반을 두십시오. 각 열 선단이 대응하는 라벨, 2 ㎖의 튜브에 있는지 확인 (도 1 참조).
- sulfatase의 soluti의 20 μL를 추가열을합니다. sulfatase가 열 재료의 표면에 도달했는지 확인하십시오. 의 NaOAc의 피펫 50 μL는 sulfatase를 플러시 각 컬럼에 버퍼. 알루미늄 호일로 열을 덮고 하룻밤 서 보자.
주 : sulfatase의 활동으로 인해 황산기들은 물로 용출 수 있도록 열에서 desulfoglucosinolates를 풀어 제거한다. 자세한 설명은 Crocoll 등을 참조하십시오. 19. - 다음날, 각 컬럼에 초순수의 2 × 0.75 mL를 피펫 팅하여 desulfoglucosinolates을 용출. 모든 열 건조 실행 한 경우, 열 선반을 들어 올려 반응 튜브에서 제거합니다.
- 튜브를 (뚜껑에 구멍이 있는지 확인) 모자 및 액체 질소 나 그들을 동결 -80 C의 냉동고 ° 30 분. 동결 건조 모든 물을 제거 (샘플 개수 및 동결 건조기의 능력에 따라) 12 내지 24 시간 동안 샘플.
<리> 동결 건조 후는, 초순수의 정확한 양 (일반적으로 1.0 ㎖)에 잔류 물을 다시 디졸브. 표시 HPLC 바이알에 샘플과 다섯 sinigrin 참조를 전송합니다. 최대 2 주 동안 냉장고 (4 ℃) 또는 HPLC로 분석하기 전에 냉동실 (-20 ° C) 최대 1 년에 샘플을 보관하십시오. - 하룻밤 후드 아래 열 건조 유리를하자 건조시를 폐기하십시오. 재사용을 위해 4.5 단계에서 사용되는 샘플 튜브에서 금속 공을 복구하고 폐기물 처리 bin에 튜브를 넣어.
추출 된 샘플 5. HPLC 측정
- 아세토 니트릴 - 물 구배를 갖는 역상 C 18 컬럼 (4.6 × 150 mm의 3 μm 인 300 Å)의 글루코 별개 0.75 mL / 분의 흐름 및 40 ℃의 칼럼 온도 (표 1 참조) . 229 nm에서 검출과 정량을 수행합니다.
- 같은 열에 있지만 적응 그라데이션으로 sinigrin 참조를 측정용매 사용을 감소시키는 방법 (표 2 참조). 가장 낮은 농도를 기준으로 시작, 다섯 sinigrin 참조를 주입 시작합니다. 그런 다음 열을 청소하고 피크의 이월을 방지하기 위해 모든 열 번째 샘플 후 메탄올 주입 (공백)를 포함하여 샘플을 주입.
| 시간 [분] | 흐름 [mL / 분] | % 물 | % B ACN |
| 1 | 0.750 | 98 | 이 |
| (35) | 0.750 | (65) | (35) |
| (40) | 0.750 | 98 | 이 |
| 칼럼 온도 40 ° C를. | |||
표 1 : 글루코 분리 및 analysi에 대한 아세토 니트릴 - 물 구배역상 HPLC에 S.
| 시간 [분] | 흐름 [mL / 분] | % 물 | % B ACN |
| 1 | 0.750 | 98 | 이 |
| (10) | 0.750 | 89.3 | 10.7 |
| (11) | 0.750 | 98 | 이 |
| 칼럼 온도 40 ° C를. | |||
표 2 : 글루코의 정량에 사용되는 다섯 sinigrin 참조 정량 단축 아세토 니트릴 - 물 구배.
6. 글루코 식별 및 정량
- 신분증
- 상업적 이익과 샘플의 피크의 UV 스펙트럼 및 유지 시간을 비교수, 순수 글루코 참조. 다양한 글루코 클래스에서 UV 스펙트럼의 예 그림 2를 참조하십시오.
- 가능하면, 참조 표준 또는 LC-MS 18, 19 일에 알 수없는 글루코을 확인합니다.
- 핵 자기 공명 (NMR), 가능하면 알 수없는 글루코을 확인합니다.
- 그림 2, 표 3, 데이터베이스, 또는 참고 문헌에서 그와 피크의 UV 스펙트럼 및 유지 시간을 비교합니다.

가장 일반적인 글루코 클래스도 2 UV 스펙트럼. 여섯 desulfoglucosinolates (GSL)의 UV 흡수 스펙트럼 (200 ~ 350 나노 미터)의 가장 일반적인 구조를 나타내는 클래스 여기서 설명으로서 추출 시판 기준 화합물로 이루어지는 용액에 기초. 일반적인 이름은이야tructural 이름 (괄호 사이), 및 구조 클래스가 제공됩니다. (A) Sinigrin (2- 프로 페닐 GSL) 알 케닐; (B) glucoerucin (4- methylthiobutyl GSL) thioalkenyl; (C) glucoraphanin (4- methylsulfinlybutyl GSL), 설피 닐; (D) glucobrassicin (인돌 -3- 일 메틸 GSL) 인돌; (E) gluconasturtiin (2- 페닐 에틸 GSL) 방향족; (F) sinalbin 방향족 (4- 히드 록시 GSL). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 부량
- 다섯 sinigrin 참조 및 샘플의 피크 아래의 면적을 통합한다.
- 통합 된 영역에 기초하여 상기 측정 된 다섯 sinigrin 참조의 검량선을 구한다. 회귀 직선의 식을 사용하여 글루코 (수학 식 2 참조)의 보간 된 양을 계산하는 (수학 식 1 참조).
- 다양한 글루코의 농도를 계산하는, EC에서 229 nm에서 검출을위한 반응 인자 (M)에 의해 보간 된 양 (X)을 곱 (1990) 16 부 흐너 (1987) 15, 또는 브라운 등. (1993) 17; 가장 일반적으로 검출 desulphoglucosinolates의 합의 응답 계수는 표 3에 제시되어있다.
참고 : 다릅니다 응답 요소 시스템-이 다른 참조에 의해 주어진 서로 다른 값이 있다는 이유가 될 수있다 (참고 문헌 15 ~ 17 참조). 그럼에도 불구하고, 값은 대부분 아주 가까운 및 구조 클래스와 유사한 범위에 있습니다. 협약에 따라, glucobrassicin 다른 인돌 글루코 (도 2)와 유사한 UV 스펙트럼을 가진 알 인돌 글루코 위해 그것을 얻기 위해 응답 인자로서 0.25를 사용하는 것이 바람직 할 것이라고했지만, 1 미확인 글루코의 응답 인자를 설정할농도의 현실적인 추정치 (표 3). - 샘플에서 글루코 최종 량 (X의 t)를 계산하기 위해 고려 분석에 사용되는 희석 계수 (D) 및 샘플의 질량 (W)을 가지고 (수학 식 3 참조).
 (1)
(1) 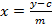 (2)
(2) 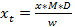 (삼)
(삼)
Y = 피크 면적
기준 5 점의 회귀 곡선의 기울기 m은 =
C = Y 축으로 회귀 직선의 절편
추출물의 글루코의 X = 양
식물 샘플에서 글루코의 X t = 농도
D = 희석 인자
외 흐너 (1987) 또는 갈색의 229 nm에서 검출은 M = 응답 인자. (1993)
w = 시료의 질량 추출에 사용
결과
이 방법은 감지 및 모든 구조 클래스에서 일반적으로 발견 desulfoglucosinolates의 분리 (그림 3) 할 수 있습니다. 해로운 2 hydroxyglucosinolate의 progoitrin은 상대적으로 초기 크로마토 그램에서 제공하고 명확하게 유익한 글루코의 glucoraphanin,이 샘플에서 유일하게 methylsulfinylglucosinolate에서 분리된다. Sinigrin는 gluconapin 및 glucobrassicanapin 증가 사이드 체인 길이 (각각 C3, C4 및 C5)와 알케 글루코의 eluotropic 시리즈를 형성한다. 비슷한 논리 시리즈는 두 methylthioalkenyl의 글루코를 들어, glucoiberverin (C3) 및 glucoerucin (C4) 볼 수 있습니다. 4- 히드 록시 및 1-methoxyglucobrassicin (neoglucobrassicin)이 세 인돌 글루코, glucobrassicin의 봉우리와 그 유도체는 또한 명확하게 구분됩니다. 주의 할 점은 neoglucobrassicin 및 glucoerucin 피크뿐만 아니라 gluconasturtiin 유일한 방향족 gluco이 샘플에서 sinolate 인해 믹스 9 루트 추출물의 첨가에이 브라 시카 추출물에서 특히 높다.
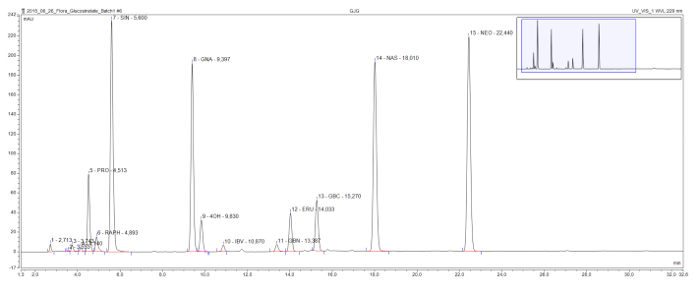
그림 3 : 글루코 추출물의 크로마토 그램. 결합 브라 시카 파괴 해에서 루트 및 촬영 샘플, B.의 라파 및 B. 올레 라 케아의 분석 결과 HPLC 크로마토 그램의 세부 사항 (32 분). 피크 라벨 체류 시간 및 식별 desulfoglucosinolates 대한 약어 (GSL)을 나타낸다. PRO progoitrin = (2-OH -3- 부 테닐 GSL); 라프 = glucoraphanin (4- methylsulfinlybutyl GSL); SIN = sinigrin (2- 프로 페닐 GSL) GNA = gluconapin (3- 부 테닐 GSL); (40H) = 4 hydroxyglucobrassicin; IBV = glucoiberverin (3- 메틸 티오 프로필 GSL); GBN = glucobrassicanapin (4- 펜 테닐 GSL); ERU = glucoerucin (4- methylthiobutyl GSL); GBC = glucobrassicin (인돌 -3- 일 메틸 GSL); NAS = gluconasturtiin (2- 페닐 에틸 GSL); NEO = neoglucobrassicin (1 메탄올 - glucobrassicin). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Rorippa의 austriaca의 뿌리 추출물에서 볼 수 있듯이 일반적으로 모델 식물 애기 장대에서 발견되는 긴 체인 메틸 술의 글루코은 또한, eluotropic 시리즈를 보여줍니다. Glucohesperalin (C6), glucosiberin (C7), glucohirsutin (C8), 및 glucoarabin (C9)의 크로마토 그램 (그림 4)에 일정한 간격으로 나타납니다. 함께 피크의 UV 스펙트럼과 같은 논리 eluotropic 시리즈 알 글루코 분류하고, 잠정적으로 식별하기 위해 사용될 수있다.
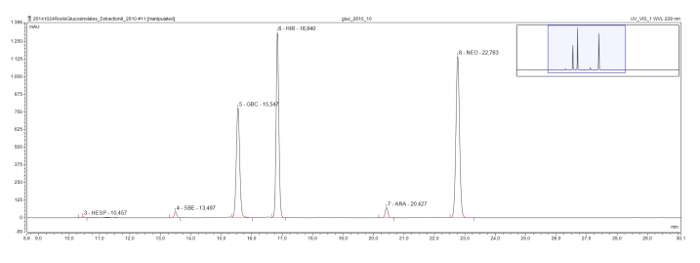
그림 4 : 크로마토 그램 (프레임 9-30 분)는 Rorippa austriaca 뿌리 추출물의 desulfoglucosinolates의. 피크 라벨 체류 시간 및 식별 desulfoglucosinolates 대한 약어 (GSL)을 나타낸다. HES = glucohesperin (6- methylsulfinylhexyl GSL); SBE = glucosiberin (7 methylsulfinylheptyl GSL); GBC = glucobrassicin (인돌 -3- 일 메틸 GSL); HIR는 glucohirsutin (8 methylsulfinlyoctyl를 GSL) =; ARA = glucoarabin (9 methylsulfinylnonylglucosinolate); NEO = neoglucobrassicin (1 메탄올 - glucobrassicin). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 일반 이름 | 측쇄 구조 | 체류 시간 (분) * | 229 nm의 | 참고# |
| aliphatiC의 글루코 | ||||
| Glucocapparin | 메틸 | 3.5 | 1 | 갈색 |
| Sinigrin | 2- 프로 페닐 | 5.5 | 1 | 브라운, EC |
| Gluconapin | 3 테닐 | 9.5 | 1.11 | EC |
| Glucobrassicanapin | 4 펜 테닐 | 13.5 | 1.15 | EC |
| Glucoiberverin | 3 메틸 티오 | 10.9 | 0.8 | 갈색 |
| Glucoerucin | 4 methylthiobutyl | 14.0 | 0.9 | 갈색 |
| Glucoiberin | 3 methylsulfinylpropyl | 3.7 | 1.2 | 갈색 |
| Glucoraphanin | 4 methylsulfinylbutyl | 4.9 | 0.9 | 갈색 |
| Glucoalyssin | 5 methylsulfinylpentyl | 7.6 | 0.9 | 갈색 |
| Glucohesperin | 6 methylsulfinylhexyl | 10.5 | 1 | 갈색 |
| Glucosiberin | 7 methylsulfinylheptyl | 13.5 | 1 | 갈색 |
| Glucohirsutin | 8 methylsulfinyloctyl | 16.8 | 1.1 | 갈색 |
| Glucoarabin | 9 methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3 methylsulfonylpropyl | 4.2 | 0.9 | 갈색 |
| Progoitrin | 2 (R) -OH -3- 부테 | 4.5 | 1.09 | 뷰 흐너, EC |
| Gluconapoleiferin | 2-OH -5- 펜 테닐 | 8.3 | 1 | EC |
| 인돌 글루코 | ||||
| 4 hydroxyglucobrassicin | 4- hydroxyindol -3- 메틸 | 11.2 | 0.28 | 뷰 흐너, EC |
| Glucobrassicin | 인돌 -3- 일 메틸 | 15.3 | 0.29 | 뷰 흐너, EC |
| 4 Methoxyglucobrassicin | 4- methoxyindol -3- 메틸 | 18.2 | 0.25 | 뷰 흐너, EC |
| Neoglucobrassicin | 1- methoxyindol -3- 메틸 | 22.5 | 0.2 | 뷰 흐너, EC |
| 방향족 글루코 | ||||
| Sinalbin | 4- 히드 록시 벤질 | 8.1 | 0.5 | 뷰 흐너 |
| Glucosibarin | 2 (R) -OH -2- 페닐 에틸 | 12.1 | 0.95 | 다음 참조 |
| Glucobarbarin | 2 (S) -OH -2- 페닐 에틸 | 12.7 | 0.95 | 뷰 흐너 |
| Glucotropaeolin | 벤질 | 13.8 | 0.95 | 뷰 흐너, EC |
| Gluconasturtiin | 2- 페닐 에틸 | 18.0 | 0.95 | 뷰 흐너, EC |
| 알 - 지방족 / UV 스펙트럼과 같은 방향족 | 1 | EC | ||
| 알 - 스펙트럼 등 인돌 | 0.25 | EC | ||
| * 대략적인 체류 시간 (RT)은 (열, 용출액의 품질에 따라 0.3 분 ±) 가까운 0.1 분에 둥근. 체류 시간은 C 18 컬럼 (150 X 4.6 mm, 3 마이크로 미터의 입자 크기) 플러스 C (18)가 장착 ThermoFisher / 다이오 넥스 궁극적 인 HPLC 플랫폼에서 결정된다 표 1에서와 같은 기울기 프로그램 UB> 프리 컬럼 (10 × 4.6 mm, 5 마이크로 미터의 입자 크기). | ||||
| 응답 요인 # 참고 : 유채의 글루코에 흐너, R. (에디션 JP Wathelet) 50-58 (Martinus Nijhoff 출판사, 1987); 브라운, PD, Tokuhisa, JG, REICHELT, M. & Gershenzon, 다른 장기와 애기 장대의 발달 단계 중 글루코 축적 J. 변화. 식물 화학. 62 (3), 471-481, 도이 : 10.1016 / S0031-9422 (02) 00549-6 (2003); EC. 오일 씨앗 - 글루코 고성능 액체 크로마토 그래피의 결정. 유럽 공동체의 공식 저널. L의 28분의 170. 부속서 VIII 03.07.27-34 (1990). | ||||
표 3 :의 응답 요인이 가장 일반적으로 발견 desulfo - 글루코 C (18) 열에 식물 추출물과 대략적인 체류 시간. 용리액, gradien표 1에서 t, 컬럼 온도 및 유속.
토론
이 설립 널리 사용되는 방법의 가장 큰 장점은 강력한 오히려 간단하고, 샘플 당 상대적으로 저렴한 비용이라고합니다. 추출과 분석에 필요한 설비의 대부분은 표준 실험실에서 사용할 수 있어야하거나 PDA-HPLC를 제외하고 자기 구축 할 수있다. 또 다른 장점은 물에 용해 desulfoglucosinolates이 시원하고 기밀 (HPLC) 유리 병에 보관하면 화학적으로 매우 안정하기 때문에 추출물이 쉽게 다른 곳에서 HPLC 분석에 배송 할 수 있다는 것이다. 훈련 된 데이터를 소프트웨어를 관리 및 분석하기위한 광범위한 체험 전문 필요 LC-MS 플랫폼 대조적으로, HPLC-UV / PDA를 쉽게 짧은 훈련 기간 이후에 수행 될 수있다. 이 절차의 비용을 줄일뿐만 아니라, 학생 포함한 과학자 광범위한,이 방법은 더 접근하게 아닙니다.
일반적으로, 절차는 전술 한 바와 carefu을 따라하는 경우에서야 베드로, 몇 가지 문제가 발생한다. 일반적으로, 글루코 피크가 아주 잘 크로마토 그램에서 분리된다. 이러한 경우가 아니라면 그래디언트 프로그램 용리액 아세토 니트릴의 증가 속도를 감소시킴으로써 적응 될 수있다. 또한, 새로운 사전 열 (200-500 주사) 또는 열 (1,500 -2,000 주사)에 구축하면 문제를 해결할 수 있습니다. 때때로, 배치에서 단일 시료의 크로마토 그램은 매우 작거나없는 피크 표시 될 수 있습니다. 이 sulfatase를 추가 할 때 인해 피펫 오류로 일반적으로 (예를 들어, 열이 생략되었거나 sulfatase가 제대로 열 아래로 세척되지 않았다). 예상과 너무 작은 물질이 추출에 사용 된 것보다 다른 방법으로, 실험 재료의 글루코 농도가 낮은되었을 수 있습니다. 후자의 경우, 주입 부피는 100 μL로 증가 될 수 있거나, 추출물의 정확한 부분 표본 (예를 들어, 800 μL)를 농축 할 수있다. 후자는 동결 건조에 의해 달성 될 수있다물을 작은 부피 (즉, 100 μL)에 잔류 물을 용해시키고, 추출물을 보내고, 같은 기준 곡선을 사용하여 재 주입. 추출물의 원래 농도 계산에서, 번호는 희석 인자에 의해 승산되어야한다. 이 문제가 해결되지 않으면, 재료보다 출발 물질을 사용하여 다시 추출해야합니다. 이 100mg 이상이면, 추출 용매의 부피 및 튜브의 크기는 광 추출 효율을 유지하기 위해 비례 적으로 조정되어야한다.
추가 장점은이 방법이 잘 검증 된 것입니다. 이 절차 및 정확도 여러 실험실에서 확인 된 16하는 유채에서 글루코의 정량화를위한 표준 방법으로 설명되어 있기 때문이다. 또한, 유전 적 배경 생합성 및 글루코의 생물학적 기능이 모드에서, 강렬한 연구 노력 될 수 있습니다다른 사람 4, 6, 12 중에서 엘 식물 종의 애기 장대. 따라서 sinigrin 관련 desulfoglucosinolates의 정확한 정량 많은 응답 요소는 잘 정의되고 15,17 공개. LS-MS 기반 프로토콜이 더 높은 처리량, 더 민감하고, 할 수 있지만 (가칭)에는 표준 18, 19, 20, LC-MS에 대한 보편적 인 응답 요소의 부족이 제한 사용할 수 없습니다하는 글루코를 식별 글루코 농도 (18)의 정확한 정량. 더욱이, 이러한 방법은 통상적으로 신선한 식물 재료의 동결 건조 공정, 및 물의 양을 포함하지 않는 것은 정확한 정량 어렵게 계산에 불명이다. 우리 추출법이 포함하기 때문에 마지막 열 기반정제 및 농축 단계, 또한 이러한 통 (21)과 같은 글루코 저농도로 "더티"샘플들에 적용될 수있다.
일반적으로, 신선 동결 재료를 추출하는 추출을 위해 96 웰 플레이트를 사용하고, sulfatase 단계 (18, 19)를 포함하지 않는 LC-MS 기반 방법에 비해, 제안 된 방법은 상대적으로 많은 시간과 노동 강렬하다. 이 문서에 설명 된 열 랙으로, 한 사람이 하루에 약 100 ~ 150 샘플을 추출 할 수 있습니다. 용출 (다음 날), (밤새) 건조 동결 및 재 용해은 다음 두 가지 일 이내에 일어날 수 있습니다. 자동화 된 HPLC 인젝터, 분사 당 40 ~ 45 분의 실행과 평형 시간, 어떤 예기치 못한 사건으로,이 샘플 세트에 대한 데이터를 수집 3-4 일이 소요될 것입니다. HPLC를 소프트웨어는 자동 정량 sinigrin 곡선, 크로마토 그램 및 체육의 수동 검사를 기반으로 허용하는 경우데이터가 통계 분석을 위해 사용하기 전에 100 샘플 AK 과제는 다시 1 또는 2 시간이 걸릴 수있다.
글루코 표준의 증가 가능성에도 불구하고, 130 개 이상의 후보들의 작은 부분은 현재 상업적으로 구입할 수있다. 그러나 생합성 각 클래스에 대한 몇 가지의 참조와; 화합물을 특정 문헌 데이터베이스에 대한 액세스는 이전 식물 종에서 발견 (예를 들어, 파헤이 (22) 등.); 이러한 eluotropic 일련의 논리와 같은 크로마토 그래피 원리의 기초 지식 (예, 지방족 화합물의 측쇄에 세슘의 숫자를 증가시키기 위해, 3 및도 4); 및 NMR (23)에 대한 LC-MS (19) 또는 격리 된 글루코 단일 샘플의 검증, 하나는 쉽게 이러한 한계를 극복 할 수 있습니다. 글루코위한 대부분의 프로토콜은 내부 기준 곡선을 사용하여 분석(즉, 추출 용매 16, 17, 19 sinigrin의 추출 또는 sinalbin 특정 농도). 원칙적으로, 내부 기준 곡선은 높은 정밀도를 얻을 따라서, 이론적으로 각각의 시료 처리 오류를 정정하는 것이 더 적합하다. 이러한 장점에도 불구하고, 우리는 주로 (예를 들어, 브라 파괴 해 24) 또는 sinalbin (예 Sinapis 알바 25)에 sinigrin 높은 수준을 함유 일부 다른 야생종을 분석 같이 5 점 외부 기준 곡선을 선호 이 글루코 참조하는 응답 요소를 사용할 수 있습니다. 고급 글루코 참조 표준은 일반적으로 매우 비싼 더욱이, 각 샘플의 내부 표준을 첨가하여, 분석의 비용을 증가시킨다.
결론적으로, 시간 - 소모적 인 단계에도 불구하고,이 프로토콜추출 및 식물 샘플에서 글루코을 정량화 할 수있는 간단하고 접근 방법을 제공한다. 그러나, 글루코 수준 자체는 단일 글루코 (11)로부터 발생하는 반응 생성물의 단지 myrosinase와 반응 할 필요성으로 본 전위 생물학적 활성의 표시, 및 변동 것을 고려하는 것이 중요하다. 유효성 검사 분석은 생물학적 관련성을 확인하기 위해 수행해야합니다.
공개
The authors have nothing to disclose.
감사의 말
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
자료
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20864.320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCl | VWR | 1.09057.1000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20816.298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass/wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2120 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Rotilabo-sealing clips | Carl Roth | N217.1 | |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83639.320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1,000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
참고문헌
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유