Method Article
Un método sencillo para glucosinolatos Extracción y análisis de alta presión con cromatografía líquida (HPLC)
En este artículo
Resumen
Here, we describe in great detail an established and robust protocol for the extraction of glucosinolates from ground plant materials. After an on-column sulfatase treatment of the extracts, the desulfoglucosinolates are eluted and analyzed by high-pressure liquid chromatography.
Resumen
Glucosinolates are a well-studied and highly diverse class of natural plant compounds. They play important roles in plant resistance, rapeseed oil quality, food flavoring, and human health. The biological activity of glucosinolates is released upon tissue damage, when they are mixed with the enzyme myrosinase. This results in the formation of pungent and toxic breakdown products, such as isothiocyanates and nitriles. Currently, more than 130 structurally different glucosinolates have been identified. The chemical structure of the glucosinolate is an important determinant of the product that is formed, which in turn determines its biological activity. The latter may range from detrimental (e.g., progoitrin) to beneficial (e.g., glucoraphanin). Each glucosinolate-containing plant species has its own specific glucosinolate profile. For this reason, it is important to correctly identify and reliably quantify the different glucosinolates present in brassicaceous leaf, seed, and root crops or, for ecological studies, in their wild relatives. Here, we present a well-validated, targeted, and robust method to analyze glucosinolate profiles in a wide range of plant species and plant organs. Intact glucosinolates are extracted from ground plant materials with a methanol-water mixture at high temperatures to disable myrosinase activity. Thereafter, the resulting extract is brought onto an ion-exchange column for purification. After sulfatase treatment, the desulfoglucosinolates are eluted with water and the eluate is freeze-dried. The residue is taken up in an exact volume of water, which is analyzed by high-pressure liquid chromatography (HPLC) with a photodiode array (PDA) or ultraviolet (UV) detector. Detection and quantification are achieved by conducting comparisons of the retention times and UV spectra of commercial reference standards. The concentrations are calculated based on a sinigrin reference curve and well-established response factors. The advantages and disadvantages of this straightforward method, when compared to faster and more technologically advanced methods, are discussed here.
Introducción
Se estima que las plantas producen más de 200.000 diferentes tipos de compuestos químicos 1. Sólo la minoría de estos compuestos parece jugar un papel en el metabolismo primario de las plantas, que alimenta el crecimiento y la reproducción; la mayoría son los denominados metabolitos secundarios. A pesar de su nombre, metabolitos secundarios son a menudo críticos para la supervivencia y reproducción de las plantas, ya que sirven para atraer a los polinizadores o defender la planta contra patógenos y herbívoros 1.
Los glucosinolatos son una clase muy diversa de metabolitos secundarios que se han estudiado durante más de 150 años 2. Hasta la fecha, más de 130 glucosinolatos estructuralmente diferentes se han identificado 3. En términos generales, los glucosinolatos se pueden subdividir en diferentes clases basadas en el aminoácido de la que se sintetizan. glucosinolatos indol, por ejemplo, se sintetizan a partir del aminoácidotriptófano, mientras que la fenilalanina proporciona el esqueleto de base para la síntesis de glucosinolatos aromáticos 4. Dentro de las clases, hay un alto grado de diversidad estructural, que se produce por los pasos de elongación de la cadena secuencial en el rutas biosintéticas, tales como en la clase de glucosinolatos alifáticos, o por modificaciones de la cadena lateral (por ejemplo, hidroxilación) 4, 5. Una especie de planta de glucosinolatos pueden contener hasta 37 glucosinolatos diferentes que pertenecen a diferentes clases estructurales 6. A pesar de que las especies de plantas tienen perfiles típicos de glucosinolatos, la variación intraespecífica de los tipos de glucosinolatos se encuentran con frecuencia entre los individuos y las poblaciones 6, 7. Glucosinolatos intactos se almacenan en las vacuolas de las células vegetales y se pueden encontrar en cualquier órgano sobre el suelo o bajo el suelo 7, 8, 9. En caso de rotura celular (por ejemplo, por los herbívoros), glucosinolatos se liberan y se mezclan con la enzima mirosinasa, lo que desencadenó una bomba de aceite de mostaza 10. Debido a la actividad de la mirosinasa, y dependiendo de la estructura de la glucosinolatos, las condiciones de reacción, y la presencia de enzimas modificadoras, se forman diferentes compuestos picantes, tóxicos, o nocivos, tales como nitrilos y (iso) tiocianatos 11. Los productos de reacción tienen altas actividades biológicas; por ejemplo, sirven como repelentes de insectos herbívoros generalistas 12. La heredabilidad y la biosíntesis de glucosinolatos vías están bien estudiados, principalmente debido a su importancia para (glucorafanina) efectos positivos sobre la salud humana 5 herbívoro y resistencia a patógenos, su valor como componentes de sabor en mostazas y coles, y su negativo (progoitrin) y, 13, 14.
Debido a la gran interés en glucosinolatos como compuestos, métodos de extracción y detección biológicamente activos basados en la cromatografía líquida de alta presión de fase inversa (HPLC) equipado con radiación ultravioleta (UV) o matriz de fotodiodos (PDA) detectores se han utilizado comúnmente desde la década de 1980 15 . Sobre la base de este método, las Comunidades Europeas emitió un protocolo estándar que fue probado y validado en varios laboratorios para el análisis de los glucosinolatos en las semillas oleaginosas (Brassica napus, colza, canola 16). Otros añaden a este método (por ejemplo, mediante la determinación de los factores de respuesta adicionales para glucosinolatos que no están presentes en violación de semillas oleaginosas) 17. A pesar de la creciente disponibilidad de plataformas de líquidos (LC-MS) de espectrometría de cromatografía de masa y protocolos de alto rendimiento para el análisis de glucosinolatos 18 , 19, el método HPLC-UV / PDA original, es aún ampliamente utilizado por los científicos. Las principales razones son que este método es sencillo, rentable y relativamente accesible a los laboratorios sin una extensa infraestructura de conocimiento-química analítica. Para servir a esta comunidad, que aquí detalladamente el protocolo para la extracción de glucosinolatos de materiales vegetales y el análisis de sus formas desulfo con HPLC-PDA.
Protocolo
1. Preparación de soluciones necesarias para la extracción glucosinolatos
- Preparar 500 ml de metanol al 70% (MeOH) en agua (ultrapura) en una botella de vidrio. Para 100 muestras y estándares de 5, 420 ml de 70% es necesaria MeOH.
- Preparar acetato de sodio 20 mM (NaOAc) (pH = 5,5) mediante la adición de 0,82 g de NaOAc o 1,36 g de NaOAc 3 x H 2 O en 500 ml de agua; ajustar el pH con cloruro de hidrógeno (HCl). Almacenar el NaOAc en el refrigerador. Para que se necesita 100 muestras y estándares de 5, 370 ml de acetato sódico 20 mM (pH = 5,5) en agua.
- Para preparar el material de la columna, la mezcla 10 g de gel de dextrano reticulado (tipo G-25) con 125 ml de agua ultrapura. Almacenar la mezcla resultante en un refrigerador (4 ° C).
- Preparación de la solución sulfatasa
- Disolver 10,000 unidades de aril sulfatasa (tipo H-1 de Helix pomatia) en 30 ml de agua ultrapura y añadir 30 ml de etanol absoluto (EtOH). Mezclar bien la solución y transferirla a uno CEN 250 mltrifuge tubo o varios tubos más pequeños, dependiendo de la disponibilidad.
- Centrifugar la mezcla a 2650 xg durante 20 min a temperatura ambiente (RT). Transferir el sobrenadante (s) a un vaso de precipitados; Agregar 90 ml de EtOH y se mezcla. Centrifugar la mezcla en uno o más tubos de centrífuga a 1.030 xg durante 15 min a TA.
- Descartar el sobrenadante. Disolver y combinar los gránulos en un total de 25 ml de agua ultrapura. Vortex así, dispensan en tubos de 1 mL, y almacenar en un congelador a -20 ° C; que se mantendrá durante al menos un año.
- Preparación de la solución de referencia sinigrin
- Pesar en torno a 9 mg de monohidrato sinigrin con 1-g exactitud (por ejemplo, 8,769 mg). Transferirla a un matraz aforado de 10 ml y disolver el monohidrato sinigrin en 10,0 ml de agua ultrapura.
- Calcular la molaridad de la solución madre y preparar cinco referencias sinigrina entre 50-750 mM por dilución de la solución madre. Para un ejemplo detallado, véase S1 del archivo .
- Prescindir de las diferentes referencias sinigrina en tubos de reacción de 1,5 ml y congelar a 20 ° C. Incluir una serie de cinco referencias sinigrina en cada lote de extracción. Utilice siempre los valores correctos para la molaridad utilizado actualmente sinigrin referencias para el cálculo de las concentraciones.
2. Preparación de la instalación de extracción
- Prepare un estante de la columna para las columnas pipeta Pasteur (para la preparación de columnas, véase el paso 3.1). Etiqueta de la cremallera o de las columnas para realizar un seguimiento de los números de las muestras (ver Figura 1).
- Preparar un bloque que sostiene el mismo número de la etiqueta tubos de microcentrífuga de 2 ml (véase la etapa 3.3 y la Figura 1)
5 / 55425fig1.jpg "/>
Figura 1: Rack para la extracción de glucosinolatos. Vista frontal (izquierda) y vista desde arriba (derecha) de un estante de la columna hecho a sí mismo y de bloques para la extracción de glucosinolatos. Altura: 100 mm, distancia entre agujeros cambió (para sostener las columnas pipeta Pasteur): 30 mm (eje x) x 15 mm (eje). Haga clic aquí para ver una versión más grande de esta figura.
3. Preparación de las columnas y tubos de microcentrífuga
- Preparar una columna por muestra y cinco columnas adicionales para las cinco muestras de referencia sinigrina.
- En cada una pipeta de vidrio, colocar un trozo de lana de vidrio de aproximadamente 1 cm x 1 cm. Use un palo de madera o de vidrio para empujar la lana de vidrio hasta el punto en el que la pipeta se estrecha. La lana de vidrio se debe evitar que el material de la columna se agote, pero no use demasiado, ya que se ralentizará la elución de las columnas. Utilizar guantes de WHen el trabajo con la lana de vidrio.
- Coloca las columnas de la rejilla columna (véase la Figura 1). Coloque la parrilla de la columna en una bandeja de laboratorio (bandeja de desechos) para atrapar a los eluyentes utilizados para los lavados de las columnas consecutivas.
- Cortar los primeros 5 mm de la punta de una punta de pipeta de 1 ml de plástico y una pipeta 0,5 ml de material de la columna preparada (G-25 gel en agua, véase el paso 1.3) en cada columna. Agite la botella que contiene el material de la columna antes de la pipeta. Eliminar las columnas con fugas (material G-25 se ejecuta a través de la capa de lana de vidrio) y sustituir por otros nuevos.
- Después de pipetear el material de la columna en las columnas, añadir 1 ml de agua ultrapura para enjuagar por la material.
- Prever un tubo de reacción de 2 ml por muestra y cinco tubos para las cinco muestras de referencia sinigrina; etiquetarlos. Use una aguja de disección para hacer agujeros en las tapas para después de la liofilización y colocar los tubos preparados en el bloque de tubo en el mismo patrón como elcolumnas (paso 2.2, véase la Figura 1).
4. Extracción de glucosinolatos
- Pesar se liofilizaron y material vegetal finamente molidas (normalmente 50,0 a 100,0 mg de peso seco; las concentraciones de glucosinolatos finales en el extracto debe estar en el rango de la curva de referencia) a la 0,1 mg en 2 ml, etiquetados, redondo tubos de reacción -fondo. Añadir dos pequeñas bolas de metal (3 mm de diámetro) como retardantes de ebullición a cada tubo.
NOTA: El protocolo también se puede aplicar a materiales frescos, flash-congelados, que han sido molidas en nitrógeno líquido y se mantuvieron congeladas hasta la extracción. Aumentar la cantidad de material pesado para la extracción y el porcentaje de MeOH en el líquido de extracción a 85% para compensar la dilución por el agua en los materiales 19. - Pipetear 1 ml de 70% de MeOH en cada tubo y vórtice brevemente. Cierre los tubos y se sellarán con tapas de seguridad antes de colocarlos lo más rápidamente posible en un caliente wbaño ater (90-92 ° C) durante algunos minutos (~ 5 minutos), hasta que el 70% de MeOH simplemente hierva. Precaución: Use gafas de seguridad durante este paso!
- Coloque los tubos de muestra en un baño ultrasónico durante 15 minutos. Mientras tanto, tomar la sulfatasa y las cinco muestras de referencia sinigrina fuera del congelador para descongelar a temperatura ambiente.
- Después de ultra-sonicación, centrifugar los tubos de muestra en 2700 xg en una centrífuga de mesa durante 10 minutos a RT; un pellet debe formar en cada tubo. Añadir los sobrenadantes de las columnas etiquetadas y pipeta de las cinco muestras de referencia en columnas separadas.
- Si bien pipeteando los sobrenadantes, mantener la punta más de la pastilla para evitar materiales vegetales pipeteo. Tenga en cuenta que cuando se utilizan muestras secas, el volumen de sobrenadante será menor que 1,0 ml.
- Añadir 1 ml de 70% de MeOH a los gránulos restantes en los tubos de muestra y agitar los tubos antes de colocarlos en un baño de ultrasonidos durante 15 min. Centrifugar los tubos de nuevo, como en el paso 4.4, y añadir la supernatantes a las respectivas columnas; debido a las propiedades del material de la columna, el grupo sulfato de carga negativa de los glucosinolatos será retenido específicamente en la columna.
- Se lavan las columnas con los extractos en tres etapas secuenciales.
- Pipetear 2 x 1 ml de 70% de MeOH en cada columna. Espere a que la columna se seque antes de agregar los próximos 1 ml; esto eliminará más compuestos apolares de los extractos (por ejemplo, clorofila).
- Enjuagar el MeOH mediante la adición de 1 ml de agua ultrapura a cada columna.
- Pipetear 2 x 1 ml de 20 mM NaOAc tampón para cada columna para crear las condiciones óptimas para la reacción de sulfatasa.
- Tome el bastidor con las columnas de la bandeja de desechos y secar los pies del bastidor con un pañuelo de papel. Coloque la parrilla sobre el bloque con los frascos y tubos etiquetados. Asegúrese de que cada punta de la columna se encuentra en la etiqueta correspondiente, tubo, de 2 ml (véase la Figura 1).
- Añadir 20 l de soluti sulfatasaa las columnas. Asegúrese de que la sulfatasa llega a la superficie del material de la columna. Pipeta de 50 l de tampón NaOAc en cada columna para limpiar abajo de la sulfatasa. Cubrir las columnas con papel de aluminio y dejar reposar durante la noche.
NOTA: Debido a las actividades de la sulfatasa, el grupo sulfato se eliminará, la liberación de los desulfoglucosinolates de la columna de modo que puedan eluir con el agua. Para una descripción detallada, consulte Crocoll et al. 19. - El día siguiente, eluir el desulfoglucosinolates pipeteando 2 x 0,75 ml de agua ultrapura a cada columna. Cuando todas las columnas se han secado, levante el estante de la columna y sacarlo de los tubos de reacción.
- Tape los tubos (asegúrese de que hay agujeros en las tapas) y congelarlos en nitrógeno líquido o en un congelador a -80ºC durante 30 min. Liofilizar las muestras durante 12 a 24 h (en función del número de muestras y la capacidad de la liofilizador) para eliminar toda el agua.
- Después de la liofilización, re-disuelve el residuo en un volumen exacto (generalmente 1,0 ml) de agua ultrapura. La transferencia de las muestras y las cinco referencias sinigrina a viales de HPLC etiquetados. Mantener las muestras en un refrigerador (4 ° C) durante un máximo de dos semanas o un congelador (-20 ° C) durante un máximo de un año antes de su análisis con HPLC.
- Dejar que el vidrio columnas se secan bajo el capó durante la noche y disponerlos en estado seco. Recuperar las bolas de metal de los tubos de muestra utilizados en el paso 4.5 para su reutilización y poner los tubos en el recipiente de eliminación de residuos.
5. Mediciones de HPLC de muestras extraídas
- Separar las glucosinolatos en una columna C18 de fase inversa (4,6 x 150 mm, 3 m, 300 Å) con un gradiente de acetonitrilo-agua (véase la Tabla 1) y un flujo de 0,75 ml / min y una temperatura de columna de 40 ° C . Realizar la detección y cuantificación a 229 nm.
- Medir las referencias sinigrina en la misma columna, pero con un gradiente adaptadoMétodo para reducir el uso de disolventes (véase la Tabla 2). Comenzar con la inyección de las cinco referencias sinigrina, a partir de la referencia con la concentración más baja. A continuación, inyectar las muestras, incluyendo una inyección de metanol (en blanco) después de cada décimo muestra para limpiar la columna, y para evitar que el arrastre de los picos.
| Tiempo [min] | Flujo [ml / min] | % Un agua | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 35 | 0.750 | sesenta y cinco | 35 |
| 40 | 0.750 | 98 | 2 |
| Temperatura de la columna 40 ° C. | |||
Tabla 1: gradiente de acetonitrilo-agua para la separación de glucosinolatos y analysis en HPLC de fase inversa.
| Tiempo [min] | Flujo [ml / min] | % Un agua | % B ACN |
| 1 | 0.750 | 98 | 2 |
| 10 | 0.750 | 89.3 | 10.7 |
| 11 | 0.750 | 98 | 2 |
| Temperatura de la columna 40 ° C. | |||
Tabla 2: acortado gradiente de acetonitrilo-agua para la cuantificación de las cinco referencias sinigrina utilizados para la cuantificación de glucosinolatos.
6. Identificación y Cuantificación de glucosinolatos
- Identificación
- Comparación de los tiempos de los espectros UV y retención de los picos en las muestras con vano comercialmentecapaces, referencias glucosinolatos puros. Vea la Figura 2 para ver ejemplos de espectros UV de las distintas clases de glucosinolatos.
- Identificar los glucosinolatos problema con los patrones de referencia o en LC-MS 18, 19, si es posible.
- Identificar los glucosinolatos desconocidos con la resonancia magnética nuclear (RMN), si es posible.
- Comparación de los tiempos de los espectros UV y retención de los picos con las de la Figura 2 y Tabla 3 referencias, bases de datos, o la literatura.

Figura 2. Espectros UV de las clases más comunes de glucosinolatos. espectros de absorción UV (200-350 nm) de seis desulfoglucosinolates (GSL), basada en soluciones hechas de compuestos de referencia disponibles en el comercio extraídos como se describe aquí, lo que representa las clases estructurales más comunes. El nombre común, esNombre STRUCTURALES (entre paréntesis), y la clase estructural se dan. (A) sinigrina (2-propenil GSL), alquenilo; (B) glucoerucın (4-methylthiobutyl GSL), thioalkenyl; (C) glucorafanina (4-methylsulfinlybutyl GSL), sulfinilo; (D) glucobrasicina (indol-3-ilmetil GSL), indol; (E) gluconasturtina (2-feniletil GSL), aromático; (F) sinalbina (4-hidroxibencil GSL), aromático. Haga clic aquí para ver una versión más grande de esta figura.
- Cuantificación
- Integrar el área bajo los picos de las cinco referencias sinigrina y las muestras.
- Calcular una curva de calibración de las cinco referencias sinigrina medido con base en el área integrada. Usar la ecuación de la recta de regresión (véase la Ecuación 1) para calcular la cantidad interpolada de glucosinolatos (ver Ecuación 2).
- Para calcular la concentración de los diferentes glucosinolatos, multiplicar la cantidad interpolado (x) por el factor de respuesta (M) para la detección a 229 nm de la CE (1990) 16, Buchner (1987) 15, o Brown et al. (1993) 17; los factores de respuesta de consenso de los desulphoglucosinolates más comúnmente detectados se dan en la Tabla 3.
NOTA: Los factores de respuesta pueden variar entre los sistemas-Esta puede ser la razón por la que existen diferentes valores dados por diferentes referencias (ver referencias 15-17). Sin embargo, los valores son en su mayoría muy cerca y en un rango similar con clases estructurales. Siguiendo la convención, establecer el factor de respuesta de glucosinolatos no identificados a 1, aunque para glucosinolatos indólicos desconocidos con un espectro de UV similar a la de glucobrasicina y otros glucosinolatos indólicos (Figura 2), sería aconsejable utilizar 0.25 como un factor de respuesta para obteneruna estimación realista de la concentración (Tabla 3). - Para calcular el importe final de glucosinolatos (x t) en la muestra, tomar el factor de dilución (D) y la masa de la muestra (w) que se utiliza para el análisis en cuenta (véase la ecuación 3).
 (1)
(1) 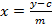 (2)
(2) 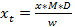 (3)
(3)
y = área de pico
m = pendiente de la curva de regresión 5-punto de referencia
c = la intersección de la línea de regresión con el eje y
x = cantidad de glucosinolatos en el extracto
x t = concentración de glucosinolatos en la muestra de la planta
D = factor de dilución
M = factor de respuesta para la detección a 229 nm de Buchner (1987) o Brown et al. (1993)
w = masa de la muestra utilizada para la extracción
Resultados
Este método permite la detección y separación de desulfoglucosinolates se encuentran comúnmente en todas las clases estructurales (Figura 3). El perjudiciales progoitrin 2-hydroxyglucosinolate viene relativamente temprano en el cromatograma y está claramente separada del glucorafanın glucosinolatos beneficiosa, la única methylsulfinylglucosinolate en esta muestra. Sinigrina, gluconapina, y glucobrassicanapin formar una serie eluotrópica de glucosinolatos alquenilo con longitudes de aumento de la cadena lateral (C3, C4, C5 y, respectivamente). Una serie lógica semejante es visible para los dos glucosinolatos methylthioalkenyl, glucoiberverin (C3) y glucoerucın (C4). Los picos de los tres glucosinolatos indólicos, glucobrasicina y sus derivados 4-hidroxi-1 y methoxyglucobrassicin (neoglucobrassicin), también están claramente separados. Cabe señalar que los picos de neoglucobrassicin y glucoerucın, así como gluconasturtina, la única gluco aromáticosinolate en esta muestra, son particularmente altas en este extracto Brassica debido a la adición de extractos de la raíz a la mezcla 9.
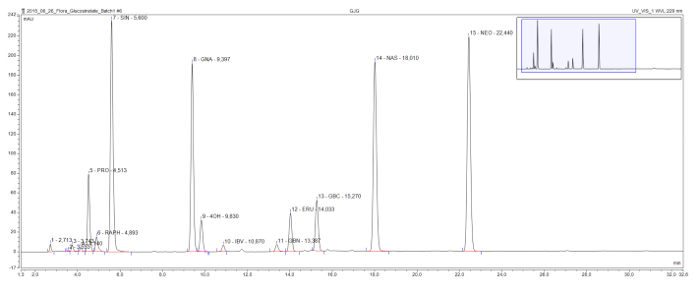
Figura 3: Cromatograma de un extracto de glucosinolatos. Detalle (1-32 min) de un cromatograma de HPLC resultante del análisis de las muestras combinadas de raíces y brotes de Brassica nigra, B. rapa, B. y oleracea. Las etiquetas de nivel indican el tiempo de retención y las abreviaturas de desulfoglucosinolates identificados (GSL). PRO = progoitrin (2-OH-3-butenilo GSL); RAPH = glucorafanın (4-methylsulfinlybutyl GSL); SIN = sinigrin (2-propenil GSL), GNA = gluconapina (3-butenilo GSL); 4OH = 4-hydroxyglucobrassicin; IBV = glucoiberverin (3-metiltiopropilo GSL); GBN = glucobrassicanapin (4-pentenilo GSL); ERU = glucoerucın (4-methylthiobutyl GSL); GBC = glucobrasicina (indol-3-ilmetil GSL); NAS = gluconasturtina (2-feniletil GSL); NEO = neoglucobrassicin (1-MeOH-glucobrasicina). Haga clic aquí para ver una versión más grande de esta figura.
Más largos glucosinolatos metilsulfinilo de cadena, que se encuentran comúnmente en la planta modelo Arabidopsis, también muestran una serie eluotrópica, como se ve en un extracto de raíz de Rorippa austriaca. Glucohesperalin (C6), glucosiberin (C7), glucohirsutin (C8), y glucoarabin (C9) aparece a intervalos regulares en el cromatograma (Figura 4). Junto con los espectros UV de los picos, tal serie lógica eluotrópica se puede usar para clasificar y provisionalmente identificar, glucosinolatos desconocidos.
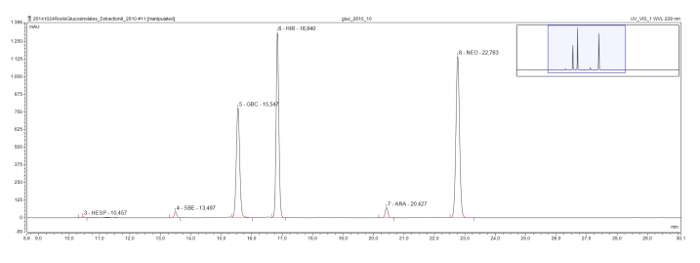
Figura 4: Cromatograma (marco de 9-30 min) De los desulfoglucosinolates en un extracto de raíz de Austrian Rorippa. Las etiquetas de nivel indican el tiempo de retención y las abreviaturas de desulfoglucosinolates identificados (GSL). HES = glucohesperin (6-methylsulfinylhexyl GSL); SBE = glucosiberin (7-methylsulfinylheptyl GSL); GBC = glucobrasicina (indol-3-ilmetil GSL); HIR = glucohirsutin (8-methylsulfinlyoctyl GSL); ARA = glucoarabin (9-methylsulfinylnonylglucosinolate); NEO = neoglucobrassicin (1-MeOH-glucobrasicina). Haga clic aquí para ver una versión más grande de esta figura.
| Nombre común | Estructura de cadena lateral | Rt (min) * | 229 nm | referencia# |
| aliphatic glucosinolatos | ||||
| Glucocapparin | metilo | 3.5 | 1 | marrón |
| sinigrin | 2-propenilo | 5.5 | 1 | Brown, CE |
| gluconapina | 3-butenilo | 9.5 | 1.11 | CE |
| Glucobrassicanapin | 4-pentenilo | 13.5 | 1.15 | CE |
| Glucoiberverin | 3-metiltiopropilo | 10.9 | 0,8 | marrón |
| glucoerucın | 4-methylthiobutyl | 14.0 | 0,9 | marrón |
| Glucoiberin | 3-methylsulfinylpropyl | 3.7 | 1.2 | marrón |
| glucorafanın | 4-methylsulfinylbutyl | 4.9 | 0,9 | marrón |
| Glucoalyssin | 5-methylsulfinylpentyl | 7.6 | 0,9 | marrón |
| Glucohesperin | 6-methylsulfinylhexyl | 10.5 | 1 | marrón |
| Glucosiberin | 7-methylsulfinylheptyl | 13.5 | 1 | marrón |
| Glucohirsutin | 8-methylsulfinyloctyl | 16.8 | 1.1 | marrón |
| Glucoarabin | 9-methylsulfinylnonyl | 20.5 | 1 | |
| Glucocheirolin | 3-methylsulfonylpropyl | 4.2 | 0,9 | marrón |
| Progoitrin | 2 (R) -OH-3-butenilo | 4.5 | 1.09 | Buchner, EC |
| Gluconapoleiferin | 2-OH-5-pentenilo | 8.3 | 1 | CE |
| glucosinolatos indólicos | ||||
| 4-hydroxyglucobrassicin | 4-hidroxiindol-3-ilmetil | 11.2 | 0.28 | Buchner, EC |
| glucobrasicina | indol-3-ilmetil | 15.3 | 0.29 | Buchner, EC |
| 4-Methoxyglucobrassicin | 4-metoxiindol-3-ilmetil | 18.2 | 0.25 | Buchner, EC |
| Neoglucobrassicin | 1-metoxiindol-3-ilmetil | 22.5 | 0,2 | Buchner, EC |
| glucosinolatos aromáticos | ||||
| sinalbina | 4-hidroxibencil | 8.1 | 0,5 | Buchner |
| Glucosibarin | 2 (R) -OH-2-feniletil | 12.1 | 0,95 | ver siguiente |
| Glucobarbarin | 2 (S) -OH-2-feniletil | 12.7 | 0.95 | Buchner |
| Glucotropaeolin | bencilo | 13.8 | 0.95 | Buchner, EC |
| gluconasturtina | 2-feniletilo | 18.0 | 0.95 | Buchner, EC |
| desconocido - alifáticos / aromáticos como el espectro UV | 1 | CE | ||
| desconocido - indol como espectro | 0.25 | CE | ||
| * Tiempo de retención aproximado (Rt) redondeado en 0,1 min (± 0,3 min dependiendo de la columna, la calidad de eluyente). Los tiempos de retención se determinan en plataformas ThermoFisher / Dionex último HPLC equipado con una columna C 18 (150 x 4,6 mm, tamaño de partícula 3 micrómetros) más C 18 precolumna (10 x 4,6 mm, tamaño de partícula 5 micrómetros) con un programa de gradiente como en la Tabla 1. | ||||
| # Referencias para los factores de respuesta: Buchner, R. en glucosinolatos en colza (ed JP Wathelet) 50-58 (Martinus Nijhoff Publishers, 1987); Brown, PD, Tokuhisa, JG, Reichelt, M. & Gershenzon, J. Variación de la acumulación de glucosinolatos entre los diferentes órganos y etapas de desarrollo de Arabidopsis thaliana. Fitoquímica. 62 (3), 471-481, doi: 10.1016 / S0031-9422 (02) 00549-6, (2003); CE. semillas oleaginosas - Determinación de glucosinolatos cromatografía líquida de alta. Diario Oficial de las Comunidades Europeas. L 170/28. Anexo VIII 03.07.27-34 (1990). | ||||
Tabla 3: Factores de respuesta de los más comúnmente encontrado desulfo-glucosinolatos en extractos de plantas y sus tiempos de retención aproximados en C 18 columnas. Eluyentes, gradient, temperatura de la columna, y la tasa de flujo como en la Tabla 1.
Discusión
Las mayores ventajas de este método establecido y ampliamente utilizado es que es robusto, bastante sencillo, y relativamente bajo costo por muestra. La mayoría de los equipos necesarios para la extracción y el análisis deben estar disponibles en un laboratorio estándar o puede ser auto-construida, con la excepción de la HPLC-PDA. Otra ventaja es que desulfoglucosinolates disueltos en agua son químicamente muy estable cuando se mantiene fresco y en viales (HPLC) estancos al aire, por lo que los extractos pueden ser fácilmente enviadas para el análisis de HPLC en otros lugares. En contraste con las plataformas LC-MS, que requieren formación y amplia experiencia práctica de la gestión del software y el análisis de los datos especializadas, HPLC-UV / PDA se pueden ejecutar con facilidad después de un corto periodo de formación. Esto no sólo reduce los costes del procedimiento, sino que también hace que este método sea más accesible a una amplia gama de los científicos, incluyendo a los estudiantes.
Generalmente, cuando los procedimientos descritos anteriormente se siguen carefuLLY, deben producirse algunos problemas. En general, los picos de glucosinolatos están muy bien separados en el cromatograma. Si este no es el caso, el programa de gradiente podría adaptarse por la disminución de la tasa de aumento de acetonitrilo en el eluyente. Por otra parte, la construcción de una nueva pre-columna (200-500 inyecciones) o columna (1.500 -2.000 inyecciones) puede resolver el problema. De vez en cuando, cromatogramas de muestras individuales en un lote pueden mostrar muy pequeño o ningún pico. Esto es generalmente debido a los errores de pipeteo cuando se añade la sulfatasa (por ejemplo, una columna o se ha omitido la sulfatasa no se lava adecuadamente hacia abajo en la columna). Por otra parte, la concentración de glucosinolatos en los materiales experimentales pueden haber sido menor de lo esperado y se utilizó muy poco material para la extracción. Si el último es el caso, el volumen de inyección se puede incrementar a 100 l, o una parte alícuota exacta (por ejemplo, 800 l) del extracto puede ser concentrado. Este último podría lograrse mediante secado por congelacióning el extracto, disolviendo el residuo en un volumen más pequeño (por ejemplo, 100 l) de agua, y reinyectar usando la misma curva de referencia. En los cálculos de la concentración original del extracto, los números deben ser multiplicados por el factor de dilución. Si esto no resuelve el problema, los materiales deben ser extraídos de nuevo utilizando más material de partida. Si esta es más de 100 mg, el volumen de los disolventes de extracción y el tamaño de los tubos deben ajustarse proporcionalmente para mantener la eficacia de la extracción.
Una ventaja adicional es que este método ha sido bien validado. Esto se debe a que ha sido descrito como un método estándar para la cuantificación de los glucosinolatos en semilla de colza, para los que se confirmaron los procedimientos y exactitud en varios laboratorios 16. Además, los antecedentes genéticos, la biosíntesis, y funciones biológicas de glucosinolatos están sujetas a intensos esfuerzos de investigación, en el modEL especies de plantas Arabidopsis thaliana entre otros 4, 6, 12. Por lo tanto, muchos factores de respuesta para la cuantificación exacta de desulfoglucosinolates en relación con sinigrin están bien definidos y disponibles públicamente 15,17. A pesar de que los protocolos basados en LS-MS son más de alto rendimiento, más sensible, y son capaces de (tentativamente) identificar glucosinolatos para los que no hay normas están disponibles 18, 19, 20, la falta de factores de respuesta universales para LC-MS limita la la cuantificación exacta de las concentraciones de glucosinolatos 18. Además, estos métodos generalmente no incluyen una etapa de liofilización, y la cantidad de agua en el material de planta fresca es no contabilizado en los cálculos, por lo que la cuantificación exacta difícil. Por último, porque nuestro método de extracción consiste en una columna de basela purificación y la etapa de concentración, también se puede aplicar a muestras "sucias" con bajas concentraciones de glucosinolatos, como los suelos 21.
En comparación con los métodos basados en LC-MS que por lo general extraen recién materiales congelados, utilizan placas de 96 pocillos para la extracción, y no incluyen una etapa de sulfatasa 18, 19, nuestro método es relativamente mucho tiempo y mano de obra intensa. Con los bastidores de las columnas descritas en el presente documento, una sola persona puede extraer cerca de 100-150 muestras en un solo día. Elución (día siguiente), secado por congelación (durante la noche), y volver a disolver puede tener lugar dentro de los siguientes dos días. Con un inyector automático de HPLC, un tiempo de ejecución y el equilibrio de 40-45 minutos por inyección, y que no surjan imprevistos, se tardaría 3-4 días para adquirir los datos para este conjunto de muestras. Cuando el software de HPLC permite la cuantificación automática basada en la curva sinigrin, una comprobación manual de los cromatogramas y PEak asignaciones para 100 muestras sólo podrán tomar otro 1 o 2 horas antes de que los datos pueden ser utilizados para los análisis estadísticos.
A pesar de la creciente disponibilidad de las normas de glucosinolatos, sólo una pequeña fracción de los más de 130 candidatos actualmente se puede adquirir en el comercio. Sin embargo, con algunas referencias para cada una de las clases de biosíntesis; el acceso a bases de datos bibliográficas que especifican los compuestos que se encuentran previamente en las especies de plantas (por ejemplo, Fahey et al. 22); conocimiento básico de los principios cromatográficos, tales como la lógica de la serie eluotrópica (por ejemplo, para un número creciente de Cs en la cadena lateral en los compuestos alifáticos, las Figuras 3 y 4); y la validación de las muestras individuales en LC-MS 19 o glucosinolatos aislados en RMN 23, uno puede fácilmente superar esta limitación. La mayoría de los protocolos para el análisis de glucosinolatos utilizar curvas de referencia internos(Es decir, una cierta concentración para la extracción de sinigrin o sinalbina un disolvente de extracción 16, 17, 19). Principalmente, las curvas de referencia internos son más apropiados para corregir los errores de procesamiento de muestras individuales y, por tanto, teóricamente, producir una mayor precisión. A pesar de esta ventaja, se prefiere utilizar una curva de referencia externa de cinco puntos, ya que a menudo analizamos diferentes especies silvestres, algunas de las cuales contienen altos niveles de sinigrin (por ejemplo, Brassica nigra 24) o sinalbina (por ejemplo, Sinapis alba 25), el dos referencias de glucosinolatos para el que los factores de respuesta están disponibles. Por otra parte, la adición de estándares internos para cada muestra aumenta el costo de los análisis, como patrones de referencia de glucosinolatos de alto grado suelen ser bastante caros.
En conclusión, a pesar de los pasos que requieren mucho tiempo, este protocoloproporciona un método sencillo y accesible para extraer y cuantificar los glucosinolatos en muestras de plantas. Sin embargo, es importante tener en cuenta que los niveles de glucosinolatos en sí son sólo una indicación de la potencial actividad biológica, visto como la necesidad de reaccionar con mirosinasa, y la variación en los productos de reacción se pueda derivar de un único glucosinolatos 11. Los ensayos de validación deben llevarse a cabo para confirmar la relevancia biológica.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
NMvD thanks Dr. Michael Reichelt (Max-Planck-Institute for chemical Ecology, Jena, Germany) for providing the first reference samples when she started using this method 16 years ago. Ciska Raaijmakers (NIOO-KNAW, Wageningen, the Netherlands), Sebastian Krosse (B-Ware, Nijmegen, the Netherlands), and Christian Ristok (iDiv, Leipzig) are acknowledged for improving the protocol over the course of the years. Mirka Macel and Martine Huberty (University Tübingen, Germany) are acknowledged for their permission to use the Rorippa chromatogram. The authors gratefully acknowledge the support of the German Centre for Integrative Biodiversity Research (iDiv) Halle-Jena-Leipzig, funded by the German Research Foundation (FZT 118).
Materiales
| Name | Company | Catalog Number | Comments |
| Methanol HiPerSolv CHROMANORM® gradient grade for HPLC grade | VWR | 20864.320 | |
| Sodium acetate (NaOAc) | Sigma-Aldrich | W302406-1KG-K | |
| HCl | VWR | 1.09057.1000 | |
| Sephadex | Sigma-Aldrich | A25120-10G | |
| (−)-Sinigrin hydrate from horseradish | Sigma-Aldrich | S1647-500MG | |
| Aryl Sulfatase | Sigma-Aldrich | S9626-10KU | |
| Ethanol | VWR | 20816.298 | |
| Pasteur Pipette | Carl Roth | 4518.1 | |
| Glass Wool | Carl Roth | 7377.1 | |
| Glass/wooden stick | VWR | HERE1080766 | |
| 2 mL reaction tubes | VWR | 211-2120 | |
| Dissecting needle | Carl Roth | KX93.1 | |
| Rotilabo-lab dishes | Carl Roth | 0772.1 | Waste tray |
| Rotilabo-sealing clips | Carl Roth | N217.1 | |
| Freeze Dryer Freezone 12 L | Labconco | 7960030 | |
| Acetonitril super gradient grade | VWR | 83639.320 | |
| Water bath | VWR | 462-5112 | |
| Ultrasonic bath | Fisher Scientific | FB 15061 | |
| PH Electrode | Thermo Fisher Scientific | STARA2115 | |
| Centrifuge Heraeus Multifuge X1 | Thermo Fisher Scientific | 75004210 | |
| Pre-Column | Thermo Fisher Scientific | 69697 | C18 column (4.6 x 10 mm, 5 µm, 300 Å) |
| Column Acclaim 300 | Thermo Fisher Scientific | 60266 | C18 column (4.6 x 150 mm, 3 µm, 300 Å) |
| HPLC Ultimate 3000 | Thermo Fisher Scientific | with column oven and UV or PDA detector | |
| Flask 1,000 mL | VWR | 215-1595 | |
| Glucosinolate reference compounds | Phytoplan | various | http://www.phytoplan.de/ |
Referencias
- Hartmann, T. From waste products to ecochemicals: Fifty years research of plant secondary metabolism. Phytochemistry. 68 (22-24), 2831-2846 (2007).
- Will, H., Laubenheimer, A. Ueber das Glucosid des weissen Senfsamens. Justus Liebigs Annalen der Chemie. 199 (1), 150-164 (1879).
- Agerbirk, N., Olsen, C. E. Glucosinolate structures in evolution. Phytochemistry. 77, 16-45 (2012).
- Halkier, B. A., Gershenzon, J. Biology and biochemistry of glucosinolates. Ann Rev Plant Biol. 57, 303-333 (2006).
- Sønderby, I. E., Geu-Flores, F., Halkier, B. A. Biosynthesis of glucosinolates - gene discovery and beyond. TIPS. 15 (5), 283-290 (2010).
- Kliebenstein, D. J., et al. Genetic control of natural variation in Arabidopsis glucosinolate accumulation. Plant Physiol. 126 (2), 811-825 (2001).
- van Leur, H., Raaijmakers, C. E., van Dam, N. M. A heritable glucosinolate polymorphism within natural populations of Barbarea vulgaris. Phytochemistry. 67 (12), 1214-1223 (2006).
- Kelly, P. J., Bones, A., Rossiter, J. T. Sub-cellular immunolocalization of the glucosinolate sinigrin in seedlings of Brassica juncea. Planta. 206 (3), 370-377 (1998).
- van Dam, N. M., Tytgat, T. O. G., Kirkegaard, J. A. Root and shoot glucosinolates: a comparison of their diversity, function and interactions in natural and managed ecosystems. Phytochem Rev. 8 (1), 171-186 (2009).
- Ratzka, A., Vogel, H., Kliebenstein, D. J., Mitchell-Olds, T., Kroymann, J. Disarming the mustard oil bomb. Proc Natl Acad Sci U S A. 99 (17), 11223-11228 (2002).
- Wittstock, U., Kliebenstein, D. J., Lambrix, V., Reichelt, M., Gershenson, J., Romeo, J. T. . Integrative Phytochemistry: From ethnobotany to molecular ecology: Recent Advances in Phytochemistry. 37, (2003).
- Hopkins, R. J., van Dam, N. M., van Loon, J. J. A. Role of glucosinolates in insect-plant relationships and multitrophic interactions. Ann Rev Entomol. 54 (1), 57 (2009).
- Kliebenstein, D. J., Gershenzon, J., Mitchell-Olds, T. Comparative quantitative trait loci mapping of aliphatic, indolic and benzylic glucosinolate production in Arabidopsis thaliana leaves and seeds. Genetics. 159 (1), 359-370 (2001).
- Mithen, R., Bennett, R., Marquez, J. Glucosinolate biochemical diversity and innovation in the Brassicales. Phytochemistry. 71 (17-18), 2074-2086 (2010).
- Buchner, R., Wathelet, J. P. . Glucosinolates in rapeseed. , 50-58 (1987).
- . Oil seeds - determination of glucosinolates High Perfomance Liquid Chromatography. Official Journal of the European Communities. , 27-34 (1990).
- Brown, P. D., Tokuhisa, J. G., Reichelt, M., Gershenzon, J. Variation of glucosinolate accumulation among different organs and developmental stages of Arabidopsis thaliana. Phytochemistry. 62 (3), 471-481 (2003).
- Glauser, G., Schweizer, F., Turlings, T. C. J., Reymond, P. Rapid Profiling of Intact Glucosinolates in Arabidopsis Leaves by UHPLC-QTOFMS Using a Charged Surface Hybrid Column. Phytochem Analysis. 23 (5), 520-528 (2012).
- Crocoll, C., Halkier, B. A., Burow, M. . Current Protocols in Plant Biology. , (2016).
- Griffiths, D. W., Bain, H., Deighton, N., Botting, N. P., Robertson, A. A. B. Evaluation of liquid chromatography-atmospheric pressure chemical ionisation-mass spectrometry for the identification and quantification of desulphoglucosinolates. Phytochem Analysis. 11 (4), 216-225 (2000).
- Gimsing, A. L., Kirkegaard, J. A. Glucosinolates and biofumigation: fate of glucosinolates and their hydrolysis products in soil. Phytochem Rev. 8 (1), 299-310 (2009).
- Fahey, J. W., Zalcmann, A. T., Talalay, P. The chemical diversity and distribution of glucosinolates and isothiocyanates among plants. Phytochemistry. 56, 5-51 (2001).
- de Graaf, R. M., et al. Isolation and identification of 4-α-rhamnosyloxy benzyl glucosinolate in Noccaea caerulescens showing intraspecific variation. Phytochemistry. 110, 166-171 (2015).
- van Dam, N. M., Raaijmakers, C. E. Local and systemic induced responses to cabbage root fly larvae (Delia radicum) in Brassica nigra and B. oleracea. Chemoecology. 16 (1), 17-24 (2006).
- Gols, R., et al. Temporal changes affect plant chemistry and tritrophic interactions. Bas Appl Ecol. 8 (5), 421-433 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados