Method Article
많은 샘플을 이용한 실험에서 토양 미생물을 특성화하기위한 지질 추출 및 분석 방법
요약
이 논문은 많은 샘플을 가진 연구에서 토양 미생물 군집 구조를 결정하기 위해 총 지질과 지표 지질의 상대적 양을 특성화하는데 사용하기 위해 미생물의 세포막으로부터 지질 추출을위한 노력과 정확성을 균형있게 유지하면서 처리량을 증가시키는 방법을 기술한다.
초록
미생물 군은 생태계 과정의 중요한 동인이자 규제자이다. 생태계 관리가 미생물 군집에 어떻게 영향을 미칠 수 있는지 이해하기 위해, 미생물 군집 구성을 분석하기위한 상대적으로 정확하지만 노력이 많이 필요한 기술은 인지질 지방산 (PLFA) 분석입니다. PLFA는 인지질 바이오 마커를 분석하기 위해 개발되었으며 미생물 바이오 매스 및 곰팡이 및 박테리아의 광범위한 기능성 그룹의 구성 요소로 사용될 수 있습니다. 대체로 식물 공동체, 생태계 및 관리 체제 하에서 토양을 비교하는 데 일반적으로 사용되었습니다. PLFA 방법은 미생물 군집 구성의 변화를 감지하는 데 민감한 것으로 나타났습니다.
지방산 메틸 에스테르 추출 및 분석법 (MIDI-FA)은 인지질 분획을 분리하지 않고 순수한 배양 물로부터 미생물 확인 기술로서 총 지질을 신속하게 추출하기 위해 개발되었다. 이 방법은신속하지만 토양 시료에 적합하지 않은 이유는 토양 입자를 분리하는 초기 단계가 없기 때문이며 토양 중 배경 유기물로 인한 인공물을 생성하는 비누화 반응으로 시작하기 때문입니다.
이 논문은 많은 샘플을 가진 연구에서 토양 미생물 군집 구조를 결정하기 위해 총 지질과 지표 지질의 상대적 양을 특성화하는데 사용하기 위해 미생물의 세포막에서 지질 추출을위한 노력과 정확성을 균형있게 유지하면서 처리량을 증가시키는 방법을 설명합니다. 이 방법은 PLFA 프로파일 링을 통해 얻은 정확성을 토양 지질을 추출 및 농축하는 첫 단계로 추출하고 추출 된 유기 물질을 비누화하고 MIDI-FA 방법으로 처리하여 노력을 줄이는 것이 두 번째 단계입니다.
서문
영양주기 1 에서 미생물의 중요한 역할을 감안할 때, 식물 군집 구성 2의 수정, 식물 생산성 3의 규제 및 유기물 4의 분해를 고려하여 토양 미생물 군을 이해하는 것은 육상 생태계를 이해하는 데 필수적입니다.
토양에있는 그들의 상대적으로 높은 풍부 및 그들의 화학 서명 때문에, 지질 biomarkers는 토양 미생물 지역 사회 5를 함유하는 지배적 인 생태 그룹을 윤곽을 그리기 위하여 이용 될 수있다. 다양한 미생물 그룹의 특성 인 지질 바이오 마커를 정량화하여 총 지질을 추정 한 다음 그 지질을 그램 양성균 (Gm +) 및 그람 음성균 (Gm-) 박테리아, arbuscular mycorrhizal (AM) 및 saprotrophic 균류 및 방선균 5 , ss = "xref"> 6 , 7 , 8 .
미생물 군집의 측면을 특성화하기위한 많은 방법이 있습니다. PLFA 방법은 기본적인 미생물 군집 구조를 이해하는 데 일반적으로 사용되는 방법입니다. 총 미생물 바이오 매스뿐만 아니라 미생물 그룹의 상대적 존재 량을 평가하는 효과적인 방법입니다. 급속한 지질 전환으로 인해 PLFA 프로파일 링은 토양 미생물 군집의 변화를 상대적으로 빠르게 탐지 할 수있게 해주 며 생태계 기능, 예를 들어 곰팡이와 박테리아 비율을 비교하여 양분 순환 속도를 평가할 수있는 정보를 제공합니다 1 , 9 , 10 . 그러나 PLFA 추출 방법은 시간을 존중 받고 존경 받지만 시간이 많이 걸리고 현장 규모 복제물에서 많은 샘플을 요구하는 생태계 규모 연구에 잘 적응하지 못합니다f "> 11 , 12 .
반대로, 지방산 메틸 에스테르 추출법 (MIDI-FA)은 신속한 처리량을 가능하게합니다. 이 방법에서는 샘플을 비누화하고 FAME으로 변환하고 추출한 다음 분석합니다. MIDI-FA 방법은 다른 지질 종류 13 (인지질, 중성 지질 및 당지질)의 분리와 함께 지질 추출을 결합하는 PLFA보다 신속하지만 차별성이 적습니다.
이 프로토콜에서는 PLFA와 MIDI-FA 지질 프로파일 링의 요소를 결합하는 방법을 설명합니다. 그것은 개량 된 Bligh and Dyer 방법의 초기 클로로포름 추출 단계를 사용하여 지질 추출을 수행 한 다음 비누화 및 FAMEs 로의 전환을 사용합니다. 이 비 미생물 재료 (5), (14)에서 배경 잡음의 많은 부분을 제외하면서 미생물 군집 구조를 감지 할 수있는 강력한 방법을 제공합니다 . 이 방법은, 즉 PLFA 및 MIDI-FA 프로토콜, 둘 사이의 균형을 달성하기는 물류 및 경제적으로 많은 샘플 (15)와 대규모 연구에서 지질을 분석 할 수 있도록 처리량을 증가시키는 동시에 정확도의 대부분을 유지하기 위해 개발되었다. MIDI-FA를 수행하기 전에 초기 추출을 수행하고 유기 용해성 성분 ( 예 : 지질)을 분리하고 정화 단계로이를 완료함으로써 프로토콜은 속도와 정밀도 간의 균형을 제공합니다.
프로토콜
참고 : 항상 적절한 개인 보호 장비 (PPE)를 착용하십시오. 잠재적 인 시료 오염을 피하려면 맨손으로 유리 제품을 만지지 마십시오. 클로로포름 처리가 필요한 프로토콜 단계를 실행할 때는 적절한 장갑을 착용하십시오.
1. 준비 (~ 40 샘플 2 일)
- 흙을 모아서 멸균 봉투에 넣고 얼음이 든 쿨러에서 들판에서 옮깁니다. 신선한 토양을 체질하고 건조를 즉시 멈출 수없는 경우, 분석을 시작할 준비가 될 때까지 샘플을 -80 ° C의 냉동고에 보관하십시오.
- 균질화하여 토양을 준비하십시오. 뿌리와 돌을 제거하고 거친 체질 ( 예 : 2 mm)로 덩어리를 분해하십시오.
- 동결 건조기 설명서의 지침에 따라 적절한 용기에 시료를 넣고 가능한 한 빨리 동결 건조하여 동결 건조를 준비하십시오. 일단 토양이 동결 건조되면 추출 될 때까지 건조제가 든 밀폐 용기에 보관하십시오. 그것은 s에게 최상이다동결 건조 토양은 최소 -20 ° C, 바람직하게는 -80 ° C에서 찢는다.
- 추출을 준비 할 때, 동결 건조 된 토양을 저장에서 제거하고 밀가루와 같은 점성으로 분쇄하십시오. 분쇄 방법은 볼 밀, 볼 비터 및 모르타르 및 유봉을 포함한다. 토양을 갈아서 냉장고에 보관하십시오 (1.3 참조).
참고 : 추출에 사용되는 시료의 양은 유기물 함량에 따라 다릅니다. 일반적인 지침은 탄소 12 ~ 18 %, 탄소 1 ~ 3 %의 토양 3 ~ 5 g을 0.5 ~ 1 g의 토양으로 사용하는 것입니다. - 헥산으로 30 mL 원심 분리 튜브를 미리 헹구십시오. 약 2 ~ 3 mL의 헥산을 튜브에 넣고 5 초간 볼 텍싱한다. 헥산을 다른 관에 따라 옮기고 와동하십시오. 헥산 (2 ~ 3 mL)을 6 개의 튜브를 연속적으로 헹구기 위해 사용할 수 있습니다. 흄 후드에서 헥산으로 헹구어 진 튜브를 뒤집어 보관하고 사용 된 헥산을 적절한 폐기 용기에 폐기하십시오.
- 유리를 2 ~ 3 층의 알루미늄 호일로 싸서 머플로에 넣습니다. 빵 굽기(muffle) 유리 제품을 450 ° C에서 4.5 시간 동안 가열합니다.
- 시약 준비.
- 클로로포름 : 인산 완충액 (P 버퍼) 2 부피비 1 : 사용 된 토양 량 들어, 0.8의 화학 물질을 추가의 MeOH.
- P- 버퍼 용액 준비 : 인산염 완충액 : 0.1M, pH 7.0.
- 1M K 2 HPO 4 스톡 61 mL를 살균합니다 (화학 약품은 ACS 인증 등급 이상이어야 함). 1 M KH 2 PO 4 스톡 39 mL를 살균하십시오 (화학 약품은 ACS 인증 등급 이상이어야 함). Type 1 물로 1000 mL로 채 웁니다. NaOH 또는 HCl로 pH를 7.0으로 조정한다. 주변 온도에서 최대 7 일 동안 또는 냉장고에서 30 일 동안 사용하지 않는 용액을 보관하십시오.
- 대안으로, K 2 10.62 g HPO 4 KH 2 PO 4 5.31 g을 달아; 1 l의 물로 1 L로 희석한다. pH를 확인하고 필요한 경우 조정하십시오.
- 시약 준비 1, 비누화 시약.
- Type 1 물 300 mL를 분배합니다.CH 3 OH (HPLC 등급 이상) 300 mL를 넣는다. 90.00g의 NaOH (ACS 이상 인증)를 첨가하십시오. 저어 주면서 용액에 NaOH 펠릿을 넣는다. 알갱이가 녹을 때까지 저어 준다. 이 용액은 30 d 이하로 보관하는 것이 좋습니다.
- 시약 2, 메틸화 시약 준비.
- CH 3 OH (HPLC 등급 이상) 275 mL를 분배합니다. 저어 주면서 6.00 N HCL 325 mL를 첨가한다. 이 용액은 30 d 이하로 보관하는 것이 좋습니다.
- 시약 3, 추출 시약 준비 : 50 % C 6 H 14 (헥산), 50 % C 5 H 12 O (MTBE).
- 흄 후드에서 C 6 H 14 (HPLC 등급 이상) 200 mL와 C 5 H 12 O (HPLC 등급 이상) 200 mL를 합친다. 잘 섞다; 모자를 단단히 조입니다. 가연성 캐비닛 또는 흄 후드에 1 년 이상 보관하십시오.
- 시약 4,베이스 세척 시약 준비.
- 분배 9001 mL의 물을 비이커에 첨가 할 것. 저어 주면서 10.80 g의 NaOH (공인 ACS 이상)를 첨가한다. 알갱이가 녹을 때까지 저어 준다. 이 용액은 30 d 이하로 보관하는 것이 좋습니다.
- 내부 표준 용액을 준비하십시오.
- 100mg의 19 : 0 EE 표준 물질의 무게를 잰다. 50 mL의 헥산 세척 부피 플라스크에 넣는다. 15 mL의 헥산 -MTBE 용액 (시약 3)을 플라스크에 넣고 교반하면서 소용돌이 친다. 헥산 -MTBE 용액 (시약 3)으로 50 mL로 내 렸습니다. 모자와 소용돌이가 혼합. PTFE 라이닝 캡으로 헥산으로 헹궈 낸 유리 튜브로 옮기고 -20 ° C에서 보관하십시오.
2. 1 일 - 토양에서 지방산 추출 (~ 40 개 시료의 경우 4 ~ 5 시간)
- P- 완충액, 클로로포름 및 메탄올을위한 5 ~ 10 mL 분배 피펫 세 개를 준비하십시오.
참고 : 클로로 프롬에 대한 덜 위험한 대안이 추출 물질로 제안되었습니다. 이들은 해당하는 지질 회수율 (16)이 발생할 수 있습니다 , 17 이지만이 프로토콜에서는 평가되지 않습니다. - 동결 건조 토양의 무게를 달아 30 mL 원심 분리 튜브에 넣고 토양 질량을 기록하십시오.
- 두 개의 공란을 만들고 검사 표준 (이전에 추출 된 토양)을 포함시킵니다.
- 흄 후드에서, 다음과 같은 순서로 원심 분리 튜브에 토양에 시약을 추가 P 버퍼, 클로로포름 및 메탄올 (표 1). 토양 시간은 클로로포름을 첨가하기 전에 P 완충액 첨가 후 젖은 허용. 원심 분리기 튜브를 단단히 막고 빛으로부터 보호하십시오.
- 셰이커에 수평으로 올려 놓습니다. 280 rpm의 속도 설정에서 1 시간 동안 흔들어주십시오. 18 .
- 다음과 같이 각각의 샘플에 대한 두 개의 16mm X 150mm 유리 튜브 준비 : 튜브 라벨과 클로로포름의 동일한 부피 P 버퍼 동량을 추가한다.
- 쉐이커에서 원심 분리 튜브를 제거하고 1,430에서 10 분간 원심 분리하십시오.xg 및 25 ° C. 상분리는 유리관에서 볼 수 있어야합니다.
- 흄 후드에서 원심 분리 튜브의 상등액을 2.6 단계에서 준비한 튜브 중 하나에 버린다. 2.4 ~ 2.5 단계를 반복하고 상층 액을 두 번째 튜브로 옮긴다.
- 모든 16mm × 150mm 유리관에 PTFE가 라이닝 된 캡으로 단단히 고정시키고 10x를 뒤집어 혼합하십시오.
- 샘플을 밤새 그대로 두어 두 단계의 분리를 완료하십시오. 이렇게하려면 샘플을 어두운 캐비닛 / 공간에 보관하거나 상온에서 알루미늄 호일로 덮으십시오. 주말에 추출물을 분리하는 것이 허용됩니다.
- 또는 다음 단계로 직접 이동하고자하거나 샘플이 다음 날에 방해가된다면 1,000 xg 및 25 ° C에서 10 분 동안 시료를 원심 분리하십시오.
참고 : 비교 그룹 내의 모든 시료에 동일한 상분리 대기 시간을 두십시오.
- 또는 다음 단계로 직접 이동하고자하거나 샘플이 다음 날에 방해가된다면 1,000 xg 및 25 ° C에서 10 분 동안 시료를 원심 분리하십시오.
3. DAY2 - 지질 분리 (~ 40 개 시료의 경우 3 ~ 4 시간)
- 증발 장치 및 용매 트랩을 켭니다. 증발기구를 33 ° C로 설정하고 예열하십시오.
- 진공 흡인기를 진공 펌프, 고순도 튜빙 및 유리 피펫에 연결된 측면 팔 플라스크에 설치하십시오.
- 수성 층을 유지하면서 두 개의 유리 튜브의 상단 레이어와 인터페이스 (약 2/3 방식)를 대기음. 각 샘플에 대해 깨끗한 피펫을 사용하여이 과정을 반복하십시오.
- 조심스럽게 기울여서 두 번째 튜브의 추출물과 첫 번째 튜브의 추출물의 수성층을 합친다. 기울어 진 튜브에 흠집이나 균열이 없는지 확인하십시오.
- 클로로포름 추출물이 결합되면, 액체를 검사 - 분명히해야한다. 명확하지 않을 때까지 MeOH를 첨가하지 않는다.
- 진공 증발 장치를 사용하여 모든 샘플을 건조시킵니다. 온도 33 ° C, 와류 속도 26 % 및 압력 400 mbar의 설정으로 시작하십시오.
- 피증발 시스템에서 샘플을 레이스하고 10 분 후에 350 mbar로 천천히 압력을 낮추십시오.
- 진행 상태를 모니터링하고 튜브의 액체 레벨이 가열 블록 수준에 도달하면 압력을 300mbar로 낮 춥니 다.
- 계속해서 나머지 액체의 높이를 모니터링하고 깊이가 약 1 cm이면 압력을 200 mbar로 낮추십시오.
- 샘플이 건조 된 후 샘플을 꺼내고 펌프를 10 분 동안 더 운전하여 증기를 제거하십시오.
- 튜브를 단단히 막고 지질을 -80 ° C의 냉동고에 보관하십시오.
- 해당 화학 물질 안전 규정에 따라 흡인 된 액체를 폐기하십시오.
4. 3 일 - 비누화 및 메틸화 (~ 40 샘플의 경우 6 ~ 7 시간)
- 수욕을 켜십시오. 욕조 1을 95 ° C에, 욕조 2 ~ 80 ° C에 놓으십시오.
- 피펫 디스펜서를 설정하고 올바른 양을 분배하는지 확인하십시오.
시약 1 : 샘플 당 1 mL
시약 2 : 샘플 당 2 mL
시약 3 : 시료 당 1.25 mL
시약 4 : 시료 당 3 mL
참고 : 가열 과정이 튜브에 압력을가합니다. 긁히거나 부서 지거나 부서진 튜브는 사용하지 마십시오. - 피펫 분배기를 사용하여 1.0 mL의 시약 1을 건조 된 지질에 첨가합니다. 뚜껑을 단단히 조이고 5 초 동안 와동을하여 랙에 넣으십시오.
- 샘플 튜브 랙을 95 ° C 수조에 5 분 동안 놓습니다. 욕조에서 랙을 꺼내고 튜브에 기포가 생겨서 튜브가 새는지 확인하십시오. 새는 튜브의 뚜껑을 다시 채우거나 교체하고 균열이나 칩이 없는지 다시 확인하십시오. 추가 10 분 동안 수조에서 튜브를 계속 가열하십시오.
- 목욕 1에서 샘플을 제거하고 목욕 2 (80 ° C)에 넣고 15 분간 더 배양하십시오.
- 튜브를 꺼내고 냉각을 위해 수돗물 팬에 랙을 올려 샘플을 냉각시킵니다.
- 각 시료에 2 mL의 시약 2를 첨가한다. 5 ~ 10 초 동안 밀폐하고 와동을하십시오.
- 랙을 80 ° C의 수 욕조에 놓고 10 분 동안 배양하십시오.
- 수조에서 튜브 랙을 제거하고 냉각을 위해 수돗물 팬에 넣습니다. 냉각 과정을 가속화하기 위해 튜브 랙을 주행합니다.
참고 : 시간과 온도를 초과하지 마십시오. 너무 많이 가열하면 FAME이 저하 될 수 있습니다. - 피펫 분배기를 사용하여 각 시료 튜브에 1.25 mL의 시약 3을 첨가하여 지방산 메틸 에스테르를 추출합니다. 캡을 단단히 조이고 튜브를 쉐이커에 10 분간 넣으십시오.
- 흔들어 준 후 튜브 랙을 10 분 동안 두어 위상이 분리되도록합니다. 유리 피펫을 사용하여 16 mm x 100 mm 유리 시험관에 유기상 (상단 층)을 옮긴다.
- 시약 3을 다시 넣고 흔들어 주면서 단계별로 분리하고 상단 단계를 옮겨 추출을 반복하십시오.
참고 하단 위상을 전송하지 마십시오. 튜브에 소량의 상 단계를 남기는 것이 좋습니다. - 피펫 분배기를 사용하여 3mL의 시약 4를e 16 mm x 100 mm 튜브.
- 시험관을 단단히 막고 20-30 초 동안 와동시킨다.
- vortexing 후 1,000 x g에서 3 분간 원심 분리한다.
- 깨끗한 유리 피펫을 사용하여 상단 유기층을 흡인하고 4mL 앰버 바이알로 옮기십시오.
- 증발 장치 및 용매 트랩을 켭니다. 증발 장치를 30 ° C, 와류 속도를 26 %, 진공을 200 mbar로 설정하고 예열을 누릅니다.
- 진행 상황을 모니터링하십시오. 샘플이 건조 된 후 샘플을 꺼내고 펌프를 10 분 동안 더 운전하여 증기를 제거하십시오.
- 시약 병 1과 4에서 pipet을 꺼내고 희석 된 산 ( 예 : 1 % HCl)을 통과시킨 다음 DI 수를 넣습니다. DI 물을 펌핑하여 시약 2에 사용 된 피펫을 헹굽니다. 후드에서 시약 3에 사용 된 피펫에서 용매를 적절한 용기에 배출하고 용매 잔류 물이 증발 할 때까지 후드에 보관하십시오.
- 스틱을 방지하기 위해 플런저를 제거한 채로 피펫을 거꾸로 보관하십시오.g의 체크 밸브.
- 유리 피펫을 한 번 사용한 다음 적절한 용기에 폐기하십시오.
- 후드에서 유리 제품의 잔류 용매가 증발하도록하십시오.
- 깨끗한 물과 세제 용액으로 유리 제품을 헹구십시오.
5. DAY 4 - GC 바이알에 작업 용액 준비 및 FAME 이동 (~ 40 개 시료의 경우 2-3 시간)
- 재료 수집 : 말린 샘플이 담긴 앰버 바이알 4 mL; 앰버 2 mL GC 바이알; 400 μL 평면 유리 삽입 및 캡; 500 μL 유리 주사기; 50 mL 부피 플라스크; 스톡 용액 - 에틸 노나 데 카노 에이트 (19 : 0 EE 내부 표준 물질) 50/50 헥산 / MTBE (시약 3).
- 유리 주사기를 사용하여 에틸 노나 데 카노 에이트 (19 : 0 EE) 스톡 용액 500 μL를 50 mL 용량 플라스크에 넣으십시오.
- 시약을 시약에 부피비로 채우십시오.
- 캡 플라스크에 넣고 5 배 반전시켜 혼합합니다.
- 3 mL를 깨끗한 4 mL 바이알에 옮겨 작업 용액 저장조에 넣습니다.
- th 사용e 유리 주사기에 말린 지방산 메틸 에스테르와 뚜껑이 들어있는 4 mL 바이알 각각에 작업 용액 300 μL를 넣으십시오.
- 샘플을 15 초 동안 볼 텍싱하고 15 분 동안 그대로 두십시오.
- 유리 파스퇴르 피펫을 사용하여 부유 지방산 메틸 에스테르를 신중하게 400 μL 인서트가 들어있는 2 mL GC 바이알에 옮기십시오.
- 분석하기 전에 밀폐 된 GC 바이알을 -20 ° C의 냉동고에 보관하십시오.
- GC 분석을위한 샘플을 제출하십시오.
참고 : 분석은 보충 파일 S1에 설명 된 특정 GC 컬럼 및 조건을 사용하여 수행해야합니다. GC 분석은 메틸화 2 주 이내에 완료하는 것이 가장 좋습니다.
결과
보고서의 데이터 테이블은 스프레드 시트 또는 데이터베이스로 대조 할 수 있습니다. 반응 계수 (서로 다른 사슬 길이에 대한 반응을 정상화하는 보정 계수)를 조정 한 후 피크 영역을 외부 또는 내부 표준의 피크 영역과 비교하여 추출물의 농도에 도달 할 수 있습니다. 추출 된 토양의 질량으로 나눔으로써 데이터는 토양 1 그램 당 FAME의 질량으로 표현되거나, 각 FAME의 분자량을 사용하여 토양 1 그램 당보다 일반적으로보고 된 nmol로 표현 될 수있다. 미생물 FAMEs의 합은 총 미생물 바이오 매스를 나타내며 처리 간 비교가 가능합니다 ( 그림 1 ). 특정 FAMEs는 그람 양성균이나 그람 음성균, 방선균 (actinomycetes), arbuscular mycorrhizal fungi 및 saprotrophic fungi와 같은 특정 미생물 군과도 연관 될 수 있습니다 19 , 20 , 21 , 22 , 23 , 24 . 특정 바이오 마커의 질량의 비율은 이들 그룹의 상대적 풍부함을 반영 할 수 있습니다 ( 그림 2 ). 전반적인 FAME 풍부 패턴은 지역 수준의 지문을 생성하므로 안수와 같은 다 변수 기술을 통해 미생물 공동체의 비평 성을 비교할 수 있습니다 ( 그림 3 ). 대부분의 DNA 기반 접근법과는 대조적으로, 커뮤니티 수준의 지질 데이터는 상대적인 또는 절대적인 풍부로 분석 될 수 있습니다. 총 바이오 매스가 표본간에 크게 다른 경우,이 두 가지 접근법은 매우 다른 결과를 나타낼 것이다. 실험의 기초가되는 생태 학적 질문은 어떤 접근법이 사용되는지를 결정해야한다.

에프 그림 1 : 총 FAME 바이오 매스. 연속 옥수수, 수정 된 대초원 및 무인 대초원으로부터 얻은 총 FAME 바이오 마커 바이오 매스 (nmol g -1 토양)의 비교. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2 : 박테리아와 곰팡이의 FAME 바이오 매스. 연속 옥수수, 수정 된 대초원 및 무궁화 대초원의 박테리아 및 곰팡이 FAME 바이오 마커 바이오 매스 (nmol g -1 토양)의 처리 비교. 절대 풍부에서 곰팡이 및 세균 덩어리. 평균 (합계 f / 합 b). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
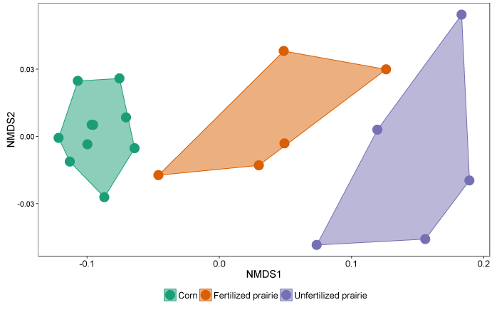
그림 3 : FAME 지질 바이오 마커의 비 메트릭 차원 스케일링. 모든 미생물 FAME 지질 바이오 마커의 절대 존재 프로파일을 이용한 전체 미생물 군집의 비교. 이 예제에서, 연속 옥수수와 비 정제 된 대초원 지역 공동체는 분리되어 있고 아주 멀리 떨어져 있으며, 일부 수정 된 대초원 지역은 옥수수와 유사한 미생물 군집을 가지고 있으며, 나머지 지역은 비옥 대초원과 유사합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
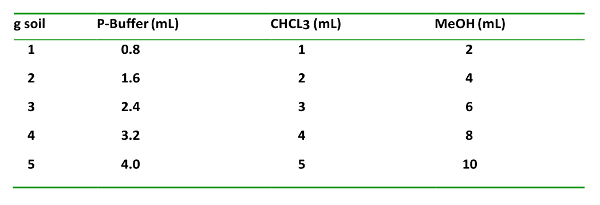
표 1 : T h e so패 VEN t의 유형들에 propor의 TI는 토양 g -1, O F N O를 ITI 추가 d 개의 t 시간에 EIR orde r에 추가. 이는 유기 및 수 성상의 적절한 추출 및 분리에 중요합니다.
토론
많은 복제물 및 실험 단위가 포함 된 실험에서 여러 시료를 검사하기 위해 연구자는 인지질 지방산 분석 (PLFA)이 시간 및 재료면에서 금지되어 있음을 발견 할 수 있습니다 25 . PLFA 방법을 사용하여 세포막 인지질을 추출하고 정제하고 수정 된 Bligh and Dyer 26 2 상 수성 유기 추출물을 사용하여 확인합니다. 이어서 극성으로 지질을 분리하는 고상 실리카 크로마토 그래피와 인지질 지방산이 지방산 메틸 에스테르로 알칼리성 메틸화됩니다. PLFA 프로파일 링에서 지질 생산량은 낮지 만 매우 높은 순도를 가질 수 있습니다. 미생물 ID는 대체 방법 인 지방산 메틸 에스테르 절차 (MIDI-FA)를 도입했습니다. MIDI-FA 방법에서 모든 지질은 순수 배양 물 또는 토양 / 퇴적물 시료 11 , 12 , 27 에서 직접 추출됩니다비누화. 이 방법은 PLFA 방법의 농도 또는 정제 단계가 없으므로 지질 손실이 적고 신속합니다. 그러나 MIDI-FA 방법은 순수 문화에서 유기체를 확인하기 위해 원래 설계 되었기 때문에 빠르고 저렴하지만 초기 추출이나 정제 단계는 없습니다. 따라서 토양 유기 물질로부터 함께 추출 된 지질 유사 화합물을 포함하여 공동체의 특성 27 , 28 , 29 을 왜곡 할 수있다. 이 포함은 또한 바이오 매스 조치를 왜곡 할 수 있기 때문에, MIDI-FA는 일반적으로 단지 토양 지질 (13)을 설명 질적으로 조악하는 데 사용되었습니다.
우리가 여기서 설명하는 절차는 두 가지 별도의 추출 절차 중 최고를 결합한 것입니다. 1) 수정 된 Bligh and Dyer 26 방법을 사용한 지질의 추출 및 농축, 2) 지방산 메틸 에스테르 sa메틸화, 추출 및 염기 세척 과정이 상업적으로 개발되었다. 이 방법은 단점 (15)을 최소화하면서 이러한 프로토콜 모두의 이익을 달성하기 위해 개발되었다. MIDI-FA를 수행하기 전에 초기 추출을 수행하고 유기 용해성 성분 ( 예 : 지질)을 분리하고 정제 단계를 통해이를 완료함으로써이 프로토콜은 속도와 정밀도 간의 균형을 제공합니다. 높은 순도가 요구되면,이 방법은 적절하지 않을 수도 있지만하거나 별도로 인지질 및 중성 지질을 분석 할 때, 대부분의 경우는 DNA 계보다 감도 환경 조건 미생물 커뮤니티 응답 검출 할 수있다 (즉, 13 C PLFA 분석) 방법 30 , 31 , 32 , 33 . 막 지질은 세포 사멸 후 빠르게 분해되어많은 정보가 죽은 또는 비활성 유기체 (34)로부터 제공되는 환경 DNA와는 대조적으로 샘플링 5, 7시에 살고있는 미생물 군집을 반영합니다. 토양 미생물 (35) 사이에 관찰 수면의 높은 비율을 감안할 때, 라이브 바이오 매스의 특성은 비교적 미세한 시간적 규모로 시간적 식물 미생물의 상호 작용을 이해하는 데 사용할 수있는 지질 바이오 마커는 미생물 군집 (7)의 생리적 상태를 분석하는 데 사용할 수 있습니다. 높은 처리량 방법이 큰 필드 설정 25 미생물 반응을 평가하기 위해 필요한 것을 보여, 우리가 여기에서 제안하는 방법은 PLFA의 바이오 마커 프로파일 링의 정확도를 복제하지 않습니다 동안 MIDI-FA 실현 변동성을 최소화하면서, 그것은 처리량을 증가하고있다 순서. 이 방법은 주소 지정에 효과적인 도구임이 입증되었습니다.대규모 농업 생태계 연구 36, 37, 38, 42, 43, 44, 45, 46, 47, 48, 49, 50 토양 광범위한 미생물 집단의 동력학에 관한 질문.
지질 수업은이 방법과 결합되어 별도의 클래스 22 , 39에 포함 된 정보가 손실 될 수 있지만 지질 클래스를 결합하면 인산염에서 16 : 1 ω5c의 arbuscular mycorrhizal fungi 기원을 감지하는 힘이 강화 될 수 있습니다 - 중성 지질 40 . 또한, t미지의 지방산 (non-living organic matter에서 유래 될 수있는)의 수는이 방법으로 더 높을 수 있으며 MIDI-FA보다 낮으며 많은 샘플을 사용한 연구에서 지질 프로파일을 비교할 수 있습니다 처리량 용량이 문제가 15입니다. 중성 분획은 일반적으로 토양 동물 (41)로부터 약간 작은 기여가있을 수 있지만, 진균에 의해 생산 저장 지질 주로 유도하는 것으로 생각된다. 이것에 비추어, 여기에서 기술 된 방법은 PLFA보다 곰팡이 지질 18 : 2 ω 6,9c 및 18 : 1 ω 9c의 더 큰 공헌을 나타내는 결과를 산출 할 수있다. 중립 부분에 표시하는 경향이 다른 지질은 포화 지방산의 일부를 포함하는 예 16 : 0, 18 : 0, 20 : 0.
지질 데이터를 표현하고 분석 할 수있는 다양한 방법이 있습니다. 가장 보편적 인 표현은 풍부 (nmol g -1 토양), mole fraction (nmol의 개별 지질 nmol -1 총 지질) 및 mole % (몰 분율 * 100). 표본의 총 지질로 표준화 된 몰분율과 몰 %는 주어진 지질의 상대적 존재 량을 나타내는 척도입니다. 아크 사인 제곱근과 같은 적절한 변환 후, 몰분율은 주성분 분석이나 중복 분석 안수화에 사용하기에 적합합니다. 풍요는 토양 1g 당 추출 된 주어진 지질의 절대량입니다. 셀 당 지질의 양이 비교적 일정하고, 지질 추출은 매우 효율적이고 포괄적이기 때문에, 총 풍부한 총 지질의 좋은 추정치이며, 주요 지표의 풍요 로움은 17 나타내는 생태 그룹의 바이오 매스를 반영한다. 마지막으로, 미생물 군집 구성에 볼 수있는 좋은 방법은 NMDS (예 : nonmetric 다차원 스케일링과 같은 예를 들어, 다변량 분석 방법 (16), 조정 방법을 사용하는 것입니다 -데이터 변환이 필요 없음) 또는 주성분 분석 (PCA)은 모든 지질 바이오 마커의 상대적 존재 량을 비교하는 데 유용 할 수 있습니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 DOE 오대호 바이오 에너지 연구 센터 (DOE BER Office of Science DE-FC02-07ER64494)와 DOE OBP 에너지 효율 및 재생 에너지 국 (DE-AC05-76RL01830)에 의해 부분적으로 자금 지원을 받았다. 저자는 비디오 촬영과 편집에 대한 그의 환자와 숙련 된 공헌에 대해 Anders Gurda에게 감사를 표합니다.
자료
| Name | Company | Catalog Number | Comments |
| RapidVap | Labconco | 7900000 | Evaporative system |
| RapidVap | Labconco | 7491400 | Sample block |
| Chem-resistant vacuum pump | Labconco | 7584000 | Vacuum pump |
| Chemical trap cannister | Labconco | 7815300 | Trap cannister |
| Solvent insert | Labconco | 7515200 | Solvent trap insert |
| Diaphragm pump | Welch | 7398000 | DryFast vacuum pump |
| Water bath | Fisher | 15-462-15Q | 2 well water bath |
| Gas chromatograph | Various | N/A | For sample analysis |
| Centrifuge | Various | N/A | For sample separation |
| Freeze Dryer | Various | N/A | For sample lyophilization |
| Repipet (6) | BrandTech | 4720440 | For dispensing reagents |
| Vortex | Fisher | 02-215-365 | Analog vortex mixer |
| Teflon centrifuge tubes | Thermo/Nalgene | 3114-0030 | Teflon sample tubes |
| Caps | Thermo/Nalgene | DS3131-0020 | Caps for teflon tubes |
| Test tube | Corning | 9825-16 | 16x100mm tubes |
| Test tube | Corning | 9825-16xx | 16x150mm tubes |
| Caps | Corning | 9998-15 | 15-415 thread black phenolic caps w/PTFE liner |
| Pasteur pipets | Fisher | 13-678-20B | 14.6cm |
| 500 uL glass syringe | Fisher | 13684106LC | Hamilton 81217 |
| Amber vials | Agilent | 5182-0716 | 4mL Amber vials |
| Caps | Agilent | 5182-0717 | Blue screw caps |
| Inserts | Agilent | 5181-3377 | 400uL flat bottom glass inserts |
| Standards | |||
| 19:0 ethyl nonadecanoate (Ethyl nonadecanoate) | VWR | TCN0459-5G | Analytical standard |
| Chemicals | |||
| Dipotassium phosphate (K2HPO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Potassium phosphate monobasic (KH2PO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Methanol (CH3OH - HPLC grade or better) | Various | N/A | For making Reagents 1 & 2 |
| Sodium hydroxide (NaOH - ACS grade or better) | Various | N/A | For making Reagents 1 & 4 |
| Hydrochloric acid (6N HCL) | Various | N/A | For making Reagent 2 |
| Hexane (HPLC grade or better) | Various | N/A | For making Reagent 3 |
| MTBE (Methyl tert-butyl ether - HPLC grade or better) | Various | N/A | For making Reagent 3 |
참고문헌
- Van Der Heijden, M. G. a., Bardgett, R. D., Van Straalen, N. M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol Lett. 11 (3), 296-310 (2008).
- Bever, J. D., et al. Rooting theories of plant community ecology in microbial interactions. Trends Ecol Evol. 25 (8), 468-478 (2010).
- Suleiman, A. K. A., Manoeli, L., Boldo, J. T., Pereira, M. G., Roesch, L. F. W. Shifts in soil bacterial community after eight years of land-use change. Syst Appl Microbiol. 36 (2), 137-144 (2013).
- Sayer, E. J., et al. Grassland management influences spatial patterns of soil microbial communities. Soil Biol Biochem. 61, 61-68 (2013).
- Fernandes, M. F., Saxena, J., Dick, R. P. Comparison of Whole-Cell Fatty Acid (MIDI) or Phospholipid Fatty Acid (PLFA) Extractants as Biomarkers to Profile Soil Microbial Communities. Microbial Ecol. 66 (1), 145-157 (2013).
- van der Heijden, M. G. A., Wagg, C. Soil microbial diversity and agro-ecosystem functioning. Plant Soil. 363 (1-2), 1-5 (2013).
- Allison, V. J., Miller, R. M., Jastrow, J. D., Matamala, R., Zak, D. R. Changes in soil microbial community structure in a tallgrass prairie chronosequence. Soil Sci Soc Am J. 69 (5), 1412-1421 (2005).
- Kowalchuk, G. A., Buma, D. S., de Boer, W., Klinkhamer, P. G. L., van Veen, J. A. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. A van Leeuw. 81 (1-4), 509-520 (2002).
- Bardgett, R. D., Hobbs, P. J., Frostegard, A. Changes in soil fungal:bacterial biomass ratios following reductions in the intensity of management of an upland grassland. Biol Fert Soils. 22 (3), 261-264 (1996).
- Frostegård, &. #. 1. 9. 7. ;., Tunlid, A., Bååth, E. Use and misuse of PLFA measurements in soils. Soil Biol Biochem. 43 (8), 1621-1625 (2011).
- Haack, S. K., Garchow, I. H., Odelson, D. A., Forney, L. J., Klug, M. J. Accuracy , Reproducibility , and Interpretation of Fatty Acid Methyl Ester Profiles of Model Bacterial Communitiest. Appl Environ Microbiol. 60 (7), 2483-2493 (1994).
- Drenovsky, R. E., Elliott, G. N., Graham, K. J., Scow, K. M. Comparison of phospholipid fatty acid ( PLFA ) and total soil fatty acid methyl esters ( TSFAME ) for characterizing soil microbial communities. Soil Biol Biochem. 36, 1793-1800 (2004).
- Cavigelli, M. A., Robertson, G. P., Klug, M. Fatty acid methyl ester ( FAME ) profiles as measures of soil microbial community structure. Plant Soil. 170, 99-113 (1995).
- Determination of microbial community structure using phospholipid fatty acid profiles. Molecular microbial ecology manual Available from: https://www.researchgate.net/profile/Robert_Findlay2/publication/281208148_Determination_of_microbial_community_structure_using_phospholipid_fatty_acid_profiles/links/55db4f0b08aec156b9afe776.pdf (2004)
- Balser, T. C., Liang, C., Gutknecht, J. L. Linking microbial community analysis and ecosystem studies: A rapid lipd analysis protocol for high throughput. Biol Fert Soils. , (2017).
- Findlay, R. H., King, G. M., Watling, L., Watling, L. E. S. Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sediments Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sedimentst. Appl Environ Microbiol. 55 (11), 2888-2893 (1989).
- Willers, C., Jansen van Rensburg, P. J., Claassens, S. Microbial signature lipid biomarker analysis - an approach that is still preferred, even amid various method modifications. J Appl Microbiol. 118 (6), 1251-1263 (2015).
- Zelles, L., Bai, Q. Y., Beck, T., Beese, F. Signature fatty-acids in phospholipids and lipopolysachharides as indicators of microbial biomass and community structure in agricultural soils. Soil Biol Biochem. 24 (4), 317-323 (1992).
- Frostegard, A., Tunlid, A., Baath, E. Phospholipid fatty-acid composition, biomass, and activity of microbial communities from 2 soil types experimentally exposed to different heavy-metals. Appl Environ Microbiol. 59 (11), 3605-3617 (1993).
- Federle, T. W., Dobbins, D. C., Thorntonmanning, J. R., Jones, D. D. Microbial biomass, activity, and community structure in subsurface soils. Ground Water. 24 (3), 365-374 (1986).
- Vestal, J. R., White, D. C. Lipid analysis in microbial ecology - quantitative approaches to the study of microbial communities. BioScience. 39 (8), 535-541 (1989).
- Wilkinson, S. G. Gram negative bacteria. Microbial Lipids. , 299-488 (1988).
- Balser, T. C., Treseder, K., Ekenler, M. Using lipid analysis and hyphal length to quantify AM and saprotrophic fungal abundance along a soil chronosequence. Soil Biol Biochem. 37 (3), 601-604 (2005).
- Buyer, J. S., Sasser, M. High throughput phospholipid fatty acid analysis of soils. Appl Soil Ecol. 61, 127-130 (2012).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Can J Biochem Phys. (37), 911-917 (1959).
- Schutter, M. E., Dick, R. P. Comparison of Fatty Acid Methyl Ester (FAME) Methods for Characterizing Microbial Communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Jandl, G., Leinweber, P., Schulten, H., Ekschmitt, K. Contribution of primary organic matter to the fatty acid pool in agricultural soils. Soil Biol Biochem. 37, 1033-1041 (2005).
- Nielsen, P., Petersen, S. O. Ester-linked polar lipid fatty acid profiles of soil microbial communities: a comparison of extraction methods and evaluation of interference from humic acids. Soil Biol Biochem. 32, 1241-1249 (2000).
- Duncan, D. S., Jewell, K. A., Suen, G., Jackson, R. D. Detection of short-term cropping system-induced changes to soil bacterial communities differs among four molecular characterization methods. Soil Biol Biochem. 96, 160-168 (2016).
- Liang, C., et al. Switchgrass rhizospheres stimulate microbial biomass but deplete microbial necromass in agricultural soils of the upper Midwest, USA. Soil Biol Biochem. 94, 173-180 (2016).
- Jangid, K., et al. Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties. Soil Biol Biochem. 43 (10), 2184-2193 (2011).
- Ritz, K., et al. Spatial structure in soil chemical and microbiological properties in an upland grassland. FEMS Microbiol Ecol. 49 (2), 191-205 (2004).
- Carini, P., et al. Relic DNA is abundant in soil and obscures estimates of soil microbial diversity. J Chem Inf Model. 53 (9), 1689-1699 (2013).
- Lennon, J. T., Jones, S. E. Microbial seed banks: The ecological and evolutionary implications of dormancy. Nat Rev Microbiol. 9 (2), 119-130 (2011).
- Gutknecht, J. L. M., Field, C. B., Balser, T. C. Microbial communities and their responses to simulated global change fluctuate greatly over multiple years. Glob Change Biol. 18, 225-269 (2012).
- Pei, Z., et al. Soil and tree species traits both shape soil microbial communities during early growth of Chinese subtropical forests. Soil Biol Biochem. 96, 180-190 (2016).
- Oates, L. G., Duncan, D. S., Sanford, G. R., Liang, C., Jackson, R. D. Bioenergy cropping systems that incorporate native grasses stimulate growth of plant-associated soil microbes in the absence of nitrogen fertilization. Ag Ecosys Environ. 233, 396-403 (2016).
- Bååth, E. The use of neutral lipid fatty acids to indicate the physiological conditions of soil fungi. Microbial Ecol. 45 (4), 373-383 (2003).
- Ngosong, C., Gabriel, E., Ruess, L. Use of the signature Fatty Acid 16:1ω5 as a tool to determine the distribution of arbuscular mycorrhizal fungi in soil. J Lipids. 2012, 236807 (2012).
- Sharma, M. P., Buyer, J. S. Comparison of biochemical and microscopic methods for quantification of arbuscular mycorrhizal fungi in soil and roots. Appl Soil Ecol. 95, 86-89 (2015).
- Oates, L. G., Balser, T. C., Jackson, R. D. Subhumid pasture soil microbial communities affected by presence of grazing, but not grazing management. Appl Soil Ecol. 59, 20-28 (2012).
- Liang, C. Potential legacy effects of biofuel cropping systems on soil microbial communities in southern Wisconsin, USA. Ag Sci. 2 (2), 131-137 (2011).
- Herzberger, A. J., Duncan, D. S., Jackson, R. D. Bouncing Back Plant-Associated Soil Microbes Respond Rapidly to Prairie Establishment. PloS One. 9 (12), 1-14 (2014).
- Fraterrigo, J. M., Balser, T. C., Turner, M. G. Microbial community variation and its relationship with nitrogen mineralization in historically altered forests. Ecology. 87 (3), 570-579 (2006).
- Kao-Kniffin, J., Balser, T. C. Elevated CO2 differentially alters belowground plant and soil microbial community structure in reed canary grass-invaded experimental wetlands. Soil Biol Biochem. 39 (2), 517-525 (2007).
- Mentzer, J. L., Goodman, R. M., Balser, T. C. Microbial response over time to hydrologic and fertilization treatments in a simulated wet prairie. Plant Soil. 284 (1-2), 85-100 (2006).
- Ushio, M., Wagai, R., Balser, T. C., Kitayama, K. Variations in the soil microbial community composition of a tropical montane forest ecosystem: Does tree species matter. Soil Biol Biochem. 40 (10), 2699-2702 (2008).
- Bartelt-Ryser, J., Joshi, J., Schmid, B., Brandl, H., Balser, T. Soil feedbacks of plant diversity on soil microbial communities and subsequent plant growth. Perspect Plant Ecol. 7 (1), 27-49 (2005).
- Fichtner, A., von Oheimb, G., Härdtle, W., Wilken, C., Gutknecht, J. L. M. Effects of anthropogenic disturbances on soil microbial communities in oak forests persist for more than 100 years. Soil Biol Biochem. 70, 79-87 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유