Method Article
多数の試料を用いた実験における土壌微生物の同定のための脂質抽出と分析法
要約
この論文は、多くの試料を用いた研究において土壌微生物群集構造を決定するために、総脂質と指標脂質の相対存在量の両方を特徴づける微生物の細胞膜から脂質を抽出するための努力と正確さとをバランスさせながらスループットを増加させる方法を記載している。
要約
微生物群集は、生態系プロセスの重要な推進要因であり規制者でもあります。生態系の管理が微生物群集にどのように影響するかを理解するために、微生物群集組成を測定する比較的正確ではあるが努力を要する技術は、リン脂質脂肪酸(PLFA)分析である。 PLFAは、微生物バイオマスの指標および菌類および細菌の広範な官能基の組成として使用できるリン脂質バイオマーカーを分析するために開発されました。それは、代替植物コミュニティ、生態系、および管理レジームの下で土壌を比較するために一般的に使用されてきた。 PLFA法は、微生物群集組成のシフトの検出に敏感であることが示されている。
別の方法である、脂肪酸メチルエステル抽出および分析(MIDI-FA)は、微生物同定技術として、純粋な培養物からリン脂質画分を分離することなく、全脂質を迅速に抽出するために開発された。このメソッドは迅速ではあるが土壌サンプルにはあまり適していない。なぜなら、土壌粒子を分離する初期段階がなく、代わりに土壌中の背景有機物からの人工物を生成する鹸化反応で始まるからである。
この論文では、多くのサンプルを用いた研究で土壌微生物群集の構造を決定するために、総脂質と指標脂質の相対存在量の両方を特徴づける微生物の細胞膜から脂質を抽出するための努力と正確さをバランスさせながらスループットを向上させる方法について説明します。この方法は、第1ステップとして土壌脂質を抽出および濃縮することによりPLFAプロファイリングによって達成された精度と、抽出された有機材料を鹸化し、MIDI-FA法で処理することによる努力の減少を第2ステップとして組み合わせる。
概要
栄養サイクル1における微生物の重要な役割、植物コミュニティの構成2の改変、植物の生産性の調節3 、有機物4の分解を考慮して、土壌微生物群を理解することは陸生生態系を理解する上で不可欠です。
土壌におけるそれらの比較的豊富な存在およびそれらの化学的特徴のために、脂質バイオマーカーは、土壌微生物群集5を含む優勢な生態学的群をプロファイルするために使用することができる5 。異なる微生物群の特徴である脂質バイオマーカーを定量化することにより、総脂質を推定し、グラム陽性(Gm +)およびグラム陰性(Gm-)細菌、アルブスカラ菌菌(AM)および栄養細菌真菌、および放線菌5 、 SS = "外部参照"> 6、7、8。
微生物群集の特徴を示す多くの方法がある。 PLFA法は、基本的な微生物群集構造を理解するために一般的に使用される方法である。微生物群の総量と微生物総量の相対量を評価するのに有効な方法です。細菌の比率栄養循環1、9、10の速度を評価するために:急激な脂質の代謝回転に、PLFAプロファイリングはまた、真菌は、例えば、土壌微生物コミュニティの変化の比較的高速な検出を可能にし、生態系の機能の比較を可能にする情報を提供します。しかし、PLFA抽出法は時間を守り、尊敬しているが、時間がかかり、野外スケールの多数のサンプルを必要とする生態系規模の研究には適していないF "> 11、12。
対照的に、脂肪酸メチルエステル抽出法(MIDI-FA)は、迅速な処理を可能にする可能性がある。この方法では、試料を鹸化し、FAMEに変換し、抽出し、次いで分析する。 MIDI-FA法は、異なる脂質クラス13 (リン脂質、中性脂質、および糖脂質)の分離を伴う脂質の抽出を組み合わせたPLFAよりも、迅速であるが区別が難しい。
このプロトコールでは、PLFAおよびMIDI-FA脂質プロファイリングの要素を組み合わせた方法について説明します。これは、改変されたBlighおよびDyer法の最初のクロロホルム抽出段階を用いて脂質の抽出を行い、次いで鹸化およびFAMEへの変換を使用する。これは、非微生物材料5、14からバックグラウンドノイズの多くを排除しながら微生物群集構造を検出するための堅牢な方法を提供します。この方法は、多くの試料15との大規模な研究から脂質を分析することがロジスティックと経済的に実現可能にするために、スループットを増加させながら精度の大部分を保持する、すなわち、PLFAとMIDI-FAの両方のプロトコルとの間のバランスを達成するために開発されました。 MIDI-FAを実施する前に初期抽出を行い、有機可溶性成分( 例えば、脂質)を単離し、精製工程でこれを完了することにより、プロトコールは速度と精度との間のバランスを提供する。
プロトコル
注記:この手順では常に適切な個人用保護具(PPE)を着用してください。潜在的なサンプル汚染を避けるため、素手でガラス製品に触れないでください。クロロホルムの取り扱いが必要な手順を実行する場合は、適切な手袋を着用してください。
1.準備(約40サンプルの2日間)
- 滅菌した袋に土を集め、氷を入れた冷蔵庫で野外から輸送してください。新鮮な土壌をふるい分けてすぐに凍結乾燥することができない場合、分析を開始する準備が整うまでサンプルを-80℃の冷凍庫に保存します。
- ホモジナイズして土壌を準備する。粗いふるい( 例えば 2mm)で根や石を取り除き、塊を砕く。
- 凍結乾燥機の取扱説明書に従ってサブサンプルを適切な容器に入れ、できるだけ早く凍結乾燥させて凍結乾燥を準備する。土壌が凍結乾燥したら、抽出するまで乾燥剤を入れた密閉容器に保存する。それは最高です凍結乾燥土壌を最低-20℃、好ましくは-80℃で磨砕する。
- 抽出の準備として、凍結乾燥した土壌を貯蔵から取り除き、粉状の粘稠度に粉砕する。粉砕の方法には、ボールミル、ボールビーター、および乳鉢および乳棒が含まれる。土壌を粉砕した後、冷凍庫に保存する(1.3参照)。
注:抽出に使用されるサンプルの量は、その有機物含量に依存する。一般的なガイドラインは、重量で炭素12〜18%、炭素1〜3%が土壌3〜5 gの土壌0.5〜1 gを使用することです。 - ヘキサンを用いて30 mLの遠心チューブをあらかじめすすぐ。約2〜3mLのヘキサンをチューブに加え、5秒間ボルテックスする。ヘキサンを別のチューブに移し、ボルテックスする。ヘキサン(2〜3mL)を使用して、6本の管を連続的にリンスすることができる。ヒュームフード内でヘキサンリンスチューブを逆さにして保管し、使用済みヘキサンを適切な廃棄容器に処分する。
- ガラス製品を2~3層のアルミニウムホイルで包み、マッフル炉に入れます。焼く(マッフル)ガラス製品を450℃で4.5時間加熱した。
- 試薬を準備する。
- 使用される土壌量については、リン酸緩衝液(P-緩衝液):CHCl 3 :MeOHの0.8:1:2の容量比で化学薬品を添加する。
- P-緩衝液の調製:リン酸緩衝液:0.1M、pH7.0。
- 1M K 2 HPO 4ストック61 mLを加え、滅菌する(化学薬品はACS認定グレード以上でなければならない)。 1 M KH 2 PO 4ストック39 mLを加え、滅菌する(化学薬品はACS認定グレード以上でなければならない)。タイプ1の水で1000 mLまで満たします。 NaOHまたはHClでpHを7.0に調整する。未使用の溶液は、周囲温度で7日間、または冷蔵庫で30日間保管してください。
- あるいは、10.62gのK 2 HPO 4および5.31gのKH 2 PO 4を計量し、タイプ1の水で1Lに希釈する。 pHを確認し、必要に応じて調整します。
- 試薬1、鹸化試薬を調製する。
- タイプ1の水300 mLを分注する。300mLのCH 3 OH(HPLC等級以上)を加える。 90.00gのNaOH(認定ACS以上)を加える。 NaOHペレットを攪拌しながら溶液に加える。ペレットが溶解するまでかき混ぜる。この溶液は30 d以下で保存することを推奨します。
- 試薬2、メチル化試薬を調製する。
- 273mLのCH 3 OH(HPLC等級以上)を分注する。攪拌しながら325mLの認定された6.00N HCLを添加する。この溶液は30 d以下で保存することを推奨します。
- 試薬3、抽出試薬:50%C 6 H 14 (ヘキサン)、50%C 5 H 12 O(MTBE)を調製する。
- ヒュームフードで、C 6 H 14 (HPLCグレード以上)200 mLとC 5 H 12 O(HPLCグレード以上)200 mLを合わせます。よく混ぜます;しっかりと蓋をする。可燃性のキャビネットまたはヒュームフードを1年以内に保管してください。
- 試薬4、塩基洗浄試薬を調製する。
- ディスペンス9001mLの水をビーカーに加える。攪拌しながら10.80gのNaOH(認定ACS以上)を加える。ペレットが溶解するまでかき混ぜる。この溶液は30 d以下で保存することを推奨します。
- 内部標準のストック溶液を調製する。
- 100mgの19:0EE標準を秤量する。 50mLのヘキサンですすいだメスフラスコに加える。 15mLのヘキサン-MTBE溶液(試薬3)をフラスコに添加し、渦流で溶解する。ヘキサン-MTBE溶液(試薬3)で50mLに捨てる。キャップと渦巻きを混ぜる。 PTFEで覆われたキャップ付きのヘキサンですすいだガラス管に移し、-20℃で保存する。
2.第1日 - 土壌からの脂肪酸の抽出(〜40サンプルで4〜5時間)
- Pバッファー、クロロホルム、およびメタノール用の5〜10 mL分注ピペットを3つ用意します。
注:クロロホルムの危険性が低い代替物質が抽出剤として提案されている。これらは、同等の脂質回収率16 、 17であるが、このプロトコルでは評価されていない。 - 凍結乾燥した土壌を30 mLの遠心チューブに秤量し、土壌の質量を記録する。
- 2つのブランクを作成し、チェック標準(前に抽出された土)を含めます。
- ヒュームフード内で、試薬をP-バッファー、CHCl 3 、およびMeOHの順で遠心チューブの土壌に加えます(表1)。 CHCl 3を添加する前に、P緩衝液添加後に土壌時間を濡らす。遠心チューブをしっかり閉めて、光から保護してください。
- シェーカーを水平に置き、確実に固定されていることを確認します。速度を280 rpmに設定し、1時間振とうします18 。
- 以下のように各サンプルに2本の16 mm x 150 mmのガラスチューブを準備する:チューブにラベルを付け、同じ容量のCHCl 3と等容量のP-バッファーを加える。
- シェーカーから遠心チューブを取り出し、1,430で10分間遠心分離するxgおよび25℃。相分離はガラス管内に見えるべきである。
- ヒュームフードで、上清を遠心分離管からステップ2.6で調製したチューブの1本に移す。ステップ2.4〜2.5を繰り返し、上清を第2チューブにデカントする。
- すべての16 mm×150 mmのガラスチューブにPTFEで覆われたキャップをしっかりとキャップし、10 xを反転させて混合します。
- 試料を一晩静置して2つの相の分離を完了させる。これを行うには、サンプルを暗いキャビネット/スペースに入れておくか、室温でアルミホイルで覆います。抽出物を週末に分けてもよい。
- あるいは、次のステップに直接移動したい場合や、翌日にサンプルが乱れる場合は、1,000 xg、25℃で10分間遠心してください。
注:比較グループ内のすべてのサンプルに、同じ相分離放置時間を与えます。
- あるいは、次のステップに直接移動したい場合や、翌日にサンプルが乱れる場合は、1,000 xg、25℃で10分間遠心してください。
3. DAY2 - 脂質の単離(約40サンプルで3〜4時間)
- 蒸発装置と溶媒トラップをオンにします。蒸発装置を33℃に設定して予熱します。
- 真空ポンプに接続されたサイドアームフラスコ、高純度チューブおよびガラスピペットをフード内に設置します。
- 水層を保持して、2つのガラス管の最上層と界面(約2/3の方法の下)を吸引する。各サンプルにクリーンピペットを使用してプロセスを繰り返します。
- 注意深くデカントすることによって、第2のチューブからの抽出物の水層を第1のチューブからの水層と合わせる。デカンテーション中のチューブに傷や亀裂がないことを確認してください。
- CHCl 3抽出物を合わせたら、液体を検査する。 MeOHを透明になるまで添加しない場合。
- 真空蒸着装置を用いて全ての試料を乾燥させる。温度33℃、渦速度26%、圧力400mbarの設定から始めてください。
- P蒸発システム内のサンプルを撚り合わせ、10分後に350mbarまでゆっくりと圧力を低下させる。
- 進行状況をモニターし、チューブ内の液体レベルが加熱ブロックのレベルに達したら、圧力を300 mbarに下げます。
- 引き続き残りの液体の高さを監視し、深さが約1cmのときは圧力を200mbarに下げます。
- サンプルが乾燥したら、サンプルを取り出し、ポンプを10分間さらに運転して蒸気を除去します。
- チューブをしっかりとキャップし、脂質を-80℃の冷凍庫に保存する。
- 該当する化学物質の安全規制に従って、吸引した液体を廃棄してください。
DAY 3 - 鹸化およびメチル化(〜40サンプルについて6〜7時間)
- 水浴をつけてください。浴1を95℃に、浴2を80℃に設定する。
- ピペットディスペンサーをセットし、正しい量を調剤していることを確認します。
試薬1:1サンプルあたり1mL
試薬2:1サンプルあたり2mL
試薬3:サンプルあたり1.25mL
試薬4:1サンプルあたり3mL
注:加熱プロセスはチューブに圧力を作ります。引っかき傷、ひび割れ、破れたチューブは使用しないでください。 - ピペットディスペンサーを使用して、1.0mLの試薬1を乾燥した脂質に添加する。密封し、5秒間ボルテックスしてラックに入れます。
- サンプルチューブのラックを95℃の水浴に5分間置きます。チューブのラックをバスから取り出し、チューブに気泡が入っていることが示されていることを確認します。漏れたチューブのキャップを締め直したり、交換したり、クラックや切粉がないか再度確認してください。水浴中でチューブをさらに10分間加熱し続ける。
- バス1からサンプルを取り出し、バス2(80℃)に置き、さらに15分間インキュベーションを続ける。
- 冷却のためにラックを水道水のパンに入れてチューブを取り外し、サンプルを冷却します。
- 各サンプルに2 mLの試薬2を加えます。キャップをしっかり締め、5〜10秒間ボルテックスします。
- ラックを80℃の水浴に置き、10分間インキュベートする。
- 水槽からチューブのラックを取り出し、冷却用の水道水のパンに入れます。冷却プロセスを加速するためにラックのラックを揺らす。
注:時間と温度を超えないでください。加熱が多すぎると、FAMEが劣化する可能性があります。 - ピペットディスペンサーを使用して、1.25mLの試薬3を各サンプルチューブに加えて、脂肪酸メチルエステルを抽出する。チューブをしっかりと締め、チューブをシェーカーに10分間置いてください。
- 振とうした後、チューブラックを10分間放置して相を分離させる。ガラスピペットを用いて有機相(最上層)を16mm×100mmガラス試験管に移す。
- 試薬3を再び添加し、振とうし、相を分離させ、上相を移すことにより抽出を繰り返す。
注記下位フェーズは転送しないでください。少量の上相をチューブに残すことは問題ありません。 - ピペットディスペンサーを使用して、3mLの試薬4をe 16mm×100mmチューブ。
- 試験管をしっかりとキャップし、20〜30秒間ボルテックスする。
- ボルテックス後、1,000×gで3分間遠心分離する。
- きれいなガラスピペットを使用して、上部の有機相を吸引し、4mLのアンバーバイアルに移す。
- 蒸発装置と溶媒トラップをオンにします。蒸発装置を30℃に設定し、ボルテックス速度を26%に、真空を200mbarに設定し、予熱を押す。
- 進行状況を監視します。サンプルが乾燥したら、サンプルを取り出し、ポンプを10分間さらに運転して蒸気を除去します。
- 試薬ボトル1および4からピペットを取り出し、希酸( 例えば 1%HCl)、続いて脱イオン水でポンプします。 DI水をポンピングして試薬2に使用したピペットをすすいでください。フード内では、試薬3で使用したピペットから適切な容器に溶媒を排出し、溶媒残留物が蒸発するまでフード内に保持します。
- スティックを防ぐためにプランジャーを取り外した状態でピペットを逆さにして保管してくださいgの逆止め弁を有する。
- ガラスピペットを一度使用してから、適切な容器に入れてください。
- フード内では、ガラス製品の溶媒残留物を蒸発させます。
- きれいな水と洗剤溶液でガラス製品をすすいでください。
5.第4日 - 作用溶液の調製およびGCバイアルへのFAMEの移動(約40サンプルについて2〜3時間)
- 材料を集める:乾燥サンプルを入れた4mLのアンバーバイアル;琥珀色の2mL GCバイアル; 400μL平底ガラスインサートとキャップ; 500μLガラスシリンジ; 50mLメスフラスコ;ストック溶液 - 50/50ヘキサン/ MTBE(試薬3)中のノナデカン酸エチル(19:0 EE内部標準)。
- ガラスシリンジを使用して、エチルノナデカノエート(19:0 EE)ストック溶液500μLを50 mLメスフラスコに加えます。
- 試薬3を用いて、フラスコを容積測定点まで満たす。
- フラスコをキャップし、5倍に転倒混和する。
- 3 mLを清潔な4 mLバイアルに移して、使用している溶液リザーバーに入れます。
- thを使う乾燥した脂肪酸メチルエステルとキャップを含む4 mLの各バイアルに、作業溶液300μLを加えます。
- サンプルを15秒間ボルテックスし、15分間放置する。
- ガラスパスツールピペットを使用して、懸濁した脂肪酸メチルエステルを注意深く400μLインサートを含む2mL GCバイアルに移す。
- 分析前に-20℃の冷凍庫に密封したGCバイアルを保管してください。
- GC分析のサンプルを提出する。
注記:分析は、補足ファイルS1に記載されている特定のGCカラムおよび条件を使用して実行する必要があります。メチル化の2週間以内にGC分析を完了することが最良である。
結果
レポートのデータテーブルは、スプレッドシートまたはデータベースに照合することができます。応答係数(異なる鎖長に対する応答を正規化する補正係数)を調整した後、ピーク面積を外部標準または内部標準のピーク面積と比較して抽出物中の濃度に到達させることができる。抽出された土壌の質量で除算することにより、データは土壌1g当たりのFAMEの質量として、または各FAMEの分子量を用いて、より一般的に報告された1g / molのnmolとして表すことができる。微生物FAMEsの合計は、微生物総バイオマスの指標であり、処理間で比較することができる( 図1 )。特定のFAMEはまた、グラム陽性又はグラム陰性細菌、放線菌、アーバスキュラー菌根菌、および真菌saprotrophic 19、20のような特定の微生物のグループに関連付けることができ 21、22、23、24アップ。特定のバイオマーカーの質量の割合は、これらの群の相対的存在量を反映することができる( 図2 )。全体的なFAMEの豊富なパターンは、コミュニティレベルの指紋を作成します。この指紋は、アジテーションなどの多変量解析技術を使用して微生物のコミュニティの非類似性を比較することができます ( 図3 )。ほとんどのDNAベースのアプローチとは対照的に、コミュニティレベルの脂質データは、相対的または絶対的な存在量として分析することができる。総バイオマスが試料間で実質的に異なる場合、これらの2つのアプローチは非常に異なる結果をもたらす。実験の根底にある生態学的疑問は、どのアプローチが使用されるかを決定するべきである。

F図1 :総FAMEバイオマス。連続トウモロコシ、受精草原、未受精草地の総FAMEバイオマーカーバイオマス(nmol g -1土壌)の比較。 この図の拡大版を見るには、ここをクリックしてください。

図2 :細菌と真菌のFAMEバイオマス。連続トウモロコシ、受精草原および未受精草地からの細菌および真菌FAMEバイオマーカーバイオマス(nmol g -1土壌)の処理比較。絶対量からの真菌および細菌の質量。平均(合計f /合計b)。 この図の拡大版を見るには、ここをクリックしてください。
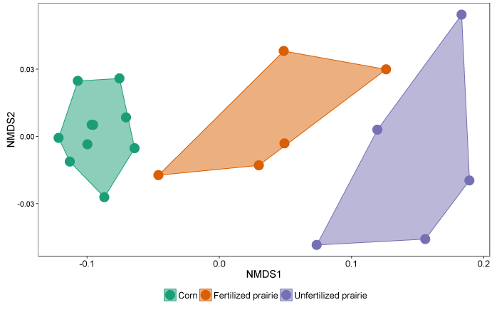
図3 :FAME脂質バイオマーカーの非測定次元スケーリング。全ての微生物FAME脂質バイオマーカーの絶対量プロファイルを用いた全体的な微生物群の比較。この例では、連続したトウモロコシと未処理の草原のコミュニティが分離され、非常に離れていますが、いくつかの受精した牧草のサンプルには、トウモロコシのものと類似の微生物のコミュニティがあり、その他のものは未取得の草原に似ています。 この図の拡大版を見るには、ここをクリックしてください。
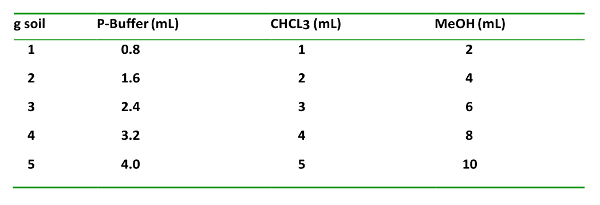
表1: T h e soLの VENの T 型 、propor S 上の TIは、G -1 土壌を 添加し 、D T H EIR オード R O F N 2 O ITIを 加えます 。これは、有機相および水相の適切な抽出および分離にとって重要である。
ディスカッション
多くの反復および/または実験単位を有する実験からの複数の試料の試験のために、研究者はリン脂質脂肪酸分析(PLFA)が時間および材料の点で禁止的であることを見出し得る25 。 PLFA法を用いて、細胞膜リン脂質を抽出し、精製し、改変したBligh and Dyer 26二相水性有機抽出物を用いて同定する。これに続いて、極性によって脂質を分離するための固相シリカクロマトグラフィー、およびリン脂質脂肪酸の脂肪酸メチルエステルへのアルカリ性メチル化が続く。 PLFAプロファイリングでは、脂質収率は低くてもよいが、非常に高純度である。微生物IDは脂肪酸メチルエステル法(MIDI-FA)の代替法を導入しました。 MIDI-FAの方法で、すべての脂質は純粋培養又は土壌/堆積物試料11から直接抽出された、12、27を介して鹸化。この方法は、PLFA法の濃縮または精製工程がないため、脂質損失が低く、迅速である。しかし、MIDI-FA法は、純粋な培養物中の生物を同定するために設計されたものであるため、迅速かつ安価であるが、最初の抽出または精製工程はない。したがって、共抽出されたコミュニティの署名27、28、29を歪ま土壌有機物から脂質様化合物を挙げることができます。この包含はまた、バイオマスの測定を歪めることができるので、MIDI-FAは、典型的には定性的土壌脂質13を説明粗くするためにのみ使用されてきました。
ここで説明する手順は、2つの別々の抽出手順の中で最良のものである:1)改変されたBligh and Dyer 26法を用いた脂質の抽出および濃縮、および2)脂肪酸メチルエステルsaメチル化、抽出、および塩基洗浄手順が市販されている。この方法は、これらのプロトコルの両方の利点を達成し、短所を最小限に抑えるために開発されました15 。 MIDI-FAを実施する前に初期抽出を行い、有機可溶性成分( 例えば、脂質)を単離し、これを精製工程で完了することにより、このプロトコルは速度と精度との間のバランスを提供する。この方法は、高純度が要求される場合( すなわち 、 13 C PLFA分析の場合)、またはリン脂質および中性脂質を別々に分析する場合には適していないが、多くの場合、DNAベースよりも高い感度で環境条件に対する微生物のコミュニティ応答を検出することができる方法30、31、32、33。膜脂質は細胞死の後に急速に分解し、情報の多くが死亡または非アクティブの生物34から来ている環境DNAとは対照的に、サンプリング5、7の時に住んでいる微生物のコミュニティを反映しています。土壌微生物35の間で観察休眠率の高さを考えると、生きたバイオマスの特性は、比較的細かい時間的スケールで時間的植物-微生物相互作用を理解するために使用することができ、脂質バイオマーカーは、微生物群集7の生理学的状態を分析するために使用することができます。大きなフィールド設定での微生物応答を評価するには、ハイスループットの方法が必要であることが示されています25 、ここで提案する方法はPLFAバイオマーカープロファイリングの精度を再現しませんが、MIDI-FA手順。この方法は、アドレッシングに有効なツールであることが証明されています大規模な農業生態系の研究36、37、38、42、43、44、45、46、47、48、49、50における土壌の広い範囲上の微生物群集動態に関する質問。
脂質クラスは、この方法で合成され、それらの別々のクラス22、39に含まれる情報の損失があるかもしれないが、力を強化することができる脂質クラスを組み合わせて16のアーバスキュラー菌根菌の原点検出する:両方のホスホから1ω5cを- および中性脂質40 。また、tこの方法では、未知の脂肪酸(非生物由来の有機物由来である可能性がある)の数は、この方法ではより高い可能性があり、MIDI-FAよりも低いことが示されており、脂質プロファイルの処理比較が、スループット能力が懸念される15 。中性画分は、主に真菌によって産生される貯蔵脂質から誘導されると考えられているが、土壌動物41からの寄与はいくらか小さいかもしれない。これに照らして、本明細書に記載の方法は、PLFAよりも真菌脂質18:2ω6,9cおよび18:1ω9cのより大きな寄与を示す結果を生じ得る。中性画分に現れやすい他の脂質には、飽和脂肪酸のいくつか、 例えば 16:0,18:0,20:0が含まれる。
脂質データを表現し分析する方法はいくつかあります。最も一般的な表現は、存在量(nmol g -1土壌)、モル分率n(ナノモルの個々の脂質nmol -1全脂質)、およびモルパーセント(モル分率* 100)。試料中の総脂質によって標準化されたモル分率およびモル%は、所与の脂質の相対存在量の尺度である。適切な変換後、 例えば 、平方根アークサイン、モル分率は、主成分または冗長解析コーディネーションによる分析での使用に適しています。存在量は、土壌1グラム当たり抽出される所定の脂質の絶対量である。細胞当たりの脂質の量はかなり一定であり、脂質抽出は非常に効率的で包括的であるため、総量は総脂質の良好な推定値であり、主要指標の豊富さはそれを表す生態学的グループのバイオマスを反映する17 。最後に、微生物群集組成を見るための良い方法は、多変量解析法16を用いることである( 例えば 、非対称多次元スケーリング(NMDS-データ変換を必要としない)または主要成分分析(PCA)は、すべての脂質バイオマーカーの相対存在量を比較するのに有用であり得る。
開示事項
著者は何も開示することはない。
謝辞
この研究はDOE五大湖バイオエネルギー研究センター(DOE BER事務局DE-FC02-07ER64494)とDOE OBP事務所(DE-AC05-76RL01830)によって資金提供された。著者はAnders Gurdaの患者とビデオ撮影と編集に巧みな貢献をしたことを認めたいと思っています。
資料
| Name | Company | Catalog Number | Comments |
| RapidVap | Labconco | 7900000 | Evaporative system |
| RapidVap | Labconco | 7491400 | Sample block |
| Chem-resistant vacuum pump | Labconco | 7584000 | Vacuum pump |
| Chemical trap cannister | Labconco | 7815300 | Trap cannister |
| Solvent insert | Labconco | 7515200 | Solvent trap insert |
| Diaphragm pump | Welch | 7398000 | DryFast vacuum pump |
| Water bath | Fisher | 15-462-15Q | 2 well water bath |
| Gas chromatograph | Various | N/A | For sample analysis |
| Centrifuge | Various | N/A | For sample separation |
| Freeze Dryer | Various | N/A | For sample lyophilization |
| Repipet (6) | BrandTech | 4720440 | For dispensing reagents |
| Vortex | Fisher | 02-215-365 | Analog vortex mixer |
| Teflon centrifuge tubes | Thermo/Nalgene | 3114-0030 | Teflon sample tubes |
| Caps | Thermo/Nalgene | DS3131-0020 | Caps for teflon tubes |
| Test tube | Corning | 9825-16 | 16x100mm tubes |
| Test tube | Corning | 9825-16xx | 16x150mm tubes |
| Caps | Corning | 9998-15 | 15-415 thread black phenolic caps w/PTFE liner |
| Pasteur pipets | Fisher | 13-678-20B | 14.6cm |
| 500 uL glass syringe | Fisher | 13684106LC | Hamilton 81217 |
| Amber vials | Agilent | 5182-0716 | 4mL Amber vials |
| Caps | Agilent | 5182-0717 | Blue screw caps |
| Inserts | Agilent | 5181-3377 | 400uL flat bottom glass inserts |
| Standards | |||
| 19:0 ethyl nonadecanoate (Ethyl nonadecanoate) | VWR | TCN0459-5G | Analytical standard |
| Chemicals | |||
| Dipotassium phosphate (K2HPO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Potassium phosphate monobasic (KH2PO4 - ACS grade or better) | Various | N/A | For making Phosphate-Buffer |
| Methanol (CH3OH - HPLC grade or better) | Various | N/A | For making Reagents 1 & 2 |
| Sodium hydroxide (NaOH - ACS grade or better) | Various | N/A | For making Reagents 1 & 4 |
| Hydrochloric acid (6N HCL) | Various | N/A | For making Reagent 2 |
| Hexane (HPLC grade or better) | Various | N/A | For making Reagent 3 |
| MTBE (Methyl tert-butyl ether - HPLC grade or better) | Various | N/A | For making Reagent 3 |
参考文献
- Van Der Heijden, M. G. a., Bardgett, R. D., Van Straalen, N. M. The unseen majority: Soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecol Lett. 11 (3), 296-310 (2008).
- Bever, J. D., et al. Rooting theories of plant community ecology in microbial interactions. Trends Ecol Evol. 25 (8), 468-478 (2010).
- Suleiman, A. K. A., Manoeli, L., Boldo, J. T., Pereira, M. G., Roesch, L. F. W. Shifts in soil bacterial community after eight years of land-use change. Syst Appl Microbiol. 36 (2), 137-144 (2013).
- Sayer, E. J., et al. Grassland management influences spatial patterns of soil microbial communities. Soil Biol Biochem. 61, 61-68 (2013).
- Fernandes, M. F., Saxena, J., Dick, R. P. Comparison of Whole-Cell Fatty Acid (MIDI) or Phospholipid Fatty Acid (PLFA) Extractants as Biomarkers to Profile Soil Microbial Communities. Microbial Ecol. 66 (1), 145-157 (2013).
- van der Heijden, M. G. A., Wagg, C. Soil microbial diversity and agro-ecosystem functioning. Plant Soil. 363 (1-2), 1-5 (2013).
- Allison, V. J., Miller, R. M., Jastrow, J. D., Matamala, R., Zak, D. R. Changes in soil microbial community structure in a tallgrass prairie chronosequence. Soil Sci Soc Am J. 69 (5), 1412-1421 (2005).
- Kowalchuk, G. A., Buma, D. S., de Boer, W., Klinkhamer, P. G. L., van Veen, J. A. Effects of above-ground plant species composition and diversity on the diversity of soil-borne microorganisms. A van Leeuw. 81 (1-4), 509-520 (2002).
- Bardgett, R. D., Hobbs, P. J., Frostegard, A. Changes in soil fungal:bacterial biomass ratios following reductions in the intensity of management of an upland grassland. Biol Fert Soils. 22 (3), 261-264 (1996).
- Frostegård, &. #. 1. 9. 7. ;., Tunlid, A., Bååth, E. Use and misuse of PLFA measurements in soils. Soil Biol Biochem. 43 (8), 1621-1625 (2011).
- Haack, S. K., Garchow, I. H., Odelson, D. A., Forney, L. J., Klug, M. J. Accuracy , Reproducibility , and Interpretation of Fatty Acid Methyl Ester Profiles of Model Bacterial Communitiest. Appl Environ Microbiol. 60 (7), 2483-2493 (1994).
- Drenovsky, R. E., Elliott, G. N., Graham, K. J., Scow, K. M. Comparison of phospholipid fatty acid ( PLFA ) and total soil fatty acid methyl esters ( TSFAME ) for characterizing soil microbial communities. Soil Biol Biochem. 36, 1793-1800 (2004).
- Cavigelli, M. A., Robertson, G. P., Klug, M. Fatty acid methyl ester ( FAME ) profiles as measures of soil microbial community structure. Plant Soil. 170, 99-113 (1995).
- Determination of microbial community structure using phospholipid fatty acid profiles. Molecular microbial ecology manual Available from: https://www.researchgate.net/profile/Robert_Findlay2/publication/281208148_Determination_of_microbial_community_structure_using_phospholipid_fatty_acid_profiles/links/55db4f0b08aec156b9afe776.pdf (2004)
- Balser, T. C., Liang, C., Gutknecht, J. L. Linking microbial community analysis and ecosystem studies: A rapid lipd analysis protocol for high throughput. Biol Fert Soils. , (2017).
- Findlay, R. H., King, G. M., Watling, L., Watling, L. E. S. Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sediments Efficacy of Phospholipid Analysis in Determining Microbial Biomass in Sedimentst. Appl Environ Microbiol. 55 (11), 2888-2893 (1989).
- Willers, C., Jansen van Rensburg, P. J., Claassens, S. Microbial signature lipid biomarker analysis - an approach that is still preferred, even amid various method modifications. J Appl Microbiol. 118 (6), 1251-1263 (2015).
- Zelles, L., Bai, Q. Y., Beck, T., Beese, F. Signature fatty-acids in phospholipids and lipopolysachharides as indicators of microbial biomass and community structure in agricultural soils. Soil Biol Biochem. 24 (4), 317-323 (1992).
- Frostegard, A., Tunlid, A., Baath, E. Phospholipid fatty-acid composition, biomass, and activity of microbial communities from 2 soil types experimentally exposed to different heavy-metals. Appl Environ Microbiol. 59 (11), 3605-3617 (1993).
- Federle, T. W., Dobbins, D. C., Thorntonmanning, J. R., Jones, D. D. Microbial biomass, activity, and community structure in subsurface soils. Ground Water. 24 (3), 365-374 (1986).
- Vestal, J. R., White, D. C. Lipid analysis in microbial ecology - quantitative approaches to the study of microbial communities. BioScience. 39 (8), 535-541 (1989).
- Wilkinson, S. G. Gram negative bacteria. Microbial Lipids. , 299-488 (1988).
- Balser, T. C., Treseder, K., Ekenler, M. Using lipid analysis and hyphal length to quantify AM and saprotrophic fungal abundance along a soil chronosequence. Soil Biol Biochem. 37 (3), 601-604 (2005).
- Buyer, J. S., Sasser, M. High throughput phospholipid fatty acid analysis of soils. Appl Soil Ecol. 61, 127-130 (2012).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Can J Biochem Phys. (37), 911-917 (1959).
- Schutter, M. E., Dick, R. P. Comparison of Fatty Acid Methyl Ester (FAME) Methods for Characterizing Microbial Communities. Soil Sci Soc Am J. 64 (5), 1659-1668 (2000).
- Jandl, G., Leinweber, P., Schulten, H., Ekschmitt, K. Contribution of primary organic matter to the fatty acid pool in agricultural soils. Soil Biol Biochem. 37, 1033-1041 (2005).
- Nielsen, P., Petersen, S. O. Ester-linked polar lipid fatty acid profiles of soil microbial communities: a comparison of extraction methods and evaluation of interference from humic acids. Soil Biol Biochem. 32, 1241-1249 (2000).
- Duncan, D. S., Jewell, K. A., Suen, G., Jackson, R. D. Detection of short-term cropping system-induced changes to soil bacterial communities differs among four molecular characterization methods. Soil Biol Biochem. 96, 160-168 (2016).
- Liang, C., et al. Switchgrass rhizospheres stimulate microbial biomass but deplete microbial necromass in agricultural soils of the upper Midwest, USA. Soil Biol Biochem. 94, 173-180 (2016).
- Jangid, K., et al. Land-use history has a stronger impact on soil microbial community composition than aboveground vegetation and soil properties. Soil Biol Biochem. 43 (10), 2184-2193 (2011).
- Ritz, K., et al. Spatial structure in soil chemical and microbiological properties in an upland grassland. FEMS Microbiol Ecol. 49 (2), 191-205 (2004).
- Carini, P., et al. Relic DNA is abundant in soil and obscures estimates of soil microbial diversity. J Chem Inf Model. 53 (9), 1689-1699 (2013).
- Lennon, J. T., Jones, S. E. Microbial seed banks: The ecological and evolutionary implications of dormancy. Nat Rev Microbiol. 9 (2), 119-130 (2011).
- Gutknecht, J. L. M., Field, C. B., Balser, T. C. Microbial communities and their responses to simulated global change fluctuate greatly over multiple years. Glob Change Biol. 18, 225-269 (2012).
- Pei, Z., et al. Soil and tree species traits both shape soil microbial communities during early growth of Chinese subtropical forests. Soil Biol Biochem. 96, 180-190 (2016).
- Oates, L. G., Duncan, D. S., Sanford, G. R., Liang, C., Jackson, R. D. Bioenergy cropping systems that incorporate native grasses stimulate growth of plant-associated soil microbes in the absence of nitrogen fertilization. Ag Ecosys Environ. 233, 396-403 (2016).
- Bååth, E. The use of neutral lipid fatty acids to indicate the physiological conditions of soil fungi. Microbial Ecol. 45 (4), 373-383 (2003).
- Ngosong, C., Gabriel, E., Ruess, L. Use of the signature Fatty Acid 16:1ω5 as a tool to determine the distribution of arbuscular mycorrhizal fungi in soil. J Lipids. 2012, 236807 (2012).
- Sharma, M. P., Buyer, J. S. Comparison of biochemical and microscopic methods for quantification of arbuscular mycorrhizal fungi in soil and roots. Appl Soil Ecol. 95, 86-89 (2015).
- Oates, L. G., Balser, T. C., Jackson, R. D. Subhumid pasture soil microbial communities affected by presence of grazing, but not grazing management. Appl Soil Ecol. 59, 20-28 (2012).
- Liang, C. Potential legacy effects of biofuel cropping systems on soil microbial communities in southern Wisconsin, USA. Ag Sci. 2 (2), 131-137 (2011).
- Herzberger, A. J., Duncan, D. S., Jackson, R. D. Bouncing Back Plant-Associated Soil Microbes Respond Rapidly to Prairie Establishment. PloS One. 9 (12), 1-14 (2014).
- Fraterrigo, J. M., Balser, T. C., Turner, M. G. Microbial community variation and its relationship with nitrogen mineralization in historically altered forests. Ecology. 87 (3), 570-579 (2006).
- Kao-Kniffin, J., Balser, T. C. Elevated CO2 differentially alters belowground plant and soil microbial community structure in reed canary grass-invaded experimental wetlands. Soil Biol Biochem. 39 (2), 517-525 (2007).
- Mentzer, J. L., Goodman, R. M., Balser, T. C. Microbial response over time to hydrologic and fertilization treatments in a simulated wet prairie. Plant Soil. 284 (1-2), 85-100 (2006).
- Ushio, M., Wagai, R., Balser, T. C., Kitayama, K. Variations in the soil microbial community composition of a tropical montane forest ecosystem: Does tree species matter. Soil Biol Biochem. 40 (10), 2699-2702 (2008).
- Bartelt-Ryser, J., Joshi, J., Schmid, B., Brandl, H., Balser, T. Soil feedbacks of plant diversity on soil microbial communities and subsequent plant growth. Perspect Plant Ecol. 7 (1), 27-49 (2005).
- Fichtner, A., von Oheimb, G., Härdtle, W., Wilken, C., Gutknecht, J. L. M. Effects of anthropogenic disturbances on soil microbial communities in oak forests persist for more than 100 years. Soil Biol Biochem. 70, 79-87 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved