Method Article
분자 프로브 최적화 (광합성 생물의 세포 사망을 확인하는 방법
요약
미생물 인구는 전체 동작을 지시 할 수있는 실질적인 세포 이질성가 포함되어 있습니다. 유동 세포 계측법을 통해 분자 프로브 분석 그러나 그것의 응용 프로그램이 종 사이에서 변화, 세포의 생리 학적 상태를 확인할 수 있습니다. 이 연구는 과소 평가하거나 거짓 긍정적 인 결과를 기록하지 않고, 정확하게 cyanobacterium 인구 내에서 세포 사망을 결정하는 프로토콜을 제공합니다.
초록
필드와 실험실 연구에서 미생물 개체군은 형태 학적 및 생리 학적 파라미터에 높은 이질성을 표시하는 것으로 나타났다. 미생물 세포 분열 및 대사 활동이 감소함으로써 휴면 상태로 존재할 수있는 균체의 실시간 상태를 결정하면, 라이브 또는 죽은 카테고리로 넘어 간다. 전체 인구의 생존을 결정하는 데 도움이 할 수있는 신속하고 정확한 방법은 분자 프로브 감지 및 미생물의 정량화에 대한 필요성, 세포 계측법 (FCM)을 흐름을 제공 감안할. 막 완전성을 검출하도록 모델에 남조류 Microcystis 녹농균을 SYTOX 그린 SYTOX 오렌지를 사용함으로써, 우리는 단일 세포 사망의 신속한 표시에 대한 방법을 개발 양도. actio의 필적 모드가 유사 여기 및 발광 파장이 다른 제품이 있지만,이 저널에서 사용 분자 프로브 (각각으로 녹색 또는 오렌지색 핵산 프로브 부른다앞이 프로브를 언급에 N, 우리는 구체적으로)를 참조하십시오. 분자 프로브를 사용하여 프로토콜 농도와 배양 시간에 주로 서로 다른 종 사이에 다릅니다. M.aeruginosa에 출발이 프로토콜에 따라 녹색 핵산 프로브는 30 배양 분, 10 분 후 1 μM에서 오렌지 핵산 프로브 후 0.5 μM의 농도에서 최적화되었습니다. 막 손상 세포의보고에서 주도 언급 최적의보다 적은 양의 프로브 농도. 반대로, 두 프로브 5 μM 농도 이상은 '생방송'세포 '는 비 생존 "세포 수의 위에 표현 선도, 대상 형광을 생성함으로써 비특이적 염색의 유형을 나타낸다. 제어 세대의 적합성이 논의 될 수 남아 있지만, 양성 대조군 (열 사망)는, 검증 가능한 죽은 바이오 매스를 제공했다. 녹색과 주황색 핵산 프로브 우리 드를 최적화하기위한 단계의 논리적 순서를 보여줌으로써시아 노 박테리아 효과적으로 생리 상태를 분석하는데 사용될 수있다 프로토콜을 만드는 방법 monstrate.
서문
세포는 지속적으로 생체 변수를 수정하고 그 기능을 변화시켜 환경에 반응 복잡한 시스템이다. 3 - 동종 미생물 인구 자연과 실험실 모두의 인구 역학은 비교적 일정한 환경 조건 (1)에서 발생, 개체군의 발전에 의해 영향을받습니다. 자연 미생물 군집의 변화로 인해 환경 조건의 매우 가변적 특성으로 발생한다. 이 때로는 확률 과정 이후 인구 평균에 매우 다른 소집단을 생산하고 있습니다. 최근의 증거는 이러한 생리적 개체군은 환경 조건에 다르게 반응과 크게 영향을 전체 인구의 3,4에 영향을 미치는 신호 화합물 또는 억제제를 생성 할 수 있음을 밝혔다.
집단 내 이질성을 정의하는 방법을 설정하면 해제의 열쇠입니다다양한 환경에서 미생물의 생태를 derstanding 및 heterocysts 같은 전문화 된 세포를 개발하고, 이러한 환경 변동에 대한 응답으로 형태 학적 이질성을 표시 크게 영향 인간의 물 보안에. 종 등 Anabaena와 같은 독성 Microcystis으로, 귀찮은 시아 노 박테리아의 지식을 구축 할 때 필수적이다 및 akinetes 2. 대조적으로, Microcystis 세포 스트레스 반응 중에 명백한 형태 이질성을 표시하지 않는다. 실용적인 비 생존 세포 간의 차별 생리 분화의 가장 중요한 측면이다 미생물 개체군에 대한 이해를 허용한다. 그러나 세균의 생존 자체의 개념 문제는 어렵고 가난 1,5,6을 특징으로 남아있다.
유동 세포 계측법 (FCM)은 각각의 세포를 분석하는 안정적이고 빠른 방법입니다. 단일 셀의 물리 치료사에 대한 이해를 높이려면FCM의 뜻을 통해, 프로브 분자는 생화학 적 대사 과정 (7)의 개수를 구별하는데 사용되어왔다. 이 세포 및 인구 수준에서 종의 증가 지식을 주도 차례로 수자원 관리 8,9 도움이되었습니다. 그러나, 생물 인해 분자 프로브 설계 및 프로토콜 구현 6,10,11의 숫자로 이끈 세포 벽과 세포막에 구멍 펌프, 분자 프로브 흡수 및 유출의 관점에서 차이가있다. 상업 및 연구 목적을 위해 사용 가능한 분자 프로브는 종종 매우 상이한 세포 유형에 적용될 수있는 일반적인 프로토콜에 공급된다. 하나는 다른 6 하나의 세포 유형을 위해 개발 된 프로토콜을 전송하기에 매우주의해야하며, 효과적으로 사용하기 전에 분자 프로브를 최적화하기 위해 필수적인 작업은 따라서이다.
녹색과 주황색 핵산 프로브는 최소한의 기본 더블 및 단일 가닥 핵산을 모두 결합 선택의 ivity 및 세포의 세포막의 무결성을 평가하기 위해 사용된다. 녹색 핵산 프로브는 세포 생존의 지표로서 작용할 수 요오드화 프로피 듐 등의 계 화합물 (12)과 같은 다른 분자 프로브에 비해 현저하게 개선 된 셀 라벨 형광 신호를 갖는다. 용어 "세포 생존 '는 여기 DNA 분해가 세포막 무결성 손실 후에 발생한다고 가정. 핵산 프로브는 세 양전하와 비대칭 시아닌 염료이며, 모두 진핵 11,13 및 원핵 생물 14, 15에, 특징 농도에서 양막 세포를 입력 할 수 없습니다. 핵산 핵산 프로브의 결합은 멤브레인 무결성이 손상된 세포에서 내인성 신호로부터 형광 방출> 500 배 증가까지 초래할 수있다. 이러한 녹색 핵산 프로브 분자 프로브는 단일 세포 생리학의 좋은 지표가 될 수 있지만, 필요에 t 존재혼자 Microcystis 실험에서 0.5 μm의 15 - - 0.1 μM에서 30 분 및 농도 범위 - 19 배양 시간은 7 분에서 다양대로 O, 의도 된 대상 유기체 각 프로브를 최적화 할 수 있습니다.
여기에서 우리는 녹색의 세포 측정 분석과 (날짜에 시아 노 박테리아 종 M.aeruginosa에서 테스트되지) 비교적 새로운 오렌지 핵산 프로브를 최적화하는 프로토콜을 제시한다. 다음 개발 된 방법론은 다른 종에 전송함으로써 미생물의 이해와 생태적 행동을 증가 다른 분자 프로브의 프로토콜을 최적화하기위한 플랫폼으로 사용될 수있다.
프로토콜
분자 프로브 및 흐름 사이토 1. 준비
- 초순수 여과하고 H 2 O에 필요한 농도의 분취 액에 디메틸 설폭 사이드 (DMSO)에 5 mM의 용액으로 공급 된 핵산 프로브의 원액을 희석
- 25 O C까지 사용 - -5 O C와 사이의 어두운 조건에서 핵산 프로브를 저장합니다.
- 사이토 흐름과 부하 소프트웨어 패키지를 켭니다 (FCM 사양 재료 / 장비의 표 참조).
- 시료 주입 프로브 (SIP)에 빈 용혈 관 (12 X 75mm)를 놓고, FCM 청소 프로세스를 시작 다시 세척 한 후 방해를 없애기 클릭합니다.
참고 : SIP에 대한 몇 가지 샘플 단계는 마이크로 원심 튜브를 포함하는 튜브의 여러 종류를 수용 할 수 있습니다. FCM 장치에 사용되는 프로브 분자 희석제 및 시스 유체 분석 등급 "타입 1"을 0.22 ㎛의 막 여과 소스이다. - 장소15 분 금식하는 유체 속도 (또는> 66 μL / 분의 유속으로) - SIP에 초순수 여과 H 2 O 2 ㎖와 신선한 용혈 튜브, 10 시간 제한을 설정한다.
- 배경 잡음을 줄이고 '실행'을 클릭 형광 빛 산란 채널 관련 임계 값을 넣어 새로운 데이터 셀을 선택합니다.
- 초당 총 이벤트가 제조업체의 추천 아래에없는 경우, 빠른 2 분 동안 오염 제거 용액의 2 ml의 샘플을 실행 한 다음 1.4 및 1.5 단계를 반복합니다.
주 :이 모델에 따라 다를 수 있기 때문에, 스타트 업 프로토콜을 청소 FCM에 대한 제조업체의 권장 사항을 확인하시기 바랍니다. 특정 임계 값에 대한 테스트는 일부 장비가 향상 또는 광 검출기에서 기록 된 전기 신호를 감소 광전자 증 튜브 (의 PMT)에 전압 이득을 적용 할 사용자를 허용하는 FCM 모델과 일치 할 필요가있다. 이 체험관에서 사용 FCM 모델, 표준은 전압의 PMT를 고정 입자보다 작은 2.0 μm의 전자 노이즈를 제외 80,000 앞으로 빛 산란 (FSC-H)의 임계 값을 사용하고있다.
문화 및 초기 세포 수의 2. 준비
- 120 O ℃에서 20 분 동안 250 mL의 비커에 조류 미디어 (50 배 농도)의 초순수 여과 H 2 O 2 ml를 압력솥 98 ml의
- SIP에서 튜브에 높은 정상 상태 밀도 장소 샘플 2 ㎖에 M.aeruginosa (7806 PCC)의 초기 단일 문화에서. 소용돌이로 교반 또는 초음파 (20)에 의한 콜로니 형성을들을 분해하고 광학 현미경을 통해 균등하게 분산 된 세포를 확인합니다.
참고 : 초음파에 과도한 노출은 세포 용해가 발생할 수 있습니다주의를 요합니다. 이러한 측면 빛의 산란으로 출력 (M.aeruginosa 같은 종에서 발견) 초음파 가스 소포를 축소 할 수 있기 때문에 (SSC-H)의 강도는 그 자체로 더 될 수 있습니다nsitive. - FCM 소프트웨어 내에서 앞으로 빛 산란 (FSC-H)의 데이터를 기록하고 축에 로그 스케일에서 볼 수 "로그"를 클릭하여 플롯 사양을 구성 할 수있는 히스토그램 플롯을 선택합니다.
- 별도의 출력, 이러한 M.aeruginosa에있는 액세서리 광합성 색소 피코시 아닌 (FL4-H, 675 ± 12.5 ㎚), 천연 형광을 기록 (축 로그) 다른 히스토그램을 선택합니다.
- 피코시 아닌 그 결과 형광에서 배출량을 필터링 할 수 있습니다 탐지기를 자극 할 수있는 광원을 사용합니다.
참고 : 피코시 아닌은 600 nm의 이상 흥분 만 빨간색 광원 (21)과 감지 반면 광합성 색소는 엽록소로, 일반적으로 사용되는 488 nm의 청색 레이저와 흥분이 될 수 있습니다. 여기 광원의 흐름 세포 계측기 제조 업체 및 방출 검출기의 스펙트럼, 여기에 모두 488 nm에서 640 nm의 레이저로 체크와 함께 사용되었다675 ± 12.5 nm의 광학 필터. - 대상 유기체 (10 μm의)과 상대적으로 느린 유속 (/ 분 14 μL)의 코어 크기에 가장 가까운 가장 높은 해상도 설정을 선택를 기록하십시오.
참고 : 최고 해상도 샘플의 경우는 초당 이벤트의 추천을 생산에 따라 실행해야합니다. - 취득 데이터 게이트 밖으로 빛의 산란 및 / 또는 형광 신호 임계 값을 사용하기 전에 전자 배경 잡음 또는 세포 샘플 파편에 의해 발생되는.
- 새로운 데이터 셀을 선택 로그 스케일에 FSC-H와 SSC-H 매개 변수와 밀도 플롯을 작성하고 실행을 클릭합니다.
- 샘플 밀도가 과도 이벤트 레이트에 이르게되면 희석 단계는 정확도와 정밀도를 증가시키기위한 조치가 취해질 수있다.
- 밀도 플롯에 배경 소음이나 파편 (FSC <320,000)에 의해 생성 된 낮은 수준의 산란 신호를 제외하기 이전 히스토그램에서 소프트웨어 게이트를 적용합니다. 상대적으로 높은 형광 반대로 게이트피코시 아닌 세포들로부터의 신호 만이 이벤트 (- 1,950,000 FL4, 56,000)을 포함한다.
- 용액 당 얼마나 많은 셀을 작동하는, 게이트 영역에 기록 셀의 개수를 사용하여 FCM 통과 한 시료의 총 부피로 나눈다.
주 : 여기에서 사용 FCM 모델은 샘플 량을 판별 할 수 있도록 마이크로 프로세서 제어 연동 펌프 시스템이있다. 기타 FCM 장비는 교정 비드 정지 또는 전체 샘플 볼륨을 확인하기 위해 H 2 O의 중량 / 부피의 차이의 계산을 필요로 할 수있다. - M.aeruginosa의 배치 성장주기 (250,000 세포 / ml)을 시작하기 위해 신선하게 제조 된 미디어에 필요한 세포의 볼륨.
주 : 종 그렇게 배치주기가 라이프 사이클 단계를 결정하는 사전 - 기록해야 그들의 시츄 환경 파라미터 및 영양소 이용 가능성에 따라 성장 속도에 차이가된다.
3. Optim을분자 프로브 세포 흡수 화
- M.aeruginosa 문화의 수확 절반 지수 단계에서 2 단계에서 제조 및 '라이브'컨트롤로 사용합니다.
주 : 직선 상에 지수 고밀도 배양 물에서 희석 된 샘플은 초기 지연 / 위상으로부터 유도 접종 배양 물에 비해, 사균 회전율을 통해 최적화 결과에 영향을 미칠 수있다. - 30 분 6,11,22 1 시간, 파라 포름 알데히드 또는 4 % 포름 알데히드 60 ℃로 방법을 다음과 같은 70 % 에탄올, 가열 샘플을 사용하여 '죽은'컨트롤로 나머지 절반을 준비합니다. 샘플의 미세 환경의 변화 (예., 산도)를 확인합니다.
참고 : M.aeruginosa에 긍정적 인, 열 사망, '죽은'컨트롤 피코시 아닌 신호에서의 감소를 통해 '라이브'샘플과 구별된다. 다른 방법으로 사망률을 유도하는 것은 동일한 출력을 일으키지 않습니다 및 VAR 것종 Y. - 다른 혼합 비율을 이용하여 시료를 설정 '라이브'와 '죽음의 샘플 (예를 들어, 0 %, 25 %, 50 %, 100 %).
- 소용돌이로 교반 또는 초음파에 의해 콜로니 형성을들을 분해하여 pH를 확인합니다.
- 각각의 검출기를 통해 피코시 아닌 신호를 기록하는 488 나노 미터 녹색에서 형광을 기록 할 수있는 검출기와 함께 레이저 (FL1, 530 ± 15 ㎚), 오렌지 (FL2, 585 ± 20 ㎚) 핵산 프로브 및 640 nm의 레이저를 선택합니다.
주 : DNA에 결합하면 오렌지 핵산 프로브가 570 내지 547 nm에서 방출 최대의 여기 파장을 갖는 반면, 녹색 핵산 프로브는, 523 내지 504 nm의 발광 최대치의 대략 형광 여기 파장을 갖는다. 488 nm의 아르곤 이온 고체 레이저가 모두 분자 프로브를 여기 시키는데 사용될 수 있지만, (547 nm의 최대)가 그린 레이저 높은 오렌지색 형광을 생성 할 것이다. - 출발점으로서, 소개제조 업체와 분자 프로브는 50 % '라이브'50 % '죽은'문화 농도를 권장하고 어둠 속에서 부화.
- 새로운 데이터 셀을 선택 배경 잡음 (FSC-H 80,000)를 줄일 수 임계 값 및 트리거와 SIP에서 샘플을 놓습니다.
- FSC-H와 SSC-H 매개 변수 및 3 개의 막대 그래프와 밀도 플롯을 작성합니다. 각각의 분자 프로브 광 검출 채널 (FL1 또는 2), 피코시 아닌 한 배출량 (FL4-H) 및 로그 스케일에 다른 FSC-H 모두를 감지를 사용하여 한 히스토그램.
- 시점 (1, 5, 10, 15, 30 및 60 분)의 전화 번호, 개별 데이터 셀에 기록하는, 최대 60 분간 어둠 속에서 핵산 프로브 M.aeruginosa의 샘플을 배양한다.
참고 : 특정 화학 물질의 잠재적 인 반응에 제조와 같은 산도 검사 등의 매개 변수를 조정할 때 (시험 핵산에 대한 버퍼가 인산염 또는 일가 또는 디바의 높은 수준을 포함 할 수 없습니다 프로브빌려준 양이온, DNA와 결합이 감소 될 것이다). - 각각의 형광 프로브 채널 히스토그램으로, 셀 크기를 유기체 대상에 대한 - 소프트웨어 게이트는 FSC-H의 히스토그램 (1,500,000 320,000)를 포함에 적용됩니다.
주 :이 프로토콜에서 사용되는 농도의 증가 또는 M.aeruginosa 샘플 또는 핵산 프로브의 초기 재고 용액 부피의 감소 중 하나에 의해 변경 될 수 0.05, 0.1, 0.5, 1, 5, 10, 50 및 100 μM이었다. - 형광 프로브 채널에서 가장 높은 히스토그램의 피크 (- 1,650,000, 오렌지 FL2-H, 30,000 - 녹색 FL1-H, 240,000 165,000)에 다른 포괄적 인 소프트웨어 게이트를 적용하고 이후에 게이트 그 밀도 플롯에 긍정적 인 프로브의 형광.
- 분자 프로브 농도 (예 : X 0.1 X 10) 및 / 또는 온도와 산도 수준 필요한 경우 조정, 100 % "라이브", 100 % '죽은'모든 혼합 배양 샘플 3.11 - 실행 3.1 단계를 반복합니다. <리> 핵산으로 염색 된 세포의 총 분율을 찾기 위해 (반 총 FSC-H 또는 100 % '죽은'배양에서 촬영) "죽은"셀 원래 셀 밀도에 긍정적 분자 프로브 형광 신호의 수를 비교하여 프로브.
- 비특이적 염색 (편도 ANOVA 또는 분산 크루스 칼 - 월리스 일방향 분석 수단을 사용하여 제조없이 세포 핵산 프로브 흡수의 최대 백분율에 대한 최적의 프로토콜을 찾기 위해 각각의 농도에서 각각의 시간 기간 동안 이렇게 데이터) 비모수 경우.
4. 분자 프로브 형광 차별
- 고유 또는 비 특정 세포 염색에서 형광 간섭 / 중복의 테스트를 위해 50 % '라이브'50 % '죽은'혼합 문화의 데이터를 선택하고 모든 게이트를 벗어.
- 만 FSC-H의 히스토그램 (320,000 - 1,500,000)를 포함하는 소프트웨어 게이트를 적용 대상에 대한 것은 피코시 아닌으로, 셀 크기를 유기체채널 히스토그램.
- 게이트 '죽은'으로 표시된 가장 낮은 피크의 추가와 함께 '라이브'로 가장 높은 피코시 아닌 피크와 레이블.
- 평균 파장을 모두 기록, '라이브'다음 '죽은'피코시 아닌 (FL4) 신호를 한 번에 이용하여, 각각의 분자 프로브 형광 히스토그램 채널에 상기 게이트 공정을 수행한다.
주 :이 실험에서 사망률을 유발 모드는이 프로토콜에 따라 명확 피코시 아닌 신호를 감소 열처리에 의해 이루어졌다. '죽은'세포의 생산 인구의 다른 방법은 획득 한 실행에서 서로 다른 출력을 얻을 수 있습니다. - 비 긍정적 인 분자 프로브의 형광 ( '죽은') 및 고유 / 비 특정 신호 ( '라이브')의 평균 파장은 프로토콜의 감도를 결정합니다.
주 : '라이브'와 '죽은'과 짧은 여행의 형광 차별을 개선하기 위해관리 포인트는 세포벽 투과성이 얻어진 형광 신호 (6)를 개선하기 위해 영양분 고갈 된 세포 또는 에틸렌 디아민 테트라 아세트산 (EDTA)에서 활성 얼룩 흡수에 탄소원을 증가시킨다. 스펙트럼 중첩 일부 FCM 모델 한정 보상 샘플 수집 (PMT 전압 변화) 동안 또는 사후 분석 전문 소프트웨어에서 사용자 조작 페어 보정에 의해 수행 될 수있다. - '죽은'세포의 최고 금액이 발생 비특이적 얼룩없이 염색 된 최적화 된 프로토콜을 선택합니다. 테스트의 숫자가있는 경우 비슷한 결과가 좋은 형광 신호 차별과 함께 가장 낮은 농도와 배양 시간 프로토콜을 받아들입니다. 팔로우는 사이토 종료 절차에 대한 지침을 제조하고 있습니다.
결과
지수 상에 M.aeruginosa 배치 문화에서 앞으로 빛 산란 (FSC)와 측면 빛 산란 (SSC) 출력은 각각 셀 크기 (직경) 및 내부 단위에 대한 정보 (그림 1A)를 제공합니다. FSC는 M.aeruginosa하기에는 너무 큰 및 / 또는 작은 세포를 구별 할 수있다. 이 차별 또는 게이팅은 FSC 출력 (도 1C)의 소정 포인트 사이의 데이터에 의해 정제 할 수있다. 빨간색 광원에 의해 심문을 할 때 피코시 아닌은, M.aeruginosa 광합성 장치의 주요 구성은 강한 신호를 생성 (예 : 640, EM : 675 ± 12.5 ㎚) FSC에서 수행 된 것과 유사한 더 게이트 인구에 사용할 수 있습니다, 게이팅하지만 형광과 (그림 1D). FSC 형광 신호에서, 데이터는 F에 대한 M.aeruginosa에 특정 데이터 원본 출력 (그림 1A)에서 문이 될 수있다원고 판 세포 수 (그림 1B).
시아 노 박테리아 인구에서 셀당 자기 형광은 생리 학적 상태의 함수로 다릅니다. 여기에 세포는 지수 상 문화 '라이브'제어 인구 상대적으로 높은 멀리 붉은 형광을 보여주는 '죽은'제어가 1 시간 동안 60 O를 C 열에 노출에서 수확했다. '살'때 더 높은 색소와 '죽은'낮은 착색 된 컨트롤이 형광도의 감소 변화가 분명하다 혼합 (도 2A & B). '죽은'셀 형광 FSC 파라미터는 분자 프로브를 촬영 한 전체 셀을 구별하는데 사용될 수있다. 손상된 막 또는 '죽은'세포 핵산 프로브는 하나의 부가적인 신호를 생성한다; FL1 채널 오렌지 핵산 교류를위한 녹색 핵산 프로브 또는 FL2 채널 (585 ± 20 ㎚)에 대한 (530 ± 15 ㎚)네이티브 '살'형광 신호에 비해 ID 프로브 (도 3A & B). 세포막 손상과 세포 모두에서 핵산 프로브의 확인이 표면 형광 현미경을 통해 알 수있다 (도 4a 및 D).
녹색 핵산 프로브에 의해 염색했다 세포의 총 비율이 있었다 혼합 샘플에서 얻은에만 M.aeruginosa는 FSC-H의 히스토그램 (- 1,500,000 320,000)에서 세포 크기 포함하는 사전 게이트. 50:50 '라이브 : 죽은'에서 샘플, 녹색 형광 세포는 '죽은'세포 인구에서 원래의 밀도 (비교 하였다 히스토그램 FL1 (530 ± 15 ㎚)에서 가장 높은 피크에서 게이트 중 총 FSC-을 절반으로하여 H 또는) 만 100 % '죽은'세포 샘플에 별도의 세포 수를 실행. 100 % 위 비특이적 염색이 발생 함을 표시. 녹색 nucle을 촬영했다 세포의 평균 비율IC 산 프로브는 원거리에서; 배양의 0.05 μm의 10시 100 μM에서 177.1 ± 5.1 %로 1 분 후 분 (표 1)에서 15 ± 0.3 %. (제외) 1 μM 이상의 농도가 비특이적 염색을 보여 주었다 (예., 분자 프로브를 차지하기 시작했다 '라이브'세포). 비특이적 염색을 나타내지 않았다 농도간에 양방향 ANOVA (0.05-1 μM)을 녹색 핵산 프로브 및 M.aeruginosa, F에서 배양 시간의 농도 사이의 상호 작용에 전반적으로 유의 한 차이를 나타내었다 (12 , 40) = 6.48, P <0.001. 녹색 핵산 F (3, 40)를 사용 프로브 = 836.92, P <0.001 및 배양 시간 F (4,40) = 347.98, P <0.001의 농도에 걸쳐 주요 효과가 있었다. 사후 Tukey에 테스트는 0.5 내지 1 μM (p <0.001)를 제외한 모든 농도 사이의 유의 한 차이를 나타내60 분 (p <0.001) - (1)의 모든 배양 시간 사이에 유의 한 차이. 그러나, 편도 분산 분석에서 사후 Tukey에 테스트 0.05 μM (P> 0.05), 1 ㎛ (P> 0.05) (그림 5A) 30과 60 분 사이에 차이가 없습니다 녹색 핵산 프로브의 평균 흡수를 한 것으로 밝혀졌습니다. (FL4 통해 측정) 집단의 차별 FL1에서 '라이브'와 '죽은'상대적인 형광 신호의 평균 비율은 714 ± 14.8 (RFU)의 60 분 후 0.1 μM에서 높은 것에서 녹색 핵산 프로브에 원거리 30 분 (표 2) 후 100 μM에서 0.8 ± 0.0 (RFU)의 가장 낮은. '죽은'라이브 '와 FL1의 강도 판정하는 상대 형광 단위 (RFU)의 비를 비교하는 양방향 ANOVA는 농도 및 배양 시간 F 사이의 상호 작용에 전반적으로 유의 한 차이를보고 신호 (28,80)는 23.9, P <녹색 핵산 프로브와 0.001 =. 모든 농도 F (7,80) = 475.41, P <0.001 및 배양 시간 F (4,80) = 78.28, P <0.001에서 주 효과에 유의 한 차이는 있었다. '죽은'세포 살해 '라이브'와 열 사이의 형광 신호의 차별 비율은 0.05 μm의 1 μM의 농도 사이의 시간에 따라 증가하지만, 5 μm의 100 μm의 (그림 5B) 사이에 감소했다.
오렌지 핵산 프로브로 염색 세포의 백분율은 인큐베이션 10 분 (표 후 100 μM에서 166 ± 3.5 %로 상승, 1 분 후, 0.05 μM의 농도로, 4 ± 0.3 %의 평균 낮은 퍼센트를 반드시 3). 다시 1 위에 μM 또한 생균의 비특이적 염색을 제시 농도. 양방향 ANOVA betwEEN은 비특이적 염색을 나타내지 않았다 농도 (0.05-1 μM)는 M.aeruginosa, F (12, 40) = 133.55 모든 오렌지 핵산 프로브의 농도 및 배양 시간 사이의 상호 작용에 전반적으로 유의 한 차이를보고 p <0.001. 농도 F (3, 40) = 6919.67, P <0.001 및 배양 시간 F (3, 40) = 1161.45, P <0.001에서 통계적으로 유의 한 주 효과가 있었다. 그러나 단지 1 μM의 한 일원 분산 분석을 통해 사후 Tukey에 테스트 오렌지 핵산 프로브 (모두 P> 0.05) (그림 6A)의 흡수에는 통계적으로 유의 한 차이가 없었다 (10), (30)과 60 분 사이의 배양 시간을 표시. FL2에서 '라이브'와 스테인드 '죽은'집단 사이의 형광 신호 차별은 50 μm의와 30m에서 60 분 후 0.3 ± 0.0 (RFU)의 가장 낮은에서 오렌지 핵산 프로브에 원거리158.3 ± 0.4 (RFU)의 최고 100 μM에서 0.1 μM (표 4)의 농도로 60 분 후. 양방향 ANOVA는 농도 및 배양 시간 F (28, 80) = 28.12, p <0.001 사이의 상호 작용의 전반적인 유의성을보고했다. 농도 F (7, 80) = 607.9, p <0.001 및 배양 시간 F (4, 80) = 31.24, p <0.001의 주요 효과는 크게 다른 모든 것으로 밝혀졌다. FL2에서 사망 된 '라이브'열 '죽은'세포 신호 사이의 형광 차별은 0.05 μm의 0.5 μM의 농도 사이의 시간에 따라 증가하지만, 1 μM, 100 μM (그림 6B) 사이에 감소했다. 따라서 녹색 핵산 프로브에 대한 최적의 농도는 30 분의 배양 시간과 함께 오렌지 핵산 프로브 0.5 μM 최적 농도는 1 μM의 incu이다10 분 동안 죽이고.

그림 1. FSC, SSC 및 M.aeruginosa PCC 7806. (B) 문 FSC 그림 1A와 동일한 출력의 멀리 붉은 형광 (675 ± 12.5 ㎚). (A) FSC와 SSC와를 통해 M.aeruginosa의 FCM 출력 멀리 붉은 형광 (예 : 640, EM : 675 ± 12.5 ㎚). 셀의 크기를 나타내는 (C) FSC. 늘어선 적색 화살표는 배경 잡음 또는 다른 입자 크기를 줄이기 위해 게이트로되는 영역을 나타낸다. 레드 지수 상 배치 문화 M.aeruginosa에서 생산 (D) 높은 피코시 아닌 신호 영역을 게이트는 화살표. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
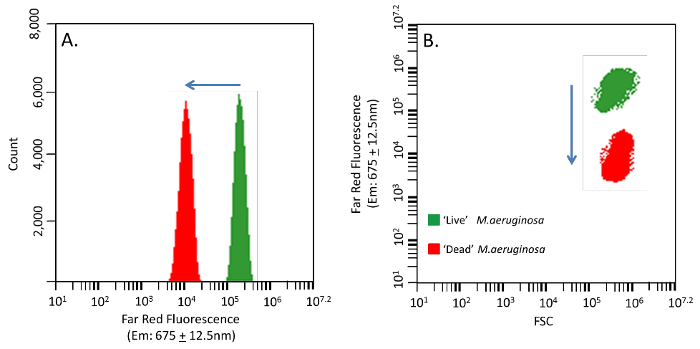
M.aeruginosa 열처리. 핵산 프로브 흡수를 확인하는 데 사용 '라이브'와 '죽은'세포에서 M.aeruginosa의자가 형광의 변화 그림 2. 피코시 아닌 신호 이동. (A) 낮은 착색 된 '죽은'인구 (빨간색)에 더 높은 착색 된 '라이브'인구 (녹색)에서 이동 멀리 빨간 신호. (B) FSC 및 크기의 거의 두 명령의 변화와 멀리 붉은 형광 결합 출력합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

'라이브'Unstaine에서 M.aeruginosa 그림 3. 오렌지 형광 이동"데드"염색 된 세포에 D. 30 분 동안 1.0 ㎛의 농도 오렌지 핵산 프로브와 함께 배양 M.aeruginosa '라이브'와 '죽은'혼합 컨트롤. (A) FL2는 (585 ± 20 ㎚)의 채널 크기의 두 명령을 통해 '죽은'스테인드 인구 (오렌지)에 '라이브'흠없는 인구 (녹색)에서 증가 변화를보고한다. (B) '죽은'스테인드 인구 멀리 빨간 신호를 감소하지만, '라이브'인구 (녹색)에서 FL2 신호를 증가 (오렌지). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4. 분자 프로브를 M.aeruginosa의 표면 형광 현미경. 마이크roscope M.aeruginosa 50:50 라이브에서 이미지 : 핵산 프로브를 배양 죽은 인구는, 모든 이미지는 배율을 x1,000. (A) '죽은'세포에 의해 흡수 녹색 핵산 프로브의 표면 형광 이미지. '라이브'세포 인해 엽록소의 형광도에 빨간색 표시됩니다. (B) 멤브레인 손상 '라이브'녹색 색소 세포와 작은 색소 '죽은'세포를 보여주는 그림 4A의 광학 현미경보기. (C)는 라이브 : 죽은 50:50 혼합 M.aeruginosa 인구. 표면 형광 현미경을 통해 오렌지 색을 드러내는 '죽은'셀 (D)도 4c에서 오렌지 핵산 프로브 배양,. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5. 녹색 핵산 프로브로 표지 된 세포의 비율과 '죽은'FL1 신호에 '라이브'의 비율. 다른 농도와 배양 시간에 녹색 핵산 프로브로 염색 M.aeruginosa 세포의 비율을 의미한다. (A) 0.1 μM 30 분 후에 최적의 배양 시간을 나타내는 충분한 세포, 5 μM 쇼 비특이적 염색을 0.5 μM의 농도 및 인구의 거의 100 %를 염색 1 μM 얼룩 않았다 (A). (B) '라이브 : 데드'지수 증식기 및 열처리 된 샘플들로부터 신호 FL1 비율. 0.5 μm의 1 μM의 농도는 배양 시간에 따라 증가 FL1 신호 (RFU 비율, 2 차의 크기)의 좋은 차별을 보여줍니다. 이상 10 μm의 및 (그래프에 표시되지 않음)의 농도는 '라이브'의 가난한 형광 신호 차별과 중첩을 보여D '죽은'인구. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
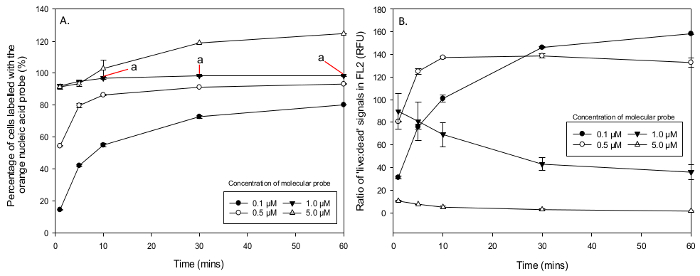
그림 6. 오렌지 핵산 프로브로 표지 된 세포의 비율과 '죽은'신호 '라이브'의 비율. M.aeruginosa의 인구 농도와 배양 시간 변경의 결과.를 기록했다 세포의 (A) 평균 비율 의 농도 FL2 오렌지 형광 신호; 0.1 μM 및 0.5 μM을 10 분 후 1 μM의 최적 농도와 함께, 5 μM 염색 생균 (비특이적 염색) 충분한 세포를 염색하지 (). '라이브 : 죽은'(B) 오렌지 핵산 프로브 FL2의 비율이 래핑 더 이상 좋은 차별과 표시1 ㎛ 이하의 농도 1 μM 이상의 농도 가난한 중복 FL2 신호 (크기의 비율보다 낮은 하나 순서)에서 형광 신호의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 진한. | 배양 시간 (분) | |||||||||
| (μM) | 1 | (5) | (10) | (30) | (60) | |||||
| 0.05 | 15.0 | 0.3 | 22.1 | 0.9 | 28.1 | 1.9 | 41.0 | 1.9 | 50.2 | 2.1 |
| 0.1 | 23.5 | 1.5 | 44.1 | 1.8 | 54.7 | 1.6 | 70.5 | 0.8 | 78.3 | 1.0 |
| 0.5 | 49.0 | 3.4 | 74.8 | 4.8 | 87.6 | 3.6 | 97.3 | 0.8 | 98.8 | 0.1 |
| 1 | 58.5 | 1.6 | 77.4 | 0.7 | 88.4 | 0.4 | 98.0 | 0.1 | 99.2 | 0.1 |
| (5) | 91.4 | 0.9 | 98.7 | 0.5 | 99.3 | 0.7 | 102.2 | 1.3 | 106.3 | 0.8 |
| (10) | 96.1 | 0.5 | 97.7 | 0.1 | 97.9 | 0.1 | 102.0 | 0.5 | 113.4 | 5.1 |
| (50) | 94.6 | 0.6 | 99.5 | 2.3 | 112.7 | 3.8 | 148.7 | 2.4 | 153.9 | 13.0 |
| (100) | 165.8 | 3.1 | 174.4 | 5.7 | 177.1 | 5.1 | 161.5 | 2.5 | 159.7 | 6.6 |
세포의 녹색 핵산 프로브의 표 1 비율 흡수. 녹색 핵산 프로브와 50 % '라이브'50 % '죽은'(열처리) 인구 샘플을 사용하여 최적화 실험에서 표 데이터를 표시하는. 녹음 한 세포의 평균 비율녹색 핵산 프로브의 형광 (FL1)는 FSC-H 카운트로부터 획득 '죽은'세포의 총 수에 대해 계산되었다. 100 % 쇼 비특이적 염색 위의 값은 (SE는 밑줄).
| 진한. | 배양 시간 (분) | |||||||||
| (μM) | 1 | (5) | (10) | (30) | (60) | |||||
| 0.05 | 92.9 | 5.4 | 170.0 | 10.9 | 237.2 | 14.9 | 385.5 | 15.0 | 481.9 | 17.7 |
| 0.1 | 178.3 | 18.1 | 343.0 | 19.(5) | 437.0 | 20.6 | 619.1 | 12.1 | 714.1 | 14.8 |
| 0.5 | 202.5 | 5.9 | 308.3 | 13.1 | 365.8 | 33.5 | 426.8 | 67.2 | 480.4 | 73.2 |
| 1 | 205.8 | 12.1 | 225.9 | 13.7 | 237.3 | 15.6 | 241.5 | 5.8 | 263.1 | 8.1 |
| (5) | 69.9 | 2.6 | 53.0 | 0.6 | 40.2 | 1.7 | 27.1 | 3.7 | 21.1 | 3.4 |
| (10) | 44.3 | 2.9 | 28.7 | 5.6 | 23.6 | 4.9 | 11.6 | 1.2 | 7.6 | 1.4 |
| (50) | 6.9 | 0.1 | 3.9 | 0.1 | 2.9 | 0.1 | 1.2 | 0.1 | 1.1 | 0.1 |
| (100) | 1.7 | 0.1 | 1.3 | 0.1 | 1.1 | 0.1 | 0.8 | 0.1 | 0.8 | 0.1 |
'라이브'와 '죽은'스테인드 M.aeruginosa 세포에서 녹색 형광 신호의 표 2 비율. 녹색 핵산 프로브와 비 특정 고유 녹음으로 염색 된 세포 사이의 FL1 신호 차별. 샘플은 50 % '라이브'50 % '죽은'(열처리) M.aeruginosa 포함모든 농도 및 배양 시간에 걸쳐 측정 같은 인구의 SE (밑줄).
| 진한. | 배양 시간 (분) | |||||||||
| (μM) | 1 | (5) | (10) | (30) | (60) | |||||
| 0.05 | 4.0 | 0.3 | 14.9 | 0.2 | 23.5 | 0.8 | 39.1 | 2.4 | 37.6 | 1.5 |
| 0.1 | 14.6 | 0.4 | 42.2 | 0.5 | 55.0 | 1.1 | 72.8 | 0.9 | 80.2 | 0.1 |
| 0.5 | 54.5 | 0.4 | 79.8 | 1.2 | 86.4 | 0.4 | 91.2 | 0.1 | 93.2 | 0.1 |
| 1 | 92.0 | 0.8 | 94.8 | 0.1 | 96.9 | 0.6 | 98.4 | 0.6 | 98.4 | 0.3 |
| (5) | 91.4 | 1.5 | 93.5 | 1.8 | 102.9 | 5.4 | 118.9 | 0.1 | 124.8 | 0.1 |
| (10) | 95.9 | 1.0 | 102.4 | 1.8 | 132.9 | 6.0 | 148.9 | 4.8 | 132.8 | 5.1 |
| (50) | 107.5 | 3.7 | 130.6 | 16.6 | 145.2 | 0.2 | 135.4 | 16.2 | 114.6 | 6.6 |
| (100) | 97.1 | 0.1 | 130.7 | 7.8 | 166.1 | 3.5 | 144.7 | 6.8 | 115.1 | 6.2 |
세포의 오렌지 핵산 프로브의 표 3 비율 흡수. 최적화 데이터가 오렌지 핵산 프로브와 50 % '라이브'50 % '죽은'(열처리) 인구 샘플을 사용하여 테이블. 오렌지 핵산 프로브의 형광 (FL2)를 녹화 한 세포의 평균 비율은 FSC-H 카운트에서 "죽은"세포의 총 수에 대해 계산 된 (SE은 밑줄).
| 진한. | 배양 시간 (분) | |||||||||
| (μM) | 1 | (5) | (10) | (30) | (60) | |||||
| 0.05 | 20.4 | 0.9 | 41.3 | 1.3 | 56.1 | 2.4 | 80.4 | 3.6 | 83.3 | 1.8 |
| 0.1 | 31.2 | 1.4 | 76.1 | 2.4 | 100.9 | 3.1 | 146.2 | 0.6 | 158.3 | 0.4 |
| 0.5 | 80.6 | 0.4 | 124.9 | 2.4 | 137.3 | 1.1 | 138.7 | 2.1 | 132.8 | 3.9 |
| 1 | 89.7 | 16.0 | 80.9 | 16.9 | 69.1 | 10.7 | 43.0 | 5.7 | 35.9 | 6.5 |
| (5) | 10.4 | 0.6 | 7.5 | 0.1 | 5.0 | 1.0 | 2.7 | 0.5 | 1.5 | 0.1 |
| (10) | 7.0 | 0.1 | 3.6 | 0.3 | 2.2 | 0.4 | 1.6 | 0.1 | 1.2 | 0.1 |
| (50) | 2.2 | 0.4 | 1.6 | 0.3 | 1.3 | 0.0 | 0.6 | 0.1 | 0.3 | 0.0 |
| (10)0 | 1.7 | 0.1 | 1.1 | 0.1 | 0.7 | 0.1 | 0.3 | 0.0 | 0.5 | 0.2 |
'라이브'와 '죽은'스테인드 M.aeruginosa 세포 오렌지 핵산의 표 4 비율. 오렌지 핵산 프로브 (FL2) 및 비 특정 고유 녹음에서 염색 된 세포 사이의 FL2 신호 차별. 샘플은 50 % '라이브'50 % '죽은'(열처리) 모든 농도 및 배양 시간에 걸쳐 측정 같은 인구의 M.aeruginosa을 포함 SE (밑줄).
토론
15,19,22,23 - 분자 프로브를 사용하여 출판물의 증가 숫자는 믿을 수 있고 정보 데이터는 5,6,8를 얻을 수 있음을 나타냅니다. 아직 같은 농도 및 배양 시간 6,10 모든 종에 걸쳐 효과적 일 수있다 세포 생존에 대한 완벽한 얼룩은 없습니다. 변경된 형광 방출과 프로브의 같은 종류가 정확한 농도와 항온 처리 시간 (표 1 및 3)을 확립 할 필요를 나타낸다. 이 프로토콜을 사용하는 경우 알 수있는 바와 같이, 오렌지 핵산 프로브에 대한 최적 농도와 항온 처리 시간은 녹색 핵산 프로브가 절반 만 집중해야하는 반면 1 μM에서 10 분이며, 그러나 세 배만큼 (도 5 및 6)에 걸린다. 1.0 μM 이상의 농도 이러한 세포 impermeant 시아닌 단량체 모두 비 막 부상 세포 스펙트럼 방출의 중첩을 생산하기 시작했다. 시의이 중복gnals은 비특이적 염색 어디에 '라이브'세포 분자 프로브를 복용하고 발생하는 증거를 제공합니다. 비특이적 염색에서 형광을 통해 결과는 신중하게 각 분자 프로브와 표적 생물체에 대해 설정되는 프로토콜 개발의 필요성을 강조하는, 오탐 (false positive)을 생성합니다. 분자 프로브를 최적화에서 가장 중요한 단계는 다음과 같습니다 1) 분자 프로브가 FCM 기기와 상호 작용하는 방법을 이해; 2) 적절한 라이브와 죽은 컨트롤을 채택; 3) FCM에서 출력 파라미터 게이팅 기술 개발 및 4) 인 - 시튜 환경의 이해를 통해 프로토콜을 수정하는 단계를 포함한다.
광원, 광학 필터, 유동 세포 계측기 내에 PMT 전압 검출기를 변경하는 능력은 그렇게 발광 스펙트럼은 형광 채널의 관계에 놓여 레이저 어디에서 어떤 여진 파장의 인식이 중요하다, 제조업체의 제조에 따라 달라질. 데이터의 인수와 함께,임계 값, 그렇지 않으면 아마도 배경 소음, 먼지 나 죽은 세포 집합체에 손실 될 수 증가 해상도를 부과 할 수있다. 분자 프로브는 막 잠재력, DNA 콘텐츠 및 효소 활성과 같은 하나의 매개 변수를 통해, 재배하지 않고 종의 생존에 대한 통찰력을 제공 할 수 있습니다. 그러나, 환경 시료에서 유사한 셀 크기 및 형광의 많은 생물이있을 수있다. uniagal 문화 내에서뿐만 아니라, 세포의 집단은 필연적으로 분자 프로브의 흡수에 영향을 미칠 수있는 생리 학적 상태 (3)의 학위를 가지고 있습니다. FCM의 주요 이점 중 하나는 구별하고 종종 빠른 동적 조건에 적용되는 바와 같이, 인 시츄 미생물 생존을 연구 할 때 필수적인 실시간 개별 셀 레벨에서 생리 학적 상태를 특성화하는 능력이다. 그 빈번한 사용에도 불구하고, 세포 생존의 개념은 여전히 정의하기 어려운 남아있다. 일반적으로 세포 증식에인가가능성은 매우 성장 기반의 접근 방식에 득점있다. 조건을 재현하는 개별 셀에 적합하지 않을 수 있습니다으로이 토대 가정은, 짧은 떨어질 수 있지만 여전히 허용 될 수있다. DNA주기 대사 기반 프로브에서 위음성을주는 분자 프로브와 상호 작용하지 않을 수 있습니다 정지 또는 G (0) 세포주기 단계 (27)를 입력 한 nonproliferating 생리 학적 상태에있는 세포.
프로브 분자를 최적화하는 실험실 성장 또는 새롭게 분리 된 세포를 사용하는 것은 생태 연구에 사용 된 데이터의 정제에 도움이된다. 일괄 문화의 최적화에 사용 된 세포는 일반적으로 지수 또는 초기 고정 단계에서 찍은 가장 높은 가능성을 가지고 있다고 가정한다. 세포 외 매트릭스를 생산하는 높은 세포 밀도, 늦은 정지 단계에서 그 또는 미생물을 사용하는 경우에는, 특별한주의를 기울여야합니다. 이 프로토콜에서 세포의 죽은 인구에 대한 제어가 1 시간 동안 60 O를 C 열에 노출,현미경을 통해 본 막 손상과 색소 저하의 확인 (그림 4)와 FCM 형광 출력 (그림 2 & 3)와. 천연 세포 사멸의 원인을 시뮬레이션하는 것은 극도로 곤란하다; 초식 동물, 바이러스 성 용해, 프로그램 된 세포의 죽음 또는 비대칭 분할 (24)의 가능성에 의해 섭취는 항상 가능 또는 실험실 조건에서 관찰 할 수 없습니다. 도덕의 실험 방식은 환경으로부터 유도 된 응력에 해당하지 않을 수 있습니다 종종 (예를 들어, 열 살인)에 의문을 제기하고, 특정 개인이 사망하고 다른 세포가 관측 세포 저하 또는 사망 3을 표시하지 않습니다하는 이종 반응이있을 수 있습니다 25. 이러한 역설에게 혼란 6,23으로 이어질하지 않도록 측정 한 실험이 명확하게 연구 사이의 정상화를 완화, 설립해야하는 조작 적 정의를 방지 할 수 있습니다.
다양한 다른 방법은 근래E는 분자 프로브와 함께 배양에서 분석 세포 생존에 사용되었다. photobleaching에 또는 주변 셀들로부터의 신호 인공물의 도입하면 아래 또는 개체군 신속하게 기록되지 않은 경우에 생리 학적 상태의 추정을 통해 제공 할 수 있지만, 표면 형광 현미경은, 사용되는 전통적인 기술이다. 이것은 잠재적으로 낮은 정확도로, 매우 어려운 이미징을 통해 최적화한다. 예컨대 DNA 및 RNA 증폭 방법을 모두 사용하여 생존 세포의 게놈 평가; 중합 효소 연쇄 반응 (PCR)은 또한 사용 된 효소 (RT-PCR)와 핵산 서열 - 기초 증폭 (NASBA)를 역방향. 핵산의 지속성이 대단히 무겁게 잠재적 28 다양한 실제 세포 생존율의 상관 관계와, 환경 조건에 의존하지만, 게놈 평가 만 생존 검증 간접법로서 기능한다. 자연 사진을 광 산란 및 / 또는 형광의 조합을 사용하여데이터의 증가 해상도, 희귀 인구 응답을 확인하고 거짓 긍정적 인 결과를 감소 : 수 인구의 ynthetic 안료 (그림 1) 게이트. 분자 프로브를 따라 FCM은 속도, 정확성, 여러 매개 변수의 녹화를 위해 단일 세포 생리 학적 테스트에서 이전 한 기술에서 눈에 띈다.
FCM은 수생 미생물학과 분자 프로브의 추가와 강력한 분석 도구를 포함한 산업 분야에 단일 셀 및 지역 사회의 분석 영역 (예., 식수 공급을 모니터링)의 수의 다양한 잠재력을 가지고있다. 미래 발전 FCM 감지하고 조밀 한 이기종 샘플 내의 개별 세포에서 특정 유전자 서열을 지역화 할 수 있습니다 현장 하이브리드 (물고기)에서 형광을 통합 볼 수 있었다. 시츄 레코딩 용 FCM 분자 프로브 이동성 개발 초기 S를 구현하는 수원에 중요한 데이터를 제공 할 수있다자원 관리를위한 trategies. 여기에 개발 된 최적화 프로토콜에 따라, FCM 분자 프로브는 잠재적으로 수생 환경에서 미생물의 생리에 대한 중요한 데이터를 제공하는 중요한 역할을 할 수있다.
공개
저자는 그들이 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
저자는 연구 및 시설에 대한 지원 및 자금 지원을 위해 박사 과정 학생 데이브 하트 넬과 본머스 대학을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Cyanobacteria Media | Sigma-Aldrich | C3061-500ML | BG-11 Freshwater concentrated solution (x50 dilution) |
| Decontamination Fluid | BD Biosciences | 653155 | Run for 2 min when outputs are more than 12 events per second on fast or a flow rate of 66 µl/min. Followed by 2 min of sheath H2O. |
| Flow Cytometer | BD Biosciences | by request | BD Accuri C6 |
| SYTOX Green | Life Technologies | S7020 | Nucleic acid stain – 5 mM solution in DMSO |
| SYTOX Orange | Life Technologies | S11368 | Nucleic acid stain – 5 mM solution in DMSO |
참고문헌
- Kell, D. B., Kaprelyants, A. S., Weichart, D. H., Harwood, C. R., Barer, M. R. Viability and Activity in Readily Culturable Bacteria: A Review and Discussion of the Practical Issues. Anton. Leeuw. Int. J. G. 73, 169-187 (1998).
- Adams, D. G., Duggan, P. S. Tansley Review No. 107. Heterocyst and Akinete Differentiation in cyanobacteria. New Phytol. 144 (1), 3-33 (1999).
- Lidstrom, M. E., Konopka, M. C. The Role of Physiological Heterogeneity in Microbial Population Behavior. Nat. Chem. Biol. 6 (10), 705-712 (2010).
- Dagnino, D., de Abreu Meireles, D., de Aquino Almeida, J. C. Growth of Nutrient-Replete Microcystis. PCC 7806 Cultures is Inhibited by an Extracellular Signal Produced by Chlorotic Cultures. Environ. Microbiol. 8 (1), 30-36 (2006).
- Davey, H. M., Kell, D. B., Weichart, D. H., Kaprelyants, A. S. Estimation of Microbial Viability Using Flow Cytometry. Curr. Protoc. Cytom. Chapter. Chapter 11, (2004).
- Davey, H. M. Life, Death, and In-Between: Meanings and Methods in Microbiology. Appl. Environ. Microb. 77 (16), 5571-5576 (2011).
- Shapiro, H. M. Chapter 7, Parameters and Probes. Practical Flow Cytometry. , 273-410 (2003).
- Hammes, F., Berney, M., Wang, Y., Vital, M., Köster, O., Egli, T. Flow-Cytometric Total Bacterial Cell Counts as a Descriptive Microbiological Parameter for Drinking Water Treatment Processes. Water Res. 42 (1-2), 269-277 (2008).
- Wang, Y., Hammes, F., De Roy, K., Verstraete, W., Boon, N. Past, Present and Future Applications of Flow Cytometry in Aquatic Microbiology. Trends Biotechnol. 28 (8), 416-424 (2010).
- Shapiro, H. M., Nebe-von-Caron, G. Multiparameter Flow Cytometry of Bacteria. Methods. Mol. Biol. 263, 33-44 (2004).
- Peperzak, L., Brussaard, C. P. D. Flow Cytometric Applicability of Fluorescent Vitality Probes on Phytoplankton. J. Phycol. 47 (3), 692-702 (2011).
- Roth, B. L., Poot, M., Yue, S. T., Millard, P. J. Bacterial Viability and Antibiotic Susceptibility Testing with SYTOX Green Nucleic Acid Stain. Appl. Environ. Microbiol. 63 (6), (1997).
- Franklin, D., Airs, R., Fernandes, M. Identification of Senescence and Death in Emiliania huxleyi. and Thalassiosira pseudonana. Cell Staining, Chlorophyll Alterations, and Dimethylsulfoniopropionate (DMSP) Metabolism. Limnol. Oceanogr. 57 (1), 305-317 (2012).
- Lebaron, P., Catala, P., Parthuisot, N. Effectiveness of SYTOX Green Stain for Bacterial Viability Assessment. Appl. Environ. Microbiol. 64 (7), 2697-2700 (1998).
- Mikula, P., Zezulka, S., Jancula, D., Marsalek, B. Metabolic Activity and Membrane Integrity Changes in Microcystis aeruginosa.- New Findings on Hydrogen Peroxide Toxicity in Cyanobacteria. Eur. J. Phycol. 47 (July), 195-206 (2012).
- Regel, R. H., Brookes, J. D., Ganf, G. G., Griffiths, R. W. The Influence of Experimentally Generated Turbulence on the Mash01 Unicellular Microcystis aeruginosa Strain. Hydrobiologia. 517 (1-3), 107-120 (2004).
- Kameyama, K., Sugiura, N., Inamori, Y., Maekawa, T. Characteristics of Microcystin production in the Cell Cycle of Microcystis viridis. Environ. toxicol. 19 (1), 20-25 (2004).
- Gustafsson, S., Hultberg, M., Figueroa, R. I., Rengefors, K. On the Control of HAB Species using Low Biosurfactant Concentrations. Harmful Algae. 8 (6), 857-863 (2009).
- Bouchard, J. N., Purdie, D. A. Effect of Elevated Temperature, Darkness, and Hydrogen Peroxide Treatment on Oxidative Stress and Cell Death in the Bloom-Forming Toxic Cyanobacterium Microcystis. J. Phycol. 47 (6), 1316-1325 (2011).
- Reynolds, C. S., Jaworski, G. H. M. Enumeration of Natural Microcystis Populations. Br. Phycol. J. 13 (3), 269-277 (1978).
- Marie, D., Simon, N., Vaulot, D., Andersen, R. A. Phytoplankton Cell Counting by Flow Cytometry. Algal culturing techniques. , 253-268 (2005).
- Assunçao, P., Antuees, N. T., Rosales, R. S., de la Fe, C., Poveda, C., Poveda, J. B., Davey, H. M. Flow cytometric method for the assessment of the minimal inhibitory concentrations of antibacterial agents to Mycoplasma agalactiae. Cytom Part A. 69, 1071-1076 (2006).
- Davey, H. M., Kell, D. B. Flow Cytometry and Cell Sorting of Heterogeneous Microbial Populations: The Importance of Single-Cell Analyses. Microbiol. rev. 60 (4), 641-696 (1996).
- Franklin, D. J. Explaining the Causes of Cell Death in Cyanobacteria: What Role for Asymmetric Division?. J. Plankton Res. 36 (1), 11-17 (2013).
- Kaprelyants, A. S., Mukamolova, G. V., Davey, H. M., Kell, D. B. Quantitative Analysis of the Physiological Heterogeneity within Starved Cultures of Micrococcus luteus. by Flow Cytometry and Cell Sorting. Appl. Environ. Microbiol. 62 (4), 1311-1316 (1996).
- Waggoner, A., Melamed, M. R., Lindmo, T., Mendelsohn, M. L. Fluorescent probes for cytometry. Flow cytometry and sorting. , 209-225 (1990).
- Gray, J. V., Petsko, G. A., Johnston, G. C., Ringe, D., Singer, R. A., Werner-washburne, M. "Sleeping Beauty": Quiescence in Saccharomyces cerevisiae. Microbiol. Mol. Biol. Rev. 68 (2), 187-206 (2004).
- Keer, J. T., Birch, L. Molecular Methods for the Assessment of Bacterial Viability. J. Microbiol. Methods. 53 (2), 175-183 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유