成長曲線:コロニー形成単位と光学密度測定を用いて成長曲線を生成する
概要
ソース: アンドリュー J. ヴァン アルスト1, リアノン M. ルヴェーク1, ナタリア マーティン1, ビクター J. ディリタ1
1ミシガン州立大学微生物・分子遺伝学科、イーストランシング、ミシガン州、アメリカ合衆国
成長曲線は、細菌の成長運動学と細胞生理学に関する貴重な情報を提供します。それらは、細菌が可変増殖条件でどのように反応するかを決定し、特定の細菌に最適な増殖パラメータを定義することを可能にします。原型的な成長曲線は、成長の4つの段階を経て進行します:ラグ、指数、静止、および死(1)。
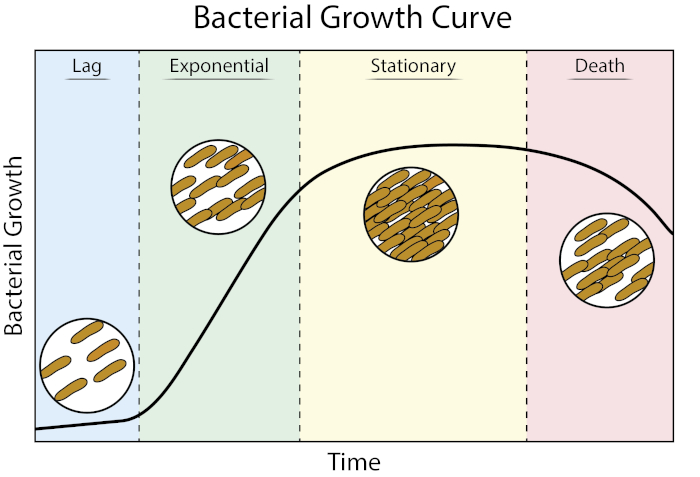
図1:細菌増殖曲線。バッチ培養で増殖した細菌は、ラグ、指数、静止、死の4つの段階を通じて進行します。ラグフェーズは、細菌が急速な細胞増殖および分裂が可能な生理学的状態に達するのにかかる時間の期間である。指数相は、DNA複製、RNA転写、タンパク質産生がすべて一定の速い速度で起こる最速の細胞増殖および分裂の段階です。静止相は、栄養制限および/または毒性中間蓄積による細菌の増殖の減速および高原化によって特徴付けられる。死期は、重度の栄養制限の結果として細胞リシスが起こる段階である。
ラグフェーズは、細菌が急速な細胞増殖および分裂が可能な生理学的状態に達するのにかかる時間の期間である。この遅れは、細菌が新しい環境に適応するのに時間がかかるために発生します。必要な細胞成分がラグフェーズで生成されると、細菌はDNA複製、RNA転写、タンパク質産生がすべて起こる成長の指数関数的段階に入ります。
手順
1. セットアップ
- 必要な実験室材料:液体媒体、固化寒天媒体、エルレンマイヤーフラスコ、15 mL試験管、リン酸緩衝生理食(PBS)、細菌細胞拡散機、70%エタノール、および分光光度計。すべてのソリューションとガラス製品は、使用前に殺菌する必要があります。
- 70%エタノールで殺菌してワークステーションを準備します。メディアの汚染を防ぐために、ブンセンバーナーの近くで作業します。
- 細菌を使用する場合は、適切な個人用保護具と無菌技術を使用する必要があります。細菌培養を行う場合は、ラボコートと手袋が必要です。
- バッファー、ソリューション、試薬のレシピ
- リン酸緩衝生理食液(PBS)(8)。
- ルリア・ベルタニ・ブロス(LB)(9)。
2. プロトコル
- メディアの準備
- 細菌を増殖させ、液体スープと固形寒天(1.5%w/v寒天)の両方の培地を別々のオートクレーブ可能なボトルに調剤する成長培地を特定します。ここで、LBスープとLB寒天は、大腸菌の成長のために調製した。
- オートクレーブで半締め付けキャップでメディアを殺菌し、121 °Cに設定し、35分間使用します。
- 寒天媒体の場合は、オートクレーブ後、50°Cに設定した水風呂に30分間入れ、冷却する。冷却したら、100x15mm円形ペトリ皿に20-25 mL寒天媒体を注ぎます。使用前にプレートを室温で24時間設定してください。
- 細菌の初期調製
- 凍結ストックから、選択した媒体寒天上で単一のコロニー単離物を得るためのストリーク細菌。選択した細菌に対して許容される成長条件でインキュベートする。ここで、大腸菌はLB寒天に縞模様され、一晩37°C(16〜18時間)でインキュベートされる。
- 無菌接種ループを使用して、ストリークプレートから単一のコロニーを選択し、15 mL試験管で4mL液体媒体を接種し、選択した細菌に許容される条件で成長する。ここで、大腸菌は一晩210rpm(16-18h)で振盪で37°Cで成長する。
- 成長曲線の設定
- 成長フラスコ製剤
- オートクレーブ適切なサイズのアーレンマイヤーフラスコ。通常、フラスコ量の合計に対するメディアの比率は 1:5 です。ここで、100mL LB培媒体は500mLフラスコに使用される。
- 血清ピペットを使用して、無菌培分をエルレンマイヤーフラスコに移します。
- 希釈シリーズの準備
- ラベル 15 mL 試験管: -1、-2、-3、-4、-5、-6、-7、-8、および -9 に 9 mL PBS をそれぞれに分配します。これらの数値は、CFU/mL の計算に使用される希釈係数に対応します。コレクションのタイムポイントごとに、新しいチューブのセットが必要です。(図 2)
- 寒天プレート製剤
- 収集時間と希釈係数を持つラベルプレート。各タイムポイントには、希釈ごとに1つのプレートがあります。
- 成長フラスコ製剤
- 成長曲線プロトコル
- メディアの接種
- ステップ2.2.2の一部として調製された一晩の液体培養を使用して、フラスコ培地を1:1000体の培養量で接種する。ここで、100 μLの一晩液体培養を100mL LB培養剤に添加する。
- メディアを旋回して、細菌を均等に分配します。
- タイムポイントコレクション
- 成長条件の設定
- 所定の細菌に対して選択された実験的な成長条件にフラスコを置きます。タイムポイントは、急速に成長する細菌のために頻繁に取られるべきであり、成長が遅い細菌のためにより長い間隔で取ることができる。ここで、大腸菌は毎分210回転(rpm)で揺れ、1時間ごとに取られるタイムポイントで37°Cで成長します。
- 光学密度(OD600)測定
- 開始時点(t = 0)を含む各タイムポイントで、細菌培養の1 mLを撤回し、分光光度計キュベットに分配する。
- キュベットをきれいに拭き取り、600 nmの波長で光学密度を記録します。光密度読み取り値が 1.0 より大きい場合は、900 μL の新鮮な媒体で培養 1:10 の 100 μL を希釈し、光学密度を記録し、OD600 測定の場合にこの値に 10 を掛けます。
- コロニー形成ユニット(CFU/mL)測定
- 各タイムポイントで、細菌培養の1 mLを撤回し、PBSの9 mLを含む-1ガラス試験管に分配する。
- 希釈シリーズの場合は、-1チューブからすべての希釈チューブを-9に連続的に1mL転送し、各転写後に渦を起用します。(図 2)
- 希釈ごとに、対応する標識された固体媒体寒天プレートに100μLの細胞懸濁液を分配する。(図 2)
- エタノールで殺菌したセル拡散機を用いて、文泉バーナーの炎を通過し、寒天の表面に触れて冷却し、寒天板の表面が乾燥するまで100μLの細胞懸濁液を広げる。
- バクテリアの増殖を支える温度でスプレッドプレートを逆さまにインキュベートします。ここで、大腸菌を37°Cでインキュベートする。
- インキュベーション後、一度目に見えるコロニーが発生したら、各プレート上の細菌コロニーの数をカウントし、各タイムポイントですべてのプレートに関連する希釈係数と共にこれらの値を記録します。
- 成長条件の設定
- メディアの接種
3. データ分析と結果
- 光学密度(OD600)成長曲線プロット
- 光学密度(OD600)と時間を半ログスケールでプロットします。(図 3)
- コロニー形成ユニット(CFU/mL)成長曲線プロット
- 各タイムポイントについて、コロニー数が30〜300菌の範囲内に収まる希釈プレートを選択します。コロニー数に希釈係数を掛け、100 μL スプレッドが CFU/mL を計算する際に追加の 1:10 希釈と見なされるため、10 を掛けます。
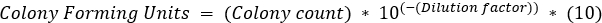
- コロニー形成単位と時間を半ログスケールでプロットします。(図 4)
- 各タイムポイントについて、コロニー数が30〜300菌の範囲内に収まる希釈プレートを選択します。コロニー数に希釈係数を掛け、100 μL スプレッドが CFU/mL を計算する際に追加の 1:10 希釈と見なされるため、10 を掛けます。
- 光学密度とコロニー形成ユニットの関係
- OD600とCFU/mLの関係が1.0 OD600を超える精度が低いため、OD600読み取り値が1.0 OD600以下の線形スケールでコロニー形成単位と光学密度をプロットします。ここでは、最初の 6 つのタイムポイントがプロットされます。(図 5)
- 方程式と R2値を表示する線形回帰近似曲線を生成します。
- 細菌の倍増時間の決定
- コロニー形成単位成長曲線プロットを使用して、指数相の間に、グラフ上の2つの点をそれらの間で最も急な勾配で識別し、倍増時間を計算します。
- 倍増時間の計算
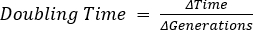
- ΔTime = t2 - t1、 t 1 = タイムポイント1およびt2 = タイムポイント 2
-
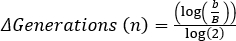 、ここで b = t 2の細菌数、B = t1の細菌数、およびn = 世代数。 派生元:
、ここで b = t 2の細菌数、B = t1の細菌数、およびn = 世代数。 派生元: .
- 次の方法で倍増時間を計算します。
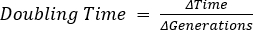
結果
コロニー形成単位と光学密度のプロットは、成長運動を視覚化する2つの方法です。CFU/mLとOD600の関係を決定することにより、光学密度プロットは、時間の経過に伴うCFU/mLの推定値も提供します。最短の倍増時間をもたらす条件は、与えられた細菌の増殖に最適と考えられる。
申請書と概要
成長曲線は、細菌の成長運動学と生理学を理解するために貴重です。それらは、細菌が可変増殖条件でどのように反応するかを決定し、特定の細菌に最適な増殖パラメータを定義することを可能にします。コロニー形成ユニットと光学密度プロットの両方には、ラグ相の持続時間、到達した最大細胞密度、および細菌の倍増時間の計算を可能にする貴重な情報が含まれています。成長曲線はまた、同じ成長条件下で異なる細菌間の比較を可能にします。さらに、光学密度は初期の接種を標準化する手段を提供し、他の実験の一貫性を高める。
成長曲線実験を設計する際に使用する方法を決定するには、考慮する必要があります。成長曲線を生成するための好ましい方法として、コロニー形成単位プロットは、バッチ培養における生存可能な細胞数をより正確に反映する。コロニー形成ユニットプロットはまた、光学密度測定を妨げる条件で細菌の増殖を測定することを可能にする。しかし、それは試薬の広範な使用を必要とし、より時間のかかるプロセスであり、手動で行う必要があります。光学密度プロットは精度が低く、コロニー形成単位の推定値のみを提供し、固有の細菌ごとに標準曲線を生成する必要があります。光学密度は、時間がはるかに少なく、多くの試薬を必要としないため、主に利便性のために使用されます。光学密度に最も魅力的なのは、分光光量インキュベーターが自動的に成長曲線を生成し、一度にテストできる培養条件の数を大幅に増加させ、常に培養に出席する必要性を排除できることです。
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
成長曲線:コロニー形成単位と光学密度測定を用いて成長曲線を生成する
Microbiology
298.9K 閲覧数

ウィノグラツキーカラムの作成:堆積物サンプル中の微生物種を濃縮する方法
Microbiology
130.4K 閲覧数

シリアル希釈とめっき:微生物列挙
Microbiology
317.7K 閲覧数

エンリッチメント培養:選択的および差動媒体における好気性微生物と嫌気性微生物の培養
Microbiology
132.5K 閲覧数

純粋な培養物と縞めっき:混合サンプルからの単一細菌コロニーの単一の分離
Microbiology
166.8K 閲覧数

16S rRNAシーケンシング:細菌種を同定するPCRベースの技術
Microbiology
190.2K 閲覧数

抗生物質感受性試験:2つの抗生物質のMIC値を決定し、抗生物質の相乗効果を評価するエプシロメーター試験
Microbiology
94.3K 閲覧数

顕微鏡検査と染色:グラム、カプセル、内胞染色
Microbiology
364.6K 閲覧数

プラークアッセイ:プラーク形成単位(PFU)としてウイルス定数を決定する方法
Microbiology
186.9K 閲覧数

適応塩化カルシウム手順を用いて大腸菌細胞の形質転換
Microbiology
87.3K 閲覧数

結合:アンピシリン耐性をドナーからレシピエント大腸菌に移す方法
Microbiology
38.5K 閲覧数

ファージトランスダクション:アンピシリン耐性をドナーからレシピエント大腸菌に伝達する方法
Microbiology
29.3K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved