ポリメラーゼ連鎖反応およびゲル電気泳動法と環境微生物の検出
概要
ソース: ドクターペッパー イアン博士チャールズ Gerba - アリゾナ大学所
示す著者: ブラッドリー ・ シュミッツ
ポリメラーゼの連鎖反応 (PCR) は、土壌・水・大気の環境に存在する微生物を検出するために使用される技術です。DNA の特定のセクションを増幅することによって PCR は種、株と血清型/pathovar レベルまで対象微生物の同定を促進できます。手法は、サンプル中の微生物のコミュニティ全体の特性評価に利用できます。
特殊な成長媒体を使って研究室微生物の培養は老舗の技術、環境試料中の微生物の検出のための使用に残ります。自然環境に多くの微生物、生きている間代謝活性および/または倍加時間の低水準を維持し、従って呼ばれます非人為的 (VBNC) 生物が、実行可能です。単独で文化ベースの技術の使用はこれらの微生物を検出できないし、したがって、サンプルで微生物集団の徹底的な評価は行いません。PCR の使用、VBNC 生物の培養微生物の検出のためでき環境試料の存在がもはや生きているか、アクティブな遺伝子配列の増幅一般的に微生物の前濃縮を必要としないもの。ただし、PCR は生存率および活動の前述の状態を区別できません。1 つまたは複数のカルチャ ベース技術と組み合わせると、微生物の特定のサブセットの実行可能性はまだ決定されるかもしれない。
原則
PCR の基本的な前提は、DNA の指数関数的増幅を達成するために連続した温度変化の繰り返しのサイクルを使用します。好熱菌(Taq) などの温泉地に住んでいる細菌から得られる DNA のポリメラーゼの酵素によって DNA 合成が行われます。これらのポリメラーゼは、熱安定性、PCR の間に使用される高温に耐えるように。
私アンプリコン、として知られているターゲット シーケンスは、「プライマー」として知られているヌクレオチドの 2 つの不足分の伸張を使用して DNA のテンプレートから増幅されています。相補的な核酸結合の高い特異性、ためプライマーは、関心の非常に特定のシーケンスのターゲットの増幅できます。興味の生物からのみ一意のシーケンス (またはシーケンスの一意の組み合わせ) を増幅するプライマーを設計することにより、特異的遺伝物質が複雑な環境試料中に存在するすべての生物の DNA の存在を検出する PCR を使用できます。
PCR を行う、たちとして知られているマシンは反応に必要な異なる温度を自動的に進めるためです。各サイクルは、3 つのフェーズに分かれています。最初に、「変性」として知られている、通常、上記の 92 ° C と続く約 30 s. 変性増幅反応を続行を許可するための単一繊維 DNA の分子に分割するために使用設定。
「熱処理」、2 番目のフェーズは、以下の 2 つのプライマーは、通常 50-65 ° C と間も続く約 30 s. 溶融温度は二本鎖 DNA の 50% が単一繊維に分離およびアニーリング ・ ステップできるようにプライマーが DNA テンプレートのターゲット サイトに結合する温度の融点の低い 2 ~ 3 ° C を設定されています。
PCR のサイクルの第 3 段階は、「伸び」や「拡張」, DNA ポリメラーゼは、プライマー テンプレート二重にバインドし、製品の合成を触媒します。Taq のポリメラーゼのための 72 ° C に設定すると、このフェーズの期間によって異なります私アンプリコン、通常 30 の長さ s/500 bp。各サイクル後増幅された DNA 変性はもう一度、PCR の製品の量の急激な増加につながる新しいテンプレートとして提供しています。
反応が完了したら、PCR の製品は電気泳動と呼ばれるプロセス、ポリマー agarose の通常作られて「ゲル」でサイズによって解決できます。Dna のバックボーンで負電荷フィールドの肯定的な端の方に移住する原因し、電界が、ゲルの上で適用されます。一般的に言えば、大きい線形 DNA の分子はゲルのマトリックスを通して旅行がかかります。
手順
1. サンプル コレクション
- オーガーを使用して土壌を収集または決められた深さまでシャベルします。根圏 (土周辺と植物の根とその関連付けられている微生物によって影響の狭い地域) から土壌を収集する場合のみから直接収集植物の根の周りコレクション バレルに土を押すことで。
- 水の中に浸漬の棒の端を押しながら滅菌プラスチック ボトルを浸すことによって水のサンプルを収集します。
2. 核酸抽出と準備
- サンプルから有機体およびウイルスを収集し、それらから DNA や RNA を抽出します。詳細については、ゼウスの科学教育コミュニティ核酸抽出に関するビデオを参照してください。
- ラベル付き microfuge の管に抽出した DNA を格納します。DNA は、一晩、または時間の長い期間保存する必要があります、-20 ° C で凍結し、常温使用の準備ができたら、チューブを解凍します。
- 試金するのに遺伝物質は (かどうかそれは RNA のウイルスのゲノムや細胞生物の転写 RNA)、RNA は PCR に進む前に相補的 DNA (cDNA) を作成するサンプルの逆のトランスクリプション (RT) を実行します。詳細については、ゼウスの理科の RT-PCR のビデオを参照してください。
3. ポリメラーゼ チェーン反応
- 氷上 PCR 酵素を (例えば、 Taqのポリメラーゼ) を置き、室温で指定された「クリーン」フードの中その他の試薬 (PCR のバッファー、dNTPs、プライマー) に解凍します。酵素は-20 ° C で保存されているが、フリーズすることはありません。温度に敏感でありのでクールなと最小周囲温度への露出を保たれなければなりません。
- すべての反応 (表 1) の間で一定しているすべての試薬の「マスター ミックス"を作るために必要な各試薬の量を計算します。(例えば、ターゲット地域を含んでいるテンプレート) の肯定的なアカウントの確認と計算に否定的な (例えば、テンプレートなし) コントロール。ピペッティング誤差を考慮する最終的なボリュームに追加の 10% を追加します。プライマー ボリュームによって異なります特定の有機体のための試金適切な値の公表された資料を参照してください。
- チューブは、プラスチック製の壁に試薬分子の付着を最小限に抑える、低結合および microfuge を使用して各試薬マスター ミックスを組み立てるための計算されたボリュームを追加します。優しく渦、追加する前に各試薬を遠心力場します。一度マスター ミックスを調製、渦をミックスし、遠心分離によって収集
- 8 チューブ PCR ストリップを準備します。各サンプルでは、正と負のコントロールを含むための管を指定します。
- ストリップの各チューブに pcr の適切な量を分注します。
- それぞれの PCR チューブにから、サンプルと同様、肯定的なテンプレートの 5 μ L、5 μ L グレードの分子水のネガティブ コントロールとしての DNA のテンプレートの適切なボリュームを追加します。
- Minicentrifuge を使用して、数秒間キャップを 8 管ストリップと遠心分離機で配置します。
- 場所、たちで 8 チューブ ストリップ
- 適切な PCR プログラム、たちに実行するを設定します。典型的なプログラムは、以下のとおり
- 変性 94 ° C、3 分で。
- 増幅の 30-40 のサイクル: 変性 94 ° c 30 s、30 s と拡張が 30 のための 72 ° c (50-60 ° C) の間に通常プライマー特定温度で焼鈍 s/500 bp。
- 7-10 分のための 72 ° C で最後の拡張。
4. Agarose のゲルの準備
- 125 mL 三角フラスコに粉が agarose の適切な量を必要なゲル容積とゲル濃度 (表 2) に基づき、重量を量る。
- フラスコ、ゲルの連続したバッファーの適切なボリュームを追加し、フラスコを手で旋回します。
- 1 分のハイパワー電子レンジ オーブンでバッファー agarose の混合物を加熱します。
- 電子レンジからフラスコを削除し、すべての agarose が溶けるように手で旋回します。Agarose に完全に溶解していない場合は、30 の単位で電子レンジを繰り返します。
- フラスコにキャップをしっかりと確保した後に、冷たい水を実行して下に回して 50 ° C にクールします。
- 臭化エチジウム (EtBr) の 1 μ L を EtBr 用に指定された micropippette を使用して agarose の混合物に追加します。EtBr は二本鎖核酸を結合し、UV ライトで照らされた時はオレンジ色の蛍光を発する染料です。EtBr は潜在的に発癌 (ゴーグル、白衣、EtBr 手袋) 保護具を着用する必要がありますので、注意してください。
- 電気泳動ゲルの鋳造トレイに溶融ゲルを注ぎなさい。Agarose 内で閉じ込められている気泡がないかどうかを確認します。ゲルに櫛を置き、確実にクランプします。ジェルを固めるための約 20-30 分を待ちます。
- ゲルは凝固させる為、一度ゲルの涙を引き起こすことがなく櫛を慎重に削除します。櫛はサンプルをロードのためのゲルの井戸を作成します。
5. ゲル電気泳動
- 電気泳動室に凝固 agarose のゲルを配置します。
- ゲルはかろうじて水没までチャンバーに適切な実行バッファーを追加します。
- パラフィルムの作品に染料の集中を読み込みのスポットをピペットします。PCR の製品の予想されるサイズの適切な範囲の DNA の梯子があります。また、microfuge の管、サンプルごとに 1 つの新鮮なセットを使用します。
- PCR が完了すると、たちから 8 チューブ ストリップを取得し、簡単に任意の凝縮を収集する遠心分離機します。ローディングの染料とミックスを上下にピペットに DNA 製品の適切な量を追加します。たとえば、ローディングの染料 × 10 の 2 μ L に 10 μ L、1 x で染付の最終的なボリュームを与えるサンプルの 8 μ L 混合です。
- 井戸を穿刺しないように注意して agarose のゲルで指定されたウェルにピペットの各色素サンプル混合物。
- 電気泳動室に電極を接続します。DNA は負に帯電""肯定的な電極に向かって動作するようです。したがって、正の電極を井戸が読み込まれた、商工会議所の反対側に接続します。バッファー システムとゲル室のサイズを適切な電圧に電源供給を設定し、それを実行するを設定します。小さな泡は、電気泳動が適切に進んでいる場合、商工会議所の側面を移動表示されます。
- 染料フロントはゲルを十分にずっと進んだ、電源をオフにします。慎重に transilluminator または視覚的撮像素子にゲルを輸送し、UV ゲルの DNA バンドを視覚化する光を入れます。
- バンドのサイズと、ゲル上の位置を分析します。関心の有機体からの DNA のサンプル (図 1) に存在を確認する肯定的な制御サンプルのバンドの位置を比較します。
| コンポーネント | チューブごとにボリューム (μ L) | 5 管の体積 (μ L) | 最終濃度 |
| 10 倍Taqバッファー Ex | 5.0 | 25 | 1 x |
| 2.5 mM dNTPs | 4.0 | 20 | 0.2 mM |
| 前方プライマー * | 2.0 | 10 | 400 nM |
| 逆プライマー * | 2.0 | 10 | 400 nM |
| 分子 H2O | 31.75 | 158.75 | - |
| Taq ex | 0.25 | 1.25 | 2.5 U |
| Pcr | 45 | 225 |
テーブル 1。PCR の試薬ボリューム マスター ミックス。* プライマー ボリュームは生物の試金によって異なります。分子グレード最終巻 45 μ L を作るために水の量を調整します。その他のコンポーネントのボリュームが変わらないようにします。
| アガロースの推奨 % | 最適な解像度線形 DNA のフラグメント (塩基) |
| 0.5 | 1,000 30,000 |
| 0.7 | 800-12,000 |
| 1.0 | 500-10,000 |
| 1.2 | 400 7,000 |
| 1.5 | 200 3,000 |
| 2.0 | 50 2,00 |
表 2。DNA フラグメント サイズ範囲の異なる agarose のゲルの割合によって最適な解決。
結果
図 1で DNA の梯子 (1 レーン) はサイズおよび PCR の製品のバンドのおおよその濃度のリファレンスを示します。ネガティブ コントロール (2 車線) では、ターゲット ターゲット バンドのサイズと位置を示す DNA を含んでいるテンプレートから肯定的な制御 (3 車線) を増幅しながら、任意の遺伝物質は含まれません。4、6、8、および 9 のサンプルは、したがってターゲットの遺伝物質を含むこれらのサンプルを示すポジティブ コントロールとして同様のバンド パターンを表わします。これらのサンプルが得られた環境で有機物があると推測できます。
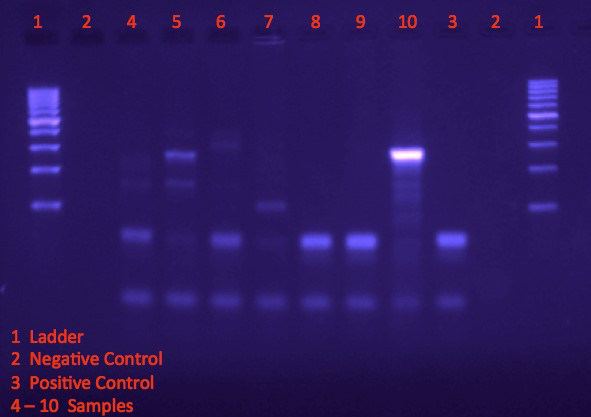
図 1。Agarose のゲルの電気泳動の後でバンドを可視化。
申請書と概要
PCR を採用して、環境中の病原体の有無を迅速に判断できます。たとえば、脳を食べるアメーバフォーラーネグレリアに特定のプライマーは DNA を増幅する、生物がサンプルで現在の場合ゲルの強力なバンドを生成します。場合単一の生物は、主な関心が、関連付けられているさまざまな有機体から毒素産生遺伝子ではなくには、PCR はこれらの特定の遺伝物質の存在の有無を決定するも使用できます。
環境微生物研究室を分析する際、PCR を確認手順として使用もできます。培養法は、環境試料に含まれる特定の有機体の区別ができない、PCR は、たぶん具体的候補微生物を区別使用。
従来の PCR は、特定の実験のためにいくつかの方法で変更できます。PCR は、逆のトランスクリプション ステップ (RT-PCR) への結合によって単一座礁させた RNA テンプレートを分析する使用ことができます。を超えて不在と存在の定量、定量 PCR (qPCR) は興味の特定の DNA の濃度を測定できます。
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
ポリメラーゼ連鎖反応およびゲル電気泳動法と環境微生物の検出
Environmental Microbiology
44.6K 閲覧数

土壌中の水分の定量
Environmental Microbiology
359.4K 閲覧数

無菌環境科学
Environmental Microbiology
126.4K 閲覧数

環境ソースから細菌のグラム染色
Environmental Microbiology
100.3K 閲覧数

連絡先を介して可視化の土壌微生物スライド法と顕微鏡
Environmental Microbiology
42.2K 閲覧数

糸状菌
Environmental Microbiology
57.3K 閲覧数

細菌のコロニーからコミュニティの DNA の抽出
Environmental Microbiology
28.8K 閲覧数

RT-PCR 法を用いた環境試料の RNA 解析
Environmental Microbiology
40.4K 閲覧数

環境微生物やウイルスを使用しての qPCR の定量化
Environmental Microbiology
47.8K 閲覧数

指標生物による水質分析
Environmental Microbiology
29.5K 閲覧数

ろ過による水試料からの糞便細菌の分離
Environmental Microbiology
39.3K 閲覧数

環境試料中のバクテリオファージの検出
Environmental Microbiology
40.7K 閲覧数

養殖および土壌試料からの細菌を列挙します。
Environmental Microbiology
184.4K 閲覧数

細菌の成長曲線の解析と環境応用
Environmental Microbiology
296.0K 閲覧数

藻類培養手法を介して列挙
Environmental Microbiology
13.8K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved