Method Article
生存可能だが培養不可能な病原体を蘇生させる ためのIn vivo モデルとしてのニワトリ胚
要約
この方法は、ニワトリの胚を、細菌性病原体L.monocytogenesを生存可能だが培養不可能な(VBNC)状態から復活させるためのシンプルで費用対効果の高いin vivoモデルとして示しており、細菌の休眠メカニズムの理解にさらに使用できる可能性があります。
要約
ニワトリの胚は、その簡便さ、手頃な価格、およびさまざまな生物学的現象の研究における適応性により、生物医学研究への応用が拡大し、人気のあるin vivoモデルとして浮上しています。このモデルは、微生物の病原性を調査するために使用されており、細菌の休眠を研究するための有用なツールになりつつあります。生存可能だが培養不可能(VBNC)状態は、細菌が代謝的に静止し、過酷な環境で生存能力を維持するために培養に抵抗性を持つ休眠状態です。好ましい条件下では、VBNC細菌は代謝活性で培養可能な状態に戻ることができます。食品媒介性リステリア症の原因となるリステリア菌など、VBNC状態に切り替える細菌性病原体は、従来の成長依存性法では検出されず、復活時に病原性を回復する可能性があるため、公衆衛生上の懸念事項です。このことは、VBNC病原体の復活を促進する条件とメカニズムについての理解を深めることを促します。ここで紹介する方法は、ニワトリの胚をVBNC L. monocytogenesを培養可能な状態に戻すための効率的なin vivoモデルとして示しています。主に栄養補給に基づくin vitroの復活の試みが非生産的であった場合、このプロトコルは、ミネラルウォーターの飢餓によって生成されたL.モノサイトゲネスの細胞壁欠損VBNC型の再活性化を促進することに成功しています。重要なことに、得られた結果は、VBNC L. monocytogenesの復活のための胚の必要性を強調しており、このプロセスにおける胚関連因子の重要な役割を示しています。この方法の他の潜在的な用途には、VBNC状態の復活のメカニズムに関与する細菌因子のスクリーニングと同定が含まれます。したがって、このモデルは、検出できない病原体に伴う公衆衛生上のリスクを軽減するために重要な知識を持つ細菌の休眠の分子的働きについての洞察を提供することができます。
概要
代替のin vivo研究モデルの探索において、関連するコストを削減し、物流的および倫理的考慮事項を伴いながら、ニワトリの胚が出現し、すぐに最も適用可能で、管理しやすく、再現性のあるin vivo脊椎動物モデルシステムの1つになりました1,2。げっ歯類やウサギなどの他の動物モデルと比較して、受精鶏卵は安価に入手でき、開発のために複雑な住宅物流を必要としません。さらに、鶏の卵のサイズは、多数の胚を並行して扱うことを可能にし、堅牢な数の実験試験条件/グループと反復をサポートします。胚形成期間が短く(21日)、発生期間の任意の時点で胚と関連構造にアクセスして観察することが容易であることから、これは発生生物学(心臓や脳の形成など)3,4や薬理学(薬物活性、送達、毒性の試験)1,5など、さまざまな分野で有用なモデルとなっています。6.さらに、ニワトリ胚の免疫系は未熟であるため、免疫ベースの研究やがん研究関連のアプローチに適したシステムとなっています7。重要なことに、このモデルの胚性は、発達13-14日目までに成熟した侵害受容システムを獲得するだけであり、8、この時間枠内で行われる研究アプリケーションは、法的および倫理的な懸念7によって制約されません。
ニワトリ胚モデルは、ヒトや他の哺乳類に病気を引き起こす微生物の病原性を研究するためにも広く使用されています。実際、原生動物の病原性を調査するために、このモデルを調査および検証する研究が数多く行われています(例:Neospora caninum、Eimeria tenella、Cryptosporidium spp.)9,10,11、真菌類(例:Candida albicans、Aspergillus fumigatus)12,13、および細菌種(例:Enterococcus spp.、Salmonella enterica、Francisella spp.、Campylobacter jejuni、Clostridium perfringens、Listeria monocytogenes、Neisseria gonorrhoeae、Staphylococcus aureus)10、図14,15,16,17,18,19,20,21,22、ならびに抗菌化合物17,23の治療効果を試験する。
上記のような微生物は、環境内でストレスの多い刺激にさらされることが多く、したがって、潜在的に有害/致命的な状況に耐えるためのストレス対処戦略を進化させてきました。一部の細菌種は、内胞子と呼ばれる非常に弾力性があり、代謝的に休眠している構造を生成することができ、厳しい環境制約の下で細胞および遺伝的完全性を維持します。良好な環境条件が集まれば、内生胞子は発芽によって生存可能な活性細胞に再生することができる24。しかし、非胞子形成細菌は、生存可能だが培養不可能(VBNC)と呼ばれる代替の代謝休眠状態に入る可能性があり、その主な表現型の特徴は、ルーチン増殖培地での培養性の喪失である25。VBNC状態に入ると報告されている>100の細菌種の大部分がヒトや他の動物に対して病原性であり26、VBNC病原体が代謝活性で毒性のある状態に戻る可能性があることを考えると25,26、VBNC病原体を検出するための従来の成長ベースの方法の失敗は、公衆衛生上の懸念事項である。この復活プロセスを推進する環境の手がかりと分子的および生理学的メカニズムはまだ十分に理解されておらず、微生物種やVBNC状態を誘発するストレスによって異なる場合があります。
研究者たちは、ニワトリ胚モデルの特殊性を利用して、VBNC状態における細菌性病原体の in vivo 再生能力を調査しました。ヒト由来 のC. jejuni 分離株は、水中の栄養不足によりVBNC状態に追い込まれ、胚化したニワトリの卵27で継代した後、ヒト細胞内での培養性と病原性を回復した。同様に、VBNC状態を元に戻す試みの成功例は、 Edwardsiella tarda28、 Legionella pneumophila29、 L. monocytogenes30などの他の病原体についても報告されています。
最近、 L. monocytogenes がミネラルウォーター中で飢餓状態に追い込まれると、棒状から球状細胞に移行することを報告しています。この形態変化は、細胞壁への累積的な損傷によって引き起こされ、細菌によって完全に脱落し、細胞壁欠損球状細胞形態31になることを明らかにしました。これらの壁のないVBNC L. monocytogenes の形態を in vitroで復活させる試みは失敗に終わり、栄養補充アプローチを使用して、in vivoでの彼らの潜在的な救済を調査することにつながりました。 L. monocytogenes30との有望な使用を考慮して、この課題にはニワトリ胚モデルを選択しました。その結果、胚化したニワトリ卵系が細胞壁欠損VBNC L. monocytogenes の活性培養可能な状態への回復を促進する能力が確認された31。
ここでは、胚のニワトリ卵環境への曝露を通じて、休眠VBNC状態からL.monocytogenesのin vivo復活を可能にする詳細なプロトコルを提供します。ニワトリ卵とVBNC細菌の調製とモニタリング、卵の接種、胚卵と非胚卵の処理、およびVBNC細胞の復活効率を評価するための培養可能な細菌負荷のスコアリングについて説明します。この結果は、ニワトリ胚が、細菌の休眠など、微生物の生活のさまざまな側面を支配するメカニズムを理解するための、単純で費用対効果が高く、適切なモデルであることを再確認した。このin vivoシステムは、復活プロセスにおける個々の細菌遺伝子の寄与を調査するためにさらに調査することができます。
プロトコル
この議定書は、研究における動物の使用に関するフランス(政令第2013-118号)および欧州(指令2010/63/EU)のガイドラインに準拠しています。さらに、フランスの法律(政令第2020-274号)では、ニワトリ胚に関するすべての実験は胚形成の最後の第3期前(すなわち、14日目)より前に行われ、完了するため、このプロトコルは倫理的制限とは関係ありません。
1. VBNC菌の調製
- グリセロールストック(-80°Cで保存)から接種ループを使用して脳心臓注入(BHI)寒天培地にストリーク細菌株を注入します。37°Cで一晩インキュベートして、単離されたコロニーを取得します。
注:必要に応じて、寒天培地に、菌株が耐性を持つ抗生物質を補充します(自然または遺伝子組み換えによる)。 - 各株について、5mLのBHIブロスで2〜3本のチューブを準備し、接種ループを使用して2〜3コロニーを接種します。培養物を撹拌(200rpm)しながら37°Cで一晩インキュベートし、固定相まで細菌を増殖させます。これらの各培養物は、VBNC細菌懸濁液の独立した生物学的複製を調製するために使用されます。
- 各培養物をBHIブロスで1:10に希釈し、分光光度計で波長600nm(OD600)の光学密度を測定します。リステリア菌の最適に増殖した固定相培養物のOD600値は、2〜4の範囲です。これは、2-4 x 109コロニー形成単位(CFU)/mLの細菌濃度に相当します。
- 1.5 mLのマイクロチューブに1 mLの細菌培養液をペレット状に含み、6,000 x g で2分間遠心分離します。真空ポンプを使用して上清を吸引します。細胞ペレットをオートクレーブ滅菌してろ過したミネラルウォーター1 mLに再懸濁します。
- 手順1.4を3回繰り返して、細菌をよく洗います。これにより、VBNC細菌の形成を遅らせる可能性のある培地の栄養素が完全に除去されます。
- 30 mLのミネラルウォーターを含むT25細胞培養フラスコに30 μLの洗浄済み細菌を加えて、開始濃度106 CFU/mLで細菌懸濁液を調製します。
- 血清学的ピペットを使用して懸濁液を混合します。室温で、静電気(フラスコを直立させた状態)および薄暗い照明条件下で保管してください。
2. VBNC細菌の形成のモニタリング
- 以下に説明するように、1日目 (調製直後)に細菌懸濁液中の培養可能な集団を決定し、その後は毎週決定します。
- ミネラルウォーター中のVBNC細菌懸濁液の10倍段階希釈液(10-1 〜10-3 希釈)を調製します。BHI寒天培地で100 μLの原液と各希釈液を二重にプレート化し、37 °Cで一晩インキュベートします。
注:培養性が1 CFU / mL<に近づくと、培養可能な細菌の有無を確認するために、希釈されていない懸濁液をより大きな量(0.5〜2 mL)で播種する必要があります。 - 培養可能な細菌の濃度を次のように計算します。
培養可能な細菌の濃度(CFU/mL)=(平均コロニー数×サンプル希釈係数)/メッキサンプル量(mL単位)。
- ミネラルウォーター中のVBNC細菌懸濁液の10倍段階希釈液(10-1 〜10-3 希釈)を調製します。BHI寒天培地で100 μLの原液と各希釈液を二重にプレート化し、37 °Cで一晩インキュベートします。
- 細菌懸濁液中の生存可能な集団を1日目( 調製直後)に決定し、その後、以下に説明するように毎週決定します。
- 細菌懸濁液のサンプル(すなわち、約106 細胞/mLの濃度)を生存率色素5(6)-カルボキシフルオレセインジアセテート(CFDA)と最終濃度30 μMで暗所で30分間インキュベートします。また、CFDAを含まないサンプル(未染色コントロール)と、CFDAとインキュベートする前に95°Cで30分間処理したサンプル(非生存細胞/死細胞コントロール)も調製します。
- 488 nmの励起レーザーと520 nmのCFDA蛍光検出器を搭載したフローサイトメーターでサンプルを分析します。統計的な頑健性を確保するには、サンプルあたり約1 x 105 の細菌イベント(これは、取得サンプル量が10〜100 μLに変換されます)を、少なくとも30 μL/minの流速で取得します。
- 未染色サンプルを使用して、対数スケールの前方散乱(FSC)対側散乱(SSC)プロットで細菌関連イベントを見つけてゲートします。ゲート型細菌イベントを対数スケールのCFDA蛍光ヒストグラムにプロットし、未染色および非生存細胞/死細胞サンプルを使用して、生存可能(CFDA陽性)集団と非生存(CFDA陰性)集団を区別します。
- 生存可能な細菌の濃度を次のように計算します。
生菌の濃度(細胞数/mL)=取得サンプル中のCFDA陽性イベントの平均数/取得サンプル量(mL)
注:サイトメーターのモデルによっては、細胞の定量にフローサイトメトリーカウントビーズの使用が必要になる場合があります。
3.卵の孵化
- 供給業者から受領したら、受精卵を翌日まで室温で収容します。
- その間に、卵インキュベーターの貯水池に脱イオン水を入れ、電源を入れます。温度を37.7°Cに、最大相対湿度を47%に設定します。
注:私たちの手では、卵は38%〜42%の相対湿度範囲で孵化され、予想される胚形成率と成功に目に見える影響はありません。 - 卵子をインキュベーターに移して胚形成を開始します。エアポケットを上に向けて(つまり、先のとがった端を下に向けて)、インキュベータートレイに配置します。
- 卵を6日間孵化させます。4日後、キャンドリングにより、生きた胚卵と死んだ卵子または非胚卵を区別します。
- 卵を強力な光源(キャンドラー)の下/上に置いて、内部を照らし、その内容を視覚的に識別します。3〜4日間の孵卵後、生きた胚卵はエアポケットから下向きに広がる血管のネットワークを示します。このネットワークは、死んだ胚の卵子では崩壊して無秩序に見え、胚形成を開始できなかった卵子では完全に存在しません。目に見える場合、生きた胚はけいれん運動を示すことさえあります(図1)。
4.接種用卵子の準備
- 接種当日は、卵子にキャンドルを当てて、生存可能な胚卵子と非胚卵子の利用可能な数を決定します。ステップ3.4で説明されているように、非胚化卵子(総数の約10%〜20%)と死んだ胚を持つ卵子を特定します。後者は、生物学的廃棄物処理に関する制度的ガイドラインに従って廃棄してください。
- エアポケットの境界線から2〜5 mm上に卵殻の注入スポットをマークします(図2A)。70%(v / v)エタノールを浸したティッシュペーパーでこすって、この領域を消毒します。.
- 18Gの針を使用して、シェルの膜を貫通せずに、注入スポットのシェルに穿刺のへこみを慎重に作ります(図2B)。70%(v / v)エタノールを浸したティッシュペーパーで注入スポットを消毒します。.
5.卵子の接種
- 25G(0.5 mm x 16 mm)の針を1 mLシリンジに差し込み、VBNC細菌懸濁液を充填します。必要に応じて、シリンジの内壁に付着した気泡を指でフリックして取り除きます。
- ミネラルウォーター単独、またはBHIブロスで一晩増殖させた L.モノサイトゲネス (5 x 103 CFU/mL)の懸濁液を、無菌性および培養性細菌由来の増殖の制御条件としてそれぞれ実施します。
- 注入スポットで穴の開いたシェルに針を導入し、針の基部がシェル表面に接触するまで垂直な角度で完全に挿入します(図2C)。これにより、針先がシリンジの内容物を尿膜腔(胚卵子の場合)または卵白(非胚卵の場合)に送達するように配置されます。
- 接種材料100μLを慎重にゆっくりと注入します。胚卵の内部では、胚に致命的な傷害を引き起こさないように、針の角度をできるだけ動かさないでください。
- 丁寧にゆっくりと針を抜き、注射部位を丸いシールで覆って接種エントリー部位を密閉します。利便性と明瞭さのために、卵の状態/グループごとに異なる色のステッカーを使用してください。
- 接種した卵をさらに2日間インキュベーターに戻します。発生中の胚を持つ卵子がインキュベーターから出ていない(または37.7°C未満の温度)30分以上経過していないことを確認してください。必要に応じて、接種をバッチで行ってください。
6. 接種サンプル中の培養可能細胞の存在評価
- 100 μL の VBNC 細菌懸濁液を 96 ウェルマイクロプレートの複数のウェルに分注します。ウェルの数≥接種された(胚化+非胚化)卵の数の2倍を計算します。
- ステップ5.2で説明した制御条件を使用する場合は、各接種物(つまり、ミネラルウォーターまたは培養可能な細菌)100 μLを、同じ96ウェルマイクロプレート内の少なくとも3つのウェルに分注します。
- マルチチャンネルピペットを使用して、前の2つのステップで調製した各ウェルに100 μLのBHI培地を加えます。
- プレートを静的条件下で37°Cでインキュベートし、培養可能な細菌を含むウェルでの細菌の増殖を促進します。これらの条件での培養可能な細菌の存在とその再増殖速度によっては、培養可能な細菌を含む井戸を完全に明らかにするために、1日以上のインキュベーションが必要になる場合があります。
- 各接種物について、細菌の増殖に対して陽性と陰性のスコアを獲得したウェルの数を視覚的に検査し、カウントします。
7. 胚の生存率のモニタリング
- 接種の翌日、胚の致死性を確認するために、胚の卵子にキャンドルを灯します。
- 死んだ胚を含む卵子を脇に置き、感染した生物学的廃棄物処理に関する施設のガイドラインに従って廃棄します。
8.胚卵の処理
- インキュベーターとキャンドルから胚の卵子を回収して、胚の致死性を確認します。死んだ胚を破棄し、最終結果でそれらを考慮しないでください。
- 卵からステッカーをはがし、シェルの上端(エアポケットを覆っている)を70%(v / v)エタノールを染み込ませたティッシュペーパーで消毒します。
- 清潔な解剖ハサミを使用して、注入スポットからシェルを切り開き、エアポケットを露出させます。清潔な解剖ピンセットを使用して、エアポケットと卵の残りの部分を隔てている内殻膜を引き裂いて開きます。
- 卵の内容物を滅菌ペトリ皿に慎重に空にします。ピンセットを使用して、胚を分離し、新しいシャーレに移します。必要に応じて、胚を滅菌PBSで洗浄します。
- 胚を4mLの滅菌PBSを含む15mLの遠心分離チューブに移します。ホモジナイザー(速度:10,000 rpm)を使用して胚を解離します。各ホモジナイズ間で分散ツールの先端を洗浄するには、滅菌PBS、70%(v / v)エタノール、および再度滅菌PBSに順次通過させます。
- BHI寒天上に胚ホモジネート500μLをプレートします。プレートを37°Cで一晩(または必要に応じてそれ以上)インキュベートします。
注:オプションで、希釈されていないホモジネート中にCFU数の増加(つまり、> 300)が予想される場合は、ホモジネートの段階希釈を播種することができます。 - 接種グループごとに、寒天プレート上の L.monocytogenes の成長に対して陽性と陰性のスコアを獲得した卵の数を数えます。
注:胚の抽出と均質化が行われる無菌条件にもかかわらず、胚ホモジネートをプレーティングするための非選択的寒天培地の使用は、汚染物質の成長のリスクを伴います。属/種特異的な増殖培地の使用、または選択的抗生物質(試験した細菌株のみが耐性を持つ)の補給により、このような汚染を軽減または防止することができます。
9.非胚卵子の処理
- インキュベーターから非胚卵子を回収します。手順8.2と8.3を繰り返して、卵白にアクセスします。
- マイクロピペットを使用して、500 μLの卵白を採取し、BHI寒天に直接広げます。プレートを37°Cで一晩またはそれ以上インキュベートします(必要であれば)。
- 各接種グループについて、寒天プレート上の L.monocytogenes の成長に陽性のスコアが付けられた卵の数を数えます。
結果
ニワトリ胚モデルがミネラルウォーター中の飢餓によって生成されたL.monocytogenesの細胞壁欠損VBNC型を蘇生させる可能性を検証するためには、VBNC細菌接種物の調製タイミング(≥28日)と胚卵の調製タイミング(6日)を明確にすることが重要でした。したがって、L. monocytogenesの複製懸濁液を、予定された卵接種の日の28日前にミネラルウォーター中の1 x 106 CFU / mLの濃度に設定しました。この開始細菌濃度は、28日後に<1 CFU / mLの望ましい残留培養性をもたらすことが示されました31。懸濁液の細菌細胞の培養性と生存レベルの最終的な検証により、1 x 106 の生細胞と mL あたり 0.5 の培養可能細胞を含む VBNC L. monocytogenes 接種材料が選択されました。実験のために、この接種物100μL(すなわち、1 x 105生細胞および<0.1 CFU)を胚卵子および非胚卵のグループに送達しました。対照群は、胚卵と非胚卵に同量のミネラルウォーターまたはBHIブロスで一晩成長させたL.monocytogenesの5×103 CFU/mL懸濁液を注入することにより、並行して調製した。
接種後2日で、卵子を加工して培養可能な L.モノサイトゲネスの存在を評価しました。予想通り、ミネラルウォーターを注入した無菌対照群の卵子から細菌の増殖は回復しなかったが、培養可能な L. monocytogenes で処理した対照群の卵子の100%が寒天培地での増殖に陽性のスコアを示しました(表1)。重要なことに、VBNC細菌を接種した卵から回収されたすべての胚は、プレート上でL.monocytogenesの成長を引き起こし、同じVBNC細菌を注入した非胚卵の内容物で広げられたすべてのプレートに L.monocytogenes が完全に存在しないのとは対照的でした(表1)。この結果は、以前に報告されたように、VBNC L. monocytogenesの覚醒プロセスに対するニワトリ胚の必要性を強調している30。
VBNC細菌を注入した胚卵から回収されたL. monocytogenesの増殖が、残留培養可能な細胞の再増殖ではなく、真のVBNC細胞の回復によるものである可能性を判断するためには、卵の継代前後で細菌の増殖を引き起こす接種用量の頻度を比較する必要があります。前者を得るために、100μLのVBNC細菌接種物を複数回、VBNC L. monocytogenes revival32をサポートしない栄養豊富な培地BHIと96ウェルプレートで混合し、37°Cでインキュベートしました。 細菌増殖陽性の接種BHI井戸の9.5%(84本中8本)の頻度は、回収された培養可能な細菌を示す卵の100%の頻度(表1)と有意に異なっていました(フィッシャーの正確確率検定、p = 1.6 × 10-17)。この実質的かつ統計的に有意な差は、胚卵から回復したL. monocytogenesの増殖が主にVBNC細菌の再活性化によるものであったことを強く示しています。さらに、その栄養型とは異なり、VBNC L. monocytogenesは非胚卵では蘇生できなかったことから、胚卵におけるVBNC細胞の復活は、接種物中に残存する培養可能な細菌によるものではないことが支持されています。
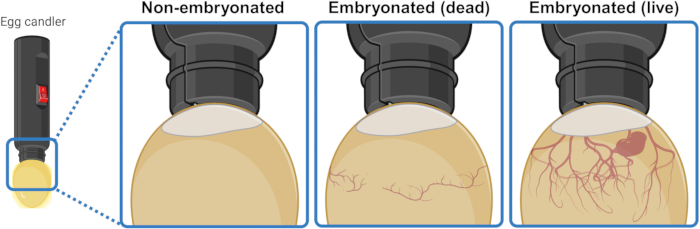
図1:キャンドリングによる非胚化、死んだ胚化、および生きた胚化鶏の卵を区別します。 胚発生状態は、近距離から光源(エッグキャンドラー)で卵子を照らすことで決定されます。発生中の生きた胚(見えるかどうかにかかわらず)を含む卵子は、エアポケットから下向きに広がる血管の強力なネットワークを示します。このネットワークは、死んだ胚を持つ卵子では崩壊して無秩序に見え、胚形成を開始できなかった卵子では完全に存在しません。BioRender.com 年に作成されました。 この図の拡大版を表示するには、ここをクリックしてください。

図2:接種用の卵子の準備。(A) 注入部位は、キャンドリングで見られるように、エアポケットの境界から2〜5mm上の位置にマークされています。 (B) 注射部位のシェルは、外殻膜を貫通せずに、18G針の先端の助けを借りて穿刺へこみます。 (C) 接種物は、25G(0.5 mm x 16 mm)の針を介して、胚卵の尿膜液または非胚卵の卵白に送達されます。BioRender.com 年に作成されました。 この図の拡大版を表示するには、ここをクリックしてください。
| 接種物 | 卵通過前の培養性 | 卵継代後の培養性b | |||
| 胚卵 | p値C | 非胚性卵子 | p値D | ||
| ミネラルウォーター | 0/3 (0%) | 0/10 (0%) | >0.999 | 0/10 (0%) | >0.999 |
| VBNCのLM | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| カルチュラブルLM | 3/3 (100%) | 8/8 (100%) | >0.999 | 2/2 (100%) | >0.999 |
| ある細菌が増殖したBHIウェルの数/接種されたBHIウェルの数。 | |||||
| イ細菌が増殖した卵の数/接種した卵の数。 | |||||
| ハ胚卵の継代前後の培養可能性の比較(両面フィッシャーの正確確率検定)。 | |||||
| d非胚卵の継代前後の培養可能性の比較(両面フィッシャーの正確確率検定)。 | |||||
表1:VBNC L. monocytogenesは 、胚のニワトリ卵で継代した後、培養可能な状態に戻ります。 胚化および非胚化ニワトリの卵(6日)に、100μLのミネラルウォーターのみ、またはVBNCのミネラルウォーター懸濁液(1×10、4 細胞、28日)または培養可能(500細胞) L.モノサイトゲネスを接種した。2日後、胚(または非胚卵の卵白)を回収し、BHI寒天に播種して、培養可能な L.モノサイトゲネスの存在を評価しました。卵継代前の接種用量で存在する培養可能な細胞の頻度は、96ウェルマイクロプレートの複数のウェルで各懸濁液100μLをBHIブロスと混合し、37°Cでのインキュベーション後の細菌増殖を伴うウェル数をスコアリングすることによって決定しました。 統計的有意性は、両側フィッシャーの正確確率検定を使用して計算され、0.05≥p値は有意ではないと考えられました。この表は昭和31年から再現したものです。
ディスカッション
生存可能だが培養不可能な(VBNC)形態の細菌性病原体に関連する公衆衛生および経済的リスクは、従来の微生物増殖ベースの方法による検出を回避する能力と、臨床および食品業界の環境で使用されるほとんどの抗菌薬に対する耐性/非感受性の結果です26,33.したがって、VBNC状態の細菌細胞の移行、維持、および復活を促進するメカニズムをよりよく理解するための研究ツールとモデルを見つけることが急務になります。
多くの点で、ニワトリの胚は、従来の哺乳類の研究モデル(マウス、ラット、ウサギなど)に代わる有利な選択肢です。卵生生物と協力する方が技術的により実用的です、なぜならその胚発生は速く、その祖先とは無関係に外部で起こるからです。重要なことに、鶏卵と胚の生産、住居、維持に関連する財政的および物流上の負担が著しく低くなっています。さらに、大きな数値を簡単に取得できるため、複数の実験条件や反復を並行してテストし、包括的で統計的に堅牢なデータを生成できます。魚類や線虫などの非哺乳類モデルも同様の利点を提供できますが、温血脊椎動物であるニワトリの胚は進化的にヒトに近いため、免疫学、疾患モデリング、発生、毒物学などの分野でより優れた研究モデルとなります。胚モデルは、倫理的な観点からも、特に成熟した侵害受容システムがまだ確立されていない発生の最初の3分の2において、より簡単に扱うことができる8。この短い時間枠は、迅速なターンアラウンドタイムを必要とするアプリケーション(薬物試験1など)には便利ですが、後の胚形成段階や孵化後の生命まで続くアッセイ(発生研究や行動研究など)には制限が生じる可能性があります。また、適応免疫系がないため、ニワトリの胚は宿主と病原体の相互作用やがん生物学などの分野で有用な研究ツールとなっています7。
ニワトリの胚は、微生物の病原性9,10,11,12,13,14,15,16,17,18の研究で広く使用されていますが、VBNC病原体を復活させるモデルとしては控えめです27,28,29,30 .ここでは、このin vivoシステムをVBNC L.モノサイトゲネスのレスキューにどのように成功裏に使用できるかについて、詳細な方法論的説明を提供しました。
この方法で考慮すべき重要な点は、培養可能な細胞の残留存在と、それらが真のVBNC細胞の復活を圧倒する可能性の問題です。この問題に対処するためのVBNC細胞作製法の限界(VBNC細胞の純度レベルは開始細菌濃度と組み合わされています)により、培養可能な細胞の汚染を完全に排除するか、またはそれらを無視できるレベルに減らすための代替アプローチを採用する必要性が生じます。このようなアプローチには、例えば、培養可能な細胞のみを標的とする抗菌剤による中和/殺傷が含まれ得る。あるいは、培養可能な細胞集団の物理的除去は、フローサイトメトリーによる独特の形態生理学的特性(例えば、細胞形状、表面または細胞質構造または分子)に基づいて達成することができる。このアプローチには、異なる年齢(すなわち、異なる時点で形成された)のVBNC細胞亜集団の単離/精製を可能にするという追加の利点があり、これはまた、それらの復活能力について ovoで テストすることもできる。
この方法の他の注意点には、特に注入ステップ中および注入ステップ直後の胚卵の慎重な取り扱い(意図しない針関連の外傷または致死性を避けるため)と、最適なインキュベーション温度以外での操作時間を短縮するよう努めることが含まれます。さらに、胚の回収、処理、およびプレーティングを行うべき無菌条件にもかかわらず、寒天プレート上で望ましくない微生物の増殖が依然として発生する可能性があります。これは、目的の細菌種に選択的な製剤(基礎組成物および/またはサプリメント)を含む寒天培地を使用することによって、または特定の抗生物質に対する耐性を有する株を使用することによって解決できます。
この研究では、細菌の休眠のメカニズムの側面を調査するための、シンプルでありながら強力で費用対効果の高い in vivo モデルとしてニワトリの胚を紹介しています。これに関連して、個々の細菌変異体のスクリーニングを通じて、または混合ライブラリー(トランスポゾン変異体ライブラリーなど)を使用してゲノムワイドスケールで、VBNC状態覚醒プロセスに関与する細菌因子を特定するために使用できる可能性があります。
開示事項
著者は、利益相反を宣言しません。
謝辞
この研究は、Micalis Institute(AAP Micalis FAMe 2023)からの助成金によって支援されました。F.C.は、Agence Nationale de Recherche(THOR: ANR-20-CE15-0008;PERMALI: ANR-20-CE35-0001)。
資料
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
参考文献
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved