Method Article
Hühnerembryo als In-vivo-Modell zur Wiederbelebung lebensfähiger, aber nicht kultivierbarer Krankheitserreger
In diesem Artikel
Zusammenfassung
Diese Methode zeigt den Hühnerembryo als einfaches und kostengünstiges in vivo Modell, um den bakteriellen Erreger L. monocytogenes aus einem lebensfähigen, aber nicht kultivierbaren (VBNC) Zustand wiederzubeleben und mit potenziellen weiteren Anwendungen für das Verständnis der bakteriellen Ruhemechanismen.
Zusammenfassung
Der Hühnerembryo hat sich aufgrund seiner Einfachheit, Erschwinglichkeit und Anpassungsfähigkeit bei der Untersuchung verschiedener biologischer Phänomene zu einem beliebten In-vivo-Modell mit zunehmender Anwendung in der biomedizinischen Forschung entwickelt. Dieses Modell wurde zur Untersuchung der mikrobiellen Pathogenität verwendet und wird zu einem nützlichen Werkzeug zur Untersuchung der bakteriellen Ruhephase. Der lebensfähige, aber nicht kultivierbare (VBNC) Zustand ist ein Ruhezustand, in dem Bakterien metabolisch ruhig und resistent gegen Kultivierung werden, um ihre Lebensfähigkeit in rauen Umgebungen zu erhalten. Unter günstigen Bedingungen können VBNC-Bakterien wieder in einen metabolisch aktiven und kultivierbaren Zustand erwachen. Bakterielle Krankheitserreger, die in einen VBNC-Zustand übergehen, wie z. B. die lebensmittelbedingte Listeriose verursachende Listeria monocytogenes, stellen ein Problem für die öffentliche Gesundheit dar, da sie sich dem Nachweis durch herkömmliche wachstumsabhängige Methoden entziehen und bei Wiederbelebung ihre Virulenz wiedererlangen können. Dies erfordert ein besseres Verständnis der Bedingungen und Mechanismen, die die Wiederbelebung von VBNC-Erregern antreiben. Die hier vorgestellte Methode zeigt den Hühnerembryo als effizientes in vivo-Modell, um VBNC L. monocytogenes wieder in einen kultivierbaren Zustand zu versetzen. Während In-vitro-Wiederbelebungsversuche, die weitgehend auf einer Nährstoffauffüllung basierten, unproduktiv waren, gelingt es diesem Protokoll, die Reaktivierung von zellwanddefizienten VBNC-Formen von L. monocytogenes zu fördern, die durch Hunger in Mineralwasser erzeugt wurden. Wichtig ist, dass die erzielten Ergebnisse die Notwendigkeit des Embryos für die Wiederbelebung von VBNC L. monocytogenes unterstreichen, was auf eine wichtige Rolle embryoassoziierter Faktoren in diesem Prozess hinweist. Weitere mögliche Anwendungen für diese Methode sind das Screening und die Identifizierung bakterieller Faktoren, die an den Mechanismen der Wiederbelebung des VBNC-Zustands beteiligt sind. Dieses Modell kann somit einen Einblick in die molekulare Funktionsweise der bakteriellen Ruhephase geben, deren Wissen entscheidend ist, um die Risiken für die öffentliche Gesundheit zu reduzieren, die von nicht nachweisbaren Krankheitserregern ausgehen.
Einleitung
Auf der Suche nach alternativen in vivo-Forschungsmodellen mit reduzierten Kosten und logistischen und ethischen Überlegungen entstand der Hühnerembryo und wurde schnell zu einem der am besten anwendbaren, handhabbarsten und reproduzierbarsten in vivo Wirbeltiermodellsysteme 1,2. Im Vergleich zu anderen Tiermodellen, wie Nagetieren und Kaninchen, sind befruchtete Hühnereier kostengünstig in der Beschaffung und benötigen keine aufwendige Haltungslogistik für ihre Entwicklung. Darüber hinaus ermöglicht die Hühnereigröße die parallele Handhabung zahlreicher Embryonen, was eine robuste Anzahl von experimentellen Testbedingungen/-gruppen und Replikationen unterstützt. Die kurze Embryogenesedauer (21 Tage) und die einfache Zugänglichkeit und Beobachtung des Embryos und der damit verbundenen Strukturen zu jedem Zeitpunkt der Entwicklungsphase machen dieses Modell zu einem nützlichen Modell in einer Vielzahl von Bereichen, wie z. B. der Entwicklungsbiologie (z. B. Herz- und Gehirnbildung)3,4 und der Pharmakologie (Prüfung der Aktivität, Verabreichung und Toxizität von Arzneimitteln)1,5, 6. Urheberrecht Darüber hinaus macht das unreife Immunsystem des Hühnerembryos ihn zu einem geeigneten System für immunbasierte Studien und Ansätze in der Krebsforschung7. Wichtig ist, dass aufgrund der embryonalen Natur dieses Modells, das erst am Entwicklungstag 13-14 8 ein ausgereiftes nozizeptives Systemerwirbt, Forschungsanträge, die innerhalb dieses Zeitraums durchgeführt werden, nicht durch rechtliche und ethische Bedenken eingeschränktsind 7.
Das Hühnerembryo-Modell wurde auch häufig verwendet, um die Pathogenität von Mikroben zu untersuchen, die Krankheiten bei Menschen und anderen Säugetieren verursachen. In der Tat haben zahlreiche Studien dieses Modell untersucht und validiert, um die Virulenz von Protozoen (z. B. Neospora caninum, Eimeria tenella, Cryptosporidium spp.) zu untersuchen.9,10,11, Pilze (z. B. Candida albicans, Aspergillus fumigatus)12,13 und Bakterienarten (z. B. Enterococcus spp., Salmonella enterica, Francisella spp., Campylobacter jejuni, Clostridium perfringens, Listeria monocytogenes, Neisseria gonorrhoeae, Staphylococcus aureus)10, 14,15,16,17,18,19,20,21,22 sowie zur Prüfung der therapeutischen Wirkung antimikrobieller Verbindungen 17,23.
Mikroorganismen, wie die oben genannten, sind in ihrer Umgebung(en) oft stressigen Reizen ausgesetzt und haben daher Stressbewältigungsstrategien entwickelt, um potenziell schädliche/tödliche Situationen zu überstehen. Einige Bakterienarten können sehr widerstandsfähige und metabolisch ruhende Strukturen produzieren, die als Endosporen bezeichnet werden und die zelluläre und genetische Integrität unter starken Umweltbedingungen bewahren. Wenn günstige Umweltbedingungen herrschen, können sich Endosporen durch Keimung zu lebensfähigen aktiven Zellen regenerieren24. Nicht-sporulierende Bakterien können jedoch in einen alternativen metabolisch ruhenden Zustand übergehen, der als lebensfähig, aber nicht kultivierbar (VBNC) bezeichnet wird und dessen wichtigstes phänotypisches Merkmal der Verlust der Kultivierbarkeit in routinemäßigen Wachstumsmedien ist25. Angesichts der Tatsache, dass ein großer Teil der > 100 Bakterienarten, von denen berichtet wird, dass sie in einen VBNC-Zustand übergehen, für Menschen und andere Tiere pathogen sind26 und dass VBNC-Krankheitserreger wieder in einen metabolisch aktiven und virulenten Zustand zurückkehren können25,26, ist das Versagen herkömmlicher wachstumsbasierter Methoden zum Nachweis von VBNC-Krankheitserregern ein besorgniserregendes Problem für die öffentliche Gesundheit. Die Umwelteinflüsse sowie molekularen und physiologischen Mechanismen, die diesen Wiederbelebungsprozess antreiben, sind noch nicht gut verstanden und können je nach mikrobieller Spezies und VBNC-zustandsinduzierendem Stress variieren.
Die Forscher haben sich die Besonderheiten des Hühnerembryo-Modells zunutze gemacht, um die In-vivo-Wiederbelebungsfähigkeit bakterieller Krankheitserreger in einem VBNC-Zustand zu untersuchen. Vom Menschen stammende C. jejuni-Isolate, die durch Nahrungsentzug im Wasser in einen VBNC-Zustand getrieben wurden, erlangten ihre Kultivierbarkeit und Virulenz in menschlichen Zellen nach der Passage in embryonierten Hühnereiern zurück27. In ähnlicher Weise wurden auch für andere Krankheitserreger wie Edwardsiella tarda28, Legionella pneumophila29 und L. monocytogenes30 erfolgreiche Versuche berichtet, den VBNC-Zustand wiederherzustellen.
Wir haben kürzlich berichtet, dass L. monocytogenes , wenn es durch Hunger in Mineralwasser in einen VBNC-Zustand getrieben wird, von einer stäbchenförmigen zu einer kokkoiden Zelle wechselt. Wir zeigten, dass diese morphologische Transformation durch eine kumulative Schädigung der Zellwand verursacht wird, die zu ihrer vollständigen Ausscheidung durch das Bakterium führt, das dann zu einer kugelförmigen Zellform mit Zellwandmangelwird 31. Unsere erfolglosen Versuche, diese wandlosen VBNC L. monocytogenes-Formen in vitro mit nährstoffauffüllenden Ansätzen wiederzubeleben, veranlassten uns, ihre mögliche Rettung in vivo zu untersuchen. Aufgrund seiner vielversprechenden Verwendung mit L. monocytogenes30 haben wir das Hühnerembryo-Modell für diese Aufgabe ausgewählt. Die Ergebnisse bestätigten die Fähigkeit des embryonierten Hühnereisystems, die Wiederherstellung des Zellwandmangels VBNC L. monocytogenes in einen aktiven kultivierbaren Zustand zu fördern31.
Hier stellen wir ein detailliertes Protokoll zur Verfügung, das die in vivo Wiederbelebung von L. monocytogenes aus einem inaktiven VBNC-Zustand durch Exposition in der embryonierten Hühnerei-Umgebung ermöglicht. Wir beschreiben die Aufbereitung und Überwachung von Hühnereiern und VBNC-Bakterien, die Inokulation von Eiern, die Verarbeitung der embryonierten und nicht embryonierten Eier und die Bewertung der kultivierbaren bakteriellen Belastung zur Beurteilung der Effizienz der VBNC-Zellwiederbelebung. Die Ergebnisse bestätigen den Hühnerembryo als einfaches, kostengünstiges und geeignetes Modell, um die Mechanismen zu verstehen, die verschiedene Aspekte des mikrobiellen Lebens steuern, wie z. B. die bakterielle Ruhephase. Dieses In-vivo-System kann weiter erforscht werden, um den Beitrag einzelner bakterieller Gene zum Auferstehungsprozess zu untersuchen.
Protokoll
Dieses Protokoll folgt den geltenden institutionellen französischen (Dekret Nr. 2013-118) und europäischen (Richtlinie 2010/63/EU) Richtlinien für die Verwendung von Tieren in der Forschung. Darüber hinaus befasst sich dieses Protokoll nach französischem Recht (Dekret Nr. 2020-274) nicht mit ethischen Einschränkungen, da alle Experimente mit Hühnerembryonen vor der letzten dritten Periode der Embryogenese (d. h. vor dem 14. Tag) durchgeführt und abgeschlossen werden.
1. Aufbereitung von VBNC-Bakterien
- Bakterienstämme aus Glycerinvorräten (gelagert bei -80 °C) mit Hilfe von Impfschleifen auf Agarmedien für Gehirn-Herz-Infusionen (BHI) streifen. Über Nacht bei 37 °C inkubieren, um isolierte Bienenvölker zu erhalten.
HINWEIS: Falls erforderlich, ergänzen Sie das Agarmedium mit Antibiotika, gegen die der Stamm (die Stamme) eine Resistenz besitzt (entweder auf natürliche Weise oder durch genetische Veränderung). - Bereiten Sie für jeden Stamm 2-3 Röhrchen mit 5 ml BHI-Brühe vor und verwenden Sie eine Impfschlaufe, um mit 2-3 Kolonien zu impfen. Inkubieren Sie die Kulturen über Nacht bei 37 °C unter Rühren (200 U/min), um die Bakterien bis zur stationären Phase zu züchten. Jede dieser Kulturen wird verwendet, um unabhängige biologische Replikate von VBNC-Bakteriensuspensionen herzustellen.
- Verdünnen Sie jede Kultur 1:10 in BHI-Bouillon und messen Sie die optische Dichte in einem Spektralphotometer bei einer Wellenlänge von 600 nm (OD600). Der OD600-Wert von optimal gewachsenen stationären Phasenkulturen von Listeria monocytogenes liegt zwischen 2 und 4. Dies entspricht einer Bakterienkonzentration von 2-4 x 109 koloniebildenden Einheiten (KBE)/ml.
- 1 mL Bakterienkultur in einem 1,5 mL Mikroröhrchen durch Zentrifugation bei 6.000 x g für 2 min pelletieren. Der Überstand wird mit einer Vakuumpumpe abgesaugt. Resuspendieren Sie das Zellpellet in 1 mL autoklaviertem und gefiltertem Mineralwasser.
- Waschen Sie die Bakterien gründlich, indem Sie Schritt 1.4 dreimal wiederholen. Dies gewährleistet die vollständige Entfernung von Nährstoffen aus dem Nährmedium, die sonst die Bildung von VBNC-Bakterien verzögern würden.
- Bakteriensuspensionen werden in einer Ausgangskonzentration von 106 KBE/ml hergestellt, indem 30 μl gewaschene Bakterien in T25-Zellkulturflaschen mit 30 ml Mineralwasser gegeben werden.
- Mischen Sie die Suspensionen mit einer serologischen Pipette. Lagern Sie sie bei Raumtemperatur, statischer Aufladung (Kolben in aufrechter Position) und schwachen Lichtverhältnissen.
2. Überwachung der Bildung von VBNC-Bakterien
- Bestimmen Sie die kultivierbare Population in den Bakteriensuspensionen am 1. Tag (unmittelbar nach der Zubereitung) und dann wöchentlich, wie unten beschrieben.
- Bereiten Sie 10-fache Serienverdünnungen der VBNC-Bakteriensuspension in Mineralwasser vor (von 10-1 bis 10-3 Verdünnungen). 100 μl unverdünnte Suspension und jede Verdünnung in zweifacher Ausfertigung auf BHI-Agar auffüllen und über Nacht bei 37 °C inkubieren.
HINWEIS: Wenn sich die Kultivierbarkeit < 1 KBE/ml nähert, sollte ein größeres Volumen (0,5-2 ml) der unverdünnten Suspension plattiert werden, um das Vorhandensein/Fehlen kultivierbarer Bakterien zu bestätigen. - Berechnen Sie die Konzentration der kultivierbaren Bakterien wie folgt:
Konzentration der kultivierbaren Bakterien (KBE/ml) = (durchschnittliche Anzahl der Kolonien x Probenverdünnungsfaktor) / plattiertes Probenvolumen (in mL).
- Bereiten Sie 10-fache Serienverdünnungen der VBNC-Bakteriensuspension in Mineralwasser vor (von 10-1 bis 10-3 Verdünnungen). 100 μl unverdünnte Suspension und jede Verdünnung in zweifacher Ausfertigung auf BHI-Agar auffüllen und über Nacht bei 37 °C inkubieren.
- Bestimmen Sie die lebensfähige Population in den Bakteriensuspensionen am 1. Tag (unmittelbar nach der Zubereitung) und dann wöchentlich, wie unten beschrieben.
- Eine Probe der bakteriellen Suspension (d. h. in einer Konzentration von etwa 106 Zellen/ml) wird mit dem Viabilitätsfarbstoff 5(6)-carboxyfluoresceindiacetat (CFDA) bei einer Endkonzentration von 30 μM für 30 min im Dunkeln inkubiert. Bereiten Sie auch eine Probe ohne CFDA (ungefärbte Kontrolle) und eine Probe vor, die 30 Minuten lang bei 95 °C behandelt wurde, bevor sie mit CFDA (nicht lebensfähige/tote Zellkontrolle) inkubiert wird.
- Analysieren Sie die Proben in einem Durchflusszytometer, das mit einem 488-nm-Anregungslaser und einem 520-nm-Emissionsdetektor für CFDA-Fluoreszenz ausgestattet ist. Für eine statistische Robustheit ist die Erfassung von etwa 1 x 105 bakteriellen Ereignissen pro Probe (dies entspricht einem erfassten Probenvolumen von 10-100 μl) bei einer Flussrate von mindestens 30 μl/min.
- Verwenden Sie die ungefärbte Probe, um die bakterienassoziierten Ereignisse in einem logarithmisch skalierten Forward Scatter (FSC) versus Side Scatter (SSC)-Diagramm zu finden und zu gaten. Zeichnen Sie die Gated Bacterial Events in einem logarithmisch skalierten CFDA-Fluoreszenzhistogramm auf und verwenden Sie die ungefärbten und nicht lebensfähigen/toten Zellproben, um die lebensfähigen (CFDA-positiven) von den nicht lebensfähigen (CFDA-negativen) Populationen zu unterscheiden.
- Berechnen Sie die Konzentration lebensfähiger Bakterien wie folgt:
Konzentration lebensfähiger Bakterien (Zellen/ml) = durchschnittliche Anzahl von CFDA-positiven Ereignissen in der gewonnenen Probe / aufgenommenes Probenvolumen (in mL)
HINWEIS: Je nach Zytometermodell kann die Zellquantifizierung die Verwendung von Durchflusszytometrie-Zählbeads erfordern.
3. Inkubation der Eier
- Lassen Sie die befruchteten Eier nach Erhalt durch den Lieferanten bis zum nächsten Tag bei Raumtemperatur lagern.
- Füllen Sie in der Zwischenzeit den Wasserbehälter des Eierbrutkastens mit entionisiertem Wasser und schalten Sie das Gerät ein. Stellen Sie die Temperatur auf 37.7 °C und die maximale relative Luftfeuchtigkeit auf 47 % ein.
HINWEIS: In unseren Händen werden die Eizellen bei einer relativen Luftfeuchtigkeit von 38%-42% inkubiert, ohne sichtbare Auswirkungen auf die erwartete Embryogeneserate und den Erfolg. - Übertragen Sie die Eizellen in den Inkubator, um die Embryogenese einzuleiten. Positionieren Sie sie mit der Lufttasche nach oben (d. h. mit dem spitzen Ende nach unten) auf die Inkubatorschale(n).
- Die Eier 6 Tage lang ausbrüten. Nach 4 Tagen sind lebende embryonierte Eizellen von toten oder nicht embryonierten Eizellen durch Durchleuchten zu unterscheiden.
- Legen Sie das Ei unter/über eine starke Lichtquelle (Kerzenleuchter), um den Innenraum zu beleuchten und seinen Inhalt visuell zu erkennen. Nach 3 oder 4 Tagen Inkubation zeigen lebende embryonierte Eier ein Netzwerk von Blutgefäßen, die sich von der Lufttasche nach unten ausdehnen. Dieses Netzwerk erscheint in toten embryonierten Eiern kollabiert und unorganisiert und fehlt vollständig in Eiern, die die Embryogenese nicht gestartet haben. Wenn ein lebender Embryo sichtbar ist, kann er sogar zuckende Bewegungen zeigen (Abbildung 1).
4. Vorbereitung der Eier für die Inokulation
- Am Tag der Inokulation werden die Eizellen mit Kerzen bestückt, um die verfügbare Anzahl lebensfähiger embryonierter und nicht embryonierter Eizellen zu bestimmen. Identifizieren Sie die nicht embryonierten Eizellen (etwa 10 % bis 20 % der Gesamtanzahl) und alle Eizellen mit toten Embryonen, wie in Schritt 3.4 beschrieben. Letztere sind gemäß den institutionellen Richtlinien für die biologische Abfallentsorgung zu entsorgen.
- Markieren Sie die Injektionsstelle auf der Eierschale 2-5 mm über dem Rand der Lufttasche (Abbildung 2A). Desinfizieren Sie diesen Bereich, indem Sie ihn mit Seidenpapier abreiben, das mit 70 % (v/v) Ethanol getränkt ist.
- Machen Sie mit einer 18G-Nadel vorsichtig eine Einstichdelle in die Schale an der Injektionsstelle, ohne die Schalenmembran zu durchstechen (Abbildung 2B). Desinfizieren Sie die Injektionsstelle mit einem Seidenpapier, das mit 70 % (v/v) Ethanol getränkt ist.
5. Inokulation der Eizellen
- Stecken Sie eine 25G-Nadel (0,5 mm x 16 mm) in eine 1-ml-Spritze und füllen Sie sie mit VBNC-Bakteriensuspension. Entfernen Sie bei Bedarf Luftblasen, die an der Innenwand der Spritze haften, indem Sie mit einem Finger darauf schnippen.
- Die Inokulation mit Mineralwasser allein oder einer Suspension von L. monocytogenes (5 x 103 KBE/ml), das über Nacht in BHI-Bouillon gezüchtet wurde, wird als Kontrollbedingung für die Sterilität bzw. das Wachstum von kultivierbaren Bakterien durchgeführt.
- Führen Sie die Nadel an der Injektionsstelle durch die durchstochene Schale ein und führen Sie sie in einem senkrechten Winkel vollständig ein, bis die Basis der Nadel die Schalenoberfläche berührt (Abbildung 2C). Dadurch wird die Nadelspitze so positioniert, dass der Spritzeninhalt in die Allantoishöhle (bei embryonierten Eiern) oder in das Eiweiß (bei nicht embryonierten Eiern) abgegeben wird.
- Injizieren Sie vorsichtig und langsam 100 μl des Inokulums. Halten Sie den Winkel der Nadel so ruhig wie möglich, wenn Sie sich in einer embryonierten Eizelle befinden, um tödliche Verletzungen des Embryos zu vermeiden.
- Entfernen Sie vorsichtig und langsam die Nadel und decken Sie die Injektionsstelle mit einem runden Aufkleber ab, um die Impfeingangsstelle zu versiegeln. Verwenden Sie aus Gründen der Bequemlichkeit und Übersichtlichkeit Aufkleber mit einer anderen Farbe für jede Bedingung/Gruppe von Eiern.
- Legen Sie die geimpften Eizellen für weitere 2 Tage in den Brutschrank. Stellen Sie sicher, dass die Eizellen mit sich entwickelnden Embryonen den Inkubator nicht länger als 30 Minuten verlassen (oder bei einer Temperatur unter 37,7 °C). Führen Sie die Inokulation bei Bedarf in Chargen durch.
6. Beurteilung des Vorhandenseins von kultivierbaren Zellen in den Inokulationsproben
- Geben Sie 100 μl VBNC-Bakteriensuspension in mehrere Vertiefungen einer 96-Well-Mikroplatte. Berechnen Sie die Anzahl der Vertiefungen ≥ 2 x die Anzahl der geimpften (embryonierten + nicht embryonierten) Eizellen.
- Wenn die in Schritt 5.2 genannten Kontrollbedingungen angewendet werden, geben Sie 100 μl jedes Inokulums (d. h. Mineralwasser oder kultivierbare Bakterien) in mindestens drei Vertiefungen in derselben 96-Well-Mikroplatte ab.
- Geben Sie mit einer Mehrkanalpipette 100 μl BHI-Medium in jede der Vertiefungen, die in den beiden vorangegangenen Schritten vorbereitet wurden.
- Inkubieren Sie die Platte bei 37 °C unter statischen Bedingungen, um das Bakterienwachstum in Vertiefungen mit kultivierbaren Bakterien zu fördern. Abhängig vom Vorhandensein kultivierbarer Bakterien und ihrer Nachwuchsrate unter diesen Bedingungen können ein oder mehrere Inkubationstage erforderlich sein, um Vertiefungen mit kultivierbaren Bakterien vollständig freizulegen.
- Überprüfen und zählen Sie für jedes Inokulum die Anzahl der Vertiefungen, die positiv und negativ für das Bakterienwachstum bewertet wurden.
7. Überwachung der Lebensfähigkeit der Embryonen
- Am Tag nach der Inokulation die embryonierten Eizellen mit Kerzen beleuchten, um die Letalität des Embryos zu überprüfen.
- Legen Sie Eier mit toten Embryonen beiseite und entsorgen Sie sie gemäß den institutionellen Richtlinien für die Entsorgung infizierter biologischer Abfälle.
8. Verarbeitung embryonierter Eizellen
- Entnehmen Sie die embryonierten Eizellen aus dem Inkubator und der Kerze, um die Letalität des Embryos zu überprüfen. Entsorgen Sie tote Embryonen und berücksichtigen Sie sie nicht in den Endergebnissen.
- Entfernen Sie den Aufkleber vom Ei und desinfizieren Sie das obere Ende der Schale (das die Lufttasche abdeckt) mit Seidenpapier, das mit 70 % (v/v) Ethanol getränkt ist.
- Schneiden Sie mit einer sauberen Präparierschere die Schale von der Injektionsstelle auf, um die Lufteinschlüsse freizulegen. Reißen Sie mit einer sauberen Pinzette die innere Schalenmembran auf, die die Lufttasche vom Rest des Eies trennt.
- Leeren Sie den Eiinhalt vorsichtig in eine sterile Petrischale. Isolieren Sie den Embryo mit einer Pinzette und übertragen Sie ihn in eine neue Petrischale. Waschen Sie den Embryo bei Bedarf mit sterilem PBS.
- Übertragen Sie den Embryo in ein 15-ml-Zentrifugenröhrchen, das 4 ml steriles PBS enthält. Dissoziieren Sie den Embryo mit einem Homogenisator (Drehzahl: 10.000 U/min). Reinigen Sie die Spitze des Dispergierwerkzeugs zwischen jeder Homogenisierung, indem Sie es nacheinander in steriles PBS, 70 % (v/v) Ethanol und erneut steriles PBS geben.
- Platte 500 μl des Embryos homogenisieren auf BHI-Agar. Inkubieren Sie die Platten über Nacht bei 37 °C (oder länger, falls erforderlich).
HINWEIS: Optional können serielle Verdünnungen des Homogenats plattiert werden, falls erhöhte KBE-Zahlen (z. B. > 300) im unverdünnten Homogenat erwartet werden. - Für jede Inokulationsgruppe ist die Anzahl der Eizellen zu zählen, die auf den Agarplatten positiv und negativ auf das Wachstum von L. monocytogenes getestet wurden.
HINWEIS: Trotz der aseptischen Bedingungen, unter denen die Embryonenextraktion und -homogenisierung durchgeführt werden, birgt die Verwendung eines nicht-selektiven Agarmediums für die Beschichtung von Embryo-Homogenaten das Risiko des Schadstoffwachstums. Durch die Verwendung eines gattungs-/artspezifischen Nährmediums oder die Supplementierung mit einem selektiven Antibiotikum (gegen das nur der getestete Bakterienstamm resistent ist) kann eine solche Kontamination reduziert oder verhindert werden.
9. Verarbeitung von nicht embryonierten Eizellen
- Entnehmen Sie die nicht embryonierten Eizellen aus dem Inkubator. Wiederholen Sie die Schritte 8.2 und 8.3, um Zugang zum Eialbumin zu erhalten.
- Mit einer Mikropipette 500 μl Eiweiß auffangen und direkt auf BHI-Agar verteilen. Inkubieren Sie die Platten bei 37 °C über Nacht oder länger, falls erforderlich.
- Zählen Sie für jede Inokulationsgruppe die Anzahl der Eizellen, die auf den Agarplatten positiv auf das Wachstum von L. monocytogenes hinweisen.
Ergebnisse
Um das Potenzial des Hühnerembryo-Modells zur Wiederbelebung von Zellwand-defizienten VBNC-Formen von L. monocytogenes , die durch Hunger in Mineralwasser erzeugt wurden, zu testen, war es wichtig, den Zeitpunkt der Präparation des VBNC-Bakterieninokulums (≥ 28 Tage) mit dem der embryonierten Eier (6 Tage) zu vereinbaren. Replizierte Suspensionen von L. monocytogenes wurden daher in einer Konzentration von 1 x 106 KBE/ml in Mineralwasser 28 Tage vor dem geplanten Tag der Eizellinokulation angelegt. Es wurde gezeigt, dass diese bakterielle Ausgangskonzentration nach 28 Tagen zu einer gewünschten Restkultivierbarkeit von <1 KBE/ml führte31. Eine abschließende Überprüfung der Kultivierbarkeit und Lebensfähigkeit der Suspensionen führte zur Auswahl eines VBNC L. monocytogenes-Inokulums , das 1 x 10,6 lebensfähige Zellen und 0,5 kultivierbare Zellen pro ml enthält. Für Experimente wurden 100 μl dieses Inokulums (d. h. 1 x 105 lebensfähige Zellen und < 0,1 KBE) in Gruppen von embryonierten und nicht embryonierten Eizellen verabreicht. Die Kontrollgruppen wurden parallel vorbereitet, indem embryonierte und nicht embryonierte Eier mit der gleichen Dosis Mineralwasser oder einer 5 x 103 KBE/ml-Suspension von L. monocytogenes , die über Nacht in BHI-Brühe gezüchtet wurde, injiziert wurden.
2 Tage nach der Inokulation wurden die Eizellen verarbeitet, um das Vorhandensein von kultivierbarem L. monocytogenes zu beurteilen. Wie erwartet wurde kein Bakterienwachstum aus den Eiern der Sterilitätskontrollgruppe, die mit Mineralwasser injiziert wurden, festgestellt, während 100 % der Eier der Kontrollgruppe, die mit kultivierbarem L. monocytogenes behandelt wurden, positiv für das Wachstum auf Agarmedien abschnitten (Tabelle 1). Wichtig ist, dass alle Embryonen, die aus mit VBNC-Bakterien geimpften Eizellen gewonnen wurden, zu einem Wachstum von L. monocytogenes auf der Platte führten, im Gegensatz zu dessen völligem Fehlen auf jeder Platte, die mit dem Inhalt einer nicht embryonierten Eizelle gestreut wurde, die mit denselben VBNC-Bakterien injiziert wurde (Tabelle 1). Dieses Ergebnis unterstreicht die Notwendigkeit des Hühnerembryos für den Erwachprozess von VBNC L. monocytogenes, wie bereits berichtetwurde 30.
Um die Wahrscheinlichkeit zu bestimmen, dass das Wachstum von L. monocytogenes , das aus embryonierten Eiern gewonnen wurde, die mit VBNC-Bakterien injiziert wurden, aus einer echten VBNC-Zellgewinnung und nicht aus dem Nachwachsen verbleibender kultivierbarer Zellen stammt, ist es notwendig, die Häufigkeit von Inokulumdosen, die Bakterienwachstum vor und nach der Eipassage hervorrufen, zu vergleichen. Um Ersteres zu erhalten, wurden mehrere 100-μl-Dosen des VBNC-Bakterieninokulums mit BHI, einem nährstoffreichen Medium, das VBNC L. monocytogenes revival 32 nicht unterstützt, in einer 96-Well-Platte gemischt und bei 37 °C inkubiert. Eine Häufigkeit von 9,5 % der geimpften BHI-Wells, die positiv für das Bakterienwachstum waren (8 von 84), unterschied sich signifikant (exakter Fisher-Test, p = 1,6 × 10-17) von der 100%-Häufigkeit von Eiern, die wiedergefundene kultivierbare Bakterien zeigten (Tabelle 1). Dieser signifikante und statistisch signifikante Unterschied deutet stark darauf hin, dass das Wachstum von L. monocytogenes aus embryonierten Eiern weitgehend auf die Reaktivierung von VBNC-Bakterien zurückzuführen war. Darüber hinaus war VBNC L. monocytogenes im Gegensatz zu seinen vegetativen Formen nicht in der Lage, sich in nicht embryonierten Eiern wiederzubeleben, was dafür spricht, dass die Wiederbelebung der VBNC-Zellen in embryonierten Eiern nicht auf die verbleibenden kultivierbaren Bakterien im Inokulum zurückzuführen ist.
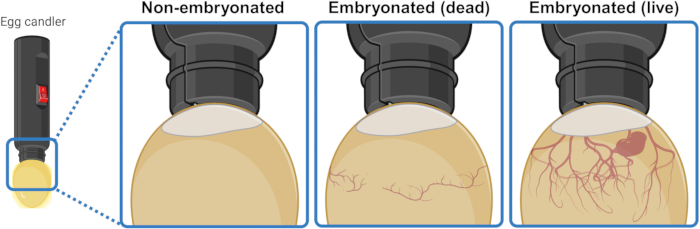
Abbildung 1: Unterscheidung von nicht embryonierten, toten embryonierten und lebenden embryonierten Hühnereiern durch Durchleuchtung. Der Embryogenesestatus wird bestimmt, indem die Eizelle mit einer Lichtquelle (Egg Candler) aus nächster Nähe beleuchtet wird. Eizellen, die einen sich entwickelnden lebenden Embryo (sichtbar oder nicht) enthalten, weisen ein starkes Netzwerk von Blutgefäßen auf, das sich von der Lufttasche nach unten ausdehnt. Dieses Netzwerk erscheint kollabiert und unorganisiert in Eiern mit toten Embryonen und fehlt vollständig in Eiern, die die Embryogenese nicht gestartet haben. Erstellt im BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Vorbereitung des Eies für die Inokulation. (A) Die Injektionsstelle ist an einer Position 2-5 mm über dem Rand der Lufteinlage markiert, die durch Durchleuchtung sichtbar ist. (B) Die Schale an der Injektionsstelle wird mit Hilfe der Spitze einer 18G-Nadel durchbohrt, ohne die äußere Schalenmembran zu durchstechen. (C) Das Inokulum wird durch eine 25G-Nadel (0,5 mm x 16 mm) in die Allantoisflüssigkeit in embryonierten Eiern oder in das Eiweiß in nicht embryonierten Eiern eingeführt. Erstellt im BioRender.com. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Inoculum | Kultivierbarkeit vor der Eipassagea | Kultivierbarkeit nach der Eipassageb | |||
| Embryonierte Eizellen | p-WertC | Nicht embryonierte Eizellen | p-Wertd | ||
| Mineralwasser | 0/3 (0%) | 0/10 (0%) | 0,999 > | 0/10 (0%) | 0,999 > |
| VBNC Lm | 8/84 (9.52%) | 24/24 (100%) | 1.63E-17 | 0/18 (0%) | 0.344 |
| Kultivierbar Lm | 3/3 (100%) | 8/8 (100%) | 0,999 > | 2/2 (100%) | 0,999 > |
| einAnzahl der BHI-Vertiefungen mit Bakterienwachstum/Anzahl der beimpften BHI-Vertiefungen. | |||||
| bAnzahl der Eier mit Bakterienwachstum/Anzahl der geimpften Eier. | |||||
| CVergleich der Kultivierbarkeit vor und nach der Passage in embryonierten Eiern (zweiseitiger exakter Fisher-Test). | |||||
| dVergleich der Kultivierbarkeit vor und nach der Passage in nicht embryonierten Eiern (zweiseitiger exakter Fisher-Test). | |||||
Tabelle 1: VBNC L. monocytogenes kehrt nach der Passage in embryonierten Hühnereiern in einen kultivierbaren Zustand zurück. Embryonisierte und nicht embryonierte Hühnereier (6 Tage) wurden nur mit 100 μl Mineralwasser oder mit Mineralwassersuspensionen von VBNC (1 x 104 Zellen, 28 Tage) oder kultivierbaren (500 Zellen) L. monocytogenes geimpft. Nach 2 Tagen wurden Embryonen (oder Eiweiß in nicht embryonierten Eiern) gewonnen und auf BHI-Agar plattiert, um das Vorhandensein von kultivierbarem L. monocytogenes zu beurteilen. Die Häufigkeit kultivierbarer Zellen, die vor der Eipassage in einer Inokulationsdosis vorhanden waren, wurde bestimmt, indem 100 μl jeder Suspension mit BHI-Bouillon in mehreren Vertiefungen einer 96-Well-Mikroplatte gemischt und die Anzahl der Vertiefungen mit Bakterienwachstum nach der Inkubation bei 37 °C bewertet wurde. Die statistische Signifikanz wurde unter Verwendung eines zweiseitigen exakten Fisher-Tests berechnet, wobei p-Werte ≥ 0,05 als nicht signifikant angesehen wurden. Diese Tabelle wurde von31.
Diskussion
Die Risiken für die öffentliche Gesundheit und die Wirtschaft, die mit lebensfähigen, aber nicht kultivierbaren (VBNC) Formen bakterieller Krankheitserreger verbunden sind, sind eine Folge ihrer Fähigkeit, sich der Erkennung durch herkömmliche auf mikrobiellem Wachstum basierende Methoden zu entziehen, sowie ihrer Toleranz/Unempfindlichkeit gegenüber den meisten antimikrobiellen Wirkstoffen, die in der klinischen Industrie und in der Lebensmittelindustrie verwendet werden26,33. Es ist daher dringend erforderlich, Forschungsinstrumente und -modelle zu finden, um die Mechanismen besser zu verstehen, die den Übergang, die Erhaltung und die Wiederbelebung von Bakterienzellen in einem VBNC-Zustand antreiben.
Der Hühnerembryo ist in vielerlei Hinsicht eine vorteilhafte Alternative zu herkömmlichen Säugetiermodellen (z.B. Maus, Ratte, Kaninchen). Technisch ist es praktischer, mit einem oviparen Organismus zu arbeiten, da seine Embryonalentwicklung schnell ist und extern und unabhängig von seinem Vorläufer erfolgt. Wichtig ist, dass der finanzielle und logistische Aufwand, der mit der Produktion, Unterbringung und Pflege von Hühnereiern und Embryonen verbunden ist, deutlich geringer ist. Darüber hinaus ermöglicht die Leichtigkeit, große Zahlen zu erhalten, das parallele Testen mehrerer experimenteller Bedingungen und/oder Replikationen und die Generierung umfassender und statistisch robuster Daten. Obwohl Nicht-Säugetiermodelle wie Fische oder Nematoden ähnliche Vorteile bieten können, ist der Hühnerembryo als warmblütiges Wirbeltier evolutionär dem Menschen evolutionär näher und damit ein besseres Forschungsmodell in Bereichen wie Immunologie, Krankheitsmodellierung, Entwicklung und Toxikologie. Auch aus ethischer Sicht ist es einfacher, mit embryonalen Modellen zu arbeiten, insbesondere in den ersten zwei Dritteln der Entwicklung, wenn noch kein ausgereiftes nozizeptives System etabliert ist8. Dieses kurze Zeitfenster ist praktisch für Anwendungen, die schnelle Durchlaufzeiten erfordern (z. B. Arzneimitteltests1), kann aber Einschränkungen für Assays mit sich bringen, die bis in spätere Embryogenesestadien oder sogar nach dem Schlüpfen (z. B. Entwicklungs- und Verhaltensstudien) andauern. Das Fehlen eines adaptiven Immunsystems macht den Hühnerembryo auch zu einem nützlichen Forschungsinstrument in Bereichen wie Wirt-Erreger-Interaktionen und Krebsbiologie7.
Der Hühnerembryo wurde ausgiebig bei der Untersuchung der mikrobiellen Virulenzverwendet 9,10,11,12,13,14,15,16,17,18, jedoch nur selten als Modell zur Wiederbelebung von VBNC-Erregern 27,28,29,30. In dieser Arbeit haben wir eine detaillierte methodische Beschreibung gegeben, wie dieses in vivo System erfolgreich für die Rettung von VBNC L. monocytogenes eingesetzt werden kann.
Ein kritischer Punkt, der bei dieser Methode zu berücksichtigen ist, ist die Frage des Restvorhandenseins kultivierbarer Zellen und ihres Potenzials, eine echte Wiederbelebung von VBNC-Zellen zu überwältigen. Die Einschränkungen der VBNC-Zellproduktionsmethode, um dieses Problem anzugehen (der Reinheitsgrad der VBNC-Zellen ist an die anfängliche Bakterienkonzentration gekoppelt), erhöhen die Notwendigkeit, alternative Ansätze zu verwenden, um kontaminierende kultivierbare Zellen ganz zu eliminieren oder auf ein vernachlässigbares Niveau zu reduzieren. Zu diesen Ansätzen kann z. B. die Neutralisierung/Abtötung durch antimikrobielle Wirkstoffe gehören, die ausschließlich auf kultivierbare Zellen abzielen. Alternativ kann die physikalische Entfernung der kultivierbaren Zellpopulation auf der Grundlage einzigartiger morphophysiologischer Merkmale (z. B. Zellform, Oberflächen- oder zytoplasmatische Strukturen oder Moleküle) durch Durchflusszytometrie erreicht werden. Dieser Ansatz hat den zusätzlichen Vorteil, dass er die Isolierung/Reinigung von VBNC-Zellsubpopulationen unterschiedlichen Alters (d.h. zu unterschiedlichen Zeitpunkten gebildet) ermöglicht, die auch in Ovo auf ihre Wiederbelebungsfähigkeit getestet werden können.
Weitere Punkte dieser Methode, die Aufmerksamkeit erfordern, sind der sorgfältige Umgang mit embryonierten Eizellen, insbesondere während und unmittelbar nach dem Injektionsschritt (um ein unbeabsichtigtes nadelassoziiertes Trauma oder Letalität zu vermeiden), und das Bestreben, die Manipulationszeit außerhalb der optimalen Inkubationstemperatur zu verkürzen. Darüber hinaus kann es trotz der aseptischen Bedingungen, unter denen die Entnahme, Verarbeitung und Beschichtung von Embryonen durchgeführt werden sollte, immer noch zu unerwünschtem mikrobiellem Wachstum auf Agarplatten kommen. Dies kann durch die Verwendung von Agarmedien mit einer für die interessierende Bakterienspezies selektiven Formulierung (basale Zusammensetzung und/oder Zusätze) oder durch die Verwendung eines Stammes gelöst werden, der eine Resistenz gegen ein bestimmtes Antibiotikum besitzt.
Diese Arbeit zeigt den Hühnerembryo als einfaches, aber leistungsstarkes und kostengünstiges in vivo Modell, um die mechanistischen Aspekte der bakteriellen Ruhephase zu untersuchen. In diesem Zusammenhang kann es möglicherweise verwendet werden, um bakterielle Faktoren zu identifizieren, die am VBNC-Zustandserweckungsprozess beteiligt sind, durch das Screening einzelner bakterieller Mutanten oder auf einer genomweiten Skala durch die Verwendung einer gemischten Bibliothek (z. B. Transposon-Mutantenbibliothek).
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Arbeit wurde durch ein Stipendium des Micalis Institute (AAP Micalis FAMe 2023) unterstützt. F.C. wurde durch ein Postdoc-Stipendium der Agence Nationale de Recherche (THOR: ANR-20-CE15-0008; PERMALI: ANR-20-CE35-0001).
Materialien
| Name | Company | Catalog Number | Comments |
| 5(6)-carboxyfluorescein diacetate (CFDA) | Sigma-Aldrich | 21879 | Prepare stock solution at 30 mM in DMSO. Aliquot and store at −20 °C. |
| Benchtop centrifuge, 24 tubes 1.5–2 mL | Eppendorf | ||
| Biosafety cabinet, class II | |||
| Brain heart infusion (BHI) agar | BD | 248130 | |
| Brain heart infusion (BHI) broth | BD | 237500 | |
| Cell culture flasks, 25 cm2 (T25), vented cap | |||
| Centrifuge tubes, 15 mL | Sarstedt | ||
| Deionised water | To fill water reservoir of egg incubator | ||
| Dissection scissors, pointed ends | |||
| Dissection tweezers, curved + serrated ends | |||
| Egg candler | FIEM (Guanzate, IT) | IM35 | |
| Egg incubator (MG 244 Mercurius SH) | FIEM (Guanzate, IT) | SH244AD | Capacity for 144 chicken eggs (rocking trays) + 100 (hatching tray) |
| Eggs, fertilized | PFIE (INRAE Val-de-Loire, FR) | From white Leghorn chickens, raised in specific pathogen-free conditions | |
| Ethyl alcohol, 70% (v/v) | |||
| Flow cytometer (CytoFLEX S) | Beckman Coulter | V0-B2-Y4-R0 | |
| Heating block (95 °C) | |||
| Incubator (37 °C) | For growth of bacteria on agar plates | ||
| Incubator w/ shaking (37 °C, 200 rpm) | INFORS-HT | For growth of liquid bacterial cultures | |
| Inoculation loops | |||
| Microcentrifuge tubes, 1.5 mL | Eppendorf | ||
| Microtiter plates w/ lid, 96-well, transparent | Greiner | To prepare serial dilutions and analyze samples in flow cytometer | |
| Mineral water | Autoclaved (121 °C, 20 min) and sterile-filtered (0.2 µm) | ||
| Needle, hypodermic, 18G | Terumo | AN1838R1 | Dimensions: 1.2 × 38 mm |
| Needle, hypodermic, 25G | Terumo | AN2516R1 | Dimensions: 0.5 × 16 mm |
| Petri dishes, 10 cm ø | Greiner | For preparation of BHI agar plates and processing of chicken embryos | |
| Phosphate buffered saline (PBS), 1X | Gibco | 14190 | |
| Plate spreaders | |||
| Serological pipettes, disposable, 5 + 10 + 25 mL | |||
| Spectrophotometer (UV-Vis) + cuvettes 1 mL | |||
| Stickers, round, colored (Tough-Spots) | Dutscher | Dimensions: 9.5 mm ø | |
| Syringe, Luer slip, 1 mL | Terumo | ||
| Tissue homogenizer | IKA | ULTRA-TURRAX T25 disperser + S25N 8G dispersion tool | |
| Vacuum pump |
Referenzen
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten