Method Article
老化中の C.エレガンス におけるミトコンドリア形態のイメージングと定量化
要約
このプロトコルは、老化中の C.エレガンスの 複数の組織におけるミトコンドリア形態をイメージングするための標準化されたアプローチを提供します。
要約
ミトコンドリアは、ほとんどの真核細胞に見られる重要な細胞小器官であり、好気性呼吸によるエネルギー生産の主要な部位です。この「細胞の原動力」としてよく知られている役割以外にも、ミトコンドリアは、細胞代謝の調節、増殖、免疫シグナル伝達、ホルモンシグナル伝達など、他の多くの重要な細胞プロセスにも関与しています。加齢時やミトコンドリアストレス下でのミトコンドリア機能の低下は、多くの場合、ミトコンドリアの形態と体積の明確な変化によって特徴付けられます。線虫 C.エレガンスは 、その透明な体と短い寿命により、生涯を通じて生きた顕微鏡観察を容易にするため、これらの変化を研究するための理想的なモデルです。しかし、 C.エレガンス の分野でも、ミトコンドリアイメージングのための多数のトランスジェニックコンストラクトと方法が利用可能であり、それぞれに独自の制限があります。ここでは、 C.エレガンスのミトコンドリア形態をイメージングするための堅牢で信頼性の高い方法として、シングルコピーのマトリックス局在化GFPコンストラクトが提示されています。この研究では、老化プロセス中にミトコンドリアイメージングを実行する際に、エラーを最小限に抑え、反復間および研究間のばらつきを減らすために、実験的に制御可能な要因に特に焦点を当てています。さらに、mitoMAPRは、老化中の組織タイプ間のミトコンドリア形態の変化を定量化するための堅牢な方法として推奨されています。
概要
ミトコンドリアは、二重のリン脂質膜で囲まれた細胞小器官であり、代謝とエネルギー生産の重要な部位として、細胞の生体エネルギーの維持に重要な役割を果たしています1。多数のミトコンドリアは、細胞の要求を満たすためにATPの形でエネルギーを連続的に生成します2。これらの重要な役割に加えて、ミトコンドリアは、シグナル伝達、オートファジー、自然免疫、細胞周期、細胞死経路などの複雑な細胞プロセスにも関与しています2,3。ミトコンドリアは、さまざまなエネルギー要件とミトコンドリアの健康に応じて、小さな個々の細胞小器官から広範な相互接続された管状ネットワークまで、さまざまな形態を示します4。
ミトコンドリアの主な特徴は、そのダイナミックな性質であり、それにより、ミトコンドリアは、密接に調整された連続的な分裂および融合イベント4を通じて、これらのさまざまな形態を交互に行うことができます。これらの相反するプロセス間の正確なバランスは、ミトコンドリアの形態、数、サイズ、および細胞質内の位置を調節します5。また、これらの融合・分裂過程は、ミトコンドリア5の品質管理を維持するために重要です。例えば、ミトコンドリア分裂は、マイトファジーによる損傷ミトコンドリアの除去や、オートファジーによるミトコンドリアの選択的除去に不可欠な要素です2。ミトコンドリアの動態は、細胞分裂、発生、さまざまなストレッサーに対する抵抗性、および細胞代謝の維持にも重要な役割を果たします6。
ミトコンドリアの動態の乱れは、神経変性疾患、代謝性疾患、心血管疾患、癌など、多くの疾患に関与しています4。さらに、老化はミトコンドリアの劇的なリモデリングと関連しており、これは主にこれらの融合-分裂ダイナミクスの変化によるものです7。したがって、さまざまなストレスや疾患条件下で、また老化プロセス全体を通じてミトコンドリアの形態の変化を視覚化し、モニタリングすることで、細胞機能、疾患メカニズム、および潜在的な治療戦略を理解するための貴重な洞察が得られます。
多くの分子経路と同様に、ミトコンドリアの動態と機能も、線虫Caenorhabditis elegansなどのモデル生物を含む真核生物全体で高度に保存されています。C.エレガンスにおけるミトコンドリア融合は、ヒト細胞と同様に、外ミトコンドリア膜(OMM)と内ミトコンドリア膜(IMM)の融合をそれぞれ制御するFZO-1(哺乳類Mfn1/2のオルソログ)やEAT-3(哺乳類のOpa1のオルソログ)などのダイナミン関連グアニントリホスファターゼ(GTPase)タンパク質の機能によって達成されます8.ミトコンドリア分裂は、ダイナミン関連タンパク質(DRP-1、ヒトDrp1のオルソログ)によって制御されており、ミトコンドリア外膜の周囲にリング状の複合体を形成してミトコンドリア分裂を促進し、ミトコンドリア膜を収縮させ、最終的には分離します9。ミトコンドリア融合は、ミトコンドリアDNA、タンパク質、脂質などのミトコンドリア内容物の混合を可能にし、部分的に損傷したミトコンドリアを健康なミトコンドリアの内容物で補完することにより、ミトコンドリアの品質管理において極めて重要な役割を果たします9。一方、ミトコンドリア分裂はミトコンドリアの分裂を可能にし、新しいミトコンドリアを作り出し、細胞質内だけでなく細胞分裂中の娘細胞への分布も促進し、適切なミトコンドリアの遺伝と機能を確保します9。このイベントは、損傷したミトコンドリアセグメントや機能不全のミトコンドリアセグメントを分離するためにも不可欠であり、その後、マイトファジー9を介した分解の標的にすることができます。
C.エレガンスは、完全なゲノムと、遺伝子改変を容易にするCRISPR/Cas910、遺伝子の過剰発現のための多数の方法、およびRNA干渉(RNAi)11のための細菌性食品ベースの方法を含むさまざまな遺伝ツールの利用可能性により、最も強力な遺伝モデルシステムの1つと長い間考えられてきました。さらに、その透明な解剖学的構造により、生きた生物12の顕微鏡イメージングが可能になります。最後に、それらの比較的短い寿命、低い維持費、および多数の年齢適合動物を生産することの容易さは、それらを老化生物学の優れたモデルシステムにします13。これらの利点は、主要なミトコンドリア調節経路の既知の保存と相まって、C.エレガンスを老化中のミトコンドリアダイナミクスを研究するための非常に魅力的なモデルシステムとなっています。
蛍光マーカーは、ミトコンドリアを含む細胞成分を視覚化および研究するための生物学研究で広く使用されています。MitoTrackerやテトラメチルローダミンエチルエステル(TMRE)など、一般的に使用される特定の細胞透過性色素があります14。前者は、全体的に負に帯電したミトコンドリアマトリックス15を染色するために使用され、一方、後者は、その正に帯電したトリフェニルホスフォニウムイオン16を通じて相対的なミトコンドリア膜電位を評価するために使用される。トランスジェニックを必要としないという利点がある一方で、老化中に構造と透過性が変化する線虫の厚いキューティクルと、異なる組織間での色素浸潤のばらつきが、 C.エレガンス17では色素ベースのアプローチを困難にしています。さらに、ミトコンドリア形態の評価は、色素凝集17のような色素の潜在的なオフターゲット効果によって交絡する。代わりに、ミトコンドリアに局在する蛍光色素を発現する遺伝的方法が、線虫モデルで一般的に使用されています。
ここで、この研究では、細胞型特異的なプロモーターの下でミトコンドリアマトリックスに局在するGFP(以下、MLS::GFP)を発現する株に焦点を当てることに焦点を当てています。重要なことに、これらのトランスジェニック株は、既知のゲノム遺伝子座におけるレポーターの単一コピー発現を確保するために、MosSCI法を使用して作成され、他の利用可能な株の問題を回避しました。例えば、一部のミトコンドリア標的タンパク質の高コピー発現は、コピー番号が不明なランダム遺伝子座に染色体外プラスミドアレイが組み込まれるため、発現レベルのばらつきにつながります18。さらに、過剰発現したミトコンドリアタンパク質を細胞が適切に局在化することは細胞にとって高い負担であるため、ミトコンドリアに損傷を誘発することが以前に示されている19。したがって、正確で安定しており、遺伝子発現が低く、既知の遺伝子座への交配が容易であることから、これらのMosSCIトランスジェニックは好ましい方法となっています。これらの株を使用して、この研究では、線虫の筋肉、腸、および皮下組織のミトコンドリアを画像化する方法を標準化します。さらに、C.エレガンスの老化中のミトコンドリアの再現性のある実験的分析を検討し、確保するために重要な重要な技術的応用とトラブルシューティング方法に焦点を当てています。
プロトコル
本試験で使用した試薬および装置の詳細は、 材料表に記載されています。
1. C.エレガンスの成長と維持
- 線虫増殖培地(NGM)プレートの調製
- C. elegansの培養には、1 mMのCaCl2、12.93 μM(5 μg/mL)のコレステロール、25 mMのKPO4(pH 6.0)、1 mMのMgSO4、2.5 mM(0.25% w/v)のペプトン、および51.3 mMのNaClを含むNGMを含む標準的な2%寒天プレートを使用します。Castro Torres et al.20に記載されているNGMプレートの詳細な注入方法を参照してください。
注:RNA干渉(RNAi)実験では、1 L NGM寒天プレート用に1 mLの1 mLの1 M IPTGと1 mLの100 mg/mLカルベニシリンを添加します。 - NGMプレートが固まったら、室温で24〜48時間、リゾジェニーブロス(LB)でOP50の培養物を増殖させるか、LBでpL4440空のベクタープラスミドをLBに含ませたHT115の培養物を、抗生物質(アンピシリン/カルベニシリン100μg/mL+テトラサイクリン5μg/mL)と37°Cで12〜16時間振とうして増殖させます。
注:このプラスミドは、市販の供給元から入手可能です( 材料表を参照)。 - 200 μLのOP50またはHT115培養物を60 mmプレートに、または1 mLを100 mmプレートに播種します。
- プレートが濡れなくなるまでプレートを乾燥させ、プレートを4°Cの密閉容器に最大2か月間保管します。
- オプション:100 μLの10 mg/mL 5-フルオロ-2'-デオキシウリジン(FUDR)を、細菌を播種したNGM-寒天プレートに直接加えて、L4/成虫を化学的に滅菌し、若齢の寄生虫の発生を防ぎます。
注:この研究で開発および使用された株は次のとおりです。
(1) RHS191 - uthSi17[myo3p::MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] I
(2) RHS192 - uthSi83[col19p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)]I
(3) RHS193 - uthSi80[vha-6p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] IV
- C. elegansの培養には、1 mMのCaCl2、12.93 μM(5 μg/mL)のコレステロール、25 mMのKPO4(pH 6.0)、1 mMのMgSO4、2.5 mM(0.25% w/v)のペプトン、および51.3 mMのNaClを含むNGMを含む標準的な2%寒天プレートを使用します。Castro Torres et al.20に記載されているNGMプレートの詳細な注入方法を参照してください。
- 同期 C. elegans 漂白による
- 多数の線虫を必要とする大規模なアッセイでは、動物でいっぱいの60 mmのNGM寒天プレートを小さく切り取り、それらを100 mmプレートにチャンクし、細菌を播種して増殖させます。チャンキング後、20°Cで成長させると、100 mmプレートがワームでいっぱいになるまで2〜3日かかります。動物の拡大に関するより詳細な推奨事項については、Castro Torres et al.20を参照してください。
- 同期のためにワームを収集するには、5〜10 mLのM9溶液(22 mMのKH2PO4 モノ塩基性、42.3 mMのNa2HPO4、85.6 mMのNaCl、1 mMのMgSO4)をワームを入れた100 mmのNGM寒天プレートに注ぎ、M9溶液を穏やかに渦巻いて細菌の芝生からワームを緩めます。
- 血清学的ピペットで線虫を引き上げ、15mLの円錐形チューブに移します。
注:プラスチック製の血清ピペットは、線虫をプラスチックピペットの内壁にくっつける傾向があるため、ガラス製の血清ピペットをお勧めします。 - 室温で1,100 x g で30秒間遠心分離し、ワームをペレット化し、真空ポンプを使用して上清を吸引します。
- 6%次亜塩素酸ナトリウム1.5mL、5MのNaOHまたはKOH0.75mL、およびdH2Oの2.75mLを含む漂白液5mLを調製し、5mLの漂白液をワームペレットに注ぎます。
注意: 次亜塩素酸ナトリウムと水酸化物溶液は腐食性があるため、この手順では手袋と白衣を着用することをお勧めします。 - ワーム+漂白液の混合物を、動物のすべての体が完全に溶解し、卵だけが残るまで4〜6分間インキュベートします。混合物を激しく振って、溶解プロセスを助けます。
注:解剖顕微鏡で毎分ワームを確認してください。成虫の体がどれだけ溶解するかに基づいて、漂白時間を短縮または延長します。卵を漂白液の中に長期間放置すると、卵が損傷し、線虫の生存能力に影響を及ぼします。 - 卵/漂白液混合物を室温で1,100 x g で30秒間遠心分離し、卵をペレット化した後、真空ポンプを使用して上清を慎重に吸引し、卵のペレットを吸引しないようにします。
注:卵が漂白液に長時間さらされるのを防ぐために、迅速に洗浄を行うことをお勧めします。 - 卵を5〜10mLのM9溶液で4回洗います。
- 卵を少量のM9溶液に再懸濁し、最大50 μLのピペッティングで細菌を播種したNGMプレートにプレートします。3〜5 μLの卵混合物をプレートにピペッティングし、このボリュームの卵の数を数えることにより、卵の数の概算を計算します。M9を加えて、卵の混合物をこの体積の可算数の卵に希釈します。
注:プレートあたり100未満のワームをメッキすることをお勧めします。これは、プレートがメッキされた動物が多すぎると、ワームが成人期の1日目より前に飢餓状態になる可能性があるためです。動物のめっき数に関するより詳細な推奨事項については、Castro Torres et al.20を参照してください。 - あるいは、線虫をL1-arrestして、より緊密な年齢同期を実現します。L1アレスティングのためには、15mLの円錐管内の卵ペレットに適切な量のM9溶液を10〜12mLの容量に加えます。ワームをローテーターで20°Cで16〜24時間回転させます。 遠心分離機(ステップ1.2.7と同様)し、上清を吸引します。L1動物の濃度を計算し、ステップ1.2.9で卵について説明したように、それらをNGMプレートに播種します。
- C.エレガンスの個体群を希望の年齢まで老化させる:ステップ1.1.6で説明したように、L4 /成体動物を5-フルオロ-2'-デオキシウリジン(FUDR)を含むプレートに移し、子孫を防ぎ、すでに生産された子孫を排除します。FUDRなしで線虫を老化させる別の方法については、Castro Torres et al.20を参照してください。
注:最初の幼虫の段階でワームを同期させる方法として漂白を選択する前に、いくつかの重要な要素を考慮する必要があります。先に強調したように、漂白剤への過度の曝露は、胚に損傷を与え、孵化率を低下させ、漂白剤耐性株の選択圧を生み出し、集団の遺伝学を変える可能性があります。さらに、胚を長期間与えずに放置すると、栄養素の枯渇により代謝と発達が損なわれる可能性があります。したがって、卵産卵法またはNemaSync法は、漂白法の代わりとして使用できます。産卵手順の方法は、Castro Torresらによる参照研究で段階的に説明されています.20。NemaSyncは、より新しく、より高価な商用方法であり、手動のワームシンクロナイザを使用して、化学薬品21を使用せずにワームを同期させる。
2. C.エレガンスにおけるミトコンドリアのイメージング
- C.エレガンスのイメージングのためのスライドの準備
- 10〜20μLのM9溶液をスライドガラスに添加し、特定の年齢の必要な数の成虫をスライド上の溶液に移します。約 25 匹のワームが推奨されます。
注:従来の方法(テトラミソールやアジ化ナトリウムなど)を使用して線虫を麻痺させると、特定の条件下でミトコンドリアの断片化を引き起こす可能性があります(以下を参照)。代わりに、ここではHistoBondスライドを使用することをお勧めします。これは、永久的な正の表面電荷を持つ表面を備えているため、アーティファクトを導入する可能性のある薬剤を使用せずにワームの動きを減らすことができます。少量ではスライドとカバースリップの間に動物が押しつぶされる可能性があり、大量では画像取得中に動物が動くため、線虫とM9溶液の適切な比率を設定することが重要です。推奨事項は 表1に記載されています。 - あるいは、線虫を麻痺させる薬剤の使用については、ミトコンドリアの断片化を限定して使用できる範囲の濃度と時点について、この原稿の代表的な結果を参照してください。
注:健康な野生型動物では大きな断片化はありませんでしたが、特定の突然変異体または状態がこれらの薬物の同じ濃度でミトコンドリアの断片化を経験する可能性があることを覚えておくことが重要です。 - スライド上のM9溶液中のワームをカバーガラスで覆い、マニキュアを使用して側面をシールし、M9溶液の蒸発を防ぎます。
- オプション:筋肉イメージングの場合は、カバースリップをそっとつねてワームを転がします。これにより、線虫の側面にある体壁の筋肉を焦点面とよりよく位置合わせして、より高品質の画像を得ることができます。
- 10〜20μLのM9溶液をスライドガラスに添加し、特定の年齢の必要な数の成虫をスライド上の溶液に移します。約 25 匹のワームが推奨されます。
- 複合顕微鏡によるミトコンドリアのイメージング
- 筋肉および皮下ミトコンドリアには、標準的な広視野顕微鏡(myo-3p::MLS::GFP および col-19p::MLS::GFP)を使用します。
注:63x/1.4 Plan Aprochromat対物レンズ、GFPフィルター(11525314)、DFC9000 GTカメラ、LED5光源を搭載した市販のイメージャーを使用し、互換性のある顕微鏡ソフトウェアを使用しました。 - 各顕微鏡と実験セットアップのイメージング設定を最適化します。
注:ただし、出発点として、この原稿で使用されているイメージャーを使用したイメージングのパラメーターは次のとおりです:寸法は、皮下ミトコンドリアの0.50μmのステップサイズで2048(x)* 2048(y)ピクセルであり、筋肉ミトコンドリアのソフトウェアによって自動的に計算される「システム最適化」です。曝露時間は、筋肉ミトコンドリアで50ms、皮下ミトコンドリアで50msです。475 nm LEDは50%の出力に設定され、NDフィルターは筋肉用に30%、皮下ミトコンドリア用に17%に設定されました。Z範囲は、GFP信号が見える場所から始まり、終了するところまで続きます。最大投影のノイズを最小限に抑えるには、最大投影に使用される z 平面の数を減らすことができます。 - 腸内ミトコンドリア(vha-6p::MLS::GFP)のイメージングには、共焦点顕微鏡を使用します。
注:イメージングは、63x/1.4 Plan ApoChromat対物レンズ、白色光レーザー(WLL)、音響光学ビームスプリッター、HyD S検出器を備えた市販の共焦点顕微鏡で行い、顕微鏡ソフトウェアで実行しました。前述のように、個々の実験設定を最適化する必要がありますが、出発点として、この研究で使用したStellarisでのイメージングのパラメータは次のとおりです:WLLは最大出力85.00%に設定され、強度3.00%の485nmレーザーラインで設定されました。HyD S検出器は490〜590 nmに設定され、アナログ設定ではゲインが25でした。1024 (x) * 1024(y) または 82.01 μm (x) * 82.01 μm (y) の領域を 5 (z) ピクセル、ステップ サイズ 0.495 μm (寸法 z は線虫または組織のサイズによって異なる) で一方向スキャンし、スキャン速度 1,000 Hz、ズーム 2.25 ズーム、ライン平均 2、ピンホール 1 AU (95.5 μm) でスキャンしました。Z範囲は、GFP信号が見える場所から始まり、終了するところまで続きます。最大投影のノイズを最小限に抑えるには、最大投影に使用される z 平面の数を減らすことができます。
- 筋肉および皮下ミトコンドリアには、標準的な広視野顕微鏡(myo-3p::MLS::GFP および col-19p::MLS::GFP)を使用します。
- ミトコンドリア形態の定量化
注:詳細については、Schindelin et al.22 および 補足図1A-Dを参照してください。- FIJI(フィジーはImageJ、https://fiji.sc/)ソフトウェアをダウンロードしてインストールします。次に、FIJIを開きます。
- MitoMAPR マクロをダウンロードしてインストールするには、 https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033 からソース コード 1 をダウンロードします。次に、「A」に記載されているすべてのコードをコピーします。MitoMAPR-1.0のIJMコード。次に、フィジーを開き、[ プラグイン] > [新しい>マクロ] に移動し、以前にコピーしたコードをマクロ ウィンドウに貼り付けます。 [ファイル] > [名前を付けて保存 ] オプションに移動し、マクロを後で使用するために保存します。
- フィジーのZスタックで3D顕微鏡画像を開くには、ファイルをフィジーツールバーにドラッグアンドドロップするか、[ ファイルを開く]>に移動します。
- 画像の最大投影を作成するには、[ Image > Stacks] > [Z Project] に移動し、焦点が合っている画像のスライスの範囲を最大投影し、投影タイプとして [Max Intensity ] を選択します。
- [ ファイル]>[TIFFとして保存]に移動して、画像をTIFFとして保存>。
- 「長方形」ツールを使用してフル画像から関心領域(ROI)をトリミングし、ROIを描画してから、 画像>トリミングに移動します。
- [ ファイル] > [Tiff として保存] に移動して、画像を TIFF として保存>画像を保存します。
- 以前に保存したMitoMAPRマクロをFijiツールバーにドラッグアンドドロップして実行し、[ 実行]をクリックします。新しいウィンドウが表示され、2.3.6でTiffファイルが保存されたフォルダを選択するように求められます。
- 新しいウィンドウでエリアを選択するように求められます。手順2.3.4で前述したように、長方形ツールを使用して画像に長方形を作成し、[ OK]を押します。
注:手順2.3.6で説明したように以前にトリミングされた画像全体を選択できます。ミトコンドリアの形態に関連するすべての値を含む「データ」ウィンドウをExcelファイルとして保存するには 、[ファイル]>[名前を付けて保存]に移動して>保存します。
- FIJIマクロを使用したサンプルのバッチ処理
- 解析する画像の領域を指定するマクロを作成します。 フィジー を開き、[ プラグイン] > [新しい>マクロ] に移動します。次のコードをテキスト ボックスに貼り付け、2.3.2 (補足図 1E-H) の説明に従ってマクロを保存します。
注:長方形(100、100、200、200)を作成します。run (幅 = 100、高さ = 100、x = 100、y =100 スケーリング) - 開いているすべての画像をTIFFファイルとして保存するためのマクロを作成します。マクロ・ウィンドウ内で、「 ファイル」>「新規」 に移動し、以下のコードをテキスト・ボックスに貼り付けます。2.3.2 の説明に従ってマクロを保存します。
注: dir = getDirectory(" Select A folder");ids=newArray(nImages);for (i=0;i - バッチ MitoMAPR のマクロを作成します。https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033 ソースコード1に移動し、B.に記載されているすべてのコードをコピーします。MitoMAPR-1.0_BatchのIJMコード」。マクロ・ウィンドウ内で、「 ファイル」>「新規」と進み、ソース・コード 1 のコードをテキスト・ボックスに貼り付けて、ステップ 2.3.2 の説明に従ってマクロを保存します。
- 反復的なトリミングのマクロを作成します。https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033 ソースコード1に移動し、C.)IJMコードのCropR」に記載されているすべてのコードをコピーします。マクロ・ウィンドウ内で、「 ファイル」>「新規」と進み、ソース・コード 1 のコードをテキスト・ボックスに貼り付けて、ステップ 2.3.2 の説明に従ってマクロを保存します。
- バッチ処理を開始するには、まず、すべての画像を開き、手順2.4.2で保存したマクロを実行して、処理するすべての画像をTIFFとして保存します。すべての画像は、指定したフォルダにTIFFとして保存されます。保存したら、すべての画像を閉じます。
- 手順2.4.5で保存した画像が3D画像(Zスタックを含む画像)の場合は、Z投影にして2D画像に変換してください。画像をバッチZ投影するには、FIJIのメインウィンドウで[ 処理]>[バッチ>マクロ ]に移動してバッチ処理ウィンドウを開きます。
- 「入力」は、2.4.5から処理するすべての3D画像が格納されているフォルダの場所を選択します。「出力」は、処理後に画像を保存する場所を選択します。出力形式として TIFF を選択します。ウィンドウの大きなテキストボックスに次のコードを貼り付け、 処理 ボタンを押します: run("Z Project...", "projection=[Max Intensity]")。
- 手順 2.4.4 の反復切り抜きマクロと手順 2.4.3 の領域指定マクロを組み合わせて使用することにより、処理するすべての 2D 画像から同じ寸法の ROI をトリミングします。手順 2.4.4 の反復トリミング マクロを実行します。ディレクトリを求めるウィンドウが表示されます。
- 手順2.4.5の2D画像のみを含むフォルダー、または手順2.4.6の2D Z投影画像を含むフォルダーを選択し、 選択 ボタンを押します。マクロは、選択したフォルダ内の画像の1つを開き、2つのボタンを備えた「選択を行う」というラベルの付いたウィンドウが表示されます。
- 手順2.4.3から指定した選択マクロを実行します。必要に応じて、そのマクロ テキスト ボックスの幅と高さの値を変更して選択寸法を変更し、[ 実行 ] を押して新しい選択を確認します。マクロの X 値と Y 値を変更すると、選択範囲の左上隅の位置が変更されます。
- 選択寸法が満足のいくものになったら、長方形を目的の領域にドラッグし、[選択]ウィンドウの [OK ]ボタンを押します。トリミングされた領域は、手順2.4.7で選択したフォルダーに保存されます。
- マクロは、フォルダ内の残りのすべての画像を反復処理します。画像ごとに、寸法値を変更せずに手順 2.4.8 のマクロを実行して、すべての画像で同じ寸法がトリミングされるようにします。画像ごとに、選択長方形を目的の位置にドラッグし、「選択」ウィンドウの [OK ]ボタンを押します。
- 手順2.4.8〜2.4.9で切り抜いた画像を含むフォルダを開き、切り抜いたすべての画像を新しいフォルダに移動します。
- ステップ2.4.3からバッチMitoMAPRマクロを実行して、トリミングされたすべての画像を分析します。新しいウィンドウでディレクトリを選択するように求められます。手順2.4.10で切り抜いた画像がすべて含まれているフォルダを選択します。完了すると、「データ」という名前のウィンドウがポップアップし、ミトコンドリアの形態に関連するすべての値が表示されます。ステップ 2.3.9 で説明したように、すべてのデータを Excel ファイルとして保存します。
- 解析する画像の領域を指定するマクロを作成します。 フィジー を開き、[ プラグイン] > [新しい>マクロ] に移動します。次のコードをテキスト ボックスに貼り付け、2.3.2 (補足図 1E-H) の説明に従ってマクロを保存します。
結果
C.エレガンスは 、その透明なボディにより、過剰なサンプル調製なしに、ミトコンドリアの生きた動物の全粒イメージングを容易にするため、ミトコンドリアイメージングの優れたモデルです。さらに、組織特異的なプロモーターを使用してミトコンドリアを標的とする蛍光タンパク質を発現させることで、さまざまな組織のミトコンドリアの形態を簡単に視覚化できます。ここでは、 myo-3p (筋肉ミトコンドリア)、 vha-6p (腸内ミトコンドリア)、 col-19p (皮下ミトコンドリア)を利用して、ミトコンドリアを標的とするGFP(ATP-1タンパク質のミトコンドリア局在配列)の発現を促進しました。 C.エレガンスの 体壁筋のミトコンドリアは、筋線維(筋原線維)に沿って整列する管状の形態を示します(図1A)。腸のミトコンドリアは、高度に相互接続されたクモの巣状の構造を示し、均一な整列は少なかった(図1B)。また、皮下組織には、腸や筋肉に比べて丸みを帯びた、または楕円形に見える管状のミトコンドリアがあります(図1C)。ミトコンドリアの形態は、一般に、筋肉と腸の線虫の長さにわたって一貫していますが、皮下組織では、線虫の近位端と遠位端の間のミトコンドリアの相互接続性にいくつかのわずかな違いが見られます。したがって、再現性のある実験結果を得るためには、彼らの体の特定の領域に焦点を当てることをお勧めします。ここでは、咽頭と外陰部の間の領域、咽頭の下100~200μmの領域が一貫して画像化されています。
筋肉および皮下ミトコンドリアの場合、複合顕微鏡でイメージングすると、細胞の平坦性と焦点の合っていない光のレベルが低いため、十分な解像度が得られます。しかし、腸内のミトコンドリアは、腸の他の部分からのボケ光が多量に当たるため、腸の体積が大きいため分解能が制限されるため、複合顕微鏡で観察することは困難です(図2)。したがって、共焦点顕微鏡で腸のミトコンドリアを画像化して、焦点の合っていない光を減らし、適切なミトコンドリアの形態を視覚化することをお勧めします。
ミトコンドリアの形状は非常に動的であり、動物の代謝環境23 に基づいて、あるいは変動する基質の硬さ24への曝露によってさえ変化する。したがって、動物を食物源がない状態で顕微鏡スライド上に長時間放置したり、ガラスの硬い基板に放置したりすると、ミトコンドリアの形態に影響を与える可能性があります。この研究では、線虫のミトコンドリアは、M9溶液中のスライド上で約30分後に断片化し、皮下ミトコンドリアが最も断片化を示すことがわかりました(図3)。したがって、ミトコンドリアのイメージングは、サンプル調製後速やかに行う必要があります。
C .エレガンスのライブイメージングには、アジ化ナトリウムやテトラミソールなど、線虫の移動性を制限する化学物質が一般的に使用されています。これは、静止した線虫が3Dイメージングのために動物の複数のz切片を撮影する必要があるためです。以前の研究では、アジ化ナトリウムまたはテトラミソールへの曝露がミトコンドリアの断片化を引き起こす可能性があることが示されています25。驚くべきことに、アジ化ナトリウムは、高濃度であっても、筋肉や腸のミトコンドリアの形態に限られた影響を与えることがわかりました。しかし、皮下組織では、M9コントロールよりも早いミトコンドリア断片化が示されました(図3)。重要なことに、高濃度のテトラミソール(100 mM)は、すべての細胞タイプでばく露直後に有意なミトコンドリア断片化をもたらしました。これに対し、中濃度(10 mM)では、M9コントロールと比較してフラグメンテーションが速くなりました。低濃度(1 mM)は、ミトコンドリアの形態に限定的な影響を与えました。これらのデータは、アジ化ナトリウムの利用がミトコンドリアの迅速なイメージングのための実行可能な選択肢であり得る一方で、テトラミソールは一般的に避けるべきであることを示唆しています。
予想通り、 C.エレガンス のすべての組織のミトコンドリアは、自然な老化プロセス中に断片化を示します(図4A)。断片化は、ミトコンドリアがより切り詰められた球形の構造として現れるものとして視覚化でき、これは若い動物に見られる線形の管状のミトコンドリアとは劇的に異なります。腸は後年で球状の自己蛍光構造が増加するため、自家蛍光と実際のミトコンドリア構造を混同しないように注意する必要があることに注意することが重要です。ミトコンドリア構造の変化には線虫間でばらつきがある可能性があるため、数本の線虫をイメージングするのではなく、かなりのサンプルサイズでミトコンドリアの形態の定量化を行うことが重要です。ここでは、オブジェクト、ネットワーク、ネットワークあたりのジャンクション、ジャンクションポイント、オブジェクトの長さ、ミトコンドリアフットプリント、ミトコンドリアカバレッジ、オブジェクト面積など、さまざまな指標を使用してミトコンドリアの形態を自動的に定量化できるmitoMAPRを使用しました(補足表1 および 補足表2)。自動化により、ユーザーから主観的な偏見が取り除かれます。ここでは、老化時の筋肉や腸のミトコンドリア形態の変化を定量的に測定するには物体長メトリクスを、老化時の皮下ミトコンドリア形態の変化を測定するにはジャンクションポイントメトリクスが最適であることを報告します(図4B)。

図1: C.エレガンスの全身にわたるミトコンドリアの画像。 ミトコンドリアイメージングは、筋肉(A)、腸(B)、および皮下組織(C)でMLS::GFPが発現するトランスジェニック動物において、L1段階からEVで増殖した成体動物5日目の全長にわたって実施された。スケールバー:100μm。 この図の拡大版を表示するには、ここをクリックしてください。

図2:化合物顕微鏡と共焦点顕微鏡のミトコンドリアイメージングの比較。 ミトコンドリアイメージングは、筋肉(A)、腸(B)、および皮下組織(C)にMLS::GFPが発現するトランスジェニック動物のL1段階からEVで成長した1日目の成体動物で実施されました。スケールバー:5μm。 この図の拡大版を表示するには、ここをクリックしてください。
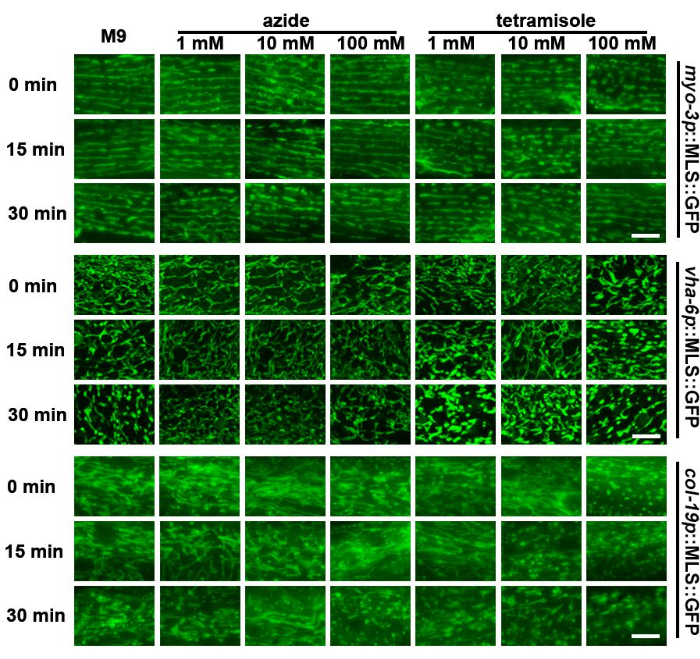
図3:M9、アジ化ナトリウム、およびテトラミソールによる処理後のさまざまな組織のミトコンドリア断片化の評価。 ミトコンドリアイメージングは、1日目の成体動物で行い、筋肉、腸、皮下組織にMLS::GFPを発現させました。動物はL1段階からEVで育てられました。M9、アジ化ナトリウム(1 mM、10 mM、100 mM)、またはテトラミソール(1 mM、10 mM、100 mM)を含むスライド上に動物を配置し、スライド調製直後(0分)またはスライド調製の15分後または30分後にイメージングを行いました。代表的な画像は、2回の生物学的複製について、系統あたりn匹>5匹の動物について示されています。スケールバー:5μm。 この図の拡大版を表示するには、ここをクリックしてください。
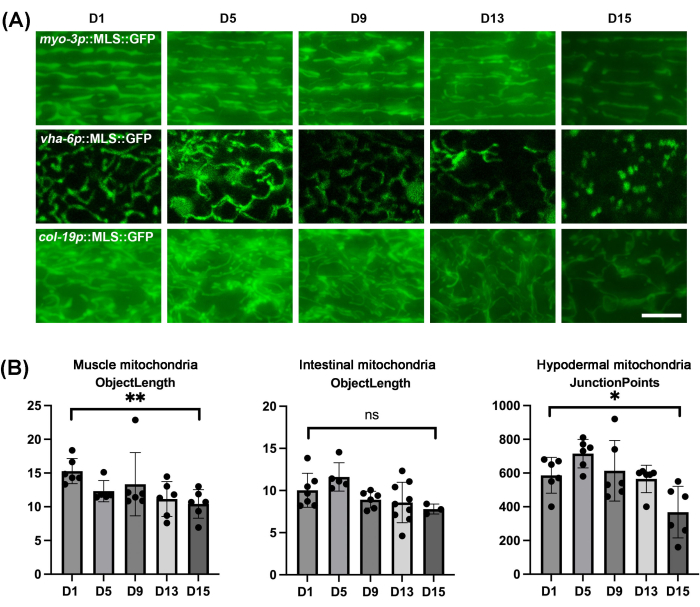
図4:さまざまな組織での老化中の C.エレガンスの ミトコンドリアイメージングとMitoMAPRを使用したミトコンドリア形態の定量化。 (A)ミトコンドリアイメージングは、成体動物の成体動物において、成人期の1、5、9、13、および15日目に行われ、筋肉、腸、および皮下組織にMLS::GFPが発現しました。動物はL1段階からEVで成長し、1日目の成体段階からFUDRを含むEVプレートに移動しました。画像は、≥ 3 回の生物学的複製について、系統あたり n ≥ 5 匹の動物を代表しています。スケールバー:5μm。(B)1日目、5日目、9日目、13日目、15日目の線虫の筋肉ミトコンドリアと腸内ミトコンドリアの物体長の定量化、および1日目、5日目、9日目、13日目、15日目の線虫の皮下ミトコンドリアの接合点の定量化。すべての個々のデータポイントと平均±SDを組み合わせたグラフをプロットし、スチューデント t検定を使用して統計的に分析しました。ns = 有意ではない, *p < 0.03;**p < 0.002;p < 0.0002;p < 0.0001 です。 この図の拡大版を表示するには、ここをクリックしてください。
| ワームの日々 | ワームの数 | 緩衝液容量(mL) |
| 1 | 25 | 13 |
| 5 | 25 | 14 |
| 9 | 20 | 15 |
| 13 | 20 | 15 |
表1:スライドを準備する際の推奨ワーム数とバッファーの量。
補足図1:MitoMAPRを使用した単一画像定量化の適用と複数の画像のバッチ処理のワークフロー。 (A)MitoMAPRマクロを用いて1枚の画像からミトコンドリアの形態を定量化するワークフロー。(B)フィジーを使用した生の3D画像ファイルのZ投影(Max投影)。(C)Z投影画像から関心領域を切り抜く。(D)MitoMAPRマクロから取得した骨格画像。スケールバー:5μm。(E) MitoMAPRマクロを用いたバッチ処理により、複数の画像からミトコンドリアの形態を定量化するワークフロー。(F)クロップマクロのスクリーンショット。(G)Z投影のバッチ処理のスクリーンショット。(H)バッチトリミングマクロの選択確認ウィンドウのスクリーンショット。 このファイルをダウンロードするには、ここをクリックしてください。
補足表1: C.エレガンス 筋肉組織におけるミトコンドリア形態指標の定量的分析。 記録されるメトリクスには、オブジェクト、ネットワーク、ネットワークあたりのジャンクション数、ジャンクションポイント、オブジェクトの長さ、ミトコンドリアフットプリント、オブジェクト面積、ミトコンドリアカバレッジなどがあり、これらは異なる日間で測定されます。データは、加齢に伴うミトコンドリアの形態の変化を評価するための基礎となります。 このファイルをダウンロードするには、ここをクリックしてください。
補足表2: C.エレガンスのミトコンドリア形態に対する固定化化学物質の影響。 データには、M9バッファーまたは異なる濃度のテトラミソールとアジ化ナトリウムを使用したサンプル調製後のさまざまな濃度と時点におけるオブジェクト、ネットワーク、ネットワークあたりのジャンクション、ジャンクションポイント、オブジェクトの長さ、ミトコンドリアフットプリント、オブジェクト面積、ミトコンドリアカバレッジなどの測定値が含まれます。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ミトコンドリアの形態の蛍光イメージングは、ミトコンドリアの変化を決定する最も一般的な方法です。透過型電子顕微鏡(TEM)、原子間力顕微鏡、クライオ電子顕微鏡などの高度な顕微鏡技術はより高い解像度を提供しますが、蛍光顕微鏡は依然として手頃な価格で、ほとんどの研究者にとって利用しやすいものです。さらに、蛍光顕微鏡法は生細胞で行うことができ、C.エレガンスのような透明なモデル生物では、動物全体でイメージングを行うことができる26,27。トランスジェニック線虫のイメージングは非常に簡単で、遺伝的にコードされた蛍光マーカーは、複雑なサンプル処理を必要とせず、MitoTrackerやTMRE 28,29,30のような従来のミトコンドリア色素からの細胞タイプや条件による染色の変動に悩まされないため、ミトコンドリアのより信頼性が高く堅牢なイメージングを可能にします.遺伝的にコードされた蛍光マーカーは、通常、ミトコンドリアタンパク質を蛍光色素で直接標識するか、最小限のミトコンドリア局在配列を持つ蛍光色素を結合させます。これらの構築物は、しばしば組織特異的なプロモーターによって駆動され、筋肉、腸、または皮下組織31のような異なる組織におけるミトコンドリアの可視化を可能にする。一般に、これらの蛍光タグ付きタンパク質は過剰発現しており、完全長のミトコンドリアタンパク質が過剰発現すると、望ましくない生理学的影響を与える可能性があります。したがって、最小限のMLSシーケンスはより良い選択肢である32。しかし、最小限のMLS蛍光タンパク質融合の過剰発現であっても、ミトコンドリアに大量のタンパク質を輸入するとミトコンドリア膜の電位が崩壊し、動物の健康に影響を与える可能性があるため、高い過剰発現は避けるべきである33。現在入手可能なすべてのC.エレガンス株の網羅的な特徴付けは、この原稿の範囲を超えていますが、多数のミトコンドリアレポーターの詳細な比較分析とそれぞれの長所と短所は、ここで見つけることができます31。
C.エレガンスのミトコンドリアの生細胞イメージングには、標準的な化合物顕微鏡または広視野顕微鏡法が、共焦点顕微鏡法よりも高速で容易であるため、好ましい選択肢となる場合があります。この研究では、筋肉や皮下組織のような平らな細胞は共焦点顕微鏡法から最小限の利益しか得られず、化合物顕微鏡法は適切なミトコンドリア形態を視覚化するのに十分な解像度で取得できることを示しています。腸のような大きな細胞は、焦点が合っていない光のために化合物顕微鏡検査を困難にします。したがって、腸のミトコンドリア形態の信頼性の高いイメージングには、共焦点顕微鏡法が必要です。
生きた動物の組織の厚さ全体にわたる3Dイメージングに関する重要な考慮事項は、画像取得中の線虫の動きを防ぐことです。研究者は、テトラミソールやアジ化ナトリウム34などの線虫を麻痺させる方法を使用することがよくあります。アジ化ナトリウムは、ミトコンドリアの電子伝達鎖における重要な酵素であるシトクロムcオキシダーゼ(複合体IV)を阻害し、筋肉の収縮や他の細胞機能に必要なATPの欠如による全身麻痺を引き起こす34,35。テトラミソールは、神経筋接合部でアセチルコリンを模倣することによって作用し、持続的な脱分極と筋肉収縮を引き起こします36。しかし、これらの薬物への曝露は、酸化ストレスを引き起こすことにより、ミトコンドリアの断片化を誘発する可能性がある23。この研究では、テトラミソールが非常に急速にミトコンドリアの断片化を誘発することがわかりましたが、アジ化ナトリウムの影響ははるかに限られていました。
C.エレガンスは、その短い寿命と動物の老化の容易さのために、老化がミトコンドリアの形態に与える影響を研究するための非常にシンプルで簡単な方法を提供します。ここでは、DNA複製を防ぐことにより動物を化学的に滅菌する堅牢な方法であるFUDRへの曝露を使用することを選択しました20,37,38。しかし、FUDRは特定の老化パラメータに望ましくない影響を与える可能性があり、FUDRのオフターゲット効果を懸念する人には、子孫を除去する他の戦略を利用することができる39。例えば、温度感受性生殖細胞変異体glp-4を含む無菌変異体、またはCF512 40,41,42のような精子欠損変異体が存在する。別の方法として、動物は毎日子孫から成虫を手動で選ぶことによって自然に老化させることもできます。
ミトコンドリアの形態の変化の定量化も非常に重要な考慮事項であり、動物間でミトコンドリアの形態に大きなばらつきがある可能性があります。したがって、十分なサンプルサイズで定量分析と統計を行うことは、ミトコンドリアの形態の変化について重要な結論を出すために不可欠です。しかし、画像解析と定量化は、主観的なバイアスや、相互接続されたミトコンドリアのような非常に複雑な構造のイメージングによる課題に大きく悩まされる可能性があります。この目的のために、ここでは、Mairラボによって開発された多数の指標を使用してミトコンドリアの形態を定量化する自動化された方法の概要を示します。MitoMAPRは、ミトコンドリアの形態を客観的に自動定量化し、ミトコンドリアネットワーク、オブジェクトの長さ、分布、ネットワークカバレッジ、ミトコンドリアフットプリントなど、ミトコンドリアのさまざまな側面を測定できます。MitoMAPRはImageJ用の無料のマクロであるため、機能的なコンピューターを持つすべてのラボで利用できます。MitoMAPRを使用することの重要な側面の1つは、テストされている実験条件の変化を決定するために、ミトコンドリア形態のどのメトリックが最も頑健であるかを決定するために、大きなサンプルサイズにわたって定量化を実行することです43,44。ここでは、物体の長さと接合点が、筋肉、腸、皮下組織の老化時の変化を判断するための最良の指標であることがわかりました。ミトコンドリアの形態の変化を解析するための別のアプローチは、zスタック画像からミトコンドリアの3D表現を生成し、続いて3D解析を行うことである16,45。これは、Image-Pro PlusとSharpStack Total Deconvolutionモジュール、3D Constructorモジュールなどの市販のソフトウェアを使用して実現できます。3Dミトコンドリア表現の定量化は、ミトコンドリアの形状とネットワーク特性についてより正確な洞察を提供することが示されている46。ただし、この方法は、広視野または共焦点zスタックから複数の画像セクションを単一の2D投影に折りたたみ、mitoMAPRなどのツールで分析するセミ3Dアプローチと比較して、技術的に複雑でコストがかかります。この研究では、ミトコンドリアマトリックスを標的としたGFPのシングルコピー発現の使用方法をまとめ、イメージング中に避けるべきいくつかの落とし穴について詳しく説明します。
制限事項と時間に関する考慮事項
腸組織などの大きくて厚い組織には共焦点顕微鏡法が推奨されますが、標準的なライン走査型共焦点顕微鏡法では、ミトコンドリアの迅速なイメージングを行うには遅すぎる場合があります。これは、線虫をスライド上に長時間置くとミトコンドリアが断片化する可能性があることを示すデータを考慮すると特に当てはまります。共焦点顕微鏡技術は大幅に進歩しましたが、スピニングディスク、Airyscan、またはこの研究で使用されたものなど、迅速なイメージングを実行できる顕微鏡は、一部のラボにとって法外な費用がかかる可能性があります。これらの場合、複合顕微鏡法を計算クリアランス法と組み合わせて、デコンボリューション47などの焦点が合っていない光を除去することができる。
また、前述のように、MitoMAPRは、ミトコンドリアの長さとミトコンドリアネットワークの相互接続を定量的に測定するための強力な自動マクロです。ただし、ここに記載されている制限を考慮して慎重に使用する必要があります。まず、マトリックスを標的としたGFPを使用すると、内膜のミトコンドリア分裂のみが観察され、外膜分裂がない場合に内膜分裂イベントが発生する可能性があるため、外膜のミトコンドリア形態を完全に再現できない可能性があります。したがって、両方のメンブレンをより詳細にイメージングするには、マトリックスターゲットとミトコンドリア外膜ターゲットの両方の蛍光色素分子を使用する必要があります。ミトコンドリア外膜マーカーは、高度に過剰発現するとマトリックス局在タンパク質と同じ結果を被る可能性があるため、シングルコピーマーカーの使用、特にここで使用されるような完全なタンパク質ではなく、最小限のミトコンドリア局在化配列を使用するマーカーの使用が推奨される31。
図3で説明したように、ミトコンドリアは顕微鏡下で急速に断片化することがあり、サンプルスライドを調製するさまざまな方法が、使用するバッファーに応じて形態に大きく影響します。この原稿に記載されている代表的なデータは、線虫のミトコンドリアがM9および低濃度のアジ化ナトリウムの下で最小限の断片化を受けることを示しています。テトラミソールは、線虫を麻痺させるために広く使用されている別の化学物質であり、ミトコンドリアを急速に断片化するため、その使用は一般的に避けるべきであることを示しています。M9とアジ化ナトリウムはミトコンドリアの有意な断片化を示さなかったが、異なる菌株がここで示した結果とは異なる反応を示す可能性があることに注意することが重要です。他の研究では、アジ化ナトリウムがミトコンドリアを断片化できることが示されていますが、私たちの株は、アジ化ナトリウムへの曝露でミトコンドリアの分裂が著しくない可能性があります。これは、私たちのコンストラクトの発現レベルが低いためです。ミトコンドリアに局在するタンパク質の発現が高いと、膜電位が崩壊する可能性があるため、他の研究で使用された異なる菌株により、この研究で使用されたのと同じ濃度のアジ化ナトリウムによるミトコンドリアの断片化の影響を受けやすくなる可能性があります。いずれにせよ、特定の変異体や条件は薬物誘発性のミトコンドリア断片化の影響を受けやすい可能性があるため、すべての研究で使用する前に、特定の条件で線虫を麻痺させる化学物質が特定の条件でミトコンドリア断片化を引き起こさないように注意する必要があります。さらに、線虫をM9に保持するだけでも、M9バッファーでの遊泳活動がミトコンドリアの分裂と融合のダイナミクスに影響を与えることが以前に示されているため、自然なミトコンドリアの形態と活動に変化をもたらす可能性があります。さらに、線虫をM9に長期間放置すると、ミトコンドリアのタンパク質抑制の混乱を引き起こすことにより、ミトコンドリアに重大な影響を与える低酸素応答が活性化される可能性があります48,49。
最後に、もう1つの重要な考慮事項は、ミトコンドリアの形態の変化はしばしばミトコンドリア機能の変化と相関しているが、両者の間には必ずしも直接的な相関関係があるわけではないということです。したがって、ミトコンドリア機能のより徹底的な分析が推奨されます。例えば、酸素消費率はタツノオトシゴ機器50を用いて測定することができ、ミトコンドリア膜電位はJC9やTMREなどの膜電位色素を用いて測定することができ51、ミトコンドリアの酸化状態はroGFP52などの酸化還元感受性色素を用いて測定することができ、ミトコンドリアのストレスレジリエンスはロテノン53のようなストレッサーに対する感受性を用いて測定することができる.ミトコンドリアのイメージングは非常に迅速であるため、実験条件がミトコンドリアの形態に影響を与えるかどうかを判断するための簡単な最初のパスとして、ここで方法を提供します。これらの方法は、薬物や遺伝子の大規模なスクリーニングにも適しており、追加の指標を使用してより徹底的なミトコンドリア分析をフォローアップすることが推奨されます。全体として、ここでは、C.エレガンスのミトコンドリア形態を最小限の実験エラーで画像化するための最も単純な方法であると考えられているものを検討します。
開示事項
著者は何も開示していません。
謝辞
JKはUSCプロボストフェローシップによってサポートされています。M.A.とG.G.はT32AG052374によってサポートされています。MVは1R25AG076400によってサポートされています。また、R.H.S.は、国立老化研究所のR01AG079806とラリー・L・ヒルブロム財団の2022-A-010-SUPの支援を受けています。一部の株は、NIH研究インフラストラクチャプログラム局の助成金P40 OD010440によって資金提供されているCGCによって提供されました。一部の遺伝子解析は、U41助成金HG002223で資金提供されているWormbaseを使用して行われました。
資料
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2'-deoxyuridine (FUDR) | Spectrum Chemical | F2026-10GMBL | for proliferation inhibition |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| Confocal microscope | Stellaris 5 | ||
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| HistoBond microscope slides | VWR | 16005-110 | for slides preparation |
| LB Broth | VWR | 95020-778 | for LB |
| LEICA S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| LEICA STELLARIS 5 | Leica | 158101100 | Confocal Microscope |
| LEICA THUNDER | Leica | 11525679 | Compound Microscope |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| pL4440 empty vector plasmid | addgene | plasmid #1654 | for empty vector plasmid |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| Sodium azide | VWR | 97064-646 | for paralyzing worms |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| WOB-L® Dry Vacuum Pumps, Standard-Duty, Welch® | VWR | 80077-612 | for aspiration |
参考文献
- Protasoni, M., Zeviani, M. Mitochondrial structure and bioenergetics in normal and disease conditions. Int J Mol Sci. 22 (2), 586(2021).
- Wang, Y., et al. The role of mitochondrial dynamics in disease. MedComm. 4 (6), e462(2023).
- Kamer, K. J., Mootha, V. K. The molecular era of the mitochondrial calcium uniporter. Nat Rev Mol Cell Biol. 16 (9), 545-553 (2015).
- Chen, W., Zhao, H., Li, Y. Mitochondrial dynamics in health and disease: mechanisms and potential targets. Signal Transduct Target Ther. 8 (1), 333(2023).
- Adebayo, M., Singh, S., Singh, A. P., Dasgupta, S. Mitochondrial fusion and fission: The fine-tune balance for cellular homeostasis. FASEB J. 35 (6), e21620(2021).
- Madan, S., Uttekar, B., Chowdhary, S., Rikhy, R. Mitochondria lead the way: mitochondrial dynamics and function in cellular movements in development and disease. Front Cell Dev Biol. 9, 781933(2021).
- Sharma, A., Smith, H. J., Yao, P., Mair, W. B. Causal roles of mitochondrial dynamics in longevity and healthy aging. EMBO Rep. 20 (12), e48395(2019).
- Rolland, S. G., Lu, Y., David, C. N., Conradt, B. The BCL-2-like protein CED-9 of C. elegans promotes FZO-1/Mfn1,2- and EAT-3/Opa1-dependent mitochondrial fusion. J Cell Biol. 186 (4), 525-540 (2009).
- Labrousse, A. M., Zappaterra, M. D., Rube, D. A., van der Bliek, A. M. C. elegans dynamin-related protein DRP-1 controls severing of the mitochondrial outer membrane. Mol Cell. 4 (5), 815-826 (1999).
- Dickinson, D. J., Pani, A. M., Heppert, J. K., Higgins, C. D., Goldstein, B. Streamlined genome engineering with a self-excising drug selection cassette. Genetics. 200 (4), 1035-1049 (2015).
- Bosher, J. M., Labouesse, M. RNA interference: Genetic wand and genetic watchdog. Nat Cell Biol. 2 (2), E31-E36 (2000).
- Yu, C. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249(2020).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Front Endocrinol. 11, 554994(2020).
- Dingley, S., et al. Mitochondrial respiratory chain dysfunction variably increases oxidant stress in Caenorhabditis elegans. Mitochondrion. 10 (2), 125-136 (2010).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. J Chromatogr B Anal Technol Biomed Life Sci. 793 (1), 141-150 (2003).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Curr Protoc Cell Biol. Chapter 4, Unit 4.25.1-Unit 4.25.21 (2010).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. Novel imaging tools to study mitochondrial morphology in Caenorhabditis elegans. Life Sci Alliance. 7 (11), e202402918(2024).
- Benedetti, C., Haynes, C. M., Yang, Y., Harding, H. P., Ron, D. Ubiquitin-like protein 5 positively regulates chaperone gene expression in the mitochondrial unfolded protein response. Genetics. 174 (1), 229-239 (2006).
- Begelman, D. V., et al. An aco-2::gfp knock-in enables the monitoring of mitochondrial morphology throughout C. elegans lifespan. microPublication Biol. 2022, (2022).
- Castro Torres, T., et al. Surveying low-cost methods to measure lifespan and healthspan in Caenorhabditis elegans. J Vis Exp. 183, e64091(2022).
- Rasmussen, N. R., Reiner, D. J. Nuclear translocation of the tagged endogenous MAPK MPK-1 denotes a subset of activation events in C. elegans development. J Cell Sci. 134 (17), jcs258456(2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Luz, A. L., et al. Mitochondrial morphology and fundamental parameters of the mitochondrial respiratory chain are altered in Caenorhabditis elegans strains deficient in mitochondrial dynamics and homeostasis processes. PLoS One. 10 (6), e0130940(2015).
- Oorloff, M., et al. Mechanical stress through growth on stiffer substrates impacts animal health and longevity in C. elegans. bioRxiv. , (2024).
- Chu, X., Wu, S., Raju, R. NLRX1 regulation following acute mitochondrial injury. Front Immunol. 10, 2431(2019).
- Shah, P., Bao, Z., Zaidel-Bar, R. Visualizing and quantifying molecular and cellular processes in Caenorhabditis elegans using light microscopy. Genetics. 221 (4), iyac068(2022).
- Wang, Y., Wang, P., Li, C. Fluorescence microscopic platforms imaging mitochondrial abnormalities in neurodegenerative diseases. Adv Drug Deliv Rev. 197, 114841(2023).
- Ding, J., et al. An expanded GCaMP reporter toolkit for functional imaging in Caenorhabditis elegans. G3 (Bethesda, Md). 13 (10), jkad183(2023).
- Sarasija, S., Norman, K. R. Analysis of mitochondrial structure in the body wall muscle of Caenorhabditis elegans. Bio-Protocol. 8 (7), e2801(2018).
- Chaweeborisuit, P., Suriyonplengsaeng, C., Suphamungmee, W., Sobhon, P., Meemon, K. Nematicidal effect of plumbagin on Caenorhabditis elegans: A model for testing a nematicidal drug. Z Naturforsch C J Biosci. 71 (5-6), 121-131 (2016).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. Novel imaging tools to study mitochondrial dynamics in Caenorhabditis elegans. 7, 11(2024).
- Bolognesi, B., Lehner, B. Reaching the limit. eLife. 7, e39804(2018).
- Jishi, A., Qi, X. Altered mitochondrial protein homeostasis and proteinopathies. Front Mol Neurosci. 15, 867935(2022).
- Morton, K. S., Wahl, A. K., Meyer, J. N. The effect of common paralytic agents used for fluorescence imaging on redox tone and ATP levels in Caenorhabditis elegans. PLoS One. 19 (4), e0292415(2024).
- Noumi, T., Maeda, M., Futai, M. Mode of inhibition of sodium azide on H+-ATPase of Escherichia coli. FEBS Lett. 213 (2), 381-384 (1987).
- Siete, C., Xiong, R., Khalid, A., Hsieh, Y. -W., Chuang, C. -F. Immobilization of C. elegans with different concentrations of an anesthetic for time-lapse imaging of dynamic protein trafficking in neurons. microPublication Biology. 2024, (2024).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. J Gerontol. 34 (1), 28-36 (1979).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2'-deoxyuridylate: covalent complex with thymidylate synthetase. Proc Natl Acad Sci U S A. 69 (7), 1855-1857 (1972).
- Wang, H., Zhao, Y., Zhang, Z. Age-dependent effects of floxuridine (FUdR) on senescent pathology and mortality in the nematode Caenorhabditis elegans. Biochem Biophys Res Commun. 509 (3), 694-699 (2019).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development (Cambridge, England). 116 (3), 755-766 (1992).
- Austin, J., Kimble, J. glp-1 is required in the germ line for regulation of the decision between mitosis and meiosis in C. elegans. Cell. 51 (4), 589-599 (1987).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Zhang, Y., et al. Neuronal TORC1 modulates longevity via AMPK and cell nonautonomous regulation of mitochondrial dynamics in C. elegans. eLife. 8, e49158(2019).
- Dutta, N., et al. Investigating impacts of the mycothiazole chemotype as a chemical probe for the study of mitochondrial function and aging. GeroScience. 46 (6), 6009-6028 (2024).
- Tronstad, K., et al. Regulation and quantification of cellular mitochondrial morphology and content. Curr Pharm Des. 20 (35), 5634-5652 (2014).
- Nikolaisen, J., et al. Automated quantification and integrative analysis of 2D and 3D mitochondrial shape and network properties. PLoS One. 9 (7), e101365(2014).
- Lee, J. S., Wee, T. L. E., Brown, C. M. Calibration of wide-field deconvolution microscopy for quantitative fluorescence imaging. J Biomol Tech. 25 (1), 31-40 (2014).
- Hong, M., Kwon, J. Y., Shim, J., Lee, J. Differential hypoxia response of hsp-16 genes in the nematode. J Mol Biol. 344 (2), 369-381 (2004).
- Yan, J., Sun, C. L., Shin, S., Van Gilst, M., Crowder, C. M. Effect of the mitochondrial unfolded protein response on hypoxic death and mitochondrial protein aggregation. Cell Death Dis. 12 (7), 711(2021).
- Koopman, M., et al. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans. Nat Protoc. 11 (10), 1798-1816 (2016).
- Shpilka, T., et al. UPRmt scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nat Comm. 12 (1), 479(2021).
- Braeckman, B. P., Smolders, A., Back, P., De Henau, S. In vivo detection of reactive oxygen species and redox status in Caenorhabditis elegans. antioxidants & redox signaling. 25 (10), 577-592 (2016).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. elegans. J Vis Exp. 159, e61001(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。