Method Article
הדמיה וכימות מורפולוגיה מיטוכונדריאלית ב - C. elegans במהלך ההזדקנות
In This Article
Summary
פרוטוקול זה מספק גישה סטנדרטית להדמיית מורפולוגיה מיטוכונדריאלית ברקמות מרובות של C. elegans במהלך ההזדקנות.
Abstract
מיטוכונדריה, אברונים תאיים חשובים הנמצאים ברוב התאים האיקריוטיים, הם אתרים עיקריים לייצור אנרגיה באמצעות נשימה אירובית. מעבר לתפקיד הידוע הזה כ"תחנת הכוח התאית", המיטוכונדריה מעורבים גם בתהליכים תאיים חיוניים רבים אחרים, כולל ויסות חילוף החומרים התאי, שגשוג, איתות חיסוני ואיתות הורמונלי. הידרדרות בתפקוד המיטוכונדריה במהלך ההזדקנות או תחת לחץ מיטוכונדריאלי מאופיינת לעתים קרובות בשינויים מובהקים במורפולוגיה ובנפח המיטוכונדריה. הנמטודה C. elegans היא מודל אידיאלי לחקר שינויים אלה בשל גופה השקוף ותוחלת החיים הקצרה שלה, המאפשרים מיקרוסקופיה חיה לאורך כל חייה. עם זאת, אפילו בתחום C. elegans , קיימים מבנים טרנסגניים רבים ושיטות להדמיה מיטוכונדריאלית, שלכל אחד מהם מגבלות משלו. כאן, מבני GFP בעותק יחיד, מקומי מטריצה מוצגים כשיטה חזקה ואמינה להדמיית מורפולוגיה מיטוכונדריאלית ב - C. elegans. מחקר זה מתמקד במיוחד בגורמים הניתנים לשליטה בניסוי כדי למזער טעויות ולהפחית את השונות בין שכפולים ובין מחקרים בעת ביצוע הדמיה מיטוכונדריאלית במהלך תהליך ההזדקנות. בנוסף, mitoMAPR מומלצת כשיטה חזקה לכימות שינויים במורפולוגיה המיטוכונדריאלית על פני סוגי רקמות במהלך ההזדקנות.
Introduction
מיטוכונדריה הם אברונים תאיים המוקפים בקרום פוספוליפיד כפול וממלאים תפקיד חשוב בשמירה על ביו-אנרגטיקה תאית כאתר מפתח לחילוף חומרים וייצור אנרגיה1. מספר רב של מיטוכונדריה מייצרים אנרגיה באופן רציף בצורה של ATP כדי לעמוד בדרישות התאים2. בנוסף לתפקידים חשובים אלה, המיטוכונדריה משתתפת גם בתהליכים תאיים מורכבים כגון העברת אותות, אוטופגיה, חסינות מולדת, מחזור התא ומסלולי מוות תאים 2,3. מיטוכונדריה מציגה מורפולוגיות מגוונות, החל מאברונים בודדים קטנים ועד לרשתות צינוריות נרחבות המחוברות זו לזו, בהתאם לדרישות האנרגטיות המשתנות ולבריאות המיטוכונדריה4.
מאפיין מרכזי של המיטוכונדריה הוא האופי הדינמי שלהם, לפיו הם יכולים לעבור לסירוגין בין הצורות השונות הללו באמצעות רצף מתואם ומתמשך של אירועי ביקוע והיתוך4. האיזון המדויק בין התהליכים המנוגדים הללו מווסת את המורפולוגיה המיטוכונדריאלית, המספר, הגודל והמיקום בתוך הציטופלזמה5. בנוסף, תהליכי היתוך וביקוע אלה חשובים לשמירה על בקרת איכות של מיטוכונדריה5. לדוגמה, ביקוע מיטוכונדריאלי הוא מרכיב חיוני בהסרת מיטוכונדריה פגומה באמצעות מיטוכונדריה והסרה סלקטיבית של מיטוכונדריה באמצעות אוטופגיה2. הדינמיקה המיטוכונדריאלית ממלאת גם תפקיד חשוב בחלוקת התאים, התפתחות, עמידות בפני גורמי לחץ שונים ושמירה על חילוף החומרים התאי6.
שיבוש הדינמיקה המיטוכונדריאלית מעורב במחלות רבות, כולל הפרעות ניווניות, מחלות מטבוליות, מחלות לב וכלי דם וסרטן4. בנוסף, הזדקנות קשורה לעיצוב מחדש דרמטי של המיטוכונדריה, בעיקר בשל שינויים בדינמיקת היתוך-ביקוע7. לכן, הדמיה וניטור של השינויים במורפולוגיה המיטוכונדריאלית במצבי לחץ או מחלה שונים ולאורך תהליך ההזדקנות מציעים תובנות חשובות להבנת תפקוד התא, מנגנון המחלה ואסטרטגיות טיפוליות פוטנציאליות.
כמו מסלולים מולקולריים רבים, גם הדינמיקה והתפקוד המיטוכונדריאלי נשמרים מאוד על פני איקריוטים, כולל אורגניזמים מודלים כמו הנמטודה Caenorhabditis elegans. בדומה לתאים אנושיים, איחוי מיטוכונדריאלי ב - C. elegans מושג על ידי תפקודם של חלבוני גואנין טריפוספטאז (GTPase) הקשורים לדינמין, כולל FZO-1 (אורתולוג של יונקים Mfn1/2) ו- EAT-3 (אורתולוג של יונקים Opa1) השולטים באיחוי של הממברנה המיטוכונדריאלית החיצונית (OMM) והממברנה המיטוכונדריאלית הפנימית (IMM), בהתאמה8. ביקוע מיטוכונדריאלי מווסת על ידי החלבון הקשור לדינמין (DRP-1, אורתולוג של Drp1 אנושי), המקדם ביקוע מיטוכונדריאלי על ידי יצירת קומפלקסים דמויי טבעת סביב הממברנה החיצונית המיטוכונדריאלית המכווצים ובסופו של דבר מפרידים את הממברנות המיטוכונדריאליות9. היתוך מיטוכונדריאלי ממלא תפקיד מרכזי בבקרת האיכות המיטוכונדריאלית בכך שהוא מאפשר ערבוב של תוכן מיטוכונדריה, כולל DNA מיטוכונדריאלי, חלבונים ושומנים, ומאפשר השלמה של מיטוכונדריה פגומה חלקית על ידי תוכן ממיטוכונדריה בריאה9. מצד שני, ביקוע מיטוכונדריאלי מאפשר למיטוכונדריה להתחלק, יוצר מיטוכונדריה חדשה ומקל על הפצתם לא רק בתוך הציטופלזמה אלא גם לתאי בת במהלך חלוקת התאים, מה שמבטיח תורשה ותפקוד מיטוכונדריאלי תקין9. אירוע זה חיוני גם להפרדת מקטעים מיטוכונדריאלים פגומים או לא מתפקדים, אשר לאחר מכן ניתן למקד לפירוק באמצעות מיטופגיה9.
C. elegans נחשבת זה מכבר לאחת ממערכות המודל הגנטי החזקות ביותר בשל הגנום השלם, וזמינותם של מגוון כלים גנטיים, כולל CRISPR/Cas9 המאפשר שינויים גנטיים10, שיטות רבות לביטוי יתר של גנים, ושיטה מבוססת מזון חיידקי להפרעות RNA (RNAi)11. בנוסף, האנטומיה השקופה שלהם מאפשרת הדמיה מיקרוסקופית באורגניזמים חיים12. לבסוף, תוחלת החיים הקצרה יחסית, עלויות התחזוקה הנמוכות והקלות לייצר מספר רב של בעלי חיים תואמי גיל הופכים אותם למערכת מודל מצוינת לביולוגיה של הזדקנות13. יתרונות אלה, בשילוב עם השימור הידוע של מסלולי ויסות מיטוכונדריאלים עיקריים, הופכים את C. elegans למערכת מודל אטרקטיבית ביותר לחקר הדינמיקה המיטוכונדריאלית במהלך ההזדקנות.
סמנים פלואורסצנטיים נמצאים בשימוש נרחב במחקר ביולוגי כדי להמחיש ולחקור רכיבים תאיים, כולל מיטוכונדריה. ישנם צבעים ספציפיים החדירים לתאים כגון MitoTracker ו-tetramethylrhodamine ethyl ester (TMRE) שנמצאים בשימוש נפוץ14. הראשון משמש לצביעת המטריצה המיטוכונדריאלית הכוללת הטעונה שלילית15, ואילו השני משמש להערכת פוטנציאל הממברנה המיטוכונדריאלית היחסית באמצעות יון הטריפנילפוספוניום הטעון חיובית16. בעוד שהן מרוויחות מכך שאינן דורשות טרנסגניות, הקוטיקולה העבה של התולעים המשתנה במבנה ובחדירות במהלך ההזדקנות והשונות של חדירת צבע על פני רקמות שונות הופכות את הגישות מבוססות הצבע למאתגרות ב - C. elegans17. יתר על כן, הערכת המורפולוגיה המיטוכונדריאלית מבולבלת על ידי השפעות פוטנציאליות מחוץ למטרה של הצבעים, כגון צבירת צבע17. במקום זאת, שיטות גנטיות לביטוי פלואורופורים מקומיים במיטוכונדריה משמשות בדרך כלל במודל התולעת.
כאן, מחקר זה מתמקד בהדגשת זנים המבטאים GFP מקומי של מטריצה מיטוכונדריאלית (להלן MLS::GFP) תחת מקדמים ספציפיים לסוג התא. חשוב לציין, קווים טרנסגניים אלה נעשו בשיטת MosSCI כדי להבטיח ביטוי בעותק יחיד של המדווח בלוקוס גנומי ידוע, מה שמונע בעיות עם זנים זמינים אחרים. לדוגמה, ביטוי עותק גבוה של כמה חלבונים ממוקדי מיטוכונדריה מוביל לשונות ברמות הביטוי עקב שילוב של מערכי פלסמיד חוץ-כרומוזומליים בלוקוס אקראי עם מספר עותק לא ידוע18. בנוסף, הוכח בעבר שהם גורמים נזק למיטוכונדריה מכיוון שזהו נטל גבוה על התאים למקם כראוי את החלבונים המיטוכונדריאלים המתבטאים יתר על המידה19. לכן, ביטוי הגנים המדויק, היציב והנמוך וקלות המעבר למיקומים ידועים הופכים את הטרנסגנים הללו של MosSCI לשיטה המועדפת. באמצעות זנים אלה, מחקר זה מתקנן שיטות להדמיית מיטוכונדריה בשרירים, במעי ובהיפודרמיס של C. elegans. יתר על כן, הוא מדגיש את היישומים הטכניים החשובים ושיטות פתרון הבעיות שחשוב לקחת בחשבון ולהבטיח ניתוח ניסיוני ניתן לשחזור של מיטוכונדריה במהלך ההזדקנות ב - C. elegans.
Protocol
פרטים על הריאגנטים והציוד המשמשים במחקר זה מפורטים בטבלת החומרים.
1. גידול ותחזוקה של C. elegans
- הכנת צלחות גידול נמטודות (NGM).
- לתרבית של C. elegans, השתמש בצלחות אגר סטנדרטיות של 2% עם NGM המכילות 1 מ"מ של CaCl2, 12.93 מיקרומטר (5 מיקרוגרם/מ"ל) של כולסטרול, 25 מ"מ של KPO4 (pH 6.0), 1 מ"מ של MgSO4, 2.5 מ"מ (0.25% w/v) של פפטון ו-51.3 מ"מ של NaCl. ראה את השיטה המפורטת למזיגת לוחות NGM המתוארת ב- Castro Torres et al.20.
הערה: עבור ניסויי הפרעות RNA (RNAi), הוסף 1 מ"ל של 1 M IPTG ו-1 מ"ל של 100 מ"ג/מ"ל קרבניצילין עבור 1 ליטר צלחות NGM-agar. - לאחר שלוחות ה-NGM התמצקו, גדלו תרבית של OP50 במרק ליזוגני (LB) למשך 24-48 שעות בטמפרטורת החדר או גדלו תרבית של HT115 הנושאת פלסמיד וקטורי ריק pL4440 ב-LB עם אנטיביוטיקה (אמפיצילין/קרבניצילין 100 מיקרוגרם/מ"ל + טטרציקלין 5 מיקרוגרם/מ"ל) עם טלטול ב-37 מעלות צלזיוס למשך 12-16 שעות.
הערה: פלסמיד זה זמין ממקורות מסחריים (ראה טבלת חומרים). - זרע 200 מיקרוליטר של תרבית OP50 או HT115 על צלחות 60 מ"מ, או 1 מ"ל על צלחות 100 מ"מ.
- יבש את הצלחות עד שהן כבר לא רטובות ואחסן את הצלחות במיכלים אטומים בטמפרטורה של 4 מעלות צלזיוס עד חודשיים.
- אופציונלי: הוסף 100 מיקרוליטר של 10 מ"ג/מ"ל 5-fluoro-2'-deoxyuridine (FUDR) ישירות על צלחות NGM-agar שנזרעו בחיידקים כדי לעקר כימית תולעי L4/בוגרות ולמנוע התפתחות של תולעים צעירות יותר.
הערה: הזנים שפותחו ושימשו במחקר זה הם:
(1) RHS191 - uthSi17[myo3p::MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] I
(2) RHS192 - uthSi83[col19p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)]I
(3) RHS193 - uthSi80[vha-6p:: MLS::GFP::unc-54 3'UTR::cb-unc-119(+)] IV
- לתרבית של C. elegans, השתמש בצלחות אגר סטנדרטיות של 2% עם NGM המכילות 1 מ"מ של CaCl2, 12.93 מיקרומטר (5 מיקרוגרם/מ"ל) של כולסטרול, 25 מ"מ של KPO4 (pH 6.0), 1 מ"מ של MgSO4, 2.5 מ"מ (0.25% w/v) של פפטון ו-51.3 מ"מ של NaCl. ראה את השיטה המפורטת למזיגת לוחות NGM המתוארת ב- Castro Torres et al.20.
- סינכרון C. elegans על ידי הלבנה
- לבדיקה בקנה מידה גדול הדורשת מספר גבוה של נמטודות, חותכים צלחת NGM-agar בגודל 60 מ"מ מלאה בבעלי חיים לחתיכות קטנות וחותכים אותם על לוחות של 100 מ"מ שנזרעים בחיידקים להתפשטות. אפשר 2-3 ימים עד שצלחות ה-100 מ"מ יהיו מלאות בתולעים כאשר הן גדלות ב-20 מעלות צלזיוס לאחר הקיבוץ. להמלצות מפורטות יותר להרחבת בעלי חיים, עיין ב-Castro Torres et al.20.
- כדי לאסוף את התולעים לסנכרון, שפכו 5-10 מ"ל של תמיסת M9 (22 מ"מ של KH2PO4 מונובסיסי, 42.3 מ"מ של Na2HPO4, 85.6 מ"מ של NaCl, 1 מ"מ של MgSO4) על צלחות 100 מ"מ של NGM-agar עם תולעים, וסובבו בעדינות את תמיסת M9 כדי לשחרר את התולעים ממדשאות החיידקים.
- צייר את התולעים בעזרת פיפטה סרולוגית והעביר אותן לצינורות חרוטיים של 15 מ"ל.
הערה: פיפטות סרולוגיות מזכוכית מומלצות מכיוון שפיפטות סרולוגיות מפלסטיק נוטות לגרום לתולעים להיצמד לדופן הפנימית של פיפטות הפלסטיק. - צנטריפוגה למשך 30 שניות ב-1,100 x גרם בטמפרטורת החדר כדי לגלול את התולעים ולשאוב את הסופרנטנט באמצעות משאבת ואקום.
- הכן 5 מ"ל של תמיסת הלבנה המכילה 1.5 מ"ל של 6% נתרן היפוכלוריט, 0.75 מ"ל של 5 M NaOH או KOH, ו-2.75 מ"ל של dH2O. יוצקים את 5 מ"ל תמיסת ההלבנה לתוך כדור התולעת.
זהירות: מומלץ ללבוש כפפות וחלוק מעבדה בשלב זה מכיוון שתמיסות נתרן היפוכלוריט והידרוקסיד הן קורוזיביות. - דגרו את תערובת התולעת + תמיסת ההלבנה למשך ~4-6 דקות עד שכל גופות בעלי החיים מומסות לחלוטין ונשארות רק הביצים. יש לנער את התערובת במרץ כדי לסייע בתהליך ההתמוססות.
הערה: בדוק את התולעים כל דקה תחת מיקרוסקופ מנתח. קצר או הארך את זמן ההלבנה על סמך מידת המומס של גופן של תולעים בוגרות. השארת הביצים בתוך תמיסת הלבנה לתקופה ממושכת תגרום לפגיעה בביצים ותשפיע על כדאיות הנמטודות. - צנטריפוגה מערבבים את הביצים/תמיסת ההלבנה במשך 30 שניות ב-1,100 x גרם בטמפרטורת החדר כדי לגלול את הביצים ואז לשאוב בזהירות את הסופרנטנט באמצעות משאבת ואקום, תוך הקפדה לא לשאוב את כדור הביצים.
הערה: מומלץ לבצע שטיפות במהירות כדי למנוע חשיפה ממושכת של הביצים לתמיסת ההלבנה. - שוטפים את הביצים עם 5-10 מ"ל תמיסת M9 4 פעמים.
- השעו את הביצים בנפח קטן של תמיסת M9 וצלחו אותן על צלחות NGM שנזרעו בחיידקים על ידי פיפטינג של עד 50 מיקרוליטר. חישבו הערכה גסה של מספר הביצים על ידי פיפטינג של 3-5 מיקרוליטר מתערובת הביצים על צלחת וספירת מספר הביצים בנפח זה. הוסף M9 כדי לדלל את תערובת הביצים למספר ביצים שניתן לספור בנפח זה.
הערה: מומלץ לצפות פחות מ-100 תולעים לצלחת מכיוון שהתולעים יכולות לגווע ברעב לפני היום הראשון לבגרות כאשר יש יותר מדי בעלי חיים מצופים. להמלצות מפורטות יותר לציפוי מספרים של בעלי חיים, עיין ב-Castro Torres et al.20. - לחלופין, L1 עוצר את הנמטודות לסנכרון גיל הדוק יותר. לעצירת L1, הוסף את הנפח המתאים של תמיסת M9 לכדור הביצה בצינור חרוטי של 15 מ"ל לנפח של 10-12 מ"ל. תן לתולעים להסתובב במסובב למשך 16-24 שעות בטמפרטורה של 20 מעלות צלזיוס. צנטריפוגה (כמו בשלב 1.2.7) ולשאוף את הסופרנטנט. חשב את הריכוז של בעלי חיים L1 וצלח אותם על צלחות NGM כמתואר עבור ביצים בשלב 1.2.9.
- הזדקנות אוכלוסיית C. elegans לגיל הרצוי: העבירו את החיות הבוגרות L4 לצלחות המכילות 5-fluoro-2'-deoxyuridine (FUDR) כמתואר בשלב 1.1.6 כדי למנוע צאצאים ולחסל צאצאים שכבר נוצרו. לשיטות חלופיות להזדקנות תולעים ללא FUDR, עיין בקסטרו טורס ואחרים.20.
הערה: יש לקחת בחשבון כמה גורמים חשובים לפני שבוחרים בהלבנה כשיטה לסנכרון תולעים בשלב הזחל הראשון שלהן. כפי שהודגש קודם לכן, חשיפת יתר לאקונומיקה עלולה לפגוע בעוברים, להפחית את שיעורי הבקיעה וליצור לחץ ברירה לזנים עמידים לאקונומיקה, מה שעלול לשנות את הגנטיקה של האוכלוסייה. בנוסף, אם עוברים נותרים ללא מזון לפרקי זמן ממושכים, דלדול חומרים מזינים עלול לפגוע בחילוף החומרים ובהתפתחות. לכן, ניתן להשתמש בשיטות הטלת ביצים או NemaSync כחלופה לשיטות הלבנה. השיטה להליך הטלת הביצים מתוארת בשלבים במחקר שהופנה על ידי קסטרו טורס ואחרים.20. NemaSync היא שיטה מסחרית חדשה ויקרה יותר, שבה נעשה שימוש בסנכרון תולעים ידני לסנכרון תולעים ללא שימוש בכימיקלים21.
2. הדמיה של מיטוכונדריה ב- C. elegans
- הכנת שקופיות להדמיה של C. elegans
- הוסף 10-20 מיקרוליטר של תמיסת M9 על שקופיות זכוכית והעביר מספר רצוי של תולעים בוגרות בגילאים הספציפיים לתמיסה שעל המגלשה. מומלץ כ-25 תולעים.
הערה: שימוש בשיטות מסורתיות לשיתוק תולעים (למשל, טטרמיסול או נתרן אזיד) עלול לגרום לפיצול מיטוכונדריאלי בתנאים מסוימים (ראה להלן). במקום זאת, מומלץ להשתמש בשקופיות HistoBond כאן, שיש להן משטח עם מטען משטח חיובי קבוע, יפחית את תנועת התולעים מבלי להשתמש בתרופות שעלולות להכניס חפצים. חשוב לשים יחס מתאים של תולעים לתמיסת M9, שכן נפחים נמוכים עלולים לגרום לבעלי חיים להימחץ בין המגלשה לכיסוי, בעוד שנפחים גבוהים יגרמו לבעלי חיים לנוע במהלך רכישת התמונה. ניתן למצוא המלצות בטבלה 1. - לחלופין, לשימוש בתרופות המשתקות תולעים, עיין בתוצאות המייצגות של כתב יד זה עבור טווח של ריכוז ונקודות זמן שניתן להשתמש בהן עם פיצול מוגבל של מיטוכונדריה.
הערה: למרות שלא היה פיצול משמעותי בבעלי חיים בריאים מסוג בר, חשוב לזכור שמוטציות או מצבים מסוימים עשויים לחוות פיצול מיטוכונדריאלי עם אותו ריכוז של תרופות אלה, ולכן נדרשת בדיקה מסוימת בעת שימוש בתרופות אלה. - מכסים את התולעים בתמיסת M9 על המגלשה בכוס כיסוי ומשתמשים בלק כדי לאטום את הדפנות ולמנוע אידוי של תמיסת M9.
- אופציונלי: להדמיית שרירים, גלגל תולעים על ידי דחיפה עדינה של החלקת הכיסוי. זה מאפשר לשרירי דופן הגוף בצידי התולעים להיות מיושרים טוב יותר עם מישור המוקד לקבלת תמונות באיכות גבוהה יותר.
- הוסף 10-20 מיקרוליטר של תמיסת M9 על שקופיות זכוכית והעביר מספר רצוי של תולעים בוגרות בגילאים הספציפיים לתמיסה שעל המגלשה. מומלץ כ-25 תולעים.
- הדמיית מיטוכונדריה באמצעות מיקרוסקופ מורכב
- השתמש במיקרוסקופ שדה רחב סטנדרטי לשרירים ולמיטוכונדריה תת-עורית (myo-3p::MLS::GFP ו-col-19p::MLS::GFP).
הערה: נעשה שימוש בצילום זמין מסחרי המצויד באובייקט 63x/1.4 Plan Aprochromat, מסנן GFP (11525314), מצלמת DFC9000 GT ומקור אור LED5, ונעשה שימוש בתוכנת מיקרוסקופ תואמת. - בצע אופטימיזציה של הגדרות ההדמיה עבור כל מיקרוסקופ ומערך ניסוי.
הערה: עם זאת, כנקודת התחלה, הפרמטרים להדמיה עם ההדמיה המשמשת בכתב יד זה הם כדלקמן: המידות הן 2048 (x) * 2048 (y) פיקסלים בגודל צעד של 0.50 מיקרומטר עבור מיטוכונדריה תת-עורית ו"אופטימיזציה למערכת" המחושבת אוטומטית על ידי התוכנה עבור מיטוכונדריית שרירים. זמן החשיפה הוא 50 אלפיות השנייה עבור מיטוכונדריה של השריר ו-50 אלפיות השנייה עבור מיטוכונדריה תת-עורית. נורית ה-LED של 475 ננומטר הוגדרה ל-50% הספק, ומסנן הצפיפות הנייטרלית הוגדר ל-30% לשריר ו-17% למיטוכונדריה תת-עורית. טווח Z מתחיל מהמקום שבו אות ה-GFP נראה למקום שבו הוא מסתיים. כדי למזער את הרעש בהקרנה מקסימלית, ניתן להקטין את מספר מישורי ה-z המשמשים להקרנה המקסימלית. - להדמיה של מיטוכונדריה במעי (vha-6p::MLS::GFP), השתמש במיקרוסקופ קונפוקלי.
הערה: ההדמיה בוצעה במיקרוסקופ קונפוקלי זמין מסחרית המצויד באובייקט 63x/1.4 Plan ApoChromat, לייזר אור לבן (WLL), מפצל קרן אקוסטו-אופטי, גלאי HyD S, והופעל על תוכנת מיקרוסקופ. כפי שצוין קודם לכן, יש לבצע אופטימיזציה של כל מערך ניסוי בנפרד, אך כנקודת התחלה, הפרמטרים להדמיה עם ה-Stellaris ששימשו במחקר זה הם כדלקמן: ה-WLL הוגדר ל-85.00% הספק מרבי ועם קו לייזר של 485 ננומטר בעוצמה של 3.00%. גלאי HyD S הוגדר ל-490-590 ננומטר עם רווח של 25 בהגדרה האנלוגית. סרקנו באופן חד-כיווני שטח של 1024 (x) * 1024 (y) או 82.01 מיקרומטר (x) * 82.01 מיקרומטר (y) עם 5 (z) פיקסלים בגודל צעד של 0.495 מיקרומטר (ממד z משתנה בהתאם לגודל התולעים או הרקמות) עם מהירות סריקה של 1,000 הרץ, זום 2.25, ממוצע קו של 2 וחור סיכה של 1 AU (95.5 מיקרומטר). תחום ה-Z מתחיל מהמקום שבו אות ה-GFP נראה למקום שבו הוא מסתיים. כדי למזער את הרעש בהקרנה מקסימלית, ניתן להקטין את מספר מישורי ה-z המשמשים להקרנה המקסימלית.
- השתמש במיקרוסקופ שדה רחב סטנדרטי לשרירים ולמיטוכונדריה תת-עורית (myo-3p::MLS::GFP ו-col-19p::MLS::GFP).
- כימות המורפולוגיה המיטוכונדריאלית
הערה: לפרטים, עיין ב-Schindelin et al.22 וראה איור משלים 1A-D.- הורד והתקן את תוכנת FIJI (פיג'י היא רק ImageJ, https://fiji.sc/). לאחר מכן פתח את FIJI.
- כדי להוריד ולהתקין את המאקרו MitoMAPR, הורד את קוד המקור 1 מ-https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033. לאחר מכן העתק את כל הקוד המוזכר תחת "A]. קוד IJM עבור MitoMAPR-1.0." לאחר מכן, פתח את פיג'י, עבור אל תוספים > מאקרו > חדש, והדבק את הקוד שהועתק בעבר בחלון המאקרו. עבור אל קובץ > שמור בשם ושמור את המאקרו לשימוש עתידי.
- פתח תמונה מיקרוסקופית תלת מימדית עם ערימות Z בפיג'י על ידי גרירה ושחרור של קבצים לסרגל הכלים של פיג'י או על ידי מעבר אל קובץ > לפתוח.
- צור הקרנה מקסימלית של תמונה על ידי מעבר אל Image > Stacks > Z Project, ולאחר מכן בחירת טווח הפרוסות עם תמונות ממוקדות להקרנה מקסימלית ובחירת עוצמה מרבית כסוג ההקרנה.
- שמור את התמונה כ-TIFF על-ידי מעבר אל File > Save As >-Tiff.
- חיתוך אזורי עניין (ROI) מתמונות מלאות באמצעות הכלי "מלבן", ציור החזר ROI ולאחר מכן מעבר אל חיתוך > תמונה.
- שמור את התמונה כ-TIFF על-ידי מעבר אל File > Save As >-Tiff.
- הפעל את המאקרו MitoMAPR שנשמר בעבר על ידי גרירה ושחרור של קובץ המאקרו לסרגל הכלים של פיג'י, ולאחר מכן לחץ על הפעלה. חלון חדש יבקש לבחור את התיקיה שבה נשמר קובץ ה-Tiff ב-2.3.6.
- חלון חדש יבקש לבחור אזור; צור מלבן בתמונה באמצעות הכלי מלבן כפי שהוזכר קודם לכן בשלב 2.3.4 ולחץ על אישור.
הערה: ניתן לבחור את התמונה כולה אם היא נחתכה קודם לכן כמתואר בשלב 2.3.6. שמור את חלון "נתונים" עם כל הערכים הקשורים למורפולוגיה מיטוכונדריאלית כקובץ Excel על ידי מעבר אל קובץ > שמור בשם > שמור.
- עיבוד אצווה של דגימות באמצעות פקודות מאקרו של פיג'י
- צור מאקרו לציון אזור התמונות לניתוח. פתח את פיג'י ועבור אל תוספים > מאקרו > חדש. הדבק את הקוד הבא בתיבת הטקסט ושמור את המאקרו כמתואר ב-2.3.2 (איור משלים 1E-H).
הערה: צור מלבן (100, 100, 200, 200); run (ציין..., רוחב = 100, גובה = 100, x = 100, y = 100 בקנה מידה). - צור מאקרו לשמירת כל התמונות הפתוחות כקובצי TIFF. בתוך חלון המאקרו, עבור אל קובץ > חדש והדבק את הקוד הבא בתיבת הטקסט. שמור את המאקרו כמתואר ב- 2.3.2.
הערה: dir = getDirectory("בחר תיקיה"); ids=newArray(nImages); עבור (i=0; i - צור מאקרו עבור האצווה MitoMAPR. עבור אל קוד מקור 1 https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033 והעתק את כל הקודים המוזכרים תחת ב'). קוד IJM עבור MitoMAPR-1.0_Batch". בתוך חלון המאקרו, עבור אל קובץ > חדש, הדבק את הקוד מקוד המקור 1 בתיבת הטקסט ושמור את המאקרו כמתואר בשלב 2.3.2.
- צור מאקרו לחיתוך איטרטיבי. עבור לקוד המקור https://doi-org.remotexs.ntu.edu.sg/10.7554/eLife.49158.033 1 והעתק את כל הקודים המוזכרים תחת C.) קוד IJM עבור CropR". בתוך חלון המאקרו, עבור אל קובץ > חדש, הדבק את הקוד מקוד המקור 1 בתיבת הטקסט ושמור את המאקרו כמתואר בשלב 2.3.2.
- כדי להתחיל בעיבוד אצווה, תחילה שמור את כל התמונות לעיבוד כ-TIFF על ידי פתיחת כל התמונות והפעלת המאקרו שנשמר בשלב 2.4.2. כל התמונות יישמרו כ-TIFF בתיקייה שצוינה. סגור את כל התמונות לאחר השמירה.
- אם התמונות שנשמרו בשלב 2.4.5 הן תמונות תלת-ממדיות (תמונות הכוללות ערימות z), המירו אותן לתמונות דו-ממדיות באמצעות הפיכתן להקרנות Z. כדי להקרין את התמונות באצווה, פתח את חלון עיבוד האצווה על ידי מעבר אל עיבוד > אצווה > מאקרו בחלון הראשי של פיג'י.
- עבור "קלט", בחר את מיקום התיקיה המכילה את כל התמונות התלת-ממדיות לעיבוד מ-2.4.5. עבור "פלט", בחר את המיקום הרצוי עבור התמונות השמורות לאחר העיבוד. בחר את פורמט הפלט כ-TIFF. הדבק את הקוד הבא בתיבת הטקסט הגדולה בחלון ולחץ על כפתור התהליך : run("Z Project...", "projection=[Max Intensity]").
- חיתוך החזר ROI עם ממדים זהים מכל התמונות הדו-ממדיות לעיבוד באמצעות מאקרו החיתוך האיטרטיבי משלב 2.4.4 בשילוב עם מאקרו האזור המציין משלב 2.4.3. הפעל את מאקרו החיתוך האיטרטיבי משלב 2.4.4. יופיע חלון המבקש ספרייה.
- בחר את התיקיה המכילה רק תמונות דו-ממדיות משלב 2.4.5 או את התמונות המוקרנות בדו-ממד Z משלב 2.4.6 ולחץ על בחר לחצן. המאקרו יפתח את אחת התמונות בתיקיה שנבחרה, ויופיע חלון שכותרתו "בצע בחירה" עם שני כפתורים.
- הפעל את מאקרו הבחירה שצוין משלב 2.4.3. שנה את ערכי הרוחב והגובה בתיבת טקסט מאקרו זו כנדרש כדי לשנות את ממדי הבחירה והקש Run כדי להציג את הבחירה החדשה. שינוי ערכי X ו- Y במאקרו ישנה את מיקום הפינה הימנית העליונה של הבחירה.
- לאחר שממדי הבחירה משביעי רצון, גרור את המלבן לאזור הרצוי ולאחר מכן לחץ על כפתור אישור בחלון "בצע בחירה". האזור שנחתך יישמר בתיקיה שנבחרה בשלב 2.4.7.
- המאקרו יחזור על עצמו בכל התמונות הנותרות בתיקיה. עבור כל תמונה, הפעל את המאקרו משלב 2.4.8 מבלי לשנות את ערכי הממד כדי להבטיח שאותם ממדים ייחתכו עבור כל התמונות. עבור כל תמונה, גרור את מלבן הבחירה למיקום הרצוי ולחץ על כפתור אישור בחלון "בצע בחירה".
- פתח את התיקיה המכילה את התמונות שנחתכו משלבים 2.4.8-2.4.9 והעבר את כל התמונות שנחתכו לתיקייה חדשה.
- נתח את כל התמונות שנחתכו על ידי הפעלת המאקרו MitoMAPR אצווה משלב 2.4.3. חלון חדש יבקש ממך לבחור ספרייה. בחר את התיקיה עם כל התמונות שנחתכו משלב 2.4.10. לאחר השלמתו, יופיע חלון בשם "נתונים" עם כל הערכים הקשורים למורפולוגיה המיטוכונדריאלית. שמור את כל הנתונים כקובץ Excel כמתואר בשלב 2.3.9.
- צור מאקרו לציון אזור התמונות לניתוח. פתח את פיג'י ועבור אל תוספים > מאקרו > חדש. הדבק את הקוד הבא בתיבת הטקסט ושמור את המאקרו כמתואר ב-2.3.2 (איור משלים 1E-H).
תוצאות
C. elegans הוא מודל נהדר להדמיה מיטוכונדריאלית בשל גופו השקוף, המאפשר הדמיה קלה של תולעים שלמות, חיות ללא הכנת דגימה מוגזמת. בנוסף, ניתן לדמיין בקלות מורפולוגיה מיטוכונדריאלית ברקמות שונות על ידי שימוש במקדמים ספציפיים לרקמות כדי לבטא חלבונים פלואורסצנטיים ממוקדי מיטוכונדריה. כאן, myo-3p (למיטוכונדריה בשרירים), vha-6p (למיטוכונדריה במעי) ו-col-19p (למיטוכונדריה היפודרמלית) שימשו להנעת ביטוי של GFP ממוקד מיטוכונדריה (רצף לוקליזציה מיטוכונדריאלי של חלבון ATP-1). המיטוכונדריה של שרירי דופן הגוף של C. elegans מציגים מורפולוגיה צינורית, ומתיישרים לאורך סיבי שריר (מיופיברילים) (איור 1A); מיטוכונדריה במעי הראתה מבנים דמויי רשת מחוברים מאוד, עם יישור פחות אחיד (איור 1B); ולהיפודרמיס יש מיטוכונדריה צינורית שנראית מעוגלת יותר או בצורת אליפסה בהשוואה למעי או לשריר (איור 1C). המורפולוגיה המיטוכונדריאלית עקבית בדרך כלל לאורך התולעת בשריר ובמעי, אך ההיפודרמיס מציג כמה הבדלים קלים בקישוריות ההדדית של המיטוכונדריה בין הקצה הפרוקסימלי והדיסטלי של התולעת. לפיכך, כדי להשיג תוצאות ניסיוניות הניתנות לשחזור, מומלץ להתמקד באזור ספציפי בגופם. כאן, האזור שבין הלוע לפות ~100-200 מיקרומטר מתחת ללוע מצולם באופן עקבי.
עבור מיטוכונדריה של שרירים והיפודרמיס, הדמיה שלהם תחת מיקרוסקופ מורכב מספקת רזולוציה מספקת בשל שטוחות התאים ורמות נמוכות של אור לא ממוקד. עם זאת, קשה לצפות במיטוכונדריה של המעי באמצעות מיקרוסקופ מורכב, מאחר שהנפח הגדול של המעי מגביל את הרזולוציה עקב כמות גדולה של אור לא ממוקד מחלקים אחרים של המעי (איור 2). לכן, מומלץ לצלם מיטוכונדריה במעי תחת מיקרוסקופ קונפוקלי כדי להפחית אור לא ממוקד ולדמיין מורפולוגיה מיטוכונדריאלית תקינה.
צורת המיטוכונדריה דינמית מאוד ומשתנה בהתאם לסביבה המטבולית של בעלי החיים23 או אפילו עקב חשיפה לנוקשות מצע משתנה24. לכן, השארת בעלי חיים על מגלשות מיקרוסקופ לפרקי זמן ממושכים בהיעדר מקור מזון ועל מצע הזכוכית הנוקשה עלולה להשפיע על המורפולוגיה המיטוכונדריאלית. כאן, מחקר זה מצא כי המיטוכונדריה של תולעים מתפרקת לאחר כ-30 דקות על שקופית בתמיסת M9, כאשר המיטוכונדריה ההיפודרמלית מציגה את הפיצול הרב ביותר (איור 3). לכן, יש לבצע הדמיה של המיטוכונדריה במהירות לאחר הכנת הדגימה.
כימיקלים המגבילים את ניידות התולעים, כולל נתרן אזיד וטטרמיסול, משמשים בדרך כלל להדמיה חיה של C. elegans, שכן תולעים נייחות נדרשות ללכוד חתכי z מרובים של בעלי חיים לצורך הדמיה תלת מימדית. מחקרים קודמים הראו כי חשיפה לנתרן אזיד או טטרמיסול עלולה לגרום לפיצול מיטוכונדריאלי25. באופן מפתיע, נמצא כי לנתרן אזיד - אפילו בריכוזים גבוהים - הייתה השפעה מוגבלת על המורפולוגיה המיטוכונדריאלית בשריר או במעי. עם זאת, ההיפודרמיס הציג פיצול מיטוכונדריאלי מוקדם יותר מאשר בקרות M9 (איור 3). חשוב לציין, ריכוזים גבוהים של טטרמיסול (100 מ"מ) הביאו לפיצול מיטוכונדריאלי משמעותי מיד לאחר החשיפה בכל סוגי התאים. לשם השוואה, ריכוזים בינוניים (10 מ"מ) הביאו לפיצול מהיר יותר בהשוואה לביקורת M9. לריכוזים נמוכים (1 מ"מ) הייתה השפעה מוגבלת על המורפולוגיה המיטוכונדריאלית. נתונים אלה מצביעים על כך ששימוש בנתרן אזיד יכול להיות אופציה מעשית להדמיה מהירה של המיטוכונדריה, בעוד שבדרך כלל יש להימנע מטטרמיזול.
כצפוי, המיטוכונדריה של כל הרקמות של C. elegans מציגה פיצול במהלך תהליך ההזדקנות הטבעי (איור 4A). ניתן לדמיין את הפיצול כמיטוכונדריה המוצגים כמבנים קטומים וכדוריים יותר, השונים באופן דרמטי מהמיטוכונדריה הליניארית והצינורית המוצגת בבעלי חיים צעירים. חשוב לציין כי המעי אכן גדל במבנים אוטו-פלואורסצנטיים כדוריים בגיל מאוחר יותר, ולכן יש להקפיד לא לבלבל בין אוטו-פלואורסצנטי למבנים מיטוכונדריאלים בפועל. מכיוון שיכולה להיות שונות של שינויים במבנה המיטוכונדריאלי בין תולעים, חשוב לבצע כימות של מורפולוגיה מיטוכונדריאלית על גודל מדגם משמעותי ולא רק הדמיה של כמה תולעים. כאן נעשה שימוש ב-mitoMAPR, המאפשר כימות אוטומטי של מורפולוגיה מיטוכונדריאלית באמצעות קבוצה מגוונת של מדדים, כולל אובייקטים, רשתות, צמתים לכל רשת, נקודות צומת, אורך אובייקט, טביעת רגל מיטוכונדריאלית, כיסוי מיטוכונדריאלי ושטח אובייקט (טבלה משלימה 1 וטבלה משלימה 2). האוטומציה מסירה הטיה סובייקטיבית מהמשתמש. כאן, אנו מדווחים כי מדד אורך האובייקט הוא אופטימלי למדידה כמותית של השינויים במורפולוגיה המיטוכונדריאלית של השרירים והמעיים במהלך ההזדקנות, ומדדי נקודות צומת למדידת השינויים במורפולוגיה המיטוכונדריאלית ההיפודרמלית במהלך ההזדקנות (איור 4B).

איור 1: תמונות של מיטוכונדריה בכל הגוף של C. elegans. הדמיה מיטוכונדריאלית בוצעה לאורך כל היום 5 בעלי חיים בוגרים שגדלו על EV משלב L1 בבעלי חיים טרנסגניים עם ביטוי MLS::GFP בשריר (A), במעי (B) ובהיפודרמיס (C). סרגל קנה מידה: 100 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: השוואה של הדמיה מיטוכונדריאלית בין מיקרוסקופ מורכב למיקרוסקופ קונפוקלי. הדמיה מיטוכונדריאלית בוצעה בבעלי חיים בוגרים ביום 1 שגדלו על EV משלב L1 בבעלי חיים טרנסגניים עם ביטוי MLS::GFP בשריר (A), במעי (B) ובהיפודרמיס (C). סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
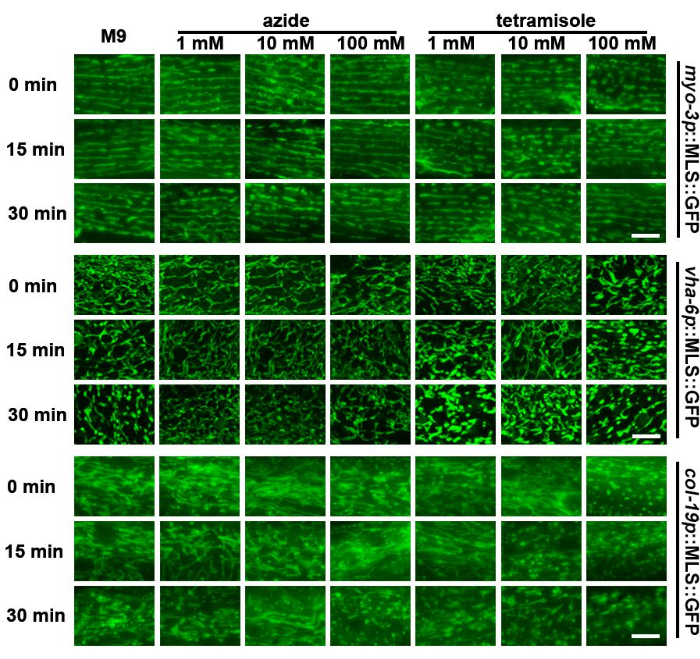
איור 3: הערכת פיצול מיטוכונדריאלי של רקמות שונות לאחר טיפול ב-M9, נתרן אזיד וטטרמיסול. הדמיה מיטוכונדריאלית בוצעה בבעלי חיים בוגרים ביום הראשון עם ביטוי של MLS::GFP בשרירים, במעי ובהיפודרמיס. בעלי חיים גודלו על EV משלב L1. בעלי חיים הונחו על מגלשות המכילות M9, נתרן אזיד (1 מ"מ, 10 מ"מ ו-100 מ"מ), או טטרמיסול (1 מ"מ, 10 מ"מ ו-100 מ"מ) וההדמיה בוצעה מיד לאחר הכנת השקופית (0 דקות) או 15 דקות או 30 דקות לאחר הכנת השקופית. תמונות מייצגות מוצגות עבור n > 5 בעלי חיים לזן עבור 2 שכפולים ביולוגיים. פסי קנה מידה: 5 מיקרומטר. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
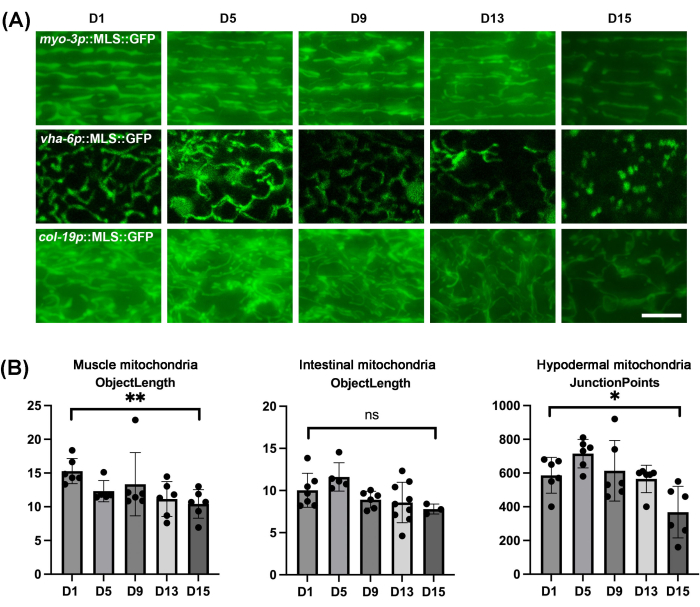
איור 4: הדמיה מיטוכונדריאלית של C. elegans במהלך הזדקנות ברקמות שונות וכימות מורפולוגיה מיטוכונדריאלית באמצעות MitoMAPR. (A) הדמיה מיטוכונדריאלית בוצעה בחיות בוגרות בימים 1, 5, 9, 13 ו-15 של הבגרות עם ביטוי של MLS::GFP בשריר, במעי ובהיפודרמיס. בעלי חיים גודלו על EV משלב L1 והועברו ללוחות EV המכילים FUDR משלב היום הראשון למבוגרים. התמונות מייצגות n ≥ 5 בעלי חיים לזן עבור ≥ 3 שכפולים ביולוגיים. סרגל קנה מידה: 5 מיקרומטר. (B) כימות אורך האובייקט של מיטוכונדריית השריר ומיטוכונדריית המעיים של תולעים בימים 1, 5, 9, 13 ו-15, וכימות נקודות הצומת של מיטוכונדריה תת-עורית של תולעים בימים 1, 5, 9, 13 ו-15. כל נקודות הנתונים הבודדות בשילוב עם ממוצע ± SD. גרפים שורטטו ונותחו סטטיסטית באמצעות מבחן t של תלמיד. ns = לא מובהק, *p < 0.03; **עמ' < 0.002; עמ' < 0.0002; עמ' < 0.0001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| ימים של תולעים | מספר תולעים | נפח המאגר (מ"ל) |
| 1 | 25 | 13 |
| 5 | 25 | 14 |
| 9 | 20 | 15 |
| 13 | 20 | 15 |
טבלה 1: מספר מומלץ של תולעים ונפחי חיץ בעת הכנת שקופיות.
איור משלים 1: זרימות עבודה של יישום כימות תמונה בודדת באמצעות MitoMAPR ועיבוד אצווה עבור תמונות מרובות. (A) זרימת עבודה של כימות המורפולוגיה המיטוכונדריאלית מתמונה בודדת באמצעות מאקרו MitoMAPR. (ב) הקרנת Z של קובץ תמונה תלת-ממדית גולמית באמצעות פיג'י (הקרנה מקסימלית). (C) חיתוך אזור העניין מהתמונה המוקרנת Z. (D) תמונות שלד שהתקבלו ממאקרו MitoMAPR. פסי קנה מידה: 5 מיקרומטר. (ה) זרימת עבודה של כימות המורפולוגיה המיטוכונדריאלית מתמונות מרובות באמצעות תהליך אצווה באמצעות מאקרו MitoMAPR. (F) צילום מסך של מאקרו חיתוך. (G) צילום מסך של תהליך אצווה עבור הקרנת Z. (H) צילום מסך של חלון אישור הבחירה של מאקרו חיתוך אצווה. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 1: ניתוח כמותי של מדדי מורפולוגיה מיטוכונדריאלית ברקמת השריר C. elegans . המדדים שנרשמו כוללים אובייקטים, רשתות, צמתים לכל רשת, נקודות צומת, אורך אובייקט, טביעת רגל מיטוכונדריאלית, שטח אובייקט וכיסוי מיטוכונדריאלי, הנמדדים על פני ימים שונים. הנתונים מספקים בסיס להערכת שינויים במורפולוגיה המיטוכונדריאלית עם ההזדקנות. אנא לחץ כאן להורדת קובץ זה.
טבלה משלימה 2: השפעות של כימיקלים משתקים על המורפולוגיה המיטוכונדריאלית ב - C. elegans. הנתונים כוללים מדידות כגון אובייקטים, רשתות, צמתים לכל רשת, נקודות צומת, אורך אובייקט, טביעת רגל מיטוכונדריאלית, שטח אובייקט וכיסוי מיטוכונדריאלי על פני ריכוזים ונקודות זמן משתנים לאחר הכנת הדגימה עם מאגר M9 או ריכוזים שונים של טטרמיזול ונתרן אזיד. אנא לחץ כאן להורדת קובץ זה.
Discussion
הדמיה פלואורסצנטית של מורפולוגיה מיטוכונדריאלית היא הדרך הנפוצה ביותר לקבוע שינויים במיטוכונדריה. בעוד שטכניקות מיקרוסקופיה מתקדמות כגון מיקרוסקופ אלקטרונים שידור (TEM), מיקרוסקופ כוח אטומי ומיקרוסקופ אלקטרונים קריו מציעות רזולוציה גבוהה יותר, מיקרוסקופיה פלואורסצנטית נשארת זולה ונגישה יותר לרוב החוקרים. בנוסף, ניתן לבצע מיקרוסקופיה פלואורסצנטית בתאים חיים, ובאורגניזמים מודלים שקופים כמו C. elegans, ניתן לבצע הדמיה בבעלי חיים שלמים26,27. הדמיה של C. elegans טרנסגנית היא די פשוטה, וסמנים פלואורסצנטיים מקודדים גנטית מאפשרים הדמיה אמינה וחזקה יותר של המיטוכונדריה מכיוון שהיא אינה דורשת עיבוד דגימות מורכב או סובלת מכתמים משתנים בין סוגי תאים או מצבים מצבעים מיטוכונדריאלים קונבנציונליים כמו MitoTracker או TMRE 28,29,30. סמנים פלואורסצנטיים מקודדים גנטית כוללים בדרך כלל תיוג ישיר של חלבונים מיטוכונדריאלים עם פלואורופורים או צימוד של פלואורופורים עם רצף לוקליזציה מיטוכונדריאלי מינימלי. מבנים אלה מונעים לרוב על ידי מקדמים ספציפיים לרקמות, המאפשרים הדמיה של מיטוכונדריה ברקמות שונות כמו רקמות שריר, מעי או היפודרמיס31. בדרך כלל, חלבונים אלה המתויגים פלואורסצנטית מתבטאים יתר על המידה, מה שעלול להיות בעל השפעות פיזיולוגיות לא רצויות אם חלבונים מיטוכונדריאלים באורך מלא מתבטאים יתר על המידה; לפיכך, רצפים מינימליים של MLS הם אפשרות טובה יותר32. עם זאת, אפילו עם ביטוי יתר של היתוך מינימלי של חלבון פלואורסצנטי MLS, יש להימנע מביטוי יתר גבוה, שכן ייבוא כמות גדולה של חלבון למיטוכונדריה יכול למוטט את הפוטנציאל של הממברנה המיטוכונדריאלית ולהשפיע על בריאות בעלי החיים33. בעוד שאפיון ממצה של כל זני C. elegans הזמינים כיום הוא מעבר להיקף כתב היד הזה, ניתוח השוואתי מפורט של מדווחים מיטוכונדריאלים רבים והיתרונות והחסרונות של כל אחד מהם ניתן למצוא כאן31.
עבור הדמיית תאים חיים של מיטוכונדריה ב - C. elegans, מיקרוסקופיה מורכבת סטנדרטית או שדה רחב עשויה להיות אפשרות מועדפת בשל המהירות והקלות הגבוהה של שיטות אלה על פני מיקרוסקופיה קונפוקלית. במחקר זה, הוכח כי תאים שטוחים כמו השריר והיפודרמיס מפיקים תועלת מינימלית ממיקרוסקופיה קונפוקלית, ומיקרוסקופיה מורכבת מאפשרת רכישה ברזולוציה מספקת כדי לדמיין מורפולוגיה מיטוכונדריאלית תקינה. תאים גדולים יותר כמו המעי הופכים את המיקרוסקופיה המורכבת למאתגרת בגלל אור לא ממוקד. לכן, מיקרוסקופיה קונפוקלית נדרשת להדמיה אמינה של מורפולוגיה מיטוכונדריאלית במעי.
שיקול חשוב בהדמיה תלת מימדית על פני כל עובי הרקמה בבעלי חיים הוא מניעת תנועת התולעים במהלך רכישת התמונה. חוקרים משתמשים לעתים קרובות בשיטות לשיתוק תולעים, כגון טטרמיזול או נתרן אזיד34. נתרן אזיד מעכב ציטוכרום c אוקסידאז (קומפלקס IV), אנזים קריטי בשרשרת הובלת האלקטרונים של המיטוכונדריה, מה שמוביל לשיתוק כללי עקב היעדר ATP הדרוש להתכווצויות שרירים ותפקודים תאיים אחרים34,35. טטרמיזול פועל על ידי חיקוי אצטילכולין בצמתים העצביים-שריריים, וגורם לדפולריזציה מתמשכת והתכווצות שרירים36. עם זאת, חשיפה לתרופות אלו עלולה לגרום לפיצול מיטוכונדריאלי על ידי גרימת מתח חמצוני23. במחקר זה נמצא כי טטרמיזול גרם במהירות רבה לפיצול מיטוכונדריאלי, אך לנתרן אזיד הייתה השפעה מוגבלת בהרבה.
C. elegans מציע דרך פשוטה וקלה מאוד לחקור את השפעת ההזדקנות על המורפולוגיה המיטוכונדריאלית בשל תוחלת החיים הקצרה שלו וקלות ההזדקנות של בעלי חיים. כאן, בחרנו להשתמש בחשיפה ל-FUDR, שהיא שיטה חזקה לעיקור כימי של בעלי חיים על ידי מניעת שכפול DNA 20,37,38. עם זאת, ל-FUDR עשויות להיות השפעות לא רצויות על פרמטרי הזדקנות ספציפיים, ולמי שמודאג מהשפעות מחוץ למטרה של FUDR, ניתן להשתמש באסטרטגיות אחרות להסרת צאצאים39. לדוגמה, ישנן מוטציות סטריליות, כולל מוטציה רגישה לטמפרטורה glp-4, או מוטציות חסרות זרע, כגון CF512 40,41,42. כחלופה, ניתן להזדקן בעלי חיים באופן טבעי על ידי בחירה ידנית של בוגרים מצאצאיהם מדי יום.
כימות השינויים במורפולוגיה המיטוכונדריאלית הוא גם שיקול חשוב מאוד, מכיוון שעשויה להיות שונות משמעותית במורפולוגיה המיטוכונדריאלית בין בעלי חיים. לכן, ביצוע ניתוח כמותי וסטטיסטיקה על פני גודל מדגם מספיק חיוני להסקת מסקנות משמעותיות על שינויים במורפולוגיה המיטוכונדריאלית. עם זאת, ניתוח וכימות תמונה יכולים לסבול מאוד מהטיה סובייקטיבית ואתגרים מהדמיית מבנים מורכבים מאוד כמו מיטוכונדריה מחוברים. לשם כך, הנה סיכום של שיטה אוטומטית לכימות מורפולוגיה מיטוכונדריאלית באמצעות מדדים רבים שפותחו על ידי מעבדת מאיר. MitoMAPR מאפשר כימות אובייקטיבי ואוטומטי של מורפולוגיה מיטוכונדריאלית, מדידת היבטים שונים של המיטוכונדריה, כולל הרשת המיטוכונדריאלית, אורך האובייקט, התפלגות, כיסוי הרשת וטביעת הרגל המיטוכונדריאלית. MitoMAPR הוא מאקרו חינמי עבור ImageJ ולכן הוא זמין לכל המעבדות עם מחשב פונקציונלי. היבט חשוב אחד בשימוש ב-MitoMAPR הוא ביצוע כימות על פני גודל מדגם גדול כדי לקבוע איזה מדד של מורפולוגיה מיטוכונדריאלית הוא החזק ביותר לקביעת שינויים בתנאי הניסוי הנבדקים43,44. כאן, נמצא שאורך האובייקט ונקודות הצומת הם המדדים הטובים ביותר לקביעת שינויים במהלך ההזדקנות בשריר, במעי ובהיפודרמיס. גישה חלופית לניתוח שינויים במורפולוגיה המיטוכונדריאלית היא יצירת ייצוגים תלת מימדיים של מיטוכונדריה מתמונות z-stack, ואחריה ניתוח תלת מימד16,45. ניתן להשיג זאת באמצעות תוכנה זמינה מסחרית, כגון Image-Pro Plus עם מודולי SharpStack Total Deconvolution ו-3D Constructor. הוכח כי כימות של ייצוגים מיטוכונדריאלים תלת מימדיים מספק תובנות מדויקות יותר לגבי צורת המיטוכונדריה ותכונות הרשת46. עם זאת, שיטה זו מורכבת ויקרה יותר מבחינה טכנית בהשוואה לגישה התלת-ממדית למחצה, הכוללת קריסת קטעי תמונה מרובים מערימת z בעלת שדה רחב או קונפוקלי להקרנה דו-ממדית אחת וניתוחם בכלים כמו mitoMAPR. מחקר זה מסכם את השימוש בביטוי עותק יחיד של GFP ממוקד מטריצה מיטוכונדריאלית ומפרט כמה מלכודות שיש להימנע מהן במהלך ההדמיה.
מגבלות ושיקולי זמן
למרות שמיקרוסקופיה קונפוקלית מומלצת לרקמות גדולות ועבות, כגון רקמת מעיים, טכניקות מיקרוסקופיה קונפוקליות סטנדרטיות לסריקת קו עשויות להיות איטיות מדי לביצוע הדמיה מהירה של המיטוכונדריה. זה נכון במיוחד בהתחשב בנתונים שלנו שמראים שהשארת תולעים על מגלשות לפרקי זמן ארוכים עלולה לגרום לפיצול המיטוכונדריה. למרות שטכנולוגיית המיקרוסקופיה הקונפוקלית התקדמה משמעותית, מיקרוסקופים שיכולים לבצע הדמיה מהירה, כגון דיסק מסתובב, Airyscan, או זה ששימש במחקר זה, יכולים להיות יקרים עבור מעבדות מסוימות. במקרים אלה, ניתן לשלב מיקרוסקופיה מורכבת עם שיטות פינוי חישוביות כדי להסיר אור לא ממוקד, כגון דה-קונבולוציה47.
כמו כן, כפי שתואר, MitoMAPR הוא מאקרו אוטומטי רב עוצמה למדידה כמותית של אורך המיטוכונדריה והחיבור ההדדי של הרשת המיטוכונדריאלית. עם זאת, יש להשתמש בו בזהירות בהתחשב במגבלות המפורטות כאן. ראשית, שימוש ב-GFP ממוקד מטריצה צופה רק בפיצול מיטוכונדריאלי של הממברנה הפנימית, מה שעשוי שלא לסכם באופן מלא את המורפולוגיה המיטוכונדריאלית של הממברנה החיצונית, מכיוון שאירועי ביקוע של הממברנה הפנימית יכולים להתרחש בהיעדר ביקוע הממברנה החיצונית. לפיכך, להדמיה מעודנת יותר של שני הממברנות, יש להשתמש גם בפלואורופור ממוקד מטריצה וגם בממברנה חיצונית מיטוכונדרית. מכיוון שסמני הממברנה המיטוכונדריאלית החיצונית יכולים לסבול מאותן השלכות כמו חלבונים מקומיים במטריקס אם הם מתבטאים יתר על המידה, מומלץ להשתמש בסמני עותק בודד, במיוחד אלה המשתמשים ברצפי לוקליזציה מיטוכונדריאלית מינימליים במקום חלבונים מלאים כמו אלה המשמשים כאן31.
כפי שמתואר באיור 3, מיטוכונדריה יכולה להתפצל במהירות תחת המיקרוסקופ, ושיטות שונות להכנת שקופיות דגימה יכולות להשפיע במידה רבה על המורפולוגיה בהתאם למאגר שבו נעשה שימוש. הנתונים המייצגים המתוארים בכתב יד זה מראים כי המיטוכונדריה של התולעים עוברת פיצול מינימלי מתחת ל-M9 וריכוזים נמוכים של נתרן אזיד. טטרמיסול, כימיקל נוסף בשימוש נרחב לשיתוק תולעים, מפרק במהירות את המיטוכונדריה, מה שמצביע על כך שיש להימנע מהשימוש בו באופן כללי. למרות ש-M9 ונתרן אזיד לא הראו פיצול משמעותי של המיטוכונדריה, חשוב לציין שזנים שונים עשויים להגיב בצורה שונה מהתוצאות המוצגות כאן. בעוד שמחקרים אחרים הראו כי נתרן אזיד יכול לפרק מיטוכונדריה, ייתכן שהזנים שלנו אינם מראים פיצול מיטוכונדריאלי משמעותי עם חשיפה לנתרן אזיד בשל רמת הביטוי הנמוכה של המבנים שלנו. ביטוי גבוה של חלבונים מקומיים במיטוכונדריה יכול למוטט את פוטנציאל הממברנה, ולכן, זנים שונים ששימשו במחקרים אחרים עשויים להפוך את המיטוכונדריה לרגישים יותר לפיצול מאותם ריכוזים של נתרן אזיד ששימשו במחקר זה. בלי קשר, יש להקפיד על כך שכימיקלים המשתקים תולעים אינם גורמים לפיצול מיטוכונדריאלי בתנאים ספציפיים שייבדקו לפני השימוש בכל המחקרים, מכיוון שמוטציות או מצבים ספציפיים עשויים להיות רגישים יותר לפיצול מיטוכונדריאלי הנגרם על ידי תרופות. יתר על כן, אפילו השארת התולעים ב-M9 יכולה לגרום לשינויים במורפולוגיה ובפעילות המיטוכונדריאלית הטבעית שלהן מכיוון שפעילות השחייה שלהן במאגר M9 הוכחה בעבר כמשפיעה על ביקוע המיטוכונדריה ודינמיקת ההיתוך. בנוסף, השארת תולעים ב-M9 לפרקי זמן ארוכים יכולה להפעיל תגובות היפוקסיה המשפיעות באופן משמעותי על המיטוכונדריה על ידי גרימת שיבושים בפרוטאאוסטזיס במיטוכונדריה48,49.
לבסוף, שיקול חשוב נוסף הוא שבעוד ששינויים במורפולוגיה המיטוכונדריאלית קשורים לעתים קרובות לשינויים בתפקוד המיטוכונדריה, לא תמיד יש מתאם ישיר בין השניים. לפיכך, מומלץ ניתוח מעמיק יותר של תפקוד המיטוכונדריה. לדוגמה, ניתן למדוד את קצב צריכת החמצן באמצעות מכשיר סוסון ים50, ניתן למדוד את פוטנציאל הממברנה המיטוכונדריאלית באמצעות צבעים בעלי פוטנציאל ממברנה כגון JC9 או TMRE51, ניתן למדוד את מצב החמצון המיטוכונדריאלי באמצעות צבעים רגישים לחמצון חיזור כגון roGFP52, וניתן למדוד את עמידות המתח המיטוכונדריאלי באמצעות רגישות לגורמי לחץ כגון רוטנון53. מכיוון שהדמיה של מיטוכונדריה יכולה להיות מהירה למדי, אנו מציעים את השיטות כאן כמעבר ראשון קל כדי לקבוע אם תנאי הניסוי משפיעים על המורפולוגיה המיטוכונדריאלית. שיטות אלה מתאימות אפילו לסריקה בקנה מידה גדול של תרופות או גנים, עם מעקב אחר ניתוח מיטוכונדריאלי יסודי יותר באמצעות מדדים נוספים מומלצים. בסך הכל, כאן אנו סוקרים את מה שנחשב לשיטות הפשוטות ביותר להדמיית מורפולוגיה מיטוכונדריאלית ב - C. elegans עם מינימום שגיאות ניסוי.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
ג'יי קיי נתמך על ידי מלגת פרובוסט של אוניברסיטת דרום קליפורניה; M.A. ו-G.G. נתמכים על ידי T32AG052374; MV נתמך על ידי 1R25AG076400; ו-R.H.S. נתמך על ידי R01AG079806 מהמכון הלאומי להזדקנות ו-2022-A-010-SUP מקרן לארי ל. הילבלום. חלק מהזנים סופקו על ידי CGC, הממומן על ידי מענק P40 OD010440 של משרד תוכניות תשתיות המחקר של ה-NIH. חלק מניתוח הגנים בוצע באמצעות Wormbase, הממומן על ידי HG002223 מענק U41.
Materials
| Name | Company | Catalog Number | Comments |
| 5-fluoro-2'-deoxyuridine (FUDR) | Spectrum Chemical | F2026-10GMBL | for proliferation inhibition |
| APEX IPTG | Genesee | 18-242 | for RNAi |
| Bacto Agar | VWR | 90000-764 | for NGM plates |
| Bacto Peptone | VWR | 97064-330 | for NGM plates |
| Calcium chloride dihydrate | VWR | 97061-904 | for NGM plates |
| Carbenicillin | VWR | 76345-522 | for RNAi |
| Cholesterol | VWR | 80057-932 | for NGM plates |
| Confocal microscope | Stellaris 5 | ||
| DMSO | VWR | BDH1115-1LP | solvent for drugs |
| HistoBond microscope slides | VWR | 16005-110 | for slides preparation |
| LB Broth | VWR | 95020-778 | for LB |
| LEICA S7E Dissecting Scope | Leica | 10450840 | Standard dissecting microscope |
| LEICA STELLARIS 5 | Leica | 158101100 | Confocal Microscope |
| LEICA THUNDER | Leica | 11525679 | Compound Microscope |
| Magnesium sulfate heptahydrate | VWR | 97062-132 | for NGM plates, M9 |
| pL4440 empty vector plasmid | addgene | plasmid #1654 | for empty vector plasmid |
| Potassium Chloride | VWR | 97061-566 | for bleach soluton |
| Potassium phosphate dibasic | VWR | EM-PX1570-2 | for NGM plates |
| Potassium phosphate monobasic | VWR | EM-PX1565-5 | for M9 |
| Sodium azide | VWR | 97064-646 | for paralyzing worms |
| Sodium Chloride | VWR | EM-SX0420-5 | for NGM plates, M9 |
| Sodium hypochlorite | VWR | RC7495.7-32 | for bleach solution |
| Sodium phosphate dibasic | VWR | 71003-472 | for M9 |
| Tetracycline hydrochloride | VWR | 97061-638 | for RNAi |
| WOB-L® Dry Vacuum Pumps, Standard-Duty, Welch® | VWR | 80077-612 | for aspiration |
References
- Protasoni, M., Zeviani, M. Mitochondrial structure and bioenergetics in normal and disease conditions. Int J Mol Sci. 22 (2), 586 (2021).
- Wang, Y., et al. The role of mitochondrial dynamics in disease. MedComm. 4 (6), e462 (2023).
- Kamer, K. J., Mootha, V. K. The molecular era of the mitochondrial calcium uniporter. Nat Rev Mol Cell Biol. 16 (9), 545-553 (2015).
- Chen, W., Zhao, H., Li, Y. Mitochondrial dynamics in health and disease: mechanisms and potential targets. Signal Transduct Target Ther. 8 (1), 333 (2023).
- Adebayo, M., Singh, S., Singh, A. P., Dasgupta, S. Mitochondrial fusion and fission: The fine-tune balance for cellular homeostasis. FASEB J. 35 (6), e21620 (2021).
- Madan, S., Uttekar, B., Chowdhary, S., Rikhy, R. Mitochondria lead the way: mitochondrial dynamics and function in cellular movements in development and disease. Front Cell Dev Biol. 9, 781933 (2021).
- Sharma, A., Smith, H. J., Yao, P., Mair, W. B. Causal roles of mitochondrial dynamics in longevity and healthy aging. EMBO Rep. 20 (12), e48395 (2019).
- Rolland, S. G., Lu, Y., David, C. N., Conradt, B. The BCL-2-like protein CED-9 of C. elegans promotes FZO-1/Mfn1,2- and EAT-3/Opa1-dependent mitochondrial fusion. J Cell Biol. 186 (4), 525-540 (2009).
- Labrousse, A. M., Zappaterra, M. D., Rube, D. A., van der Bliek, A. M. C. elegans dynamin-related protein DRP-1 controls severing of the mitochondrial outer membrane. Mol Cell. 4 (5), 815-826 (1999).
- Dickinson, D. J., Pani, A. M., Heppert, J. K., Higgins, C. D., Goldstein, B. Streamlined genome engineering with a self-excising drug selection cassette. Genetics. 200 (4), 1035-1049 (2015).
- Bosher, J. M., Labouesse, M. RNA interference: Genetic wand and genetic watchdog. Nat Cell Biol. 2 (2), E31-E36 (2000).
- Yu, C. C. J., et al. Expansion microscopy of C. elegans. eLife. 9, e46249 (2020).
- Zhang, S., Li, F., Zhou, T., Wang, G., Li, Z. Caenorhabditis elegans as a useful model for studying aging mutations. Front Endocrinol. 11, 554994 (2020).
- Dingley, S., et al. Mitochondrial respiratory chain dysfunction variably increases oxidant stress in Caenorhabditis elegans. Mitochondrion. 10 (2), 125-136 (2010).
- Presley, A. D., Fuller, K. M., Arriaga, E. A. MitoTracker Green labeling of mitochondrial proteins and their subsequent analysis by capillary electrophoresis with laser-induced fluorescence detection. J Chromatogr B Anal Technol Biomed Life Sci. 793 (1), 141-150 (2003).
- Mitra, K., Lippincott-Schwartz, J. Analysis of mitochondrial dynamics and functions using imaging approaches. Curr Protoc Cell Biol. Chapter 4, Unit 4.25.1-Unit 4.25.21 (2010).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. Novel imaging tools to study mitochondrial morphology in Caenorhabditis elegans. Life Sci Alliance. 7 (11), e202402918 (2024).
- Benedetti, C., Haynes, C. M., Yang, Y., Harding, H. P., Ron, D. Ubiquitin-like protein 5 positively regulates chaperone gene expression in the mitochondrial unfolded protein response. Genetics. 174 (1), 229-239 (2006).
- Begelman, D. V., et al. An aco-2::gfp knock-in enables the monitoring of mitochondrial morphology throughout C. elegans lifespan. microPublication Biol. 2022, (2022).
- Castro Torres, T., et al. Surveying low-cost methods to measure lifespan and healthspan in Caenorhabditis elegans. J Vis Exp. 183, e64091 (2022).
- Rasmussen, N. R., Reiner, D. J. Nuclear translocation of the tagged endogenous MAPK MPK-1 denotes a subset of activation events in C. elegans development. J Cell Sci. 134 (17), jcs258456 (2021).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Luz, A. L., et al. Mitochondrial morphology and fundamental parameters of the mitochondrial respiratory chain are altered in Caenorhabditis elegans strains deficient in mitochondrial dynamics and homeostasis processes. PLoS One. 10 (6), e0130940 (2015).
- Oorloff, M., et al. Mechanical stress through growth on stiffer substrates impacts animal health and longevity in C. elegans. bioRxiv. , (2024).
- Chu, X., Wu, S., Raju, R. NLRX1 regulation following acute mitochondrial injury. Front Immunol. 10, 2431 (2019).
- Shah, P., Bao, Z., Zaidel-Bar, R. Visualizing and quantifying molecular and cellular processes in Caenorhabditis elegans using light microscopy. Genetics. 221 (4), iyac068 (2022).
- Wang, Y., Wang, P., Li, C. Fluorescence microscopic platforms imaging mitochondrial abnormalities in neurodegenerative diseases. Adv Drug Deliv Rev. 197, 114841 (2023).
- Ding, J., et al. An expanded GCaMP reporter toolkit for functional imaging in Caenorhabditis elegans. G3 (Bethesda, Md). 13 (10), jkad183 (2023).
- Sarasija, S., Norman, K. R. Analysis of mitochondrial structure in the body wall muscle of Caenorhabditis elegans. Bio-Protocol. 8 (7), e2801 (2018).
- Chaweeborisuit, P., Suriyonplengsaeng, C., Suphamungmee, W., Sobhon, P., Meemon, K. Nematicidal effect of plumbagin on Caenorhabditis elegans: A model for testing a nematicidal drug. Z Naturforsch C J Biosci. 71 (5-6), 121-131 (2016).
- Valera-Alberni, M., Yao, P., Romero-Sanz, S., Lanjuin, A., Mair, W. B. . Novel imaging tools to study mitochondrial dynamics in Caenorhabditis elegans. 7, 11 (2024).
- Bolognesi, B., Lehner, B. Reaching the limit. eLife. 7, e39804 (2018).
- Jishi, A., Qi, X. Altered mitochondrial protein homeostasis and proteinopathies. Front Mol Neurosci. 15, 867935 (2022).
- Morton, K. S., Wahl, A. K., Meyer, J. N. The effect of common paralytic agents used for fluorescence imaging on redox tone and ATP levels in Caenorhabditis elegans. PLoS One. 19 (4), e0292415 (2024).
- Noumi, T., Maeda, M., Futai, M. Mode of inhibition of sodium azide on H+-ATPase of Escherichia coli. FEBS Lett. 213 (2), 381-384 (1987).
- Siete, C., Xiong, R., Khalid, A., Hsieh, Y. -. W., Chuang, C. -. F. Immobilization of C. elegans with different concentrations of an anesthetic for time-lapse imaging of dynamic protein trafficking in neurons. microPublication Biology. 2024, (2024).
- Mitchell, D. H., Stiles, J. W., Santelli, J., Sanadi, D. R. Synchronous growth and aging of Caenorhabditis elegans in the presence of fluorodeoxyuridine. J Gerontol. 34 (1), 28-36 (1979).
- Santi, D. V., McHenry, C. S. 5-Fluoro-2'-deoxyuridylate: covalent complex with thymidylate synthetase. Proc Natl Acad Sci U S A. 69 (7), 1855-1857 (1972).
- Wang, H., Zhao, Y., Zhang, Z. Age-dependent effects of floxuridine (FUdR) on senescent pathology and mortality in the nematode Caenorhabditis elegans. Biochem Biophys Res Commun. 509 (3), 694-699 (2019).
- Beanan, M. J., Strome, S. Characterization of a germ-line proliferation mutation in C. elegans. Development (Cambridge, England). 116 (3), 755-766 (1992).
- Austin, J., Kimble, J. glp-1 is required in the germ line for regulation of the decision between mitosis and meiosis in C. elegans. Cell. 51 (4), 589-599 (1987).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Zhang, Y., et al. Neuronal TORC1 modulates longevity via AMPK and cell nonautonomous regulation of mitochondrial dynamics in C. elegans. eLife. 8, e49158 (2019).
- Dutta, N., et al. Investigating impacts of the mycothiazole chemotype as a chemical probe for the study of mitochondrial function and aging. GeroScience. 46 (6), 6009-6028 (2024).
- Tronstad, K., et al. Regulation and quantification of cellular mitochondrial morphology and content. Curr Pharm Des. 20 (35), 5634-5652 (2014).
- Nikolaisen, J., et al. Automated quantification and integrative analysis of 2D and 3D mitochondrial shape and network properties. PLoS One. 9 (7), e101365 (2014).
- Lee, J. S., Wee, T. L. E., Brown, C. M. Calibration of wide-field deconvolution microscopy for quantitative fluorescence imaging. J Biomol Tech. 25 (1), 31-40 (2014).
- Hong, M., Kwon, J. Y., Shim, J., Lee, J. Differential hypoxia response of hsp-16 genes in the nematode. J Mol Biol. 344 (2), 369-381 (2004).
- Yan, J., Sun, C. L., Shin, S., Van Gilst, M., Crowder, C. M. Effect of the mitochondrial unfolded protein response on hypoxic death and mitochondrial protein aggregation. Cell Death Dis. 12 (7), 711 (2021).
- Koopman, M., et al. A screening-based platform for the assessment of cellular respiration in Caenorhabditis elegans. Nat Protoc. 11 (10), 1798-1816 (2016).
- Shpilka, T., et al. UPRmt scales mitochondrial network expansion with protein synthesis via mitochondrial import in Caenorhabditis elegans. Nat Comm. 12 (1), 479 (2021).
- Braeckman, B. P., Smolders, A., Back, P., De Henau, S. In vivo detection of reactive oxygen species and redox status in Caenorhabditis elegans. antioxidants & redox signaling. 25 (10), 577-592 (2016).
- Bar-Ziv, R., et al. Measurements of physiological stress responses in C. elegans. J Vis Exp. 159, e61001 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved