Method Article
インビボ ルシフェラーゼを発現するAxenic Amastigotesの歯肉接種による Leishmania乳児感染ハムスターのイメージング
要約
ここでは、腹腔内(IP)または歯肉内(IG)を介して L.infantum-Lucに感染したゴールデンハムスターの縦断的評価を、生物発光イメージングとPCRによって紹介します。ハムスターは、感染の1日後(1 dpi)、感染の1週間後(8 dpi)、および感染の3週間後(22 dpi)に評価され、50dpi および感染後8か月で安楽死させました。
要約
米国被皮性リーシュマニア症(ATL)および内臓リーシュマニア症(VL)は、世界保健機関(WHO)によって無視されていると考えられています。VLは治療しないと致命的となる可能性があります。治療に使用される薬は有毒であり、耐性の場合があります。前臨床試験は、動物モデル、使用する菌株、接種経路によっては、治療用の新薬を発見する際のボトルネックとなることがあります。ゴールデンハムスターは、 Viannia 亜属および Leishmania 種に対する高い感受性で際立っており、ヒトの疾患で観察される臨床的および免疫病理学的プロセスの多くを示しています。
尻尾と手足が短いハムスターの解剖学では、通常、 リーシュマニアの静脈注射には心臓内ルートが選択されます。しかし、それは出血を引き起こし、最終的には動物の死につながる可能性のある接種物です。したがって、私たちは、低侵襲で、静脈へのアクセスが容易で、動物に局所的および全身的な損傷を引き起こさない、歯肉静脈での感染に対する代替の静脈内接種ルートを標準化しました。したがって、腹腔内(IP)または歯肉内(IG)経路でルシフェラーゼ(Luc)を発現する Leishmania Infantum に感染したハムスターを、生物発光イメージングシステムにより22日間、感染後50日間および8か月後にPCRで追跡した。
L. infantum-Lucの無軸性アマスティゴテスとプロマスティゴテスの両方に歯肉接種を行った後、注射部位での生物発光は少なくとも2週間制限されました。これは、歯肉神経叢周囲の組織への感染の指標です。L. infantum-Lucに腹腔内に感染したハムスターは、予想通り腹部全体に分散した生物発光を示した。しかし、生物発光イメージングシステムにより、感染は50dpiまで減少し、PCRによってのみ検出可能でした。無菌性無菌は、PCRで評価されたように、前胸茎動物よりも良好な感染を示しました。実際、感染から8ヶ月後には、無菌性アマスティゴテスを接種した動物の肝臓でPCRにより寄生虫が静脈内経路で検出されましたが、これは、感染がゆっくりと進行し、生物発光イメージングの解像度よりも低い寄生虫負荷を示すL. infantum MHOM/BR/1974/PP75の参照株の特徴である可能性があります。したがって、無菌性無力症は、前胸茎よりも感染およびフォローアップに適した選択肢であり、歯肉接種物はリーシュマニアや他の病原体の静脈内注射の実行可能な経路です。
概要
リーシュマニア症は、ラテンアメリカ、北アフリカ、東アフリカ、西アジア、東南アジアの4つの中央生態疫学地域のいくつかの国で風土病である20種以上の リーシュマニアによって引き起こされる顧みられない再興性疾患と考えられています1。それらは、被蓋(TL)と内臓リーシュマニア症(VL)に分類でき、治療しないと致命的です。ブラジルにおけるVLの病原体は Leishmania infantumであり、治療は五価アンチモンまたはアムホテリシンBを用いて行われる。これらの薬剤は静脈内投与され、毒性が高く、副作用がみられ、耐性の症例もあります2。
したがって、新しい化学療法の検索に投資する必要があります。実際、前臨床試験は、動物モデル、使用する菌株、接種経路、その他のロジスティック、技術、運用上の要因によっては、VL治療のための新薬の発見におけるボトルネックとなっています。ゴールデンハムスターは、VianniaおよびLeishmania亜属の種に対する高い感受性で際立っており、Leishmania braziliensis 3,4の以前の研究で観察されたように、ヒトの疾患で観察された臨床的および免疫病理学的プロセスの多くを示しています。L. infantumに感染したハムスターは、貧血、白血球減少症、血小板減少症、肝脾腫など、ヒトおよびイヌ5のVLに特徴的な免疫病理学的プロセスのほとんども発症する。また、ゴールデンハムスターは近交系動物であり、一様な反応を示さず、ヒトに見られるような臨床症状の不均一性を再現しています3。
感染結果について考慮すべき別の側面は、L. infantum株と接種経路です。L. infantumのいくつかの系統は、遺伝的背景と治療に対する感受性が異なります2,6,7。一部の株は、前胸炎感染後の肝臓と脾臓への寄生負荷が低く、無菌性アマスティゴテスは、あまり研究されていない感染を改善するための代替手段になる可能性があります。実際、静脈内経路は感染を促進し、臨床徴候を示す動物の頻度を増加させます。しかし、腹腔内接種が最も使用されています。心臓内経路は、L. infantum 5,8,9 による静脈内感染の選択肢です。しかし、ハムスターでは、歯肉内接種は静脈注射の代替ルートであり、感染部位とは記載されていません。報告されているにもかかわらず、歯肉静脈穿刺は侵襲性が最小限で、静脈へのアクセスが容易で、局所的および全身的な損傷をほとんど引き起こしません10。歯肉静脈穿刺は、動物の健康を維持しながら、結果の質と適用性を最大化するための推奨事項に最も同意します11。
従来の方法を用いたVLの化合物の前臨床評価には、より多くの動物が必要であり、組織病理学的分析や組織内の寄生虫負荷の評価のために安楽死させる必要があります。対照的に、生物発光イメージングシステムは、前臨床試験をスピードアップし、動物の数を減らすことができます。感染した組織の生物発光部位は、同じ動物で数週間にわたってリアルタイムで追跡することができます。この重要な技術ツールの標準化に関するいくつかの研究は、Trypanosoma cruzi、Leishmania spp.、およびToxoplasma gondiiに感染したマウスを用いた研究でその応用を示しています12,13,14,15。しかし、組織中の寄生虫の負荷によっては、in vivoイメージングシステムでは生物発光が過小に検出されないことがあり、罹患臓器の定量的PCRによる評価が必要です。したがって、私たちは、ルシフェラーゼを発現するL.infantumの静脈内注射に基づく方法論を開発することを提案します ゴールデンハムスターの歯肉静脈で、生物発光イメージングシステムとPCRによるフォローアップのために。
プロトコル
ハムスターに関するプロトコルは、Instituto Oswaldo Cruz/IOC Committee of Ethics in Animal Research(承認:CEUA/IOC L-015/2022)のガイドラインに従っていました。
1. ホタルルシフェラーゼ遺伝子の リーシュマニア 発現プラスミドへのクローニング
- プラスミドpLEXSY-hyg2をBglII(10 U/μL)およびNotI(10 U/μL)エンドヌクレアーゼで消化します。まずBglIIで消化します:プラスミド50μL(DNA9μg)、制限酵素緩衝液30μL、ウシ血清アルブミン(BSA)3μL、BglII3μL、およびヌクレアーゼフリー水を加えて、最終容量300μLにします。37°Cで3時間インキュベートします。
- BamHI(10 U/μL)およびNotIでTOPOII/LUCプラスミドを消化し、TOPOIIベクター16にクローニングしたKozak配列(Kozak-LUC)を含むホタルルシフェラーゼオープンリーディングフレームを放出します。最初にBamHIで消化します:100μLのプラスミド(8.5μgのDNA)と30μLの制限酵素バッファーを混合します。BSA 3 μL、BamHI 3 μL、ヌクレアーゼフリー水で最終容量 300 μL まで。37°Cで3時間インキュベートします。
- シリカメンブレン上で各プラスミドをクリーンアップし、DNAを50 μLの水で2回溶出して、最終容量を100 μLにします。
- 以前に直鎖化されたpLEXSY-hyg2およびTOPOII/LUCプラスミドをNotIでダブルダイジェストします。シリカメンブレンから溶出したDNA100μLをバッファーD15μL、NotI2μL、ヌクレアーゼフリー水と混合して最終容量150μLにします。37°Cで1時間インキュベートします。
- トリス酢酸EDTA(TAE)バッファーによる電気泳動後、1%アガロースゲルから二重消化ベクター(pLEXSY-hyg2)とインサートKozak-LUCをゲル精製します。メスで~8kbと1.6kbのバンドを切除します。スライスを秤量し、1容量のゲルに3容量のバッファーを加え、50°Cでインキュベートしてゲルを溶解し、シリカメンブレンに移し、DNAを20 μLの水で2回洗浄して溶出し、最終容量を40 μLにします。
- 二重消化ベクター(pLEXSY-hyg2)とインサートKozak-LUCをT4リガーゼでライゲーションします:2 μLのベクターとインサートを混合します。どちらも55 ng/μL、モル比1:5です。5 μL のライゲーションバッファーを添加します。1 μL の T4 DNA リガーゼ (1U/mL)、最終容量 10 μL16°Cで一晩インキュベートします。
- 10 μLのライゲーション反応に40 μLのヌクレアーゼフリー水を加え、10容量のブタノールでDNAを沈殿させます。マイクロ遠心分離機で最高速度で10分間遠心分離し、ペレットを70%エタノールで洗浄し、最高速度で10分間遠心分離し、ペレットをベンチで乾燥させ、4μLの水を加えます。
- ライゲーション反応液4μLをエレクトロコンピテントバクテリアJM109(40μL)と混合し、キュベット(d = 0.2 cm)に移し、氷上に保持します。2,500 V、200 Ω、25 μFでエレクトロポレートし、キュベットを氷に入れ、1 mLのLB培地を加えます。直ちに混合物を15 mLコニカルチューブに移し、37°Cで60分間、100 rpmでインキュベートします。
- 混合物を2枚のLB寒天/アンピシリン(100 μg/mL)プレート(1枚は200 μL、もう1枚はエレクトロポレーション細菌全体)にプレートします。形質転換細菌を2,000 × g で10分間遠心分離して容量を濃縮し、ペレットを100 μLに再懸濁し、全容量/ペレットをプレート化します。プレートを30°Cで24〜30時間インキュベートし、クローンが成長するのを待ちます。
- つまようじでクローンを選択し、5 mLのLB/アンピシリン(100 μg/mL)培地を含む50 mLのコニカルチューブに移します。30°C、100rpmで20-24時間インキュベートし、ミニプレップ培養物を増殖させます。
- miniprepキットでプラスミドを精製し、DNAを30 μLの水で溶出します。コンストラクトpLESXY-LUC-hyg2を含むクローンをBamHIによる分解によりスクリーニングします。
- miniprepから10 μLのDNAを混合します。2 μL の制限酵素バッファー;0.2 μL の BSA: 1 μL の BamHI とヌクレアーゼフリーの水で最終容量 20 μL まで。1% アガロースゲル電気泳動:3,450 および 6,290 塩基対で、ポジティブクローンのフラグメントを 37 °C で 1 時間インキュベートします。
- maxiprep培養物を調製して、コンストラクトpLESXY-LUC-hyg2を大規模に精製します。三角(1 L)、アンピシリンを添加したLB培地250 mL、およびJM109をトランスフェクトしたminiprep1 mLを1 mL加え、30°C、200 rpmで18-20時間インキュベートします。
2. ルシフェラーゼを発現するリーシュマニアインファンタム の作製と選抜
- Leishmaniaインテグレーションカセットをリリースするには、プラスミドpLESXY-LUC-hyg2をSwaIで制限消化して完了させます。40 μL のプラスミド (50 μg)、10 μL の高速消化バッファー、4 μL の SwaI、およびヌクレアーゼフリーの水を 100 μL の最終容量に加えます。30°Cで一晩インキュベートします。
- エタノールで沈殿させ、70%エタノールで一度洗浄し、50μLの水で再懸濁し、氷上に保持します。
- 遠心分離機 Leishmania MHOM/BR/1974/PP75 promastigotesを1,000 × g で10分間、シュナイダー培地で指数関数的に増殖させます。ペレットを脳および心臓輸液(BHI)培地で洗浄し、1,000 × g で10分間遠心分離します。ペレットをBHIで108 プロマスチゴット/ mLに再懸濁します。
- L. infantum promastigotes (500 μL) を pLESXY-LUC-hyg2 統合カセット体 (50 μg) とエレクトロポレーションキュベット (d = 0.4 cm) で氷上で混合します。1,500 V/25 μ Fと10秒間隔の2パルスでエレクトロポレーションします。脈拍後、10分間氷の上に保ちます。
- トランスフェクションしたプロマスティゴテスを、20% FCSを添加したシュナイダー培地を26°Cでフラスコに移します。 24時間後、まずハイグロマイシンを50 μg/mLに加え、48時間後に100 μg/mLに増量し、1週間後に150 μg/mLに増やします。
- L. infantum-Lucのプロマスタゴテスを、20% FCSおよび150 μg/mLのハイグロマイシンを添加したシュナイダーズを用いた96ウェルプレートでの限定希釈によりトランスフェクトした。26°Cでインキュベートしてクローンを増殖させます。
- マイクロプレートリーダーで、生物発光発光相対発光ユニット(RLU)により、遺伝的に均質で発現力の高い L. infantum-Lucを選抜するスクリーニングクローン。
- 簡単に説明すると、25 mM HEPES pH 7.8、15 mM MgCl2、4 mM EGTA、1 mM DTT、1 μg/mL BSA、2.5 mM ATP、0.1% Triton X-100、および 300 μM コエンザイム A からなるバッファー中の 100 μL の基質 D-ルシフェリン (300 μg/mL) と白色 96 ウェルプレートに 10 μL のプロマスティゴットを混合し、直ちにマイクロプレートリーダーで評価します。
3. 18S rRNA(ssu)リボソーム遺伝子座へのゲノム統合を評価するためのPCR
- ルシフェラーゼと野生型を発現する前胸茎からゲノムDNAを精製します(10、8)。15 mLのコニカルチューブでプロマスティゴットを1,000 × g で10分間遠心分離し、ペレットにリン酸緩衝生理食塩水(PBS)を加え、ノイバウアーチャンバーでカウントし、1,000 × gで10分間遠心分離します。溶解バッファー(100 mM NaCl、10 mM Tris、25 mM EDTA、0.5% SDS、0.1 mg/mL プロテイナーゼK)でペレットを108/mLの密度で再懸濁します。56°Cで一晩インキュベートします。
- 1容量のフェノール/クロロホルム/イソアミルアルコール、25:24:1(v / v)と1容量のクロロホルムを使用して、2サイクルのDNAクリーンアップを実行します。各抽出サイクルの間に、水相を新しいチューブに移し、2,000 × g で10分間遠心分離します。
- DNAを2容量のエタノールで沈殿させ、5,000 × g、10分間、4°Cで遠心分離します。 70%エタノール1mLを加え、マイクロチューブに移し、15,000 × g で5分間遠心分離します。
- 70%エタノールで2回目の洗浄を行います。遠心分離後、上清を捨て、ベンチでペレットを乾燥させます。
- ゲノムDNAを50-100μLの超純水で65°Cのウォーターバスで30分間再水和し、DNAを定量し、-20°Cで保存します。
- 次のPCR反応を設定することにより、 Leishmania ゲノムへのpLEXSYカセットの統合を評価するための診断PCRを実施します:10 μLのPCRバッファー、0.2 mM dNTP、1 UのDNAポリメラーゼ、1 μgのゲノムDNA、各プライマーの0.5 μM、およびヌクレアーゼフリー水の最終容量50 μLに設定します。
- pLEXSYベクターおよび Leishmania ゲノムでハイブリダイズするプライマーを選択します:(1)aprtリバースプライマーA1715 5'-TATTCGTTGTCAGATGGCGCAC-3'、utr1(aprt)領域でハイブリダイズします。(2) リーシュマニア 染色体18SrRNA(ssu)遺伝子座のssuフォワードプライマーF3001 5'-GATCTGGTTGATTCTGCCAGTAG-3'。
- 次の増幅プロトコルを使用してください:94°Cで2分間の変性を1サイクル行います。30サイクルの増幅、94°Cで30秒、60°Cで30秒、72°Cで1分。72°Cで10分間の最終延長。 PCR産物の予想サイズは1.1Kbです。
- (1)hygフォワードプライマーA3804 5'-CCGATGGCTGTAGAAGTACTCG-3、および(2)ssuリバースプライマーF3002 5'-CTGCAGGTTCACCTACAGCTAC-3'を使用し、これらはpLEXSYベクターの耐性マーカーと リーシュマニア ゲノムの18SrRNA(ssu)遺伝子座でハイブリダイズします。ステップ 3.6.2 で説明したものと同じ PCR プロトコルを使用しますが、アニーリング温度を 60 °C ではなく 53 °C にします。 期待されるプロダクトは1.8 kb(hyg-3'ssu)です。
- 1% アガロースゲル電気泳動により PCR 産物を分析し、 L. infantum ゲノムのリボソーム 18S rRNA 遺伝子座に組み込みがあったかどうかを確認します。
4. L. infantum- Luc メタサイクリック前乳房と無酸素性アマスタチゴートの分化
- BHI培地で、ルシフェラーゼを構成的に発現する L. infantum-LucMHOM/BR/1974/PP75を培養し、25 mg/Lヘミンと20%のウシ胎児血清(FCS)を添加します。
注:ハイグロマイシンは、安定トランスフェクタントの培地から回収されました。 - L. infantum-Luc のメタサイクリック前乳房を得るには、75 cm2 フラスコに 10個の 6/mL 前乳房を播種し、20 mL の BHI 培地を 26 °C で添加し、4 日間水平位置に保つか、成長の静止期までわずかに傾けます。6〜8日連続して、フラスコには増加した中環状前胸茎が含まれています。前胸茎を1,000 × gで4°Cで10分間遠心分離します。
- 前胸部のペレットを20mLのDMEM低グルコースで再懸濁し、ノイバウアーチャンバーを用いてカウントし、1,000 × g で4 °Cで10分間遠心分離します。
- DMEM低グルコースをペレットに3〜5 × 107 promastigotes/mLの密度で添加します。5 mLのプロマスティゴテスをDMEMで2:1(v / v)に希釈した10 mLのFicollクッションに注ぎます。.グラジエントを100 × g で4 °Cで15分間遠心分離し、ブレーキをオフにしてゆっくりと加速します。
- 界面、Ficollクッションの上部でメタサイクリックプロマスタゴテを採取し、ノイバウアーチャンバーを使用してカウントし、4°Cで1,000 × gで10分間遠心分離します×。
- ペレットをPBSで2 × 109 / mLに再懸濁します。接種前に前胸炎を氷の上に置いてください。
- L. infantum-Lucのプロマスタゴテスをin vitroでアキセン性アマスチゴテスに区別し、アキセン的に成長したアマスタス(MAA)の修飾培地で17。
- 9.55 g/L の培地 199 を Early's 塩とグルタミン、0.5% トリプトカゼイン、3 mM L-システイン、15 mM D-グルコース、4 mM NaHCO3、0.33 mM Na2HPO4、25 mM HEPES を最終 pH 6.5 まで添加し、20% 子牛胎児血清 (FCS) を添加して MAA を調製します。
- 成長の固定段階(7日目)で、9 mLの培地MAAと1 mLのプロマスティゴテスを含むミディアムフラスコ(75 cm2)で培養を開始し、2〜3 × 107個のプロマスティゴテス/ mL。32°Cで24-48時間インキュベートし、アマスチゴートの分化を可能にします。
- アキセン的に成長させたアマスチゴテスを週に2〜3回、密度が2〜3×107 / mLに達するまで保管します。
- ハムスター感染のための無菌性アマスティゴテス培養物のスケールアップ。20%FCSを添加した20mLのMAA培地に高密度のアマスチゴテス(5 × 106 / mL)を含む150 cm2フラスコを準備します。.
- 24時間後、1,000 × gで4°Cで10分間遠心分離し、同量のPBSで洗浄し、ノイバウアーチャンバーを使用してカウントし、1,000 × gで4°Cで10分間遠心分離します。
5. 動物たち
- 4〜6週齢でオスのゴールデンハムスターを調達し、2週間隔離します。 彼らがL. infantum MHOM/BR/1974/PP75に感染したときの生後6〜8週間で、体重が80〜100gであることを確認してください。
注:このプロトコルは、オスとメスの両方のハムスターに適用されます。しかし、当時は入手可能だったため、この研究ではオスのハムスターのみを使用しました。 - ハムスターを4つのグループに分けます:グループ1、腹腔内にアマスチゴートに感染(n = 3)。グループ2、腹腔内に前乳房に感染(n = 3)。グループ3、歯肉静脈にアマスチゴート(n = 2)に感染。グループ4、歯肉静脈に前胸茎(n = 2)に感染。グループ5、対照としての未感染のハムスター(n = 2)。
- 動物は、制御された換気システム(10〜15回の空気交換/ h)、12時間の明暗サイクル、21±〜2 °C、湿度40〜60%の換気ラックに保管してください。紙、干し草、疎水性綿、段ボールロール、オートクレーブ水、食品など、 環境を豊かにするものを自由自在に提供します。
6. 腹腔内経路による感染
- 親指と人差し指をピンセットとして使用して、頭の近くの側面から背中の皮膚をつまみ、他の指で背中に沿って皮膚を引っ張って、ケージのグリッドにハムスターを物理的に拘束します。
- 腹部の右下象限の接種部位を大腿部の後部の筋肉に合わせます。
- 動物の体を45°傾け、頭を腹部より低くし、針を15°から20°に配置して接種します。
- 13 x 0.45 mm の針を 1 mL シリンジに結合した PBS で 50 μL (108) の無軸性アマスチゴテスまたは前マスティゴテスに接種します。ベベルから0.5cm先に挿入します。腹部に針を挿入した後、プランジャーを引いて静脈に挿入されていないことを確認し、慎重に液体を注入します。
7. 歯肉接種による静脈内感染
- セクション6に従ってハムスターを拘束します。200 mg / kgの10%ケタミン塩酸塩と10 mg / kgの混合物、最終容量1.3 mLの2%塩酸キシラジンを、13 x 0.45 mm針に結合した3 mLシリンジに腹腔内投与します。.
- クッションの指間ベースをクランプして足をつまみ、動物が麻酔をかけられるようにします。
- 麻酔をかけたハムスターを仰臥位で両手で拘束し、親指で下唇をそっと引き下げて、歯茎と歯肉静脈を露出させます
- 細い針(8 x 0.30 mm)を1mLシリンジに結合して、歯のペアの間の中央線に沿って下顎切歯の下に25°の角度で配置し、下顎口唇静脈に2〜4mmを挿入します。
- 接種物が静脈内投与され、下顎口唇静脈に針が挿入されたことを確認するために、針のバレル(黄色の部分)まで血液を吸引します。
- 50μL(108)のアマスチゴテスまたはプロマスティゴテスをPBSに1分間かけてゆっくりと慎重に注入し、静脈から外部環境への接種と血液の漏れを防ぎ、血流に分散できるようにします。
- 針を抜く前に、綿棒で軽く圧力をかけます。同時に、綿棒を保持してその部位の止血を促進し、出血や接種の喪失を避けるために1分間軽い圧力を加えて、血管から針を取り外します
8. 心臓穿刺による安楽死
- セクション7で説明されているように、動物を麻酔するように拘束します。20 x 0.55 mm の針を 5 mL シリンジに結合し、45º の角度で挿入し、剣状突起軟骨のすぐ下でわずかに左に傾けて心臓穿刺を行います。
- 1mLの血液を採取します。終末採血後、シリンジを取り外しますが、針は心臓に保持します。
- 動物がすでに呼吸していて心拍を示している場合は、チオペンタールナトリウム5%(200 mg / kg)を5 mLシリンジで投与し、すでに心臓にある20 x 0.55 mmの針に結合します。.
- 5分後、聴診器を使用して、呼吸運動と心拍があるかどうかを確認します。
9. 臓器や組織からのDNA抽出
- 安楽死後、脾臓、腸間膜リンパ節、および肝臓の断片を採取します。
- ドライアイスで凍結し、解凍し、メスの刃2枚で切って組織をカットします。20 mgのミンチ組織を600 μLの溶解バッファーで17.5 μLのプロテイナーゼK(20 mg/mL)と共に消化し、55 °Cで一晩インキュベートします。
- 15,000 × g で4分間遠心分離し、溶解されていない組織の断片を除去します。
- 200 μL のタンパク質沈殿溶液を加え、20 秒間激しく混合し、氷上で 5 分間インキュベートし、15,000 × g で 4 分間遠心分離します。
- 上清を別のチューブに移し、600μLのイソプロパノールを加え、DNAが沈殿するまで穏やかに混合します。DNAを15,000 × g で2分間遠心分離し、ペレットを70%エタノールで30分間チルトシェーカーで洗浄し、遠心分離します。
- エタノールを捨て、ペレットを室温で乾燥させます。50-200 μLの超純水で65 °Cで30分間DNAを再水和し、DNAを定量して0.1 μg/mLに希釈し、-20 °Cで保存します。
10. PCRによる組織・臓器の感染評価
- 従来のPCRにより、組織および臓器のゲノムDNAの寄生虫負荷を評価します:2.5 μLのPCRバッファー、1.5 mM MgSO4、0,2 mM dNTP、1 UのDNAポリメラーゼ、300 ngのゲノムDNA、各プライマーの0.2 μM、およびヌクレアーゼフリー水で25 μLの最終容量まで。
- L. infantum kDNA18のプロトコルを使用して増幅します:94°Cで2分間の変性を1サイクル行います。39サイクルの増幅、94°Cで30秒、60°Cで15秒、72°Cで30秒、72°Cで5分の最終延長。 (1)Fw kDNA(RV1)5'-CTTTTCTGGTCCCGCGGGTAGG-3';(2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Amplify hamster GAPDH, the endogenous control of PCR3: 1 サイクルの変性 (94 °C で 2 分間)、増幅 39 サイクル、94 °C で 30 秒、58 °C で 15 秒、72 °C で 30 秒、72 °C で 5 分間の最終延長 (1) Fw GAPDH ハムスター 5'- GGTTGCCAAACCTTATCAGAAATG-3';(2)Rv GAPDHハムスター5'-TTCACCTGTTCCACAGCCTTG -3'。
- PCR産物を1%アガロースゲル電気泳動で分析します。
11. in vivo 生物発光イメージングによるハムスターの追跡調査
- 光密チャンバーに取り付けられた冷却電荷結合カメラ(CCD)で構成される生物発光 in vivo イメージングシステムにおける動物全体の生物発光放出による感染の経時的な進行を評価します。画像取得中は、ノーズコーンデリバリーで動物に麻酔をかけてください。
- 生物発光取得前および麻酔導入の5分前に、セクション6に従ってD-ルシフェリン(150 mg / kg)をハムスターに腹腔内に注射します。.PBS中の15 mg/mL D-ルシフェリンカリウム塩ストック溶液を調製し、フィルター滅菌し、-80 °Cで保存します。
- 動物にD-ルシフェリンを注射してから5分後、酸素が豊富な誘導チャンバーで2%イソフルランで麻酔をかけます。さらに5分後、CCDカメラを使用して生物発光画像を撮影します。感染後2時間および24時間後、感染後8日および22日(dpi)の腹側位置にあるハムスターの画像を取得します。
注:イメージングプロセス中は、イソフルオラン-酸素送達装置を使用して麻酔を維持してください。 - 生物発光の放出レベルに基づいて、次のパラメーターを使用します: 露光時間、30秒から5分の範囲、ビニング中または大、f /ストップ1 、 視野D (12、5 cm)。
12. L. infantum-Luc に感染した動物における生物発光定量
- 手動測定ツールを使用して、動物の頭部と体の関心領域(ROI)、サイズ、および面積を特定します。CCDカメラで取得した生物発光を、選択したROIで定量化します。
- 平均バックグラウンドROIでバックグラウンド信号を測定し、手動ROIから得られた生物発光から差し引きます。
- 生物発光発光を放射輝度で表し、時間と面積で正規化された単位:photons.sec-1.cm-2.sr-1
結果
L. infantumにおけるルシフェラーゼの安定発現
遺伝子組み換え L. infantum は、18S rRNA(ssu)リボソーム遺伝子座のリーシュマニアのゲノムに組み込まれる pLEXSY 系統のプラスミドを使用して作製されました。したがって、L. infantum-Luc クローンは、リーシュマニアのゲノムにおけるプラスミドの統合、および in vitro での生物発光放出による安定発現について評価されました.バックグラウンドから>120倍上に生物発光を示す高発現クローンを、PCRによるゲノム統合の評価に選択しました。PCR産物のアガロースゲル電気泳動については、L. infantum-Lucクローンのプロマスティゴテスのゲノムおよび生物発光発光(RLU)におけるプラスミド統合を評価するための図1を参照してください。予想されるサイズのフラグメントを各PCRから取得しました。L. infantum-Lucのゲノムから約1.1 kbの産物(5'ssu-utr1)と1.8 kbの産物(Hyg-3'ssu)を増幅し(図1A)、L. infantumゲノムのssu遺伝子座におけるプラスミドカセットとルシフェラーゼ遺伝子の統合を確認しました。
ホタルのルシフェラーゼの発現は、プロトコル、セクション2に記載されているように、マイクロプレートリーダーでの生物発光放出(RLU)によって L. infantum-Lucのプロマスタゴテスでも評価されました。培養およびBALB/cマウスで5日間数回の継代を行った後でも、生物発光のレベルを維持しました。569.3 ± 19.5 は野生型の背景、59361.9 ± 2673.3 (n = 2) はクローン化された L. infantum- Luc です (図 1B)。したがって、ホタルルシフェラーゼを安定して発現する L.infantum-Lucクローンを使用して、歯肉縁内または腹腔内経路を介してハムスターに感染しました。
歯肉静脈の静脈内接種
リーシュマニアをハムスターの血流に接種するには、静脈の穿孔、出血、接種の漏れを最小限に抑えるように注意する必要があります。.したがって、歯肉静脈を露出させるためには、下唇を穏やかに引き下げる必要があります(図2A)。また、静脈の過度の穿孔を避けるために、より小さなゲージの30G針を使用する必要があります。針は、適切な角度で静脈に挿入するために、ベゼルを上に向けて配置する必要があります(図2B)。実際、針が血管(下顎唇静脈)に注入されたことを確認するには、血液が針のバレルに吸引されるまでシリンジプランジャーを引き下げる必要があります(図2C)。針を抜く前に、止血を促進するために綿棒で軽い圧力をかける必要があります(図2D)。
生物発光イメージングによる縦断的評価
腹腔内(IP)または歯肉内(IG)を介してL. infantum-Lucに感染したハムスターを50dpiまで追跡し、22 dpiまで生物発光イメージングによって評価しました(図3)。画像は腹腔内感染の2時間後に取得され、腹腔内に108個の寄生虫がいました。画像は、30秒または1分間のexposition binning mediumで取得しました。アマスチゴテ感染動物の腹部での生物発光シグナルは、前マスティゴテ感染動物(×±×6.8 × 103 ± 3.8 × 103)よりも腹部で>65倍強かった(表1)ことから、in vitroで分化したアマスチゴテは、固定相でメタサイクリック前胸炎動物よりも生物発光性が高く、Ficollクッションで精製されたことが示されています。
感染の1日後(1 dpi)に、3分間の曝露で生物発光画像を取得しました(図3)。前胸綱に感染したハムスターでは腹部の生物発光シグナルが45%減少し、母性母岩に感染したハムスターでは70%減少したこと(図3)ことから、母体はメタサイキング前胸炎よりも大きく分解されたことが示唆されています(表1 および 図4)。感染の1週間後(8 dpi)、前胸腺に感染した動物は生物発光シグナルを維持しました(3.3 × 103 ± 5 × 103)。しかし、アマスチゴテに感染したハムスターの生物発光は、1.3 × 105 ± 1.1 × 105 から6.7 × 103 ± 7.5 × 103 (表1)に95%減少し、プロマスティゴテ感染ハムスターと同レベルに達しました。感染の3週間後(22 dpi)、5分間の露出と大きなビニングで生物発光シグナルを取得しました(図3)。シグナルは、プロマスティゴテスおよびアマスチゴテスに感染した動物でははるかに低かった(表1 および 図4)。
ハムスターの別のグループは、L. infantum-Lucのアマスチゴテスとプロマスティゴテスに歯肉内経路を介して感染しました(108)。生物発光は上顎領域で観察されました(図3)。追跡調査は感染の1日後に開始され、アマスティゴテに感染したハムスターは、前マスティゴテに感染したハムスター(1 × 103 ± 5.7 × 102)よりも、アマスティゴテに感染したハムスター(7.3 × 103 ± 4.1 × 103)が多かった。感染の1週間後(8 dpi)、前胸茎に感染した動物では生物発光シグナルの36%の低下が観察され、アマスチゴテに感染したハムスターでは90%の低下が観察されました。放射輝度は、7.3 × 103 ± 4.1 × 103 から 7.8 × 102 ± 5.6 × 102 までさまざまでした(表 1)。感染の3週間後(22 dpi)、5分間の曝露とビニングで生物発光シグナルも取得されました(図3)。生物発光シグナルは、歯肉に感染した動物の頭部における前乳房感染動物とアマスチゴテ感染動物(表1および図4)で同様で低かったが、生物発光シグナルによる腹部への感染の分散は観察されなかった。
PCRによる組織や臓器の感染評価
私たちは、肝臓、脾臓、リンパ節など、 in vivo イメージングの検出限界を下回る可能性のある特定の臓器への感染を調べるために、従来のPCRを実施しました。kDNAの標的領域は、感染組織や臓器における L. infantum のDNA増幅により特異的であり、ハムスター由来の酵素GAPDHのPCRは、DNAの完全性とPCR反応の制御であった。 GAPDH 用に増幅されたサンプルのみが分析で考慮されました。したがって、PCRにより、腹腔内経路を介して無菌性アマスチゴテスに感染したハムスター3匹のうち2匹が、組織および臓器に感染を示した。脾臓の動物2(A2)と肝臓の動物3(A3)、50dpi(図5A)。1匹のハムスターは、淫腸性前胸茎に腹腔内に感染しました。動物3(A3)(図5B)は、リンパ節の増幅を示しました。50 dpiで歯肉内投与されたハムスターは、前乳房に感染した動物(A1)の肝臓にバンドがあるだけで、明確な増幅を示すことができませんでした(図5C)。特に、歯肉内ルートで送達された接種物が注射中にわずかに漏れたアマスチゴテスを含む3匹の動物を8か月間維持しました。3匹中2匹、1匹と2匹は肝臓に明らかな感染を示しました(図5D)。
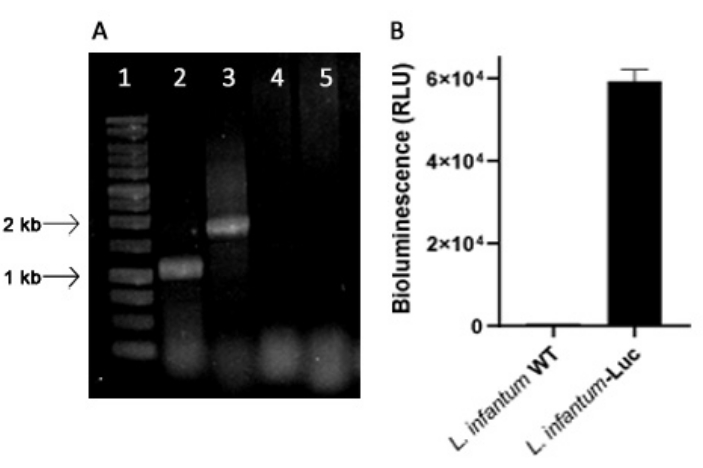
図1:PCRおよび生物発光発光による リーシュマニアインファンタム-リュッククローンの評価。 (A)ゲノムにおけるプラスミド統合を評価するためのPCR産物のアガロースゲル電気泳動:レーン1〜1kb DNAラダー; L. infantum-LucゲノムDNA、レーン2-5'ssu-utr1(1.1 kb)およびレーン3-hyg-3'ssu(1.8 kb)のPCR; L. infantum-wtゲノムDNAのPCR、レーン4および5。(B)マイクロプレートリーダーにおける L. infantum-Lucクローン(106)の前胸茎の生物発光(RLU)。 この図の拡大版を表示するには、ここをクリックしてください。
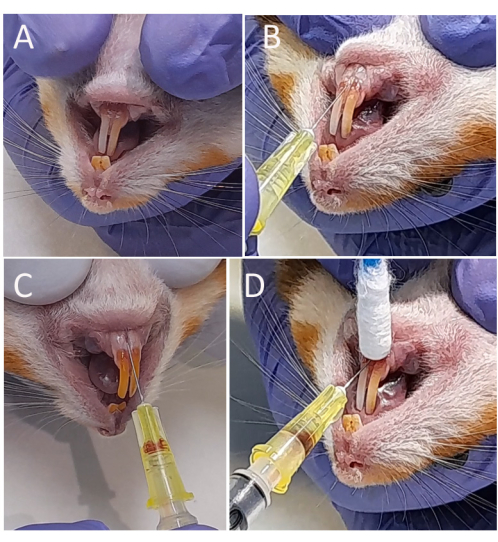
図2:Leishmania infantum-Lucの歯肉静脈への静脈内注射(A)ハムスターを背側褥瘡に入れ、下唇を引き下げた。(B)1mLの注射器に結合された細い針(8 x 0.30 mm)を、一対の歯の間の中央線に沿って下切歯の下に25°の角度で配置し、下顎口唇静脈に2〜4mm挿入しました。(C)PBS中の50μL(108)のアマスチゴテスまたはプロマスティゴテスの接種。(D)綿棒を使用し、接種部位に軽い圧力を加える止血。この図の拡大版を表示するには、ここをクリックしてください。

図3: in vivo 生物発光イメージングによる追跡調査。 グループごとに1匹の動物の代表的な画像:腹腔内(上部パネル)または歯肉内(下部パネル)を介して感染し、 L. infantum-Lucのアマスチゴテスまたは前マスティゴテスを1、8、および22 dpiで投与。赤のROIは、腹腔内感染または歯肉内感染の場合、腹部と頭部でそれぞれプローブされた領域を表します。データによると、1dpiでは、すべての動物が腹部または下顎骨に生物発光シグナルを示しました。信号は 8 dpi 後に低下し、22 dpi のどのグループでもほとんど検出できませんでした。 この図の拡大版を表示するには、ここをクリックしてください。

図4:生物発光画像からの放射輝度の比較分析。 放射輝度定量化photons.sec-1.cm-2.sr-1は、手動ROI測定ツールを使用してハムスターの腹部または頭部で実行されました。平均バックグラウンドROIを測定ROIから差し引いて、スプリアス信号を除去しました。この図の拡大版を表示するには、ここをクリックしてください。
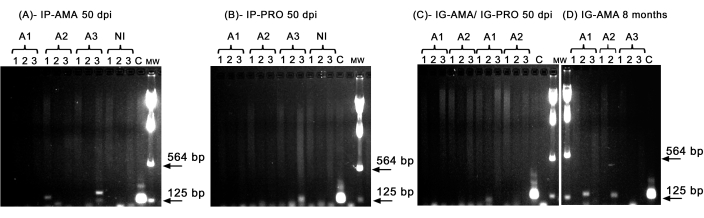
(A) IP-AMA、アマスチゴテによる腹腔内経路で感染したハムスター、50 dpi (n = 3);(B)IP-PRO、腹腔内経路を介して前胸腔に感染、50 dpi(n = 3);(C)IG-AMA、アマスチゴート(n = 2)による歯肉内経路を介して感染、IG-PRO、前乳房(n = 2)による歯肉内経路を介して感染;(D) IG-AMA、アマスチゴテによる歯肉内経路による感染、感染後8ヶ月(n = 3)。NI、ネガティブコントロールとしての未感染のハムスター(n = 2)。L. infantum-LucのC-ゲノムDNA、PCRのポジティブコントロール。組織および臓器:1-脾臓、2-肝臓、3-リンパ節。MW-分子量マーカー、矢印は低分子量バンドを示します。A1-動物1、A2-動物2、A3-動物3。この図の拡大版を表示するには、ここをクリックしてください。
| DPIの | アマスティゴテスIP | プロマスティゴテスIP | アマスティゴテスIG | プロマスタゴテスIG | ||||||||
| 意味する | SDの | N | 意味する | SDの | N | 意味する | SDの | N | 意味する | SDの | N | |
| 0 | 4.6×105 | 3.7×105 | 3 | 6.8×103 | 3.8×103 | 3 | - | - | - | - | - | - |
| 1 | 1.3×105 | 1.1×105 | 3 | 3.8×103 | 5.5×103 | 3 | 7.3×103 | 4.1×103 | 2 | 1.0×103 | 5.7×102 | 2 |
| 8 | 6.7×103 | 7.5×103 | 3 | 3.3×103 | 5.0×103 | 3 | 7.8×102 | 5.6×102 | 2 | 6.4×102 | 8.2×101 | 2 |
| 22 | 7.3×101 | 8.5×101 | 3 | 9.9×101 | 8.6×101 | 3 | 4.6×102 | 7.5×101 | 2 | 5.0×102 | 1.5×102 | 2 |
表1:生物発光画像の比較放射輝度分析からの生データ。 グループおよびルート別の放射輝度定量化平均photons.sec-1.cm-2.sr-1。略語:dpi =感染後日数;SD = 標準偏差;N = サンプルサイズ。
ディスカッション
ハムスターへの採血または物質の静脈内注射は、さまざまな科学的研究に必要です。研究目的19に直接関連するさまざまな収集または接種ルートにアクセスするために、いくつかの方法が開発されてきた。ハムスターの解剖学的構造(尻尾と手足が短い)のため、リーシュマニアの静脈注射には通常、心臓内経路が選択されます。使用される株にもよりますが、心臓内経路は、感染が長期、6〜9か月5にわたって発生する参照株L.infantum MHOM/BR/1974/PP75として有利であることが証明されました5。しかし、それは動物の出血や死につながる可能性のある接種物です。したがって、私たちは、動物への害が少ない歯肉神経叢、下顎唇静脈での感染に対する代替の静脈内接種ルートを標準化しました。動物は、遺伝子組み換え参照株L.infantum MHOM/BR/1974/PP75に感染し、これは培養およびマウスで数回の継代後もホタルルシフェラーゼを安定して発現し(図1)、同じ統合プラスミド20によってトランスフェクトされた他のリーシュマニア種と関連している。
下顎口唇筋静脈または歯肉静脈は、採血や複数の採血に適したルートです10,11。しかし、これは、歯肉静脈がハムスターのリーシュマニアによる静脈内感染の実行可能な部位であることを初めて実証したものです。通常、血液溶血を避けるためにハイゲージの26G針を用いる採血10とは対照的に、この針ゲージは静脈穿孔、出血、接種の漏れなどからリーシュマニア接種には適していなかった。上顎下顎静脈を介したリーシュマニア感染には、より小さなゲージの30G針が不可欠でした。静脈穿刺と歯肉静脈を介した感染を区別する別の側面は、約1μL / sの投与速度です。そして、それが血管(下顎唇静脈)に注入され、粘膜、皮下または皮内静脈に留まらないようにするためです。歯肉神経叢の血液代謝回転率が低いため、50 μL の無軸アマスティゴテスまたはラメ インファンタム リュックのプロマスティゴテスの高密度接種物 (2 x 109 寄生虫/mL) をゆっくりと (~ 1 分) 接種しなければならず、スワブを 1 分間押し続けて針を抜く必要があります 血流に接種物が分散します (図 2)。
感染の縦断的評価のために、ハムスターは腹腔内(IP)または歯肉内(IG)経路を介してL.infantum-Lucに感染し、安楽死するまで生物発光イメージングシステムによって50dpi追跡されました。参照株PP75はそれ自体が毒性が低い可能性があり、ルシフェラーゼの超発現も感染の有効性に影響を与え、感染を長期的に維持する可能性があることを考慮して、感染には108寄生虫の高接種を使用しました。L. infantum-Lucのアマスチゴテスとプロマスティゴテスの両方に歯肉接種を行い、生物発光イメージングシステムによる評価を行ったところ、感染後24時間でハムスターの上顎領域に生物発光が限定されました。実際、L. infantum-Lucのアマスチゴテスおよびプロマスティゴテスに腹腔内に感染したハムスターは、腹部全体に分散した生物発光を示しました(図3、1 dpi)。L. infantum-Lucに感染したハムスターにおける感染初日から8日目、および22日目までの経時的な生物発光の連続的な減少は、接種経路とは無関係であった(表1および図4)。
しかし、動物組織における寄生虫の負荷が低い場合、生物発光イメージングシステムの検出限界を下回ることがありますが、PCRまたはqPCRによって検出および定量することができます。すでに報告されているように、PP75株による感染は他の株5よりも確かに低く、動物の遺伝的多様性のために病気の臨床徴候を発症したのはごくわずかです。この研究では、動物の数が少なく、この株の病原性が低いにもかかわらず、無軸性アマスティゴテスは50 dpiで利点を示し、PCRで示されたように、プロマスティゴテスよりも優れた感染を示しました(図5)。歯肉経路によるアマスチゴテス感染から8か月後、肝臓のPCRにより寄生虫を検出することができ(図5)、中等度の立毛、眼窩の圧迫感、弓状姿勢も示しました。
無菌性アマスティゴテスは、プロマスティゴテス21 よりも感染およびフォローアップに適した選択肢であり、大規模に生産しやすいという利点があります。歯肉接種は、化合物の静脈内接種や リーシュマニア や他の病原体の感染に実行可能であり、下顎の塗布部位や動物の健康に対する損傷や腫れはありません。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT.PPSUS/ Decit-MS/CNPq/SESは、この研究に資金援助を提供しました。予防接種のルートについてアドバイスしてくれたMonique Ribeiro de Limaに感謝します。このプロジェクトは、FIOCRUZとリオデジャネイロ連邦大学(UFRJ)との間の協力協定No 258/2017に基づいて開発されました。科学普及センター(IOC)のビデオプロデューサー、リカルド・バプティスタ・シュミット氏とゲニルトン・ホセ・ヴィエイラ氏には、プロトコルの撮影とインタビューの実施に貴重なご支援とご協力をいただき、誠にありがとうございます。
資料
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
参考文献
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved