Method Article
In vivo Imágenes de hámsters infectados con Leishmania infantum mediante inoculación gingival de amastigotes axénicos que expresan luciferasa
En este artículo
Resumen
En este trabajo presentamos una evaluación longitudinal de hámsters dorados infectados por vía intraperitoneal (IP) o intragingival (IG) con L. infantum-Luc mediante imagen bioluminiscente y por PCR. Los hámsters fueron evaluados 1 día después de la infección (1 dpi), 1 semana después de la infección (8 dpi) y 3 semanas después de la infección (22 dpi) y se les practicó la eutanasia a los 50dpi y 8 meses después de la infección.
Resumen
La leishmaniasis tegumentaria americana (ATL) y la leishmaniasis visceral (LV) son consideradas desatendidas por la Organización Mundial de la Salud. La LV puede ser letal si no se trata; Los fármacos utilizados en el tratamiento son tóxicos y hay casos de resistencia. Las pruebas preclínicas pueden representar un cuello de botella en el descubrimiento de nuevos medicamentos para el tratamiento, dependiendo del modelo animal, la cepa utilizada y la ruta del inóculo. El hámster dorado se destaca por su alta susceptibilidad a las especies de los subgéneros Viannia y Leishmania , mostrando muchos de los procesos clínicos e inmunopatológicos observados en las enfermedades humanas.
Por la anatomía del hámster, que tiene una cola y extremidades cortas, la vía intracardíaca suele ser la opción para la inyección intravenosa de Leishmania. Sin embargo, es un inóculo que puede provocar hemorragias y, finalmente, la muerte del animal. Por lo tanto, estandarizamos una ruta alternativa de inoculación intravenosa para la infección en la vena gingival, que es mínimamente invasiva, permite un fácil acceso venoso y causa pocas lesiones locales y sistémicas al animal. Por lo tanto, los hámsters infectados por vía intraperitoneal (IP) o intragingival (IG) con Leishmania Infantum que expresaba luciferasa (Luc) fueron seguidos durante 22 días por el sistema de imagen de bioluminiscencia y 50 días y 8 meses después de la infección por PCR.
Después de la inoculación gingival de amastigotes axénicos y promastigotes de L. infantum-Luc, se restringió la bioluminiscencia durante al menos 2 semanas en el lugar de la inyección, lo que es un indicador de infección en los tejidos alrededor del plexo gingival. Los hámsters infectados intraperitonealmente con L. infantum-Luc mostraron bioluminiscencia dispersa por todo el abdomen, como se esperaba. Sin embargo, por el sistema de imagen de bioluminiscencia, la infección disminuyó hasta los 50 ppp y solo fue detectable por PCR. Los amastigotes axénicos mostraron mejor infección que los promastigotes, evaluados por PCR. De hecho, 8 meses después de la infección, se detectaron parásitos por PCR en el hígado de animales inoculados con amastigotes axénicos por vía intravenosa, lo que puede ser una característica de la cepa de referencia de L. infantum MHOM/BR/1974/PP75, cuya infección progresa lentamente y muestra una baja carga parasitaria, por debajo de la resolución de la imagen bioluminiscente. Por lo tanto, los amastigotes axénicos pueden ser una mejor opción para la infección y el seguimiento que los promastigotes, y el inóculo gingival es una vía factible para la inyección intravenosa de Leishmania y otros patógenos.
Introducción
Las leishmaniasis se consideran enfermedades desatendidas y reemergentes causadas por más de 20 especies de Leishmania, endémicas en varios países de las cuatro regiones ecoepidemiológicas centrales: América Latina, África del Norte y Oriental, y Asia Occidental y Sudeste1. Se pueden agrupar en legumentaria (TL) y leishmaniasis visceral (VL), que es letal si no se trata. El agente etiológico de la LV en Brasil es Leishmania infantum, y el tratamiento se realiza con antimoniales pentavalentes o anfotericina B. Estos fármacos se administran por vía intravenosa, tienen alta toxicidad, presentan reacciones adversas y hay casos de resistencia2.
Por lo tanto, es necesario invertir en la búsqueda de nuevas quimioterapias. Las pruebas preclínicas son, de hecho, un cuello de botella en el descubrimiento de nuevos fármacos para el tratamiento de la LV, dependiendo del modelo animal, la cepa utilizada, la ruta del inóculo y otros factores logísticos, técnicos y operativos. El hámster dorado se destaca por su alta susceptibilidad a especies de los subgéneros Viannia y Leishmania, mostrando muchos de los procesos clínicos e inmunopatológicos observados en la enfermedad humana como se observó en estudios previos con Leishmania braziliensis 3,4. El hámster infectado con L. infantum también desarrolla la mayoría de los procesos inmunopatológicos característicos de la LV en humanos y perros5, como anemia, leucopenia, trombocitopenia y hepatoesplenomegalia. Además, el hámster dorado es un animal endogámico y no muestra una respuesta uniforme, reproduciendo la heterogeneidad de las manifestaciones clínicas observadas en los humanos3.
Otro aspecto a tener en cuenta para el resultado de la infección es la cepa de L. infantum y la vía de inoculación. Varias cepas de L. infantum difieren en antecedentes genéticos y susceptibilidad al tratamiento 2,6,7. Algunas cepas tienen baja carga parasitaria en el hígado y el bazo después de la infección por promastigotes8, y los amastigotes axénicos pueden ser una alternativa para mejorar la infección que no está muy explorada. De hecho, la vía intravenosa favorece la infección y aumenta la frecuencia de animales con signos clínicos; Pero la inoculación intraperitoneal es la más utilizada. La vía intracardíaca es la de elección para la infección intravenosa por L. infantum 5,8,9. Sin embargo, en hámsters, la inoculación intragingival es una vía alternativa para la inyección intravenosa, no descrita como un sitio de infección. A pesar de ser reportada, la venopunción gingival es mínimamente invasiva, permite un fácil acceso venoso y causa pocas lesiones locales y sistémicas10. La punción de la vena gingival es la que más concuerda con las recomendaciones para maximizar la calidad y aplicabilidad de los resultados, preservando el bienestar animal11.
La evaluación preclínica de compuestos para la LV utilizando métodos tradicionales requiere más animales, que deben ser sacrificados para el análisis histopatológico y la evaluación de la carga parasitaria en los tejidos. Por el contrario, el sistema de imágenes bioluminiscentes puede acelerar los estudios preclínicos y reducir el número de animales. Los sitios bioluminiscentes en los tejidos infectados se pueden seguir en tiempo real en el mismo animal durante varias semanas. Varios estudios sobre la estandarización de esta crucial herramienta tecnológica han demostrado su aplicación en estudios con ratones infectados con Trypanosoma cruzi, Leishmania spp. y Toxoplasma gondii 12,13,14,15. Sin embargo, dependiendo de la carga del parásito en el tejido, la bioluminiscencia puede ser subdetectada por el sistema de imagen in vivo, que requiere la evaluación por PCR cuantitativa de los órganos afectados. Por lo tanto, proponemos desarrollar una metodología basada en la inyección intravenosa de L. infantum que expresa luciferasa en la vena gingival de hámsters dorados para su seguimiento mediante el sistema de imagen bioluminiscente y PCR.
Protocolo
Los protocolos con hámsters siguieron los lineamientos del Comité de Ética en Investigación Animal del Instituto Oswaldo Cruz/COI (aprobación: CEUA/COI L-015/2022).
1. Clonación del gen de la luciferasa luciérnaga en el plásmido de expresión de Leishmania
- Digiera el plásmido pLEXSY-hyg2 con endonucleasa BglII (10 U/μL) y NotI (10 U/μL). Digiera primero con BglII: agregue 50 μL de plásmido (9 μg de ADN), 30 μL de tampón de enzima de restricción, 3 μL de albúmina sérica bovina (BSA), 3 μL de BglII y agua libre de nucleasas hasta un volumen final de 300 μL. Incubar durante 3 h a 37 °C.
- Digiera el plásmido TOPOII/LUC con BamHI (10 U/μL) y NotI para liberar el marco de lectura abierto de luciferasa luciferasa de luciérnaga con la secuencia de Kozak (Kozak-LUC), clonado en el vector TOPOII16. Digiera primero con BamHI: mezcle 100 μL de plásmido (8,5 μg de ADN) con 30 μL de tampón de enzima de restricción; 3 μL de BSA, 3 μL de BamHI y agua libre de nucleasas hasta un volumen final de 300 μL. Incubar durante 3 h a 37 °C.
- Limpie cada plásmido en una membrana de sílice y eluya el ADN dos veces con 50 μL de agua para obtener un volumen final de 100 μL.
- Digestión doble de los plásmidos pLEXSY-hyg2 y TOPOII/LUC previamente linealizados con NotI. Mezcle 100 μL del ADN eluido de la membrana de sílice con 15 μL de tampón D, 2 μL de NotI y agua libre de nucleasas hasta 150 μL de volumen final. Incubar durante 1 h a 37 °C.
- Purifique en gel el vector de doble digestión (pLEXSY-hyg2) y el inserto, Kozak-LUC, a partir de un gel de agarosa al 1% después de la electroforesis con tampón de tris-acetato EDTA (TAE). Extirpa las bandas de ~8 kb y 1,6 kb con un bisturí. Pesar las lonchas, añadir tres volúmenes de tampón a 1 volumen de gel, incubar a 50 °C para disolver el gel, transferir a la membrana de sílice y lavar y eluir el ADN dos veces con 20 μL de agua, con un volumen final de 40 μL.
- Ligue el vector de doble digestión (pLEXSY-hyg2) y el inserto, Kozak-LUC, con la ligasa T4: mezcle 2 μL de vector e inserto, ambos a 55 ng/μL, relación molar de 1:5; añadir 5 μL de tampón de ligadura; 1 μL de ADN ligasa T4 (1U/mL), volumen final de 10 μL. Incubar durante la noche a 16 °C.
- Añadir 40 μL de agua libre de nucleasas a los 10 μL de reacción de ligadura y precipitar el ADN con 10 volúmenes de butanol. Centrifugar a máxima velocidad durante 10 min en una microcentrífuga, lavar el pellet con etanol al 70%, centrifugar a máxima velocidad durante 10 min, dejar secar el pellet en el banco y añadir 4 μL de agua.
- Mezclar 4 μL de la reacción de ligadura con bacterias electrocompetentes, JM109 (40 μL), transferir la mezcla a una cubeta (d = 0,2 cm) y mantenerla en hielo. Electroporar a 2,500 V, 200 Ω, 25 μF, poner la cubeta en hielo y agregar 1 mL de medio LB. Transfiera inmediatamente la mezcla a un tubo cónico de 15 mL e incube a 37 °C durante 60 min y 100 rpm.
- Coloque la mezcla en dos placas de agar/ampicilina LB (100 μg/mL): una con 200 μL y otra con todas las bacterias electroporadas. Concentre el volumen centrifugando las bacterias transformadas a 2.000 × g durante 10 minutos, vuelva a suspender el pellet en 100 μL y coloque todo el volumen/pellet. Incubar las placas durante 24-30 h a 30 °C y esperar a que crezcan los clones.
- Seleccione los clones con un palillo y transfiéralos a tubos cónicos de 50 mL que contengan 5 mL de medio LB/ampicilina (100 μg/mL). Incubar durante 20-24 h a 30 °C y 100 rpm para permitir el crecimiento de los cultivos de minipreparación.
- Purifique el plásmido con el kit de minipreparación y eluya el ADN con 30 μL de agua. Cribado de clones que contienen el constructo pLESXY-LUC-hyg2 por digestión con BamHI.
- Mezcle 10 μL de ADN de miniprep; 2 μL de tampón enzimático de restricción; 0,2 μL de BSA: 1 μL de BamHI y agua libre de nucleasas hasta un volumen final de 20 μL. Incubar durante 1 h a 37 °C: fragmentos esperados de clones positivos en electroforesis en gel de agarosa al 1%: 3.450 y 6.290 pares de bases.
- Prepare un cultivo maxiprep para purificar el constructo pLESXY-LUC-hyg2 a mayor escala. Añadir un Erlenmeyer (1 L), 250 mL de medio LB suplementado con ampicilina, y 1 mL del miniprep transfectado JM109 e incubar durante 18-20 h a 30 °C y 200 rpm.
2. Producción y selección de Leishmania infantum que expresa luciferasa
- Para liberar el casete de integración de Leishmania , la restricción digiere el plásmido pLESXY-LUC-hyg2 hasta completar con SwaI. Agregue 40 μL de plásmido (50 μg), 10 μL de tampón de digestión rápida, 4 μL de SwaI y agua sin nucleasas al volumen final de 100 μL. Incubar durante la noche a 30 °C.
- Precipitar con etanol, lavar una vez con etanol al 70%, volver a suspender con 50 μL de agua y mantener en hielo.
- La centrífuga Leishmania MHOM/BR/1974/PP75 promastigotes a 1.000 × g durante 10 min en la fase de crecimiento exponencial en el medio de Schneider. Lave el pellet con medio de infusión cerebral y cardíaca (BHI) y centrifugue a 1.000 × g durante 10 min. Volver a suspender el pellet a 108 promastigotes/mL en BHI.
- Mezclar los promastigotes de L. infantum (500 μL) con el casete de integración pLESXY-LUC-hyg2 (50 μg) en la cubeta de electroporación (d = 0,4 cm), en hielo. Electroporato con dos pulsos de 1.500 V/25 micro F e intervalos de 10 s. Después del pulso, manténgalo en hielo durante 10 min.
- Transfiera los promastigotes transfectados a un matraz con medio de Schneider suplementado con FCS al 20% a 26 °C. Después de 24 h, agregue 50 μg/mL de higromicina primero, luego aumente a 100 μg/mL después de 48 h y 150 μg/mL después de 1 semana.
- El clon transfectó promastigotes de L. infantum-Luc limitando la dilución en una placa de 96 pocillos con Schneider suplementado con FCS al 20% y 150 μg/mL de higromicina. Incubar a 26 °C para el crecimiento de los clones.
- Cribado de clones para seleccionar L. infantum-Luc genéticamente homogéneo y altamente expresivo mediante unidad de luminiscencia relativa a emisiones bioluminiscentes (RLU), en el lector de microplacas.
- Brevemente, mezcle 106 promastigotes en una placa blanca de 96 pocillos con los 100 μL de sustrato D-luciferina (300 μg/mL) en tampón compuesto por 25 mM HEPES pH 7.8, 15 mM MgCl2, 4 mM EGTA, 1 mM DTT, 1 μg/mL BSA, 2.5 mM ATP, 0.1% Triton X-100 y 300 μM Coenzima A, evaluados inmediatamente en el lector de microplacas.
3. PCR para evaluar la integración genómica en el locus ribosómico del ARNr 18S (ssu)
- Purificar el ADN genómico de promastigotes que expresan luciferasa y tipo salvaje (10,8). Centrifugar promastigotes a 1.000 × g durante 10 min en tubos cónicos de 15 mL, añadir solución salina tamponada con fosfato (PBS) al pellet, contar con una cámara de Neubauer y centrifugar a 1.000 ×g durante 10 min. Vuelva a suspender el pellet con tampón de lisis: 100 mM de NaCl, 10 mM de Tris, 25 mM de EDTA, 0,5% de SDS y 0,1 mg/mL de proteinasa K a una densidad de 108/mL. Incubar durante la noche a 56 °C.
- Realice dos ciclos de limpieza de ADN con un volumen de fenol/cloroformo/alcohol isoamílico, 25:24:1 (v/v), y con un volumen de cloroformo. Entre cada ciclo de extracción, transfiera la fase acuosa a nuevos tubos y centrifugue a 2.000 × g durante 10 minutos.
- Precipitar el ADN con dos volúmenes de etanol y centrifugar a 5.000 × g, 10 min, 4 °C. Agregue 1 mL de etanol al 70%, transfiéralo a un microtubo y centrifugue a 15,000 × g durante 5 min.
- Realizar un segundo lavado con etanol al 70%. Después de la centrifugación, deseche el sobrenadante y seque el pellet en el banco.
- Rehidratar el ADN genómico con 50-100 μL de agua ultrapura en un baño de agua a 65 °C durante 30 min, cuantificar el ADN y almacenar a -20 °C.
- Llevar a cabo una PCR diagnóstica para evaluar la integración del casete pLEXSY en el genoma de Leishmania mediante la configuración de la siguiente reacción de PCR: 10 μL de tampón de PCR, 0,2 mM de dNTP, 1 U de ADN polimerasa, 1 μg de ADN genómico, 0,5 μM de cada cebador y agua libre de nucleasas hasta un volumen final de 50 μL.
- Seleccione cebadores que hibridan en el vector pLEXSY y el genoma de Leishmania: (1) cebador inverso aprt A1715 5'-TATTCGTTGTCAGATGGCGCAC-3', hibridar en la región utr1 (aprt); y (2) cebador directo ssu F3001 5'-GATCTGGTTGATTCTGCCAGTAG-3', en el locus 18SrRNA (ssu) del cromosoma Leishmania.
- Utilice el siguiente protocolo de amplificación: Un ciclo de desnaturalización a 94 °C durante 2 min; 30 ciclos de amplificación, 30 s a 94 °C, 30 s a 60 °C, 1 min a 72 °C; extensión final de 10 min a 72 °C. El tamaño esperado del producto PCR es de 1,1 Kb.
- Utilice un segundo conjunto de cebadores: (1) cebador directo hyg A3804 5'-CCGATGGCTGTGTAGAAGTACTCG-3, y (2) el cebador inverso ssu F3002 5'-CTGCAGGTTCACCTACAGCTAC-3', que se hibridan en el marcador de resistencia del vector pLEXSY y el locus 18SrRNA (ssu) del genoma de Leishmania . Utilice el mismo protocolo de PCR descrito en el paso 3.6.2, excepto por la temperatura de recocido de 53 °C, en lugar de 60 °C. El producto esperado es de 1.8 kb (hyg - 3'ssu).
- Analizar los productos de PCR mediante electroforesis en gel de agarosa al 1% para comprobar si había integración en el locus ribosómico 18S rRNA del genoma de L. infantum .
4. Diferenciación de L. infantum-Luc promastigote metacíclico y amastigote axénico
- Cultivar L. infantum-LucMHOM/BR/1974/PP75, expresando constitutivamente luciferasa, en medio BHI, suplementado con 25 mg/L de hemina y 20% de suero fetal de ternero (FCS).
NOTA: La higromicina se retiró del medio de los transfectantes estables. - Para obtener promastigotes metacíclicos de L. infantum-Luc, siembre 10 promastigotes de6/mL en matraces de75 cm2 , añadir 20 mL de medio BHI suplementado con FCS al 20% a 26 oC y mantener en posición horizontal durante 4 días o ligeramente inclinado hasta la fase estacionaria de crecimiento. Después de 6-8 días consecutivos, el matraz contiene un aumento de promastigotes metacíclicos; centrifugar los promastigotes a 1.000 × g durante 10 min a 4 oC.
- Vuelva a suspender el pellet de promastigotes con 20 mL de DMEM bajo en glucosa, cuente con la cámara de Neubauer y centrifugue a 1.000 × g durante 10 min a 4 oC.
- Añadir DMEM glucosa baja al pellet a 3-5 × 107 promastigotes/mL de densidad. Vierta 5 mL de promastigotes en una almohadilla Ficoll de 10 mL, diluida en DMEM, 2:1 (v/v). Centrifugar el gradiente a 100 × g durante 15 min a 4 oC, con el freno apagado y una aceleración lenta.
- Recoja los promastigotes metacíclicos en la interfaz, en la parte superior de la almohadilla Ficoll, cuente con la cámara de Neubauer y centrifugue a 1.000 × g durante 10 min a 4 oC. Lave el pellet con PBS para eliminar cualquier residuo de Ficoll, cuente con la cámara de Neubauer y centrifugue a 1.000 × g durante 10 min a 4 oC.
- Vuelva a suspender el pellet en PBS a 2 × 109/mL. Mantenga los promastigotes en hielo antes de la inoculación.
- Promastigotes diferenciados de L. infantum-Luc a amastigotes axénicos in vitro, en medio modificado para amastigote cultivado axénicamente (MAA)17.
- Prepare MAA añadiendo 9,55 g/L de medio 199 con sales de Early y glutamina, 0,5% de triptocaseína, 3 mM de L-cisteína, 15 mM de D-glucosa, 4 mM de NaHCO3, 0,33 mM de Na2HPO4, 25 mM de HEPES hasta un pH final de 6,5, y suplementar con un 20% de suero fetal de ternero (FCS).
- Iniciar los cultivos en matraces medianos (75cm2) con 9 mL de MAA media y 1 mL de promastigotes en la fase estacionaria de crecimiento (7º día), 2-3 × 107 promastigotes/mL. Incubar durante 24-48 h a 32 °C para permitir la diferenciación de los amastigotes.
- Mantenga los amastigotes cultivados axénicamente de dos a tres pasos por semana hasta que alcancen una densidad de 2-3 × 107 mL.
- Ampliar el cultivo de amastigotes axénicos para la infección de hámster. Preparar 150cm2 frascos con una alta densidad de amastigotes (5 × 106/mL) en 20 mL de medio MAA suplementado con 20% de FCS.
- A las 24 h, centrifugar a 1.000 × g durante 10 min a 4 oC, lavar con el mismo volumen de PBS, contar con la cámara de Neubauer y centrifugar a 1.000 × g durante 10 min a 4 oC. Añadir PBS para preparar el inóculo de 108 amastigotes en 50 μL.
5. Animales
- Consigue hámsters dorados machos a la edad de 4 a 6 semanas y mantenlos en cuarentena durante 2 semanas. Asegúrese de que tengan entre 6 y 8 semanas de edad y pesen entre 80 y 100 g cuando estén infectados con L. infantum MHOM/BR/1974/PP75.
NOTA: Este protocolo se aplica tanto a hámsters machos como hembras. Sin embargo, debido a su disponibilidad en ese momento, solo se utilizaron hámsters machos en este estudio. - Divida a los hámsters en cuatro grupos: grupo 1, infectado intraperitonealmente con amastigote (n = 3); grupo 2, infectado intraperitonealmente con promastigotes (n = 3); grupo 3, infectado en la vena gingival con amastigote (n = 2); grupo 4, infectado en la vena gingival con promastigote (n = 2); Grupo 5, hámsters no infectados como control (n = 2).
- Mantener a los animales en jaulas ventiladas, equipadas con un sistema de ventilación controlada (10-15 renovaciones de aire/h), ciclo luz/oscuridad de 12 h, a 21 ± 2 oC y 40-60% de humedad. Proporcionar enriquecimiento ambiental, como papel, heno, algodón hidrofóbico, rollos de cartón, agua esterilizada en autoclave y alimentos ad libitum.
6. Infección por vía intraperitoneal
- Sujeta físicamente al hámster en la rejilla de la jaula, usando el pulgar y el índice como pinzas para pellizcar la piel de la espalda desde los lados cerca de la cabeza, y los otros dedos tiran de la piel a lo largo de la espalda, tratando de obtener la mayor cantidad de piel posible.
- Alinee el sitio del inóculo en el cuadrante inferior derecho abdominal con los músculos posteriores del muslo.
- Inocular con el cuerpo del animal inclinado 45º, la cabeza más baja que el abdomen y la aguja colocada entre 15° y 20°.
- Inocular amastigotes axénicos o promastigotes, 50 μL (108) en PBS, con aguja de 13 x 0,45 mm acoplada a jeringa de 1 mL. Inserte 0,5 cm más allá del bisel. Después de insertar la aguja en el abdomen, tire del émbolo para confirmar que no se ha insertado en la vena e inyecte el líquido con cuidado.
7. Infección intravenosa por inoculación gingival
- Sujete al hámster siguiendo la sección 6. Administrar por vía intraperitoneal una mezcla de 200 mg/kg de clorhidrato de ketamina al 10% y 10 mg/kg de clorhidrato de xilacina al 2%, volumen final de 1,3 mL, en una jeringa de 3 mL acoplada a una aguja de 13 x 0,45 mm.
- Pellizque la pata sujetando la base interdigital del cojín para asegurarse de que el animal esté anestesiado.
- Sujete al hámster anestesiado en posición supina con ambas manos y tire suavemente hacia abajo del labio inferior con los pulgares para exponer la encía y la vena gingival
- Coloque una aguja más delgada (8 x 0,30 mm) acoplada a una jeringa de 1 ml debajo de los incisivos inferiores a lo largo de la línea media entre el par de dientes en un ángulo de 25º, e inserte 2-4 mm en la vena labial mandibular.
- Para confirmar que el inóculo fue intravenoso y que la aguja se insertó en la vena labial mandibular, aspire la sangre hasta el cilindro de la aguja (parte amarilla).
- Inyecte lenta y cuidadosamente el inóculo de 50 μL (10,8) amastigotes o promastigotes en PBS durante 1 min hasta que se haya inoculado todo el volumen para evitar la fuga del inóculo y la sangre de la vena al medio externo y permitir la dispersión en el torrente sanguíneo.
- Antes de retirar la aguja, aplique una ligera presión con un bastoncillo de algodón. Al mismo tiempo, retire la aguja del vaso manteniendo el hisopo de algodón para promover la hemostasia en el sitio, aplicando una ligera presión durante 1 minuto para evitar el sangrado y la pérdida del inóculo
8. Eutanasia por punción cardíaca, exanguinación
- Sujetar al animal para anestesiarlo, como se describe en la sección 7. Realizar la punción cardíaca con una aguja de 20 x 0,55 mm acoplada a una jeringa de 5 mL, insertada en un ángulo de 45º y ligeramente inclinada hacia la izquierda, justo debajo del cartílago xifoides.
- Extraiga 1 mL de sangre. Después de la recolección de sangre terminal, retire la jeringa pero mantenga la aguja en el corazón.
- Si el animal ya está respirando y presenta latidos cardíacos, administre tiopental sódico al 5% (200 mg/kg) con una jeringa de 5 ml y conéctela a la aguja de 20 x 0,55 mm que ya está en el corazón.
- Después de 5 minutos, con un estetoscopio, verifique si hay movimientos respiratorios y latidos cardíacos.
9. Extracción de ADN de órganos y tejidos
- Después de la eutanasia, recoja el bazo, los ganglios linfáticos mesentéricos y fragmentos del hígado.
- Corta los pañuelos congelándolos en hielo seco, descongelándolos y cortándolos con dos hojas de bisturí. Digerir 20 mg de tejidos picados en 600 μL de tampón de lisis con 17,5 μL de proteinasa K (20 mg/mL) e incubar a 55 °C durante la noche.
- Centrifugar a 15.000 × g durante 4 min para eliminar fragmentos de tejidos que no estén lisados.
- Añadir 200 μL de solución de precipitación de proteínas, mezclar vigorosamente durante 20 s, incubar durante 5 min en hielo y centrifugar a 15.000 × g durante 4 min.
- Transfiera el sobrenadante a otro tubo, agregue 600 μL de isopropanol y mezcle suavemente hasta la precipitación del ADN. Centrifugar el ADN a 15.000 × g durante 2 minutos y lavar el pellet con etanol al 70% durante 30 minutos en un agitador basculante y centrífuga.
- Deseche el etanol y seque el pellet a temperatura ambiente. Rehidratar el ADN con 50-200 μL de agua ultrapura a 65 °C durante 30 min, cuantificar y diluir el ADN a 0,1 μg/mL y almacenar a -20 °C.
10. Evaluación de la infección en tejidos y órganos por PCR
- Evaluar la carga parasitaria en el ADN genómico de tejidos y órganos mediante PCR convencional: 2,5 μL de tampón PCR, 1,5 mM de MgSO4, 0,2 mM de dNTP, 1 U de ADN polimerasa, 300 ng de ADN genómico, 0,2 μM de cada cebador y agua libre de nucleasas hasta un volumen final de 25 μL.
- Amplificar utilizando el protocolo de ADNk18 de L. infantum: Un ciclo de desnaturalización a 94 °C durante 2 min; 39 ciclos de amplificación, 30 s a 94 °C, 15 s a 60 °C, 30 s a 72 °C, extensión final de 5 min a 72 °C. El tamaño esperado del producto de PCR es de 145 pb. (1) Fw kDNA (RV1) 5'-CTTTTCTGGTCCCGCGGGTAGG-3'; (2) Rv kDNA (RV2) 5'-CCACCTGGCCTATTTTACACCA-3'.
- Amplificar el GAPDH del hámster, el control endógeno de la PCR3: Un ciclo de desnaturalización a 94 °C durante 2 min, 39 ciclos de amplificación, 30 s a 94 °C, 15 s a 58 °C, 30 s a 72 °C, extensión final de 5 min a 72 °C. (1) Fw GAPDH hámster 5'- GGTTGCCAAACCTTATCAGAAATG-3'; (2) Rv GAPDH hámster 5'- TTCACCTGTTCCACAGCCTTG -3'.
- Analice los productos de PCR mediante electroforesis en gel de agarosa al 1%.
11. Seguimiento de hámsters mediante imágenes de bioluminiscencia in vivo
- Evaluar la progresión de la infección a lo largo del tiempo mediante la emisión de bioluminiscencia de todo el animal en el sistema de imágenes de bioluminiscencia in vivo , que consiste en una cámara de carga acoplada (CCD) refrigerada montada en una cámara hermética a la luz. Mantenga al animal anestesiado durante la adquisición de imágenes con la colocación de un cono nasal.
- Antes de la adquisición de la bioluminiscencia y 5 min antes de inducir la anestesia, inyectar D-luciferina (150 mg/kg) por vía intraperitoneal en hámsters siguiendo la sección 6. Prepare una solución calurosa de D-luciferina potásica de 15 mg/mL en PBS, filtre-esterilice y almacene a -80 oC.
- Cinco minutos después de inyectar a los animales con D-luciferina, anestesiarlos con isoflurano al 2% en una cámara de inducción rica en oxígeno. Después de otros 5 minutos, capture imágenes de bioluminiscencia con la cámara CCD. Obtener imágenes de hámsters en posición ventral 2 h y 24 h después de la infección, 8 y 22 días después de la infección (dpi).
NOTA: Mantenga la anestesia durante el proceso de diagnóstico por imágenes con el dispositivo de administración de oxígeno y isofluorano. - En función del nivel de emisión de bioluminiscencia, utilice los siguientes parámetros: tiempo de exposición, que oscila entre 30 s y 5 min, Binning medio o grande, f/stop 1 y campo de visión D (12, 5 cm).
12. Cuantificación de la bioluminiscencia en animales infectados con L. infantum-Luc
- Utilice la herramienta de medición manual para identificar las regiones de interés (ROI), el tamaño y el área en la cabeza y el cuerpo del animal. Cuantifique la bioluminiscencia adquirida por la cámara CCD en el ROI seleccionado.
- Mida la señal de fondo con el ROI de fondo promedio y reste de la emisión bioluminiscente obtenida del ROI manual.
- Expresa la emisión de bioluminiscencia en radiancia, una unidad normalizada por tiempo y área: photons.sec-1.cm-2.sr-1
Resultados
Expresión estable de luciferasa en L. infantum
Se produjo L. infantum modificado genéticamente utilizando el plásmido de la línea pLEXSY, que se integra en el genoma de Leishmania en el locus ribosómico 18S rRNA (ssu), cuya transcripción es impulsada por la ARN polimerasa I. Así, se evaluó la integración de plásmidos en el genoma de Leishmania y la expresión estable por emisión de bioluminiscencia in vitro. El clon de alta expresión que muestra una bioluminiscencia de >120 veces por encima del fondo se eligió para la evaluación de la integración genómica mediante PCR. Véase la Figura 1 para la electroforesis en gel de agarosa de productos de PCR para evaluar la integración de plásmidos en el genoma y la emisión de bioluminiscencia (RLU) de promastigotes del clon L. infantum-Luc. De cada PCR se obtuvieron fragmentos del tamaño esperado; un producto de aproximadamente 1,1 kb (5'ssu - UTR1), y otro de 1,8 kb (hyg-3'ssu) fueron amplificados a partir del genoma de L. infantum-Luc (Figura 1A), confirmando la integración del casete del plásmido y el gen de la luciferasa en el locus ssu del genoma de L. infantum .
La expresión de luciferasa luciérnaga también se evaluó en promastigotes de L. infantum-Luc mediante emisión de bioluminiscencia (RLU) en el lector de microplacas, como se describe en los protocolos, sección 2. Incluso después de varios pasos en cultivo y en ratones BALB/c durante 5 días, mantuvo el nivel de bioluminiscencia; 569.3 ± 19.5 para el fondo de tipo silvestre, y 59361.9 ± 2673.3 (n = 2) para L . infantum-Luc clonado (Figura 1B). Así, el clon de L. infantum-Luc que expresa de manera estable luciferasa de luciérnaga, se utilizó para infectar hámsters por vía intragingival o intraperitoneal.
Inóculo intravenoso en la vena gingival
Para inocular la Leishmania en el torrente sanguíneo de los hámsters, se debe tener cuidado de minimizar la perforación de las venas, el sangrado y la fuga del inóculo. Por lo tanto, el labio inferior debe tirarse suavemente hacia abajo para exponer la vena gingival (Figura 2A); y se debe utilizar una aguja de calibre más pequeño de 30 G para evitar la perforación excesiva de la vena. La aguja debe colocarse con el bisel hacia arriba para insertarla en la vena en un ángulo adecuado (Figura 2B). De hecho, para asegurarse de que la aguja se inyectó en el vaso sanguíneo (la vena labial mandibular), el émbolo de la jeringa debe tirarse hacia abajo hasta que la sangre se aspire en el cilindro de la aguja (Figura 2C). Antes de retirar la aguja, se debe aplicar una ligera presión con un hisopo de algodón para promover la hemostasia (Figura 2D).
Evaluación longitudinal por imágenes de bioluminiscencia
Los hámsters infectados intraperitonealmente (IP) o intragingival (IG) con L. infantum-Luc fueron seguidos hasta los 50dpi y fueron evaluados mediante imágenes de bioluminiscencia hasta los 22 dpi (Figura 3). Las imágenes se adquirieron 2 h después de la infección intraperitoneal con 108 parásitos en la cavidad peritoneal; Las imágenes se adquirieron durante 30 s o 1 min en medio de exposición binning. La señal de bioluminiscencia fue >65 veces más intensa en el abdomen en los animales infectados con amastigotes (4,6 ×10 5 ± 3,7 ×10 5) que en los infectados con promastigotes (6,8 ×10 3 ± 3,8 ×10 3) (Tabla 1), lo que demuestra que los amastigotes diferenciados in vitro son más bioluminiscentes que los promastigotes metacíclicos en la fase estacionaria y purificados en la almohadilla Ficoll.
Un día después de la infección (1 dpi), se adquirieron imágenes de bioluminiscencia durante 3 min de exposición (Figura 3). Hubo una disminución del 45% en la señal de bioluminiscencia en la región abdominal en los hámsteres infectados con promastigotes y del 70% en los infectados con amastigotes (Figura 3), lo que sugiere que los amastigotes se habían degradado en mayor medida que los promastigotes metacíclicos (Tabla 1 y Figura 4). Una semana después de la infección (8 dpi), los animales infectados con promastigotes mantuvieron la señal de bioluminiscencia (3,3 × 103 ± 5 × 103). Sin embargo, la emisión de bioluminiscencia en hámsteres infectados con amastigotes disminuyó un 95%, de 1,3 ×10 5 ± 1,1 × 105 a 6,7 ×10 3 ± 7,5 × 103 (Tabla 1) y alcanzó el mismo nivel de hámsteres infectados con promastigotes. Tres semanas después de la infección (22 dpi), se adquirió una señal de bioluminiscencia durante 5 min de exposición y agrupación grande (Figura 3); la señal fue mucho menor para los animales infectados con promastigotes y amastigotes (Tabla 1 y Figura 4).
Otro grupo de hámsters se infectó por vía intragingival con amastigotes y promastigotes de L. infantum-Luc (10,8); se observó emisión de bioluminiscencia en la región maxilar (Figura 3). El seguimiento comenzó 1 día después de la infección, y los hámsters infectados con amastigotes mostraron más señal de bioluminiscencia y luminosidad (7,3 ×10 3 ± 4,1 × 103) que los infectados con promastigotes (1 ×10 3 ± 5,7 × 102). Una semana después de la infección (8 dpi), se observó una caída del 36% en la señal de bioluminiscencia en los animales infectados con promastigotes y del 90% en los hámsteres infectados con amastigotes; El resplandor varió de 7,3 × 10,3 ± 4,1 × 103 a 7,8 × 102 ± 5,6 × 102 (Tabla 1). Tres semanas después de la infección (22 dpi), también se adquirió una señal de bioluminiscencia durante 5 min de exposición y binning grande (Figura 3). La señal de bioluminiscencia fue similar y baja para los animales infectados con promastigotes y amastigotes (Tabla 1 y Figura 4) en la cabeza de los animales infectados en la encía y no se observó dispersión de la infección a la región abdominal por la señal de bioluminiscencia.
Evaluación de la infección en tejidos y órganos por PCR
Realizamos PCR convencional para investigar infecciones en órganos específicos, como el hígado, el bazo y los ganglios linfáticos, que podrían estar por debajo del límite de detección de las imágenes in vivo . La región diana del ADNk fue más específica para la amplificación del ADN de L. infantum en tejidos y órganos infectados, y la PCR para la enzima GAPDH del hámster fue un control de la integridad del ADN y la reacción de PCR. Solo se consideraron en el análisis las muestras que se amplificaron para GAPDH . Así, por PCR, dos de los tres hámsters infectados por vía intraperitoneal con amastigotes axénicos mostraron infección en tejidos y órganos; el animal dos (A2) en el bazo y el animal tres (A3) en el hígado, a 50 ppp (Figura 5A). Un hámster se infectó intraperitonealmente con promastigotes axénicos; el animal tres (A3) (Figura 5B) mostró amplificación en el ganglio linfático. Los hámsters inoculados por vía intragingival con promastigotes o amastigotes axénicos a 50 dpi no pudieron mostrar una amplificación clara, solo una banda en el hígado del animal (A1) infectado con promastigotes (Figura 5C). Cabe destacar que tuvimos tres animales mantenidos durante 8 meses cuyo inóculo administrado por vía intragingival con amastigotes se filtró ligeramente durante la inyección. Dos de los tres animales mostraron una infección clara en el hígado, los animales uno y dos (Figura 5D).
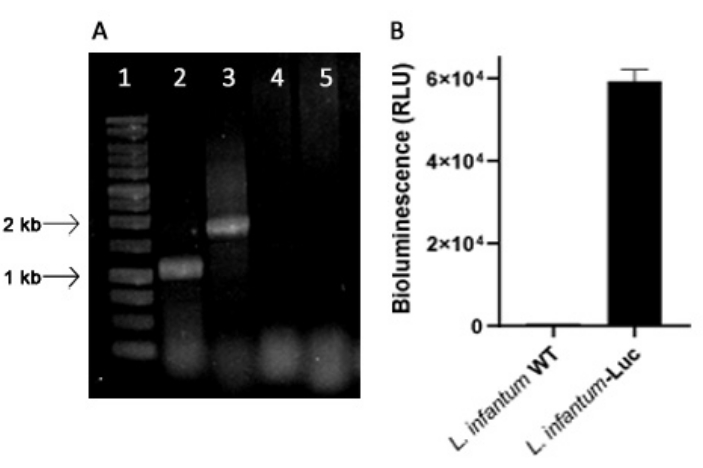
Figura 1: Evaluación del clon de Leishmania infantum-Luc por PCR y emisión de bioluminiscencia. (A) Electroforesis en gel de agarosa de productos de PCR para evaluar la integración de plásmidos en el genoma: carril 1 - 1 kb escalera de ADN; PCR del ADN genómico de L. infantum-Luc, carril 2 - 5'ssu - utr1 (1,1 kb) y carril 3- hyg- 3'ssu (1,8 kb); PCR de ADN genómico de L. infantum-wt, carriles 4 y 5. (B) Emisión de bioluminiscencia (RLU) de promastigotes del clon L. infantum-Luc (106) en el lector de microplacas. Haga clic aquí para ver una versión más grande de esta figura.
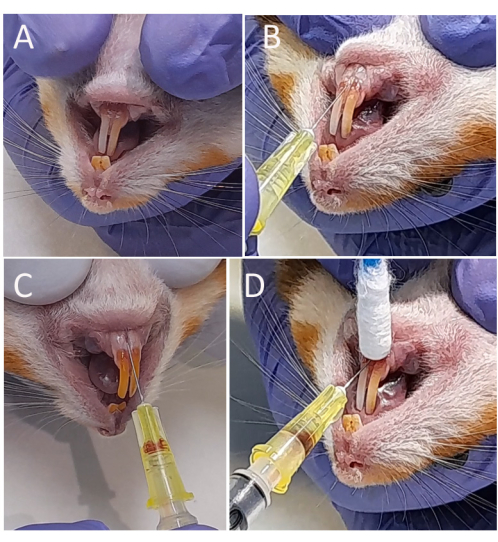
Figura 2: Inyección intravenosa de Leishmania infantum-Luc en la vena gingival. (A) Se colocó al hámster en decúbito dorsal y se tiró del labio inferior hacia abajo. (B) Se colocó una aguja más delgada (8 x 0,30 mm) acoplada a una jeringa de 1 mL debajo de los incisivos inferiores a lo largo de la línea media entre el par de dientes en un ángulo de 25º y se insertó 2-4 mm en la vena mandibular labial. (C) Inoculación de 50 μL (108) de amastigotes o promastigotes en PBS. (D) Hemostasia usando un hisopo de algodón y aplicando una ligera presión en el sitio de inoculación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Seguimiento mediante imágenes de bioluminiscencia in vivo . Imágenes representativas de un animal por grupo: Infectados por vía intraperitoneal (paneles superiores) o intragingival (paneles inferiores), con amastigotes o promastigotes de L. infantum-Luc, durante 1, 8 y 22 dpi. El ROI rojo representa las regiones sondeadas en el abdomen y la cabeza, para la infección intraperitoneal o intragingival, respectivamente. Los datos muestran que a 1 dpi, todos los animales mostraron una señal de bioluminiscencia en el abdomen o la mandíbula. La señal caía después de 8 ppp y era casi indetectable en cualquier grupo a 22 ppp. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis comparativo de la radiación de las imágenes de bioluminiscencia. La cuantificación de la radiancia photons.sec-1.cm-2.sr-1 se realizó en el abdomen o la cabeza de hámsters con herramientas manuales de medición de ROI. El ROI promedio de fondo se restó del ROI de la medición para eliminar cualquier señal espuria. Haga clic aquí para ver una versión más grande de esta figura.
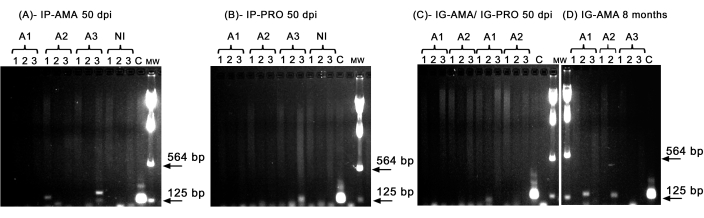
Figura 5: Amplificación por PCR de kDNA. (A) IP-AMA, hámsters infectados por vía intraperitoneal con amastigote, 50 dpi (n = 3); (B) IP-PRO, infectado por vía intraperitoneal con promastigotes, 50 dpi (n = 3); (C) IG-AMA, infectado por vía intragingival con amastigote (n = 2), IG-PRO, infectado por vía intragingival con promastigote (n = 2); (D) IG-AMA, infectado por vía intragingival con amastigote, 8 meses después de la infección (n = 3). NI, hámsters no infectados como control negativo (n = 2); C- ADN genómico de L. infantum-Luc, control positivo de PCR. Tejidos y órganos: 1- bazo, 2- hígado, 3- ganglios linfáticos. MW: marcador de peso molecular, las flechas indican las bandas de peso molecular más bajo. A1- animal uno, A2- animal dos y A3- animal tres. Haga clic aquí para ver una versión más grande de esta figura.
| ppp | Amastigotes IP | Promastigotes IP | Amastigotes IG | Promastigotes IG | ||||||||
| Significar | SD | N | Significar | SD | N | Significar | SD | N | Significar | SD | N | |
| 0 | 4.6 x 105 | 3.7 x 105 | 3 | 6.8 x 103 | 3.8 x 103 | 3 | - | - | - | - | - | - |
| 1 | 1.3 x 105 | 1.1 x 105 | 3 | 3.8 x 103 | 5.5 x 103 | 3 | 7.3 x 103 | 4.1 x 103 | 2 | 1.0 x 103 | 5.7 x 102 | 2 |
| 8 | 6.7 x 103 | 7.5 x 103 | 3 | 3.3 x 103 | 5.0 x 103 | 3 | 7.8 x 102 | 5.6 x 102 | 2 | 6.4 x 102 | 8.2 x 101 | 2 |
| 22 | 7.3 x 101 | 8.5 x 101 | 3 | 9.9 x 101 | 8.6 x 101 | 3 | 4.6 x 102 | 7.5 x 101 | 2 | 5.0 x 102 | 1.5 x 102 | 2 |
Tabla 1: Datos brutos del análisis comparativo de radiancia de imágenes de bioluminiscencia. Cuantificación de radiancia promedio de fotones.sec-1.cm-2.sr-1 por grupo y ruta. Abreviaturas: dpi = días después de la infección; DE = desviación estándar; N = tamaño de la muestra.
Discusión
La extracción de sangre o la inyección intravenosa de sustancias en hámsters es necesaria para diversos estudios científicos. Se han desarrollado varios métodos para acceder a diferentes rutas de recolección o inoculación directamente relacionadas con los objetivos de la investigación19. Debido a la anatomía del hámster, una cola y extremidades cortas, la vía intracardíaca suele ser la opción para la inyección intravenosa de Leishmania. Dependiendo de la cepa utilizada, la vía intracardíaca resultó ventajosa como la cepa de referencia L. infantum MHOM/BR/1974/PP75, cuya infección ocurre a largo plazo, 6-9 meses5. Sin embargo, es un inóculo que puede provocar hemorragias y la muerte del animal. Por lo tanto, estandarizamos una ruta alternativa de inoculación intravenosa para la infección en el plexo gingival, vena labial mandibular, que causa menos daño al animal. Los animales fueron infectados con la cepa de referencia genéticamente modificada L. infantum MHOM/BR/1974/PP75, que expresó de manera estable la luciferasa de luciérnaga incluso después de varios pasos en cultivo y ratones (Figura 1), como se relaciona para otras especies de Leishmania transfectadas por el mismo plásmido integrador20.
La vena mandibular labial o vena gingival es una mejor vía para la toma de muestras de sangre y para la extracción múltiplede sangre 10,11. Sin embargo, esta es la primera demostración de que la vena gingival es un sitio factible para la infección intravenosa por Leishmania en hámsters. A diferencia de la toma de muestras de sangre que suele utilizar una aguja de calibre alto de 26 G para evitar la hemólisis sanguínea10, esta aguja no era apropiada para la inoculación de Leishmania, debido a la perforación de la vena, el sangrado y la fuga del inóculo. Para la infección por Leishmania a través de la vena maxilar mandibular, fue esencial una aguja 30G de menor calibre. Otro aspecto que diferencia la punción venosa a la infección vía gingival es la tasa de administración, en torno a 1 μL/s; y para asegurar que se inyecta en el vaso, la vena labial mandibular, y no se aloja en la mucosa, subcutánea o intradérmica. Debido al bajo recambio sanguíneo del plexo gingival, los 50 μL de un inóculo de alta densidad de amastigotes axénicos o promastigotes de L. infantum-Luc, 2 x 109 parásitos/mL, tuvieron que ser inoculados lentamente (~ 1 min), y la aguja debe ser retirada manteniendo el hisopo presionado durante 1 min para permitir la dispersión del inóculo en el torrente sanguíneo (Figura 2).
Para la evaluación longitudinal de la infección, los hámsters se infectaron por vía intraperitoneal (IP) o por vía intragingival (IG) con L. infantum-Luc y se les hizo un seguimiento de 50 ppp mediante el sistema de imágenes de bioluminiscencia hasta la eutanasia. Teniendo en cuenta que la cepa de referencia PP75 podría ser menos virulenta per se y que la superexpresión de luciferasa también podría afectar la efectividad de la infección y mantener la infección a largo plazo, se utilizó un inóculo alto de 10a 8 parásitos para la infección. Después de la inoculación gingival de amastigotes y promastigotes de L. infantum-Luc y la evaluación por el sistema de imágenes de bioluminiscencia, la bioluminiscencia se restringió a la región maxilar de los hámsters 24 h después de la infección. De hecho, los hámsters infectados intraperitonealmente con amastigotes y promastigotes de L. infantum-Luc mostraron bioluminiscencia dispersa por todo el abdomen (Figura 3, 1 dpi). La disminución continua de la emisión bioluminiscente a lo largo del tiempo, desde el primer día de infección hasta el8º día y hasta el22º dpi en hámsteres infectados con L. infantum-Luc, fue independiente de la vía de inoculación (Tabla 1 y Figura 4).
Sin embargo, cuando la carga de parásitos en los tejidos animales es baja, puede estar por debajo del límite de detección del sistema de imágenes de bioluminiscencia, pero puede detectarse y cuantificarse mediante PCR o qPCR. Como ya se ha informado, la infección causada por la cepa PP75 es efectivamente menor que la de otras cepas5, y solo unos pocos desarrollaron signos clínicos de la enfermedad debido a la variabilidad genética de los animales. En este estudio, a pesar del pequeño número de animales y la baja virulencia de esta cepa, los amastigotes axénicos demostraron una ventaja a 50 dpi, mostrando mejor infección que los promastigotes, según lo demostrado por PCR (Figura 5). Ocho meses después de la infección por amastigotes por vía gingival, los parásitos pudieron ser detectados por PCR en el hígado (Figura 5) y también mostraron piloerección moderada, opresión orbitaria y postura arqueada.
Los amastigotes axénicos pueden ser una mejor opción para la infección y el seguimiento que los promastigotes21 y tienen la ventaja de ser fáciles de producir a gran escala. El inóculo gingival es factible y una mejor ruta para la inoculación intravenosa de compuestos y para la infección de Leishmania y otros patógenos, sin daño o hinchazón en el sitio de aplicación en la mandíbula o para la salud del animal.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Fundação de Apoio ao Desenvolvimento do Ensino, Ciência e Tecnologia do Estado de Mato Grosso do Sul- FUNDECT. PPSUS/ Decit-MS/CNPq/SES proporcionó apoyo financiero para esta investigación. Gracias a Monique Ribeiro de Lima por sus consejos sobre las vías de inoculación. Este proyecto fue desarrollado en el marco del Convenio de CooperaciónNº 258/2017 entre la FIOCRUZ y la Universidad Federal de Río de Janeiro (UFRJ). El equipo agradece sinceramente a los productores de video Ricardo Baptista Schmidt y Genilton José Vieira del Centro de Divulgación Científica (COI) por su invaluable apoyo y asistencia en la filmación de los protocolos y la realización de las entrevistas.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 kb ladder | Promega | G5711 | |
| 1-Butanol | Sigma-Aldrich | B7906 | |
| Acetyl coenzyme A | Sigma-Aldrich | A2181 | |
| Agarose, LE, Analytical Grade | Promega | V3125 | |
| aprt reverse primer A1715 aprt reverse primer A1715 | Jena Bioscience | PM-111 | |
| BamHI 10 U/mL | Promega | R6021 | |
| BglII 10 U/mL | Promega | R6071 | |
| brain and heart infusion (BHI) | Sigma-Aldrich | 53286 | |
| Cetamin (Ketamine hydrochloride 10%) | Syntec | - | Veterinary use. Anesthetic. Injectable solution containing a 10 mL vial of 10% ketamine hydrochloride. |
| Dextrose Glucose, BD Diagnostics | Difco | 215530 | |
| D-luciferin potassium salt | Promega | E1601 | |
| DMEM low glucose | Sigma-Aldrich | D6046 | |
| eletroporador Gene Pulser Xcell | BioRad Laboratories | ||
| Fetal calf serum (FCS) | vitrocell/embriolife | ||
| Ficoll-plaqueTM PLUS | Cytiva | 17144003 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.2 cm gap 1652082 | Bio-Rad | 1652082 | |
| Gene Pulser/MicroPulser Electroporation Cuvettes, 0.4 cm gap 1652081 | Bio-Rad | 1652081 | |
| GoTaq Platinum polymerase | Fischer Scientific | 10-966-034 | |
| GoTaq DNA Polymerase | Promega | M3001 | |
| Hemin powder | inlab | ||
| HEPES buffer | Sigma-Aldrich | H3375 Sigma-Aldrich | |
| hyg forward primer A3804 | Jena Bioscience | PM-109 | |
| Hygromycin | Sigma-Aldrich | H3274 | |
| ISOFORINE | Cristalia | Inhalation solution in packs containing 1 bottle of 100 and 240 mL of isoflurane | |
| IVIS Lumina | Perkin Elmer | ISO838N4625 | |
| JM109 Competent Cells | Promega | L2005 | |
| L- Glutamin | Sigma-Aldrich | G8540 Sigma-Aldrich | |
| Lambda DNA/HindIII Marker | Thermo Fischer Scientific | SM0101 | |
| L-cystein | Sigma-Aldrich | 168149 Sigma-Aldrich | |
| Living Image software | Perkin Elmer | - | |
| NotI 10 U/mL | Promega | R6431 | |
| Phenol/Chloroform/Isoamyl Alcohol, 25:24:1 (v/v), Molecular Biology Grade | Sigma-Aldrich | 516726 | |
| Phosphate-buffered saline (DPBS) | Gibco | 14190 | |
| plasmid pLEXSY-hyg2 | Jena Bioscience | EGE-232 | |
| Proteinase K | Promega | V3021 | |
| QIAGEN Plasmid Midi Kit | Qiagen | 12143 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| QIAquick PCR & Gel Cleanup Kit | Promega | A9281 | |
| Schneider's medium | Gibco | 21720-024 | |
| Sodium bicarbonate | Sigma-Aldrich | S6014 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 Sigma-Al | |
| SpectraMax2 microplate reader | Applied Biosystems | ||
| ssu forward primer F3001 primer F3001 | Jena Bioscience | PM-105 | |
| ssu reverse primer F3002 ssu reverse primer F3002 | Jena Bioscience | PM-104 | |
| Steady-Glo Luciferase Assay System | Promega | E2510 | |
| SwaI 10 U/mL | Thermo Scientific | ER1241 | |
| T4 DNA ligase 1 U/mL | Promega | M1801 | |
| T4 fast ligation system | Promega | M8221 | |
| Thermal cycler | Applied Biosystems | Veritiy 96 well plate | |
| TRITON X-100 | Sigma-Aldrich | T8787 Sigma-Aldrich | |
| Tryptic Soy Broth (Soybean-Casein Digest Medium) | Difco-BD | 211823 | |
| Ventilated racks | Alesco | ||
| With Earle′s salts and L-glutamine, without sodium bicarbonate, powder, | Merck | M5017 | |
| Wizard SV Gel and PCR Clean-Up | Promega | A9282 | |
| Xilazina (Xylazine hydrochloride 2%) | Syntec | - | Veterinary use. Sedative, analgesic and myorelaxant. Injectable solution containing a 10 mL vial of 2% xylazine hydrochloride. |
| Zero Blunt TOPO PCR Cloning Kit | Thermo Fischer | 451245 |
Referencias
- Ruiz-Postigo, J. A., et al. Global leishmaniasis surveillance, 2022: assessing trends over the past 10 years. WHO, Weekly epidemiological record n° 40. , (2023).
- Faraut-Gambarelli, F., et al. In vitro and in vivo resistance of Leishmania infantum to meglumine antimoniate: a study of 37 strains collected from patients with visceral leishmaniasis. Antimicrob Agents Chemother. 41 (4), 827-830 (1997).
- Ribeiro-Romão, R. P., et al. Comparative evaluation of lesion development, tissue damage, and cytokine expression in golden hamsters (Mesocricetus auratus) infected by inocula with different Leishmania (Viannia) braziliensis concentrations. Infect Immun. 82 (12), 5203-5213 (2014).
- Gomes-Silva, A., et al. hamster (Mesocricetus auratus) as an experimental model for Leishmania (Viannia) braziliensis infection. Parasitology. 140 (6), 771-779 (2013).
- Moreira, N. D., et al. hematological and biochemical alterations in hamster (Mesocricetus auratus) experimentally infected with Leishmania infantum through different routes of inoculation. Parasit Vectors. 9 (1), 181-194 (2016).
- Carnielli, J. B. T., et al. A Leishmania infantum genetic marker associated with miltefosine treatment failure for visceral leishmaniasis. EBioMedicine. 36, 83-91 (2018).
- Carnielli, J. B. T., et al. Natural resistance of Leishmania infantum to miltefosine contributes to the low efficacy in the treatment of visceral leishmaniasis in Brazil. Am J Trop Med Hyg. 101 (4), 789-794 (2019).
- Moreira, D., et al. Impact of continuous axenic cultivation in Leishmania infantum virulence. PLoS Negl Trop Dis. 6 (1), e1469 (2012).
- Fortin, A., et al. Efficacy and tolerability of oleylphosphocholine (OlPC) in a laboratory model of visceral leishmaniasis. J Antimicrob Chemother. 67 (11), 2707-2712 (2012).
- Rodrigues, M. V., et al. The gingival vein is a minimally traumatic site for multiple blood sampling in guinea pigs and hamsters. PLoS ONE. 12 (5), e0177967 (2017).
- Oliveira, D. T., et al. Technical report: Gingival vein punction: A new simple technique for drug administration or blood sampling in rats and mice. Scand J Lab Anim Sci. 36 (2), 109-113 (2009).
- Saeij, J. P., et al. Bioluminescence imaging of Toxoplasma gondii infection in living mice reveals dramatic differences between strains. Infect Immun. 73 (2), 695-702 (2005).
- Thalhofer, C. J., et al. In vivo imaging of transgenic Leishmania parasites in a live host. J Vis Exp. 41, e1980 (2010).
- Andriani, G., et al. Activity in vivo of anti-Trypanosoma cruzi compounds selected from a high throughput screening. PLoS Negl Trop Dis. 5 (8), e1298 (2011).
- Henriques, C., et al. In vivo imaging of mice infected with bioluminescent Trypanosoma cruzi unveils novel sites of infection. Parasit Vectors. 7, 89 (2014).
- Henriques, C., et al. Bioluminescent imaging of Trypanosoma cruzi infection in Rhodnius prolixus. Parasit Vectors. 26 (5), 214 (2012).
- Sereno, D., Lemesre, J. L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob Agents Chemother. 41 (5), 972-976 (1997).
- Lachaud, L., et al. Value of two PCR methods for the diagnosis of canine visceral leishmaniasis and the detection of asymptomatic carriers. Parasitology. , 197-207 (2002).
- . Blood sampling Microsite Available from: https://www.nc3rs.org.uk/3rs-resources/blood-sampling/blood-sampling-hamster (2021)
- Bolhassani, A., et al. Fluorescent Leishmania species: development of stable GFP expression and its application for in vitro and in vivo studies. Exp Parasitol. 127 (3), 637-645 (2011).
- Mendes Costa, D., et al. Murine infection with bioluminescent Leishmania infantum axenic amastigotes applied to drug discovery. Sci Rep. 9 (1), 18989 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados