Method Article
経上皮電気インピーダンスモニタリングによる多孔質基板ベースのエレクトロポレーション
要約
多孔質基質エレクトロポレーション(PSEP)は、一貫したハイスループットデリバリーと高い細胞生存率を兼ね備えています。経上皮電気インピーダンス(TEEI)測定の導入により、PSEPの中間プロセスに関する洞察が得られ、ラベルフリーの送達が可能になります。この記事では、PSEP送達実験とTEEI測定解析を同時に行う方法について説明します。
要約
多孔質基板エレクトロポレーション(PSEP)は、高スループットと一貫した送達を提供する新しいエレクトロポレーション方法です。他の多くの種類の細胞内送達と同様に、PSEPは、送達の成功を判断するために蛍光マーカーと蛍光顕微鏡法に大きく依存しています。エレクトロポレーションプロセスの中間ステップに関する洞察を得るために、経上皮電気インピーダンス(TEEI)モニタリングを統合したPSEPプラットフォームが開発されました。細胞は、多孔質膜を備えた市販のインサートで培養されます。完全にコンフルエントな細胞単層の形成を可能にするための12時間のインキュベーション期間の後、インサートをPSEPデバイスのウェルにあるトランスフェクション培地に入れます。次に、細胞単層をユーザー定義の波形にさらし、蛍光顕微鏡で送達効率を確認します。このワークフローは、PSEPプロセスに関する追加データを収集するために、パルス顕微鏡と蛍光顕微鏡の間のTEEI測定によって大幅に強化でき、この追加のTEEIデータは、送達効率や生存率などの送達指標と相関しています。この記事では、TEEI測定でPSEPを実行するためのプロトコルについて説明します。
概要
エレクトロポレーションは、細胞を電場にさらす技術で、細胞膜に一時的な孔を作り、タンパク質、RNA、DNAなどのカーゴが通過できるようにします1,2。最も広く使用されているのは、バルクエレクトロポレーション(BEP)です。BEPは、数百万個の細胞を含む電解質をキュベットに充填し、電解質を高電圧にさらし、拡散またはエンドサイトーシスを通じて貨物を細胞内に侵入させることによって実行されます1。BEPには、ハイスループットや多数の市販システムなど、多くの利点があります。ただし、BEP 配信には制限があります。電極に対する細胞の位置に一貫性がなく、隣接する細胞からの電界遮蔽により、BEP 3,4中の電界ばく露に大きなばらつきが生じます。BEPに必要な高電圧は、細胞の生存率にも大きな悪影響を及ぼします5。2011年6月の開始以来、多孔質基質エレクトロポレーション(PSEP)と呼ばれるエレクトロポレーション法への関心が高まっているが、局在エレクトロポレーションやナノまたはマイクロエレクトロポレーション1,7,8などの他の名前で呼ばれることもある。BEPの細胞懸濁液とは対照的に、PSEPは多孔質基質に接着した細胞上で行われます。接着状態は、大多数のヒト細胞株9にとって好ましいだけでなく、基質の細孔も電流に焦点を合わせ、膜貫通電位(TMP)を細胞膜の特定の領域に局在させる10,11。この局在化により、印加電圧の大幅な低減が可能になり、損傷が減少し、細胞の生存率が向上します。この効果の組み合わせは、細胞膜の細孔形成を制御するのに役立ち、その結果、より一貫性のある効率的な送達が実現します1,5,12。
最近の研究では、市販の多孔質膜インサート13 (図1A、B)を保持するための6ウェルの金メッキ電極アレイを備えたPSEPデバイスが導入されました。これは、Vindisらによって最初に導入された方法です14。このデバイスは、パルスを印加し、経上皮電気インピーダンス(TEEI)として知られる細胞単層全体の電気インピーダンスをリアルタイムで測定できます13。デバイスのユーザーインターフェースにより、エレクトロポレーション波形と極性を完全に制御できます。重要なのは、リアルタイムのインピーダンス測定を使用して、高価な試薬や蛍光マーカーを必要とせずに送達結果を予測できることです。これはラベルフリー送達15として知られています。
PSEPプラットフォームは、パルス発生器とTEEI測定装置を収容するデバイスの本体と、多孔質基板が挿入され、エレクトロポレーションが発生する電極アレイの2つの主要なカスタム電気部品で構成されています。すべてのカスタム電子機器と3Dプリントコンポーネントの図は、GitHub: https://github.com/YangLabUNL/PSEP-TEEI にあります。カスタム電子機器に加えて、プラットフォームが正しく機能するためにはコンピューターも必要です。このカスタムソフトウェアを実行するには MATLAB (バージョン 2021a 以降) が必要であり、解析用のデータを保存してアクセスするには Microsoft Excel が必要です。このプログラムは、カスタム電子機器を制御し、設定を調整するためのグラフィカルユーザーインターフェース(GUI)を提供します。これらのプログラムは、GitHub: https://github.com/YangLabUNL/PSEP-TEEI でも公開されています。
予備データでは、このプロセスはさまざまなタイプの接着細胞で可能であることが示唆されていますが(図1C)、この記事では、Brooksらがこの細胞株に最適であると判断したパラメータを使用したA431細胞の調製についてのみ説明します13。さらに、ヨウ化プロピジウム(PI)カーゴは細胞毒性があるため、2つの実験が行われ、1つ目は高濃度のPIトランスフェクション培地を使用して送達効率を定量化し、もう1つは細胞培養培地のみを使用してより長い時間スケールでTEEIを測定します。これらの実験では、同一のエレクトロポレーション波形を使用しているため、結果を相関させることができます(図1D)。

図1:電極アレイの組み立て図と基本データ(A)電極アレイのウェル内のインサートのCADモデル。(B)電極アレイのCADモデル。(C)選択した細胞株のPSEPによるインピーダンスの増加、細胞株あたりn = 3。エラーバー:平均の標準誤差。(D)配送効率とTEEI は相関データを増やします。送達効率は、送達実験からPI画像とカルセイン画像の両方で標識された細胞の数を、Hoechstで同定された細胞の総数で割ることによって計算されました。セル数は、カスタム CellProfiler パイプライン (電圧あたり n = 6) を使用して決定しました。エラーバー:(x軸とy軸)平均の標準誤差。この図は、Brooks et al.13から許可を得て転載しています。この図の拡大版を表示するには、ここをクリックしてください。
プロトコル
本試験で使用した試薬および機器の詳細は、 資料表に記載されています。
1. 試薬の調製と細胞培養
- 50 mLのウシ胎児血清(FBS)と5 mLのペニシリン-ストレプトマイシンをDulbecco's Modified Eagle Medium(DMEM)の500 mL容器に加えて、細胞培養培地を調製します。汚染のリスクを減らすために11個の50 mLアリコートを製造し、4°Cで冷蔵します。
- 製造元の指示に従って、リン酸緩衝生理食塩水(PBS)ストック溶液中に25 μg/mLのヒト血漿フィブロネクチン1 mLを作成します。
- DMEMストック溶液中に0.1 mg/mLのヨウ化プロピジウムを15 mL調製し、さまざまなカーゴ濃度での実験を可能にします。
- 調製した細胞培養培地12 mLを含むT75フラスコでA431細胞を培養します。細胞は1〜2日ごとに継代され、50%のコンフルエンシーが維持されました。
2. サンプル調製
- フィブロネクチンコーティング
- 12種類のインサートと2種類の24ウェルプレートを選択します。インサートを1つのウェルプレートにセットし、6つの列を2列作成します。2 番目のウェルプレートは、後で置いておきます。
- 1.5 mLチューブに52 μLのフィブロネクチンストック溶液と1,248 μLのPBSを混合して、1 μg/mLのフィブロネクチン溶液1,300 μLを作製します。
- 100 μLのフィブロネクチン溶液を各インサートに分配します。ウェルプレート内のインサートを37°Cで3時間インキュベートします。
- 細胞密度を最適化するための細胞濃度の調整
- フィブロネクチンのインキュベーションが完了する約1時間前に、A431細胞のT75フラスコをインキュベーターから取り出して細胞抽出します。
- フラスコ内の培地を吸引器で取り出し、5mLのPBSで洗浄します。同様にPBSを取り出し、トリプシン3mLを追加します。フラスコの側面を軽くたたいて細胞を完全に剥離する前に、3〜4分間インキュベートします。
- 6 mLの細胞培養培地をフラスコに加え、ピペットで激しく混合して残りの細胞を分離し、内容物を15 mLの遠心チューブに移します。100 x g 、20°Cで5分間遠心分離します。
- 細胞ペレットを乱さないように注意しながら、吸引器を使用して細胞培養培地とトリプシンを遠心分離管から取り出します。遠心チューブに1mLの培地を加え、(気泡を出さずに)前後にピペットで動かして細胞ペレットを分裂させ、細胞を再懸濁します。
- 細胞懸濁液10μL、細胞培養培地40μL、トリパンブルー色素50μLを200μLのチューブにピペットで移し、ピペットで十分に混合します。
- 染料混合物10μLを取り出し、血球計算盤に注入します。色素混合物を10%希釈して細胞をカウントし、15 mL遠心チューブ内の総細胞数を推定します。
注:このプロトコルでは、5,000,000細胞/ mLの濃度を想定しています。 - 目的の播種密度にインサートメンブレンの表面積を掛け、懸濁液中のカウントされた細胞数/mLで割り、1,000を掛けて、インサートあたりに必要な細胞懸濁液のマイクロリットルを計算します。
- 必要な細胞懸濁液の総量を求めるには、この数値に10を掛け(12個のインサートのうち3個が無細胞コントロールであるため、9個のサンプルに十分な細胞を確保するため)、最も近い整数に切り上げます。この場合、この実験には合計135μLの細胞懸濁液が必要です。
- 以前に計算した135 μLの細胞懸濁液と1,865 μLの細胞培養培地を別の15 mL遠心チューブで混合することにより、2,000 μLの調整済み細胞溶液を作成します。
- 細胞の播種
- フィブロネクチンのインキュベーションが完了したら、各インサートから余分なフィブロネクチンを取り除きます。
- 各インサートに100 μLの滅菌蒸留水を加えて、インサートを2回洗浄します。インサート間の洗浄時間が一定になるように、追加したのと同じ順序で水を取り除きます。
- 各インサートに100 μLの細胞培養培地を加えて、インサートを再度洗浄します。メディアは、インサート間で一貫した洗浄時間を確保するために、追加したのと同じ順序で取り出します。
- 細胞サンプルインサート
- 調整した細胞溶液200μLを各インサートにピペッティングして細胞を播種します。インサート間の一貫したコンフルエンシーを確保するには、分配前に遠心分離チューブ内で細胞溶液を混合し、分配後に各インサート内で再度混合します。
- ネガティブコントロールインサート
- 200 μLの細胞培養培地を各インサートにピペットで入れます。細胞サンプルインサートとの一貫性を保つには、ピペットを使用して各インサート内で細胞培養培地を混合します。
- ラベリングとインキュベーション
- 油性マーカーを使用して、2 番目のウェルプレートを 3 つのウェル幅の 2 つの列に分割する線を引きます (3 ウェルで実行される条件の場合)。各列を行に分割します。グリッド内の各領域に、関連するパラメーターのラベルを付けます。
- 1 mLの細胞培養培地をすべてのウェルに加えると、実験用のインサートが入ってきます。調製ウェルプレートから標識された実験ウェルプレートの適切な位置にインサートを移し、37°Cで少なくとも12時間インキュベートします。
3. 実験手順
- 配信実験
- 0.1 mg/mL PI 溶液 1.5 mL を電極アレイの各ウェルにピペットで移します。電極アレイの各ウェルにインサートを配置し、インサートの脚をアライメント溝に合わせ、インサートがウェルの上面と同じ高さになるようにします(図1A、B)。
- 上部電極プリント回路基板(PCB)を電極アレイウェルの上部にねじ込み、電極アレイをPSEPデバイスに接続します。
- 電極アレイを37°Cインキュベーターに少なくとも1時間置き、温度を平衡化させます。
- GUIの左上隅にある[Membrane]の横にあるドロップダウンをクリックし、[ 400 nm GBO]をクリックします。「Electrolyte」、「Cells」、「Cell Seeding Density」、および「Cell Duration」に対してこの手順を繰り返し、それぞれDMEM、A431、200、および12を選択します。
注:これらの値は記録保持のみを目的としており、デバイスの機能に影響を与えることはありません。正しいデータ追跡のために、必要に応じてこれらの値を調整してください。 - GUI の右側にある [Post Pulse Time Duration (min)] 編集フィールドに 1 を入力して、デフォルトのパルス後測定時間を 1 分に変更します。他のすべての設定はデフォルトの状態のままにします。
注:デフォルトのパルスパラメータは、30ボルト、20Hz、1msの持続時間、および200パルスの矩形波を作成します。デフォルトのTEEI測定パラメータは、0.5ボルト、100Hz、1,000Hz、10,000Hz、および100,000Hzです。 - 「実行」ボタンをクリックし、プロンプトが表示されたら、井戸 1-3 と 4-6 の適切な名前を入力します。[OK]をクリックして実験を開始します。
- インキュベーターから電極アレイを取り外し、プログラムの実行が終了したら、インサートを実験ウェルプレートの元の位置に戻します。
- 2 μL の Hoechst 33342 と 5 μL のカルセイン AM を 123 μL の細胞培養培地と 200 μL チューブで混合します。
- 10 μLの染色液を各ポストパルスインサートに静かにピペットで移し、インサートをインキュベーターに5分間戻します。
- ウェルプレートを5倍対物レンズを備えた蛍光顕微鏡のプレートホルダーに移します。明視野と各染色の蛍光を使用した画像。カメラをトリガーする前に、インサートを対物レンズの中央に配置します。
注:PI、calcein AM、およびHoechst 33342の励起波長は、それぞれ558 nm、495 nm、および353 nmです。発光波長は、それぞれ575nm、519nm、465nmです。
- TEEI測定実験
- 1.5 mLの細胞培養培地を電極アレイの各ウェルにピペットで移します。セルサンプルインサートをウェル1〜3に、コントロールインサートをウェル4〜6に配置し、インサートの足をアライメント溝に合わせ、インサートがウェルの上面と同じ高さになるようにします。
- 上部電極PCBを電極アレイウェルの上部にねじ込み、電極アレイをPSEPデバイスに接続します。
- 電極アレイを37°Cインキュベーターに少なくとも1時間置き、温度を平衡化させます。
- GUIの左上隅にある[Membrane]の横にあるドロップダウンをクリックし、[400 nm GBO]をクリックします。「Electrolyte」、「Cells」、「Cell Seeding Density」、および「Cell Duration」に対してこの手順を繰り返し、それぞれDMEM、A431、200、および12を選択します。
注:これらの値は記録保持のみを目的としており、デバイスの機能に影響を与えることはありません。正しいデータ追跡のために、必要に応じてこれらの値を調整してください。 - 残りの設定はすべてデフォルトの状態のままにします。
注:デフォルトのパルスパラメータは、30ボルト、20Hz、1msの持続時間、および200パルスの矩形波を作成します。デフォルトのTEEI測定パラメータは、0.5ボルト、100Hz、1,000Hz、10,000Hz、および100,000Hzです。 - 「実行」ボタンをクリックし、プロンプトが表示されたら、井戸 1-3 と 4-6 の適切な名前を入力します。[OK]をクリックして実験を開始します。
- インキュベーターから電極アレイを取り外し、プログラムの実行が終了したら、インサートを実験ウェルプレートの元の位置に戻します。
- 200 μLの反応チューブに、2 μLのHoechst 33342、5 μLのカルセインAM、および10 μLのPIを113 μLの細胞培養培地と混合します。
- 10 μLの染色液を各ポストパルスインサートにピペットで注入し、インサートをインキュベーターに5分間戻します。
- ウェルプレートを5倍対物レンズを備えた蛍光イメージング顕微鏡のプレートホルダーに移します。明視野と各染色の蛍光を使用した画像。カメラをトリガーする前に、インサートをレンズの中央に配置します。
注:PI、calcein AM、およびHoechst 33342の励起波長は、それぞれ558 nm、495 nm、および353 nmです。発光波長は、それぞれ575nm、519nm、465nmです。
4. データ分析
- CellProfiler パイプラインを使用した画像データの分析
- GitHub:https://github.com/YangLabUNL/PSEP-TEEI で提供されているカスタム CellProfiler ワークフローを使用して、配信と TEEI 測定実験画像を処理します。
- TEEI分析
- GUI の [Analysis ] タブをクリックします。
- GUIの下部にある インピーダンスタイプインジケータ をTEEIに切り替えます。
- 左上のボックスの矢印をクリックすると、データファイル内のすべての実験名が表示されます。TEEI測定実験からすべての 細胞サンプルデータ を選択します。
- 右側の次のボックスの矢印をクリックすると、データ ファイル内のすべての実験名が表示されます。TEAI測定からすべての 制御インサートデータ を選択します。
- 「実行」をクリックします。選択したセルサンプルデータを最も低い測定周波数で含む基本図が表示されます。
- GUI の右側にあるサンプル オプション ボックスで、矢印をクリックして、選択したすべての挿入データを表示します。外れ値を削除するには、適切なデータを選択し、下の [削除 ]をクリックします。
注: [削除 ] ボタンを最後にクリックして解析から削除されたデータは、[ 元に戻す ] ボタンで取得できます。 - [ 完了 ]をクリックして、目的のデータが図に表示されたら、次の図に進みます。
- 残りのセルサンプルデータと制御データについて、手順4.2.6と4.2.7を繰り返します。「Done」をクリックして最終的なデータセットを確認すると、完全な分析図が表示されます。
- 解析図を保存します。
結果
与えられたプロトコルは、TEEI測定を使用してエレクトロポレーションの中間プロセスを調べ、特にA431細胞株とPIカーゴについて送達予測を行う方法を確立します。このプロトコルの変更については、この記事で詳しく説明しますが、特定の値は変わる可能性がありますが、応答の一般的な傾向は一貫していることに注意することが重要です。例えば、初期ベースラインを下回るTEEIデータは細胞死に対応し、最小値を超えるTEEI値の最大増加は送達効率に対応する13。これらの一般的な傾向とその影響については、以下で説明します。
図2Aに示すように、PSEPプラットフォームの使用中には、さまざまなTEEI測定と細胞イメージングのトレンドが生じる可能性があります。このプロトコルの理想的な結果は、図 2Ai に示されている最適化された健康データと同様の曲線を生成することです。これは、ベースラインを下回る低下がなく、細胞死があったとしてもほとんどないことから、理想的な結果として特徴付けられます。さらに、最適化された健全曲線は、TEEIの最小値から最大の増加を示しており、送達効率が高いことを示しています13。これらの推論は、細胞単層のPSEP後イメージングによって裏付けられており、細胞死はごくわずかで、健康で完全にコンフルエントな細胞単層が明らかになります(図2Aiii)。さらに、同一のPSEP波形を使用した成功した送達実験は、図2Bに示す画像によって特徴付けることができます。適切なエレクトロポレーション波形の適用とカーゴの集中により、高い送達一貫性と細胞生存率が得られます。
細胞単層の健康状態とコンフルエンシーは、TEEIベースの送達予測16,17を成功裏に適用するために重要である。波形が最適化されていても、不健康または不完全な細胞単層は、図2Aiiの最適化された不健康なデータに示されているように、TEEI応答の低下をもたらします。ただし、この結果の画像(図2Avi)は、Brooksら13によるTEEI応答の解釈にまだ対応していることに注意してください。ベースラインを下回るディップはなく、細胞死がほぼゼロであることを示しています(図2C、D)。さらに、最小値からの減少の増加は、単分子膜内の細胞が少なくなると総PI送達が減少するため、送達効率に悪影響を与えることに対応します(図2C、D)。
最適化されていない波形を適用すると、TEEI応答がさらに大幅に低下する可能性があります。全エネルギーとそれが適用される時間枠に応じて、最適化されていない波形は、効率の低下からセル単層のほぼ完全な消滅まで、さまざまな結果を生み出す可能性があります(図2Ai、iii、v)。最適化されていない曲線と非常に最適化されていない曲線の両方で、ベースラインから大幅に減少しており、かなりの細胞死を示しています。しかし、最適化されていない波形が増えると、細胞の回収が妨げられ、送達効率が低下します。
送達効率は、送達実験からPI画像とカルセイン画像の両方で標識された細胞の数を、Hoechstで同定された細胞の総数で割ることによって計算されました。死亡は、TEEI測定実験でPIでマークされた細胞を取り、Hoechstで同定された細胞の総数で割ることによって計算されました。セル数は、両方のメトリクスのカスタム CellProfiler パイプラインを使用して決定しました。
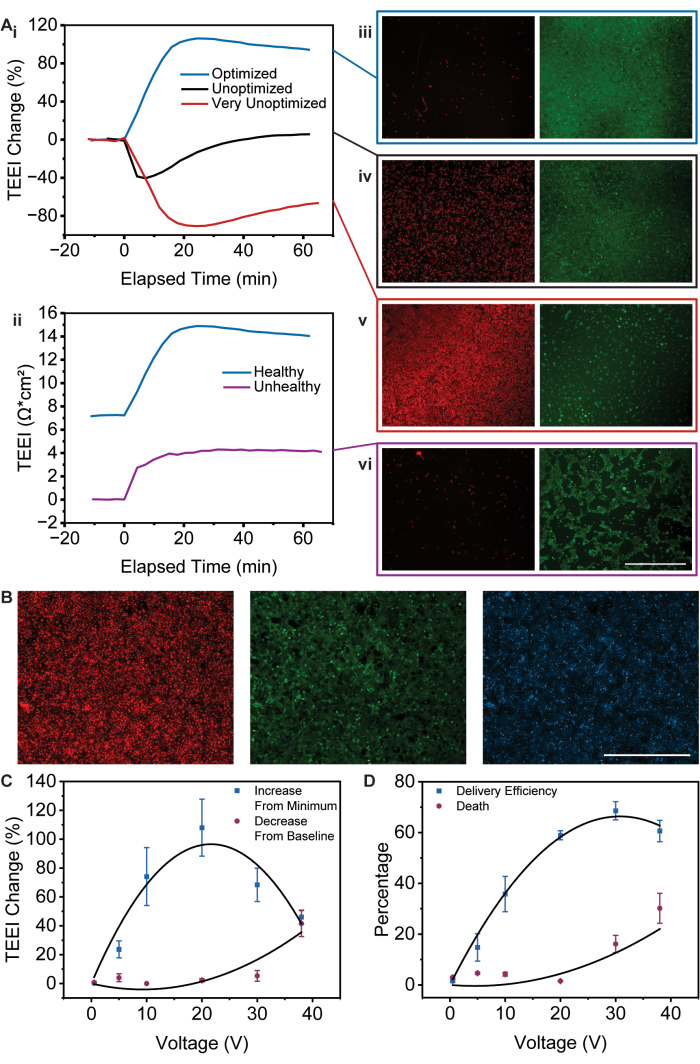
図2:一般的な条件のTEEI応答曲線とイメージング (A) (i) 最適化された条件と最適化されていない条件のTEEI変化率を示すTEEI応答データ。(ii)最適化された波形条件下での健康な単分子膜と不健康な単分子膜のTEEI応答比較。(III.-V)細胞死(赤)と生細胞(緑)を示す最適化された波形条件と最適化されていない波形条件の潜在的な結果の代表的なイメージング。(vi)細胞死(赤)生きた細胞(緑)を示す最適化された波形条件を適用した後の不健康な単分子膜の代表的なイメージング。(B)成功したPIデリバリー(赤)、生細胞(緑)、および核の位置(青)を示す画像。すべての画像が明るくなり、鮮明になりました。スケールバー:1000μm.(C)TEEIは、特定の電圧について、PSEP前のベースラインからPSEP後の最小値まで減少し、PSEP後の最小値からPSEP後のピークまで増加します。(D)特定の電圧に対する送達効率と細胞死率。エラーバーはSEM(n = 6)を表します。(C,D) 許可を得てBrooks et al.13 から転載。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
図2C は、TEEIが最小値から増加し、ベースラインから減少する様子を各PSEP波形電圧についてプロットすることを示しています。TEEIの増加は放物線弧を作成し、減少する前に約20ボルトでピークに達しますが、ベースラインからのTEEIの減少は電圧が増加するにつれて指数関数的に増加します。 図 2D の供給効率とデス パーセンテージはこれらの傾向を反映しており、デンス効率は放物線状に弧を描き、約 30 ボルトでピークに達し、波形電圧が増加するとデスは指数関数的に増加します。
TEEIの増加を引き起こす根本的なメカニズムの1つの仮説は、負に帯電した基板マイクロチャネルを介した電気浸透であり、電界18,19の印加によって引き起こされる現象である。TEEI応答が、エレクトロポレーション20で発生することが知られている要因である電気浸透液の流れによる細胞腫脹による機械的刺激によるものであろうと、波形自体の電気刺激によるものであろうと、エレクトロポレーションに必要な細胞膜を横切る適切な電圧降下を達成するためには、単層の健全性と完全性が最も重要なことは明らかである。このため、この方法で最も重要なステップは、細胞の播種と適切な細胞単層形成の確保に関するステップです。これは、細胞単層をイメージングし、ベースラインTEEI値によって確認できます。A431細胞の場合、平均TEEIは約7 Ω・cm²ですが、HEK293T細胞の平均はわずかに5 Ω・cm²であり(図2Aii)、これは形態学的な違いが細胞間結合面積の違いを引き起こしているためと思われます。
多孔質基板のエレクトロポレーションに必要な電界により、電気分解が起こり、電極が腐食する原因となります12,21。これは、この実験では正に帯電したPIを提供するために正に帯電したため、下部電極で特に顕著でした。実験を通じて、重大な悪影響が交換を必要とする前に、底部PCBを約20回使用できることが決定されました13。電極アレイを洗浄して再利用するには、吸引器を使用して、残りの細胞培養またはトランスフェクション培地をチャンバーから取り出します。各チャンバーの4分の3を70%エタノールで満たし、上部の電極PCBを電極アレイに配置して、上部の電極が水没するようにします。エタノールを電極アレイに少なくとも10分間置いてから、エタノールを取り出し、電極アレイを脇に置いて乾かします。
基板を取り外し、インサートを滅菌し、別のソースから取得した基板と交換することで、購入したインサートを再利用することが可能です。同じ細孔密度と直径の6ウェルインサートが市販されており、24ウェルインサートサイズの交換用基材を4枚回収するために使用できます。以前に使用したインサートを滅菌したら、10μLの紫外線硬化型エポキシを新しいシャーレに加えます。インサートの基板側をエポキシのプールに浸して底面をコーティングし、インサートの穴に新しい基板を慎重に置きます。エポキシ樹脂が完全なリングを作っていることを目視で確認し、接続部に隙間がないことを確認します。UVライトで30秒間硬化させ、再生したインサートを清潔な24ウェルプレートに保管して、再利用する前に新しい基材が損傷しないようにします。
前述したように、観察されたTEEIの増加は複数の細胞型で起こると仮定されていますが、それはA431およびHEK293T細胞株13 (図1C)でのみ実証されており、これらはどちらも接着細胞です。この方法は、異なる細胞株を選択すること、異なる細孔特性を持つ膜を選択すること、濃度を調整することによってフィブロネクチンコーティングを別の細胞外マトリックスタンパク質に置き換えること、またはカーゴを変更することによって変更することができます。ただし、実験の設定に変更を加えた場合は、波形を再最適化する必要がある場合があります。波形を最適化するために、3つのサンプルの各グループ間で電圧などの1つの波形パラメータのみを変更するTEEI測定実験を行うことができます。少なくとも 9 つの正常なサンプルで TEEI の最大の増加を特定して、最適な電圧を選択します。各波形パラメータに対してこのプロセスを繰り返し、新しく最適化された値を使用して次のパラメータに進みます。波形パラメータには複数の局所最適値が存在する可能性があることに注意してください(つまり、1つのパルス持続時間に最適な電圧が別のパルス持続時間に最適な電圧ではないかもしれません)。
多孔質基板エレクトロポレーションの利点は広範囲に及びます。細胞内送達の他の方法はかなりの期間存在していましたが、PSEPが有する1,13ほどの高度な制御とハイスループットを組み合わせたものはほとんどありません。さらに、プラットフォームではTEEI測定を使用しているため、エレクトロポレーションプロセスの中間ステップを垣間見ることができます。TEEIの測定値は、細胞の状態を伝え、エレクトロポレーションパラメータの選択を導き、特定の細胞の挙動とメカニズムについてさらに洞察することができます13,17。TEEI測定により、このプラットフォームはラベルフリーの送達13も可能であり、実験が行われるたびに高価なバイオマーカーや試薬の必要性を減らして迅速な最適化を可能にします。細胞内送達の分野へのこれらの貢献により、この製品は基礎生物学研究および生物医学応用のための送達プラットフォームとして最有力候補となっています。
開示事項
著者は、利益相反を宣言しません。
謝辞
NSF(Awards 1826135、1936065、2143997)、NIH国立総合医科学研究所P20GM113126(Nebraska Center for Integrated Biomolecular Communication)、P30GM127200(Nebraska Center for Nanomedicine)、Nebraska Collaborative Initiative、Voelte-Keegan Bioengineering Supportからの資金援助に感謝します。このデバイスは、Nebraska Research Initiativeが一部出資しているNanoEngineering Research Core Facility(NERCF)で製造されました。
資料
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
参考文献
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved