Method Article
基于多孔底物的电穿孔与跨上皮电阻抗监测
摘要
多孔底物电穿孔 (PSEP) 将一致、高通量的递送与高细胞活力配对。跨上皮电阻抗 (TEEI) 测量的引入提供了对 PSEP 中间过程的深入了解,并允许无标记交付。本文讨论了一种同时进行 PSEP 递送实验和 TEEI 测量分析的方法。
摘要
多孔底物电穿孔 (PSEP) 是一种新兴的电穿孔方法,可提供高通量和一致的递送。与许多其他类型的细胞内递送一样,PSEP 在很大程度上依赖于荧光标志物和荧光显微镜来确定递送是否成功。为了深入了解电穿孔过程的中间步骤,开发了一个集成了跨上皮电阻抗 (TEEI) 监测的 PSEP 平台。细胞在带有多孔膜的市售插入片段中培养。孵育 12 小时后,为了形成完全汇合的细胞单层,将插入片段置于位于 PSEP 装置孔中的转染培养基中。然后对细胞单层进行用户定义的波形,并通过荧光显微镜确认递送效率。通过脉冲和荧光显微镜之间的 TEEI 测量,可以显著增强该工作流程,以收集有关 PSEP 过程的额外数据,并且这些额外的 TEEI 数据与递送指标(如递送效率和活力)相关。本文介绍了使用 TEEI 测量执行 PSEP 的协议。
引言
电穿孔是一种将细胞暴露在电场中的技术,在细胞膜上形成临时孔,包括蛋白质、RNA 和 DNA 在内的货物可以通过该孔 1,2。使用最广泛的版本是体电穿孔 (BEP)。BEP 的执行方式是:在比色皿中填充含有数百万个细胞的电解质,将电解质暴露在高压下,并允许货物通过扩散或内吞作用进入细胞1。BEP 具有许多优点,包括高通量和众多市售系统。但是,BEP 交付存在限制。相对于电极的电池位置不一致和相邻电池的电场屏蔽会导致 BEP 3,4 期间电场暴露的显着变化。BEP 所需的高电压也对细胞活力有显著的负面影响5。自 2011 年问世以来6,人们对一种称为多孔衬底电穿孔 (PSEP) 的电穿孔方法越来越感兴趣,尽管它有时被称为其他名称,包括局部电穿孔和纳米或微电穿孔 1,7,8。与 BEP 的细胞悬液相比,PSEP 是在粘附在多孔基质上的细胞上进行的。不仅贴壁状态是大多数人类细胞系的首选9,而且底物中的孔也集中在电流上,将跨膜电位 (TMP) 定位到细胞膜的特定区域10,11。这种定位可以显著降低施加的电压,减少损伤并提高细胞活力。这种作用组合有助于控制细胞膜孔的发育,从而实现更一致和高效的递送 1,5,12。
最近的一项研究引入了一种具有六孔镀金电极阵列的 PSEP 装置,用于固定市售的多孔膜插入物13 (图 1A、B),这种做法最早由 Vindis 等人提出14。该设备可以施加脉冲并实时测量细胞单层的电阻抗,称为跨上皮电阻抗 (TEEI)13。该设备的用户界面允许完全控制电穿孔波形和极性。重要的是,实时阻抗测量可用于预测递送结果,而无需昂贵的试剂或荧光标记物,这一概念称为无标记递送15。
PSEP 平台由两个主要的定制电气组件组成:设备主体,容纳脉冲发生器和 TEEI 测量设备,以及电极阵列,插入多孔衬底并进行电穿孔。所有定制电子设备和 3D 打印组件的图表都可以在 GitHub 上找到:https://github.com/YangLabUNL/PSEP-TEEI。除了定制的电子设备外,还需要一台计算机才能使平台正常运行。自定义软件需要 MATLAB(版本 2021a 或更高版本)才能运行,并且需要 Microsoft Excel 来存储和访问数据以进行分析。该程序控制自定义电子设备并提供用于调整设置的图形用户界面 (GUI)。这些程序也可在 GitHub 上获得:https://github.com/YangLabUNL/PSEP-TEEI。
初步数据表明,这个过程对于不同类型的贴壁细胞是可能的(图 1C),但本文将仅使用 Brooks 等人发现最适合该细胞系的参数来讨论 A431 细胞的制备13。此外,由于碘化丙啶 (PI) 货物具有细胞毒性,因此进行了两项实验,第一次使用高浓度 PI 转染培养基来量化递送效率,第二次仅使用细胞培养基在更长的时间尺度上测量 TEEI。这些实验使用相同的电穿孔波形,允许将结果关联起来(图 1D)。

图 1:电极阵列组件图和基础数据。 (A) 电极阵列孔内插入物的 CAD 模型。(B) 电极阵列的 CAD 模型。(C) 对于选定的细胞系,PSEP 导致的阻抗增加,每个细胞系 n = 3。误差线:均值的标准误差。(D) 交付效率 vs.TEEI 增加相关数据。通过将递送实验中 PI 和钙黄绿素图像中标记的细胞数除以用 Hoechst 鉴定的细胞总数来计算递送效率。使用自定义 CellProfiler 管道确定电池单元计数,每个电压 n = 6。误差线:(x 轴和 y 轴)平均值的标准误差。此图经许可转载自 Brooks 等人 13 。 请单击此处查看此图的较大版本。
研究方案
材料 表中列出了研究中使用的试剂和设备的详细信息。
1. 试剂和细胞培养的制备
- 将 50 mL 胎牛血清 (FBS) 和 5 mL 青霉素-链霉素添加到 500 mL 的 Dulbecco 改良 Eagle 培养基 (DMEM) 容器中,制备细胞培养基。生产 11 个 50 mL 等分试样以降低污染风险,并在 4 °C 下冷藏。
- 根据制造商的说明,在磷酸盐缓冲盐水 (PBS) 储备液中制备 1 mL 25 μg/mL 人血浆纤连蛋白。
- 在 DMEM 储备液中制备 15 mL 0.1 mg/mL 碘化丙啶,以允许对不同货物浓度进行实验。
- 在含有 12 mL 制备的细胞培养基的 T75 培养瓶中培养 A431 细胞。每 1-2 天传代一次细胞以保持 50% 的汇合度。
2. 样品制备
- 纤连蛋白涂层
- 选择 12 个插件和 2 个 24 孔板。将插件放入一个孔板中,形成两排,每行 6 个。将第二个孔板放在一边,直到以后。
- 在 1.5 mL 试管中混合 52 μL 纤连蛋白储备液和 1,248 μL PBS,制备 1,300 μL 1 μg/mL 纤连蛋白溶液。
- 将 100 μL 纤连蛋白溶液分配到每个插入片段中。将插入物在孔板中于 37 °C 孵育 3 小时。
- 调整细胞浓度以优化细胞密度
- 在纤连蛋白孵育完成前约 1 小时,从培养箱中取出 A431 细胞的 T75 培养瓶进行细胞提取。
- 用抽吸器取出培养瓶中的培养基,并用 5 mL PBS 洗涤。以相同的方式去除 PBS 并加入 3 mL 胰蛋白酶。孵育 3-4 分钟,然后敲击培养瓶的侧面以完全分离细胞。
- 向培养瓶中加入 6 mL 细胞培养基,用移液管剧烈混合以分离任何剩余的细胞,并将内容物转移到 15 mL 离心管中。在 100 x g 和 20 °C 下离心 5 分钟。
- 使用抽吸器从离心管中取出细胞培养基和胰蛋白酶,注意不要干扰细胞沉淀。向离心管中加入 1 mL 培养基并来回移液(不产生气泡)以打碎细胞沉淀并重悬细胞。
- 将 10 μL 细胞悬液、40 μL 细胞培养基和 50 μL 台盼蓝染料移液到 200 μL 试管中,使用移液管充分混合。
- 取出 10 μL 染料混合物并将其注入血细胞计数器中。使用 10% 稀释的染料混合物对细胞进行计数,以估计 15 mL 离心管中的总细胞计数。
注:对于此方案,假设浓度为 5,000,000 个细胞/mL。 - 将所需的接种密度乘以插入膜的表面积,除以悬浮液中计数的细胞/mL,然后乘以 1,000 以计算每个插入片段所需的微升细胞悬液。
- 要找到所需的细胞悬液总量,请将此数字乘以 10(以确保 9 个样品有足够的细胞,因为 12 个插入片段中有 3 个是无细胞对照),然后四舍五入到最接近的整数。在这种情况下,本实验总共需要 135 μL 的细胞悬液。
- 将先前计算的 135 μL 细胞悬液与 1,865 μL 细胞培养基混合在单独的 15 mL 离心管中,制备 2,000 μL 调整后的细胞溶液。
- 接种细胞
- 纤连蛋白孵育完成后,从每个插入片段中去除多余的纤连蛋白。
- 向每个插件中加入 100 μL 无菌蒸馏水,洗涤插件两次。按照与添加水相同的顺序去除水,以确保插入物之间的洗涤时间一致。
- 向每个小室中加入 100 μL 细胞培养基,再次洗涤小室。按照添加介质的顺序去除介质,以确保插入片段之间的洗涤时间一致。
- 细胞样品插件
- 通过将 200 μL 调整后的细胞溶液移液到每个插入物中来接种细胞。为确保插入片段之间的一致汇合,请在分配前将细胞溶液混合在离心管中,并在分配后在每个插入管中再次混合。
- 阴性对照插件
- 将 200 μL 细胞培养基移液到每个插件中。为了与细胞样品插件保持一致,使用移液器混合每个插件内的细胞培养基。
- 标记和孵育
- 使用永久性记号笔画一条线,将第二个孔板分成两列,两列宽为三孔(对于一式三份的条件)。将每列分隔为行。使用相关参数标记网格中的每个区域。
- 向每个孔中加入 1 mL 细胞培养基,以获得用于实验的插入片段。将插入物从制备孔板转移到标记的实验孔板中的适当位置,并在 37 °C 下孵育至少 12 小时。
3. 实验程序
- 投放实验
- 将 1.5 mL 的 0.1 mg/mL PI 溶液移液到电极阵列中的每个孔中。将插入物放入电极阵列中的每个孔中,将插入物的支脚安装到对准槽中,使插入物与孔的上表面齐平(图 1A、B)。
- 将顶部电极印刷电路板 (PCB) 拧到电极阵列孔的顶部,并将电极阵列连接到 PSEP 设备。
- 将电极阵列置于 37 °C 培养箱中至少 1 小时,以使温度平衡。
- 单击 GUI 左上角“Membrane”(膜)旁边的下拉菜单,然后单击 400 nm GBO。对“电解质”、“细胞”、“细胞接种密度”和“细胞持续时间”重复此步骤,分别选择 DMEM、A431、200 和 12。
注意:这些值仅用于记录保存目的,不会影响设备的功能。请确保根据需要调整这些值,以便正确跟踪数据。 - 在 GUI 右侧的 Post Pulse Time Duration (min) 编辑字段中键入 1,将默认脉冲后测量时间更改为 1 min。将所有其他设置保留为默认状态。
注意:默认脉冲参数创建具有 30 伏特、20 赫兹、1 毫秒持续时间和 200 个脉冲的方波。默认 TEEI 测量参数为 0.5 伏和 100 Hz、1,000 Hz、10,000 Hz 和 100,000 Hz。 - 单击 “运行 ”按钮,并在出现提示时为孔 1-3 和 4-6 输入适当的名称。单击 OK 开始实验。
- 程序执行完成后,从培养箱中取出电极阵列,并将插入物转移回实验孔板中的原始位置。
- 在 200 μL 试管中混合 2 μL Hoechst 33342 和 5 μL 钙黄绿素 AM 与 123 μL 细胞培养基。
- 轻轻吸取 10 μL 染色溶液到每个脉冲后插入物中,然后将插入物放回培养箱中 5 分钟。
- 将孔板转移到具有 5 倍放大倍率物镜的荧光显微镜的板架上。使用明场和每种染色剂的荧光进行成像。在触发相机之前,将插入物对准物镜。
注:PI、钙黄绿素 AM 和 Hoechst 33342 的激发波长分别为 558 nm、495 nm 和 353 nm。发射波长分别为 575 nm、519 nm 和 465 nm。
- TEEI 测量实验
- 将 1.5 mL 细胞培养基移液到电极阵列中的每个孔中。将细胞样品插件放入孔 1-3 中,将对照插件放入孔 4-6 中,将插件的支脚安装到对齐槽中,使插件与孔的上表面齐平。
- 将顶部电极 PCB 拧到电极阵列孔的顶部,并将电极阵列连接到 PSEP 设备。
- 将电极阵列置于 37 °C 培养箱中至少 1 小时,以使温度平衡。
- 单击 GUI 左上角“Membrane”旁边的下拉菜单,然后单击 400 nm GBO。对“电解质”、“细胞”、“细胞接种密度”和“细胞持续时间”重复此步骤,分别选择 DMEM、A431、200 和 12。
注意:这些值仅用于记录保存目的,不会影响设备的功能。请确保根据需要调整这些值,以便正确跟踪数据。 - 将其余所有设置保留为默认状态。
注意:默认脉冲参数创建具有 30 伏特、20 赫兹、1 毫秒持续时间和 200 个脉冲的方波。默认 TEEI 测量参数为 0.5 伏和 100 Hz、1,000 Hz、10,000 Hz 和 100,000 Hz。 - 单击 “运行 ”按钮,并在出现提示时为孔 1-3 和 4-6 输入适当的名称。单击 OK 开始实验。
- 程序执行完成后,从培养箱中取出电极阵列,并将插入物转移回实验孔板中的原始位置。
- 在 200 μL 反应管中将 2 μL Hoechst 33342、5 μL 钙黄绿素 AM 和 10 μL PI 与 113 μL 细胞培养基混合。
- 将 10 μL 染色溶液移液到每个脉冲后插入物中,然后将插入物放回培养箱中 5 分钟。
- 将孔板转移到带有 5 倍物镜的荧光成像显微镜的板架上。使用明场和每种染色剂的荧光进行成像。在触发相机之前,将插件置于镜头的中心。
注:PI、钙黄绿素 AM 和 Hoechst 33342 的激发波长分别为 558 nm、495 nm 和 353 nm。发射波长分别为 575 nm、519 nm 和 465 nm。
4. 数据分析
- 使用 CellProfiler 管道分析图像数据
- 使用 GitHub 上提供的自定义 CellProfiler 工作流:https://github.com/YangLabUNL/PSEP-TEEI 处理投放和 TEEI 测量实验图像。
- TEEI 分析
- 单击 GUI 中的 Analysis 选项卡。
- 将 阻抗类型指示器 切换到 GUI 底部的 TEEI。
- 单击左上角框中的箭头可显示数据文件中的所有实验名称。从 TEEI 测量实验中选择所有 细胞样品数据 。
- 单击右侧下一个框中的箭头,以显示数据文件中的所有实验名称。从 TEEI 测量中选择所有 对照插入数据 。
- 单击 Run(运行)。将出现一个基本图,其中包含最低测量频率下选定的细胞样品数据。
- 在 GUI 右侧的示例选项框中,单击箭头以显示所有选定的插入数据。可以通过选择适当的数据并单击下面的 Remove 来删除异常值。
注意:通过上次单击 Remove 按钮从分析中删除的任何数据都可以通过 Undo 按钮进行检索。 - 点击 完成 当图中显示所需数据时,继续下一个图。
- 对剩余的细胞样品数据和控制数据重复步骤 4.2.6 和 4.2.7。当通过单击 “Done” 确认最终数据集后,将出现完整的分析图。
- 保存分析图窗。
结果
给定的协议建立了一种使用 TEEI 测量来检查电穿孔的中间过程并进行递送预测的方法,特别是对于 A431 细胞系和 PI 货物。虽然本文将进一步讨论此协议的修改,但现在需要注意的是,虽然具体值可能会发生变化,但响应的总体趋势保持不变。例如,低于初始基线的 TEEI 数据对应于细胞死亡,而 TEEI 值高于最小值的最大增加对应于递送效率13。下面将探讨这些总体趋势及其影响。
如图 2A 所示,使用 PSEP 平台时可能会出现一系列 TEEI 测量和细胞成像趋势。该协议的理想结果是产生类似于 图 2Ai 中所示的优化健康数据的曲线。这被描述为理想的结果,因为没有低于基线,表明细胞死亡非常少(如果有)。此外,优化后的健康曲线的 TEEI 从最小值增加最大,表明交付效率高13。这些推断得到了细胞单层的 PSEP 后成像的支持,它揭示了可忽略不计的细胞死亡和健康、完全融合的细胞单层(图 2Aiii)。此外,使用相同的 PSEP 波形的成功递送实验可以用 图 2B 中所示的图像来表征。适当的电穿孔波形应用和货物浓度可实现高度的递送一致性和细胞活力。
细胞单层的健康和汇合度对于基于 TEEI 的递送预测的成功应用至关重要16,17。即使使用优化的波形,不健康或不完整的细胞单层也会导致 TEEI 反应减弱,如图 2Aii 中优化的不健康数据所示。但是,请注意,该结果的图像(图 2Avi)仍然对应于 Brooks 等人 13 给出的 TEEI 响应的解释。基线以下没有下降,表明细胞死亡接近零(图 2C,D)。此外,从最小值减少的增加对应于对递送效率的负面影响,因为单层中较少的细胞减少了总 PI 递送(图 2C,D)。
如果应用未优化的波形,则可能会看到 TEEI 响应的显著降低幅度更大。根据总能量和应用它的时间范围,未优化的波形会产生从效率降低到细胞单层几乎完全湮灭的结果(图 2Ai,iii,v)。未优化和非常未优化的曲线均显示较基线显著减少,表明大量细胞死亡。然而,越来越未优化的波形会阻碍电池恢复,导致传输效率降低。
通过将递送实验中 PI 和钙黄绿素图像中标记的细胞数除以用 Hoechst 鉴定的细胞总数来计算递送效率。通过在 TEEI 测量实验中取 PI 标记的细胞并除以用 Hoechst 鉴定的细胞总数来计算死亡。对于这两个指标,使用自定义 CellProfiler 管道确定细胞计数。
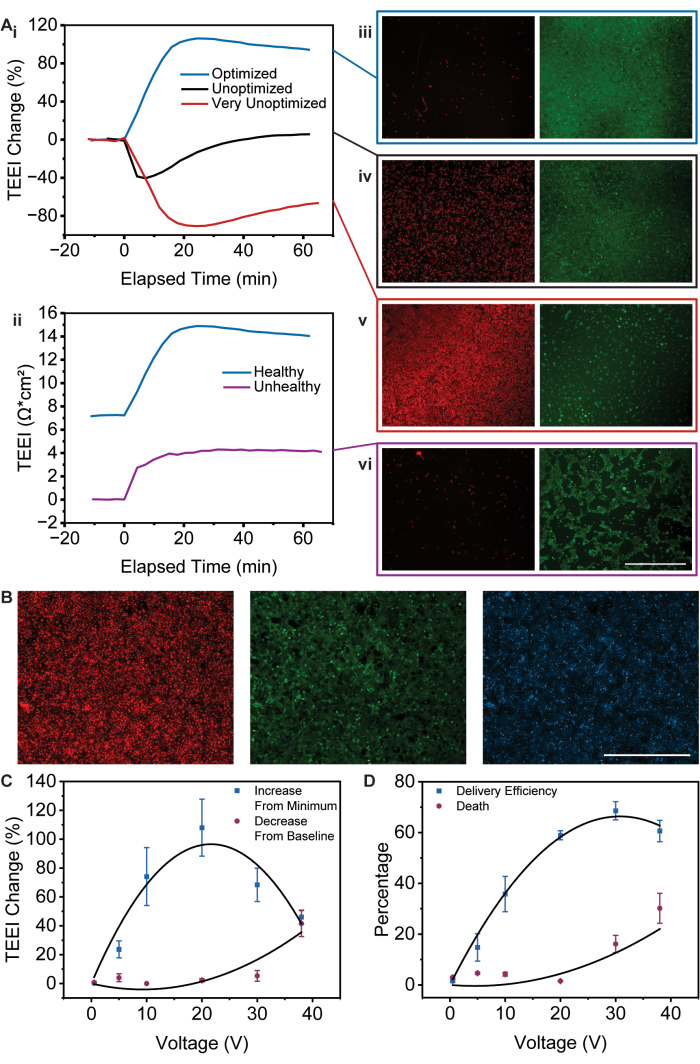
图 2:常见条件的 TEEI 响应曲线和成像。(A) (i) TEEI 响应数据说明了优化和未优化条件的 TEEI 变化百分比。(ii) 优化波形条件下健康和不健康单层之间的 TEEI 响应比较。(iii-v)优化和未优化波形条件的潜在结果的代表性成像,显示细胞死亡(红色)和活细胞(绿色)。(vi) 应用优化波形条件后不健康单层的代表性成像,显示细胞死亡(红色)活细胞(绿色)。(B) 显示 PI 成功递送(红色)、活细胞(绿色)和细胞核位置(蓝色)的图像。所有图像均变亮以使其清晰。比例尺:1000 μm。(C) 对于给定电压,TEEI 从 PSEP 前基线降低到 PSEP 后最小值,并从 PSEP 后最小值增加到 PSEP 后峰值。(D) 给定电压下的递送效率和细胞死亡百分比。误差线代表 SEM (n = 6)。(C,D) 经许可转载自 Brooks 等人 13。请单击此处查看此图的较大版本。
讨论
图 2C 表明,对于每个 PSEP 波形电压,TEEI 从最小值增加,从基线降低。TEEI 的增加会产生抛物线电弧,在降低之前达到 20 伏左右的峰值,而 TEEI 相对于基线的降低随着电压的增加呈指数增加。 图 2D 中的传输效率和死亡百分比反映了这些趋势,传输效率呈抛物线电弧,峰值约为 30 伏,并且随着波形电压的增加,死亡呈指数级增加。
导致 TEEI 增加的潜在机制的一种假设是通过带负电的底物微通道的电渗透,这是一种由施加电场引起的现象18,19。无论 TEEI 响应是由于电渗液流动引起的细胞膨胀的机械刺激(已知电穿孔20 发生的因素),还是由于波形本身的电刺激,很明显,单层的健康和完整性对于实现电穿孔所需的细胞膜上的适当电压降至关重要。因此,该方法中最关键的步骤是关于细胞接种和确保正确形成细胞单层的步骤。这可以通过细胞单层成像和基线 TEEI 值来确认。对于 A431 细胞,平均 TEEI 约为 7 Ω·cm²,而 HEK293T 细胞的平均 TEEI 略低 5 Ω·cm²(图 2Aii),可能是由于形态差异导致细胞间连接面积的差异。
由于多孔衬底电穿孔所需的电场,会发生电解,导致电极腐蚀12,21。这对于底部电极尤其明显,因为在该实验中,它带正电以产生带正电的 PI。通过实验,确定底部 PCB 可以使用大约 20 次,然后需要更换13 个重大负面影响。要清洁电极阵列以供重复使用,请使用抽吸器从腔室中取出剩余的细胞培养物或转染培养基。将每个腔室装满 70% 乙醇的四分之三,然后将顶部电极 PCB 放在电极阵列上,以便将顶部电极浸没。将乙醇留在电极阵列中至少 10 分钟,然后去除乙醇并将电极阵列放在一边晾干。
可以通过去除基材、对插件进行消毒并用从其他来源取的基材替换基材来重复使用购买的插件。具有相同孔密度和孔径的 6 孔小室可在市场上买到,可用于收获四个 24 孔小室大小的替换底物。对先前使用的小室进行灭菌后,将 10 μL 紫外线固化的环氧树脂添加到新鲜的培养皿中。将嵌件的基板侧浸入环氧树脂池中以涂覆底面,然后小心地将新基板放在嵌件上的孔上。目视验证环氧树脂是否形成一个完整的环,以确保连接中没有间隙。在紫外线下固化 30 秒,并将翻新的插入物存放在干净的 24 孔板中,以避免在重新使用前损坏新基材。
如前所述,虽然假设观察到的 TEEI 增加将发生在多种细胞类型中,但仅在 A431 和 HEK293T 细胞系13 中得到证明(图 1C),它们都是贴壁细胞。该方法可以通过选择具有不同孔特性的膜来选择不同的细胞系,通过调整浓度用另一种细胞外基质蛋白替换纤连蛋白涂层,或者通过改变货物来改变方法。但是,如果对实验的设置进行了任何更改,则可能需要重新优化波形。为了优化波形,可以进行 TEEI 测量实验,其中每组三个样品之间只有一个波形参数,例如电压。通过确定至少 9 个健康样品中 TEEI 的最大增加来选择最佳电压。对每个波形参数重复此过程,在移动到下一个波形参数时使用新优化的值。请记住,波形参数可能有多个局部最优值(即,一个脉冲持续时间的最佳电压可能不是另一个脉冲持续时间的最佳电压,依此类推)。
多孔基材电穿孔的好处是广泛的。虽然其他细胞内递送方法已经存在了相当长的时间,但很少有方法将 PSEP 所拥有的高通量与高度控制相结合 1,13。此外,该平台对 TEEI 测量的使用让我们得以一窥电穿孔过程的中间步骤。TEEI 读数可以了解细胞的状况,指导电穿孔参数的选择,并允许进一步了解特定的细胞行为和机制13,17。通过 TEEI 测量,该平台还能够实现无标记交付13,从而可以快速优化,减少每次进行实验时对昂贵的生物标志物和试剂的需求。这些对细胞内递送领域的贡献使其成为基础生物学研究和生物医学应用递送平台的主要候选者。
披露声明
作者声明没有利益冲突。
致谢
我们感谢 NSF(1826135、1936065、2143997 奖)、NIH 国家普通医学科学研究所 P20GM113126(内布拉斯加州综合生物分子通讯中心)和 P30GM127200(内布拉斯加州纳米医学中心)、内布拉斯加州合作倡议和 Voelte-Keegan 生物工程支持的资金支持。该设备是在纳米工程研究核心设施 (NERCF) 制造的,该设施部分由内布拉斯加州研究计划资助。
材料
| Name | Company | Catalog Number | Comments |
| 15 mL Conical Centrifuge Tube | Thermo Scientific | 339651 | |
| 2-Chip Disposable Hemocytometer | Bulldog Bio | DHC-N01 | |
| 75 cm2 Tissue Culture Flask | fisherbrand | FB012937 | |
| A431 Cells | ATCC | CRL-1555 | |
| Calcein AM | Invitrogen | C3099 | |
| Class II Type A2 Biosafety Cabinet | Labgard | NU-543-600 | |
| Custom Components | YangLab | https://github.com/YangLabUNL/PSEP-TEEI | |
| Disposable Centrifuge Tube (50 mL) | fisherbrand | 05-539-6 | |
| DMEM | Gibco | 11965092 | |
| Fetal Bovine Serum | Gibco | A5670401 | |
| Fluid Aspiration System | vacuubrand | 20727403 | |
| HERACELL 240i | Thermo Scientific | 51026331 | |
| Hoechst 33342 | Thermo Scientific | 62249 | |
| Human Plasma Fibronectin | Sigma-Aldrich | FIBRP-RO | |
| Inverted Fluorescent Microscope | Zeiss | 491916-0001-000 | |
| Inverted Microscope | Labomed | TCM 400 | |
| PBS | cytiva | SH30256.02 | |
| PCR Tube 200 µL | Sarstedt | 72.737 | |
| Penicillin / Streptomycin | Gibco | 15140148 | |
| Pipette (0.2-2 µL) | fisherbrand Elite | FBE00002 | |
| Pipette (100-1000 µL) | fisherbrand Elite | FBE01000 | |
| Pipette (20-200 µL) | fisherbrand Elite | FBE00200 | |
| Pipette (2-20 µL) | fisherbrand Elite | FBE00020 | |
| Propidium Iodide | Invitrogen | P1304MP | |
| Reaction Tube 1.5 mL | Sarstedt | 72.690.300 | |
| Sorvall ST 16R Centrifuge | Thermo Scientific | 75004240 | |
| Thincert (24-well) | Greiner Bio-One | 662 641 | 0.4 µm pore diameter, 2x106 cm-2 pore density, transparent PET |
| Tissue Culture Plate (24-well) | fisherbrand | FB012929 | |
| Trypan Blue Solution | Sigma-Aldrich | T8154-20mL | |
| Trypsin | Gibco | 15090046 |
参考文献
- Brooks, J., et al. High throughput and highly controllable methods for in vitro intracellular delivery. Small. 16 (51), e2004917 (2020).
- Stewart, M. P., Langer, R., Jensen, K. F. Intracellular delivery by membrane disruption: Mechanisms, strategies, and concepts. Chem Rev. 118 (16), 7409-7531 (2018).
- Canatella, P. J., Karr, J. F., Petros, J. A., Prausnitz, M. R. Quantitative study of electroporation-mediated molecular uptake and cell viability. Biophys J. 80 (2), 755-764 (2001).
- Pliquett, U., Gift, E. A., Weaver, J. C. Determination of the electric field and anomalous heating caused by exponential pulses with aluminum electrodes in electroporation experiments. Bioelectrochem Bioenerg. 39 (1), 39-53 (1996).
- Pan, J., et al. Cell membrane damage and cargo delivery in nano-electroporation. Nanoscale. 15 (8), 4080-4089 (2023).
- Boukany, P. E., et al. Nanochannel electroporation delivers precise amounts of biomolecules into living cells. Nat Nanotechnol. 6 (11), 747-754 (2011).
- Chang, L., et al. Micro-/nanoscale electroporation. Lab Chip. 16 (21), 4047-4062 (2016).
- Patino, C. A., et al. Multiplexed high-throughput localized electroporation workflow with deep learning-based analysis for cell engineering. Sci Adv. 8 (29), 7637 (2022).
- Sagvolden, G., Giaever, I., Pettersen, E. O., Feder, J. Cell adhesion force microscopy. Proc Natl Acad Sci U S A. 96 (2), 471-476 (1999).
- Ishibashi, T., Takoh, K., Kaji, H., Abe, T., Nishizawa, M. A porous membrane-based culture substrate for localized in situ electroporation of adherent mammalian cells. Sensors Actuators B: Chem. 128 (1), 5-11 (2007).
- Mukherjee, P., Nathamgari, S. S. P., Kessler, J. A., Espinosa, H. D. Combined numerical and experimental investigation of localized electroporation-based cell transfection and sampling. ACS Nano. 12 (12), 12118-12128 (2018).
- Brooks, J. R., et al. An equivalent circuit model for localized electroporation on porous substrates. Biosens Bioelectron. 199, 113862 (2022).
- Brooks, J. R., et al. Transepithelial electrical impedance increase following porous substrate electroporation enables label-free delivery. Small. 20 (25), 2310221 (2023).
- Vindiš, T., et al. Gene electrotransfer into mammalian cells using commercial cell culture inserts with porous substrate. Pharmaceutics. 14 (9), 1959 (2022).
- Ye, Y., et al. Single-cell electroporation with real-time impedance assessment using a constriction microchannel. Micromachines. 11 (9), 856 (2020).
- Bednarek, R. In vitro methods for measuring the permeability of cell monolayers. Methods Protoc. 5 (1), 17 (2022).
- Harhaj, N. S., Antonetti, D. A. Regulation of tight junctions and loss of barrier function in pathophysiology. Int J Biochem Cell Biol. 36 (7), 1206-1237 (2004).
- Hunter, R. J. . Zeta potential in colloid science: Principles and applications. 2, (2013).
- Wong, P. K., Wang, T. -. H., Deval, J. H., Ho, C. -. M. Electrokinetics in microdevices for biotechnology applications. IEEE/ASME Trans Mechatron. 9 (2), 366-376 (2004).
- Qian, K., Wang, Y., Lei, Y., Yang, Q., Yao, C. An experimental and theoretical study on cell swelling for osmotic imbalance induced by electroporation. Bioelectrochemistry. 157, 108637 (2024).
- Fox, M. B., et al. Electroporation of cells in microfluidic devices: A review. Anal Bioanal Chem. 385 (3), 474-485 (2006).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。