Method Article
胆道閉鎖症研究のための慢性肝線維症のマウスモデル
要約
ウイルス誘発性胆道閉鎖症(BA)の肝線維化機構研究に適した動物モデルと、将来のBA治療のプラットフォームを提供する慢性肝線維症のマウスモデルを確立しました。
要約
胆道閉鎖症(BA)は閉塞性黄疸を伴う致命的な病気であり、子供の肝移植の最も一般的な適応症です。複雑な病因と未知の病因のために、効果的な薬物治療はまだありません。現在、アカゲザルロタウイルス(RRV)によって誘導される古典的なBAマウスモデルは、BAの病因を研究するために最も一般的に使用されているモデルです。このモデルは、成長遅延、皮膚および粘膜の黄疸、粘土便、および暗黄色の尿を特徴としています。組織病理学は、重度の肝炎症および肝内および肝外胆管の閉塞を示し、これはヒトBAの症状に類似している。しかし、このモデルの末期マウスの肝臓は線維症を欠いており、臨床BAにおける肝線維症の特徴を完全にシミュレートすることはできません。発表された研究は、5〜10μgの抗Ly6G抗体を4回注射することにより、慢性肝線維症の新しいBAマウスモデルを開発しました。その結果、一部のマウスは、時間経過後に典型的な線維症を伴う慢性BAの形成に成功したことが示され、これらのマウスは、ウイルス誘発性肝線維症のBA機構研究に適した動物モデルであり、将来のBA治療法を開発するためのプラットフォームを表しています。
概要
胆道閉鎖症(BA)は、乳幼児によく発生する深刻な肝胆道疾患です。具体的には、新生児黄疸と淡い便を伴う閉塞性胆管症として現れます1。その臨床的特徴は、肝内および肝外胆管の炎症性破壊と進行性線維症であり、最終的には肝不全に発展します2。統計によると、アジア諸国のBAの発生率は欧米諸国よりも高く、アジア諸国のBAの発生率は1 / 8,000です。BAの病因には、ウイルス感染、異常な胆管発達、免疫障害、および遺伝的変異が含まれます3。葛西手術は、BAの子供の胆汁うっ滞を改善するために最も一般的に使用される方法ですが、最終的には、線維症の進行を防ぐことはできません4。BAの現在の治療法は主に肝移植に依存しており、肝臓源の不足によって制限されています。BAの病因の詳細な研究は、この病気の課題を解決するための最も直接的な手段です。しかし、BAの病態に関する研究は主にBA動物モデルに依存しており、適切な動物モデルを選択することが重要です。
BAの組織病理学的研究のほとんどは、胆管過形成(BDP)、胆汁血栓症、および門脈線維症がBAの最も重要な病理学的特徴であり、門脈炎症性細胞浸潤や肝細胞の腫れなど、さまざまなグレードの他の病理学的特徴が同時に存在することを示しています5,6.現在、BAを模倣したマウスモデルには、分節胆管閉塞と肝外胆管を伴う胆管周囲炎を伴う慢性3,5-ダイトキシカルボニル-1,4-ジヒドロコリジン(DDC)給餌マウスモデル7や、四塩化炭素の腹腔内注射による肝線維化マウスモデル8など、さまざまなモデルがあります。胆管結紮(BDL)モデルは、黄疸と急速な門脈線維症を特徴としています9。α-ナフチルイソチオシアネート(ANIT)を給餌したマウスモデルは、肝内胆管に限定された胆管炎と肝細胞損傷を呈します10。黄疸が長引くマウスモデルは、遅延アカゲザルロタウイルス(RRV)接種によって誘導されます11。動物モデル、特にマウスモデルにはさまざまなものがありますが、各モデルには独自の制限があります。それらは、胆道閉鎖症の過程で急性炎症や肝線維症などのBAの疾患特性の一部しかシミュレートできず、BAの疾患プロセスおよび病理学的特徴と高度に一致するモデルはありません。
古典的なBAマウスモデルはRRVによって誘導され、このモデルはヒトにおけるBAに最も類似したモデルである。しかし、RRV誘発BAモデルマウスは、肝外胆道閉鎖症の一部と同様の臨床症状と病理学的特徴を示しますが、このモデルは肝線維症を欠いており、BAメカニズムの詳細な研究と新しい治療法の開発を大幅に制限しています12。そこで、本研究では、慢性肝線維症の新規BAマウスモデルを開発しました。抗Ly6G抗体は、出生日にRRV接種前に腹腔内注射した。次に、5〜10μgの抗Ly6G抗体を、各注入の間に2日の間隔を空けて4回注射した。マウスのBA症状は改善し、生存期間が延長され、マウスは慢性線維化段階に入った。このモデルは、BAの急性期反応をシミュレートするだけでなく、肝臓のプロセスと進行性線維症も模倣します。したがって、BAの機構研究により適した動物モデルであり、BAの将来の治療法を開発するための理論的基礎を提供する可能性があります。
このGr-1分子は、もともと好中球で発現していることが判明した骨髄由来細胞表面マーカーである13。抗Ly6G抗体の枯渇は、循環好中球を90%以上減少させ、他の免疫細胞によって活性化される応答を変化させます。Gr-1+ 細胞集団の機能は、特定の消去抗体を用いたさまざまな研究で報告されており、サイトカインおよび媒介免疫防御に対してさまざまな効果が確認されています14。RRV接種BAマウスモデルにおけるGr-1+ 細胞の機能を検討しました。しかし、Gr-1分子がヒトで発現していることは見出されていないため、同様の分子であるCD177がBA患者で研究されています15。私たちのデータは、特に疾患の慢性線維化期におけるGr-1+ 細胞集団の重要性を証明し、潜在的なBA療法を調査するための適切な動物モデルを提供します。
プロトコル
この研究は、すべての動物実験が行われた広州永奴生物医学動物センターの施設動物管理および使用委員会(IACUC-AEWC-F2208020)によって承認されました。
1. 慢性線維性BAマウスモデルの樹立
注:すべての動物を同じ部屋の特定の病原体フリー(SPF)環境で飼育し、実験は従来の環境で実施しました。妊娠12.5日目のBALB/cマウス(生後10-12週、体重35-40g)を、特定の病原体のない部屋で25°C、12時間の暗/明サイクルで飼育し、オートクレーブした餌と水に自由にアクセスできました。新生児マウスを、生後24時間以内に(平均体重:1.5-1.6g)、マウスBAモデル用に選択した。
- 以前に報告されたようにRRVを準備する16.
注:モデルマウスの生存状態が悪いため、同じケージ内の他のマウスに噛まれたり殺されたりしないように、21日齢で分離する必要があります。 - 新生児マウスを対照群、RRV群、RRV+抗Ly6G群の3群に分ける。生後24時間以内に、新生児マウスに20 μLのRRV(力価:1.5 x 106 PFU / mL)(RRV群)または生理食塩水(対照群)を腹腔内注射します。Gr-1+ 細胞を枯渇させるには、RRV注射の4時間前に5μgの抗Ly6G抗体の腹腔内注射で各マウスを前処理します。
注:抗Ly6G抗体溶液は2〜8°Cで保存され、凍結しないでください。使用前に抗体を取り出し、室温で30分間置いて温めます。 - RRV注射後12日目まで、3日ごとに10μgの抗Ly6G抗体をマウスの腹部に注射します(図1A)。
- すべてのマウスの外観、体重、生存率を毎日確認して記録します。
2.マウスの腹腔内注射
- ケージから生まれたばかりのマウスを取り除きます。1 mLのインスリンシリンジを使用して、20 μLのRRV溶液または50 μLの抗Ly6G抗体溶液を注入します。片方の手の人差し指と親指で若いマウスの首の皮膚をつまみ、薬指と尾指でマウスの後足をそっと持ち、腹部を露出させます。
- 針を上向きに持ち上げます。マウスの右後脚の中央大腿部に針を皮膚に対して15°の角度で挿入します。針がマウスの右肋骨端に達するまで皮下経路に沿って移動した後、針を下向きにして腹腔内に向ける。次に、マウスの肝臓の下に液体を注入します。
注:生まれたばかりのマウスは、左腹部に胃と脾臓を持っています。左側に針を挿入すると、胃を刺したり、脾臓出血を起こしやすくなります。 - 注射直後に針を抜き、注射部位の出血や漏れを観察します。ある場合は、オートクレーブ綿で拭いてください。マウスを母親のケージに戻します。
注意: 注射中の液体漏れが実験結果に与える影響を減らすために、注射動作が穏やかであることを確認し、ゆっくりと針を外し、綿棒で注射部位を30秒間押します。
3.サンプル組織の収集
- 12日目に、4%イソフルラン吸入でマウスに麻酔をかけ、顕微鏡下で解剖する。1 mLのインスリン注射器を心臓の左心室に挿入して採血します。採血後、4%イソフルランを10分間吸入してマウスを安楽死させる。血液を400 × g で室温で5分間遠心分離し、肝機能測定のために血清を分離します。
注:採血はマウスが生きている間に行わなければなりません。マウスが死亡した場合、血液は血管に保持され、収集できなくなります。 - 肝臓と胆管の一般的な外観を撮影します。続いて、マウスの肝臓と脾臓をハサミとピンセットで周囲の組織から解剖します。
注:肝臓およびその他の組織は、RNAおよびタンパク質抽出のために-80°Cで収集および保存されるか、組織学的標本の調製のために10%ホルマリンに浸されます。
4.肝外胆管のフルオレセイン血管造影
- マウスを安楽死させた後、ハサミと綿棒で肝臓、胆嚢、肝外胆管を完全に露出させます。
- 姿勢顕微鏡で観察し、蛍光色素ローダミン123(20mg/mL)を5-10μLのインスリン注射器で胆嚢に注入し、写真を撮ります。このプロセスは、以前の16で報告されたものと同じです。
注:同じグループの異なるマウスが、サンプル組織収集および蛍光血管造影に使用される。
5. H&E染色
- 新鮮なマウス肝臓組織を10%ホルマリンに24時間浸します。
- 組織をパラフィンに包埋した後、パラフィンミクロトームを使用してパラフィンブロックを厚さ4μmの切片に切断し、同じスライド上に2つの連続した切片を配置します。経験豊富な担当者は、指の切断を避けるために操作を標準化する必要があります17。
- スライスをスライスラックに入れ、キシレンで脱ワックスし、無水エタノール、95%エタノール、80%エタノール、70%エタノール、蒸留水で順次水和し、それぞれに5分間浸します。
- 切片をヘマトキシリン溶液で5分間染色し、1%塩酸と75%アルコールに5秒間浸します。切片をきれいな水ですすぎ、エオジン溶液で1分間染色します。
6. CK19およびF4/80免疫組織化学染色
- 最初の3つのステップは、H&E染色セクションでの組織の埋め込み、切片作成、および脱ろうの手順と同じです。
- Tris-EDTAバッファー(10 mmol/L Tris塩基、1 mmol/L EDTA溶液、pH 9.0)で抗原修復を行い、切片を95°Cの電子レンジで10分間加熱した後、取り出して室温まで自然冷却します。
- 組織切片を3%過酸化水素水に10分間入れて、内因性ペルオキシダーゼを除去します。
- スライスを5%ヤギ血清で処理して、非特異的結合をブロックします。
- 初代ラット抗マウスサイトケラチン19またはラット抗マウスF4/80モノクローナル抗体を切片に加え、4°Cで一晩インキュベートします。
- 切片を適切な二次抗体とともに室温で30分間インキュベートします。
- 発色剤として3,3'-ジアミノベンジジン(DAB)を使用し、顕微鏡下で発色反応を観察します。
- スライスを40倍の顕微鏡で観察して写真を取得し、必要に応じて分析します。
7.シリウスレッド染色
- H&E染色のセクションで説明したように、組織の埋め込み、切片作成、および脱ろうの最初の3つのステップを実行します。
- 組織切片をヘマトキシリンで対比染色した後、各組織を50 μLのシリウスレッド色素溶液で室温で1時間覆います。
- スライドを室温で4時間自然乾燥させ、各スライドに中性ガムを一滴加え、カバーガラスを使用して組織をゆっくりと覆い、気泡を防ぎます。スライドを室温で24時間放置して、ニュートラルガムを固化させます。
- 偏光コントラスト光顕微鏡を使用して、コラーゲン沈着の詳細を観察します。鮮明で適切な視野を選択し、顕微鏡の視野の明るさとホワイトバランスを調整します。画像を取得し、必要に応じて40倍の顕微鏡で分析します。
結果
マウスに生後24時間以内に5μgの抗Ly6G抗体を腹腔内注射し、4時間後に20μLのRRVを腹腔内注射した。その後、12日目まで3日毎に10μgの抗Ly6G抗体を注射した(図1A)。RRV群の生存期間の中央値は13日であった。それどころか、抗体で治療されたマウスのほとんどは軽度の黄疸を発症し、体重減少は観察されませんでした(図1C)。マウスの約20%〜30%は、長期黄疸および低体重を伴うBA症候群を有していたが、42日以上生存した。抗Ly6G抗体処理後、Gr-1+細胞数は15個減少し、マウスは慢性BAと呼ばれる慢性線維症の段階に入った。標本は12日目と42日目に収集され、シリウスレッドで染色された組織スライスは肝線維症の漸進的な増加を示しました。42日間生存した慢性BAマウスを詳細な解析に用いた。小さいサイズに加えて、耳、足、尾の皮膚は顕著な黄疸を示しました(図1Eの青い矢印)。RRV注射後6日目に、マウスの糞便の色は明るくなり、尿の色は暗くなった。これは、RRV群のマウスが白い糞便と暗黄色の尿を示した12日目の対照群とは有意に異なっていました。42日目に、慢性BAマウスの尿および糞便も黄疸の明らかな特徴を示した(図1D、E)。BAマウスの肝臓を摘出し、対照の肝臓と比較した。肝臓は小さく(図2B)、壊死病変は肉眼で見え(図2A、黒い三角形)、胆管閉鎖症のセグメントも肝外に観察されました(図2A、白いアスタリスク)。
肝組織切片解析では,低用量抗Ly6G療法により門脈炎症が軽減することが示された。しかしながら、炎症性細胞蓄積は、42日目の肝臓組織スライスにおいて依然として観察された(図3A)。シリウスレッド染色は、RRV注射後12日目に門脈領域におけるコラーゲンの沈着のわずかな増加を示した。また、抗Ly6g抗体による処理後のコラーゲン発現に有意な変化は認められなかったが、42日目のBA組織サンプルにおけるコラーゲン発現は有意に増加した(図3B)。偏光顕微鏡で調べると、隣接する肝臓組織にコラーゲン線維が蓄積していることが観察されました。42日目にBA組織標本でコラーゲンの実質的な沈着(主に緑色)が見られ(図3C)、体重増加なしで42日間生存したマウスではコラーゲン沈着がさらに増加しました。門脈炎症の減少に伴い、CK19+ 胆管細胞が12日目に観察されました。しかし、42日目には、CK19+ 胆管細胞の増加が見られたにもかかわらず、成熟胆管はほとんど検出できませんでした(図4A、赤い矢印は胆管上皮細胞を示す)。慢性BAマウスの肝外胆管の場合、マウスの門脈領域の連続解剖により、肝外胆管が閉塞し、マクロファージの炎症性浸潤があることが明らかになりました(図4B、黒矢印はマクロファージを示す)。
RRV単独と比較して、低用量の抗Ly6G抗体による治療は、RRV接種後12日目に肝酵素レベルの点で肝障害を減少させた。肝臓のアラニンアミノトランスフェラーゼおよびアルカリホスファターゼレベルは、正常対照群よりも慢性BA群で高かった。最も顕著な変化はビリルビンレベルに見られ、RRV +抗Ly6Gマウスは、RRV単独とは対照的に、急性BAにおいてTBIL、DBIL、およびIBILレベルの低下を示した。慢性BAマウスでは、TBIL、DBIL、IBILのレベルが上昇し(図5)、BAの慢性線維化段階で肝機能が有意に低下したことを示しています。

図1:RRVに感染した胆道閉鎖症のマウスモデルにおける抗Ly6G抗体治療の効果。 (A)マウスにおいて急性期および慢性期BAを誘導するための低用量抗体の模式図を矢印で示し、抗体およびRRVの注射時期を示す。(B)ノーマルコントロール(続き)群、アカゲザルロタウイルス(RRV)群、及びRRV+抗Ly6G抗体群のマウスの生存曲線。(c)各群のマウスの体重曲線。(D)12日目の各群におけるマウスとその糞便および尿の代表的な画像。(E)42日目の各群におけるマウスとその糞便および尿の代表的な画像。青い矢印は黄色の耳と尾を示しています。この図はZhangらの許可を得て転載されています15。 この図の拡大版を表示するには、ここをクリックしてください。
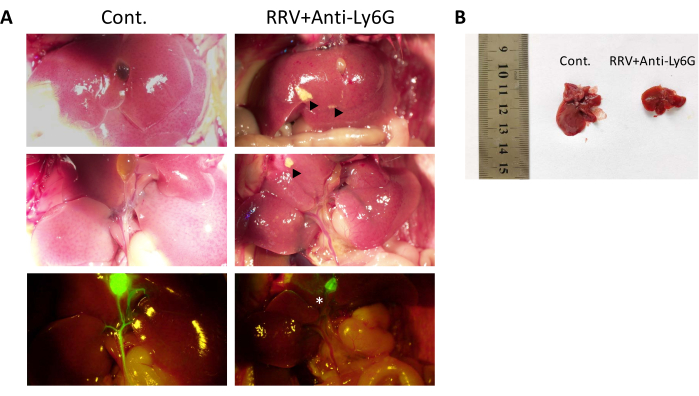
図2:RRVに感染した胆道閉鎖症のマウスモデルにおける肝臓に対する抗Ly6G抗体治療の効果 。 (A)42日目の慢性BAマウス(右)と正常マウスの肝臓解剖学的構造と肝外胆管蛍光血管造影の比較。(B)慢性BAマウスと正常マウスの肝臓サイズの比較。黒い三角形は、慢性BAマウスの肝壊死を示す。白いアスタリスクは肝外胆道閉鎖症を示します。この図はZhangらの許可を得て転載されています15。 この図の拡大版を表示するには、ここをクリックしてください。

図3:12日目および42日目の正常対照(Cont)群、アカゲザルロタウイルス(RRV)群、およびRRV+抗Ly6G抗体群のマウスの 肝臓組織切片。 (A)ヘマトキシリンおよびエオジン(H&E)で染色された肝臓組織切片の画像。(B)シリウスレッド染色はコラーゲン沈着(PSR)を示した。(C)偏光顕微鏡(Pol. Light)を用いたスライスのさらなる観察。略語:PV =門脈。スケールバー = 50 μm。この図はZhangらから修正された15。 この図の拡大版を表示するには、ここをクリックしてください。

図4:12日目および42日目の正常対照(Cont)群、アカゲザルロタウイルス(RRV)群、およびRRV+抗Ly6G抗体群からの肝臓組織スライスの免疫組織化学染色 。 (a)異なる治療群における胆管上皮細胞マーカー(CK19)の発現。(B)マクロファージの炎症性細胞浸潤は、異なる治療群で実証された。略語:PV =門脈。赤い矢印は胆管上皮細胞を示す。黒い矢印はマクロファージを示す。スケールバー = 50 μm。この図はZhangらから修正された15。 この図の拡大版を表示するには、ここをクリックしてください。
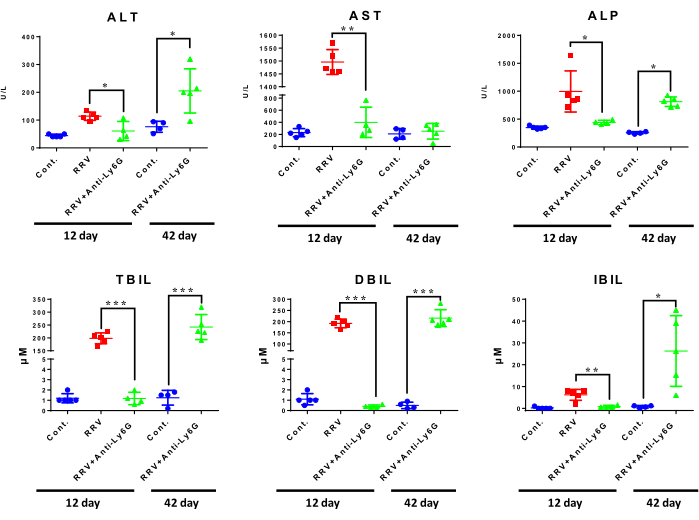
図5:異なる治療群のマウスにおける肝機能の比較。実験後にマウスの血液を採取し、病院の検査部で試験した。各グループには3〜5匹のマウスが含まれていました。*P < 0.05, **P < 0.01, ***P < 0.001.略語:ALT =アラニンアミノトランスフェラーゼ;AST =アスパラギン酸アミノトランスフェラーゼ;ALP = アルカリホスファターゼ;TBIL =総ビリルビン;DBIL = 直接ビリルビン;IBIL =間接ビリルビン。この図はZhangらから修正された15。この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本研究では、RRVに感染した胆道閉鎖症マウスモデルにおいて、抗Ly6G抗体を用いてGr-1+細胞を排除または減少させ、急性BA症候群の改善、生存率の延長、BAマウスの慢性期への移行を可能にしました。抗体の投与量を減らすと、肝線維症を伴う慢性BAにつながる可能性があり、これは、Gr-1+細胞の数が急性期および慢性期のBAの結果を変えることを示しています。以前の研究では、抗Ly6G抗体の投与後にGr-1+細胞が減少し、BAマウスの全生存状態が改善されました15。同時に、Gr-1+マクロファージ19、Gr-1+好中球20、Gr-1+骨髄系細胞21、およびGr-1+顆粒球が、いくつかの動物モデル22において線維症を増強できることが報告されている。しかし、この研究では、マウスのGr-1+細胞は低用量の抗Ly6G抗体で部分的に枯渇し、コラーゲン沈着物が残った。その結果、病気により徹底的に対処するためにより多くの時間が必要になるかもしれません。
抗Ly6G抗体の適用は、炎症を軽減し、胆管を部分的に保存し、マウスの急性BA誘発死を予防しました。しかし、マウスの20%から30%だけがBAの慢性期に入った。これは、抗Ly6G抗体の時点および注射回数に関連している可能性がある。成功率を向上させるためには、この重要なポイントをさらに調査する必要があります。また、Gr-1+ 細胞だけでなく、NK細胞、T細胞、B細胞、マクロファージなど他の免疫細胞も重要な役割を担っている可能性があると考えています。
プロトコルに関しては、いくつかの詳細に注意する必要があります。(i)注射薬の漏れを避けるため、針の直径が小さく、注射器への針穴が小さいため、直径0.33mmの針が付いた1mLのインスリン注射器を使用し、薬物の漏出の可能性を減らすことができます。(ii)注射の前に、マウスを固定して、マウスが動かないようにし、薬物の漏れを防ぎ、実験効果をさらに確実にする必要があります。(iii)薬剤注入時には、薬剤が腹部に入り、肝臓に十分に接触して効果を発揮するように、マウスの肝臓の表面または下縁にできるだけ薬剤を注射しました。(iv)新生マウスの胃と脾臓は左腹部にあり、胃はミルクでいっぱいであるため、注射は通常マウスの右上大腿部から行われます。針を左側から挿入すると、胃に穴を開けて牛乳が腹部に流れ込んだり、脾臓に穴を開けて出血を引き起こしたりする可能性があります。
CD177はLy6Gのホモログであり、BA患者におけるCD177の発現が調査されています。CD177は、小児におけるBAの早期診断のマーカーとして使用することができ、CD177+ 細胞がBA23の過程で重要な役割を果たすことを示している。RNAシーケンシングデータを分析することにより、私たちのチームはCD177細胞がGr-1+ 細胞の支配的な集団であることを発見しました。一方、RRVを接種したCd177-/-BALB/ cマウスは、BAの発症が遅れ、罹患率と死亡率が低下しました18。したがって、私たちの慢性BAマウスモデルは、BAの病因と疾患進行を研究するための明らかな利点があります。また、BAの潜在的な治療法を研究するための適切な動物モデルも提供します。
開示事項
著者は、開示すべき利益相反はありません。
謝辞
この研究は、中国国家自然科学基金会(81974056)からR.Z.への助成金、中国国家自然青年基金会(82101808)および広州科学技術計画プロジェクト(No.202102020196)からZ.L.への助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Balb/c mouse | Guangdong Skarjingda Biotechnology Co., LTD | 20221000112 | |
| rat anti-mouse Ly6G | Bio X Cell | clone 1A8 | West Lebanon, NH |
| rat anti-mouse cytokeratin 19 | Developmental Studies Hybridoma Bank | clone TROMA III | Iowa City, IA |
| rat anti-mouse F4/80 | R&D Systems | MAB5580 | Minneapolis, MN |
| RRV strain | ATCC | MMU 18006 | Manassas, VA |
| Fluorescent stereomicroscope | Olympus | SZX7 | |
| Leica light microscopy | Leica Microsystems | Leica DMI8+DFC7000T | Wetzlar, Germany |
| Hitachi Pre-Analytical Process Automation System | Hitachi | 7600 Clinical Analyzer | Tokyo, Japan |
| Isoflurane anesthetic | RWD | R510-22-10 | |
| Rhodamine 123 | Sigma-Aldrich | 83702 | |
| sirius red dye | Leagene | DC0041 | |
| paraffin microtome | Leica Microsystems | RM2235 | |
| neutral gum | Solarbio | G8590 |
参考文献
- Lakshminarayanan, B., Davenport, M. Biliary atresia: A comprehensive review. Journal of Autoimmunity. 73, 1-9 (2016).
- Bassett, M. D., Murray, K. F. Biliary atresia: Recent progress. Journal of Clinical Gastroenterology. 42 (6), 720-729 (2008).
- Bezerra, J. A., et al. Biliary atresia: Clinical and research challenges for the twenty-first century. Hepatology. 68 (3), 1163-1173 (2018).
- Hartley, J. L., Davenport, M., Kelly, D. A. Biliary atresia. Lancet. 374 (9702), 1704-1713 (2009).
- Lee, W. S., Looi, L. M. Usefulness of a scoring system in the interpretation of histology in neonatal cholestasis. World Journal of Gastroenterology. 15 (42), 5326-5333 (2009).
- Russo, P., et al. Key histopathologic features of liver biopsies that distinguish biliary atresia from other causes of infantile cholestasis and their correlation with outcome: A multicenter study. The American Journal of Surgical Pathology. 40 (12), 1601-1615 (2016).
- Fickert, P., et al. Characterization of animal models for primary sclerosing cholangitis (PSC). Journal of Hepatology. 60 (6), 1290-1303 (2014).
- Sonoda, S., et al. Biliary atresia-specific deciduous pulp stem cells feature biliary deficiency. Stem Cell Research and Therapy. 12 (1), 582 (2021).
- Xiao, Y., et al. Long noncoding RNA H19 contributes to cholangiocyte proliferation and cholestatic liver fibrosis in biliary atresia. Hepatology. 70 (5), 1658-1673 (2019).
- Desmet, V. J., Krstulović, B., Van Damme, B. Histochemical study of rat liver in alpha-naphthyl isothiocyanate (ANIT) induced cholestasis. The American Journal of Pathology. 52 (2), 401-421 (1968).
- Luo, Z., Shivakumar, P., Mourya, R., Gutta, S., Bezerra, J. A. Gene expression signatures associated with survival times of pediatric patients with biliary atresia identify potential therapeutic agents. Gastroenterology. 157 (4), 1138-1152 (2019).
- Mariotti, V., Strazzabosco, M., Fabris, L., Calvisi, D. F. Animal models of biliary injury and altered bile acid metabolism. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1864, 1254-1261 (2018).
- Egan, C. E., Sukhumavasi, W., Bierly, A. L., Denkers, E. Y. Understanding the multiple functions of Gr-1(+) cell subpopulations during microbial infection. Immunologic Research. 40 (1), 35-48 (2008).
- McDermott, A. J., et al. The role of Gr-1(+) cells and tumour necrosis factor-α signalling during Clostridium difficile colitis in mice. Immunology. 144 (4), 704-716 (2015).
- Zhang, R., et al. The role of neonatal Gr-1(+) myeloid cells in a murine model of rhesus-rotavirus-induced biliary atresia. The American Journal of Pathology. 188 (11), 2617-2628 (2018).
- Fu, M., et al. A silver nanoparticle method for ameliorating biliary atresia syndrome in mice. Journal of Visualized Experiments. (140), e58158 (2018).
- Sy, J., Ang, L. C. Microtomy: Cutting formalin-fixed, paraffin-embedded sections. Methods in Molecular Biology. 1897, 269-278 (2019).
- Zhang, R., et al. CD177(+) cells produce neutrophil extracellular traps that promote biliary atresia. Journal of Hepatology. 77 (5), 1299-1310 (2022).
- Engel, D. R., et al. CX3CR1 reduces kidney fibrosis by inhibiting local proliferation of profibrotic macrophages. Journal of Immunology. 194 (4), 1628-1638 (2015).
- Liang, M., et al. A modified murine model of systemic sclerosis: Bleomycin given by pump infusion induced skin and pulmonary inflammation and fibrosis. Laboratory Investigation. 95 (3), 342-350 (2015).
- Chen, Y., et al. Differential effects of sorafenib on liver versus tumor fibrosis mediated by stromal-derived factor 1 alpha/C-X-C receptor type 4 axis and myeloid differentiation antigen-positive myeloid cell infiltration in mice. Hepatology. 59 (4), 1435-1447 (2014).
- Tomasson, M. H., et al. Fatal myeloproliferation, induced in mice by TEL/PDGFbetaR expression, depends on PDGFbetaR tyrosines 579/581. Journal of Clinical Investigation. 105 (4), 423-432 (2000).
- Zhang, R., Huang, J., Shan, J., Chen, Y., Xia, H. Peripheral blood CD177(+) cells as an early diagnostic marker for biliary atresia: A prospective multicentre study in pediatric patients with cholestasis. Journal of Hepatology. 77 (6), 1714-1716 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved