Method Article
慢性肝纤维化小鼠模型用于研究胆道闭锁
摘要
我们建立了慢性肝纤维化小鼠模型,为病毒诱导的胆道闭锁(BA)肝纤维化机制研究提供了合适的动物模型,并为未来的BA治疗提供了平台。
摘要
胆道闭锁(BA)是一种涉及阻塞性黄疸的致命疾病,是儿童肝移植最常见的适应症。由于病因复杂,发病机制未知,目前尚无有效的药物治疗。目前,恒河猴轮状病毒(RRV)诱导的经典BA小鼠模型是研究BA发病机制最常用的模型。该模型的特征是生长迟缓、皮肤和粘膜黄疸、粘土粪便和深黄色尿液。组织病理学显示严重的肝脏炎症和肝内和肝外胆管梗阻,与人BA的症状相似。然而,该模型中终末期小鼠的肝脏缺乏纤维化,不能完全模拟临床BA中肝纤维化的特征。所提出的研究通过四次注射5-10μg抗Ly6G抗体,每次注射后间隔2天,开发了一种新的慢性肝纤维化的BA小鼠模型。结果表明,部分小鼠在延时后成功形成具有典型纤维化的慢性BA,这意味着这些小鼠代表了BA病毒诱导的肝纤维化机制研究的合适动物模型和开发未来BA治疗的平台。
引言
胆道闭锁(BA)是一种严重的肝胆疾病,常发生在婴幼儿中;具体而言,它表现为闭塞性胆管病,伴有新生儿黄疸和大便苍白1。其临床特征是肝内和肝外胆管的炎症破坏和进行性纤维化,最终发展为肝衰竭2。据统计,BA在亚洲国家的发病率高于欧美国家,BA在亚洲国家的发病率为1/8000。BA 的病因包括病毒感染、胆管发育异常、免疫紊乱和遗传变异3.Kasai手术是改善BA患儿胆汁淤积的最常用方法,但最终,这不能阻止纤维化的进展4。目前BA的治疗主要依靠肝移植,受限于肝源缺乏。深入研究BA的发病机制是解决该疾病挑战的最直接手段。然而,BA发病机制的研究主要依赖于BA动物模型,选择合适的动物模型至关重要。
大多数BA的组织病理学研究表明,胆管增生(BDP)、胆汁血栓形成和门静脉纤维化是BA最重要的病理特征,同时存在不同等级的其他病理特征,如门静脉炎性细胞浸润和肝细胞肿胀5,6.目前,模拟BA的小鼠模型多种多样,如慢性3,5-二氧羰基-1,4-二氢可圈(DDC)喂养的节段性胆管梗阻和累及肝外胆管的胆管炎小鼠模型7和腹腔注射四氯化碳8的肝纤维化小鼠模型。胆管结扎术(BDL)模型的特征是黄疸和快速门静脉纤维化9。α-萘异硫氰酸酯(ANIT)喂养的小鼠模型表现为胆管炎局限于肝内胆管和肝细胞损伤10。延迟恒河猴轮状病毒(RRV)接种诱导具有长期黄疸的小鼠模型11。虽然动物模型多种多样,尤其是小鼠模型,但每种模型都有自己的局限性。他们只能模拟BA的部分疾病特征,如胆道闭锁过程中的急性炎症或肝纤维化,没有与BA的疾病过程和病理特征高度一致的模型。
经典的BA小鼠模型是由RRV诱导的,该模型是与人类BA最相似的模型。然而,虽然RRV诱导的BA模型小鼠表现出与一些肝外胆道闭锁相似的临床症状和病理特征,但该模型缺乏肝纤维化,这极大地限制了对BA机制的深入研究和新疗法的开发12。因此,本研究开发了一种新型的慢性肝纤维化BA小鼠模型。出生当天接种RRV前腹腔注射抗Ly6G抗体。然后,注射5-10μg抗Ly6G抗体4次,每次注射间隔2天。小鼠BA症状改善,存活时间延长,小鼠进入慢性纤维化阶段。该模型不仅模拟BA的急性期反应,还模拟肝脏和进行性纤维化的过程。因此,它是更适合BA机理研究的动物模型,可为未来BA治疗方法的发展提供理论依据。
Gr-1分子是一种髓源性细胞表面标志物,最初发现在中性粒细胞13中表达。抗Ly6G抗体的消耗使循环中性粒细胞减少90%以上,并改变其他免疫细胞激活的反应。Gr-1+ 细胞群的功能已在使用特异性清除抗体的各种研究中报道,对细胞因子和介导的免疫保护具有不同的影响14。我们已经研究了RRV接种的BA小鼠模型中Gr-1 + 细胞的功能。然而,由于尚未发现Gr-1分子在人类中表达,因此已经在BA患者中研究了类似的分子CD17715。我们的数据证明了Gr-1+ 细胞群的重要性,特别是在疾病的慢性纤维化阶段,并为研究潜在的BA疗法提供了合适的动物模型。
研究方案
本研究获得广州市永诺生物医学动物中心机构动物护理与使用委员会(IACUC-AEWC-F2208020)的批准,所有动物实验均在该委员会进行。
1.慢性纤维化BA小鼠模型的建立
注意:所有动物都在同一房间的特定无病原体(SPF)环境中饲养,实验在常规环境中进行。将妊娠第12.5天(年龄:10-12周;体重35-40g)的BALB / c小鼠保存在25°C的无特定病原体的房间中,在12小时黑暗/光照循环下,并免费获得高压灭菌的食物和水。出生后24小时内(平均体重:1.5-1.6g)选择新生小鼠用于小鼠BA模型。
- 按照之前的报告准备RRV16。
注意:由于模型小鼠的存活状态较差,它们需要在21天大时分开,以避免它们被同一笼子里的其他小鼠咬伤甚至杀死。 - 将新生小鼠分为三组:对照组,RRV组和RRV +抗Ly6G组。在出生后24小时内腹膜内向新生小鼠注射20μLRRV(滴度:1.5 x 106PFU / mL)(RRV组)或盐水(对照组)。为了耗尽Gr-1 + 细胞,在RRV注射前4小时腹膜内注射5μg抗Ly6G抗体预处理每只小鼠。
注意:抗Ly6G抗体溶液储存在2-8°C,不应冷冻。使用前取出抗体,在室温下加热30分钟。 - 每3天向小鼠腹部注射10μg抗Ly-Ly6G抗体,直到RRV注射后第12天(图1A)。
- 每天检查并记录所有小鼠的外观、体重和存活率。
2.腹腔注射小鼠
- 将新生小鼠从笼子中取出。使用 1 mL 胰岛素注射器注射 20 μL RRV 溶液或 50 μL 抗 Ly6G 抗体溶液。一只手的食指和拇指捏住幼鼠的颈部皮肤,用无名指和尾指轻轻握住小鼠的后腿,露出腹部。
- 向上倾斜抬起针头。将针头插入鼠标右后腿的中大腿,与皮肤成15°角。沿着皮下路径移动直到针到达小鼠的右肋边缘后,将针向下引导到腹腔中。然后,将液体注射到小鼠肝脏下。
注意:新生小鼠的胃和脾脏在左腹部。如果在左侧插入针头,很容易刺穿胃或引起脾出血。 - 注射后立即拔出针头,观察注射部位是否有出血或渗漏。如果有,请用高压灭菌的棉擦拭。将鼠标放回母亲的笼子里。
注意:为了减少注射过程中液体泄漏对实验结果的影响,请确保注射动作轻柔,慢慢取出针头,用棉签按压注射部位30秒。
3. 采集样本组织
- 在第12天,用4%异氟醚吸入麻醉小鼠,并在显微镜下解剖它们。将1mL胰岛素注射器插入心脏左心室以收集血液。采血后,通过吸入4%异氟醚10分钟对小鼠实施安乐死。在室温下以400× g 离心血液5分钟,并分离血清进行肝功能测量。
注意:必须在小鼠活着时进行采血。如果小鼠死亡,血液将保留在血管中,无法收集。 - 拍摄肝脏和胆管的一般外观。随后,用剪刀和镊子从周围组织中解剖小鼠肝脏和脾脏。
注意:收集肝脏和其他组织并将其保存在-80°C下用于RNA和蛋白质提取,或浸泡在10%福尔马林中以制备组织学标本。
4.肝外胆管荧光素血管造影
- 对小鼠实施安乐死后,用剪刀和棉签完全暴露肝脏、胆囊和肝外胆管。
- 在姿势显微镜下观察,用1 mL胰岛素注射器将5-10μL荧光染料罗丹明123(20mg / mL)注入胆囊,并拍照。此过程与之前16 中报告的过程相同。
注意:同一组中的不同小鼠用于样品组织收集和荧光血管造影。
5. H&E 染色
- 将新鲜小鼠肝组织浸入10%福尔马林中24小时。
- 将组织嵌入石蜡中后,使用石蜡切片机将石蜡块切成厚度为4μm的部分,并在同一载玻片上放置两个连续的切片。要求有经验的人员规范操作,避免割伤手指17.
- 将切片放入切片架中,用二甲苯脱蜡,依次在无水乙醇,95%乙醇,80%乙醇,70%乙醇和蒸馏水中水合,并分别浸泡5分钟。
- 用苏木精溶液染色切片5分钟,然后将它们浸泡在1%盐酸和75%酒精中5秒。用清水冲洗切片,并用伊红溶液染色1分钟。
6. CK19和F4/80免疫组化染色
- 前三个步骤与H&E染色部分中的组织包埋,切片和脱蜡步骤相同。
- 使用Tris-EDTA缓冲液(10 mmol/L Tris碱,1 mmol/L EDTA溶液,pH 9.0)进行抗原修复,在95°C的微波炉中加热切片10分钟,然后取出并自然冷却至室温。
- 将组织切片置于3%过氧化氢溶液中10分钟以除去内源性过氧化物酶。
- 用5%山羊血清处理切片以阻断非特异性结合。
- 向切片中加入原代大鼠抗小鼠细胞角蛋白19或大鼠抗小鼠F4 / 80单克隆抗体,并在4°C孵育过夜。
- 在室温下用适当的二抗孵育切片30分钟。
- 使用3,3'-二氨基联苯胺(DAB)作为显色剂,在显微镜下观察显色反应。
- 在40倍显微镜下观察切片以获得图片,并根据需要进行分析。
7.天狼星红染色
- 执行组织包埋,切片和脱蜡的前三个步骤,如H&E染色部分所述。
- 组织切片用苏木精复染后,在室温下用50μL天狼星红染料溶液覆盖每个组织1小时。
- 在室温下自然干燥载玻片4小时,向每张载玻片中加入一滴中性口香糖,并使用盖玻片缓慢覆盖组织以避免气泡。将载玻片在室温下放置24小时以固化中性胶。
- 使用偏振对比光显微镜观察胶原蛋白沉积的细节;选择清晰合适的视野,调整显微镜视野的亮度和白平衡。获取图像,并根据需要在40倍显微镜下进行分析。
结果
小鼠在出生后24小时内腹膜内注射5μg抗Ly6G抗体,然后在4小时后腹膜内注射20μLRRV。然后,每3天注射10μg抗Ly6G抗体,直到第12天(图1A)。RRV组的中位生存时间为13天。相反,大多数用抗体治疗的小鼠出现轻度黄疸,并且没有观察到体重减轻(图1C)。约20%-30%的小鼠患有长期黄疸和低体重的BA综合征,但存活超过42天。抗Ly6G抗体处理后,Gr-1+细胞数量减少15个,小鼠进入慢性纤维化阶段,称为慢性BA。在第12天和第42天收集标本,用天狼星红染色的组织切片显示肝纤维化逐渐增加。存活42天的慢性BA小鼠用于详细分析。除了体积小外,耳朵,脚和尾巴皮肤还显示出明显的黄疸(图1E中的蓝色箭头)。注射RRV后第6天,小鼠粪便颜色变浅,尿液颜色变深;这在第12天与对照组显着不同,当时RRV组小鼠显示白色粪便和深黄色尿液。在第42天,慢性BA小鼠的尿液和粪便也显示出明显的黄疸特征(图1D,E)。取出BA小鼠的肝脏并与对照组的肝脏进行比较。肝脏较小(图2B),肉眼可见坏死病变(图2A,黑色三角形),肝外还观察到一段胆管闭锁(图2A,白色星号)。
肝组织切片分析显示,低剂量抗Ly6G治疗可减少门静脉炎症。然而,在第42天,在肝组织切片中仍观察到炎症细胞积聚(图3A)。天狼星红染色显示,在注射RRV后第12天,门静脉区域的胶原蛋白沉积略有增加。此外,用抗Ly6g抗体处理后,胶原蛋白表达没有显着变化,但第42天BA组织样品中的胶原蛋白表达显着增加(图3B)。在偏振光显微镜下检查时,观察到胶原纤维已积聚在邻近的肝组织中。在第42天,在BA组织标本中观察到大量胶原蛋白沉积,主要是绿色的(图3C),并且在存活42天而没有体重增加的小鼠中,胶原蛋白沉积进一步增加。随着门静脉炎症的减少,在第12天观察到CK19+ 胆管细胞。然而,在第42天,即使看到CK19 + 胆管细胞增加,也很难检测到成熟的胆管(图4A,红色箭头表示胆管上皮细胞)。在慢性BA小鼠肝外胆管的情况下,小鼠门静脉区域的连续解剖显示肝外胆管被阻塞并具有巨噬细胞的炎症浸润(图4B,黑色箭头表示巨噬细胞)。
与单独使用RRV相比,低剂量抗Ly6G抗体治疗在RRV接种后第12天降低了肝损伤的肝酶水平。慢性BA组肝脏丙氨酸氨基转移酶和碱性磷酸酶水平高于正常对照组。胆红素水平的变化最明显,与单独使用RRV相比,RRV +抗Ly6G小鼠在急性BA中显示TBIL,DBIL和IBIL水平降低。在患有慢性BA的小鼠中,TBIL,DBIL和IBIL的水平升高(图5),表明BA的慢性纤维化阶段肝功能显着降低。

图1:抗Ly6G抗体治疗在感染RRV的胆道闭锁小鼠模型中的效果 。 (A)低剂量抗体诱导小鼠急性和慢性期BA的示意图,箭头指示注射抗体和RRV的时间。(B)正常对照(连续)组,恒河猴轮状病毒(RRV)组和RRV +抗Ly6G抗体组小鼠的存活曲线。(C)每组小鼠的体重曲线。(D)第12天每组小鼠及其粪便和尿液的代表性图像。(E)第42天每组小鼠及其粪便和尿液的代表性图像。蓝色箭头表示黄色的耳朵和尾巴。本图经张等人授权转载15。 请点击此处查看此图的大图。
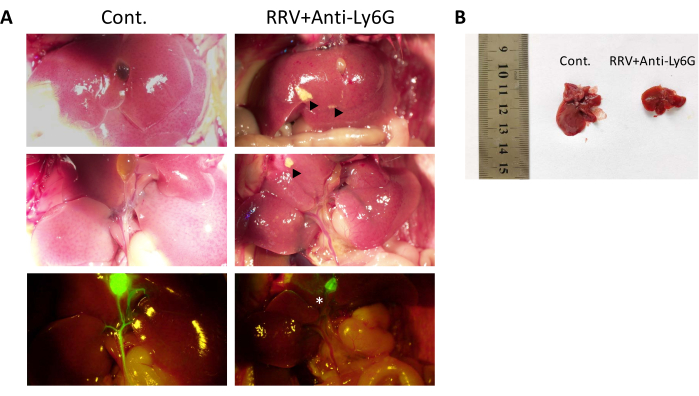
图2:抗Ly6G抗体治疗对感染RRV的胆道闭锁小鼠模型肝脏的影响 。 (A)第42天慢性BA小鼠(右)和正常小鼠的肝脏解剖学和肝外胆管荧光血管造影比较。(B)慢性BA小鼠和正常小鼠肝脏大小的比较。黑色三角表示慢性BA小鼠的肝坏死。白色星号表示肝外胆道闭锁。本图经张等人授权转载15。 请点击此处查看此图的大图。

图3:第12天和第42天正常对照(连续)组,恒河猴轮状病毒(RRV)组和RRV +抗Ly6G抗体组小鼠 的肝组织切片。 (A)用苏木精和伊红(H&E)染色的肝组织切片图像。(B)天狼星红染色显示胶原蛋白沉积(PSR)。(C)使用偏振光显微镜(Pol. Light)进一步观察切片。缩写:PV = 门静脉。比例尺 = 50 μm。这个数字是从Zhang等人15修改而来的。 请点击此处查看此图的大图。

图 4:第 12 天和第 42 天正常对照 (Cont.) 组、恒河猴轮状病毒 (RRV) 组和 RRV + 抗 Ly6G 抗体组肝组织切片的免疫组织化学染色 。 (A)胆管上皮细胞标志物(CK19)在不同治疗组中的表达。(B)巨噬细胞的炎症细胞浸润在不同的治疗组中得到证实。缩写:PV = 门静脉。红色箭头表示胆管上皮细胞。黑色箭头表示巨噬细胞。比例尺 = 50 μm。这个数字是从Zhang等人15修改而来的。 请点击此处查看此图的大图。
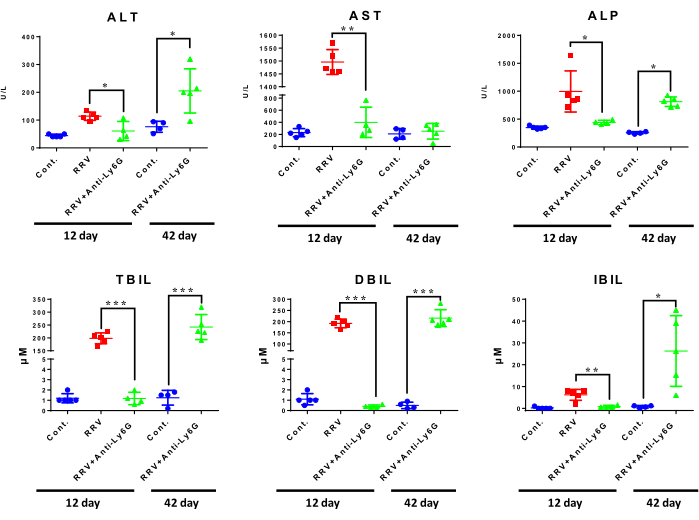
图5:不同治疗组小鼠肝功能比较。实验后采集小鼠血液,在医院实验室进行检测。每组包含三到五只小鼠。*P < 0.05, **P < 0.01, ****P < 0.001。缩写:ALT = 丙氨酸氨基转移酶;AST = 天冬氨酸氨基转移酶;ALP = 碱性磷酸酶;TBIL = 总胆红素;DBIL = 直接胆红素;IBIL = 间接胆红素。这个数字是从Zhang等人15修改而来的。请点击此处查看此图的大图。
讨论
在我们的研究中,我们使用抗Ly6G抗体消除或减少感染RRV的胆道闭锁小鼠模型中的Gr-1+细胞,以改善急性BA综合征,延长存活率,并使BA小鼠进入慢性期。减少抗体剂量可导致慢性BA伴肝纤维化,这表明Gr-1+细胞的数量改变了急性期和慢性期BA的结果。在我们之前的研究中,给予抗Ly6G抗体后Gr-1+细胞减少,BA小鼠的总体存活状态改善了15。同时,据报道,Gr-1+巨噬细胞19、Gr-1+中性粒细胞20、Gr-1+髓细胞21和Gr-1+粒细胞在一些动物模型中可增强纤维化22。然而,在这项研究中,小鼠体内的Gr-1+细胞被低剂量的抗Ly6G抗体部分耗尽,胶原蛋白沉积仍然存在。因此,可能需要更多时间来更彻底地处理这一疾病。
抗Ly6G抗体的应用减少了炎症,部分保留了胆管,并防止了急性BA诱导的小鼠死亡。然而,只有20%至30%的小鼠进入BA的慢性期;这可能与抗Ly6G抗体的时间点和注射次数有关。我们需要进一步探索这个关键点,以提高成功率。此外,我们认为不仅Gr-1+ 细胞,其他免疫细胞也可能发挥重要作用,例如NK细胞,T细胞,B细胞和巨噬细胞。
至于协议,需要注意一些细节。(i)为避免注射药物泄漏,我们使用1毫升胰岛素注射器,针头直径为0.33毫米,因为针头直径小,针孔进入注射器,有利于减少药物泄漏的可能性。(ii)注射前应固定小鼠,防止其移动,避免药物泄漏,从而进一步保证实验效果。(iii)在药物注射过程中,我们尽可能将药物注射到小鼠肝脏表面或下缘,使药物进入腹部并充分接触肝脏以生效。(四)注射通常从小鼠的右大腿上部进行,因为新生小鼠的胃和脾脏在左腹部,胃里充满乳汁。如果从左侧插入针头,很容易刺穿胃,导致牛奶流入腹部,或刺穿脾脏,引起出血。
CD177是Ly6G的同系物,CD177在BA患者中的表达已被研究。CD177可作为儿童BA早期诊断的标志物,表明CD177+ 细胞在BA23病程中起重要作用。通过分析RNA测序数据,我们的团队发现CD177细胞是Gr-1+ 细胞的主要群体;同时,接种RRV的Cd177−/− BALB/c小鼠显示出BA的延迟发作并降低了发病率和死亡率18。因此,我们的慢性BA小鼠模型在研究BA的发病机制和疾病进展方面具有明显的优势;它还为研究BA的潜在治疗方法提供了合适的动物模型。
披露声明
作者没有利益冲突需要披露。
致谢
这项工作得到了中国国家自然科学基金(81974056)对R.Z.的资助,以及中国国家自然青年基金会(82101808)和广州市科学技术计划项目(第202102020196号)对Z.L.的资助。
材料
| Name | Company | Catalog Number | Comments |
| Balb/c mouse | Guangdong Skarjingda Biotechnology Co., LTD | 20221000112 | |
| rat anti-mouse Ly6G | Bio X Cell | clone 1A8 | West Lebanon, NH |
| rat anti-mouse cytokeratin 19 | Developmental Studies Hybridoma Bank | clone TROMA III | Iowa City, IA |
| rat anti-mouse F4/80 | R&D Systems | MAB5580 | Minneapolis, MN |
| RRV strain | ATCC | MMU 18006 | Manassas, VA |
| Fluorescent stereomicroscope | Olympus | SZX7 | |
| Leica light microscopy | Leica Microsystems | Leica DMI8+DFC7000T | Wetzlar, Germany |
| Hitachi Pre-Analytical Process Automation System | Hitachi | 7600 Clinical Analyzer | Tokyo, Japan |
| Isoflurane anesthetic | RWD | R510-22-10 | |
| Rhodamine 123 | Sigma-Aldrich | 83702 | |
| sirius red dye | Leagene | DC0041 | |
| paraffin microtome | Leica Microsystems | RM2235 | |
| neutral gum | Solarbio | G8590 |
参考文献
- Lakshminarayanan, B., Davenport, M. Biliary atresia: A comprehensive review. Journal of Autoimmunity. 73, 1-9 (2016).
- Bassett, M. D., Murray, K. F. Biliary atresia: Recent progress. Journal of Clinical Gastroenterology. 42 (6), 720-729 (2008).
- Bezerra, J. A., et al. Biliary atresia: Clinical and research challenges for the twenty-first century. Hepatology. 68 (3), 1163-1173 (2018).
- Hartley, J. L., Davenport, M., Kelly, D. A. Biliary atresia. Lancet. 374 (9702), 1704-1713 (2009).
- Lee, W. S., Looi, L. M. Usefulness of a scoring system in the interpretation of histology in neonatal cholestasis. World Journal of Gastroenterology. 15 (42), 5326-5333 (2009).
- Russo, P., et al. Key histopathologic features of liver biopsies that distinguish biliary atresia from other causes of infantile cholestasis and their correlation with outcome: A multicenter study. The American Journal of Surgical Pathology. 40 (12), 1601-1615 (2016).
- Fickert, P., et al. Characterization of animal models for primary sclerosing cholangitis (PSC). Journal of Hepatology. 60 (6), 1290-1303 (2014).
- Sonoda, S., et al. Biliary atresia-specific deciduous pulp stem cells feature biliary deficiency. Stem Cell Research and Therapy. 12 (1), 582 (2021).
- Xiao, Y., et al. Long noncoding RNA H19 contributes to cholangiocyte proliferation and cholestatic liver fibrosis in biliary atresia. Hepatology. 70 (5), 1658-1673 (2019).
- Desmet, V. J., Krstulović, B., Van Damme, B. Histochemical study of rat liver in alpha-naphthyl isothiocyanate (ANIT) induced cholestasis. The American Journal of Pathology. 52 (2), 401-421 (1968).
- Luo, Z., Shivakumar, P., Mourya, R., Gutta, S., Bezerra, J. A. Gene expression signatures associated with survival times of pediatric patients with biliary atresia identify potential therapeutic agents. Gastroenterology. 157 (4), 1138-1152 (2019).
- Mariotti, V., Strazzabosco, M., Fabris, L., Calvisi, D. F. Animal models of biliary injury and altered bile acid metabolism. Biochimica et Biophysica Acta. Molecular Basis of Disease. 1864, 1254-1261 (2018).
- Egan, C. E., Sukhumavasi, W., Bierly, A. L., Denkers, E. Y. Understanding the multiple functions of Gr-1(+) cell subpopulations during microbial infection. Immunologic Research. 40 (1), 35-48 (2008).
- McDermott, A. J., et al. The role of Gr-1(+) cells and tumour necrosis factor-α signalling during Clostridium difficile colitis in mice. Immunology. 144 (4), 704-716 (2015).
- Zhang, R., et al. The role of neonatal Gr-1(+) myeloid cells in a murine model of rhesus-rotavirus-induced biliary atresia. The American Journal of Pathology. 188 (11), 2617-2628 (2018).
- Fu, M., et al. A silver nanoparticle method for ameliorating biliary atresia syndrome in mice. Journal of Visualized Experiments. (140), e58158 (2018).
- Sy, J., Ang, L. C. Microtomy: Cutting formalin-fixed, paraffin-embedded sections. Methods in Molecular Biology. 1897, 269-278 (2019).
- Zhang, R., et al. CD177(+) cells produce neutrophil extracellular traps that promote biliary atresia. Journal of Hepatology. 77 (5), 1299-1310 (2022).
- Engel, D. R., et al. CX3CR1 reduces kidney fibrosis by inhibiting local proliferation of profibrotic macrophages. Journal of Immunology. 194 (4), 1628-1638 (2015).
- Liang, M., et al. A modified murine model of systemic sclerosis: Bleomycin given by pump infusion induced skin and pulmonary inflammation and fibrosis. Laboratory Investigation. 95 (3), 342-350 (2015).
- Chen, Y., et al. Differential effects of sorafenib on liver versus tumor fibrosis mediated by stromal-derived factor 1 alpha/C-X-C receptor type 4 axis and myeloid differentiation antigen-positive myeloid cell infiltration in mice. Hepatology. 59 (4), 1435-1447 (2014).
- Tomasson, M. H., et al. Fatal myeloproliferation, induced in mice by TEL/PDGFbetaR expression, depends on PDGFbetaR tyrosines 579/581. Journal of Clinical Investigation. 105 (4), 423-432 (2000).
- Zhang, R., Huang, J., Shan, J., Chen, Y., Xia, H. Peripheral blood CD177(+) cells as an early diagnostic marker for biliary atresia: A prospective multicentre study in pediatric patients with cholestasis. Journal of Hepatology. 77 (6), 1714-1716 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。